甜橙油具有橙子的特殊芳香滋味,被广泛应用于烟草、日化和香精等领域[1]。但甜橙油作为一种液体状香精,其香气成分具有易挥发和易受光、热、氧影响等缺点,从而限制了这些香精产品在某些领域的应用,目前,能对甜橙油进行有效保护,常见的方法是微胶囊法。常用的制备微胶囊的方法有喷雾干燥法、界面聚合法、原位聚合法和复合凝聚法等。
其中复合凝聚法中的反应,主要是2种或2种以上大分子之间由于静电相互作用而发生的自聚集现象,是一种能有效使物质稳定的包埋技术[2]。根据调节pH值,蛋白-多糖复合物可以遍布在整个体系中而不发生相分离,形成可溶性复聚物。随着pH不断减小,可溶性复聚物由于静电作用发生聚集形成不溶性复聚物,体系同时发生相分离形成水相-复聚物相。根据静电引力强度和生物大分子特性不同,不溶性复聚物能够进一步沉降形成复凝聚液滴,复凝聚液滴经沉降及融合形成复凝聚相,促成复凝聚反应,最终导致溶剂分为上清相和下层大分子物质富集的复凝聚相。此下层复凝聚相根据不同环境条件可以形成微米甚至纳米级别的复聚物,因此可应用于食品组成、微胶囊体系或者生物材料中[3]。
目前对于复合凝聚反应的研究多集中于乳清分离蛋白[4]、β-乳球蛋白[5]和豌豆蛋白[6]等原蛋白与多糖作为壁材原料制备微胶囊。另外,大豆分离蛋白(soy protein isolate,SPI)也较常应用于复合凝聚制备微胶囊,如DONG等[7]以大豆分离蛋白与阿拉伯胶为微胶囊壁材原料,通过三相图分析复合凝聚反应产物形成过程中相行为。然而,由于大豆分离蛋白功能性质,如溶解性和乳化性较差,而使其在工业应用上受限,虽然有关大豆分离蛋白改性的研究较多[8],但目前对大豆分离蛋白改性后与多糖的复合凝聚反应这方面研究鲜少报道。
本文以SPI为原料,采用Fungal protease 400(F400)蛋白制备水解度为2%的酶解大豆蛋白(hydrolyzed soy protein isolate,HSPI),使其与海藻酸钠(sodium alginate,SA)为微胶囊壁材,进行复合凝聚反应,利用不同比例和不同温度下pH-浊度曲线结合ζ-电位分析,确定复聚物生成的最佳条件。通过微胶囊理化指标、乳化活性(emulsification activity index,EAI)及乳化稳定性(emulsion stability index,ESI)、热重和挥发性风味物质等分析指标比较HSPI-SA甜橙油微胶囊(hydrolyzed soy protein isolate - sodium alginate capsule,HSC)和SPI与SA复合凝聚制备的微胶囊(soy protein isolate-sodium alginate capsule,ISC)的性质差异,以便根据食品工业应用要求选择最佳的壁材原料制备相应需求的微胶囊。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(蛋白质量分数91.84%),山东万德福生物科技有限公司;F400蛋白酶,Enzyme Development公司;巴西天然甜橙油,广州RHF香料公司;辛酸乙酯(色谱纯),上海安谱实验科技股份有限公司;C6~C20 正构烷烃标准品,西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
UV-2450型分光光度计、DTG-60型差热热重同步分析仪、GCMS-QP 2010 Plus型气相色谱-质谱联用仪,日本岛津仪器有限公司;PHS-320型显数式pH计,成都世纪方舟科技有限公司;75 μm CAR/PDMS萃取头,美国Supelco公司。
1.3 试验方法
1.3.1 HSPI的制备方法
将SPI粉末溶于适量的去离子水,制备5 g/L的蛋白溶液,加入适量的蛋白酶F400,在其最适温度50 ℃和pH 7.0条件下进行水解,采用pH-stat[9]计算产物水解度。水解完成后,收集水解度为2%的水解产物,将其于95 ℃下加热10 min后灭酶,并于4 000 r/min条件下离心15 min,上清液经过冷冻干燥后即为HSPI。
1.3.2 壁材反应液的制备
参考HUANG等[10]的方法并稍作改变。将一定量的HSPI和SA用去离子水溶解后常温下搅拌2 h,于室温下3 000×g离心30 min,除去不溶性杂质及泡沫,分别用凯氏定氮法[11]和苯酚法[12]测定HSPI蛋白含量和SA中多糖含量,留待后续各反应进行。配制不同浓度的醋酸溶液用于滴定反应的不同阶段。
1.3.3 壁材溶液的ζ-电位分析
分别配制0.1 g/L的HSPI和SA反应溶液,在室温条件下利用不同浓度的醋酸溶液将其pH值调至2.5~6.0,将样品分别置于样品池中,用马尔文纳米粒度仪测定不同pH值下两者的ζ-电位值。
1.3.4 浊度滴定曲线测定
采用KLEMMER等[13]的方法有所改变,分别配制质量浓度为1 g/L的HSPI和SA溶液,用0.1 mol/L的NaOH溶液调节初始pH值至6.0,匀速搅拌反应液,用醋酸调节溶液的pH值,取不同pH下的反应液于600 nm处测定吸光度值。
1.3.5 复聚物及微胶囊的制备
取相同质量的HSPI和SPI分别与SA以一定比例混合,溶于去离子水中使其混合液总质量浓度为10 g/L,在500 r/min搅拌速率下,缓慢用醋酸溶液调pH至特定值,反应30 min,即得到相应的复聚物溶液,经冷冻干燥后制得固体粉末SPI-SA复聚物和HSPI-SA复聚物。
在上述混合溶液的基础上,每100 mL混合溶液中加入1 mL甜橙油,在10 000 r/min的转速下高速分散3 min,后续步骤同上即得到相应的HSC和ISC溶液,冷冻干燥后分别制得HSC和ISC固体粉末微胶囊。
1.3.6 微胶囊流动性的测定
固定圆锥法测定休止角的装置由支架、漏斗、圆盘和刻度尺组成。将漏斗置于支架上,向漏斗内倒入干燥后制得的固体粉末微胶囊产品,使样品通过漏斗落在下方固定直径的圆盘上,粉体逐渐堆积,直至物料不能继续堆高为止。用刻度尺测量物料堆高度,计算如公式(1)所示[14]:
(1)
式中:θ为休止角,°;h为物料堆高度,mm;r为圆盘半径,mm。
1.3.7 微胶囊水分的测定
精密称取固体粉末微胶囊1 g左右于干燥至恒重的铝盒中,置于105 ℃干燥箱中干燥2 h后,盖好铝盖取出,随后放入干燥器中冷却0.5 h后称重,重复以上操作,直到前后质量差不超过2 mg,通过计算得出微胶囊产品水分质量分数,其计算如公式(2)所示[15]:
水分质量分数![]()
(2)
式中: m1,铝盒和样品的质量,g;m2,铝盒的质量,g;m3,铝盒和样品干燥后的质量,g。
1.3.8 有效载量的测定
产品中甜橙油总含量的测定:称取0.5 g冻干后微胶囊粉末,加入10 mL无水乙醇磁力搅拌20 min,30 ℃、100 W条件下超声10 min,在4 000 r/min下离心5 min,洗去无水乙醇相,再向剩下的沉淀中加入10 mL无水乙醇,重复上述操作至少3次,0.22 μm有机滤膜过滤后在317 nm处测其吸光度。
表面油含量的测定:同样精密称取0.5 g冻干后的微胶囊粉末,加入10 mL无水乙醇,轻微振荡1 min,洗脱包合物表面的甜橙油,然后3 000 r/min离心1 min,倾出乙醇相,再向沉淀中加入10 mL乙醇,重复上述操作3次,合并乙醇相,经0.22 μm有机滤膜过滤后,在317 nm处测定吸光度。有效载量的计算如公式(3)所示:
有效载量![]()
(3)
1.3.9 乳化活性和乳化稳定性的测定
将SPI、HSPI、经干燥制得的SPI-SA复聚物和HSPI-SA复聚物,分别溶于pH=7的混合磷酸盐缓冲液中,配制成1 g/L的样品溶液。取75 mL样品溶液于250 mL烧杯中,加入25 mL大豆色拉油,在10 000 r/min条件下均质1 min后,迅速从底部吸取乳化液50 μL,稀释于5 mL、0.1%(质量分数)SDS溶液中,用0.1%的SDS溶液作为对照,立即使用分光光度计测定其在500 nm吸光值(A)。EAI和ESI计算如公式(4)、公式(5)所示[16]:
![]() 稀释度
稀释度
(4)
式中:EAI,m2/g;A0,测定的吸光度值;φ,大豆油占乳液的体积比;ρ,HSPI乳化之前的质量浓度,g/mL。
(5)
式中:ESI,min;A0,均质后迅速吸取的乳化液的吸光值;At,乳化液静止后的吸光值;t,时间差。
1.3.10 微胶囊热重分析
分别称取约5 mg的甜橙油及冷冻干燥的甜橙油微胶囊粉末样品,采用热重分析仪测量其热释放曲线,测量条件如下:初始温度25 ℃,以20 ℃/min的速率升温至400 ℃,载气为氮气,流量为30 mL/min。
1.3.11 甜橙油微胶囊挥发性成分分析
样品准备:称取约0.3 g甜橙油微胶囊溶液,置于15 mL固相微萃取样品瓶中,密封,80 ℃下水浴加热,处理时间分别为0、1、3、5、7 h。
SPME条件:将处理后的样品置于40 ℃的水浴中[17],用75 μm CAR/PMDS萃取头吸附30 min。将萃取头取下置于GC进样口解吸10 min,进样口温度为250 ℃。
GC条件:采用DB-WAX毛细管色谱柱(30 m×0.25 mm×0.25 μm),载气为氦气,流速为1.8 mL/min。升温程序:40 ℃维持1 min,后以5 ℃/min升温至60 ℃,随后以10 ℃/min升温至100 ℃并保持3 min,最后以5 ℃/min升温至180 ℃并保持2 min。
MS条件:电离方式为EV,电子能量70 eV,灯丝发射电流为35 μA,扫描速率4.45 次/s,质量扫描范围 35~450 m/z。
以正构烷烃C6~C20的实际测量值校正保留时间。通过NIST17Library谱库对测试结果进行检索,取匹配度80%以上的挥发性成分。采用辛酸乙酯(1 mg/mL,溶剂为甲醇)作为内标进行定量分析。
1.3.12 数据处理
采用Origin 2018对柱状图和折线图进行绘制,每个样品均重复3次,描述性统计值以x±s 表示。
2 结果与分析
2.1 微胶囊壁材的ζ-电位
HSPI是由SPI水解而成的酶解大豆蛋白,其本身带有羧基与氨基,其带电的性质直接决定于环境中所带的pH值。由图1可知,HSPI等电点(isoelectric point,pI)在4.2左右,在pH<4.2时HSPI带正电,在pH>4.2时HSPI带负电。SA由葡萄糖醛酸(G)和甘露醇酸(M)组成,形成M块和G块以及交替序列块的区域[18]在pH 2.5~6.0均带负电,并且所带负电基团数随pH的减小而减少。由此可知,当HSPI的pI<4.2时,由于正负电荷的吸引作用,使HSPI具备与SA发生静电相互作用的能力。
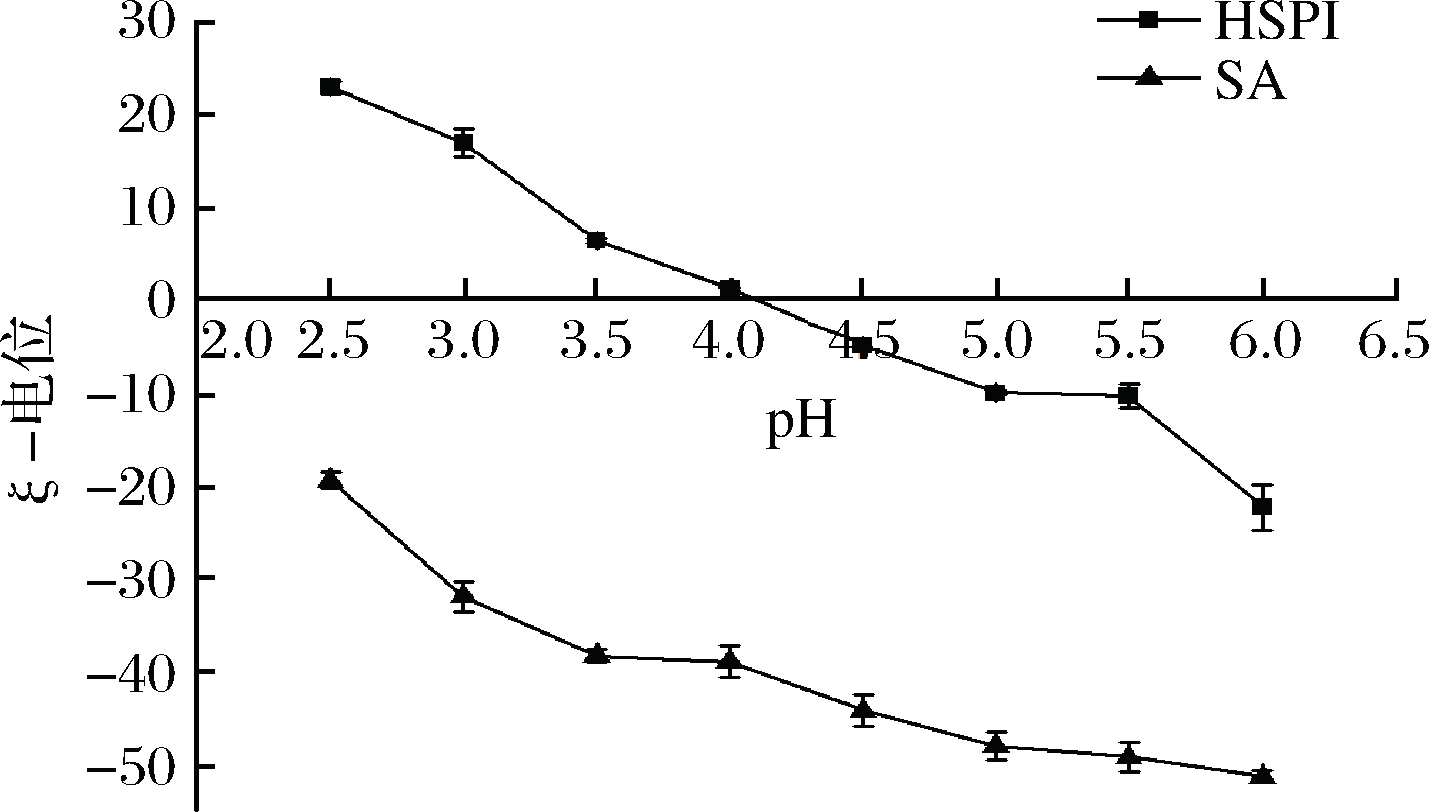
图1 不同pH下HSPI和SA的ζ-电位值
Fig.1 ζ-potential values of HSPI and SA at different pHs
2.2 不同HSPI与SA质量比下复聚物的形成
2种胶体由于发生静电相互作用生成乳白色浑浊液,从而降低该溶液的光透过性,且反应程度与透光性成正比关系。浊度滴定曲线开始于pH 6.0,此pH下由于HSPI与SA两分子之间的静电相互作用斥力而使溶液均一透明。由图2可知,随着pH的下降,有一部分带正电基团的蛋白分子与带负电的SA发生微弱的静电相互作用,溶液由于混合光密度值的升高(OD600),出现轻微的浑浊,溶液整体泛着淡淡的乳光,此过程被定义为可溶性复聚物的生成阶段[19],对应的pH临界值为pHc。随着pH的进一步降低,由于静电相互作用反应的增强,体系OD600值迅速攀升,如在m(HSP)∶m(SA)=7∶1体系中,pH值由4.5降至3.5时,OD600由0.151快速上升至0.802,说明在pH 4.5左右不可溶性复聚物开始生成,对应临界值pHφ1,此时由于蛋白多糖结合成紧密结构致使溶液呈现非透明状的乳白色,这被解释为奥斯特熟化现象[20];当该体系pH达到3.5时,OD600达到峰值为0.802,对应pHopt;pH继续减小,在pH 3.0左右出现拐点值,此时对应临界值为pHa,经过此拐点,OD600值呈现更为缓慢的下降趋势,静电相互作用力逐渐减弱,直到OD600开始不再发生变化,此时所对应的是反应的pHφ2处。由于本文主要研究不可溶性复聚物,因此pHc到pHa所对应的OD600为主要研究区域。
由图2可知,HSPI-SA不同比例下出现的OD600峰值是不同的,这是由于HSPI和SA分子结构、电荷数量不同而导致不可溶性复合物内部致密性不同,而复合凝聚微胶囊形成的原理是当不可溶性复合物出现pI值时,复聚物内部致密度能够达到最高,此时所对应的OD600值也最大。当m(HSP)∶m(SA)=7∶1,pH 3.5时,OD600也达到峰值。
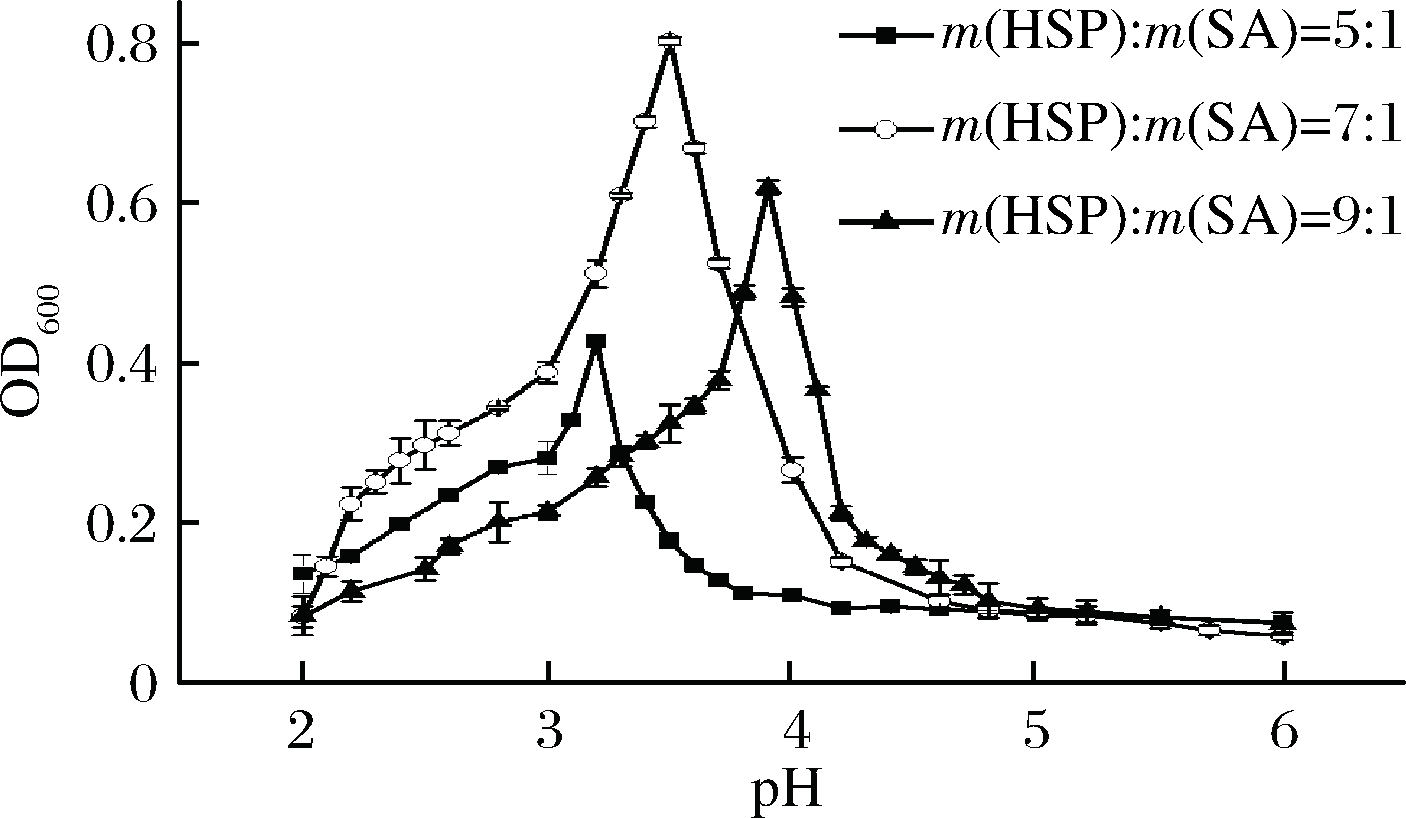
图2 HSPI-SA复合溶液的浊度滴定曲线
Fig.2 Effect of biopolymers mixing ratio and pH on the turbidity for the system of HSPI-SA
2.3 温度对HSPI-SA复聚物形成的影响
由图3可知,随着温度的升高,OD600峰值逐渐减小并且其对应的pHopt逐渐减小,说明温度的升高在一定程度上阻碍了复合凝聚物的生成,这可能是由于部分氢键断裂所导致。一般情况下,温度较高时,分子的运动速度增加,疏水相互作用增强,氢键减弱[4]。GIRARD等[21]研究也发现,随着温度的升高,β-乳球蛋白-高甲氧基果胶形成复合凝聚物的产量逐渐减少。当pH低于pHopt时,OD600值迅速下降,到达pHa时出现拐点,在 25、35、45 ℃ 时,其拐点分别出现在pH 3.1、pH 2.8和pH 2.6处。当pH
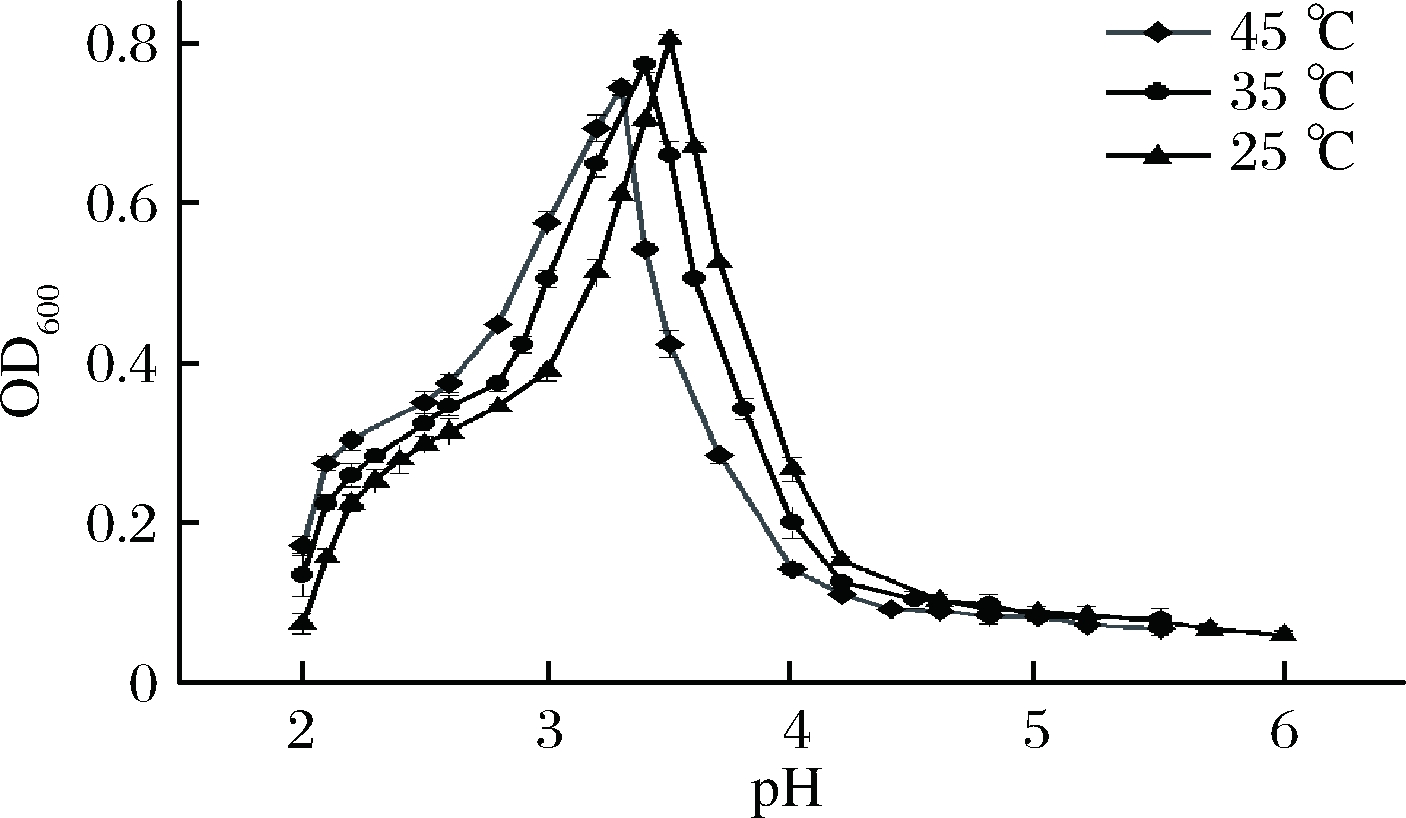
图3 HSPI-SA复合溶液浊度曲线
Fig.3 Turbidity curves of HSPI-SA mixtures as a function of temperature
2.4 甜橙油微胶囊产品的理化指标
对于粉末状微胶囊而言,过高的水分含量在后续的贮藏过程中容易使样品结块和霉变[22]。由表1可知,2种微胶囊的水分含量都较低,而HSC微胶囊水分含量略低于ISC微胶囊,说明HSC微胶囊更易于保藏。微胶囊产品的流动性一般用休止角评价,休止角在30°~45°则说明粉末流动性较好,当休止角>45° 时则表明粉末流动性一般[23]。HSC微胶囊休止角为38.7°优于SPI-SA微胶囊46.5°,说明HSC微胶囊流动性相对较好。这可能是由于经过酶解反应制成的微胶囊较小增加了其流动性能。微胶囊产品的有效载量越高其产品质量越高,由此得出HSC有效载量略高于ISC微胶囊。
表1 甜橙油微胶囊产品的理化指标
Table 1 Physical and chemical properties of sweet orange oil microcapsules

微胶囊水分质量分数/%休止角/°有效载量/%HSC7.023±0.13438.7±0.844.74±2.14ISC7.238±0.53146.5±0.539.98±1.21
2.5 乳化活性和乳化稳定性
由图4可知,复合凝聚反应使EAI显著增高,而ESI也比单独的蛋白高,这可能是因为复合凝聚反应与糖结合促进蛋白暴露出更多的反应位点,减小了油滴与蛋白疏水部位结合的位阻。而较高的ESI值能使包埋的疏水性物质保持较长时间的稳定,说明复合凝聚反应比单个蛋白更适合疏水性物质的包埋。而较高的EAI反映出其与油滴之间的亲和能力较强[22],这也是复合凝聚物对芯材具有更高载量的重要原因。由于微胶囊乳化停留时间一般不超过10 min,而复合凝聚物中,ESI最小值为42.1 min,远远大于10 min,说明2种复聚物的ESI值均能达到微胶囊性质要求。由此可见,HSPI-SA复聚物较SPI-SA复聚物对于疏水性芯材物质更具有亲和力,更适合作为复合凝聚壁材。
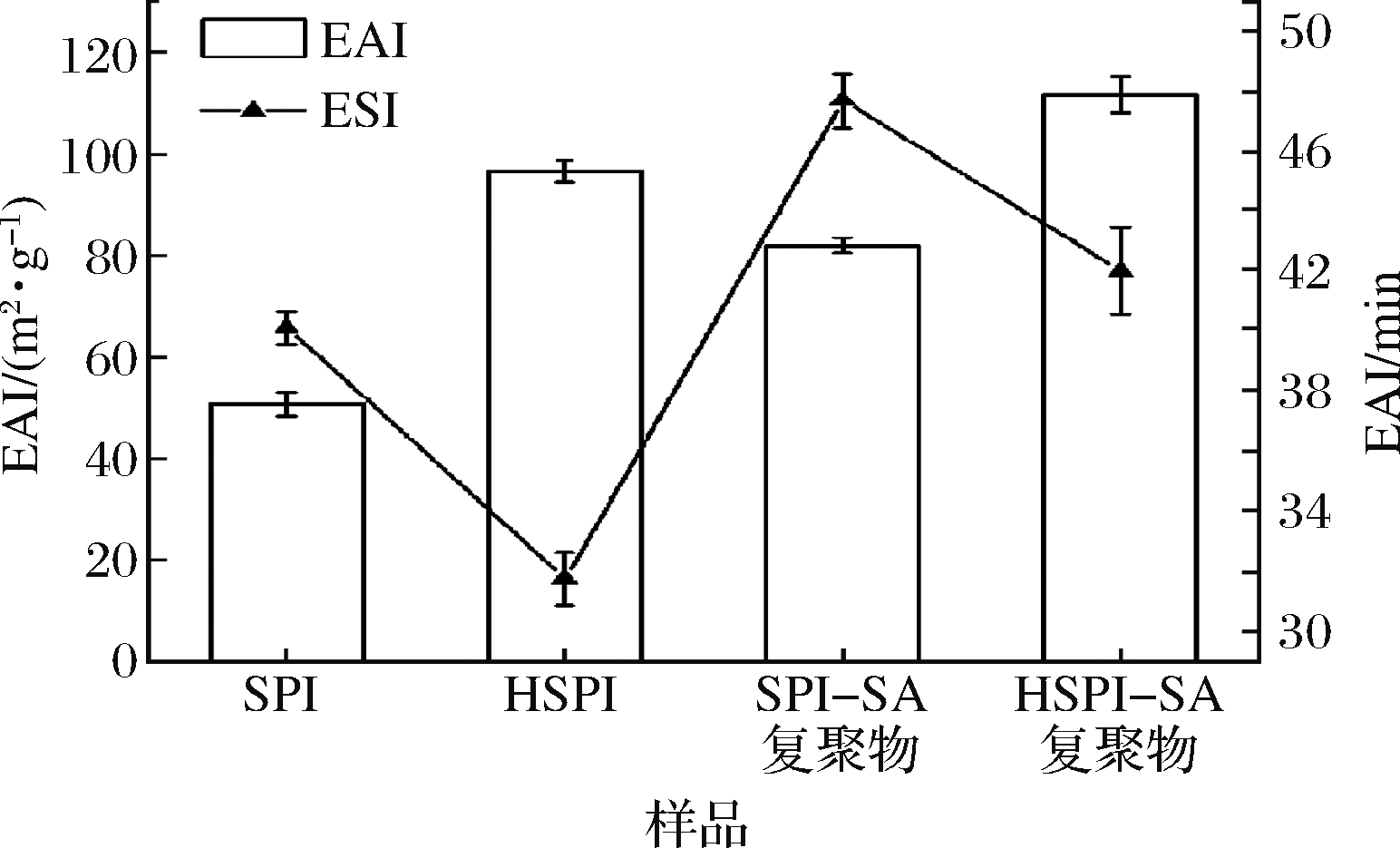
图4 SPI、HSPI、SPI-SA复聚物和HSPI-SA复聚物乳化性质的影响
Fig.4 The thee mulsifying properties of SPI、HSPI、SPI-SA coacervation and HSPI-SA coacervation
2.6 热重分析
热重分析(thermo-gravimetric analysis, TGA)是指在程序控制升温条件下,待测样品由于温度升高发生物理化学变化而导致本身质量的变化,因此微胶囊的热重曲线是衡量其耐热性好坏的重要分析指标,常应用于测定热分解温度以及分析热稳定性和热分解动力学等[25]。图5为单独的芯材甜橙油、HSC和ISC在0~400 ℃的热重分析曲线。其中,未经包埋的甜橙油质量损失速率呈先平缓后增大的趋势,尤其是在达到75 ℃以上时,质量迅速损失,当温度上升至150 ℃时,损失程度几乎达到100%。而HSC和ISC中,热重变化可分为3个部分,其中低于200 ℃为第一阶段,此阶段2种微胶囊的质量损失都较小,这种现象可能与残留水分的质量损失有关,较低温度可能会导致水分与物质分离。200~350 ℃升温过程为第二阶段,2种微胶囊均出现最大的质量损失,HSPI-SA微胶囊质量损失达到37.2%,ISC微胶囊达到44.7%,表明此阶段部分芯材出现泄漏现象,并且ISC微胶囊损失程度大于HSC微胶囊损失程度。第3阶段为350~400 ℃,仍能观测到微胶囊的部分热降解,而曲线呈现平缓下降趋势,意味着此时的2种微胶囊仍然具有一定的耐热性,至400 ℃时,HSC质量比仍高于ISC,由此说明,由HSPI制备的微胶囊耐热性比SPI制备的微胶囊更好。

图5 甜橙油及复合凝聚微胶囊热重分析
Fig.5 The TGA curves of sweet orange oil and microcapsules
2.7 热处理时间对甜橙油微胶囊挥发性风味成分的影响
表2为HSC预先经80 ℃下加热不同时间后,通过SPME- GC-MS检测得到的挥发性风味物质的组成及含量。由于微胶囊溶液是液固体共存状态,采用SPME萃取技术能充分富集体系中的挥发性成分[24]。对于香精微胶囊,耐热性是衡量微胶囊保香性质的重要分析指标,通过该指标可探究HSC在高温条件下可耐受的最佳保香时间。
从表2可以看出,不同加热时间下甜橙油微胶囊中共检测到48种挥发性风味化合物,随着加热时间的增加,甜橙油大部分挥发性风味物质含量均不同程度地减小,但同时,有些物质随着加热时间的增加呈相反趋势,如α-松油醇、香芹酮和香芹醇。α-松油醇被认为是在甜橙油贮藏过程中变质时产生的最重要的一类挥发性化合物之一,因其赋予食物陈腐和霉臭特征味道[25],因此把它作为甜橙油变质的重要指标[26],而α-松油醇在微胶囊加热前5 h含量未检出,到第7 h时其含量高达6.463 μg/g,说明加热到7 h时甜橙油已变质。同时由于加热时间的延长,D-柠檬烯极易氧化生成香芹酮和香芹醇,这也是导致甜橙油变质的主要原因[27]。
由表2和图6可知,D-柠檬烯(D-limonene)、癸醛(decanal)、月桂烯(myrcene)、辛醛(octanal)、芳樟醇(linalool)、α-蒎烯(α-pinene)和柠檬醛(citral)含量较高,通常被认为是甜橙油的特征风味物质[27-28]。其中,含量最高的为D-柠檬烯(含量82.63%),具有柠檬与橘子的混合香味[29],而芳樟醇的风味阈值很低,具有浓郁的花香[30], 癸醛具有渗透性的桔香和果甜香,月桂烯兼具药草味和柑桔味混合香气,而柠檬醛和辛醛则是具有强烈的似柠檬的香味和桔子的甜味[29],它们共同构成了甜橙油特征香型的主体轮廓。如图6所示,随着加热时间的延长,7种主要特征风味物质含量均有所减小。在加热至1 h时,微胶囊可有效保护内部芯材物质,延至第5 h时,大部分特征风味物质仍能保持在50%左右,到第7 h时,4种含量最高的特征性风味物质(D-柠檬烯,葵醛,月桂烯和辛醛)均降至30%以下,说明此时甜橙油风味识别极差,同时也表明HSC无法耐受5 h以上的高温。
表2 甜橙油微胶囊于80 ℃ 下加热不同时间后的挥发性物质的组成及含量 单位:μg/g
Table 2 The components and contents of volatile compounds from sweet orange oil microcapsules heated at 80 ℃ for various hours
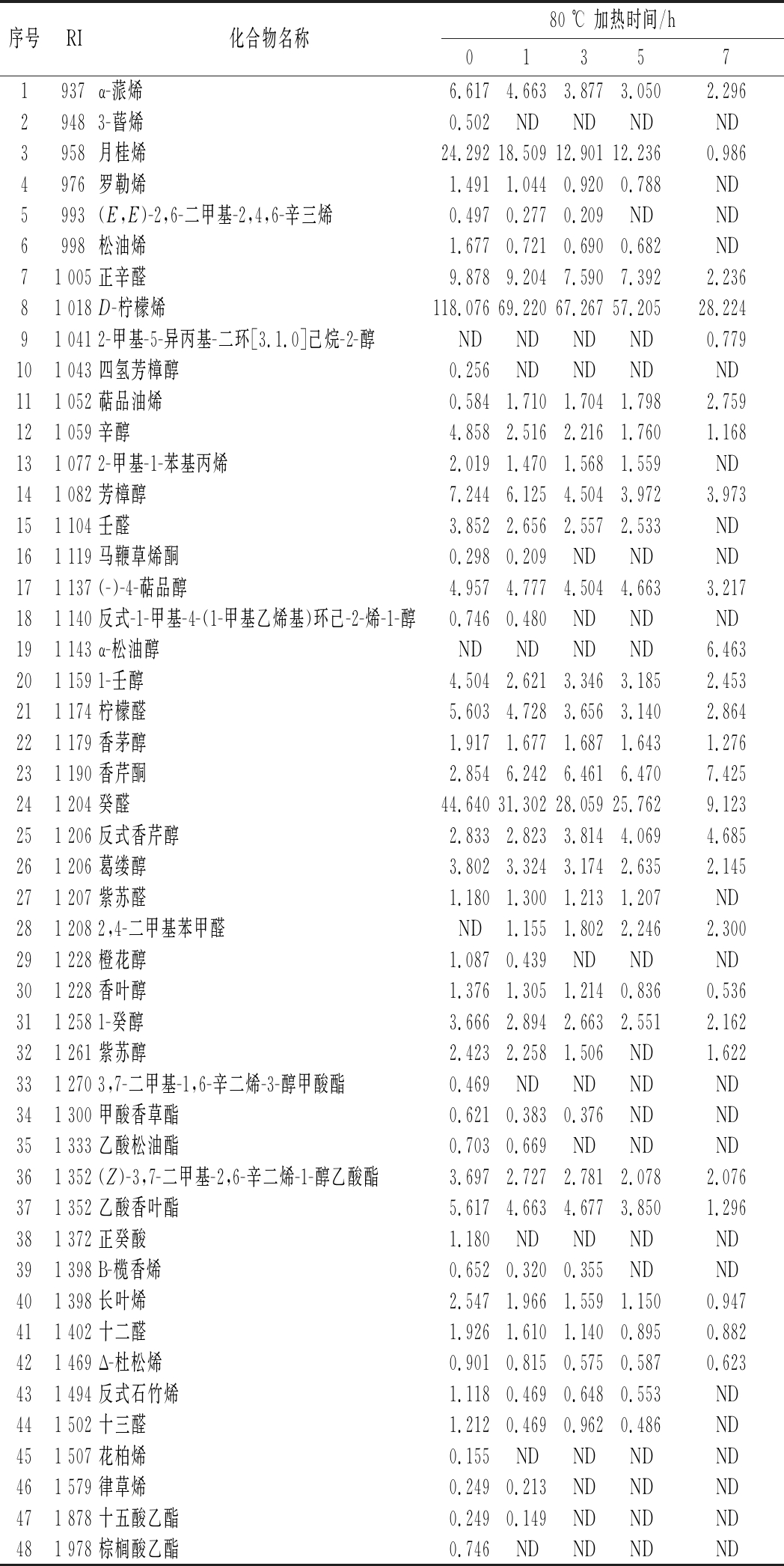
序号RI化合物名称80 ℃ 加热时间/h013571937α-蒎烯6.6174.6633.8773.0502.29629483-蒈烯0.502NDNDNDND3958月桂烯24.29218.50912.90112.2360.9864976罗勒烯1.4911.0440.9200.788ND5993(E,E)-2,6-二甲基-2,4,6-辛三烯0.4970.2770.209NDND6998松油烯1.6770.7210.6900.682ND71 005正辛醛9.8789.2047.5907.3922.23681 018D-柠檬烯118.07669.22067.26757.20528.22491 0412-甲基-5-异丙基-二环[3.1.0]己烷-2-醇NDNDNDND0.779101 043四氢芳樟醇0.256NDNDNDND111 052萜品油烯0.5841.7101.7041.7982.759121 059辛醇4.8582.5162.2161.7601.168131 0772-甲基-1-苯基丙烯2.0191.4701.5681.559ND141 082芳樟醇7.2446.1254.5043.9723.973151 104壬醛3.8522.6562.5572.533ND161 119马鞭草烯酮0.2980.209NDNDND171 137(-)-4-萜品醇4.9574.7774.5044.6633.217181 140反式-1-甲基-4-(1-甲基乙烯基)环己-2-烯-1-醇0.7460.480NDNDND191 143α-松油醇NDNDNDND6.463201 1591-壬醇4.5042.6213.3463.1852.453211 174柠檬醛5.6034.7283.6563.1402.864221 179香茅醇1.9171.6771.6871.6431.276231 190香芹酮2.8546.2426.4616.4707.425241 204癸醛44.64031.30228.05925.7629.123251 206反式香芹醇2.8332.8233.8144.0694.685261 206葛缕醇3.8023.3243.1742.6352.145271 207紫苏醛1.1801.3001.2131.207ND281 2082,4-二甲基苯甲醛ND1.1551.8022.2462.300291 228橙花醇1.0870.439NDNDND301 228香叶醇1.3761.3051.2140.8360.536311 2581-癸醇3.6662.8942.6632.5512.162321 261紫苏醇2.4232.2581.506ND1.622331 2703,7-二甲基-1,6-辛二烯-3-醇甲酸酯0.469NDNDNDND341 300甲酸香草酯0.6210.3830.376NDND351 333乙酸松油酯0.7030.669NDNDND361 352(Z)-3,7-二甲基-2,6-辛二烯-1-醇乙酸酯3.6972.7272.7812.0782.076371 352乙酸香叶酯5.6174.6634.6773.8501.296381 372正癸酸1.180NDNDNDND391 398B-榄香烯0.6520.3200.355NDND401 398长叶烯2.5471.9661.5591.1500.947411 402十二醛1.9261.6101.1400.8950.882421 469Δ-杜松烯0.9010.8150.5750.5870.623431 494反式石竹烯1.1180.4690.6480.553ND441 502十三醛1.2120.4690.9620.486ND451 507花柏烯0.155NDNDNDND461 579律草烯0.2490.213NDNDND471 878十五酸乙酯0.2490.149NDNDND481 978棕榈酸乙酯0.746NDNDNDND
注:RI (retention index)表示保留指数;ND表示未检测到

I-D-柠檬烯;D-癸醛;M-月桂烯;O-辛醛;L-芳樟醇;P-α-蒎烯;C-柠檬醛
图6 不同加热时间处理下HSC的主要挥发性成分比较
Fig.6 The comparation of major volatile compounds of HSC heated at 80 ℃ for various hours
3 结论
以水解度为2%的HSPI与SA为复合凝聚壁材,通过ζ-电位确定HSPI的pI值为4.2,即HSPI与SA发生的最大静电相互作用在4.2以下。以浊度滴定曲线为主要参考指标,发现静电相互作用3个临界点pHc、pHφ1和pHopt随HSPI与SA质量比增加而增加,而随体系反应温度的增高均减小,并通过pHopt确定HSPI-SA复聚物最适壁材质量比为7∶1,最适温度为25 ℃。以甜橙油微胶囊的理化指标、ESI、EAI和热重分析为主要考察指标,结果发现,HSC耐贮藏性、耐热性和对芯材的亲和力均优于ISC。利用SPME-GC-MS测定不同加热时间下甜橙油微胶囊挥发性风味物质的种类与含量,发现HSC无法耐受5 h以上的高温,本研究为风味微胶囊在食品热加工中应用提供理论基础。
[1] 刘鑫, 谭烨, 周红审, 等.水蒸气蒸馏甜橙油的工艺优化、分析及应用[J].食品研究与开发, 2014, 35(10):66-69.
LIU X, TAN Y, ZHOU H S, et al.Study on the extraction, analysis and application for sweet orange oil by steam distillation[J].Food Research and Development, 2014, 35(10):66-69.
[2] DE KRUIF C G, TUINIER R.Polysaccharide protein interactions[J].Food Hydrocolloids, 2001, 15(4-6):555-563.
[3] CHANG C P, LEUNG T K, LIN S M, et al.Release properties on gelatin-gum Arabic microcapsules containing camphor oil with added polystyrene[J].Colloids Surf B Biointerfaces, 2006, 50(2):136-140.
[4] WEINBRECK F, NIEUWENHUIJSE H, ROBIJN G W, et al.Complexation of whey proteins with carrageenan[J].Journal of Agricultural & Food Chemistry, 2004, 52(11):3 550-3 555.
[5] SCHMITT C, SANCHEZ C, DESPOND S, et al.Effect of protein aggregates on the complex coacervation between β-lactoglobulin and acacia gum at pH 4.2[J].Food Hydrocolloids, 2000, 14(4):403-413.
[6] LIU S, CAO Y L, GHOSH S, et al.Intermolecular interactions during complex coacervation of pea protein isolate and gum Arabic[J].Journal of Agricultural and Food Chemistry, 2010, 58(1):552-556.
[7] DONG D, LI X F, HUA Y F, et al.Mutual titration of soy proteins and gum Arabic and the complexing behavior studied by isothermal titration calorimetry, turbidity and ternary phase boundaries[J].Food Hydrocolloids, 2015, 46:28-36.
[8] ZHANG Y T, TAN C, ABBAS S, et al.Modified SPI improves the emulsion properties and oxidative stability of fish oil microcapsules[J].Food Hydrocolloids, 2015, 51:108-117.
[9] ADLERNISSEN J.Enzymic hydrolysis of food proteins[J].Canadian Medical Association Journal, 1986, 172(8):1 783-1 785.
[10] HUANG G Q, SUN Y T, XIAO J X, et al.Complex coacervation of soybean protein isolate and chitosan[J].Food Chemistry, 2012, 135(2):534-539.
[11] WEESEPOEL Y, SILLETTI E, ALEWIJN M, et al.Importance of harmonised sample preparation for moisture and protein content determinations in official food control laboratories:A poultry meat case study[J].Food Chemistry, 2019, 301:125 291.
[12] ZHANG W H, WU J, WENG L Y, et al.An improved phenol-sulfuric acid method for the determination of carbohydrates in the presence of persulfate[J].Carbohydrate polymers, 2020, 227:115 332.
[13] KLEMMER K J, WALDNER L, STONE A, et al.Complex coacervation of pea protein isolate and alginate polysaccharides[J].Food Chemistry, 2011, 130(3):710-715.
[14] 高艳. 复合凝聚法制备辣椒素微胶囊的研究[D].长沙:长沙理工大学, 2012.
GAO Y.Preparation of capsaicin microcapsules by complex coacervation[D].Changsha:Changsha University of Science and Technology, 2012.
[15] 中华人民共和国国家卫生与计划生育委员会. GB/T 5009.3—2016 食品中水分的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB/T 5009.3—2016 Determination of moisture in food[S].Beijing:China Standards Press, 2016.
[16] 张根生, 岳晓霞, 李继光.大豆分离蛋白乳化性影响因素的研究[J].食品科学, 2006, 27(7):48-51.
ZHANG G S, YUE X X, LI J G.Study on affecting factors of emulsification properties of soybean isolated protein[J].Food Science, 2006, 27(7):48-51.
[17] 杨菜冬, 张晓鸣.不同品种甜橙芳香物质的SPME分析[J].食品研究与开发, 2006, 27(11):162-166.
YANG C D, ZHANG X M.Analysis of aroma compounds of different varieties of sweet orange with SPME[J].Food Research and Development, 2006, 27(11):162-166.
[18] PALLANDRE S, DECKER E A, MCCLEMENTS D J.Improvement of stability of oil-in-water emulsions containing caseinate-coated droplets by addition of sodium alginate[J].Journal of Food Science, 2007, 72(9):518-524.
[19] MEKHLOUFI G, SANCHEZ C, RENARD D, et al.pH-induced structural transitions during complexation and coacervation of β-lactoglobulin and acacia gum[J].Langmuir the Acs Journal of Surfaces & Colloids, 2005, 21(1):386-394.
[20] SINGH S S, SIDDHANTA A K, MEENA R, et al.Intermolecular complexation and phase separation in aqueous solutions of oppositely charged biopolymers[J].International Journal of Biological Macromolecules, 2007, 41(2):185-192.
[21] GIRARD M, TURGEON S L, GAUTHIER S F.Interbiopolymer complexing between β-lactoglobulin and low- and high-methylated pectin measured by potentiometric titration and ultrafiltration[J].Food Hydrocolloids, 2002, 16(6):585-591.
[22] 赖凌峰. 明胶与羧甲基纤维素钠的复合凝聚作用及其微胶囊制备[D].无锡:江南大学, 2017.
LAI L F.Complex coacervation of gelatin and sodium carboxymethyl cellulose and preparation of microcapsules[D].Wuxi:Jiangnan University, 2017.
[23] 杜歌. 谷胱甘肽的复合凝聚微胶囊化技术研究[D].无锡:江南大学, 2015.
DU G.Study on complex coacervation microencapsulation of glutathione [D].Wuxi:Jiangnan University, 2015.
[24] LIU P, HUANG M G, SONG S Q, et al.Sensory characteristics and antioxidant activities of Maillard reaction products from soy protein hydrolysates with different molecular weight distribution[J].Food & Bioprocess Technology, 2012, 5(5):1 775-1 789.
[25] HALEVA-TOLEDO E, NAIM M, ZEHAVI U.Formation of α-terpineol in citrus juices, model and buffer solutions[J].Journal of Food Science, 1999, 64(5):838-841.
[26] RU Z, QING H B, MING D Y, et al.Thermal decomposition mechanism and kinetics study of plastic waste chlorinated polyvinyl chloride[J].Polymers, 2019,11(12):2 080.
[27] 刘克海, 陈秋林, 谢晶, 等.分子蒸馏法富集甜橙油特征香气成分[J].食品科学, 2012, 33(10):200-203.
LIU K H, CHEN Q L, XIE J, et al.Enrichment of characteristic aroma compounds in sweet orange oil by molecular distillation [J].Food Science, 2012, 33(10):200-203.
[28] 李源栋, 刘秀明, 蒋举兴.气相色谱/质谱法结合保留指数分析甜橙油中香味成分[J].食品与生物技术学报, 2017, 36(4):438-442.
LI Y D, LIU X M, JIANG J X.Analysis of aroma components in orange oil by GC/MS combined with the retention index[J].Journal of Food Science and Biotechnology, 2017, 36(4):438-442.
[29] 肖作兵, 马胜涛, 牛云蔚, 等.气相色谱嗅闻技术结合主成分分析鉴定甜橙油特征香气成分[J].中国食品学报, 2017, 17(1):253-257.
XIAO Z B, MA S T, NIU Y W, et al.Detection of the key aroma compounds of sweet orange oils by GC-O coupled with PCA[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(1):253-257.
[30] ITO Y, SUGIMOTO A, KAKUDA T, et al.Identification of potent odorants in Chinese jasmine green tea scented with flowers of Jasminum sambac [J].Journal of Agricultural and Food Chemistry, 2002, 50(17):4 878-4 884.