我国是小麦种植与消费大国,小麦秸秆作为小麦种植的副产物,年产量高达15 334万t。但小麦秸秆分布零散、体积大、运输成本高以及综合利用经济性差、产业化程度低等缺点,导致大量小麦秸秆未被有效利用,不仅造成资源浪费,还带来很多安全隐患和环境污染[1]。小麦秸秆的主要成分为纤维素、半纤维素和木质素,是一种产量巨大的木质纤维素资源[2]。由于木质素和半纤维素之间以牢固的醚键或酯键相互交联并镶嵌在纤维素内,且木质素包裹在纤维素外形成一种外围基质,使得木质纤维素产品的直接利用变得异常困难,限制了小麦秸秆的利用[3]。因此,有效开发利用小麦秸秆资源已成为提高麦田经济效益和绿色可持续发展的途径之一。
本实验以小麦秸秆为唯一碳源接种球毛壳菌CGMCC 6882进行发酵,并对发酵产生的胞外多糖进行提取纯化、结构解析和抗氧化活性分析,探究球毛壳菌CGMCC 6882对小麦秸秆的利用情况。
1 材料与方法
1.1 实验材料
小麦秸秆,河南郑州郊区;单糖标准品,美国Sigma公司;琼脂、蛋白胨、三氟乙酸、苯酚、浓硫酸,国药集团化学试剂有限公司;胰酶消化液、青霉素、链霉素、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)检测试剂盒,上海碧云天生物技术有限公司。
1.2 仪器与设备
HD500MHZ核磁共振仪,德国Bruker公司;Waters 1525高效液相排阻色谱仪,美国Waters公司;HT7700透射电子显微镜,日本HITACHI公司;WQF-510红外光谱仪,天津天光光学仪器有限公司;Q50 热重分析仪,美国TA公司;Series 8000 WJCO2细胞培养箱,美国Thermo Fisher公司。
1.3 实验方法
1.3.1 球毛壳菌CGMCC 6882利用小麦秸秆发酵生产活性多糖
1.3.1.1 球毛壳菌CGMCC 6882菌种活化
采用马铃薯、葡萄糖和琼脂制备PDA培养基,然后将冰箱中保藏的球毛壳菌CGMCC 6882取出并接种于PDA平板上,置于28 ℃生化培养箱中培养3 d左右。
1.3.1.2 球毛壳菌CGMCC 6882利用小麦秸秆发酵
将小麦秸秆烘干、粉碎、过60目筛,并以其作为唯一碳源配制发酵培养基,按2%接种量接种球毛壳菌CGMCC 6882种子液,28 ℃、150 r/min培养7 d。
1.3.1.3 发酵液的收集与处理
发酵结束后,发酵液抽滤除菌体和大颗粒不溶性杂质,25 ℃、10 000 r/min离心20 min除去不溶性细小颗粒,收集上清液并在60 ℃、0.1 MPa下旋蒸浓缩。浓缩液中加入活性炭于25 ℃、150 r/min振荡过夜并离心取上清液。上清液中加入3倍体积Sevage溶剂脱蛋白,然后加入4倍体积无水乙醇4 ℃过夜析出多糖。最后,将多糖冻干并研磨收集。
1.3.1.4 发酵过程中多糖含量的测定
以不接种球毛壳菌CGMCC 6882的发酵培养基作空白对照,分别在不同时间用吸管吸取2 mL空白对照组和实验组发酵液。加5倍无水乙醇析出多糖沉淀,再加蒸馏水复溶,并定容到50 mL。然后采用苯酚-硫酸法测定样品中多糖含量[4]。
1.3.2 多糖结构特征分析
采用高效体积排阻色谱测定多糖分子质量,色谱条件为:UltrahydrogelTMLinear 300 mm×7.8 mm二级串联柱,流动相0.1 mol/L硝酸钠,流速0.9 mol/min,柱温45 ℃。用Mw (重均分子质量) 分别为270 000、975 000、3 680 000、13 535 000 Da的葡聚糖标品绘制分子质量校正曲线。
使用高效离子色谱测定单糖组成,色谱条件:Dionex CarboPacPA20 (3 mm×150 mm) 阴离子交换柱,Dionex CarboPacPA20 (3 mm×50 mm) 保护柱,以18 mmol/L NaOH溶液为流动相,等度洗脱,流速0.5 mL/min,柱温30 ℃,脉冲安培检测器检测,进样体积为20 μL。
称取1.0 mg球毛壳菌CGMCC 6882胞外多糖,然后与200 mg溴化钾充分研磨并压片,采用红外光谱仪于400~4 000 cm-1对样品进行红外扫描,并用OMNIC 8.2软件处理红外数据。
称取球毛壳菌CGMCC 6882胞外多糖约3 mg,以1 mL重水溶液进行溶解,放置室温下过夜使多糖完全溶解,涡旋混匀,以7 200 r/min离心10 min,最后将样品转移到5 mm核磁管中进行检测。核磁检测条件如下:PA BBI 400S1 H-BB-D-05 Z探头,共振频率500 MHz,仪器检测温度298 K。以四甲基硅烷(δ = 0 ppm)和重水(D2O)(δ = 4.8 ppm) 作化学位移内标。
称取球毛壳菌CGMCC 6882胞外多糖1 mg加入到100 mL水中,室温下150 r/min磁力搅拌过夜,然后将多糖溶液滴到铜网上,晾干后采用透射电子显微镜进行扫描观察,根据观察要求放大不同倍数。
称取3 mg左右球毛壳菌CGMCC 6882胞外多糖,使用Al2O3作参比物,在0.15 MPa的N2气氛下从35 ℃升温至300 ℃进行热重分析,升温速率10 ℃/min。
1.3.3 多糖的体外抗氧化活性
球毛壳菌CGMCC 6882胞外多糖清除ABTS阳离子自由基、超氧阴离子、羟自由基和DPPH自由基的活性参照HU等[5]方法进行检测。
1.3.4 多糖的细胞抗氧化活性
1.3.4.1 细胞氧化损伤诱导模型的构建
将Caco-2细胞活化接种于96孔板,移入细胞培养箱中培养24 h。之后每孔加入100 μL含不同H2O2浓度的细胞培养液,对Caco-2细胞进行诱导损伤。采用MTT染色法在490 nm处测定各组吸光值。
1.3.4.2 球毛壳菌CGMCC 6882胞外多糖的细胞抗氧化活性
细胞损伤会导致其清除H2O2能力下降,引起脂质过氧化反应,过氧化物MDA 大量聚集。SOD、CAT和GSH-Px是抗氧化酶系的重要组成部分,通过测定加入不同浓度多糖溶液的细胞氧化诱导Caco-2细胞损伤模型胞内SOD、CAT、GSH-Px和MDA活力变化,分析球毛壳菌CGMCC 6882胞外多糖对细胞的氧化保护作用[6]。
将接种了Caco-2细胞的96孔细胞培养板移入细胞培养箱中,培养至细胞状态稳定。然后,多糖试验组每孔加入100 μL含IC50左右值浓度的H2O2和不同浓度CGMCC 6882胞外多糖的培养液。试验设置空白组 (不加H2O2和CGMCC 6882胞外多糖) 和H2O2对照组 (不加CGMCC 6882胞外多糖,只加培养液和400 μmol/L的H2O2溶液)。最后,将上述5组细胞均置于细胞培养箱中,在37 ℃和含5%(体积分数)CO2条件下培养4 h。之后每孔加入100 μL细胞裂解液使细胞裂解,然后于4 ℃下8 000 r/min离心10 min,取上清液作为样本,参照试剂盒说明书对Caco-2胞内的SOD、CAT、GSH-Px和MDA活力进行测定。
2 结果与分析
2.1 球毛壳菌 CGMCC 6882利用小麦秸秆发酵生产活性多糖
以小麦秸秆为唯一碳源配制平板培养基,并接种球毛壳菌CGMCC 6882,发现平板上长出白色菌落 (图1-a),证明其具有降解利用小麦秸秆的能力。将球毛壳菌CGMCC 6882接种至发酵培养基进行发酵,对其发酵液进行抽滤除菌、离心、浓缩、脱色、脱蛋白、醇沉、柱层析和冷冻干燥等处理获得胞外多糖(图1-b)。对发酵过程中多糖产量进行监测(图1-c),空白对照组在培养过程中几乎没有多糖产生,说明发酵液中多糖是由球毛壳菌CGMCC 6882所产生。同时,XIANG等[7]发现Inonotus obliquus可以利用玉米秸秆生产抗氧化性多糖;XU等[8]也证实I.obliquus可以分别利用小麦秸秆、水稻秸秆和甘蔗渣发酵生产抗氧化活性胞外多糖。

a-球毛壳菌CGMCC 6882生长情况;b-球毛壳菌CGMCC 6882
胞外多糖;c-发酵液中多糖含量
图1 球毛壳菌CGMCC 6882在小麦秸秆平板上
生长情况、胞外多糖生成情况及发酵液中多糖产量
Fig.1 Growth profile of C.globosum CGMCC 6882 on wheat straw plate, polysaccharide produced, the content of polysaccharide in fermentation broth
2.2 多糖结构特征解析
球毛壳菌CGMCC 6882胞外多糖的单糖组成为鼠李糖、氨基葡萄糖、半乳糖、葡萄糖、木糖、果糖和葡萄糖醛酸,且其摩尔比为21.46∶1.58∶1.11∶55.15∶36.37∶7.04∶7.34 (图2-a)。同时,高效液相排阻色谱检测结果显示(图2-b),球毛壳菌CGMCC 6882胞外多糖的Mn(数均分子质量)为3.391×104 Da,Mw为3.538×104 Da,分散系数为1.043。LIU等[9]研究发现,单糖组成中葡萄糖酸和海藻糖含量影响Pleurotus citrinipileatus多糖的抗氧化活性。SONG等[10]发现糖苷键类型和岩藻糖含量能够影响平菇多糖的抗氧化活性。但LI等[11]证实,木糖含量对Epimedium koreanum Nakai多糖的抗氧化活性影响不大。大量研究发现,多糖的分子质量与其活性之间存在密切联系[12]。BLASCHEK等[13]发现分子质量可以影响多糖的生物活性,高分子质量葡聚糖具有较好免疫调节活性。ZHANG等[14]发现Pleurotus tuber-regium多糖分子质量影响其抗肿瘤活性。WANG等[15]研究也证实,小分子质量多糖具有更好的抗癌活性。单糖组成及比例和分子质量大小会影响多糖及寡糖的生物活性,可使多糖具有不同生物活性。
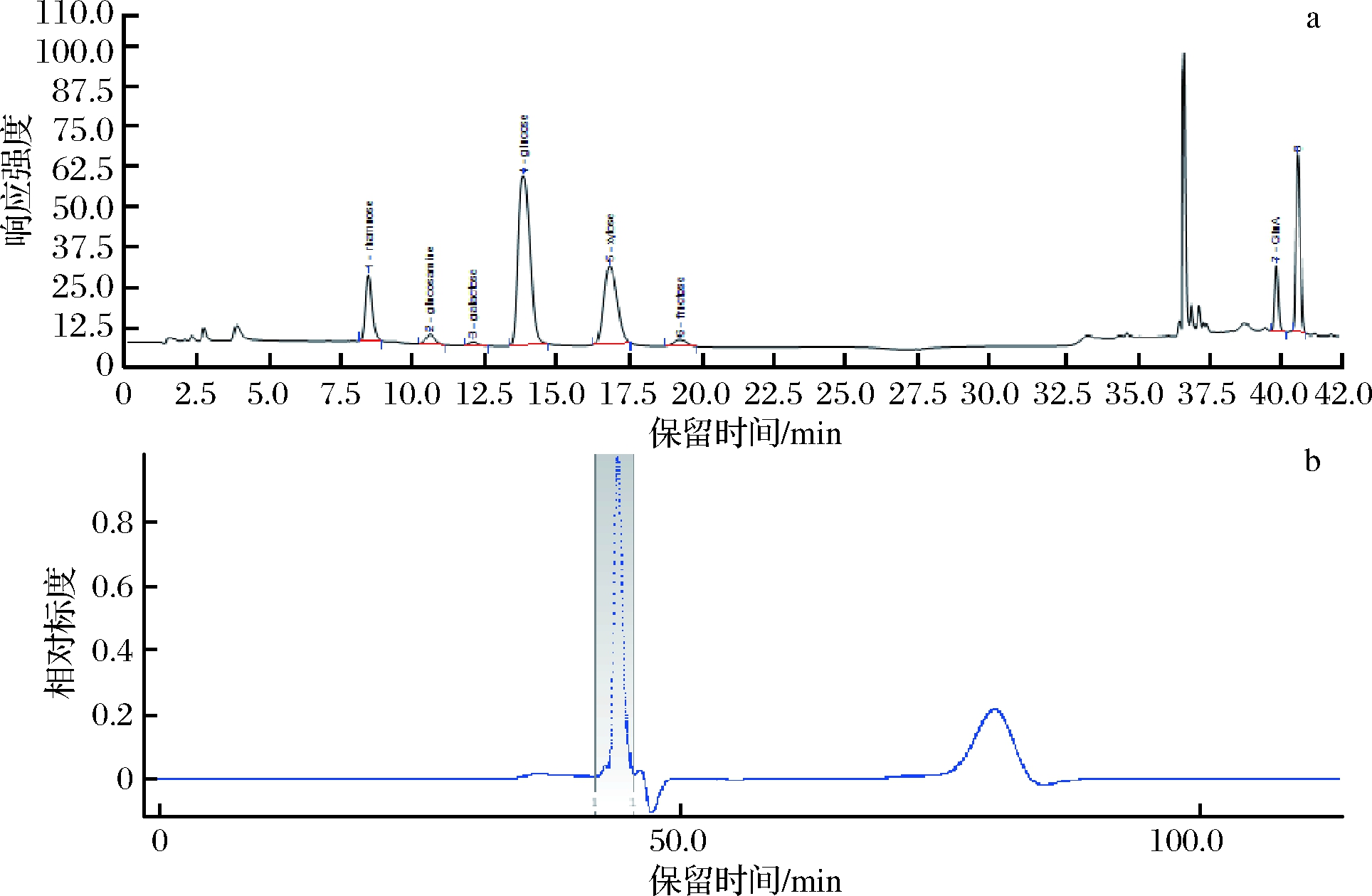
a-离子色谱;b-排阻色谱
图2 球毛壳菌CGMCC 6882胞外多糖色谱图
Fig.2 Chromatography of exopolysaccharide from C.globosum CGMCC 6882
红外光谱结果显示(图3-a),3 424 cm-1处吸收峰由—OH伸缩振动引起,2 910 cm-1处吸收峰由C—H伸缩振动引起,1 727 cm-1处为C![]() O伸缩振动吸收峰,1 612 cm-1处为C
O伸缩振动吸收峰,1 612 cm-1处为C![]() C变形吸收峰,1 420~1 360 cm-1内的吸收峰为C—H变角振动吸收峰,1 062 cm-1处吸收峰由C—O伸缩振动引起[9-10]。核磁共振结果显示(图3-b),4.701 ppm左右对应的峰为D2O,3.620~3.653 ppm对应的峰可能为CH2,3.747~3.776 ppm对应的峰可能为二氧杂环或CH2O,3.987~4.047 ppm对应的峰可能为CH,4.2 ppm 左右对应的CH2可能包在D2O峰当中而未显示。LO等[16]研究发现,多糖的抗氧化性不仅与其单糖组成和分子质量有关,还与糖苷键类型和连接方式密切相关。MIRZADEH等[17]研究发现一些多糖的生物活性与其是否含有某些化学基团密切关系,而这些化学基团可通过人为化学反应来添加或消除。因此,分析多糖的基团结构已成为提高多糖活性和多糖构效关系的有力手段。
C变形吸收峰,1 420~1 360 cm-1内的吸收峰为C—H变角振动吸收峰,1 062 cm-1处吸收峰由C—O伸缩振动引起[9-10]。核磁共振结果显示(图3-b),4.701 ppm左右对应的峰为D2O,3.620~3.653 ppm对应的峰可能为CH2,3.747~3.776 ppm对应的峰可能为二氧杂环或CH2O,3.987~4.047 ppm对应的峰可能为CH,4.2 ppm 左右对应的CH2可能包在D2O峰当中而未显示。LO等[16]研究发现,多糖的抗氧化性不仅与其单糖组成和分子质量有关,还与糖苷键类型和连接方式密切相关。MIRZADEH等[17]研究发现一些多糖的生物活性与其是否含有某些化学基团密切关系,而这些化学基团可通过人为化学反应来添加或消除。因此,分析多糖的基团结构已成为提高多糖活性和多糖构效关系的有力手段。

a-红外光谱;b-1H NMR谱
图3 球毛壳菌CGMCC 6882胞外多糖红外光谱和1H NMR谱结果
Fig.3 Fourier transform infraved spectroscopy and 1H NMR results of polysaccharide produced by C.globosum CGMCC 6882
CGMCC 6882胞外多糖在水溶液中形成米粒状小颗粒,而非网状或交联状,说明这一胞外多糖的分子质量可能较小。SHEN等[18]在研究Nostoc flagelliforme多糖的理化特性和抗氧化活性时发现,多糖的空间结构也会影响其生物活性,尤其是抗氧化活性。热重分析结果显示(图4),CGMCC 6882胞外多糖在整个加热过程中有2个降解阶段,第1个降解阶段出现在100 ℃左右,主要是由于多糖结合水受热挥发导致质量减少,第2个降解阶段开始于200 ℃左右,主要是由于多糖主链及氢键断裂,生成CO2和水导致的失重降解[19]。
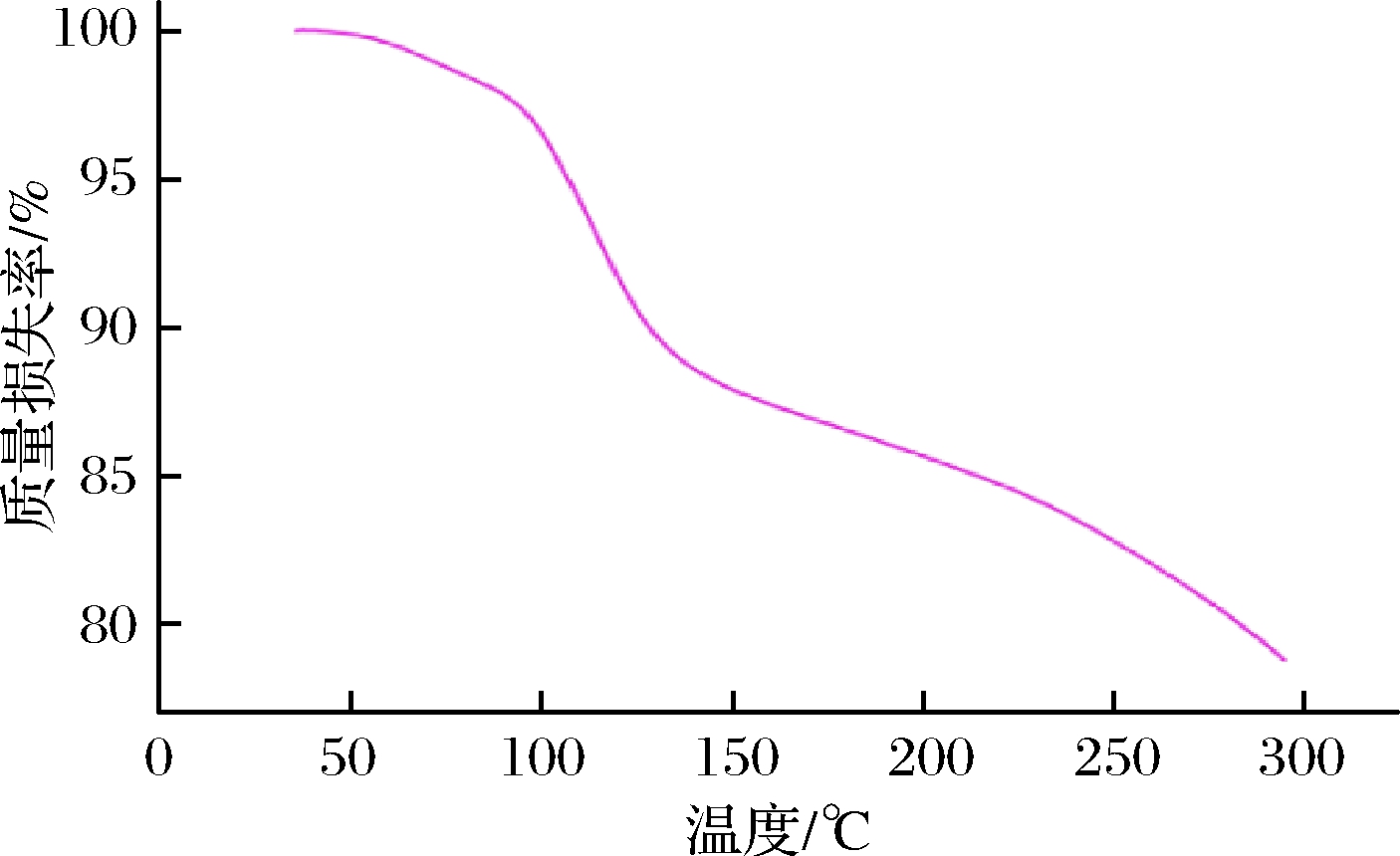
图4 球毛壳菌CGMCC 6882胞外多糖的热重分析结果
Fig.4 Thermogravimetric analysis results of polysaccharide produced by C. globosum CGMCC 6882
2.3 多糖的体外抗氧化活性
球毛壳菌CGMCC 6882胞外多糖可以有效清除DPPH自由基、羟自由基、超氧阴离子和ABTS阳离子自由基,且清除率与多糖浓度成正相关 (图5)。当多糖质量浓度为5 mg/mL时,对上述自由基的清除率分别为(83.08±2.58)%、(81.39±1.47)%、(79.38±2.03)%和(85.69±1.62)%。大量实验证明自由基会干扰机体正常的新陈代谢,引起DNA、蛋白质、脂类等生物大分子的氧化损伤,进而诱发心血管疾病、糖尿病等多种疾病[20]。王浩南等[21]发现丹参花多糖不仅具有较强抗氧化活性,同时还具有保护神经细胞、抑制黑色素生成和保肝等作用。球毛壳菌CGMCC 6882胞外多糖可以有效清除体内自由基,有延缓衰老和保护机体的作用,有望在食品和医药等领域得到应用。
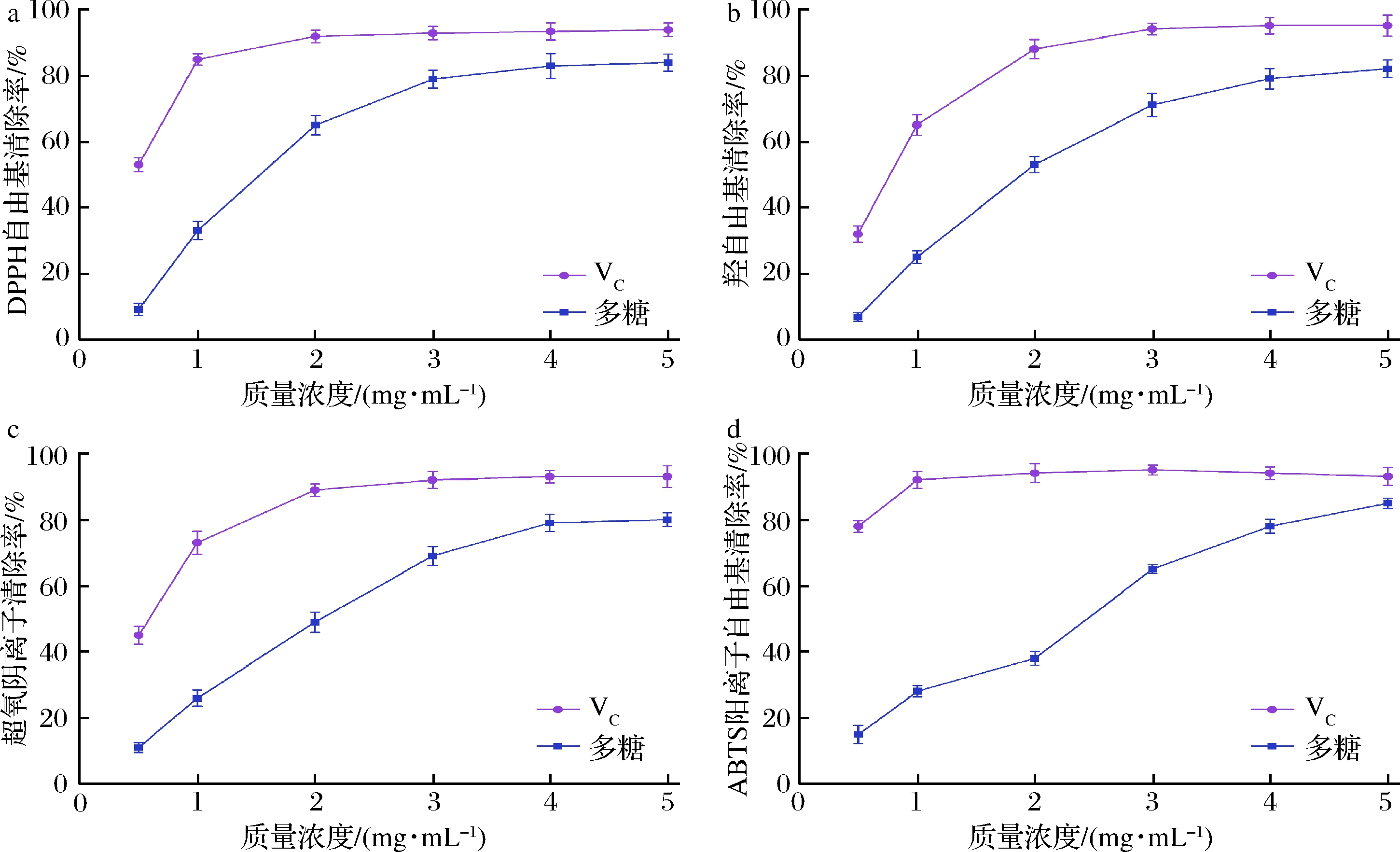
a-DPPH自由基;b-羟自由基;c-超氧阴离子;d-ABTS阳离子自由基
图5 球毛壳菌CGMCC 6882胞外多糖的抗氧化能力
Fig.5 Antioxidant capacity of polysaccharide produced by C.globosum CGMCC 6882
2.4 多糖的细胞抗氧化
当H2O2浓度增加到400 μmol/L时,细胞活性下降到(51.2±1.5)%,适于构建细胞氧化损伤模型 (图6)。因此,选择400 μmol/L的H2O2诱导构建Caco-2细胞氧化损伤模型。细胞抗氧化模型分析发现(图7),H2O2组MDA活力显著升高,SOD、CAT和GSH-Px活力均显著下降,说明H2O2对Caco-2细胞造成了氧化损伤。多糖实验组中MDA酶活水平从(15.8±0.25) μmol/g降低至(7.5±0.31) μmol/g,且MDA酶活水平与球毛壳菌CGMCC 6882胞外多糖浓度成负相关。同时,多糖实验组细胞内的SOD、CAT和GSH-Px活力水平明显升高,分别从(147.28±4.82)、(11±1.15)和(18.08±1.96) U/mg增加至(238.89±3.91)、(39.12±0.76)和(41.35±2.18) U/mg,且与球毛壳菌CGMCC 6882胞外多糖浓度成正相关。上述结果表明,球毛壳菌CGMCC 6882胞外多糖对被H2O2氧化损伤的Caco-2细胞有很好的保护作用[22]。同时,吴丽红等[23]研究发现,川牛膝多糖对H2O2诱导的PC12细胞氧化损伤具有一定保护作用;顾程远等[24]研究也证实,桔梗多糖对H2O2诱导的PC12细胞氧化损伤也有一定保护作用。这些实验中的多糖与本实验所获得的球毛壳菌CGMCC 6882胞外多糖具有相似的抗氧化作用。
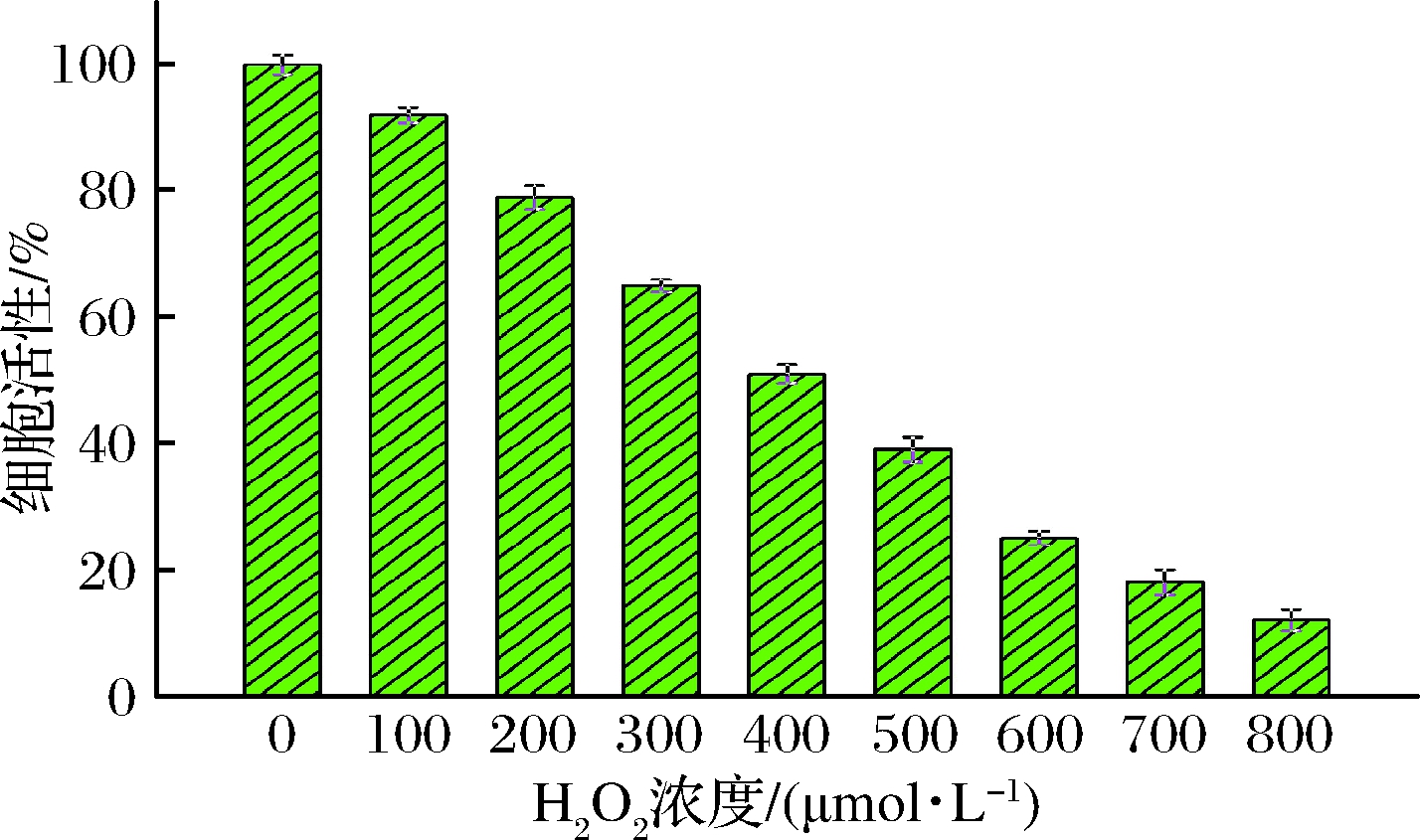
图6 不同浓度H2O2对细胞存活率的影响
Fig.6 Effect of different concentrations H2O2 on the cell viability of Caco-2 cells

图7 球毛壳菌CGMCC 6882胞外多糖对Caco-2胞内SOD、CAT、GSH-Px和MDA活力的影响
Fig.7 Effect of polysaccharide produced by C.globosum CGMCC 6882 on the SOD, CAT, GSH-Px, and MDA activities in Caco-2 cells
3 结论
小麦秸秆的随意丢弃和堆放,不仅造成资源浪费,还带来很多安全隐患和环境污染等问题。本实验以小麦秸秆为唯一碳源,采用球毛壳菌CGMCC 6882进行发酵获得了一种具有良好抗氧化性的胞外多糖。在未来的研究中,我们将采用代谢途径分子改造、小麦秸秆预处理和发酵工艺优化等策略,实现球毛壳菌CGMCC 6882利用小麦秸秆工业化生产活性胞外多糖。
[1] 高利伟, 马林, 张卫峰, 等.中国作物秸秆养分资源数量估算及其利用状况[J].农业工程学报, 2009(7):173-179.
GAO L W, MA L, ZHANG W F, et al.Estimation of nutrient resource quantity of crop straw and its utilization situation in China[J].Transactions of the Chinese Society of Agricultural Engineering, 2009(7):173-179.
[2] LIU T, ZHOU X Q, LI Z F, et al.Effects of liquid digestate pretreatment on biogas production for anaerobic digestion of wheat straw[J].Bioresource Technology, 2019, 280:345-351.
[3] ISLAM S M M, ELLIOTT J R, JU L K.Minimization of fermentation inhibitor generation by carbon dioxide-water based pretreatment and enzyme hydrolysis of guayule biomass[J].Bioresource Technology, 2018, 251:84-92.
[4] 陈凤, 赵万岭, 王星仪, 等.苯酚-硫酸法测定明日叶根中多糖含量[J].化工管理, 2019(26):11-13.
CHEN F, ZHAO W L, WANG X Y, et al.Determination of polysaccharide content in Angelica keiskei root by phenol sulfuric acid method[J].Chemical Enterprise Management, 2019(26):11-13.
[5] HU X L, WANG K L, YU M, et al.Characterization and antioxidant activity of a low molecular weight xanthan gum[J].Biomolecules, 2019, 9(11):730.
[6] 郭增旺, 樊乃境, 田海芝, 等.小米糠黄酮对H2O2致HepG2氧化应激损伤的保护作用[J].食品科学, 2020, 41(5):159-165.
GUO Z W, FAN N J, TIAN H Z, et al.Protective effects of flavonoids from millet bran on H2O2-induced oxidative stress injury in HepG2 cells[J].Food Science, 2020, 41(5):159-165.
[7] XIANG Y L, XU X L, LI J.Chemical properties and antioxidant activity of exopolysaccharides fractions from mycelial culture of Inonotus obliquus in a ground corn stover medium[J].Food Chemistry, 2012, 134(4):1 899-1 905.
[8] XU X Q, HU Y, QUAN L L.Production of bioactive polysaccharides by Inonotus obliquus under submerged fermentation supplemented with lignocellulosic biomass and their antioxidant activity[J].Bioprocess and Biosystems Engineering, 2014, 37(12):2 483-2 492.
[9] LIU X C, PANG H, GAO Z, et al.Antioxidant and hepatoprotective activities of residue polysaccharides by Pleurotus citrinipileatus[J].International Journal of Biological Macromolecules, 2019, 131:315-322.
[10] SONG X L, SHEN Q, LIU M, et al.Antioxidant and hepatoprotective effects of intracellular mycelium polysaccharides from Pleurotus geesteranus against alcoholic liver diseases[J].International Journal of Biological Macromolecules, 2018, 114:979-988.
[11] LI B, ZHANG N, WANG D X, et al.Structural analysis and antioxidant activities of neutral polysaccharide isolated from Epimedium koreanum Nakai[J].Carbohydrate Polymers, 2018, 196:246-253.
[12] 景永帅, 张钰炜, 李佳瑛, 等.硒多糖的合成方法、结构特征和生物活性研究进展[J/OL].食品工业科技,2021.DOI:10.13386/j.issn1002-0306.2020050188.
JING Y S, ZHANG Y W, LI J Y, et al.Progress of synthesis methods, structural characteristics and biological activities of selenium polysaccharides[J/OL].Science and Technology of Food Industry, 2021.DOI:10.13386/j.issn1002-0306.2020050188.
[13] BLASCHEK W, K SBAUER J, KRAUS J, et al.Pythium aphanidermatum:Culture, cell-wall composition, and isolation and structure of antitumour storage and solubilised cell-wall (1→3),(1→6)-β-D-glucans[J].Carbohydrate Research, 1992, 231:293-307.
SBAUER J, KRAUS J, et al.Pythium aphanidermatum:Culture, cell-wall composition, and isolation and structure of antitumour storage and solubilised cell-wall (1→3),(1→6)-β-D-glucans[J].Carbohydrate Research, 1992, 231:293-307.
[14] ZHANG M, ZHANG L N, CHEUNG P C K, et al.Molecular weight and anti-tumor activity of the water-soluble polysaccharides isolated by hot water and ultrasonic treatment from the sclerotia and mycelia of Pleurotus tuber-regium[J].Carbohydrate Polymers, 2004, 56(2):123-128.
[15] WANG Z C, CHEN P Z, NING T, et al.Anticancer activity of polysaccharides produced from glycerol and crude glycerol by an endophytic fungus Chaetomium globosum CGMCC 6882 on human lung cancer A549 cells[J].Biomolecules, 2018, 8(4):171.
[16] LO T C T, CHANG C A, CHIU K H, et al.Correlation evaluation of antioxidant properties on the monosaccharide components and glycosyl linkages of polysaccharide with different measuring methods[J].Carbohydrate Polymers, 2011, 86(1):320-327.
[17] MIRZADEH M, ARIANEJAD M R, KHEDMAT L.Antioxidant, antiradical, and antimicrobial activities of polysaccharides obtained by microwave-assisted extraction method:A review[J].Carbohydrate Polymers, 2020, 229:115 421.
[18] SHEN S G, JIA S R, WU Y K, et al.Effect of culture conditions on the physicochemical properties and antioxidant activities of polysaccharides from Nostoc flagelliforme[J].Carbohydrate Polymers, 2018, 198:426-433.
[19] NAWROCKA A, ![]() A, et al.Effect of dietary fibre polysaccharides on structure and thermal properties of gluten proteins-A study on gluten dough with application of FT-Raman spectroscopy, TGA and DSC[J].Food Hydrocolloids, 2017, 69:410-421.
A, et al.Effect of dietary fibre polysaccharides on structure and thermal properties of gluten proteins-A study on gluten dough with application of FT-Raman spectroscopy, TGA and DSC[J].Food Hydrocolloids, 2017, 69:410-421.
[20] JEONG H K, LEE D, KIM H P, et al.Structure analysis and antioxidant activities of an amylopectin-type polysaccharide isolated from dried fruits of Terminalia chebula[J].Carbohydrate Polymers, 2019, 211:100-108.
[21] 王浩南, 吴雨蒙, 张永清, 等. 丹参花与根部多糖抗氧化活性及其组成研究[J]. 辽宁中医药大学学报, 2020, 22(11):38-43.
WANG H N, WU Y M, ZHANG Y Q, et al. Analysis of monosaccharide composition and antioxidant activity of Salvia miltiorrhiza and Salvia miltiorrhiza polysaccharides[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2020, 22(11): 38-43.
[22] 张佳婵, 王昌涛, 易思雨, 等.沙棘粕提取物对H2O2诱导的B16F10细胞氧化损伤的保护及修复[J].中国食品学报, 2019, 19(8):13-21.
ZHANG J C,WANG C T,YI S Y,et al.Protective and prothetic effects of Sea buckthorn seed extracts on H2O2-induced oxidative damage of B16F10[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(8):13-21.
[23] 吴丽红, 怀雪, 马智超, 等.川牛膝多糖对H2O2诱导PC12细胞氧化损伤保护作用的研究[J].化学工程师, 2019, 33(2):68-70;49.
WU L H, HUAI X, MA Z C, et al.Protection of polysaccharids from Cyathula officinalis Kuan on PC12 cells injury induced by H2O2[J].Chemical Engineer, 2019,33(2):68-70;49.
[24] 顾程远, 陈秋利, 李海涛.桔梗多糖对H2O2诱导PC12细胞氧化损伤的保护作用及机制研究[J].南京中医药大学学报, 2017, 33(3):268-272.
GU C Y, CHEN Q L, LI H T.Protective effects and mechanism of polysaccharide from Platycodon Grandiflorum on damage of PC12 cells induced by H2O2[J].Journal of Nanjing University of Traditional Chinese Medicine, 2017, 33(3):268-272.