羊肚菌(Morchella spp.)俗称羊肚菜,为马鞍菌科属珍稀的食药两用真菌[1]。羊肚菌含有优质蛋白质、多糖、多酚、铁、钾、磷、硒等营养元素,羊肚菌风味独特、味道鲜美、肉质脆嫩可口,营养丰富[2-3]。已有研究表明,羊肚菌或其提取物具有降血脂、抗肿瘤、抗氧化等生物活性[4-7]。目前,对羊肚菌的研究主要集中在人工种植栽培条件的筛选[8]、多糖的提取及纯化[9-10]、发酵产物功能性研究[11]及硒化修饰[12]等方面。
气相色谱-离子迁移谱(gas chromatography-ion mobility spectrum,GC-IMS)是近年来出现的一种新型气相分离和检测技术,该项技术整合了GC、IMS在分离和检测方面的优势,形成具有高灵敏度、高分辨率、操作简便、分析高效等特点的方法,特别适合于部分挥发性有机化合物的痕量检测。目前,国内外将GC-IMS用于食品检测分析的研究日益增多[13],如应用于菌类及菌汤风味成分分析[14-15]、植物油鉴别及掺假检测[16]、酒类发酵过程中风味的变化[17]、蛋类新鲜度鉴别[18]、调味品风味物质的检测分析[19]、果蔬在贮藏过程中风味化合物的分析检测[20]等。
目前,利用GC-IMS检测技术对羊肚菌风味成分进行分析的报道较少。本文以长白山、林芝、青川、香格里拉4个产地羊肚菌为研究对象,在研究其蛋白质、粗多糖及总酚含量的基础上,利用氨基酸自动分析仪检测样品的游离氨基酸种类及含量,进而再利用GC-IMS检测样品的挥发性有机物(volatile organic compounds,VOCs)。通过主成分分析(principal component analysis,PCA)、热图聚类分析对VOCs进行化学计量学分析,对比分析了不同产地羊肚菌的营养和风味成分的差异,为羊肚菌资源的开发利用提供理论支撑。
1 材料与方法
1.1 材料与试剂
羊肚菌:吉林长白山、西藏林芝、四川青川、云南香格里拉羊肚菌原料产地。
没食子酸、80%(体积分数)乙醇、碳酸钠、硫酸铜、硫酸钾、硫酸、氢氧化钠、对硝基苯酚、乙酸钠、乙酸、37%甲醛、乙酰丙酮、无水乙醇、苯酚、葡萄糖,成都市科隆化学品有限公司;福林酚,上海康朗生物科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
L-8800型日立全自动氨基酸分析仪,日本日立公司;FlavorSpec®食品风味分析仪(含CTC自动顶空进样器、Laboratory Analytical Viewer(LAV)分析软件、GC×IMS Library Search 软件及软件内置的NIST数据库和IMS数据库对物质进行定性分析),德国G.A.S公司。
1.3 试验方法
1.3.1 样品准备
分别将各羊肚菌样品清洁干净,取菌盖干品粉碎成菌粉后,密封,编号(长白山产羊肚菌样品标记为CBS;林芝产样品标记为LZ;青川产样品标记为QC;香格里拉产样品标记为XGLL),待测。
1.3.2 理化指标检测
蛋白质含量的测定:分光光度法,参照GB 5009.5—2016《食品中蛋白质的测定》,平行测定3次。
粗多糖含量的测定:参照NY/T 1676—2008《食用菌中粗多糖含量的测定》,平行测定3次。
总酚含量的测定:根据参考文献[21]所述方法进行测定,平行测定3次。
1.3.3 游离氨基酸含量测定
参照GB/T 5009.124—2016《食品中氨基酸的测定》进行测定。平行测定2次。
1.3.4 VOCs的测定
取1 g羊肚菌样品于20 ml顶空进样瓶中,80 ℃孵化20 min,经顶空进样用气相离子迁移谱仪FlavorSpec®进行测试。平行测定3次,各样品盲测1次。
1.3.4.1 自动进样器条件
孵化温度:80 ℃;孵化时间:20 min;进样方式:顶空进样;进样体积:500 μL;进样针温度:85 ℃;加热方式:振荡加热;振荡速度:500 r/min;不分流;清洗时间:5 min。
1.3.4.2 GC条件
色谱柱:FS-SE-54-CB-1;石英毛细管柱(15 m×0.53 mm,0.5 μm);色谱柱温度:40 ℃;载气:N2(纯度≥99.999%);载气流速:初始流速0~2 min,2 mL/min;2~10 min,2~20 mL/min;10~20 min,20~100 mL/min;20~30 min,100~150 mL/min;分析时间:30 min。
1.3.4.3 IMS检测条件
漂移管长度:98 mm;管内线性电压:500 V/cm;漂移管温度:45 ℃;漂移气:N2(纯度≥99.999%);漂移气流量:150 mL/min;放射源:β射线(氚,3H);离子化模式:正离子。
1.3.5 数据处理
利用FlavorSpec®配备的Laboratory Analytical Viewer(LAV)分析软件及GC×IMS Library Search定性软件对羊肚菌样品的VOCs 进行采集和分析;利用软件内置的NIST数据库和IMS数据库对物质进行定性分析;
化合物RI值计算方法:通过测试已知保留指数标品(2-丁酮、2-戊酮、2-己酮、2-庚酮、2-辛酮、2-壬酮)的保留时间,经FlavorSpec®自带的GC×IMS Library Search软件拟合出保留时间与保留指数RI的关系,再将羊肚菌GC-IMS捕捉到的VOCs的保留时间转化为保留指数RI。
用Excel、R语言和Origin软件对数据进行统计和绘图,以![]() 或
或![]() 表示结果,采用SPSS 22对样品间差异采用ANOVA检验分析,利用Duncan方法进行显著性差异(P<0.05)分析。
表示结果,采用SPSS 22对样品间差异采用ANOVA检验分析,利用Duncan方法进行显著性差异(P<0.05)分析。
2 结果与分析
2.1 理化指标
羊肚菌中的多种营养成分具有良好的生物活性。蛋白具有脂氧合酶和葡聚糖裂解酶活性及抑制血小板聚集等作用[22],多糖具有保肝、降血脂、增强免疫力、抗肿瘤抗氧化等生物活性[9-10]。植物多酚分子结构中的酚羟基基团可与体内的自由基结合,从而消耗自由基,因而植物多酚具有抗氧化、抗癌[23]等生物活性。由表1可知,林芝产羊肚菌蛋白质含量最高,达(32.61±0.04) g/100g,与其他3个产地的含量均有显著差异(P<0.05);4个不同产地样品中的粗多糖含量差异显著(P<0.05),林芝最高;林芝和香格里拉样品总酚含量相当,与长白山和青川有显著差异(P<0.05)。总体来说,林芝产羊肚菌的蛋白质、粗多糖、总酚含量均较高,这可能与不同地区的海拔、气候、光照、水分等种植条件的差异性有关。因此,在选择加工原材料时,可根据产品对营养成分的需求来选择适宜的产地。具体产地因素对羊肚菌基本营养成分的影响尚不明确,还需进一步扩大样品数量,丰富产地类型,对产地的光照条件、气候条件、土壤质地、栽培方式等因素做进一步研究。
表1 羊肚菌样品的蛋白质、粗多糖、总酚含量
Table 1 The contents of protein, crude polysaccharide and total phenol in Morchella spp.samples
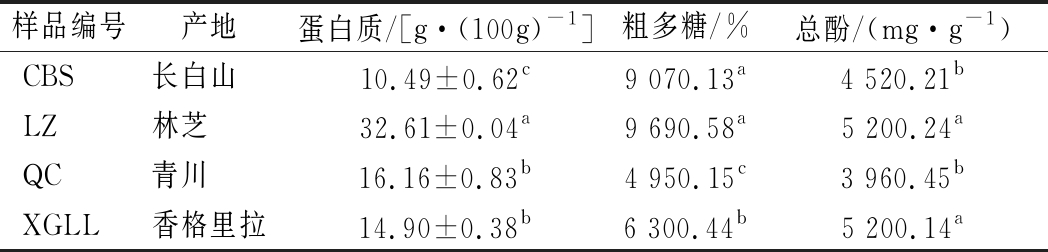
样品编号产地蛋白质/[g·(100g)-1]粗多糖/%总酚/(mg·g-1)CBS长白山 10.49±0.62c9 070.13a4 520.21bLZ林芝 32.61±0.04a9 690.58a5 200.24aQC青川 16.16±0.83b4 950.15c3 960.45bXGLL香格里拉14.90±0.38b6 300.44b5 200.14a
注:不同字母表示不同样品间差异极显著(P<0.05)
2.2 游离氨基酸
食用菌的滋味是由各种不同呈味的游离氨基酸的平衡及相互影响共同决定的,对其风味具有重要作用。氨基酸是羊肚菌特征风味化合物之一,4种羊肚菌样品的菌丝体中均富含氨基酸,其中总氨基酸和人体必需氨基酸的含量均较高,接近FAO/WHO推荐模式[24-25]。由表2可知,从4个产地的羊肚菌样品中均检测出17种氨基酸,包含7种必需氨基酸。各个含量指标中,长白山样品的最高,除半胱氨酸和脯氨酸外,4个产地的样品各指标呈显著性差异(P<0.05)。谷氨酸、丙氨酸、精氨酸分别是鲜味、甜味、苦味氨基酸中含量最高的氨基酸。在必需氨基酸中,含量较高的为蛋氨酸、赖氨酸和亮氨酸,且4个产地呈显著性差异(P<0.05)。在游离氨基酸中,谷氨酸含量最高,该结果与熊丙全等[26]的研究结果一致,4种样品呈显著性差异(P<0.05),其中长白山样品中的含量最高,为41.013 mg/g。此外,4种样品的鲜味、甜味、苦味氨基酸总量差别较大,含量分别为49.397~65.291、54.409~64.741、103.312~127.917 mg/g,呈显著性差异(P<0.05)。谷氨酸、天冬氨酸均可提供鲜味,且在4个产地的羊肚菌中含量均较高,这是羊肚菌具有特殊鲜味的主要成因之一。本实验中,各样品中的氨基酸含量差异较大,这可能与不同产地的土壤质地、光照、气候和培育方式有关。
表2 不同产地羊肚菌的氨基酸含量检测
Table 2 Determination of content of amino acids in Morchella spp.samples from different habitats
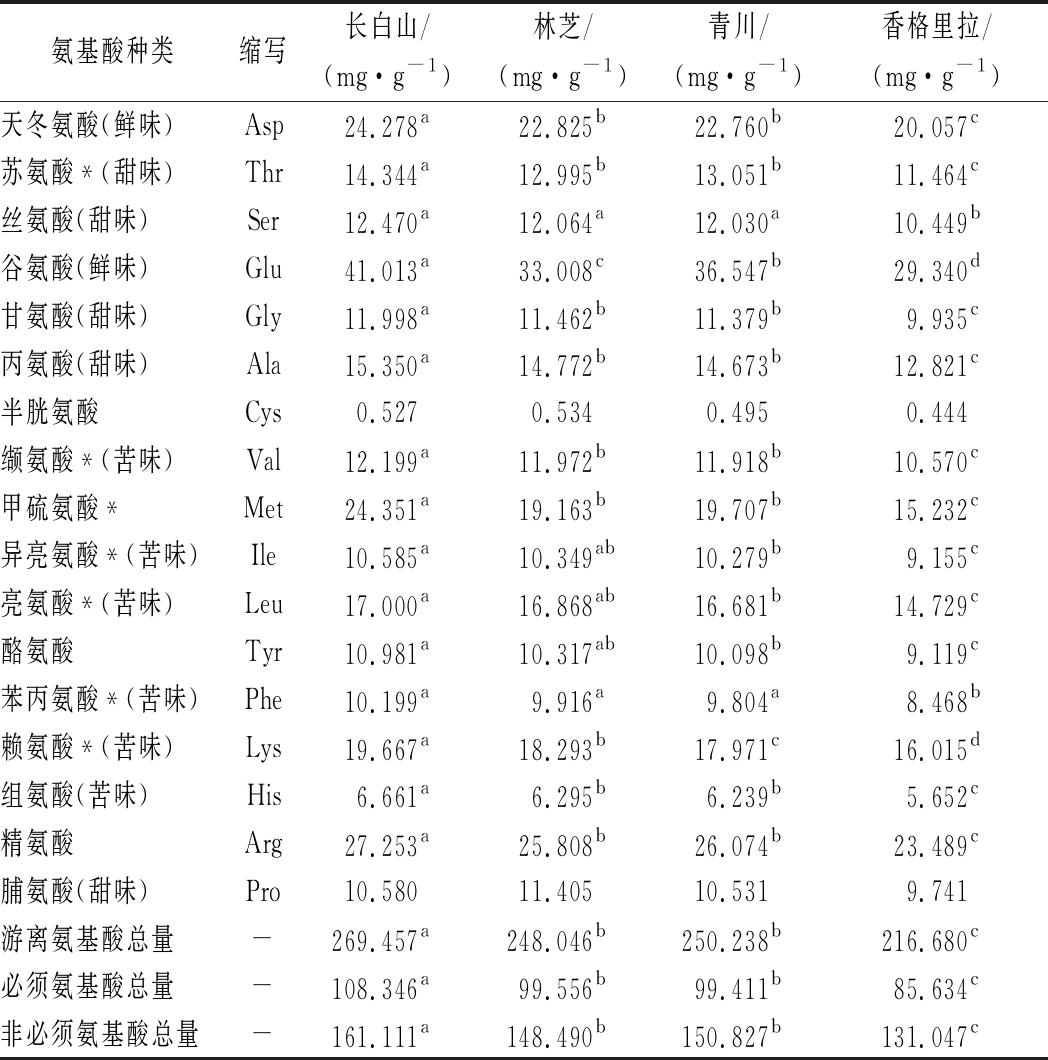
氨基酸种类缩写长白山/(mg·g-1)林芝/(mg·g-1)青川/(mg·g-1)香格里拉/(mg·g-1)天冬氨酸(鲜味)Asp24.278a22.825b22.760b20.057c苏氨酸*(甜味)Thr14.344a12.995b13.051b11.464c丝氨酸(甜味)Ser12.470a12.064a12.030a10.449b谷氨酸(鲜味)Glu41.013a33.008c36.547b29.340d甘氨酸(甜味)Gly11.998a11.462b11.379b9.935c丙氨酸(甜味)Ala15.350a14.772b14.673b12.821c半胱氨酸Cys0.5270.5340.4950.444缬氨酸*(苦味)Val12.199a11.972b11.918b10.570c甲硫氨酸*Met24.351a19.163b19.707b15.232c异亮氨酸*(苦味)Ile10.585a10.349ab10.279b9.155c亮氨酸*(苦味)Leu17.000a16.868ab16.681b14.729c酪氨酸Tyr10.981a10.317ab10.098b9.119c苯丙氨酸*(苦味)Phe10.199a9.916a9.804a8.468b赖氨酸*(苦味)Lys19.667a18.293b17.971c16.015d组氨酸(苦味)His6.661a6.295b6.239b5.652c精氨酸Arg27.253a25.808b26.074b23.489c脯氨酸(甜味)Pro10.58011.40510.5319.741游离氨基酸总量-269.457a248.046b250.238b216.680c必须氨基酸总量-108.346a99.556b99.411b85.634c非必须氨基酸总量-161.111a148.490b150.827b131.047c
注:*表示必需氨基酸,不同字母表示不同样品间差异显著(P<0.05)
2.3 GC-IMS数据分析
2.3.1 羊肚菌的GC-IMS分析
图1是羊肚菌样品GC-IMS谱图中VOCs的指纹图谱。Y轴为羊肚菌样品编号(每1行为1个羊肚菌样品的指纹图,每种羊肚菌样品平行测定3次),X轴为VOCs的编号。图中点的颜色深浅和点的面积表示VOCs含量大小,颜色越深、面积越大则含量越高[27],白色点的VOCs含量较低,而红色点则含量较高。如图1所示,平行测定的羊肚菌样品含有共有VOCs,仅区别于浓度大小,样品组内具有明显的相似性,样品组间则呈现出明显的差异性。林芝产羊肚菌样品的VOCs的种类和含量均高于其他3个产地的样品,因此,林芝产羊肚菌的风味最为独特;香格里拉产羊肚菌的VOCs种类最少。这可能与不同地区的光照、海拔、气候、土壤质地以及水分等种植的条件以及栽培方式有关。
由图1可知,4种样品中共检测出84种VOCs,通过与FlavorSpec®内置的NIST 2014气相保留指数数据库和G.A.S的IMS迁移时间数据库进行二维定性,确定了23种VOCs(表3)。结合图1和表3可知,A框区域(1~33号VOCs)为羊肚菌样品的共有区域峰,主要包括:2-苯乙醇、壬醇、苯乙醛、2-乙基己醇、辛醛、庚醇、甲硫基丙醛、己醛、丁酸、丁酸乙酯、1-己醇;B框区域(34~36,65~83号VOCs)为林芝产羊肚菌样品(LZ)的特征峰区域,主要包括:γ-丁内酯、2-丁酮、异丁醇、1-戊醇、戊醛、3-甲基-1-丁醇、3-甲基丁醛;C框区域(37~41号VOCs)为香格里拉产羊肚菌样品的特征峰区域;D框区域(43~48号VOCs)为长白山产羊肚菌样品的特征风味区域;E框区域(49~61号VOCs)是长白山产羊肚菌样品和青川产羊肚菌样品共有的特征峰区域,主要包括:乙酸乙酯、3-甲基丁酸、2-甲基丁酸乙酯、丁醛。未鉴定出的61种VOCs待进一步研究。
表3 不同产地羊肚菌VOCs
Table 3 The VOCs of Morchella spp.samples from different habitats
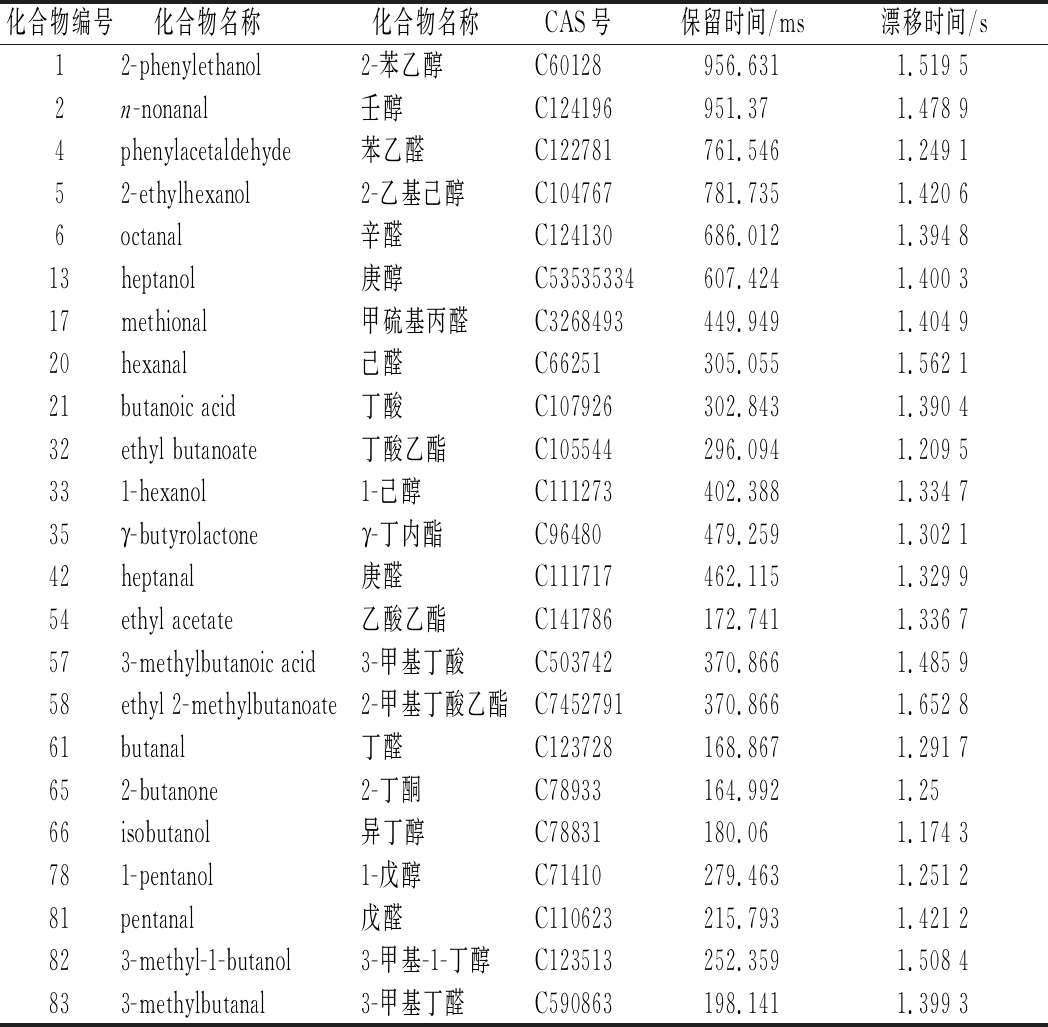
化合物编号化合物名称 化合物名称 CAS号 保留时间/ms漂移时间/s12-phenylethanol2-苯乙醇C60128956.6311.519 52n-nonanal壬醇C124196951.371.478 94phenylacetaldehyde苯乙醛C122781761.5461.249 152-ethylhexanol2-乙基己醇C104767781.7351.420 66octanal辛醛C124130686.0121.394 813heptanol庚醇C53535334607.4241.400 317methional甲硫基丙醛C3268493449.9491.404 920hexanal己醛C66251305.0551.562 121butanoic acid丁酸C107926302.8431.390 432ethyl butanoate丁酸乙酯C105544296.0941.209 5331-hexanol1-己醇C111273402.3881.334 735γ-butyrolactoneγ-丁内酯C96480479.2591.302 142heptanal庚醛C111717462.1151.329 954ethyl acetate乙酸乙酯C141786172.7411.336 7573-methylbutanoic acid3-甲基丁酸C503742370.8661.485 958ethyl 2-methylbutanoate2-甲基丁酸乙酯C7452791370.8661.652 861butanal丁醛C123728168.8671.291 7652-butanone2-丁酮C78933164.9921.2566isobutanol异丁醇C78831180.061.174 3781-pentanol1-戊醇C71410279.4631.251 281pentanal戊醛C110623215.7931.421 2823-methyl-1-butanol3-甲基-1-丁醇C123513252.3591.508 4833-methylbutanal3-甲基丁醛C590863198.1411.399 3

图1 不同产地羊肚菌的HS-GC-IMS的指纹谱图
Fig.1 Fingerprint of HS-GC-IMS of Morchella spp.samples from different habitats
2.3.2 不同产地羊肚菌的PCA
将不同产地羊肚菌样品所有的VOCs进行PCA,结果如图2所示。PC_1[43%]与PC_2[33%]之和为76%,说明降维时保留了VOCs的主要有效信息。4种羊肚菌样品各自成组,而盲样(图中4个黑点)也落在相应的组别中,说明通过检测羊肚菌样品的VOCs,进行主成分分析,对羊肚菌产地的区分是可行的。PC_1[43%]可将长白山、林芝样品与青川和香格里拉样品进行区分;而长白山、青川和香格里拉3个产地的样品的PC_2接近;青川和香格里拉样品PC_1与PC_2均相近,2种样品的风味相似,但各自成组。林芝产羊肚菌样品PC_1和PC_2与其他3个样品差异较大,说明林芝产羊肚菌的挥发性风味独特,可能为林芝海拔较高,其特殊环境导致其特殊风味的形成。长白山产羊肚菌样品的PC_1与其余3个产地样品差异较大,可能是长白山纬度比其余3个产地更偏北,其严寒气候条件导致羊肚菌特殊风味的形成,但要阐明产地因素对羊肚菌挥发性风味物质种类和含量的具体影响,还需扩大样品量做进一步的研究。
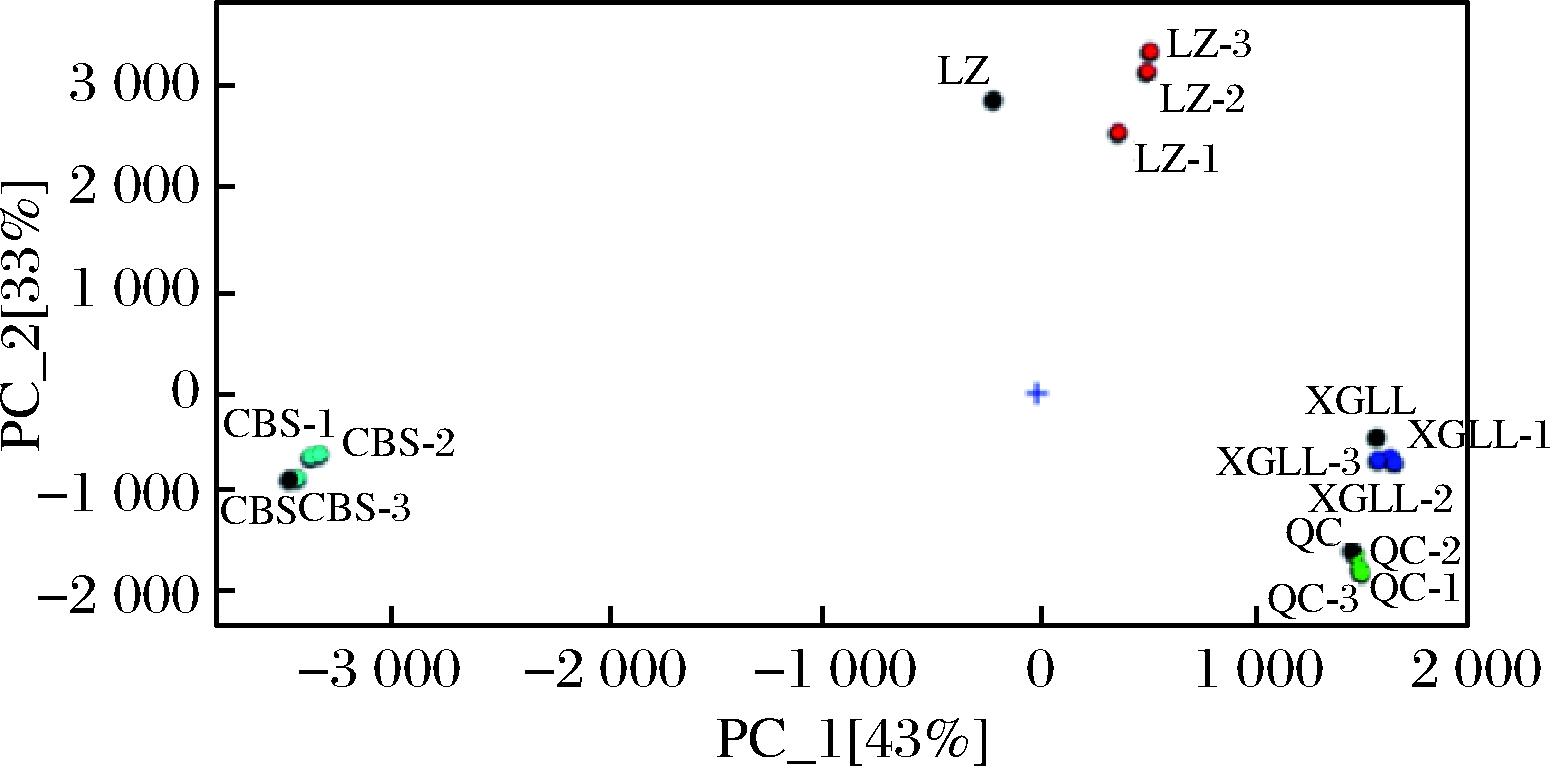
图2 不同产地羊肚菌样品的主成分分析
Fig.2 The principal component analysis of Morchella spp.samples from different habitats
注:图中黑点表示盲测样品
2.3.3 热图聚类分析
对不同产地羊肚菌样品的VOCs进行热图聚类分析,结果如图3所示。Y轴为已鉴定的各VOCs的编号,X轴为各产地羊肚菌样品编号。由热图聚类分析结果可知,林芝产羊肚菌样品的VOCs最为特别,单独一组,其次是长白山样品再分组。由此可知,产地的高海拔和严寒气候对羊肚菌样品风味的形成有影响,青川和香格里拉样品风味相似。热图聚类分析的结果与PCA结果一致。
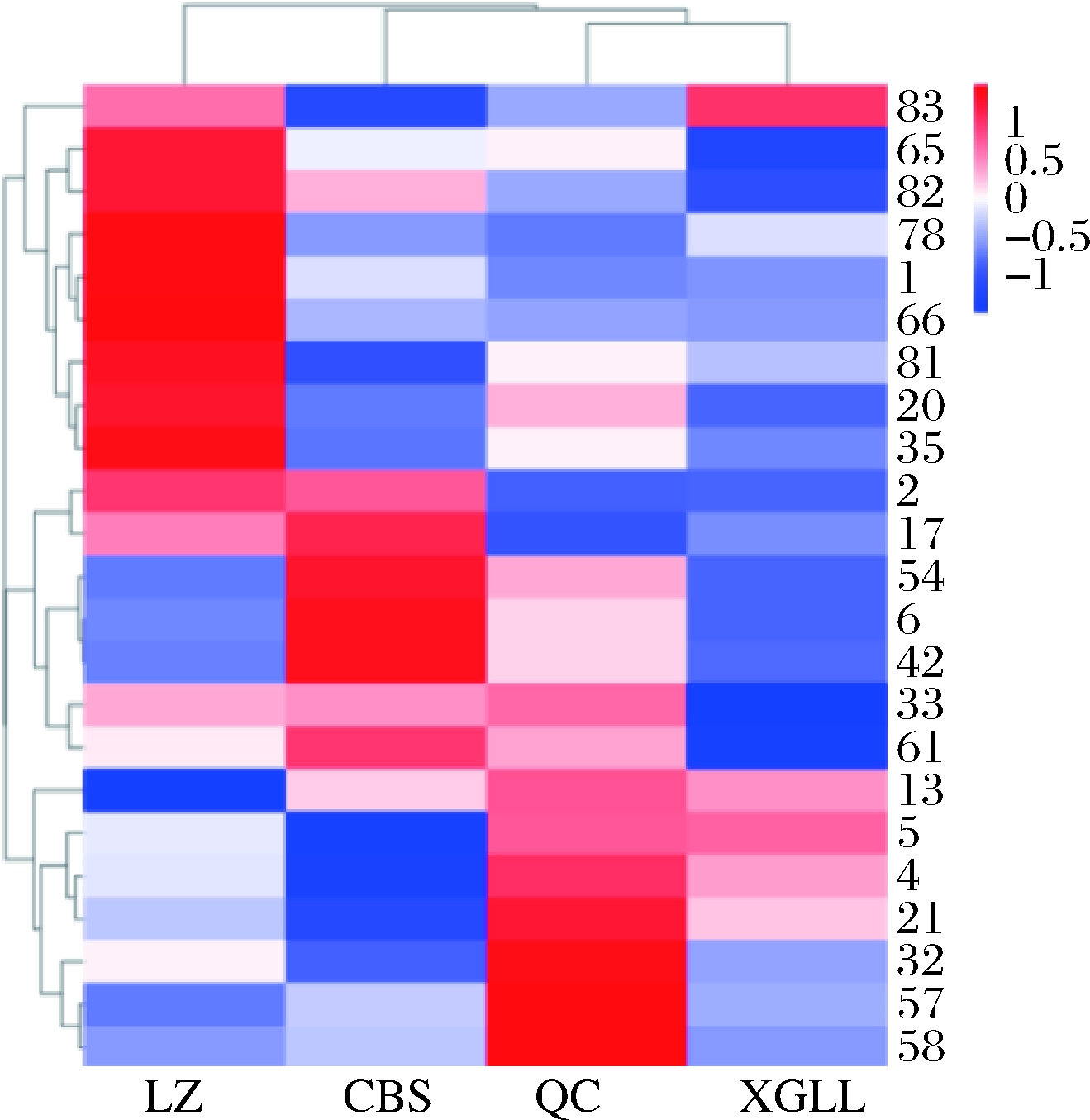
图3 不同产地羊肚菌样品的热图聚类分析
Fig.3 The heat map cluster analysis of Morchella spp.
samples from different habitats
2.3.4 不同产地羊肚菌的VOCs变化分析
已定性的23种VOCs的名称、CAS号、保留时间、漂移时间如表3所示。醇类化合物主要来源于醛类的还原[28]和脂肪氧化[29],直链饱和醇阈值普遍较高,对风味贡献不大,包括:壬醇、庚醇等。醛类化合物主要来源于脂肪氧化,氨基酸反应亦是重要来源,且醛类阈值很低[29],对羊肚菌的风味贡献较大。检出的醛类共有8种,包括:苯乙醛、辛醛、甲硫基丙醛、己醛、庚醛、丁醛、戊醛、3-甲基丁醛。其中,己醛具有叶香、果香,3-甲基丁醛稀释后具有愉快的水果香气[30],主要存在于LZ中,醛类化合物是羊肚菌风味的重要组成部分。脂质氧化降解的另一类产物为酮[29],羊肚菌样品中鉴定出具有果香味的2-丁酮,主要存在于LZ中。脂肪酸与醇类化合物的酯化反应产生酯类化合物,酯类化合物一般呈现香甜果味[29]。已定性的4种酯分别是:丁酸乙酯、γ-丁内酯、乙酸乙酯、2-甲基丁酸乙酯。已定性的2种酸分别是丁酸和3-甲基丁酸。羊肚菌风味的具体成因还有待进一步研究。
3 结论
本文对4个产地(长白山、林芝、青川、香格里拉)羊肚菌样品的蛋白质、粗多糖、总酚、游离氨基酸和挥发性风味成分进行了分析,发现林芝产羊肚菌的蛋白质、粗多糖、总酚含量均最高,长白山产羊肚菌游离氨基酸、必需氨基酸总量均最高,所有氨基酸中谷氨酸含量最高,说明羊肚菌鲜味明显。基于GC-IMS技术对样品VOCs进行采集分析,通过绘制GC-IMS指纹图谱,确定了各产地样品的特征峰区域,通过主成分分析,不同产地的羊肚菌样品得到了较好的区分,盲品亦能准确归属。热图聚类分析的结果与PCA结果一致,说明基于GC-IMS检测技术,对不同产地羊肚菌样品的VOCs进行检测分析,以辨别产地是可行的。关于生态环境、气候条件、栽培方式等因素对羊肚菌的风味和理化性质的具体影响机制,尚待深入研究。
[1] 卯晓兰. 中国蕈菌[M].北京:科学出版社, 2009:750-777.
MAO X L.Mushroom China[M].Beijing:Science Press, 2009:750-777.
[2] 顾可飞, 李亚莉, 刘海燕, 等.牛肝菌、羊肚菌营养功能特性及利用价值浅析[J].食品工业, 2018, 39(5):287-291.
GU K F, LI Y L, LIU H Y, et al.Initial analysis on the nutritional and functional properties and utilization of bolete and toadstool[J].The Food Industry, 2018, 39(5):287-291.
[3] TIETEL Z, MASAPHY S.True morels (Morchella)-nutritional and phytochemical composition, health benefits and flavor:A review[J].Critical Reviews in Food Technology, 2018, 58(11):1 888-1 901.
[4] LI S H, GAO A, DONG S, et al.Purification, antitumor and immunomodulatory activity of polysaccharides from soybean residue fermented with Morchella esculenta[J].International Journal of Biological Macromolecules, 2017, 96(3):26-34.
[5] 卢可可, 谭玉荣, 吴素蕊, 等.不同产地尖顶羊肚菌多酚组成及抗氧化活性研究[J].食品科学, 2015, 36(7):6-12.
LU K K, TAN Y R, WU S R, et al.Polyphenol components and antioxidant activity of Morchella conica Pers.from three different habitats[J].Food Science, 2015, 36(7):6-12.
[6] HUANG M, ZHANG S, ZHANG M L.Effects of polysaccharides from Morchella conica on nitric[J].Applied Microbiology and Biotechnology, 2012, 94(3):763-771.
[7] 孙巧弟, 张江萍, 谢洋洋, 等.羊肚菌营养素、功能成分和保健功能研究进展[J].食品科学, 2019, 40(5):323-328.
SUN Q D, ZHANG J P, XIE Y Y, et al.Recent progress in research on nutrients, functional components and health benefits of Morchella esculenta[J].Food Science, 2019, 40(5):323-328.
[8] LIU Q S, MA H S, ZHANG Y, et al.Artificial cultivation of true morels:Current state, issues and perspectives[J].Critical Reviews in Biotechnology, 2018,38(2):259-271.
[9] MONIKA O J, ANNA J W, JOLANTA J S, et al.Extracellular polysaccharides from ascomycota and basidiomycota:Production conditions, biochemical characteristics, and biological properties[J].World J Microbiol Biotechnol, 2015, 31:1 823-1 844.
[10] 范三红, 贾槐旺, 张锦华, 等.羊肚菌多糖纯化、结构分析及抗氧化活性[J].食品与发酵工业, 2020, 46(3):65-71.
FAN S H, JIA H W, ZHANG J H, et al.Purification, structural analysis and antioxidant activity of polysaccharides from Morchella esculenta[J].Food and Fermentation Industries, 2020, 46(3):65-71.
[11] 刘超. 液体深层发酵羊肚菌胞内多糖提取、结构分析及抗结肠癌作用研究[D].长春:吉林大学, 2017.
LIU C.Preparation, molecular characterization and inhibitory effect on human colon cancer of Morchella esculenta endo-polysaccharide based on submerged fermentation[D].Changchun:Jilin University, 2017.
[12] 张强, 王松华, 孙玉军, 等.羊肚菌蛋白的硒化修饰及其体外抗氧化活性[J].精细化工, 2017, 34(11):1 252-1 259.
ZHANG Q, WANG S H, SUN Y J, et al.Selenylation modification of Morchella esculenta proteins and their antioxidant activity in vitro[J].Fine Chemicals, 2017, 34(11):1 252-1 259.
[13] WANG S Q, CHEN H T, SUN B G.Recent progress in food flavor analysis using gas chromatography-ionmobility spectrometry (GC-IMS)[J].Food Chemistry, 2020,315:126 158.
[14] LI M Q, YANG R W, ZHANG H, et al.Development of a flavor fingerprint by HS-GC-IMS with PCA for volatile compounds of Tricholoma matsutake Singer[J].Food Chemistry, 2019, 290:32-39.
[15] 杨芳, 杨莉, 张振宇, 等.基于气相-离子迁移谱对竹燕窝菌汤风味成分的分析[J].食品工业科技, 2020, 41(23):8-14;24.
YANG F, YANG L, ZHANG Z Y, et al.Analysis of volatile flavor constituents in bamboo bird′s nest soups with headspace-gas chromatography-ion mobility spectrometry [J].Science and Technology of Food Industry, 2020, 41(23):8-14;24.
[16] MAR A M C, NATIVIDAD J C, LOURDES A, et al.A robustness study of calibration models for olive oil classification:Targeted and non-targeted fingerprint approaches based on GC-IMS[J].Food Chemistry, 2019,288:315-324.
A M C, NATIVIDAD J C, LOURDES A, et al.A robustness study of calibration models for olive oil classification:Targeted and non-targeted fingerprint approaches based on GC-IMS[J].Food Chemistry, 2019,288:315-324.
[17] TANG Z S, ZENG X A, MARGARET A, et al.Characterization of aroma profile and characteristic aromas during lychee wine fermentation[J].Journal of Food Processing and Preservation, 2019, 43(8):e14 003.
[18] DANIELE C, SANDRO Z, CHIARA D A, et al.Ion mobility spectrometry coupled to gas chromatography:A rapid tool to assess eggs freshness[J].Food Chemistry, 2019,271:691-696.
[19] 杨芳, 杨莉, 粟立丹.基于电子鼻和气相-离子迁移谱对美人椒酱的风味分析[J].食品工业科技, 2019, 40(23):193-198;206.
YANG F, YANG L, SU L D.Flavor analysis of Capsicum frutescens L.sauce based on electronic nose and gas chromatograph-ion mobility spectrometer(GC-IMS)[J].Science and Technology of Food Industry, 2019, 40(23):193-198;206.
[20] YANG L Z, LIU J, WANG X Y, et al.Characterization of volatile component changes in jujube fruits during cold storage by using headspace-gas chromatography-ion mobility spectrometry[J].Molecules, 2019, 24(3 904):1-21.
[21] 范金波, 蔡茜彤, 冯叙桥, 等.桑葚、蓝莓、黑加仑中多酚类物质的抗氧化活性[J].食品与发酵工业, 2015, 41(2):157-162.
FAN J B,CAI X T,FENG X Q, et al.Phenolic content and antioxidant capacity of blueberry,mulberry and blackcurrant[J].Food and Fermentation Industries, 2015, 41(2):157-162.
[22] LI C H.Analysis of proteins in three fungi traditional Chinese medicines by gel electrophoresis[D].Chongqing:Chongqing University, 2016.
[23] HERVERT-HERN NDEZ D, GARC
NDEZ D, GARC A O P, ROSADO J L, et al.The contribution of fruits and vegetables to dietary intake of polyphenols and antioxidant capacity in a Mexican rural diet:Importance of fruit and vegetable variety[J].Food Research International, 2011, 44(5):1 182-1 189.
A O P, ROSADO J L, et al.The contribution of fruits and vegetables to dietary intake of polyphenols and antioxidant capacity in a Mexican rural diet:Importance of fruit and vegetable variety[J].Food Research International, 2011, 44(5):1 182-1 189.
[24] 顾可飞, 周昌艳, 邵毅, 等.云南省野生牛肝菌与羊肚菌营养成分分析[J].食品研究与开发, 2017, 38(17):129-133.
GU K F, ZHOU C Y, SHAO Y, et al.The composition analysis of the wild boletus and morel in yunnan province nutrient[J].Food Research and Development, 2017, 38(17):129-133.
[25] LEDUY A, KOSARIC N, ZAJIC J E.Morel mushroom mycelium growth in waste sulfite liquors as source of protein and flavouring[J].Canadian Institute of Food Science and Technology Journal, 1974, 7(1):44-50.
[26] 熊丙全, 兰秀华, 彭卫红, 等.不同羊肚菌氨基酸比较分析及营养评价[J].食品与发酵工业, 2020, 46(2):114-119.
XIONG B Q, LAN X H, PENG W H, et al.Comparative analysis and nutritional evaluation of different amino acids in Morchlla spp.[J].Food and Fermentation Industries, 2020, 46(2):114-119.
[27] 姚文生, 蔡莹暄, 刘登勇, 等.不同材料熏制鸡腿肉挥发性物质GC-IMS 指纹图谱分析[J].食品科学技术学报, 2019, 37(6):37-45.
YAO W S, CAI Y X, LIU D Y, et al.Volatile compounds analysis in chicken thigh smoked with different materials by GC-IMS fingerprint[J].Journal of Food Science and Technology, 2019, 37(6):37-45.
[28] GAAFAR A M.Volatile flavour compounds of yoghurt[J].International Journal of Food Science and Technology, 2007, 27(1):87-91.
[29] 陈海涛, 张宁, 徐晓兰, 等.SPME和SDE-GC-MS分析贾永信腊羊肉挥发性风味成分[J].食品科学, 2013, 34(14):187-191.
CHEN H T, ZHANG N, XU X L,et al.Comparison of simultaneous distillation extraction (SDE) and solid-phase microextraction (SPME) for the analysis of volatile flavor compounds in jiayongxin preserved mutton by GC-MS[J].Food Science, 2013, 34(14):187-191.
[30] 孙宝国. 食用调香术[M].北京:化学工业出版社, 2003:116.
SUN B G.The Technology of Food Flavoring[M].Beijing:Chemical Industry Press, 2003:116.