乙醇、乙酸作为常见的化合物,广泛存在于食品、医药、工业等领域。在食用植物酵素生产中,乙醇、乙酸常伴随着发酵而产生,其含量直接影响发酵产品的品质、口感、香气等评价指标[1-2]。在果汁发酵生产中,乙醇的含量可能会直接影响发酵菌株的活性、营养成分的溶出、产品的稳定性及产品分类;乙酸与产品口感、香味等因素息息相关,控制乙醇、乙酸的含量无论是在生产过程中,还是在产品品质评价上都非常重要[3-4]。有报道采用高效液相色谱法对发酵饮料中乙酸的含量进行测定[5],但乙酸极性较大且属于末端吸收,对色谱柱、流动相都有特殊的要求;乙醇多使用气相色谱内标法进行测定[6],其易挥发、极性较大,对毛细管色谱柱有特殊要求,若测试样品中存在类乙醇和类乙酸的化合物时测试难度会增大。对乙醇、乙酸的含量检测也有采用重铬酸钾氧化、酸碱滴定、pH电位法等[7-10],这些检测方法样品前处理复杂,测试耗时长,对二者同时进行含量测定少有研究,因此,有必要探析一种更为方便、快捷、检测结果准确可靠的检测技术,同时测定发酵饮料中乙醇、乙酸的含量。
在定量核磁试验中,定量峰面积与对应的质子数成正相关,其测定具有不破坏样品、不依赖标准物质、样品制备简单与测试结果高效准确等优势[11-14]。早期,低灵敏度是定量核磁共振氢谱(quantitative proton nuclear magnetic resonance,q1H-NMR)技术面临的主要问题,但随着高磁场、超低温探头技术的问世,这个问题已被逐步解决。1H-NMR可以提供不同化合物、不同化学环境下质子的信号峰,这些核磁信号峰与质子所处的空间化学环境相关,这为同时测定多种化合物提供了可能。目前,q1H-NMR技术被多国药典收录,常用于多成分的含量测定,蜂蜜、咖啡等鉴别测试、代谢组学等方面的研究[15-19],但用于发酵饮料含量测定方面的研究还少有报道。本文采用q1H-NMR技术,同时测定5种发酵饮料中乙醇、乙酸的含量,对重复性、稳定性、准确度、线性范围等进行方法学考察,使用GC法对q1H-NMR测试结果进行验证。建立并优化5种发酵饮料中乙醇和乙酸含量的测定方法,该方法可用于准确快速地检测发酵饮料的中间产品,为最终保证成品质量的稳定性、均一性提供数据支持,也为食用植物酵素中醇、酸类物质的含量测定提供参考与借鉴。
1 材料与方法
1.1 试剂与仪器
乙醇(99.80%)、乙酸(99.50%)标准品,中国计量科学研究院;3-(三甲基甲硅烷基)丙酸-d4钠[sodium 3-(trimethylsilyl) propionate-2,2,3,3-d4,TMSP](98%),美国剑桥;5种发酵饮料,互联网方式购入,命名为F1~F5,分别为刺梨、李子、木瓜、刺梨木瓜与刺梨山楂饮料。
Bruker Avance NEO 600 MHz型核磁共振波谱仪,Bruker公司;明澈TM-D24UVB纯水-超纯水一体机,德国默克集团;AG285分析天平,梅特勒-托利多集团;Agilent 7820气相色谱仪,Agilent公司;氘代二甲基亚砜(dimethyl sulfoxide-d6,DMSO-d6),美国剑桥同位素实验室。
1.2 试验方法
1.2.1 核磁共振供试品溶液制备
精密称取适量样品至内径为5 mm核磁管中,精确称取内标TMSP 1.00 mg,加入溶剂[V(DMSO-d6):V(H2O) = 4∶1]500 μL,混匀后测试。分别取适量乙醇、乙酸标准品溶液配制6个标准样品(乙醇64.05~0.32 mg/mL,乙酸19.51~0.20 mg/mL),按上述样品配制方法,配制、混匀后测试,并绘制标准曲线。
1.2.2 核磁测试参数设置
q1H-NMR测试采用90° 脉冲,脉冲程序为zg,谱宽设置为 SW∶10.96 ppm、O1∶5.06 ppm,采样次数(NS)为16次,测试温度298 K,采样时间(AQ)为4.50 s,弛豫延迟时间(D1)为20 s,采样点数为64 K。1H-1H COSY脉冲程序为cosygpppqf,F1谱宽SW∶10.96 ppm,O1∶4.37 ppm,F2谱宽SW∶10.96 ppm,O1∶4.37 ppm,D1为2 s,NS为4次,空扫(DS) 为16。1H-13C HSQC脉冲程序为hsqcedetgpsp.3,F2维(H)谱宽SW∶10.96 ppm,O1∶4.37 ppm,F1(C)谱宽SW∶200 ppm,O1∶95 ppm,NS 为8次,DS 为32。
1.2.3 核磁数据处理计算
将采集得到的数据使用Topspin 4.0.3软件进行傅里叶变换,定标、相位校正和五阶基线校正处理,选定内标和样品定量特征峰,放大后进行积分,取5次积分的平均值进行计算,如公式(1)所示:
(1)
式中:Wr,内标物的质量;As,供试品特征峰值;Ar,内标峰的振幅值;Es,供试品的质子当量质量;Er, 内标物的质子当量质量(以分子质量除以特征峰的质子数计算得到);根据Ws和称样量,计算组分在样品中的含量。
1.2.4 气相色谱供试品溶液制备
分别取适量的乙醇、乙酸超纯水稀释配制得标准样品各6份(乙醇0.68~3.41 mg/mL,乙酸2.16~12.40 mg/mL),进样检测后绘制标准曲线。取适量乙醇、乙酸超纯水稀释为不同浓度的供试验证样品。
1.2.5 气相色谱参数设置
毛细管色谱柱为HP-INNOWAX (30 m×320 μm, 0.25 μm),进样口温度220 ℃,FID检测器温度 220 ℃;采用程序升温:起始温度为30 ℃,保持 8 min,以10 ℃/min的速率升温至70 ℃,再以25 ℃/min的速率升温至220 ℃,维持3 min。进样量1 μL,分流进样,分流比为20∶1,载气为氮气,柱流量为1.00 mL/min。测试结果使用SPSS 19.0软件对比分析。
2 结果与分析
2.1 q1H-NMR测试方法的优化
2.1.1 内标物与溶剂的选择
采用q1H-NMR技术进行含量测定时,内标物应选纯度高、易称量、与待测物不发生反应的化合物,在1H-NMR图谱中可以完全分离、互不干扰。在本试验中,试样中的水与乙醇、乙酸发生质子交换,活泼氢不出峰;故乙酸只出现甲基的质子信号(CH3—),化学位移为1.80 ppm (s, CH3—),可作为定量峰;乙醇出现2个信号峰,化学位移分别为1.10 ppm (t, CH3—)、3.49 ppm (q,—CH2—),为计算方便、提高测定结果的准确度本试验选择化学位移1.10 ppm (t)作为乙醇定量峰;TMSP化学位移为0.00 ppm (s);三者不重叠、分离度良好且不受样品中其他杂质信号影响(图1),故TMSP可作为本测试的内标。由于本实验测定样品的特殊性,选用醇类氘代溶剂和极性较小的氘代溶剂可能会对测试准确度有一定的影响,本试验选用DMSO-d6与超纯水混合溶剂能充分溶解样品和内标,溶剂信号峰在1H-NMR谱图中与TMSP、乙醇、乙酸的信号峰完全分离,不影响其检测结果。
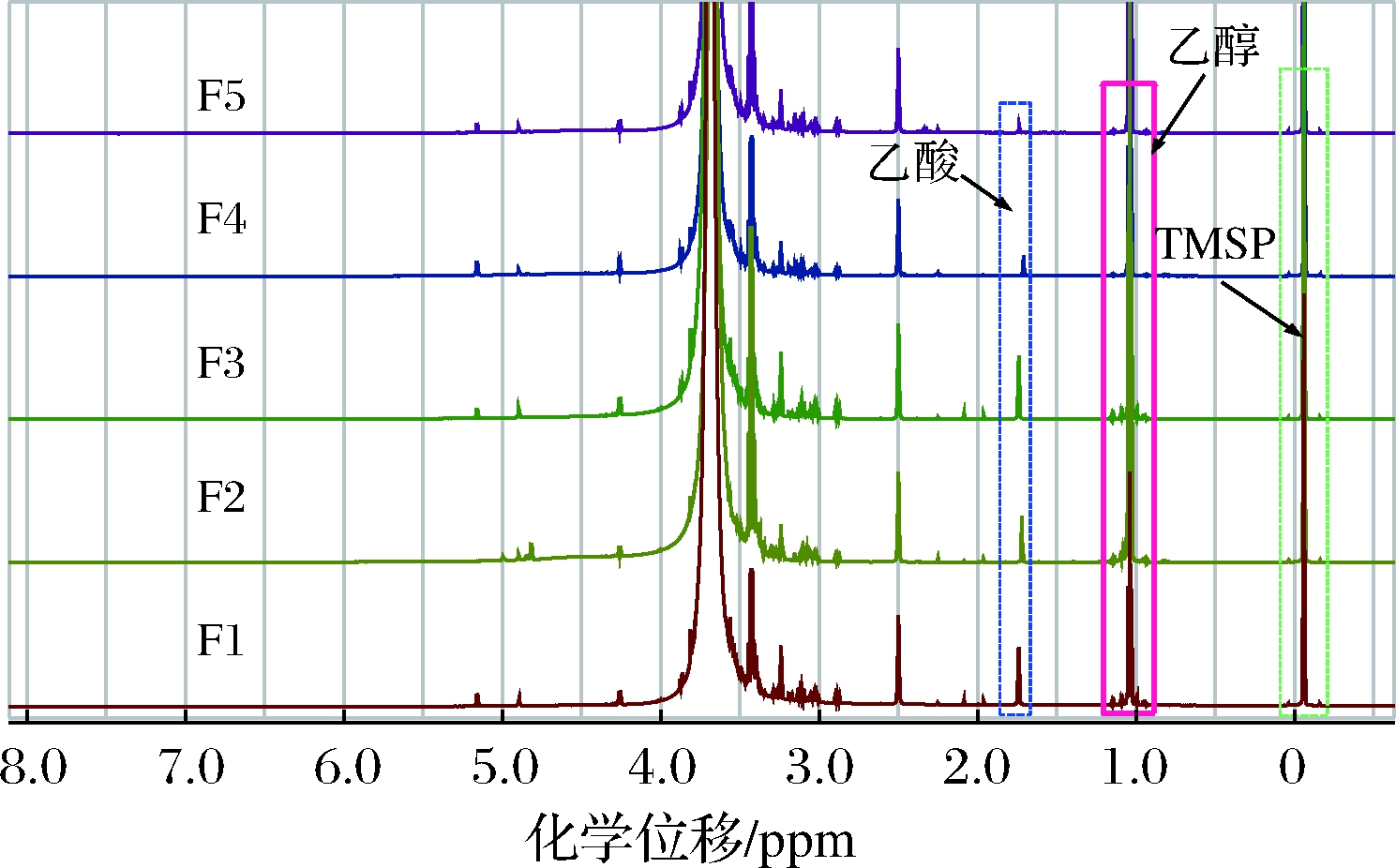
图1 发酵饮料1H-NMR重叠图
Fig.1 Overlaid 1H-NMR spectra of the fermented drinks
2.1.2 q1H-NMR测试参数的优化
影响定量核磁共振测定结果准确度与重复性的参数主要有D1、NS及信噪比(S/N)等。D1的设定依据是由待测物与内标物中待定量质子的纵向弛豫时间T1决定,只有待测质子完全弛豫后,相应的峰面积比值才会保持相对恒定,从而确保测试结果的准确度,研究报道当D1≥ 5T1时测定结果的准确度得到保障[20]。在本试验中,分别取适量乙醇、乙酸和TMSP溶于核磁管中,采用反转恢复法[21](设置Vdlist参数为0.01、0.05、0.10、0.25、0.50、1.00、2.00、4.00、8.00、15.00、30.00 s)测得乙醇、乙酸和TMSP化合物的T1分别为4.04、2.16、2.51 s;故本实验D1设置为20 s,加上样品采集时间AQ=4.50 s,满足AQ+D1>5T1。在q1H-NMR测试中,S/N与NS成正相关,通常情况下增加扫描次数,能够获得足够高的信噪比;但随着扫描次数增加测试实验时间也会延长,降低检测效率。本试验设置NS为8、16、32进行考察,对测试结果进行对比分析,无明显的差异变化,为保障测试结果的稳定性,本试验扫描16次能完全满足测试要求。
2.2 核磁定量方法学考察
2.2.1 线性范围试验
按照1.2.1核磁供试品配制6个不同浓度的待测样品,采集数据处理后,分别计算乙醇、乙酸与内标峰面积的比值,将比值设为纵坐标;分别计算乙醇、乙酸与内标的质量比,将质量比设为横坐标进行线性回归,得到乙醇回归方程y=1.083 5x-0.006, R2=0.999 9(线性范围64.05~0.32 mg/mL),乙酸回归方程 y=8.365 5x-0.008 4,R2=0.999 8(线性范围19.51~0.20 mg/mL),测试结果表明,TMSP为内标测定乙醇、乙酸含量时,其线性关系良好。测试中S/N≥250时,测定结果的准确度可以得到保障,本试验乙醇、乙酸的线性下限分别为0.32、0.20 mg/mL,在优化条件下测试乙醇、乙酸的S/N均>250。
2.2.2 准确度试验
按照1.2.1核磁供试品配制3个浓度的试验样品分别测定,计算乙醇、乙酸的含量,将实际值与理论值比较,计算回收率,乙醇回收率99.68%~100.65%,相对标准差(relative standard deviation,RSD)0.19%~0.37%;乙酸回收率98.38%~99.24%,RSD 0.59%~1.11%;平均回收率均在98.00%~102.00%,RSD< 2.00%。显示该测试方法准确度良好。
2.2.3 重复性试验
在优化条件下对供试样品(n=6)重复测定6次,采集的数据处理后计算乙醇、乙酸的含量,以乙醇、乙酸的含量计算其RSD值,分别为0.11%、0.99%,显示该测试方法重复性良好。
2.2.4 稳定性试验
取5种发酵饮料供试品按2.1核磁供试品配制后存放在4 ℃冰箱于0、6、12、24、48 h测试,分别测得发酵饮料中乙醇、乙酸的含量,计算RSD值,乙醇为0.15%~1.32%,乙酸为0.24%~1.86%,结果显示供试品溶液在48 h内稳定性良好。
2.2.5 专属性试验
取5种发酵饮料供试品按2.1核磁供试品配制后,采用二维核磁技术1H-13C HSQC、1H-1H COSY标准试验对方法的专属性进行考察[22]。1H-1H COSY结果显示乙醇δ 1.10 (t, CH3—)与δ 3.49 (q, —CH2—)相关,且无其他杂质信号干扰;乙酸δ 1.80 (s, CH3—)在谱图除自相关外无其他杂质干扰。1H-13C HSQC结果显示乙醇δ 1.10与δ 20.19、δ 3.48与δ 57.92相关无其他杂质信号干扰;乙酸δ 1.80 与δ 25.06直接相关无其他杂质信号干扰,测试图谱见图2,结果表明,本试验方法专属性强,可用于发酵饮料中乙醇、乙酸的含量测定。
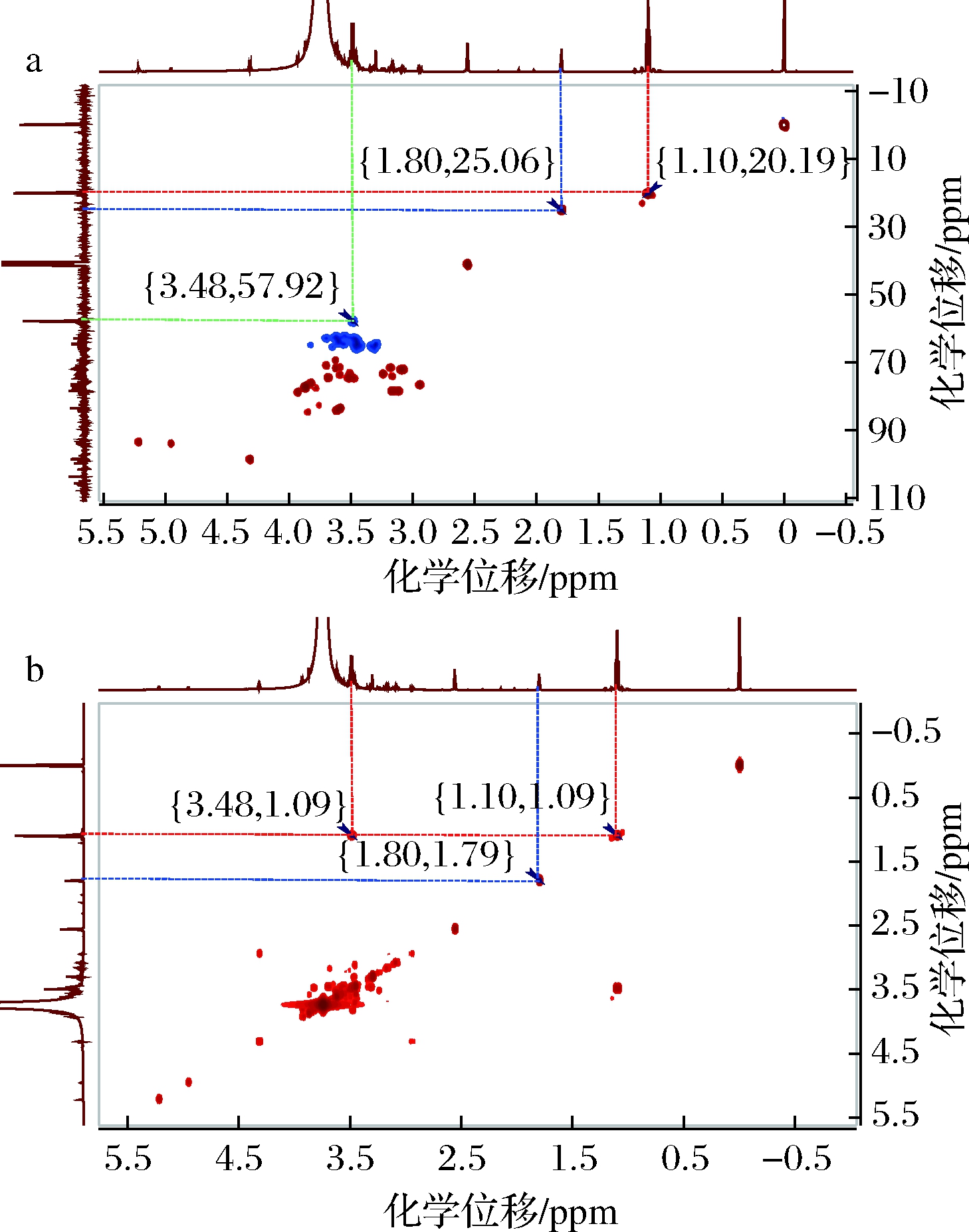
a-1H-13C HSQC;b-1H-1H COSY
图2 样品1H-13C HSQC、1H-1H COSY谱图
Fig.2 1H-13C HSQC and 1H-1H COSY spectrum of sample
2.2.6 气相色谱法验证试验
本实验采用目前醇、酸类物质常用的检测手段GC法对定量核磁共振测试结果进行验证。试验发现,发酵饮料中可能存在与类乙醇的物质难以实现分离,无法进行定量测定。故此,本实验直接使用乙醇、乙酸标准品配制3个不同浓度的验证样品,使用上述优化后的检测方法,分别使用GC与q1H-NMR技术其进行含量测定,测试谱图见图3,测得结果见表1,结果无显著性差异(P>0.05)。
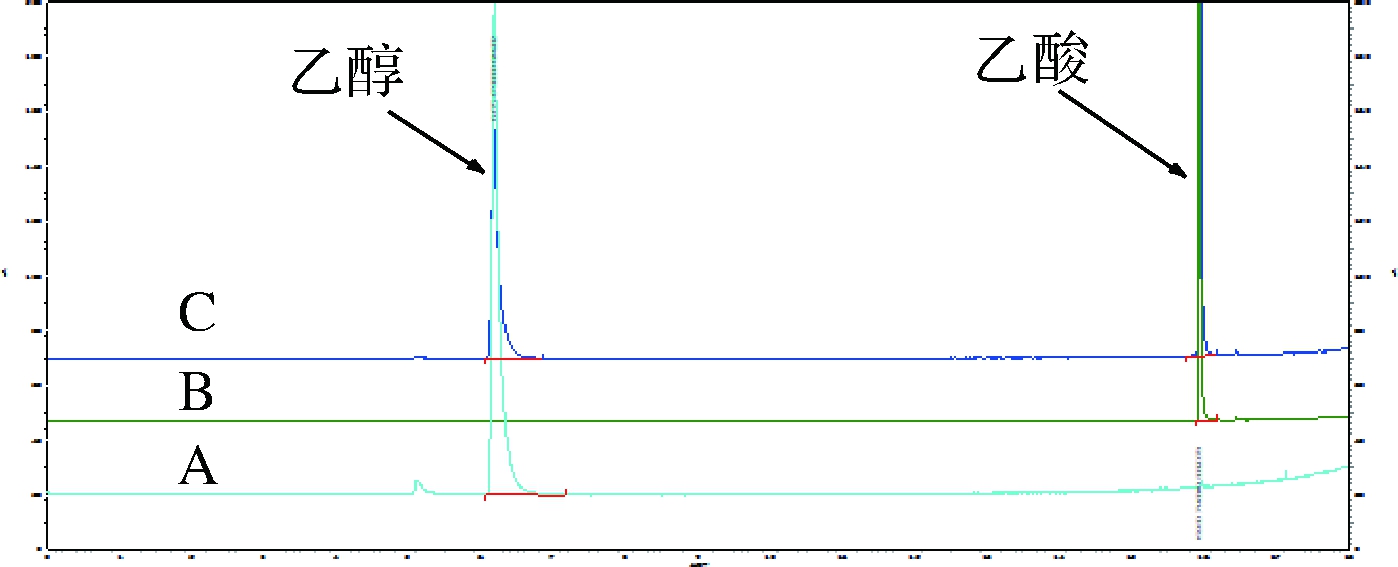
A-乙醇;B-乙酸;C-乙醇和乙酸
图3 气相色谱图
Fig.3 GC spectrum
表1 验证试验结果(n=3)单位:mg/mL
Table 1 Results of verification tests (n=3)
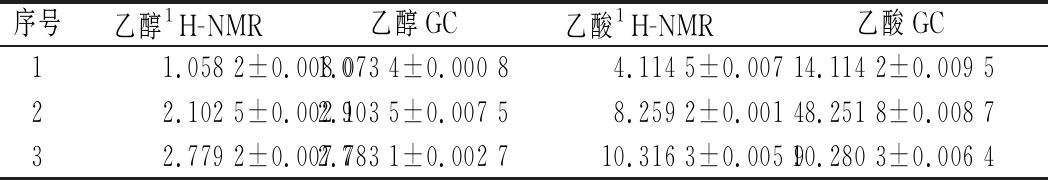
序号乙醇1H-NMR乙醇GC乙酸1H-NMR乙酸GC11.058 2±0.008 01.073 4±0.000 84.114 5±0.007 14.114 2±0.009 522.102 5±0.002 92.103 5±0.007 58.259 2±0.001 48.251 8±0.008 732.779 2±0.007 72.783 1±0.002 710.316 3±0.005 910.280 3±0.006 4
2.3 发酵饮品的测定结果
按照1.2.1核磁供试品配制,每个样品平行3份,分别测得发酵饮料中乙醇、乙酸的含量,测试结果如表2所示。
表2 五种饮料中乙醇和乙酸的含量(n=3) 单位:mg/mL
Table 2 The contents of ethanol and acetic acid in five fermented drinks samples (n=3)
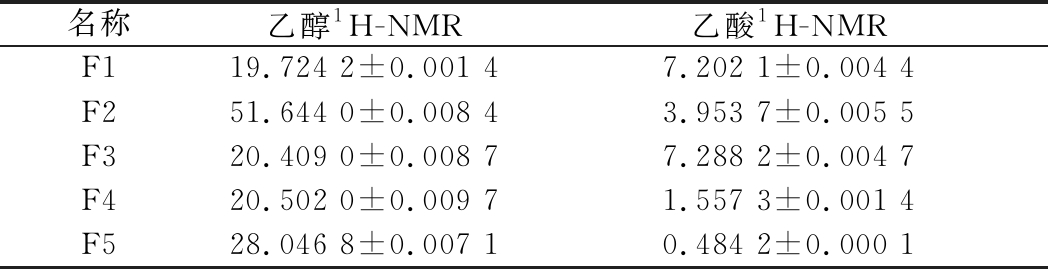
名称乙醇1H-NMR乙酸1H-NMRF119.724 2±0.001 47.202 1±0.004 4F251.644 0±0.008 43.953 7±0.005 5F320.409 0±0.008 77.288 2±0.004 7F420.502 0±0.009 71.557 3±0.001 4F528.046 8±0.007 10.484 2±0.000 1
3 结论
乙醇、乙酸常伴随着果蔬的发酵产生,是衡量发酵产品品质的重要指标,在发酵饮料生产、食用酒的酿造等领域都需要对其含量进行控制[23-24]。由于乙醇、乙酸物理化学性质差异大、测试样品成分复杂,采用GC、HPLC等技术难以同时对其进行测定。为此,本文通过q1H-NMR技术同时测定发酵饮料中乙醇、乙酸的含量,并对其进行了方法学考察,结果均显示良好;发酵饮料成分繁杂,可能存在与二者沸点相近的化合物,使用GC法进行验证试验时,不论是样品稀释后检测,还是将样品蒸馏、稀释后检测,二者都不能同时测得;故使用标准物质配制不同浓度的验证样品对q1H-NMR技术进行方法验证,验证结果无显著差异。
在q1H-NMR试验中,对核磁共振测试参数进行优化,AQ为4.50 s,D1为20 s,NS为16次,以TMSP为内标,测试溶剂选用DMSO-d6与H2O的混合溶剂,既节约成本又能更好溶解样品,定量质子信号峰不受溶剂信号干扰,保证了测试方法的稳定性和检测结果的准确性,每个试样测试时间约为10 min,对比其他检测方法在时间上具有竞争优势。试验前测定发酵样品的1H-NMR、1H-13C HSQC和1H-1H COSY谱图,结果显示乙酸信号1.80 ppm(s, CH3—)与乙醇信号1.10 ppm(t,CH3—)不受试样中其他化合物的干扰,可作为二者的专属测定峰。定量1H-NMR测定不需要分离过程、效率高、样品前处理简单,有效的减少样品处理对测定结果的影响,在发酵生产中实时监测乙醇、乙酸含量的变化具有较大优势,能有效的提高生产效率。本文通过q1H-NMR技术对5种发酵饮料中乙醇、乙酸的含量进行检测,进一步提高q1H-NMR技术在食品生产中的应用,拓宽了醇、酸类物质检测手段,为今后发酵工艺的优化、食用植物酵素产品的质量监控提供新的检测手段。
[1] 郑宇,程程,刘静,等.中国传统固态发酵食醋主要特征风味物质组成分析[J].中国食品学报,2020,20(8):237-247.
ZHENG Y, CHENG C, LIU J, et al.Analysis of main characteristic flavor components in Chinese traditional solid-state sermented vinegars [J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(8):237-247.
[2] 陈娟,唐俊妮,王文娟.三种猕猴桃酒发酵过程中挥发性香气成分的变化[J].食品工业科技,2019, 40(3):242-248.
CHEN J, TANG J N, WANG W J.Changes of volatile aroma components of three cultivars of kiwifruit wines during fermentation process [J].Science and Technology of Food Industry, 2019, 40(3):242-248.
[3] CUSANO E, SIMONATO B, CONSONNI R.Fermentation process of apple juice investigated by NMR spectroscopy [J].Lwt Food Science & Technology, 2018, 96 (10):147-151.
[4] 蒋予箭,何炯灵,王晶晶.黄酒固定化发酵过程及香气物质形成的研究[J].中国食品学报,2020,20(5):130-137.
JIANG Y J, HE J L, WANG J J.Studies on the immobilized fermentation process and the formation of roma substances in yellow rice wine[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(5):130-137.
[5] 张晶,陈悦,余偲,等.短乳杆菌发酵苹果汁工艺优化及有机酸变化[J].食品与发酵工业,2020,46(2):180-187.
ZHANG J, CHEN Y, YU S, et al.Optimization of fermentation process of apple juice by Lactobacillus brevis and its organic acids changes [J].Food and Fermentation Industries, 2020, 46(2):180-187.
[6] 王璐, 李金慈, 乔立业,等.顶空进样-气相色谱法测定双乌止痛酊中甲醇和乙醇含量[J].海峡药学, 2019, 31 (8):106-108.
WANG L, LI J C, QIAO L Y, et al.Determination of methanol and ethanol in Shuangwuzhitong tincture by headspace sampling GC [J].Strait Pharmaceutical Journal, 2019, 31 (8):106-108.
[7] 车逸心,刘雯娴,徐瑞欣,等.紫红曲霉与酿酒酵母共发酵对红曲甜米酒风味的影响[J].中国食品学报,2020,20(4):118-124.
CHE Y X, LIU W X, XU R X, et al.Influence of Monascus purpureus and Saccharomyces cerevisiae co-fermentation on the flavor of sweet red yeast rice wine [J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(4):118-124.
[8] 范昊安,薛淑龙,王高坚,等.紫苏叶酵素发酵过程中代谢产物与抗氧化活性研究[J].中国酿造,2019,38(9):148-154.
FAN H A, XUE S L, WANG G J, et al.Metabolites and antioxidant activity of Perilla leaves jiaosu during the fermentation[J].China Brewing, 2019, 38(9):148-154.
[9] 程昊,陈姚锋,唐婷范,等.发酵型百香果酒的研制[J].食品研究与开发,2020,41(16):160-164.
CHENG H, CHEN Y F, TANG T F, et al.Development of fermented passion fruit wine [J].Food Research and Development, 2020, 41(16):160-164.
[10] 范智义,邓维琴,李恒,等.不同品牌郫县豆瓣品质指标分析[J].食品与发酵工业,2020,46(13):230-236.
FAN Z Y, DENG W Q, LI H, et al.Quality analysis of eight commercial Pixian broad bean-chili pastes[J].Food and Fermentation Industries, 2020, 46(13):230-236.
[11] QIN L P, WANG X X, LU D Q, et al.Quantitative determination and validation of topiramate and its tablet formulation by 1H-NMR spectroscopy[J].Analytical Methods, 2019, 11(5):661-668.
[12] 仲艳,李家春,王志霞,等.1H定量核磁共振波谱法测定二对甲苯磺酸缘生替尼对照品的含量[J].药物分析杂志,2019,39(3):432-435.
ZHONG Y, LI J C, WANG Z X, et al.Determination of yunsintinib ditosylate reference subsfance by 1H quantitative nuclear magnetic resonance spectroscopy[J].Chin J Pharm Anal, 2019, 39(3):432-435.
[13] 吉鑫,樊双喜,杨彤晖,等.核磁共振法测定食品中水苏糖的含量[J].食品与发酵工业,2019,45(19):251-257.
JI X, FAN S X, YANG T H, et al.Quantitative determination of stachyose in foods by NMR [J].Food and Fermentation Industries, 2019, 45(19):251-257.
[14] GOUGEON L, DA COSTA G, RICHARD T, et al.Wine authenticity by quantitative 1H-NMR versus multitechnique analysis:A case study[J].Food Analytical Methods, 2019, 12:956-965.
[15] LIU H Y, TAYYARI F, KHOO C, et al.A 1H-NMR-based approach to investigate metabolomic differences in the plasma and urine of young women after cranberry juice or apple juice consumption [J].Journal of Functional Foods, 2015,14:76-86.
[16] CERCEAU C I, BARBOSA L C A, FILOMENO C A, et al.An optimized and validated 1H NMR method for the quantification of α-pinene in essentials oils [J].Talanta, 2016, 150:97-103.
[17] VILLALON-LOPEZ N, SERRANO-CONTRERAS J I, TELLEZ-MEDINA D I, et al.An 1H-NMR-based metabolomic approach to compare the chemical profiling of retail samples of ground roasted and instant coffees [J].Food Research International, 2018,106:263-270.
[18] FAN G, ZHANG M Y,ZHOU X D, et al.Quality evaluation and species differentiation of Rhizoma Coptidis by using proton nuclear magnetic resonance spectroscopy [J].Analytica Chimica Acta, 2012,747:76- 83.
[19] SHARMA N, VERMA M K, GUPTA D K, et al.Isolation and quantification of pinitol in Argyrolobium roseum plant, by 1H-NMR [J].Journal of Saudi Chemical Society 2016,20(1):81-87.
[20] DONG J W, LI X J.Simultaneous determination of alkaloids dicentrine and sinomenine in Stephania epigeae by 1H-NMR spectroscopy [J].Journal of Pharmaceutical and Biomedical Analysis, 2018,160:330-335.
[21] DING P L, CHEN L Q, LU Y, et al.Determination of protoberberine alkaloids in Rhizoma Coptidis by ERETIC 1H NMR method [J].Journal of Pharmaceutical and Biomedical Analysis, 2012,60:44-50.
[22] KAI J Y, YANG C, JIAN H, et al.Qualitative and quantitative analyses of compound Danshen extract based on 1H NMR method and its application for quality control[J].Journal of Pharmaceutical and Biomedical Analysis, 2016,131:183-187.
[23] 陈治宇,叶佳锟,黄丹,等.功能性红枣果酒发酵工艺优化[J].酿酒,2020,47(3):80-84.
CHEN Z Y, YE J K, HUANG D, et al.Optimization of fermentation process of functional jujube wine[J].Liquor Making, 2020, 47(3):80-84.
[24] 曾智娟,邓杰,任志强,等.不同酵母菌发酵对生姜梨酒品质的影响[J].食品与发酵工业,2020,46(1):229-236.
ZENG Z J, DENG J, REN Z Q, et al.Effect of different yeast fermentations on ginger pear wine quality [J].Food and Fermentation Industries, 2020,46(1):229-236.