活性羰基化合物(reactive carbonyl species,RCS)是一类有害活泼性小分子,如丙烯醛(acrolein,ACR)、丙酮醛(methylglyoxal,MGO)、巴豆醛(crotonaldehyde,CRO)、5-羟甲基糠醛(5- hydroxymethylfurfural,5-HMF)、甲醛(formaldehyde,FOR)、乙醛(acetaldehyde,ACE)。RCS主要存在于环境污染[1]、动植机体内源性代谢[2]和食品加工贮藏过程中[3-4]。脂质氧化、磷脂和脂肪酸氢过氧化物分解、还原糖和蛋白质的美拉德反应均为食源性RCS的主要产生途径。RCS具有强亲电性能,可与不同的细胞成分(大多数为亲核物质)发生强烈反应[5]。生物分子的巯基、咪唑基、羟基以及嘌呤和嘧啶碱基中的氮、氧原子等强亲核位点是其最易攻击的目标,RCS与其相互作用可能导致蛋白质、核酸和氨基磷脂的化学修饰,从而导致细胞毒性和诱变作用[6-7]。研究证明,RCS与癌症、神经退行性疾病、糖尿病并发症、阿尔茨海默症、衰老、动脉粥样硬化等多种疾病密切相关[8]。因此,食品加工和贮藏过程中产生的RCS,给食品安全带来潜在危害,成为目前关注的热点。
白酒是以粮谷为主要原料,以大曲、小曲或麸曲及酒母等为糖化发酵剂,经蒸煮、糖化、发酵、蒸馏、贮存而制成的蒸馏酒。白酒作为我国特色蒸馏酒,产量逐年递增,饮用白酒的人口也十分庞大,因此,白酒的质量安全状况与我国人民的生命健康息息相关[9-10],关注白酒加工过程中潜在的有害物质愈发重要。国外已在葡萄酒[11]、啤酒[12]、水果蒸馏酒、威士忌、龙舌兰、白兰地、朗姆酒[13-15]等酒精饮料中检测到甲醛、乙醛、乙二醛、丙酮醛、丙烯醛、巴豆醛、糠醛、5-羟甲基糠醛等RCS。目前白酒中有毒有害物质研究主要集中在氨基甲酸乙酯[16]、生物胺[17]、氰化物[18]等内源性物质,以及塑化剂[19]、重金属[20]、农药残留[21]、真菌毒素[22]等外源性物质,而针对小分子RCS尚未引起足够重视。研究发现,微生物发酵以及粮食发生的美拉德反应极大提升了酒体中RCS的形成,因此监控白酒中的有害RCS至关重要。
近年来国内外针对RCS的检测分析主要有荧光光谱法[23]、分光光度法[24]、同位素稀释质谱法[25]、液相色谱法[26]、气相色谱质谱联用法[27]、电化学法[28]等。虽然质谱联用可以同时检测多种醛类物质,但质谱成本较高,企业普及和推广受限。因此有必要建立同时检测多种RCS的普通色谱方法。由于白酒中挥发性物质较多,采用气相色谱法分析RCS,干扰较大;而且气相色谱选用的共衍生化试剂成本较高;而液相色谱法既能对多种成分实现有效分离,衍生化试剂简单易得,成本低,且方法稳定性较好、检测限灵敏度均能达到预期效果,在行业中易于普及推广。故而本研究拟以2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)作为衍生化试剂,采用HPLC-二级管阵列检测器(diode array detection,DAD)建立一种同步测定白酒中多种RCS(ACR、MGO、CRO、5-HMF、FOR、ACE)含量的方法,为白酒产品中多种有害RCS的同步检测以及对白酒酿造加工过程有害RCS产生途径的监控提供有利手段。
1 材料与方法
1.1 材料与试剂
丙烯醛(95%),萨恩化学技术(上海)有限公司;丙酮醛(40%),美国Sigma-Aldrich公司;巴豆醛(99%),Adamas-beta试剂;5-羟甲基糠醛(99.7%),毕得医药;甲醛(100 mg/L),生态环境部标准样品研究所;乙醛(40%),上海展云化工有限公司;2,4-二硝基苯肼(98%),上海麦克林生化科技有限公司;乙腈(色谱纯),德国Merck公司;实验用水为超纯水;其余试剂均为国产分析纯。
实验样品均通过市售或酒厂取样方式获得。酒样1~3为浓香型(42%vol~52%vol),由酒厂A、B、C提供;4~6为酱香型(43%vol~53%vol),由酒厂D、E提供;7~9为清香型(42%vol~53%vol),由酒厂F、G提供;10~12为凤香型(42%vol~55%vol),由酒厂H提供;13~15为芝麻香型(42%vol),由酒厂I、J提供;16~18为兼香型(40.2%vol~42%vol),由酒厂K、L提供。浓香型不同加工阶段样品由酒厂J提供,酱香型不同取酒次数样品由酒厂M提供。
1.2 仪器与设备
e2695液相色谱仪(配有2998二极管阵列检测器),美国Waters公司;Thermo Biofuge Stratos超速冷冻离心机、N-EVAP氮气吹干仪,美国Organomation公司;Nanopure超纯水机,美国Thermo公司;PWC 254型分析天平,英国ADAM公司。
1.3 试验方法
1.3.1 溶液的配制
1.3.1.1 标准储备液的配制
精确吸取适量ACR、MGO、CRO、5-HMF、FOR、ACE标准品于100 mL棕色容量瓶中,加入磷酸盐缓冲溶液(0.1 mol/L,pH 4.0)溶解并定容后配制成质量浓度分别为0.01、0.02、0.01、0.01、0.01、0.50 mg/mL的标准品储备液,置于4 ℃条件下避光保存备用。
1.3.1.2 系列标准溶液的配制
精确吸取1.3.1.1中储备液适量于容量瓶中,用磷酸盐缓冲溶液(0.1 mol/L,pH 4.0)逐级稀释至标准系列溶液,其中ACR、CRO、5-HMF、FOR的质量浓度为0.012 5、0.025、0.05、0.1、0.25、0.5、1、1.5 μg/mL,MGO的质量浓度为0.025、0.05、0.1、0.2、0.5、1、2、3 μg/mL,ACE的质量浓度为0.625、1.25、2.5、5.0、12.5、25、50、75 μg/mL。
1.3.2 样品前处理
1.3.2.1 成品酒、原酒样品
参考文献[29-30]并进行优化,取适量液体样品用磷酸盐缓冲溶液(0.1 mol/L,pH 4.0)将其酒精度稀释至10%vol,涡旋混匀,精密吸取3 mL加入4 mg/mL DNPH-乙腈溶液 0.3 mL,加盖混匀,于50 ℃恒温水浴振荡器中避光反应1.5 h后冰水冷却。加入3 mL二氯甲烷,涡旋2 min,10 000 r/min离心15 min,萃取2次,合并二氯甲烷层,氮气吹干后用200 μL乙腈复溶,0.22 μm有机滤膜过滤后HPLC检测。
1.3.2.2 固体原料、酒醅样品
取一定量固体样品粉碎,精密称取5 g,加入50 mL 磷酸盐缓冲溶液(0.1 mol/L、pH 4.0),加盖混匀,浸泡过夜,冰浴超声30 min后10 000 r/min离心15 min,精确吸取上清液3 mL按1.3.2.1中方法处理样品,HPLC检测。
1.3.3 色谱条件
色谱柱为Beconsil C18色谱柱(250 mm×4.6 mm,5 μm);柱温40 ℃;流速1.0 mL/min;进样量5 μL;检测波长360 nm(ACR、MGO、CRO、FOR、ACE)/400 nm(5-HMF);流动相为超纯水与乙腈梯度洗脱(0~3 min,乙腈50%;3~12 min,乙腈50%~90%;12~12.5 min,乙腈90%~100%;12.5~15 min,乙腈100%)。
1.4 数据统计及图表绘制方法
所有实验均平行3次,采用Excel 2010、SPSS 17.0 分析实验数据,结果以![]() 表示。采用One-way ANOVA模式分析, 显著性差异采用Duncan检验,P<0.05表示差异具有统计学意义。
表示。采用One-way ANOVA模式分析, 显著性差异采用Duncan检验,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 色谱峰确立
由图1可知,通过对RCS共衍生化条件及色谱条件的优化,各待测物质在液相色谱中分离度良好,空白无杂质峰干扰,达到分析要求。
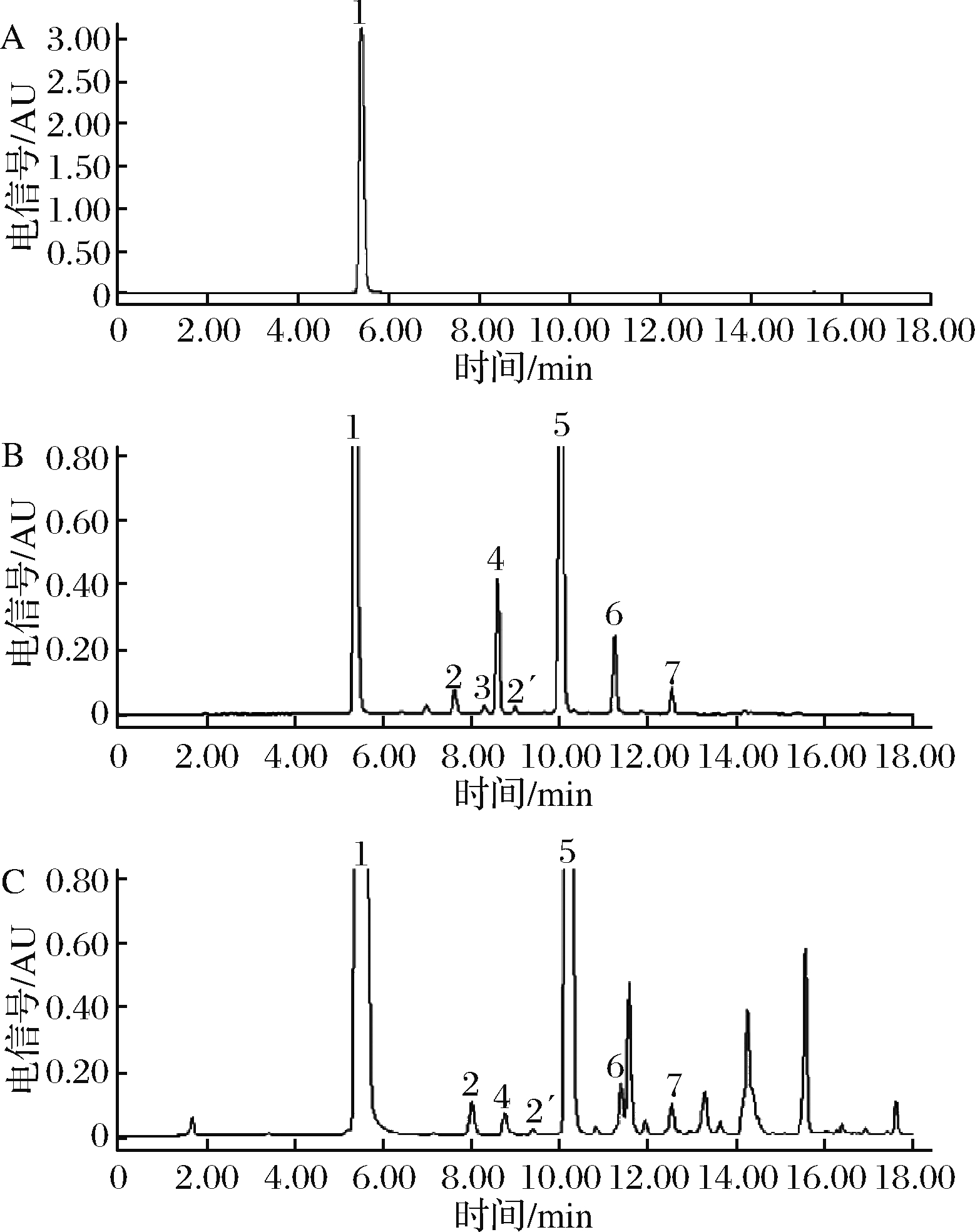
1-DNPH;2、2′-5-HMF;3-MGO;4-FOR;5-ACE;
6-ACR;7-CRO
A-空白溶液;B-混合标准品溶液;C-白酒样品
图1 空白溶液、混合标准品溶液及白酒样品的色谱图
Fig.1 HPLC chromatograms of blank sample、mix standard solution and liquor samples
2.2 方法学考察
2.2.1 标准曲线、线性范围和检出限及定量限测定结果
取系列标准溶液按1.3.2.1进行衍生化,按1.3.3进行HPLC分析。以质量浓度为横坐标x,以RCS衍生物峰面积为纵坐标y,分别绘制标准曲线并计算回归方程。根据信噪比确定检出限(RSN=3)以及定量限(RSN=10)。如表1所示,6种RCS呈现良好的线性关系,相关系数在0.999以上,检出限和定量限满足分析要求。
表1 六种RCS的标准曲线、相关系数、线性范围、检出限和定量限
Table 1 Regression equation, correlation coefficient, linear range, limit of detection and limit of quantitation of 6 RCS by HPLC
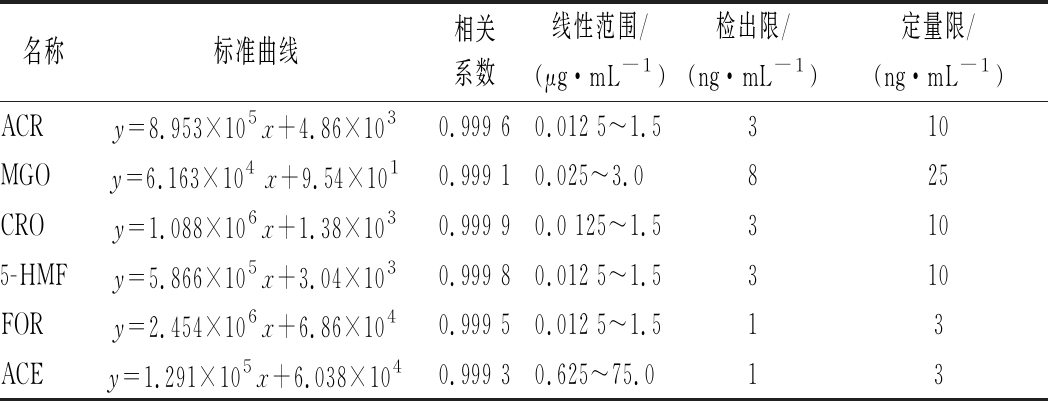
名称标准曲线相关系数线性范围/(μg·mL-1)检出限/(ng·mL-1)定量限/(ng·mL-1)ACRy=8.953×105x+4.86×1030.999 60.012 5~1.5310MGOy=6.163×104 x+9.54×1010.999 10.025~3.0825CROy=1.088×106x+1.38×1030.999 90.0 125~1.53105-HMFy=5.866×105x+3.04×1030.999 80.012 5~1.5310FORy=2.454×106x+6.86×1040.999 50.012 5~1.513ACEy=1.291×105x+6.038×1040.999 30.625~75.013
2.2.2 样品稳定性测定结果
将混合RCS标准溶液按1.3.2.1方法处理后,分别于25、4 ℃避光放置0、1、2、4、8、16、24 h后在1.3.3的色谱条件下测定各RCS衍生物的峰面积,计算相对标准偏差(relative standard deviation,RSD)。表2结果表明在室温贮存条件下,ACR、MGO、CRO、5-HMF、FOR、ACE的RSD均<5%,但MGO的RSD略高,总体在室温下24 h内稳定。而在4 ℃下,6种目标物的RSD均<2%,表明4 ℃条件下稳定性更好。
表2 稳定性实验结果(n=3) 单位:%
Table 2 Results of stability assay (n=3)
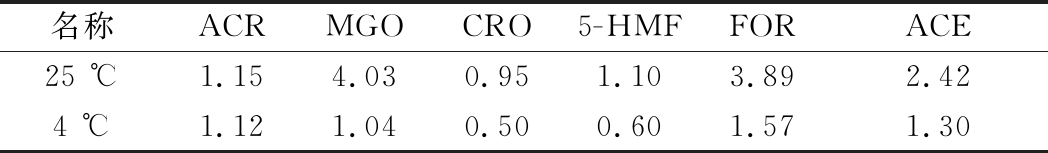
名称ACR MGOCRO 5-HMF FOR ACE25 ℃1.154.030.951.103.892.424 ℃1.121.040.500.601.571.30
2.2.3 加标回收率和精密度测定结果
向白酒样品中分别加入低、中、高3个浓度水平的混合标准溶液,混合均匀后将样品酒精度稀释至10%(体积分数),取3 mL按1.3.2.1方法处理,每个加标水平平行做6次实验,计算相应组分的加标回收率和RSD,结果见表3。6种RCS平均加标回收率为85.39%~105.78%,RSD均<4%,表明该方法精密度良好,准确度高。
表3 加标回收率和精密度结果(n=6)
Table 3 Results of average recoveries and precision (n=6)
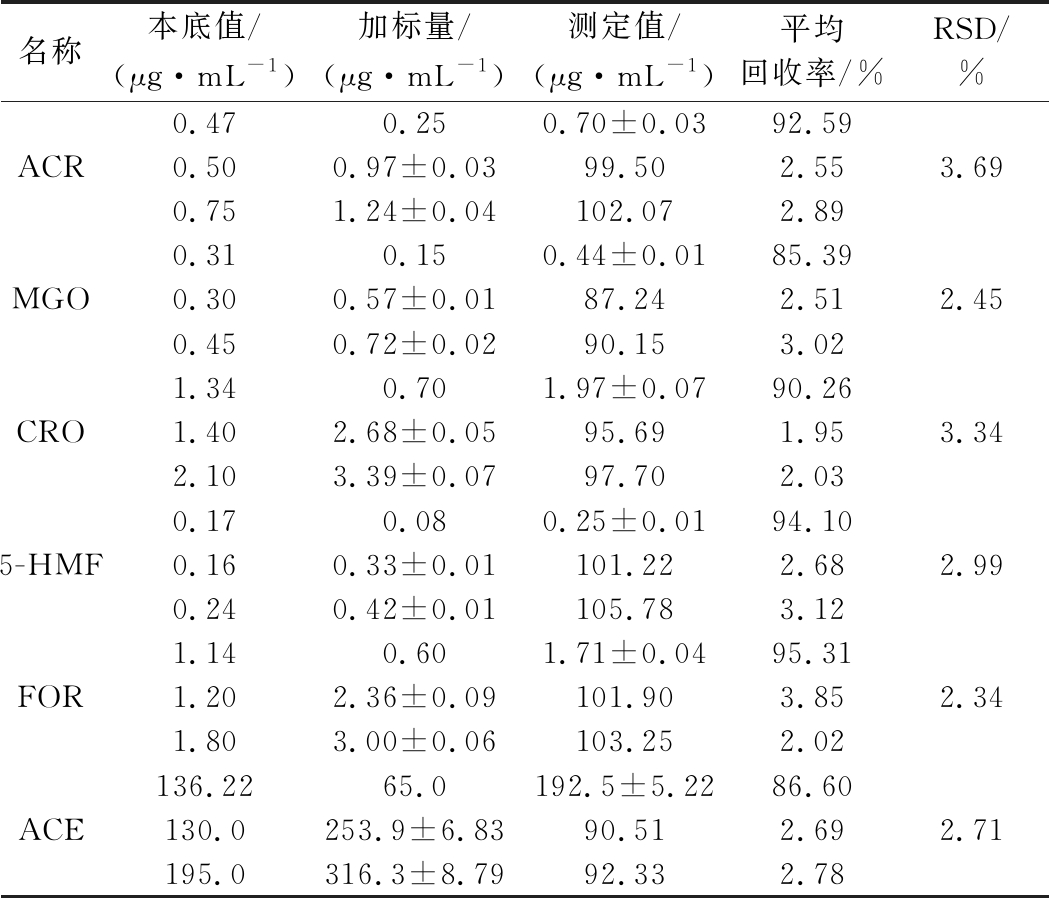
名称本底值/(μg·mL-1)加标量/(μg·mL-1)测定值/(μg·mL-1)平均回收率/%RSD/%0.470.250.70±0.0392.59ACR0.500.97±0.0399.502.553.690.751.24±0.04102.072.890.310.150.44±0.0185.39MGO0.300.57±0.0187.242.512.450.450.72±0.0290.153.021.340.701.97±0.0790.26CRO1.402.68±0.0595.691.953.342.103.39±0.0797.702.030.170.080.25±0.0194.105-HMF0.160.33±0.01101.222.682.990.240.42±0.01105.783.121.140.601.71±0.0495.31FOR1.202.36±0.09101.903.852.341.803.00±0.06103.252.02136.2265.0192.5±5.2286.60ACE130.0253.9±6.8390.512.692.71195.0316.3±8.7992.332.78
2.3 不同香型成品酒中RCS的含量解析
选取18种白酒样品进行测定,包括浓香、酱香、清香、凤香、芝麻香和兼香型6种香型。采用上述方法测定ACR、MGO、CRO、5-HMF、FOR和ACE含量。结果见表4,ACR含量为0.21~0.88 μg/mL,MGO含量为0~0.45 μg/mL,CRO含量为0.10~0.94 μg/mL,5-HMF含量为0.03~0.29 μg/mL,FOR含量为0.30~2.73 μg/mL,ACE含量为85.36~215.04 μg/mL。其中大部分样品中未检出MGO,检出部分MGO含量为0.31~0.45 μg/mL;此外所有样品中均含有85 μg/mL以上的ACE,平均含量高于伏特加(3 μg/mL)、朗姆酒(18 μg/mL)和威士忌(28 μg/mL)等国外蒸馏酒[27]。同时我们发现酱香型和芝麻香型白酒中ACR、MGO、FOR和ACE含量明显高于其他香型,芝麻香型和酱香型白酒均采用高温发酵工艺,尤其酱香型白酒生产遵循“四高两长”工艺,即高温制曲、高温堆积、高温发酵、高温馏酒,发酵周期长、贮存期长,高温处理明显加快美拉德反应、甘油脱水及糖分解等反应[1, 21],由此推测高温工艺是导致这2种香型白酒中有害RCS含量高于其他香型白酒原因之一。
表4 白酒中6种RCS的含量(n=3) 单位:μg/mL
Table 4 The content of 6 RCS in liquor(n=3)
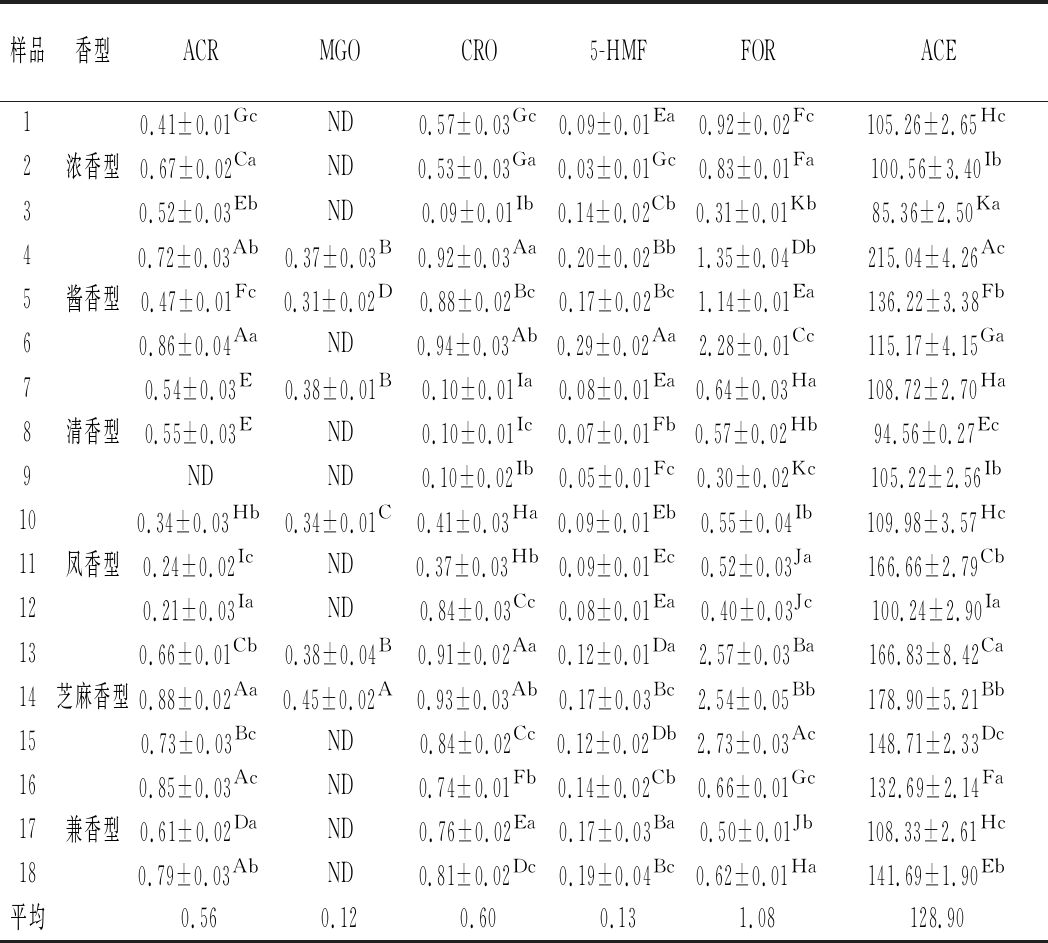
样品香型ACRMGOCRO5-HMFFORACE10.41±0.01GcND0.57±0.03Gc0.09±0.01Ea0.92±0.02Fc105.26±2.65Hc2浓香型0.67±0.02CaND0.53±0.03Ga0.03±0.01Gc0.83±0.01Fa100.56±3.40Ib30.52±0.03EbND0.09±0.01Ib0.14±0.02Cb0.31±0.01Kb85.36±2.50Ka40.72±0.03Ab0.37±0.03B0.92±0.03Aa0.20±0.02Bb1.35±0.04Db215.04±4.26Ac5酱香型0.47±0.01Fc0.31±0.02D0.88±0.02Bc0.17±0.02Bc1.14±0.01Ea136.22±3.38Fb60.86±0.04AaND0.94±0.03Ab0.29±0.02Aa2.28±0.01Cc115.17±4.15Ga70.54±0.03E0.38±0.01B0.10±0.01Ia0.08±0.01Ea0.64±0.03Ha108.72±2.70Ha8清香型0.55±0.03END0.10±0.01Ic0.07±0.01Fb0.57±0.02Hb94.56±0.27Ec9NDND0.10±0.02Ib0.05±0.01Fc0.30±0.02Kc105.22±2.56Ib100.34±0.03Hb0.34±0.01C0.41±0.03Ha0.09±0.01Eb0.55±0.04Ib109.98±3.57Hc11凤香型0.24±0.02IcND0.37±0.03Hb0.09±0.01Ec0.52±0.03Ja166.66±2.79Cb120.21±0.03IaND0.84±0.03Cc0.08±0.01Ea0.40±0.03Jc100.24±2.90Ia130.66±0.01Cb0.38±0.04B0.91±0.02Aa0.12±0.01Da2.57±0.03Ba166.83±8.42Ca14芝麻香型0.88±0.02Aa0.45±0.02A0.93±0.03Ab0.17±0.03Bc2.54±0.05Bb178.90±5.21Bb150.73±0.03BcND0.84±0.02Cc0.12±0.02Db2.73±0.03Ac148.71±2.33Dc160.85±0.03AcND0.74±0.01Fb0.14±0.02Cb0.66±0.01Gc132.69±2.14Fa17兼香型0.61±0.02DaND0.76±0.02Ea0.17±0.03Ba0.50±0.01Jb108.33±2.61Hc180.79±0.03AbND0.81±0.02Dc0.19±0.04Bc0.62±0.01Ha141.69±1.90Eb平均0.560.120.600.131.08128.90
注:ND,未检测到;采用Duncan′s 多重比较法进行显著性检验,不同小写字母代表相同香型不同酒之间差异性显著(P<0.05);不同大写字母代表18种样品之间差异性显著(P<0.05)
2.4 酱香型白酒多次取酒RCS的含量变化
酱香型白酒作为我国主体香型之一,占据较大消费市场,采用2次投料,8轮次发酵,7次取酒,“四高两长”工艺。由表4可知酱香型白酒中RCS含量最高,因此对2~7次取酒样品中RCS进行分析。由图2可知,不同次数所取酒样中RCS含量存在显著性差异。我们知道酿造完成取酒过程中,第3、4次取酒产量最高[31],第3、4、5次的酒口感、香气最佳。但是我们分析结果发现,除乙醛外,5种RCS总量最高的为第5次,总量为12.80 μg/mL;第4次与第5次无显著性差异,为12.49 μg/mL。在这些酒体样品中,乙醛含量远高于其他4种醛类。其中第3次取酒乙醛含量远高于其他取酒样品,推测随着发酵时间的延长,微生物发酵过程产生的RCS化合物含量存在增加趋势,到后期这些醛类随着取酒产量和酒体内容物含量的降低而降低。
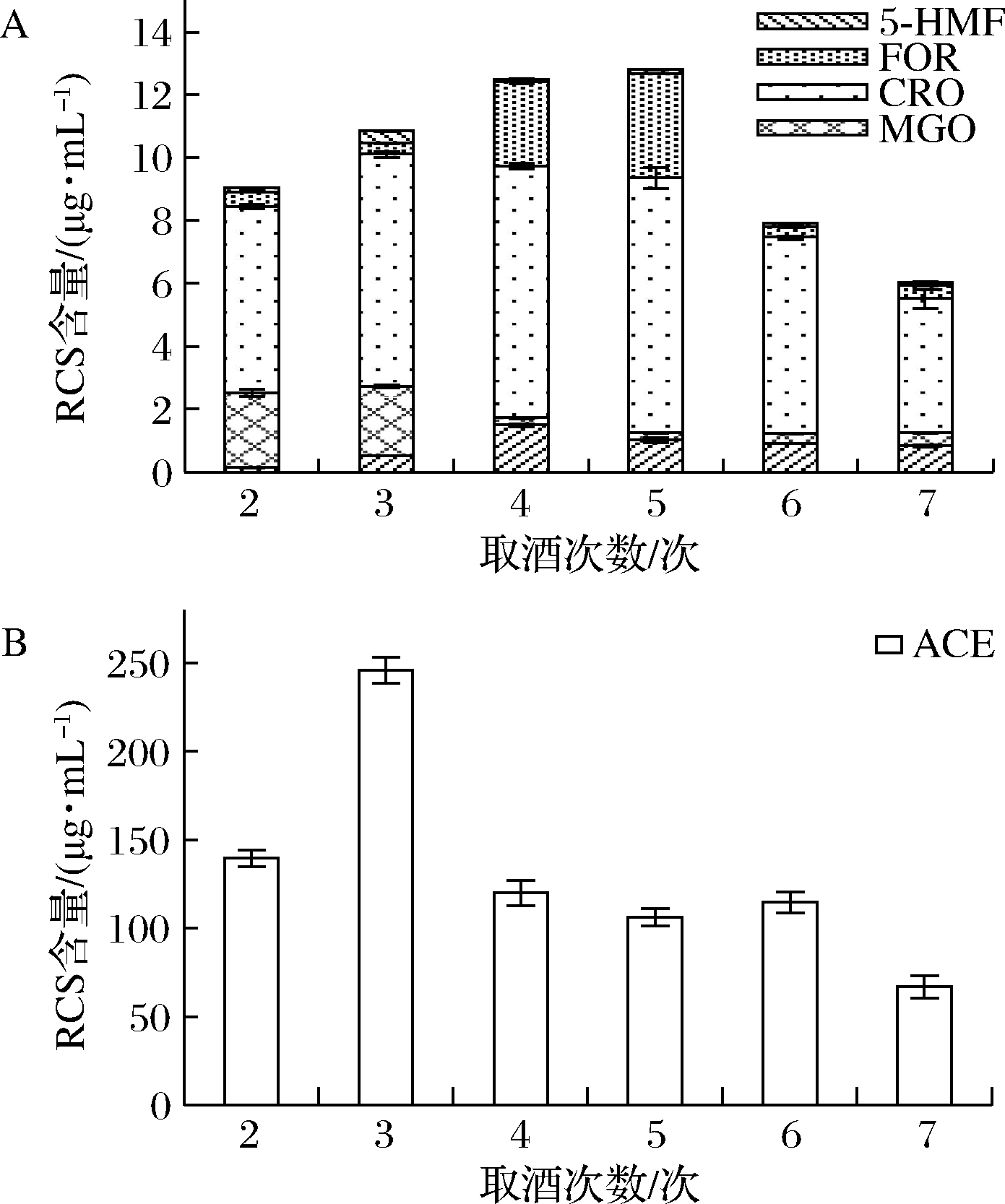
A-5-HMF、FOR、CRO、MGO含量;B-ACE含量
图2 酱香型白酒不同取酒次数对RCS含量的影响
Fig.2 The contents of RCS of different times in taking Maotai-flavor liquor
2.5 浓香型白酒不同加工阶段RCS的含量变化
在我国所有白酒香型酒中浓香型的产量最大,生产采用混蒸续粮固态发酵法,中偏高温发酵,采用“跑窖”、“原窖”、“老五甑”工艺;“两高一长三适当”(即入窖淀粉高,酸度高,长期发酵,适当的水分、温度和糠壳用量)。浓香型白酒在发酵结束开窖时,将大部分糟醅取出,在窖池底部留少部分糟醅进行再次发酵,经过2轮发酵期满的这部分酒醅,即称为“双轮发酵糟”,所酿出的酒为“双轮底发酵酒”,此为延长发酵期的一种工艺方法。为考察浓香型白酒加工过程中RCS产生的规律,对白酒加工不同阶段取样进行测定,前期固体样品包括:润料、入窖发酵前原料、出窖堆积原料;液体酒样品包括:发酵上层、发酵中层、发酵下层、双轮底酒样。结果见图3,固体原粮从润料到出窖堆积产生的RCS总量升到最高值,而液体发酵馏出酒液中双轮底样品RCS含量最高;其次是中层发酵酒样含量较高。推测其原因为出窖堆积过程中发生的美拉德反应导致RCS上升;而双轮底为2次发酵,中层酒样发酵也是发酵过程相对比较充分,使得两者产生的RCS较多。除含量最高的ACE之外,针对不同种类的RCS,上层酒样中MGO含量最高,中层酒样中CRO含量最高,双轮底样品中ACR、FOR和5-HMF最高。其原因有待进一步研究。另外,我们发现经润料后的酿酒原料,也含有一定量的RCS。

RS-润料样品;FS-入窖发酵前;DS-出窖堆积;UL-发酵
上层酒样品;ML-发酵中层酒样品;LL-发酵下层酒样品;SL-双轮底发酵酒样品;mg/kg-固体样品RS、FS、DS的单位;μg/mL-液体样品UL、ML、LL、SL的单位
A-ACR、MGO、CRO、FOR、5-HMF含量;B-ACE含量
图3 浓香型白酒各加工阶段RCS的含量
Fig.3 The contents of RCS in each processing stage in Luzhou-flavor liquor
3 结论
本研究建立了一种同时测定ACR、MGO、CRO、FOR、ACE的方法,以DNPH为衍生化试剂,在50 ℃条件下反应1.5 h,采用Beconsil C18色谱柱(250 mm×4.6 mm,5 μm),以纯水为流动相A,乙腈为流动相B,梯度洗脱,流速为1.0 mL/min,柱温40 ℃,二极管阵列检测器,检测波长360 nm(ACR、MGO、CRO、FOR、ACE)/400 nm(5-HMF)。各RCS的线性范围较宽,相关系数均在0.999以上,检出限1~8 ng/mL,定量限3~25 ng/mL,加标回收率为85.39%~105.78%,RSD均<4%,该方法准确度高,回收率好。对白酒成品样品和加工过程中原粮和发酵酒原液分析发现,酱香型和芝麻香型成品白酒的RCS物质明显高于其他香型,推测与其高温发酵工艺相关;酱香型白酒8轮发酵,7次取酒过程中,RCS总体含量最高的为第3、4和5次。浓香型白酒原料出窖堆积过程中产生的RCS升至最高,液体发酵酒原液中双轮底和中层发酵酒样品含量分列前2。由于白酒微生物发酵过程相当复杂,高温反应与发酵过程交织,活泼羰基化合物的形成机制还有待进一步研究。
[1] WANG L, CSALLANY A S, KERR B J, et al.Kinetics of forming aldehydes in frying oils and their distribution in French fries revealed by LC-MS-based chemometrics[J].J Agric Food Chem, 2016,64(19):3 881-3 889.
[2] VIEIRA S A, ZHANG G D, DECKER E A. Biological implications of lipid oxidation products[J].J Am Oil Chem Soc, 2017, 94:339-351.
[3] HELLWIG M, GENSBERGER-REIGL S, HENLE T, et al.Food-derived 1,2-dicarbonyl compounds and their role in diseases[J].Seminars in Cancer Biology, 2018, 49:1-8.
[4] AKO S, MARIKO U, MASASHI H, et al.Acrolein as a major volatile in the early stages of fish oil tag oxidation[J].Journal of Oleo Science,2018,67(5):515-524.
[5] HWANG S W,LEE Y M,AIDINI G, et al.Targeting reactive carbonyl species with natural sequestering agents[J].Molecules, 2016, 21(3):280.
[6] ELLIS E M.Reactive carbonyls and oxidative stress:Potential for therapeutic intervention [J].Pharmacology&Therapeutics, 2007, 115(1):13-24.
[7] MA H, JOHNSON S L,LIU W X, et al.Evaluation of polyphenol anthocyanin-enriched extracts of blackberry, black raspberry, blueberry, cranberry, red raspberry, and strawberry for free radical scavenging, reactive carbonyl species trapping, anti-glycation, anti-β-amyloid aggregation, and microglial neuroprotective effects[J].International Journal of Molecular Science, 2018, 19(2):461-467.
[8] 王睿. 多孔钙铝石块体材料的制备、掺杂及性能[D].杭州:浙江大学,2019.
WANG R.Preparation, doping and properties of porous calcium aluminum block materials [D].Hangzhou:Zhejiang University, 2019.
[9] 王珣,孙嘉彤.金属罐饮料的食品安全问题及保障措施[J].食品安全导刊,2019(21):55.
WANG X, SUN J T.Food safety problems and safeguard measures of metal can drinks [J].Food Safety Guide, 2019(21):55.
[10] 张秋, 范光森, 李秀婷.我国白酒质量安全现状浅析[J].中国酿造, 2016,35(11):15-20.
ZHANG Q, FAN G S, LI X T.Analysis of liquor quality and safety status in China [J].China Brewing, 2016,35(11):15-20.
[11] MOREIRA N, ARAUJO A M, ROGERSON F, et al.Development and optimization of a HS-SPME-GC-MS methodology to quantify volatile carbonyl compounds in Port wines [J].Food Chem, 2019, 270:518-526.
[12] LAGO L O, NICOLLI K P, MARQUES A B, et al.Influence of ripeness and maceration of the grapes on levels of furan and carbonyl compounds in wine-simultaneous quantitative determination and assessment of the exposure risk to these compounds [J].Food Chem, 2017, 230(3):594-603.
[13] QIN Y,SHIN J A,LEE K T.Determination of acetaldehyde, methanol and fusel oils in distilled liquors and sakès by headspace gas chromatography[J].2020, 29:331-337.
[14] GONZ LEZ-ROBLES L W,ESTARR
LEZ-ROBLES L W,ESTARR NESINOSA M,D
NESINOSA M,D AZMON-TA
AZMON-TA O D M.Fermentative capabilities and volatile compounds produced by Kloeckera/Hanseniaspora and Saccharomyces yeast strains in pure and mixed cultures during Agave tequilana juice fermentation[J].Antonie Van Leeuwenhoek, 2015, 108(3):525-536.
O D M.Fermentative capabilities and volatile compounds produced by Kloeckera/Hanseniaspora and Saccharomyces yeast strains in pure and mixed cultures during Agave tequilana juice fermentation[J].Antonie Van Leeuwenhoek, 2015, 108(3):525-536.
[15] PAIANO V, BIANCHI G, DAVOLI E, et al.Risk assessment for the Italian population of acetaldehyde in alcoholic and non-alcoholic beverages [J].Food Chem, 2014, 154(1):26-31.
[16] 范文来,王栋.近10年我国传统饮料酒白酒和黄酒品质安全研究现状与展望[J].食品安全质量检测学报,2019,10(15):4 811-4 829.
FAN W L, WANG D.Research status and prospect of quality and safety of Chinese traditional beverage liquor, liquor and yellow rice wine in recent 10 years [J].Journal of food safety and quality inspection, 2019,10 (15):4 811-4 829.
[17] 税丕容. 白酒中潜在有害物质的研究进展 [J].食品安全导刊, 2018(21):87.
SHUI P R.Research progress of potential harmful substances in liquor [J].Food Safety Guide, 2018(21):87.
[18] 张明赞, 何腊平, 张义明.白酒中甲醇、甲醛、氰化物和金属离子的研究进展 [J].食品安全质量检测学报, 2015,6(9):3 563-3 568.
ZHANG M Z, HE L P, ZHANG Y M.Research progress of methanol, formaldehyde, cyanide and metal ions in liquor [J].Journal of food safety and quality detection, 2015,6(9):3 563-3 568.
[19] 马荣山, 韩营, 王凤兰, 等.白酒酿造过程中塑化剂来源分析 [J].食品科学,2015,36(20):242-246.
MA R S, HAN Y, WANG F L, et al.Source analysis of plasticizer in liquor brewing [J].Food science, 2015,36 (20):242-246.
[20] 董占华. 陶瓷食品包装材料中重金属有害物的迁移试验与理论研究 [D].无锡:江南大学, 2015.
DONG Z H.Experimental and theoretical study on migration of heavy metals in ceramic food packaging materials [D].Wuxi:Jiangnan University, 2015.
[21] 艾欢秀. 白酒中有害物质的探讨 [J].酿酒, 2018,45(1):85-88.
AI H X.Discussion on harmful substances in liquor [J].Liquor making, 2018,45 (1):85-88.
[22] ZHU W Y, NIE Y, XU Y.The incidence and distribution of ochratoxin A in Daqu, a Chinese traditional fermentation starter[J].Food Control, 2017, 78:222-229.
[23] WENG X, CHON C H, JIANG H, et al.Rapid detection of formaldehyde concentration in food on a polydimethylsiloxane (PDMS) microfluidic chip [J].Food Chemistry,2008, 114(3):1 079-1 082.
[24] 胡文斌, 张少飞, 朱秀娟, 等.分光光度法测定几种食品中的甲醛 [J].农业灾害研究, 2020,10(1):111-112;121.
HU W B, ZHANG S F, ZHU X J, et al.Determination of formaldehyde in several foods by spectrophotometry [J].Agricultural disaster research, 2020, 10 (1):111-112;121.
[25] RIVERO R T, TOPIWALA V.Quantitative determination of formaldehyde in cosmetics using a combined solid-phase microextraction-isotope dilution mass spectrometry method [J].Journal of chromatography A, 2004, 1 029(1-2):217-222.
[26] MICHOUD V, SAUVAGE S, L ONARDIS T, et al.Field measurements of methylglyoxal using proton transfer reaction time-of-flight mass spectrometry and comparison to the DNPH-HPLC-UV method [J].Atmospheric Measurement Techniques, 2018, 11(10):5 729-5 740.
[27] 朱梦旭. 白酒中易挥发的有毒有害小分子醛及其结合态化合物研究 [D].无锡:江南大学, 2016.
ZHU M X.Study on volatile toxic and harmful small molecule aldehydes and their bound compounds in liquor [D].Wuxi:Jiangnan University, 2016.
[28] ZACHUT M, SHAPIRO F, SILANIKOVE N.Detecting ethanol and acetaldehyde by simple and ultrasensitive fluorimetric methods in compound foods [J].Food Chem, 2016, 201(1):270-274.
[29] UCHIYAMA S, INABA Y, KUNUGITA N.Derivatization of carbonyl compounds with 2,4-dinitrophenylhydrazine and their subsequent determination by high-performance liquid chromatography[J].Journal of chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2011, 879(17-18):1 282-1 289.
[30] ZHANG X Y,WANG C C,WANG L L,et al.Optimization and validation of a head space solid-phase microextraction-arrow gas chromatography-mass spectrometry method using central composite design for determination of aroma compounds in Chinese liquor (Baijiu)[J].Journal of Chromatography A,2020,1 610:460 584.
[31] 刘涛. 试论白酒的分类、生产工艺及其营养价值[J].酿酒, 2018, 45(3):21-22.
LIU T.Discussion on the classification, production technology and nutritional value of liquor [J].Liquor Making, 2018, 45 (3):21-22.