葡萄酒中酚类物质主要分为类黄酮类和非类黄酮类。类黄酮类主要包括黄酮醇类、黄烷醇类、花青素及其衍生物等;非类黄酮类主要是酚酸类化合物,包括羟基肉桂酸衍生物、羟基苯甲酸衍生物、芪类和一些挥发性酚等[1]。葡萄酒中酚类物质主要来源于果实和果梗[2],还来源于发酵或陈年过程中使用或添加的橡木制品[3],以及发酵过程中微生物的代谢产物[4]。酚类物质影响葡萄酒的颜色、香气和口感[5-6],是红葡萄酒风格和品质的重要指标。黄烷-3-醇类单体[7]是黄烷醇类的结构基础,葡萄酒的苦味主要与黄烷-3-醇单体的含量有关,单体的收敛性比寡聚物低[8]。原花青素属于原花色素类化合物,由黄烷-3-醇和黄烷-3,4-二醇聚合形成的缩合单宁[9](原花色素)是葡萄酒收敛性(涩感)的主要原因[10],对葡萄酒的苦味也有影响[11],天然形成的原花青素主要以B型为主,葡萄果皮中原花青素二聚体B1的浓度最高。大分子缩合单宁对口味几乎没有什么影响[12]。气相色谱质谱联用技术[13]、液相色谱[14]以及液相色谱质谱联用技术[15-19]能定性分析葡萄酒中酚类物质。国内外学者对用色谱法分析酚类物质的研究已经比较广泛,但是对与葡萄酒苦涩感相关的黄烷-3-醇类单体和二聚体酚类物质的定性定量研究较少。故本实验探讨了对葡萄酒苦涩味贡献比较大的5种黄烷-3-醇单体和原花青素B1、原花青素B2两种二聚体的定性定量方法。
本研究以宁夏贺兰山东麓葡萄酒产区的5个子产区(石嘴山市、银川市贺兰县、银川市西夏区、银川市永宁县、吴忠市)赤霞珠干红葡萄酒为研究对象,采用液-液萃取对酒样进行前处理,保留被检组分的同时尽量消除其他物质的干扰,减小基质效应,通过HPLC分析研究了影响葡萄酒苦涩感的7种酚类物质,所建立的方法成本低、检测时间短且各物质分离度好,为深入研究宁夏贺兰山东麓葡萄酒的风味物质提供参考依据。
1 材料与方法
1.1 材料与试剂
酒样:2016年宁夏贺兰山东麓产17款赤霞珠干红葡萄酒,酒样取自5个葡萄酒产区的17个葡萄酒庄。
试剂:乙酸(色谱纯)、乙腈(色谱纯)、乙酸乙酯(分析纯)。
标准品:儿茶素(catechin,C)、表儿茶素(epicatechin,EC)、表儿茶素没食子酸酯(epicatechin gallate,EcG)、表没食子儿茶素(epigallocatechin,EgC)、没食子儿茶素(gallocatechin,GC)、原花青素B1(procyanidin B1,PC B1)、原花青素B2(procyanidin B2,PC B2),纯度HPLC≥98%,上海源叶生物科技有限公司。
1.2 仪器与设备
2XZ(S)-2型旋片式真空泵,上海德英真空照明设备有限公司;RE-2000A旋转蒸发器,上海亚荣生化仪器厂;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;Shimadzu LC-20AD液相色谱仪(LC-20AD色谱泵、SPD-M20A紫外检测器、SIL-20A自动进样器),岛津仪器有限公司;platisil ODS色谱柱(250 mm×4.6 mm,5 μm),迪马科技公司;BT125D分析天平,北京赛多利斯科学仪器有限公司;SHZ-Ⅲ循环水真空泵,上海知信实验仪器技术有限公司。
1.3 实验方法
1.3.1 样品预处理
采用乙酸乙酯液-液萃取法。取10 mL酒样,用30 mL乙酸乙酯,萃取3次,收集有机相,旋转蒸发仪(25 ℃)浓缩至干,用10 mL色谱级甲醇溶解,-18 ℃避光保存,待液相分析。样品测定前经0.22 μm微孔滤膜过滤。
1.3.2 色谱条件
platisil ODS色谱柱(250 mm×4.6 mm,5 μm),紫外检测波长为280 nm,柱温30 ℃,进样量10 μL,流速1 mL/min。因所检测的7种酚类物质结构相似,为了实现有效分离,根据预实验的结果,如表1所示拟定3种不同的色谱条件。
表1 三种不同的色谱分析条件
Table 1 Three different chromatographic conditions

方法序号流动相A流动相B梯度洗脱程序1[20]V(水)∶V(乙酸)=98∶2乙腈0~10 min,5%B;10~15 min,5%~20%B;15~35 min,20%~40%B;35~50 min,40%~100%B;50~55 min,100%~5%B;55~60 min,5%B2[21]V(水)∶V(乙酸)=98∶2甲醇0~15 min,25%B;15~25 min,25%~50%B;25~35 min,50%~100%B;35~45 min,100%~25%B;45~50 min,25%B3V(水)∶V(乙酸)=98∶2乙腈0~10 min,10%B;10~15 min,10%~20%B;15~26 min,20~40%B;26~30 min,40%~100%B;30~35 min,100%~10%B;35~40 min,10%B
1.3.3 标准曲线的绘制
分别称取各酚类物质标准品5 mg于10 mL棕色容量瓶中,色谱级甲醇定容,得到500 mg/L单标溶液;精确称取7种酚类物质标准品5 mg,于10 mL棕色容量瓶中,色谱级甲醇定容,得到500 mg/L的混合标准品溶液,稀释成不同浓度梯度,-18 ℃保存。
2 结果与分析
2.1 HPLC色谱条件选择
分别对7种物质单标和混标进样分析,3种分析方法的色谱图如图1所示。方法1洗脱流程最长,并且各标准品出峰时间过于集中,表儿茶素没有得到较好的分离;方法2中没食子儿茶素和原花青素B1没有得到稳定分离,表没食子儿茶素和儿茶素没有得到稳定分离;方法3分离酚类物质所用时间最短,并且7种物质能得到有效分离且出峰时间稳定。所以确定方法3的分析方法用于测定葡萄酒中的酚类物质。
2.2 标准曲线的绘制
将混合标准品稀释成不同梯度,按照优化好的色谱条件进样分析,以峰面积为纵坐标,浓度为横坐标,建立标准曲线,各物质的含量与峰面积呈良好的线性关系,以信噪比3∶1时的相应浓度确定为检测限,见表2。
表2 各酚类物质的标准曲线,检测限和保留时间
Table 2 Standard curve, detection limits and remain time of 7 phenols
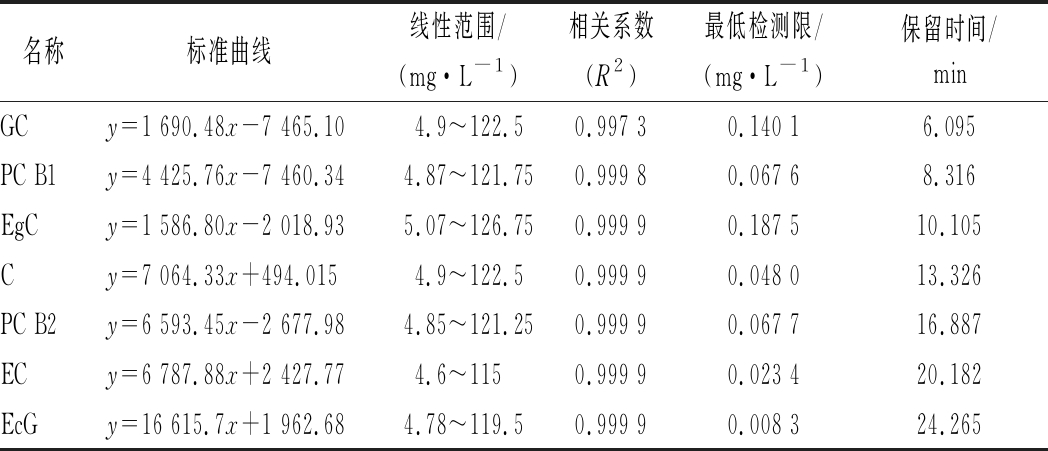
名称标准曲线线性范围/(mg·L-1)相关系数(R2)最低检测限/(mg·L-1)保留时间/minGCy=1 690.48x-7 465.104.9~122.50.997 30.140 16.095PC B1y=4 425.76x-7 460.344.87~121.750.999 80.067 68.316EgCy=1 586.80x-2 018.935.07~126.750.999 90.187 510.105Cy=7 064.33x+494.0154.9~122.50.999 90.048 013.326PC B2y=6 593.45x-2 677.984.85~121.250.999 90.067 716.887ECy=6 787.88x+2 427.774.6~1150.999 90.023 420.182EcGy=16 615.7x+1 962.684.78~119.50.999 90.008 324.265

a-方法1;b-方法2;c-方法3
图1 七种酚类物质标准品色谱图
Fig.1 Chromatogram of 7 phenols standards
注:1-GC;2-PC B1;3-EgC;4-C;5-PC B2;6-EC;7-EcG(下同)
2.3 加标回收率实验
向已知各酚类物质浓度的酒样中定量添加标准品,按上述方法液相分析,根据检测含量计算回收率,结果见表3。
表3 酚类物质加标回收率实验结果(n=3)
Table 3 Results of recovery experiment for several phenols(n=3)
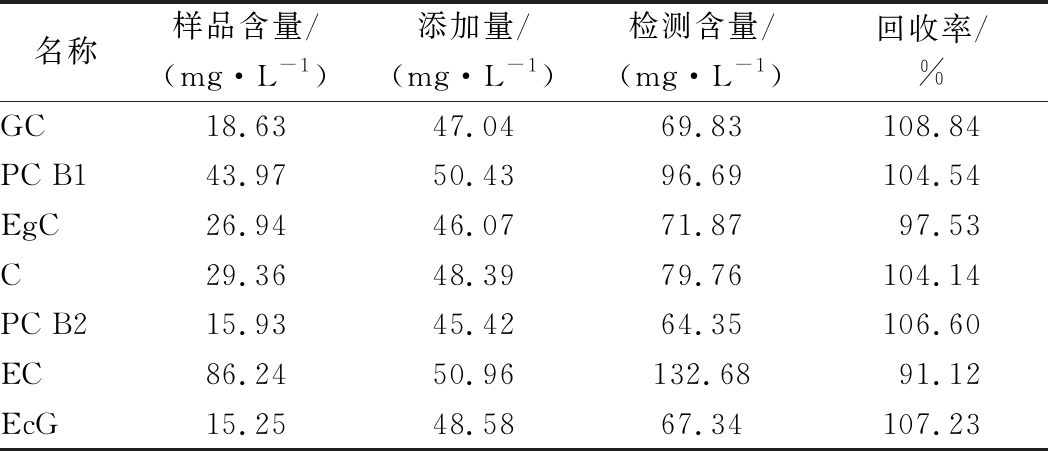
名称样品含量/(mg·L-1)添加量/(mg·L-1)检测含量/(mg·L-1)回收率/%GC18.6347.0469.83108.84PC B143.9750.4396.69104.54EgC26.9446.0771.8797.53C29.3648.3979.76104.14PC B215.9345.4264.35106.60EC86.2450.96132.6891.12EcG15.2548.5867.34107.23
2.4 稳定性实验
在上述色谱条件下,将同一标样和样品分别连续进样6次,记录其保留时间和峰面积。结果见表4,标准品和样品保留时间的相对标准偏差均在1%以内,峰面积的相对标准偏差均在4%以内,表明色谱工作稳定、重复性好。
表4 标准品和样品重复性实验结果(n=6)
Table 4 Results of repeatability for standards and sample determination(n=6)
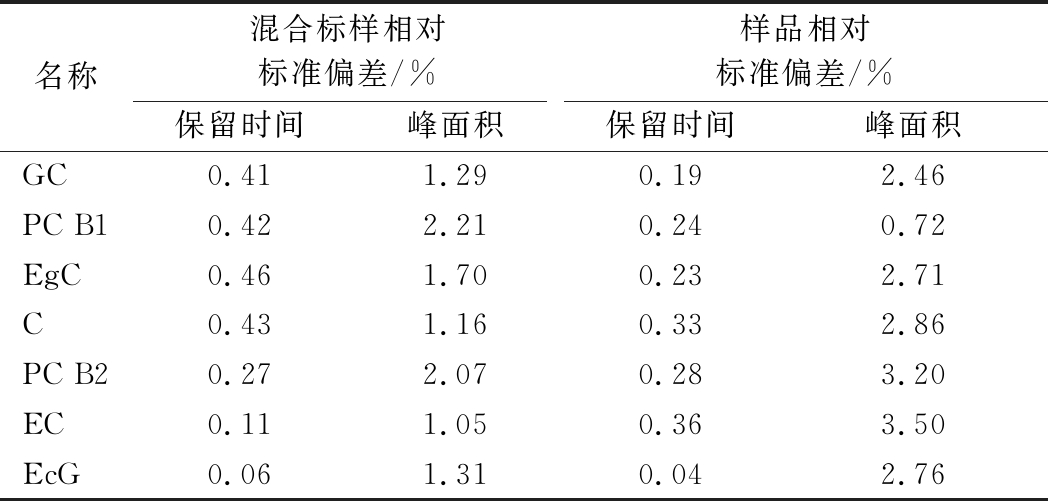
名称混合标样相对标准偏差/%样品相对标准偏差/%保留时间峰面积保留时间峰面积GC0.411.290.192.46PC B10.422.210.240.72EgC0.461.700.232.71C0.431.160.332.86PC B20.272.070.283.20EC0.111.050.363.50EcG0.061.310.042.76
2.5 酒样的测定
根据上述色谱条件,对采集的酒样进行测定,以贺东庄园(贺兰山东麓石嘴山产区)赤霞珠干红葡萄酒为例的色谱图见图2,各个酒样酚类物质含量见表5。由表5可知,酚类物质总量最高的是美御酒庄2016年开庄珍藏干红葡萄酒(237.528 mg/L),总量最少的是宝源大地酒庄鼎品红赤霞珠蓝钻干红葡萄酒(127.237 mg/L);圆润酒庄2015年珍藏赤霞珠干红葡萄酒、类人首2016年R1干红葡萄酒、汇达阳光2016年千红裕钻石级赤霞珠干红葡萄酒,酚类物质含量最高的是没食子儿茶素,其他酒样酚类物质含量最高的均为表儿茶素;除2016年嘉地酒园风信子干红葡萄酒、迦南美地干红葡萄酒、贺玉酒庄秘密花园赤霞珠干红葡萄酒、汇达阳光2016年千红裕钻石级赤霞珠干红葡萄酒、紫尚酒庄轮回蛇龙珠干红葡萄酒未检出表儿茶素没食子酸酯外,其他酒样均检出了7种酚类物质。经方差分析,宁夏贺兰山东麓不同子产区间葡萄酒的各种酚类物质的含量差异不显著(P>0.05)。
表5 宁夏贺兰山东麓不同产区葡萄酒酚类物质含量(n=3) 单位:mg/L
Table 5 Phenolic contents in 17 different wines(n=3)
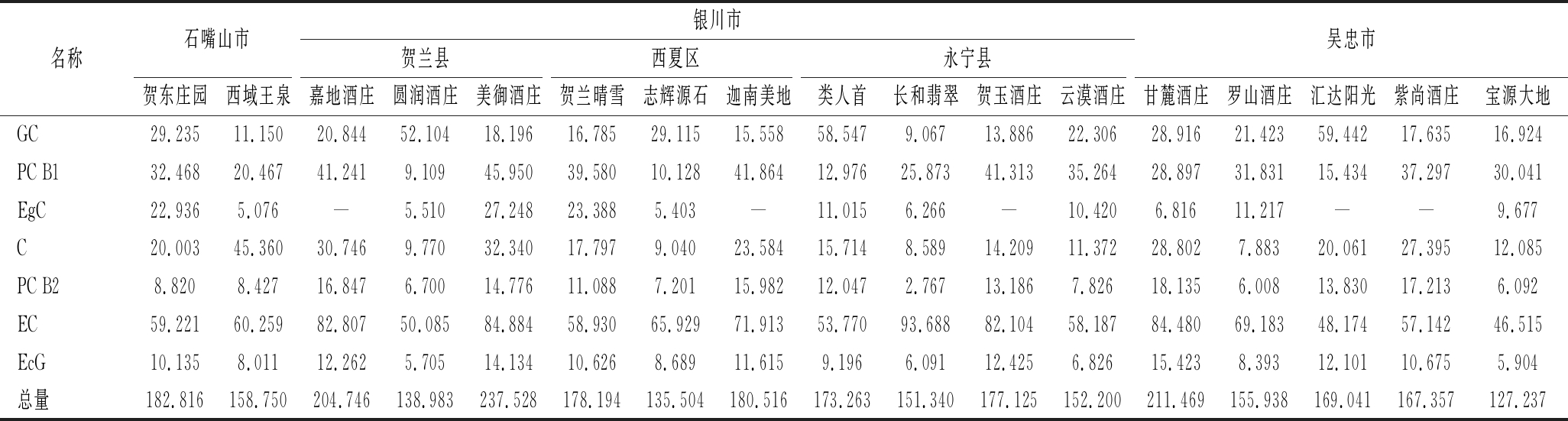
石嘴山市银川市吴忠市名称贺兰县西夏区永宁县贺东庄园西域王泉嘉地酒庄圆润酒庄美御酒庄贺兰晴雪志辉源石迦南美地类人首长和翡翠贺玉酒庄云漠酒庄甘麓酒庄罗山酒庄汇达阳光紫尚酒庄宝源大地GC29.23511.15020.84452.10418.19616.78529.11515.55858.5479.06713.88622.30628.91621.42359.44217.63516.924PC B132.46820.46741.2419.10945.95039.58010.12841.86412.97625.87341.31335.26428.89731.83115.43437.29730.041EgC22.9365.076—5.51027.24823.3885.403—11.0156.266—10.4206.81611.217——9.677C20.00345.36030.7469.77032.34017.7979.04023.58415.7148.58914.20911.37228.8027.88320.06127.39512.085PC B28.8208.42716.8476.70014.77611.0887.20115.98212.0472.76713.1867.82618.1356.00813.83017.2136.092EC59.22160.25982.80750.08584.88458.93065.92971.91353.77093.68882.10458.18784.48069.18348.17457.14246.515EcG10.1358.01112.2625.70514.13410.6268.68911.6159.1966.09112.4256.82615.4238.39312.10110.6755.904总量182.816158.750204.746138.983237.528178.194135.504180.516173.263151.340177.125152.200211.469155.938169.041167.357127.237
注:“-”代表未检出
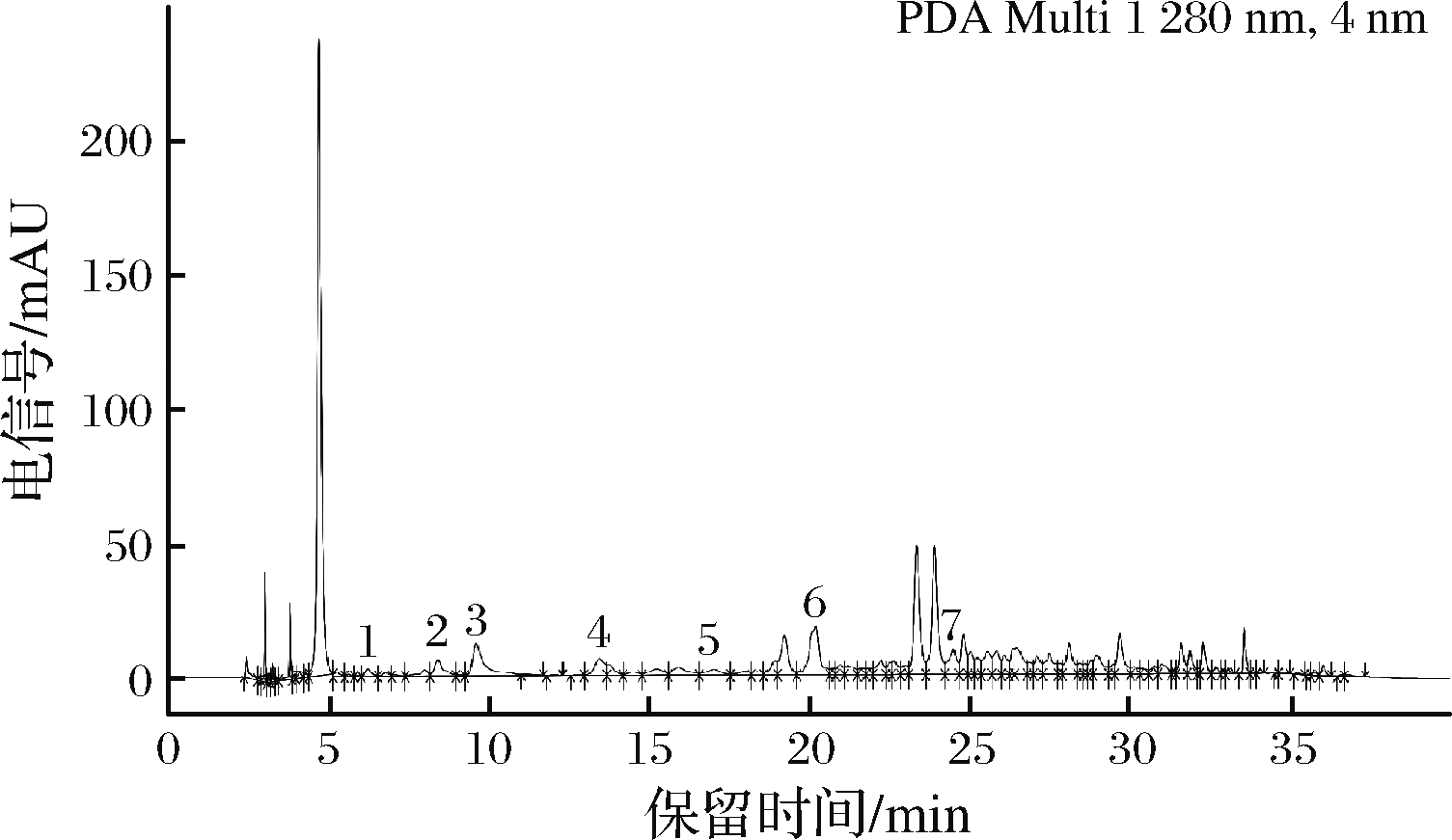
图2 葡萄酒样品色谱图
Fig.2 Chromatogram of wine sample
3 结论
本实验采用乙酸乙酯液-液萃取对酒样前处理,通过对流动相和洗脱程序的优化,确定了最佳检测条件,采用platisil ODS色谱柱(250 mm×4.6 mm,5 μm),流动相A为V(水)∶V(乙酸)=98∶2,流动相B为乙腈,梯度洗脱,流速1.0 mL/min,柱温30 ℃,检测波长280 nm,建立了1种同时分离5种黄烷-3-醇单体和2种原花青素二聚体的HPLC方法。
葡萄酒成分复杂,通过液-液萃取对酒样进行前处理,相比直接进样,可以有效分离和提取待测组分;相比固相萃取,操作简单,样品处理步骤少且提取效率高[22]。采用乙酸和乙腈为流动相,试剂容易获得,降低了实验成本,通过对色谱条件的优化,7种酚类物质在30 min内就能得到有效分离。
采用已建立的方法对宁夏贺兰山东麓葡萄酒产区不同子产区赤霞珠干红葡萄酒的酚类物质进行测定。结果显示黄烷-3-醇单体中,儿茶素和表儿茶素含量较高,并且有样品中未检出表儿茶素没食子酸酯,这与温鹏飞等[23]的研究结果相同。酒样儿茶素含量在7.883~45.360 mg/L,这与孙海燕[24]用超高效液相色谱对贺兰山东麓产区葡萄酒中儿茶素含量(9.01~29.49 mg/L)的检测结果相似。此外,采用该方法还同时实现了对2种原花青素二聚体的定量分析。结果表明,宁夏贺兰山东麓葡萄酒产区2016年不同酒庄生产的赤霞珠干红葡萄酒的酚类物质含量不同,但每种酚类物质在不同产区间的含量差异性不显著。
葡萄酒中酚类物质对于酒的品质至关重要,葡萄品种、产区因素、栽培管理方式、酿造工艺和陈年方法等都会影响葡萄酒中酚类物质的种类和含量。本研究只检测了产区内赤霞珠干红葡萄酒中部分酚类物质的含量,在今后的研究中,可考虑结合产区风土、葡萄栽培和酿造工艺,探究酚类物质的种类和含量的差异,以及对葡萄酒品质和口感的影响。
[1] 张欣珂, 赵旭, 成池芳, 等.葡萄酒中的酚类物质Ⅰ:种类, 结构及其检测方法研究进展[J].食品科学, 2019, 40(15):255-268.
ZHANG X K, ZHAO X, CHENG C F, et al.Phenolics in wines I:A review of categories, structures and detection methods[J].Food Science, 2019, 40(15):255-268.
[2] VERONIQUE C.Polyphenols in foods are more complex than often thought[J].American Journal of Clinical Nutrition, 2005, 81(1):223-229.
[3] JORDO A M, CORREIA A C.Relationship between antioxidant capacity, proanthocyanidin and anthocyanin content during grape maturation of Touriga Nacional and Tinta Roriz grape varieties[J].South African Journal for Enology and Viticulture, 2016, 33(2):214-224.
[4] ROJAS I B, SMITH P A, BARTOWSKY E J.Influence of choice of yeasts on volatile fermentation-derived compounds, colour and phenolics composition in Cabernet Sauvignon wine[J].World Journal of Microbiology and Biotechnology, 2012, 28:3 311-3 321.
[5] 史明科, 郭金英, 任国艳, 等.葡萄酒酚类物质研究进展[J].酿酒科技, 2012(4):17-20.
SHI M K, GUO J Y, REN G Y, et al.Research progress in phenolic compounds in grape wine[J].Liquor-Making Science and Technology, 2012(4):17-20.
[6] VILLAO D, FERNANDEZ-PACHON M S, MOYA M L, et al.Radical scavenging ability of polyphenolic compounds towards DPPH free radical[J].Talanta, 2007, 71(1):230-235.
[7] MONAGAS M, BARTOLOME B, GOMEZ-CORDOVES C.Updated knowledge about the presence of phenolic compounds in wine[J].Critical Reviews in Food Science and Nutrition, 2005, 45(2):85-118.
[8] 李超, 李辉, 孙佳莹, 等.多酚化合物单宁对葡萄酒口感影响的研究进展[J].北方园艺, 2017(4):182-186.
LI C, LI H, SUN J Y, et al.Investigation progress of the wine′s taste influenced by polyphenols and tannins[J].Northern Horticulture, 2017(4):182-186.
[9] 李蕊蕊, 赵新节, 孙玉霞.葡萄和葡萄酒中单宁的研究进展[J].食品与发酵工业, 2016, 42(4):260-265.
LI R R, ZHAO X J, SUN Y X.Research progress of tannin in grape and wine[J].Food and Fermentation Industries, 2016, 42(4):260-265.
[10] 谭立杭. 红葡萄酒中缩合单宁特性与感官收敛性的关系研究[D].杨凌:西北农林科技大学, 2019.
TAN L H.Relationship between condensed tannins properties and sensory astringency of wine[D].Yangling:Northwest Agriculture and Forestry University, 2019.
[11] LEA A G H.Bitterness and astringency:The procyanidins of fermented apple ciders[J].Developments in Food ence, 1990(25):123-143.
[12] 成宇峰. 葡萄与葡萄酒单体酚分析测定方法的研究[D].杨凌:西北农林科技大学, 2008.
CHENG Y F.Study on the method of determination of mono-phenol in grape berry and wine[D].Yangling:Northwest Agriculture and Forestry University, 2008.
[13] 栾天罡, 李攻科, 张展霞.固相微萃取-衍生化法与气相色谱-质谱联用分析葡萄酒中多酚类化合物[J].中山大学学报(自然科学版), 2001, 40(1):54-57.
LUAN T G, LI G K, ZHANG Z X.Analysis of polyphenols in wine by solid phase microextraction and derivatization combined with gas chromatography-mass spectrometry[J].Acta Scientiarum Naturalium Universitatis Sunyatseni, 2001, 40(1):54-57.
[14] 孙佳莹, 刘娟, 王宏, 等.HPLC法对贺兰山东麓干红葡萄酒中酚类物质的测定与分析[J].中外葡萄与葡萄酒, 2017, 2(6):30-38.
SUN J Y, LIU J, WANG H, et al.Determination and analyse of phenols in dry red wine from the eastern foot of Helan mountain by HPLC[J].Sino-Overseas Grapevine and Wine, 2017, 2(6):30-38.
[15] 宓捷波, 毕玉国, 赵孔祥, 等.葡萄酒中10种多酚类物质的高效液相色谱-四极杆/静电场轨道高分辨质谱测定方法研究[J].分析测试学报, 2015, 34(11):1 227-1 232.
MI J B, BI Y G, ZHAO K X, et al.Studies on determination of 10 polyphenols in wine by HPLC-quadrupole/electrostatic field orbitrap HRMS[J].Journal of Instrumental Analysis, 2015, 34(11):1 227-1 232.
[16] 张协光, 郑彦婕, 曾泳艇, 等.超高效液相色谱-线性离子阱/静电场轨道阱高分辨质谱直接分析葡萄酒中38种多酚类化合物[J].色谱, 2015, 33(6):583-589.
ZHANG X G, ZHENG Y J, ZENG Y T, et al.Direct analysis of 38 polyphenols in wine by ultra high performance liquid chromatography-linear ion trap/orbitrap high resolution mass spectrometry[J].Chinses Journal of Chromatography, 2015, 33(6):583-589.
[17] KENNEDY J A, JONES G P.Analysis of proanthocyanidin cleavage products following acid-catalysis in the presence of excess phloroglucinol[J].Journal of Agricultural and Food Chemistry, 2001, 49(4):1 740-1 746.
[18] KENNEDY J A, TAYLOR A W.Analysis of proanthocyanidins by high-performance gel permeation chromatography[J].Journal of Chromatography A, 2003, 995(1):99-107.
[19] 吕丽爽, 曹栋.薄层色谱法分离葡萄籽中的低聚原花青素[J].无锡轻工大学学报, 2001.20(1):65-67.
LYU L S, CAO D.Isolation of oligomeric proanthocyanidins from grape seed by TLC[J].Journal of Wuxi university of light industry, 2001.20(1):65-67.
[20] 成宇峰, 张振文, 岳泰新, 等.HPLC同时检测葡萄酒中10种单体酚的方法[J].食品科学, 2008, 29(4):287-290.
CHENG Y F, ZHANG Z W, YUE T X, et al.Study on simultaneous determination of 10 mono-phenols in wines by HPLC[J].Food Science, 2008, 29(4):287-290.
[21] 李永库, 李晓静, 欧小辉.固相萃取-高效液相色谱法同时测定葡萄酒中没食子酸等8种多酚类化合物[J].食品科学, 2008, 29(4):283-286.
LI Y K, LI X J, OU X H.Simultaneous analysis of eight phenolic compounds in wines by SPE-HPLC-PAD[J].Food Science, 2008, 29(4):283-286.
[22] MALOVANA S, MONTELONGO F J G, PEREZ J P, et al.Optimisation of sample preparation for the determination of trans-resveratrol and other polyphenolic compounds in wines by high performance liquid chromatography[J].Analytica Chimica Acta, 2001, 428(2):245-253.
[23] 温鹏飞, 陈建业, 黄卫东, 等.HPLC法同时测定葡萄酒中5种黄烷-3-醇单体的研究[J].中国食品学报, 2006, 6(3):133-137.
WEN P F, CHEN J Y, HUANG W D, et al.Simultaneous determination of 5 flavan-3-alcohol monomers in wine by HPLC[J].Journal of Chinese Institute of Food Science and Technology, 2006, 6(3):133-137.
[24] 孙海燕. 贺兰山东麓干红葡萄酒多酚组分与其抗氧化、抗癌活性的关联性研究[D].杨凌:西北农林科技大学, 2019.
SUN H Y. Study on antioxidant and anticancer activity of polyphenols in dry red wines from eastern foot of Helan mountain in Ningxia[D].Yangling:Northwest Agriculture and Forestry University, 2019.