金黄色葡萄球菌是医院和社区中最常见的病原菌之一[1],常存在于人体鼻腔和皮肤,其产生的毒素和侵袭性酶,可引起人类患上坏死性肺炎、菌血症等疾病[2]。不同部位分离出的耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)具有多样性和系统性的区别[3-4],能引起严重的皮肤及软组织感染[5-6]。金黄色葡萄球菌引起的食物中毒事件常发生于世界各国[7-8]。美国疾病控制中心报告,金黄色葡萄球菌引起的食源性感染仅次于大肠杆菌[9]。在中国20%~25%的细菌性食物毒事件是由金黄色葡萄球菌引起的,2002年—2015年学校食源性金黄色葡萄球菌疾病暴发食物中毒事件占9.58%[10-11]。总体上看国内外由金黄色葡萄球菌及其毒素引起的食物中毒事件的发生率在前4位左右。
食品中金黄色葡萄球菌的传统分离技术虽是“金标准”,但前增菌、平板分离、纯化鉴定等步骤耗时4~7 d,菌株分离判别大多借助于肉眼,主观性强、准确度和灵敏度较低[12],在应对突发性食品安全事件上,不能满足快速、准确、灵敏和特异性高等要求。在食品抽检方面,每年食品抽检数量巨大,部分食品采用三级采样方案,传统分离技术较难满足检验需求。鉴于食源性金黄色葡萄球菌感染的高风险性和严重性,建立特异性高、准确、快速的金黄色葡萄球菌检测方法具有重要意义。
1 传统检测方法
目前我国食品中金黄色葡萄球菌的传统检测方法为GB 4789.10—2016《金黄色葡萄球菌检测》,但标准中推荐的Baird-Parker琼脂平板不能检测出卵黄反应为阴性的金黄色葡萄球菌,部分菌株受食品基质、加工条件、稀释液温度等的影响,菌落外观可能较粗糙、质地较干燥,有出现漏检、误检的可能。姚贵哲等[13]利用传统检测方法与环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)快速检测方法,对动物食品中金黄色葡萄球菌的分离结果表明,前者的分离率较后者低25.8%。值得注意的是,王利刚等[14]将全自动荧光免疫分析仪(mini-VIDAS)和膜芯片法与传统检测方法进行比较发现,传统检测方法的特异性和灵敏性较高。因此,建议在GB 4789.10—2016《金黄色葡萄球菌检测》的基础上,参照2020年版《中国药典》将甘露醇氯化钠琼脂或显色培养基与Baird-Parker琼脂结合使用。
2 快速检测方法
2.1 生化检测(显色培养基)
显色培养基在致病菌的初筛和鉴定方面得到广泛应用,其基本原理是在分离培养基中加入人工合成的用于检测某些菌种的特异性酶底物,该底物由产色基团和微生物可代谢物质组成,通常为无色,目标微生物在培养基上选择性生长,其特征酶能够降解显色底物,产生有特殊颜色的代谢产物,使菌落呈现特定的颜色,非目标菌被抑制或显示其他颜色。
WANG等[15]开发的一种基于计算机视觉的选择性培养基和快速检测方法,对金黄色葡萄球菌的总分析时间为5 h。顾其芳等[16]发现,环凯金黄色葡萄球菌显色培养基和科马嘉金黄色葡萄球菌的灵敏性和特异性均高于Baird-Parker琼脂平板,对缓慢葡萄球菌、溶血葡萄球菌、着色葡萄球菌等的抑制能力较强。显色培养基在MRSA的分离方面也得到广泛应用[17-20];Brilliance MRSA 2和ChromID MRSA这两种选择性培养基对食源性MRSA的分离灵敏度>92%、特异性>89%,Brilliance MRSA 2对阳性菌株的确认率相对较低[18]。Brilliance MRSA 2用于检测肉鸡中MRSA时,优于MRSASelect和ChromID MRSA,且Brilliance MRSA 2琼脂的相对敏感性较高,但使用ChromID MRSA检测猪相关的MRSA时,其相对敏感性和相对特异性最高,这可能与样品中的假阳性和假阴性菌株数量、样品预培养时间以及培养基孵化时间的长短有一定关系[21]。不同MRSA显色琼脂出现假阳性的原因与样品中存在一定量凝固酶阴性葡萄球菌以及带有编码®-内酰胺抗性的mecA基因非金黄色葡萄球菌有必然关系[22-24]。同时不同厂家的显色培养基的最佳分离时间不同,ChromID MRSA琼脂培养48 h后敏感度最高,Colorex MRSA琼脂则只需要24 h[25];但没有一种显色培养基能够百分百的将目标菌分离出来,实际检测过程中可将显色培养基与其他仪器或与其他选择性培养基联合使用。
2.2 以免疫分析技术为基础的快速检测方法
2.2.1 酶联免疫技术(enzyme-linked immunosorbent assay, ELISA)
ELISA是免疫分析技术中应用最广泛的方法[26],基本原理是将抗原(或抗体)吸附于固相载体上并保持其免疫活性,再加入酶标抗体在载体上进行免疫酶染色,底物显色后,分析有色产物量即可确定样品中待测物质的含量,由于酶的催化效率很高,间接的放大了反应结果从而提高反应的敏感度。
将ELISA结合PCR技术检测牛奶中的金黄色葡萄球菌时,其检测敏感性为10 CFU/mL[27]。但ELSIA在金黄色葡萄球菌肠毒素、溶血素的检测中应用最广泛[28]。NOURI等[29]发现直接酶联免疫吸附法对牛奶中金黄色葡萄球菌肠毒素检测的准确性明显高于电泳法、高效液相色谱法、夹心酶联免疫吸附法。
2.2.2 酶联免疫荧光分析技术(enzyme-linked fluorescence immunoassay, ELFA)
ELFA是在ELISA的基础上建立起的一种高灵敏度、快速检测方法,其中其中酶联免疫荧光分析技术将酶放大技术、固相分离技术和荧光检测技术三者相结合, 是免疫荧光分析中最为灵敏的方法[30];原理是利用ELFA技术,包被了固相抗体的固相吸附器,将样品中目标菌的特异性抗原捕获,碱性磷酸酶标记的二抗再与目标菌的特异性抗原结合,二抗连接的碱性磷酸酶将底物水解,产生的磷酸-4-甲基伞型酮在370 nm下能够产生荧光,再将荧光强度与阈值相比较,大于阈值判定为阳性,反之为阴性[31]。
王利刚等[14]研究表明mini-VIDAS特异性、灵敏性和抗干扰性均表现良好,但对阴性样品的筛检率仅为80%,这可能与样品原料及样品制备过程中是否曾被金黄色葡萄球菌及其肠毒素污染有一定关系。食品样品中假阳性菌株产生的特异性抗原也可能与VIDAS的固相抗体相结合,造成假阳性结果。
2.3 以分子生物学为基础的快速检测方法
2.3.1 常规PCR技术
PCR技术即聚合酶链式反应,在DNA聚合酶催化下,以母链DNA为模板,以特定引物为延伸起点,通过高温变性、低温退火、中温延伸等步骤,体外复制与模板DNA互补子链DNA的过程。该技术在金黄色葡萄球菌的16S rDNA和耐热核酸酶(nuc)基因扩增方面得到广泛的应用[32-33]。SARAIVA 等[34]表明PCR技术是动物源性金黄色葡萄球菌鉴定的准确方法,其利用PCR技术扩增金黄色葡萄球菌的femA、nuc和coa基因的特异性均为100%,但coa基因的敏感度最低,同时扩增femA和nuc基因能明显提高敏感度。
在常规PCR技术的基础上建立的多重PCR技术,在食源性金黄色葡萄球菌的鉴定以及其耐药基因、肠毒素基因的检测中得到广泛应用;SAVARIRAJ等[33]、LI等[35]研究表明,利用多重PCR技术能够快捷、准确的分析猪肉源性金黄色葡萄球菌耐药性和肠毒素。
2.3.2 环介导等温扩增技术
LAMP技术是一种高特异性和灵敏度的DNA扩增方法,利用识别多区域特异性引物组和具有链置换活性的BstDNA聚合酶,在60~75 ℃等温条件下,1 h内能扩增出高达109拷贝的靶序列。使用的多区域特异性引物组,被称为“环引物”,可加快金黄色葡萄球菌的鉴定和更高的特异性。
基于nuc基因建立的LAMP技术能够在2 h内检出金黄色葡萄球菌,最低检测限为9×102 CFU/mL[36];但赵玥明等[37]的研究表明,基于nuc基因建立的LAMP技术对金黄色葡萄球菌纯菌最低检测限为2.01 CFU/mL,对肉中金黄色葡萄球菌的最低检测限为2.01×101 CFU/mL。出现检出限差异的原因可能是后者使用的Bst 2.0 WarmStart DNA聚合酶进行LAMP扩增,该酶是热启动酶,无需低温条件下配制反应体系,保证了酶催化反应的特异性,因此检测限更低。梁玉林等[38]利用反转录-环介导等温扩增技术(reverse transcription-LAMP,RT-LAMP)对nuc基因设计多组引物,在等温65 ℃条件下,30 min内完成RT-LAMP反应,对人工污染脱脂乳样品的检测中,金黄色葡萄球菌灵敏度达到230 CFU/g。
2.3.3 实时荧光定量PCR技术(real-time fluorescent quantitative PCR, RTQ-PCR)
荧光定量PCR技术融合了PCR技术的高灵敏性、DNA杂交的高特异性和光谱技术的高精确定量等优点,直接探测PCR过程中荧光信号的变化,以获得特定区段扩增产物定量的结果,不需要PCR后处理或电泳检测,完全闭管操作。其基本原理是基于荧光能量传递技术,通过受体发色团之间偶极-偶极相互作用,能量从供体发色基团转移到受体发色基团,受体荧光染料发射出的荧光信号强度与DNA产量成正比,检测PCR过程的荧光信号便可得知靶序列的初始浓度。
郭梦冉等[39]建立一种基于SYBR GreenⅡ染料的RTQ-PCR检测技术,对肉类和乳制品中金黄色葡萄菌的检测限分别为4.0×10和 3.5×10 CFU/mL,比普通PCR高出2~3个数量级;王晓[40]针对金黄色葡萄球菌nuc基因建立的多重实时荧光定量PCR技术,对冷冻蔬菜中金黄色葡萄球菌的最低检测限为104 CFU/mL。
2.4 基于蛋白质的检测方法(基质辅助激光解吸电离飞行时间质谱)
基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization-time of flight-mass spectrometry,MALDI-TOF-MS)被证明适用于常规细菌鉴定,实现了92%的种类的正确鉴定,该技术明显优于传统的生化鉴定,只需从琼脂平板上挑选细菌菌落,将它们涂抹到MALDI TOF靶板上,然后在检测器中快速分析,通过在参考菌株的数据库中搜索匹配度来识别[41]。在基质辅助激光解析的离子源部分,基质与样本形成共晶体后,从激光中吸收能量使样本解吸,基质与样本间发生电荷转移使得样本分子电离,在飞行时间质谱分析器部分,离子在电场作用下加速飞过管道,飞行时间与离子的质荷比成正比,根据到达检测器的飞行时间可测出质荷比,通过软件处理得到特征性的指纹图谱,其基本原理如图1所示。
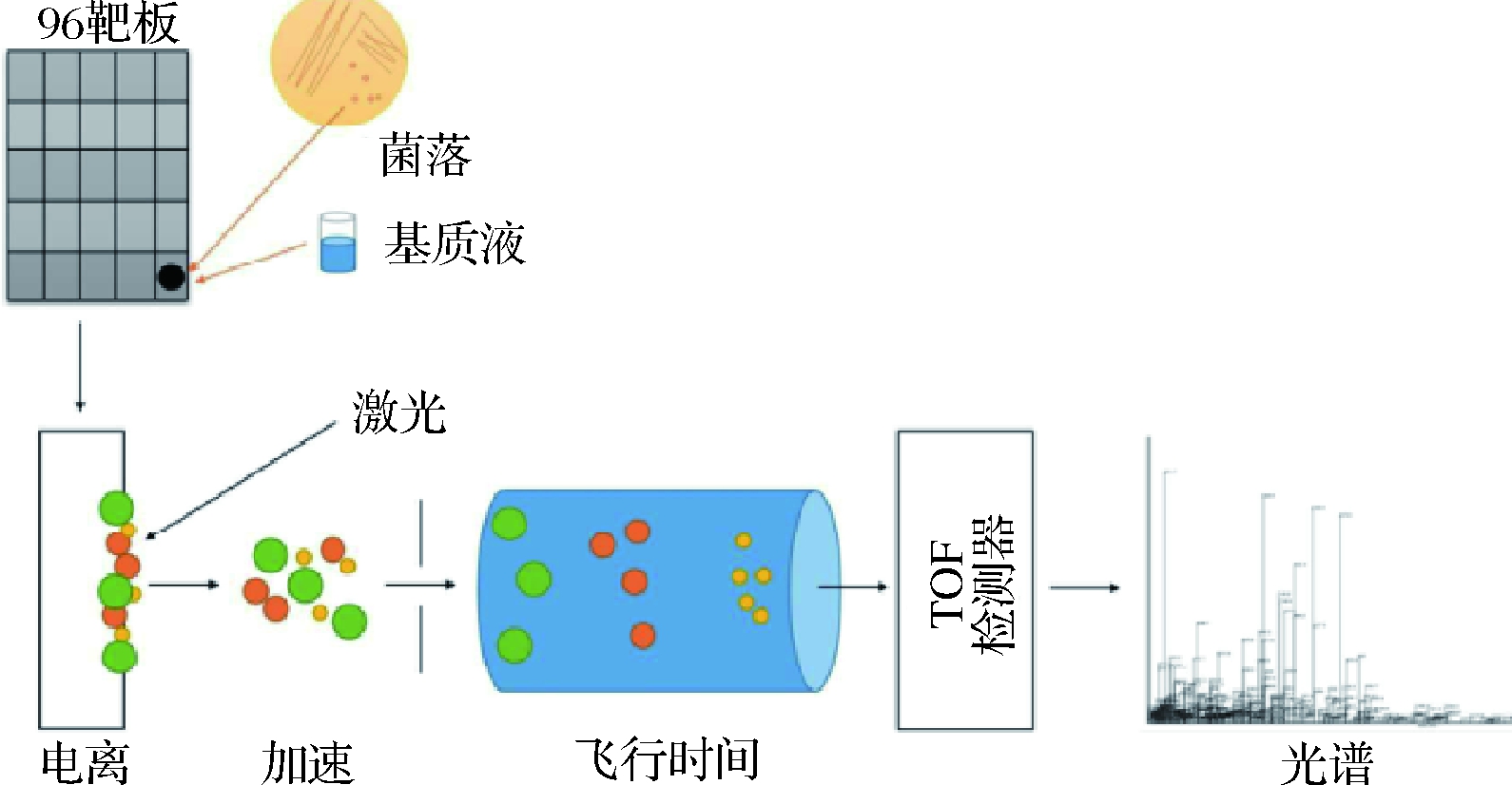
图1 MALDI-TOF-MS检测原理图
Fig.1 MALDI-TOF-MS detection principle diagram
BÖEHME等[42],张玲等[43]利用MALDI-TOF-MS鉴定出来自于乳品和人体的金黄色葡萄球菌,并利用MALDI-TOF-MS进行聚类分型,其构建的树形图和16S rDNA系统发育树一致性较高。该技术在MRSA菌株分离以及金黄色葡萄球菌肠毒素检测方面也有大量运用[44]。与传统生化试验相比,MALDI-TOF-MS能够更快捷的鉴定金黄色葡萄球菌[45]。
2.5 生物传感器在金黄色葡萄球菌检测方面的运用
生物传感器是一种分析装置,通过结合生物识别元件和生物材料一起产生可测量的信号,从而对目标物进行定性和定量,基本原理如图2所示[46]。

图2 生物传感器检测原理图
Fig.2 Schematic diagram of biosensor structure
RUBAB等[46]设计了一种纸基生物传感器,基本原理是基于金黄色葡萄球菌蛋白酶在特定多肽底物的蛋白水解活性,该底物夹在磁性纳米棒和纸载体上的金表面之间。将外磁体固定在传感器的背面,以加速磁性纳米棒-肽段在试样掉落时从传感器表面解离。用肉眼检测到磁性纳米棒部分解离引起的颜色变化,再用分析软件进行分析,以便进行定量测量,基本原理如图3所示。RUBAB等[46]实验结果表明,该生物传感器在纯肉汤培养中的检出限为7 CFU/mL,在食品中的检出限为40 CFU/mL,在环境样品中的检出限为100 CFU/mL,且只需要1 min即可得出结果,证明该传感器能够用于食源性金黄色葡萄球菌的快速检测。
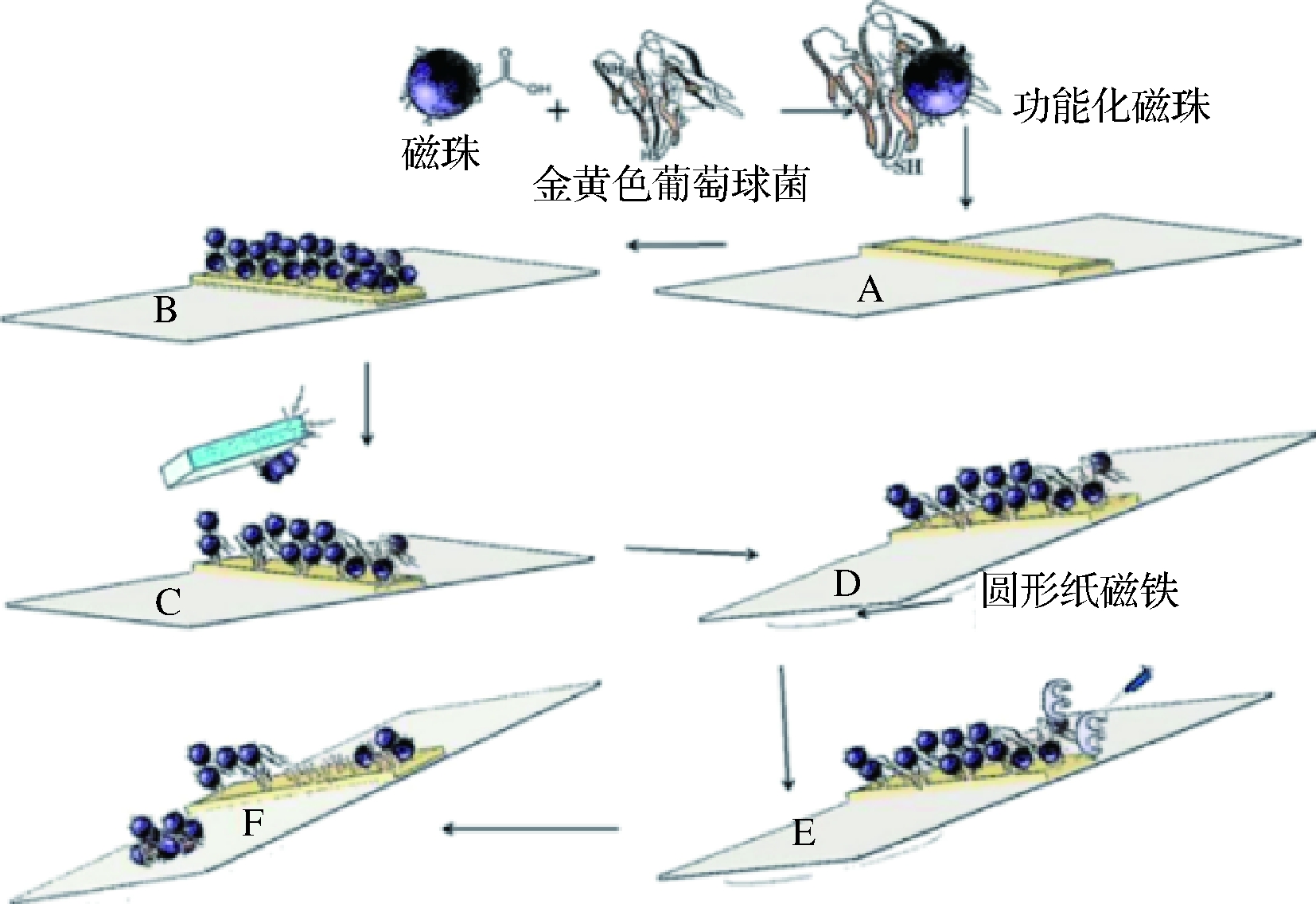
图3 纸基生物传感器检测原理图
Fig.3 Schematic diagram of paper-based biosensor
SUAIFAN等[47]设计了一种电化学DNA基因组生物传感器,其原理是用巯基和氨基修饰带有固定和捕获探针的基因组DNA生物传感器系统,作为与靶DNA的互补,采用多壁碳纳米管-壳聚糖-铋修饰玻碳电极,经固定化和杂交后,形成一个三明治(固定DNA-靶DNA-捕获DNA-铅纳米颗粒)结构,基本原理如图4。实验证明,该生物传感器对牛肉样品中金黄色葡萄球菌的检测限为1.23 ng/mL,且灵敏度高、响应速度较快。

图4 电化学DNA基因组生物传感器检测原理图
Fig.4 Schematic diagram of electrochemical DNA genomic biosensor
BHARDWAJ等[48]首次利用金属有机骨架(metal-organic framework,MOF)与噬菌体形成的复合物完成对金黄色葡萄球菌检测,该技术是基于噬菌体设计的一种新型生物传感器。基本原理是先将噬菌体与水、金属有机骨架(MOF)NH2-MIL-53(Fe)连接,然后以戊二醛为交联剂,使MOF与噬菌体偶联,MOF-噬菌体生物传感器基于光致发光猝灭现象,实现样品中金黄色葡萄球菌的高灵敏度检测;结果表明,该生物传感器对金黄色葡萄球菌的检测限为31 CFU/mL,检测范围为40~4×108 CFU/mL;值得注意的是,这种传感器的感官材料和识别探针都是微米级的颗粒,MOF作为一种纳米级荧光标记物材料,广泛运用于医疗、食品设备,稳定性、安全性高于以染料掺杂纳米粒子为接合材料设计的生物传感器,原理如图5。
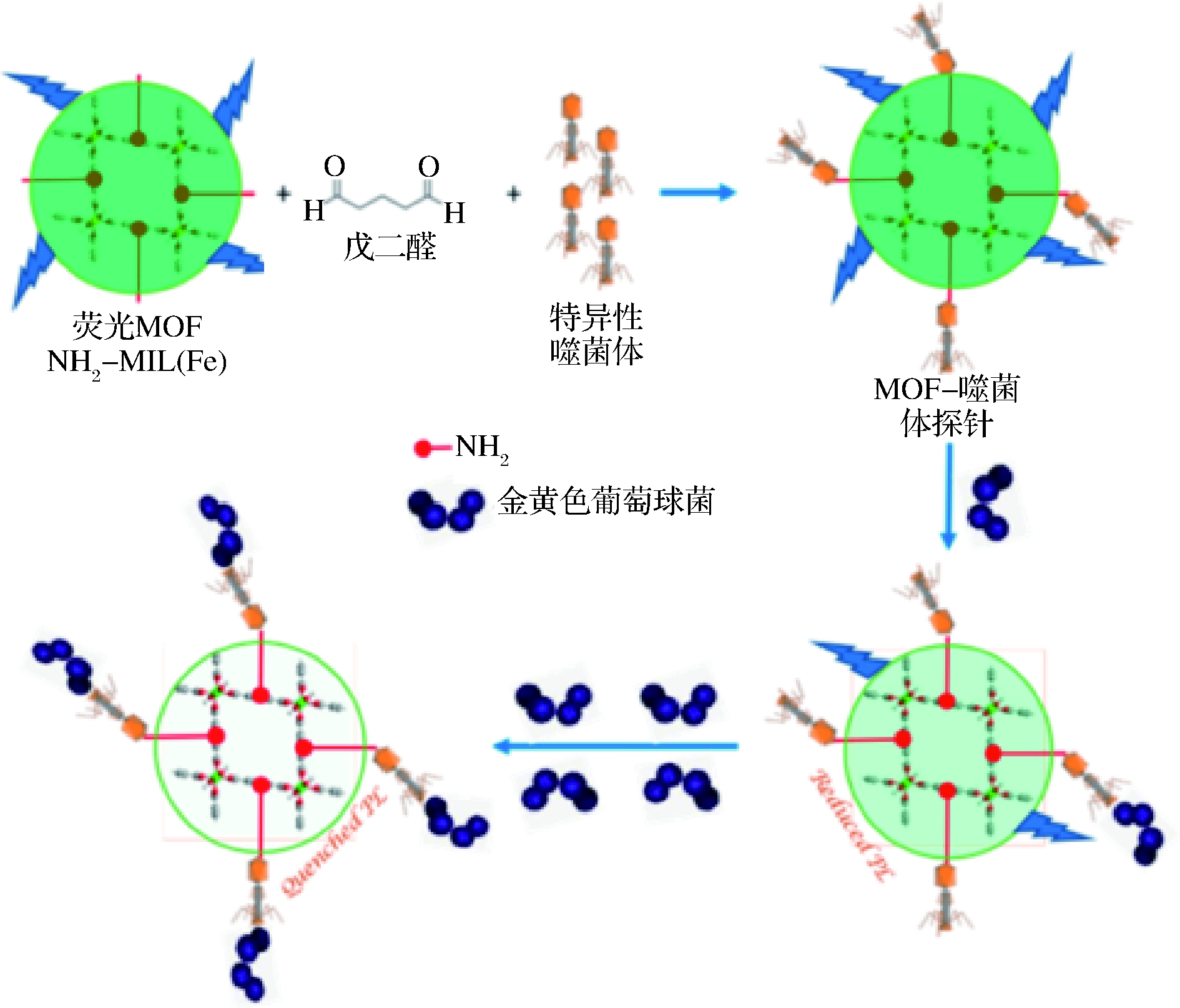
图5 MOF-噬菌体生物传感器检测原理图
Fig.5 Schematic diagram of MOF bacteriophage biosensor
3 结语
金黄色葡萄球菌在生鲜猪肉、冷冻食品、蛋糕、鸡肉等食品中时有检出,摄入被金黄色葡萄球菌及其肠毒素污染的食品会引起食物中毒;因此对食品中金黄色葡萄球菌的早期、快速检测显得尤为重要。近年来,金黄色葡萄球菌快速检测技术正在快速更新;国家标准对食源性金黄色葡萄球菌的检验周期较长,较难满足突发性食物中毒事件的检测需要,但该方法成本低,能够满足基层食品检测机构的需要;显色培养基操作方便,特异性强,但偶尔产生假阳性现象。以免疫学为基础的快速检测方法操作简单,检测成本低,没有同位素和放射性元素的污染,但会受食品基质以及非金黄色葡萄球菌产生抗原影响,商品化ELISA试剂盒只能检测金黄色葡萄球菌的传统肠毒素。以分子生物学为基础的检测方法操作较为简单,灵敏度高,但是引物的设计较为复杂。MALDI-TOF-MS的检测速度最快,功能最强大,但仪器成本也最贵,基层食品检测部门很难配备。生物传感器的种类较多,灵敏度高,检测速度快,但是对操作人员的专业知识要求也较高。总体上看,针对食源性金黄色葡萄球菌快速检测技术正在朝着快捷、高灵敏度、高特异性的方向发展。
[1] SILVA-SANTANA G, AGUIAR-ALVES F, LENZI-ALMEIDA K C, et al.Perfil patologico de infeccoes sistemicas por cepas de Staphylococcus aureus strains in a murine model[J].Journal of Applied Microbiology, 2020, 128(6):1 820-1 842.
[2] GONZALEZ C D, LEDO C, CELA E, et al.The good side of inflammation:Staphylococcus aureus proteins SpA and Sbi contribute to proper abscess formation and wound healing during skin and soft tissue infections[J].Biochimica et Biophysica Acta-Molecular Basis of Disease, 2019, 1 865(10):2 657-2 670.
[3] VALDERRAMA-BELTRAN S, GUALTERO S, ALVAREZ-MORENO C, et al.Risk factors associated with methicillin-resistant Staphylococcus aureus skin and soft tissue infections in hospitalized patients in Colombia[J].International Journal of Infectious Diseases, 2019, 87:60-66.
[4] ALBRECHT V S, LIMBAGO B M, MORAN G J, et al.Staphylococcus aureus colonization and strain type at various body sites among patients with a closed abscess and uninfected controls at us emergency departments[J].Journal of Clinical Microbiology, 2015, 53(11):3 478-3 484.
[5] DASA S, LINDEMANN C, YOUNG B C, et al.Natural mutations in a Staphylococcus aureus virulence regulator attenuate cytotoxicity but permit bacteremia and abscess formation[J].Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(22):3 101-3 110.
[6] WANNER S, SCHADE J, KEINHOERSTER D, et al.Wall teichoic acids mediate increased virulence in Staphylococcus aureus[J/OL].Nature Microbiology, 2017.DOI:10.1038/nmicrobiol.2016.257.
[7] GUMBO A, BANGURE D, GOMBE N T, et al.Staphylococcus aureus food poisoning among bulawayo city council employees, zimbabwe, 2014[J/OL].BMC Research Notes, 2015.DOI:10.1186/S13104-015-1490-4.
[8] LIMA G C, LOIKO M R, CASARIN L S, et al.Assessing the epidemiological data of Staphylococcus aureus food poisoning occurred in the State of Rio Grande do Sul, Southern Brazil[J].Brazilian Journal of Microbiology, 2013, 44(3):759-763.
[9] SHANGGUAN J, LI Y, HE D, et al.A combination of positive dielectrophoresis driven on-line enrichment and aptamer-fluorescent silica nanoparticle label for rapid and sensitive detection of[J].Analyst (London), 2015, 140(13):4 489-4 497.
[10] 马智杰, 王岗, 李向云, 等.中国2002—2015年学校食源性疾病暴发事件分析[J].中国公共卫生, 2016, 32(12):1 700-1 705.
MA Z J, WANG G, LI X Y, et al.Epidemiological characteristics of foodborne disease outbreaks in schools in China, 2002—2015[J].Chinese Journal of Public Health, 2016, 32(12):1 700-1 705.
[11] 付萍, 王连森, 陈江, 等.2015年中国大陆食源性疾病暴发事件监测资料分析[J].中国食品卫生杂志, 2019, 31(1):64-70.
FU P, WANG L S, CHEN J, et al.Analysis of foodborne disease outbreaks in China mainland in 2015[J].Chinese Journal of Food Hygiene, 2019, 31(1):64-70.
[12] 姜童童, 田桂杰, 李贤煜, 等.基于微生物快速鉴定系统对金黄色葡萄球菌耐药性鉴定新评估方法的建立[J].中国实验方剂学杂志, 2020, 26(10):128-135.
JIANG T T, TIAN G J, LI X Y, et al.Establishment of a new evaluation method for identification of drug resistance of Staphylococcus aureus based on rapid identification system of microorganisms[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(10):128-135.
[13] 姚贵哲, 王伟利, 夏明, 等.3种病原菌快速检测方法与国标检测方法比较[J].食品科技, 2018, 43(11):358-362.
YAO G Z, WANG W L, XIA M,et al.Comparison of fast detection and national standard test methods for three pathogenic bacterias[J].Food Science and Technology, 2018,43(11):358-362.
[14] 王利刚, 张磊, 张婧,等.国标培养法与2种金黄色葡萄球菌快速筛检方法的比较[J].食品安全质量检测学报, 2017, 8(1):238-242.
WANG L G,ZHANG L,ZHANG J,et al.Comparison of traditional culture method and 2 rapid screening methods for detection of Staphylococcus aureus[J].Journal of Food Safety and Quality, 2017, 8(1):238-242.
[15] WANG Y, YIN Y G, ZHANG C N.Selective cultivation and rapid detection of Staphylococcus aureus by computer vision[J].Journal of Food Science, 2014, 79(3):399-406.
[16] 顾其芳, 张红芝, 朱颖莹, 等.三种金黄色葡萄球菌选择性分离培养基的检测效果比较[J].上海预防医学, 2018, 30(1):69-73.
GU Q F,ZHANG H Z,ZHU Y Y,et al.Detection effects compared between three types of selective media for Staphylococcus aureus[J].Shanghai Journal of Preventive Medicine, 2018, 30(1):69-73.
[17] DUPIEUX C, KOLENDA C, LARSEN A R, et al.Variable performance of four commercial chromogenic media for detection of methicillin-resistant Staphylococcus aureus isolates harbouring mecC[J].International Journal of Antimicrobial Agents, 2017, 50(2):263-265.
[18] ARIZA-MIGUEL J, ONICIUC E, SANZ I, et al.Evaluation of two commercially available chromogenic media for confirmation of methicillin-resistant Staphylococcus aureus from human, animal, and food samples[J/OL].International Journal of Food Microbiology, 2015.DOI:10.1016/j.ijfoodmicro.2015.05.004.
[19] VAN VAERENBERGH K, CARTUYVELS R, COPPENS G, et al.Performance of a new chromogenic medium, BBL CHROMagar MRSA II (BD), for detection of methicillin-resistant staphylococcus aureus in screening samples[J].Journal of Clinical Microbiology, 2010, 48(4):1 450-1 451.
[20] KUMAR V A, STEFFY K, CHATTERJEE M, et al.Detection of oxacillin-susceptible mecA-positive Staphylococcus aureus isolates by use of chromogenic medium MRSA ID[J].Journal of Clinical Microbiology, 2013, 51(1):318-319.
[21] PLETINCKX L J, DEWULF J, DE BLEECKER Y, et al.Evaluation of different chromogenic media for the detection of methicillin-resistant Staphylococcus aureus CC398 in broilers[J].European Journal of Clinical Microbiology & Infectious Diseases, 2013, 32(8):1 023-1 026.
[22] KATAYAMA Y, ZHANG H, HONG D, et al.Jumping the barrier to beta-lactam resistance in Staphylococcus aureus[J].Journal of bacteriology, 2003, 185(18):5 465-5 472.
[23] COMPERNOLLE V, VERSCHRAEGEN G, CLAEYS G.Combined use of Pastorex Staph-Plus and either of two new chromogenic agars, MRSA ID and CHROMagar MRSA, for detection of methicillin-resistant Staphylococcus aureus[J].Journal of Clinical Microbiology, 2007, 45(1):154-158.
[24] KASSEM I I, ESSEILI M A, VON SIGLER.Occurrence of mecA in nonstaphylococcal pathogens in surface waters[J].Journal of Clinical Microbiology, 2008, 46(11):3 868-3 869.
[25] MORRIS K, WILSON C, WILCOX M H.Evaluation of chromogenic meticillin-resistant Staphylococcus aureus media:Sensitivity versus turnaround time[J].Journal of Hospital Infection, 2012, 81(1):20-24.
[26] 危梦, 晏宸然, 黄嘉玲, 等.猪肉中沙门氏菌污染情况及检测方法进展[J].农产品加工, 2019(23):64-66.
WEI M, YAN C R,HUANG J L,et al.Progress of Salmonella contamination and detection methods in pork[J].Farm Products Processing, 2019(23):64-66.
[27] 胡金强,雷俊婷,白艳红,等.食品中金黄色葡萄球菌PCR-ELISA检测技术建立[J].食品工业科技, 2016, 37(20):63-67.
HU J Q,LEI J T,BAI Y H,et al.Establishment of PCR-ELISA technology for Staphylococcus aureus in food[J].Science and Technology of Food Industry, 2016, 37(20):63-67.
[28] ZHENG Y, OUYANG X, HUANG W, et al.Establishment and evaluation of array-ELISA for detection of enterotoxins from Staphylococcus aureus[J].Chinese journal of cellular and molecular immunology, 2019, 35(8):695-701.
[29] NOURI A, AHARI H, SHAHBAZZADEH D.Designing a direct ELISA kit for the detection of Staphylococcus aureus enterotoxin A in raw milk samples[J].International Journal of Biological Macromolecules, 2018, 107:1 732-1 737.
[30] 宋丽萍, 姜洁, 李玮, 等.食源性致病菌快速检测技术研究进展[J].食品安全质量检测学报, 2015, 6(9):3 441-3 446.
SONG L P,JIANG J, LI W, et al.Research progress on rapid detection of foodborne bacterial pathogens[J].Journal of Food Safety and Quality, 2015, 6(9):3 441-3 446.
[31] 王似锦, 高春.VIDAS在保健食品沙门氏菌快速检测中的应用[J].食品安全质量检测学报, 2015, 6(2):677-681.
WANG S J,GAO C.Fast detection of Salmonella in health food by VIDAS method[J].Journal of Food Safety and Quality, 2015, 6(2):677-681.
[32] CASTRO R D, PEDROSO S H S P, SANDES S H C, et al.Virulence factors and antimicrobial resistance of Staphylococcus aureus isolated from the production process of Minas artisanal cheese from the region of Campo das Vertentes, Brazil[J].Journal of dairy science, 2020, 103(3):2 098-2 110.
[33] SAVARIRAJ W R, RAVINDRAN N B, KANNAN P, et al.Prevalence, antimicrobial susceptibility and virulence genes of Staphylococcus aureus isolated from pork meat in retail outlets in India[J].Journal of Food Safety, 2019,39:e125 891.
[34] SARAIVA M M, DE LEON C M, SANTOS S C, et al.Accuracy of PCR targeting different markers for Staphylococcus aureus identification:A comparative study using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry as the gold standard[J].Journal of Veterinary Diagnostic Investigation, 2018, 30(2):252-255.
[35] LI L, YE L, YU L, et al.Characterization of extended spectrum B-lactamase producing enterobacteria and methicillin-resistant Staphylococcus aureus isolated from raw pork and cooked pork products in South China[J].Journal of Food Science, 2016, 81(7):1 773-1 777.
[36] SHEET O H, GRABOWSKI N T, KLEIN G, et al.Development and validation of a loop mediated isothermal amplification (LAMP) assay for the detection of Staphylococcus aureus in bovine mastitis milk samples[J].Molecular and Cellular Probes, 2016, 30(5):320-325.
[37] 赵玥明, 满朝新, 曲艳艳, 等.环介导等温扩增技术快速检测肉中金黄色葡萄球菌[J].中国食物与营养, 2016, 22(1):57-61.
ZHAO Y M, MAN C X, QU Y Y, et al.Rapid detection of Staphylococcus aureus in raw meat samples by loop-mediated isothermal amplification[J].Food and Nutrition in China, 2016, 22(1):57-61.
[38] 梁玉林, 刘秀, 周振森, 等.基于反转录-环介导等温扩增技术检测金黄色葡萄球菌[J].食品与发酵工业, 2018, 44(1):217-223.
LIANG Y L, LIU X, ZHOU Z S, et al.Staphylococcus aureus detection by reverse transcription loop-mediated isothermal amplification[J].Food and Fermentation Industries, 2018, 44(1):217-223.
[39] 郭梦冉, 董兵,李聪, 等.荧光定量PCR检测金黄色葡萄球菌方法的建立及应用[J].河北农业大学学报, 2018,41(3):72-76.
GUO M R,DONG B,LI C, et al.Establishment and application of the real-time fluorescence-based quantitative PCR method for detection of Staphylococcus aureus[J].Journal of Agricultural University of Hebei, 2018, 41(3):72-76.
[40] 王晓. 多重实时荧光定量PCR同时检测冷冻蔬菜中4种食源性致病菌[J].食品安全质量检测学报, 2018, 9(22):5 917-5 921.
WANG X.Simultaneous determination of 4 kinds of foodborne pathogens in frozen vegetables by multiplex quantitative real-time PCR[J].Journal of Food Safety and Quality, 2018, 9(22):5 917-5 921.
[41] TONACINI J, STEPHAN D, VOGEL G, et al.Intact Staphylococcus enterotoxin SEB from culture supernatant detected by MALDI-TOF mass spectrometry[J].Toxins, 2019, 11(2):101.
[42] BÖEHME K, MORANDI S, CREMONESI P, et al.Characterization of Staphylococcus aureus strains isolated from Italian dairy products by MALDI-TOF mass fingerprinting[J].Electrophoresis, 2012, 33(15):2 355-2 364.
[43] 张玲, 常江, 吴俐勤, 等.生鲜牛乳中金黄色葡萄球菌的鉴定及耐药分子特征研究[J].中国预防兽医学报, 2019, 41(9):899-905.
ZHANG L, CHANG J, WU L Q, et al.Identification of Staphylococcus aureus from raw milk and study on the molecular characteristics of antimicrobial resistance[J].Chinese Journal of Preventive Veterinary Medicine, 2019, 41(9):899-905.
[44] OSTERGAARD C, HANSEN S G K, MOLLER J K.Rapid first-line discrimination of methicillin resistant Staphylococcus aureus strains using MALDI-TOF MS[J].International Journal of Medical Microbiology, 2015, 305(8):838-847.
[45] ZHU W, SIERADZKI K, ALBRECHT V, et al.Evaluation of the Biotyper MALDI-TOF MS system for identification of Staphylococcus species[J].Journal of Microbiological Methods, 2015, 117:14-17.
[46] RUBAB M, SHAHBAZ H M, OLAIMAT A N, et al.Biosensors for rapid and sensitive detection of Staphylococcus aureus in food[J].Biosensors & Bioelectronics, 2018, 105:49-57.
[47] SUAIFAN G A R Y, ALHOGAIL S, ZOUROB M.Rapid and low-cost biosensor for the detection of Staphylococcus aureus[J].Biosensors & Bioelectronics, 2017, 90:230-237.
[48] BHARDWAJ N, BHARDWAJ S K, MEHTA J, et al.MOF-bacteriophage biosensor for highly sensitive and specific detection of Staphylococcus aureus[J].Acs Applied Materials & Interfaces, 2017, 9(39):33 589-33 598.