茶叶是以山茶科植物茶(Camellia sinensis)的芽叶为原料制成的产品,在全世界有着非常悠久的药用和饮用历史,据陆羽《茶经》所载,饮茶“发乎于神农,闻于鲁周公,兴于唐,而盛于宋”。茶叶中含有丰富的功能活性物质,如茶多酚、茶多糖、咖啡碱和茶氨酸等[1],其中茶多酚是最主要的活性成分,也是茶叶深加工的主要产物。目前工业上生产茶多酚主要采用液液萃取工艺,即使用乙酸乙酯萃取茶叶水提液中的茶多酚,再通过水反萃取除去乙酸乙酯中夹带的咖啡碱以获得高纯度的茶多酚[2-3],因此萃余液中含有大量的咖啡碱和一些非酯型儿茶素类、酚酸类和缩酚酸类茶多酚,这几类茶多酚活性较低且分离纯化困难[4],萃余液常被作为废液排放。茶叶咖啡碱属于甲基黄嘌呤类生物碱,具有提神醒脑、利尿减肥、促进机体代谢、治疗新生儿呼吸暂停和协助镇痛等功效[5-6],被广泛应用于食品和医药等行业。此外,茶叶咖啡碱还具有良好的抗皮肤光老化、生热解脂和紫外线防护作用,因此常被添加到眼霜、防晒霜和洗面奶等日用护肤产品中,起到提亮肤色、消除眼部浮肿和减缓皮肤老化的效果[7-8]。为了有效合理地利用资源,为茶叶深加工企业增收,选择一种高效经济的方法提取纯化萃余液中的咖啡碱十分必要。
现阶段茶叶咖啡碱的纯化方法主要有溶剂萃取法、升华法、超临界流体萃取法和吸附分离法。溶剂萃取法通常选用毒性较大的氯仿作为萃取剂,咖啡碱得率较高,但对生产人员的健康具有较大危害,且容易带来二次污染;超临界萃取法提取效率高,对环境污染较小,但设备造价高昂,无法进行大规模的工业化生产;吸附分离法绿色安全,但分离效率低,溶剂使用量大[9-11]。升华法利用咖啡碱在100 ℃以上时易失去结晶水开始升华、温度达到178 ℃左右时快速升华的性质进行纯化,具有操作简单方便、工序少、所得咖啡碱纯度高等优点,适用于工业化生产[12],但现有报道主要集中于升华装置的改进,对升华工艺进行研究和优化的文章较少,而且传统的升华工艺通常使用氧化钙处理原料液,存在得率低、升华时间长和所得咖啡碱偏黄等缺点[13]。
胶原酶和弹性蛋白酶是基质金属蛋白酶家族中最重要的2种酶,主要由成纤维细胞合成分泌,能够降解皮肤中的胶原蛋白,和弹性蛋白导致皮肤老化[14],然而茶叶咖啡碱对胶原酶和弹性蛋白酶活性的影响鲜有报道。基于此,本研究以液液萃取技术提取茶多酚后的萃余液为原料,采用升华法提取纯化其中的咖啡碱,通过单因素和响应面实验优化升华工艺参数,并研究了所得茶叶咖啡碱对胶原酶和弹性蛋白酶活性的影响,以期实现萃余液中茶叶咖啡碱的高效提取,并为进一步促进其在护肤品等领域的开发利用奠定基础。
1 材料与方法
1.1 材料与仪器
绿茶由江苏瑾辉生物科技有限公司提供;胶原酶、三羟甲基氨基甲烷(Tris)、咖啡碱标准品、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),上海源叶生物科技有限公司;弹性蛋白酶,上海麦克林生化科技有限公司;N-[3-(2-呋喃基)丙烯酰基]-亮氨酸-甘氨酸-脯氨酸-丙氨酸{N-[3-(2-furyl)acryloyl]-Leu-Gly-Pro-Ala,FALGPA}、N-琥珀酰-丙氨酸-丙氨酸-丙氨酸-p-硝基苯胺(N-succinyl-Ala-Ala-Ala-p-nitroanilide,AAAPAN)、N-三(羟甲基)甲基甘氨酸(Tricine),美国Sigma公司;氧化钙、碳酸钠、碳酸钾、碳酸钙、乙酸钠、碳酸氢钠、氯化钠、氯化钙、柠檬酸、乙酸乙酯(均为分析纯),国药试剂有限公司。
DF-101S集热式磁力加热搅拌器,江苏省金坛市仪器厂;UV-2100紫外分光光度计,上海尤尼柯仪器有限公司;M5全波长酶标仪,美国Molecular Devices公司;HH-4数显搅拌水浴锅,常州赛普实验仪器厂;1525EF高效液相色谱仪,美国Waters公司。
1.2 试验方法
1.2.1 茶叶萃余液的制备
模拟工业化生产茶多酚的方法获得萃余液:将绿茶在105 ℃下鼓风干燥12 h,机械粉碎后过40目筛,取一定量过筛后的茶粉,在90 ℃的热水中回流浸提1 h,浸提后过滤,滤渣反复浸提2次,合并滤液后浓缩至固形物含量为8%左右,取适量浓缩液用等体积的乙酸乙酯通过三级错流萃取富集浓缩液中的茶多酚,再用等体积的蒸馏水通过三级错流反萃取除去乙酸乙酯中夹带的咖啡碱,将萃余液浓缩至固形物含量为5%后作为原料备用,参照张琪等[15]的实验方法通过高效液相色谱法测定浓缩后萃余液中咖啡碱的含量。
1.2.2 萃余液中咖啡碱的提取
采用升华法提取纯化萃余液中的咖啡碱:取40 mL浓缩后的萃余液于蒸发皿内,加入适量的前处理剂后用玻璃棒搅拌均匀,放入95 ℃的烘箱中烘干水分至固体状,将块状固体碾磨成粉末并均匀分散在蒸发皿底部,将蒸发皿放在油浴锅内的三角支架上,调整油面高度使蒸发皿内粉末均能稳定受热,在蒸发皿上方盖1张刺有许多小孔且孔刺向上的滤纸,将与蒸发皿口径相同的漏斗倒扣在滤纸上方,用棉花堵住漏斗颈部,设定油浴锅内的温度开始加热,一段时间后停止加热并冷却10 min,冷却后轻轻取下漏斗,将漏斗内壁与滤纸上的白色晶体用适量超纯水溶解,稀释至合适倍数后参照GB/T 8312—2013《茶 咖啡碱测定》,采用紫外分光光度法对咖啡碱含量进行测定,绘制咖啡碱标准曲线为A=0.049 8C+0.010 9,R2=0.999 1(A为吸光度,C为质量浓度,μg/mL),线性范围在0~12 μg/mL,按照公式(1)计算咖啡碱得率:
咖啡碱得率![]()
(1)
1.2.3 前处理剂筛选试验
采用1.2.2中方法提取萃余液中的咖啡碱,固定反应条件为升华温度200 ℃,升华时间30 min,前处理剂添加量与萃余液固形物的质量比为2.5∶1,考察不同前处理剂(氧化钙、碳酸钠、碳酸钾、碳酸钙、乙酸钠、碳酸氢钠、氯化钠)对咖啡碱得率的影响。
1.2.4 单因素试验
采用1.2.2中方法提取萃余液中的咖啡碱,固定反应条件为选择碳酸钠作为前处理剂,升华时间30 min,碳酸钠添加量与萃余液固形物的质量比为2.5∶1(碳固比),考察不同升华温度(180、190、200、210、220 ℃)对咖啡碱得率的影响;固定反应条件为选择碳酸钠作为前处理剂,升华温度200 ℃,碳固比2.5∶1,考察不同升华时间(10、20、30、40、50 min)对咖啡碱得率的影响;固定反应条件为选择碳酸钠作为前处理剂,升华温度200 ℃,升华时间30 min,考察不同碳固比(1∶1、1.5∶1、2∶1、2.5∶1、3∶1)对咖啡碱得率的影响。进行单因素试验,考察各因素变量对咖啡碱得率的影响。
1.2.5 响应面优化试验
根据单因素实验结果,选择升华温度、升华时间和碳固比为考察因素,咖啡碱得率为响应值,采用Design Expert软件进行3因素3水平的Box-Behnken中心组合实验设计,对升华法提取萃余液中咖啡碱的工艺条件进行优化,实验水平和编码见表1。
表1 响应面实验的因子水平和编码
Table 1 Factors and levels of response surface experiments

水平因素A(升华温度)/℃B(升华时间)/minC(碳固比)-1200101.5∶10210202∶11220302.5∶1
1.2.6 茶叶咖啡碱抑制胶原酶活性测定
胶原酶抑制试验按照SATYAVANI等[16]的方法进行,并稍作修改。配制含有400 mmol/L NaCl和10 mmol/L CaCl2的Tricine缓冲液(50 mmol/L、pH 7.5),利用Tricine缓冲液配制0.8 U/mL的胶原酶溶液和2 mmol/L的FALGPA溶液。将40 μL不同质量浓度的样品溶液与100 μL Tricine缓冲液混合后加入20 μL 0.8 U/mL的胶原酶溶液,混匀后于25 ℃恒温孵育15 min,再加入40 μL 2 mmol/L的FALGPA溶液,15 min后在335 nm处测定吸光度值,选用EGCG作为阳性对照,平行测定3次。保证混合体系中样品和EGCG的质量浓度梯度均为10、50、100、500、1 000 μg/mL。按照公式(2)计算样品对胶原酶的抑制率:
抑制率![]()
(2)
式中:A为不含样品的反应溶液的吸光度;B为不含样品和酶的反应溶液的吸光度;C为含有样品和酶的反应溶液的吸光度;D为不含酶的反应溶液的吸光度。
1.2.7 茶叶咖啡碱抑制弹性蛋白酶活性测定
参照NEMA等[17]的实验方法进行弹性蛋白酶的抑制实验,并稍作修改。取85 μL 50 mmol/L Tris-HCl缓冲液(pH 8.0)与15 μL不同质量浓度的样品溶液混合后加入25 μL弹性蛋白酶溶液(60 mU/mL),在25 ℃下孵育15 min,随后加入25 μL 1.015 mmol/L AAAPAN溶液,15 min后在410 nm处测定吸光度值,弹性蛋白酶溶液和AAAPAN溶液均用50 mmol/L Tris-HCl的缓冲液(pH 8.0)配制,以EGCG作为阳性对照,平行测定3次。保证混合体系中样品和EGCG的质量浓度梯度均为10、50、100、500、1 000 μg/mL。按照公式(2)计算样品对弹性蛋白酶的抑制率。
1.2.8 统计分析
实验数据采用SPSS 19.0和Design Expert 8.0软件进行统计分析,实验重复测试3次,数据结果以平均值±标准偏差的形式表示,采用Origin 8.0软件作图。
2 结果与分析
2.1 前处理剂筛选试验结果与分析
不同前处理剂对咖啡碱得率的影响如图1所示,其中使用碳酸钠和碳酸钾作为前处理剂时咖啡碱得率最大,分别达到57.21%和55.55%,而不使用前处理剂时咖啡碱得率仅15.3%,传统升华工艺中使用最多的氧化钙作为前处理剂时,咖啡碱得率为34.47%,远低于碳酸钠和碳酸钾,也低于碳酸氢钠和乙酸钠,但高于空白组。这表明萃余液在蒸发水分过程中,高浓度的咖啡碱会与萃余液中的其他物质以多种方式结合,如与没食子酸等酸类物质结合生成盐[12],与EGCG等多酚类物质形成络合物沉淀等[18],这些结合阻碍了咖啡碱的升华,而加入合适的前处理剂能避免咖啡碱与这些物质发生结合,因此提高了得率。使用碳酸钙作为前处理剂时,咖啡碱得率最低,仅为18.35%,与空白组相当,这是因为碳酸钙不溶于水,无法在萃余液中电离出碳酸根离子和钙离子,因此不能与萃余液中的其他物质反应。氧化钙与水反应后生成微溶于水的氢氧化钙,氢氧化钙只能电离出少量的钙离子和氢氧根离子,而且钙离子会促进咖啡碱与EGCG等多酚类物质形成沉淀[19],另外,氧化钙与水反应生成的氢氧化钙会夹杂在蒸干水分后的块状物内,这可能会对咖啡碱的升华产生一定的阻碍作用,因此导致咖啡碱得率偏低。选用氯化钠作为前处理剂时,咖啡碱得率较低,这是因为氯化钠呈中性,无法与萃余液中的酸性物质发生反应,高于空白组可能是钠离子在其中起到了一定的积极作用。而碳酸钠、碳酸钾、碳酸氢钠和乙酸钠均为强碱弱酸盐,不仅能与萃余液中的没食子酸等酸类物质反应生成盐,还能提高萃余液的pH值,使萃余液中的多酚类物质发生降解和氧化聚合反应,避免了与咖啡碱的结合,因此咖啡碱得率较高。4种前处理剂在水溶液中碱性大小顺序为碳酸钾>碳酸钠>碳酸氢钠>乙酸钠,这表明前处理剂在水溶液中的碱性越强,咖啡碱得率也越高,而碳酸钾得率低于碳酸钠可能是因为钾离子促进咖啡碱与EGCG形成沉淀的作用较强[19]。因此,相比于传统工艺中使用的氧化钙,使用碳酸钠作为前处理剂时能较大地提高咖啡碱得率,同时所得咖啡碱为白色针状晶体,品质较高。另外,碳酸钠作为一种常用的食品添加剂,具有绿色安全,经济节约的优点。

图1 不同前处理剂对咖啡碱得率的影响
Fig.1 Effect of different pretreatment agent on the yield of caffeine
注:不同小写字母代表具有显著性差异(P<0.05)
2.2 单因素试验结果与分析
由图2-a可知,升华温度为180~190 ℃时,咖啡碱得率随温度升高变化不明显,当温度达到190 ℃后,随着温度的升高,咖啡碱得率急剧上升,并在210 ℃时咖啡碱得率达到最大值,继续升高温度咖啡碱得率反而减低,这说明当升华温度达到210 ℃左右时,咖啡碱的升华速率已经达到了峰值,继续升高温度不仅会增加能耗,还可能使蒸发皿内的物质炭化影响咖啡碱的品质和得率。由图2-b可知,在其他升华条件一定的情况下,咖啡碱得率随着升华时间的增加而升高,但绝大部分咖啡碱在前20 min内升华出来,20 min 后仅有少量咖啡碱升华,继续增加升华时间对咖啡碱得率的提升较小,这表明咖啡碱的最佳升华时间在20 min左右。另外,当升华温度为200 ℃时,即使升华50 min,咖啡碱得率仍低于在210 ℃的温度下升华30 min,这可能是因为部分咖啡碱需要在较高温度才能被升华出来。由图2-c可知,随着碳固比的增加,咖啡碱得率也逐渐增加,当碳固比达到2∶1后,继续增加碳酸钠的添加量,其得率并无明显提升,而且当碳固比为3∶1时咖啡碱得率反而降低,这可能是因为部分未参加反应的碳酸钠蒸干水分后沉积在蒸发皿内阻碍了咖啡碱的升华。
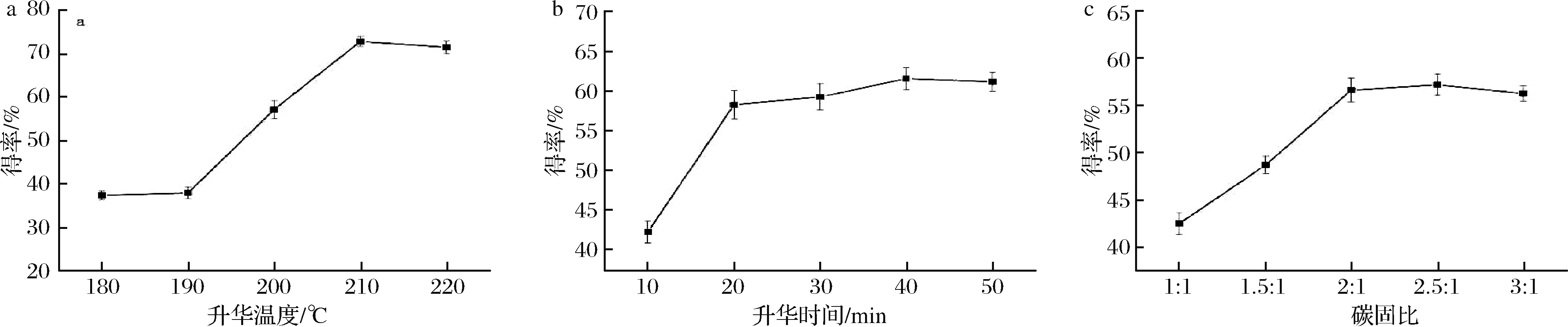
a-升华温度对得率的影响;b-升华时间对得率的影响;c-碳固比对得率的影响
图2 咖啡碱纯化工艺中升华温度、升华时间、碳固比对得率的影响
Fig.2 Effects of sublimation temperature, sublimation time and sodium carbonate-solid ratio on the yield of caffeine
2.3 升华工艺条件的优化
在单因素实验基础上,根据Box-Behnken中心组合实验设计原理,确定以升华温度(A)、升华时间(B)、碳固比(C)为基础设计3因素3水平共17 组响应面分析实验,实验方案设计及结果见表2。对咖啡碱得率与升华温度、升华时间和碳固比之间的关系进行回归分析,得到回归方程:Y = 71.21+5.36A+10.82B+0.85C+3.27AB-0.5AC+1.96BC-8.73A2-8.52B2-1.64C2,其中Y为咖啡碱得率的预测值。
表2 响应面试验方案及结果
Table 2 Response surface test plan and results and results

试验号A(升华温度)/℃B(升华时间)/minC(碳固比)咖啡碱得率/%1210301.5∶168.732210202∶172.833210202∶169.544210202∶173.175200201.5∶152.756220302∶172.147210102.5∶149.438210202∶170.369200302∶157.8410220201.5∶167.4211210101.5∶151.4312220202.5∶167.9113210202∶170.1314200102∶142.3115200202.5∶155.2416220102∶143.5217210302.5∶174.57
按此回归方程建立响应值的方差分析见表3。由表3可知,模型回归为极显著(P<0.000 1),失拟项不显著(P>0.05),说明该回归模型与实际的升华过程具有极高的拟合程度。相关系数 R2(0.985 1),调整决定系数![]() 变异系数(3.27%)较小,说明误差较小,未知因素对实验结果干扰较小,能准确预测实际情况。模型中的交互项AB的P值<0.05说明升华温度和升华时间交互作用对咖啡碱得率影响显著,二次项 A2和B2的P值均<0.000 1,说明这2个因素对咖啡碱得率影响极显著,根据F值大小可知,这3个因素对咖啡碱得率的影响主次顺序为:升华时间>升华温度>碳固比。
变异系数(3.27%)较小,说明误差较小,未知因素对实验结果干扰较小,能准确预测实际情况。模型中的交互项AB的P值<0.05说明升华温度和升华时间交互作用对咖啡碱得率影响显著,二次项 A2和B2的P值均<0.000 1,说明这2个因素对咖啡碱得率影响极显著,根据F值大小可知,这3个因素对咖啡碱得率的影响主次顺序为:升华时间>升华温度>碳固比。
表3 回归模型方差分析表
Table 3 Analysis of variance for the regression model
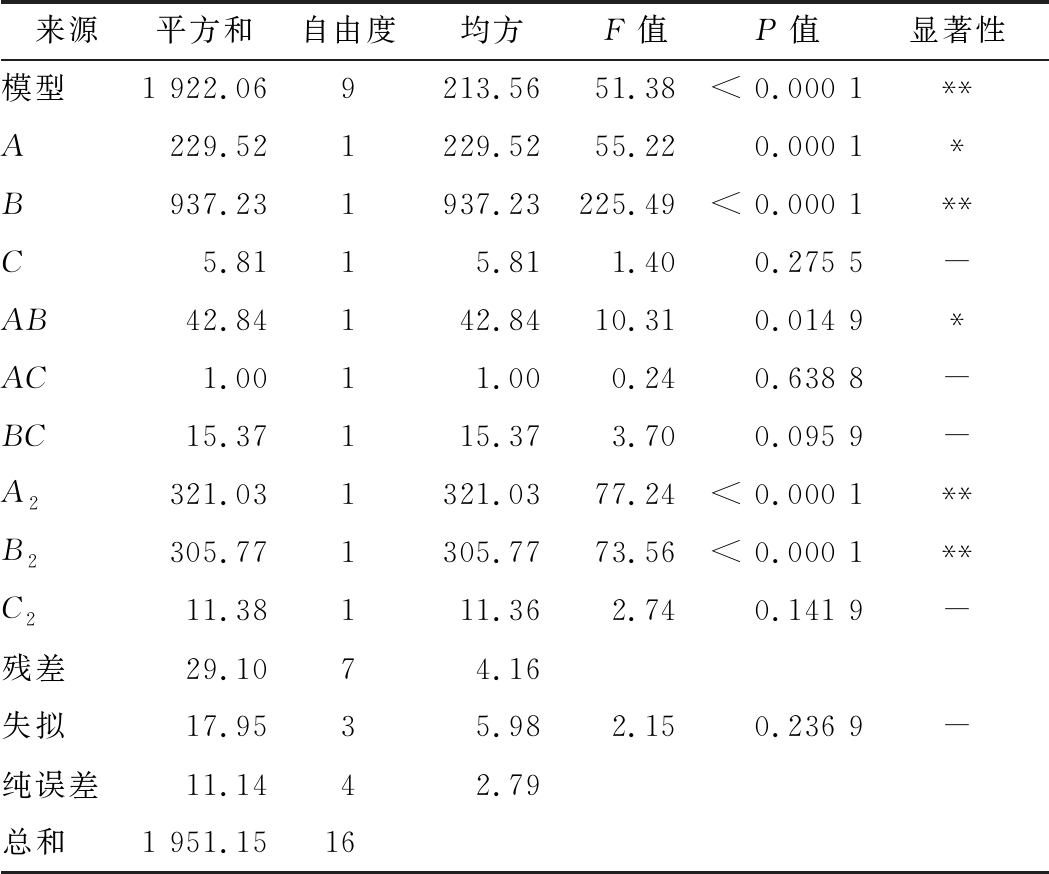
来源平方和自由度均方F值P值显著性模型1 922.069213.5651.38< 0.000 1**A229.521229.5255.220.000 1*B937.231937.23225.49< 0.000 1**C5.8115.811.400.275 5-AB42.84142.8410.310.014 9*AC1.0011.000.240.638 8-BC15.37115.373.700.095 9-A2321.031321.0377.24< 0.000 1**B2305.771305.7773.56< 0.000 1**C211.38111.362.740.141 9-残差29.1074.16失拟17.9535.982.150.236 9-纯误差11.1442.79总和1 951.1516
注:**表示差异极显著(P<0.000 1),*表示差异显著(P<0.05);-表示差异不显著(P>0.05)
使用Design-Expert软件对两两变量之间的交互作用进行分析,做出响应曲面图和等高线图,响应曲面图中坡度越陡峭,等高线图越趋近于椭圆形,则表明该交互作用越显著[20]。由图3分析可知,AB的响应曲面较陡峭,说明升华温度与升华时间的交互作用显著,AC和BC响应曲面比较平滑,说明升华温度与碳固比之间的交互作用及升华时间与碳固比之间的交互作用不显著,这与方差分析的结果一致。
利用Design-Expert软件分析计算出咖啡碱的最佳纯化工艺条件:升华温度214.34 ℃,升华时间27.96 min,碳固比2.33∶1,此时咖啡碱得率达到76.97%。为了验证模型的有效性,同时结合实际操作将最佳工艺条件调整为升华温度214 ℃,升华时间28 min,碳固比2.3∶1,在此工艺条件下进行3次平行实验,最终测得咖啡碱得率为76.21%,与预测值偏差较小,表明基于响应面法所得的咖啡碱纯化工艺参数准确可靠,具有实用价值。
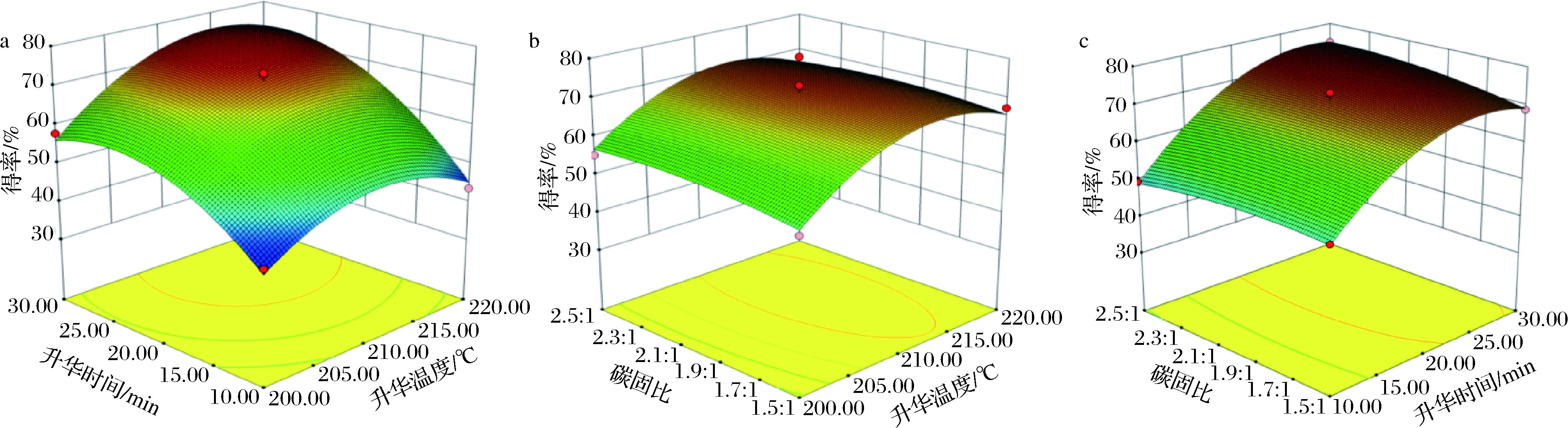
a-升华时间、升华温度交互作用;b-碳固比、升华温度交互作用;c-碳固比、升华时间交互作用
图3 各因素交互作用对咖啡碱得率的响应面图
Fig.3 Response surface plots showing the interactive effects of various factors on caffeine yield
2.4 茶叶咖啡碱对胶原酶和弹性蛋白酶活性的抑制作用
胶原酶和弹性蛋白酶不仅能够降解包括胶原蛋白和弹性蛋白在内的大部分胞外基质蛋白,还能激活其他基质金属蛋白酶活性,加速真皮层细胞外基质的降解,从而导致人类皮肤真皮层正常的结构和功能被严重损害,使皮肤产生明显的皱纹,失去弹性[21],因此抑制胶原酶和弹性蛋白酶的活性在一定程度上能起到减缓皮肤老化的功效。茶叶咖啡碱对胶原酶的抑制作用如图4所示,在10~1 000 μg/mL,随着咖啡碱质量浓度的增加,其对胶原酶的抑制作用逐渐增强,1 000 μg/mL的咖啡碱对胶原酶的抑制率达到46.72%,而阳性对照组EGCG在1 000 μg/mL时对胶原酶的抑制率为81.65%。
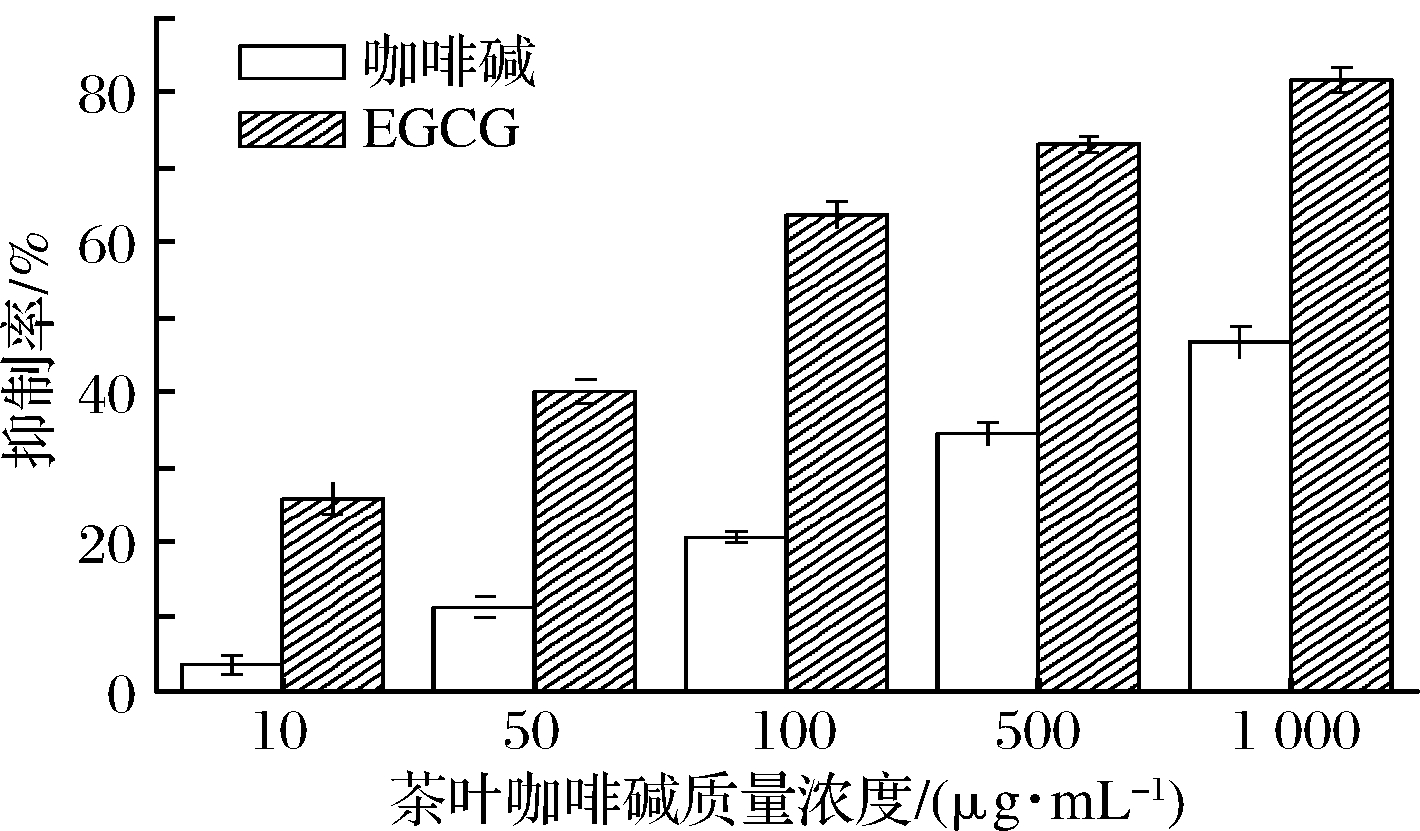
图4 不同浓度茶叶咖啡碱对胶原酶活性的抑制作用
Fig.4 Inhibitory effect of different concentrations of tea caffeine on collagenase activity
茶叶咖啡碱对弹性蛋白酶的抑制作用如图5所示,茶叶咖啡碱对弹性蛋白酶的抑制作用与质量浓度呈正相关,但在相同质量浓度下咖啡碱对弹性蛋白酶的抑制作用低于对胶原酶的抑制作用,质量浓度为1 000、10 μg/mL的咖啡碱对弹性蛋白酶的抑制率分别为38.43%和3.42%,而EGCG则表现出显著的抑制能力,1 000、10 μg/mL的EGCG对弹性蛋白酶的抑制率分别为80.23%和14.15%。实验表明茶叶咖啡碱对胶原酶和弹性蛋白酶具有良好的抑制作用,且呈现出明显的浓度依赖性,虽然抑制作用低于阳性对照组EGCG,但咖啡碱的体外稳定性远高于EGCG[22],因此适宜浓度的咖啡碱有潜力用于护肤品中作为胶原酶和弹性蛋白酶的天然抑制剂,起到减缓皮肤老化的效果。
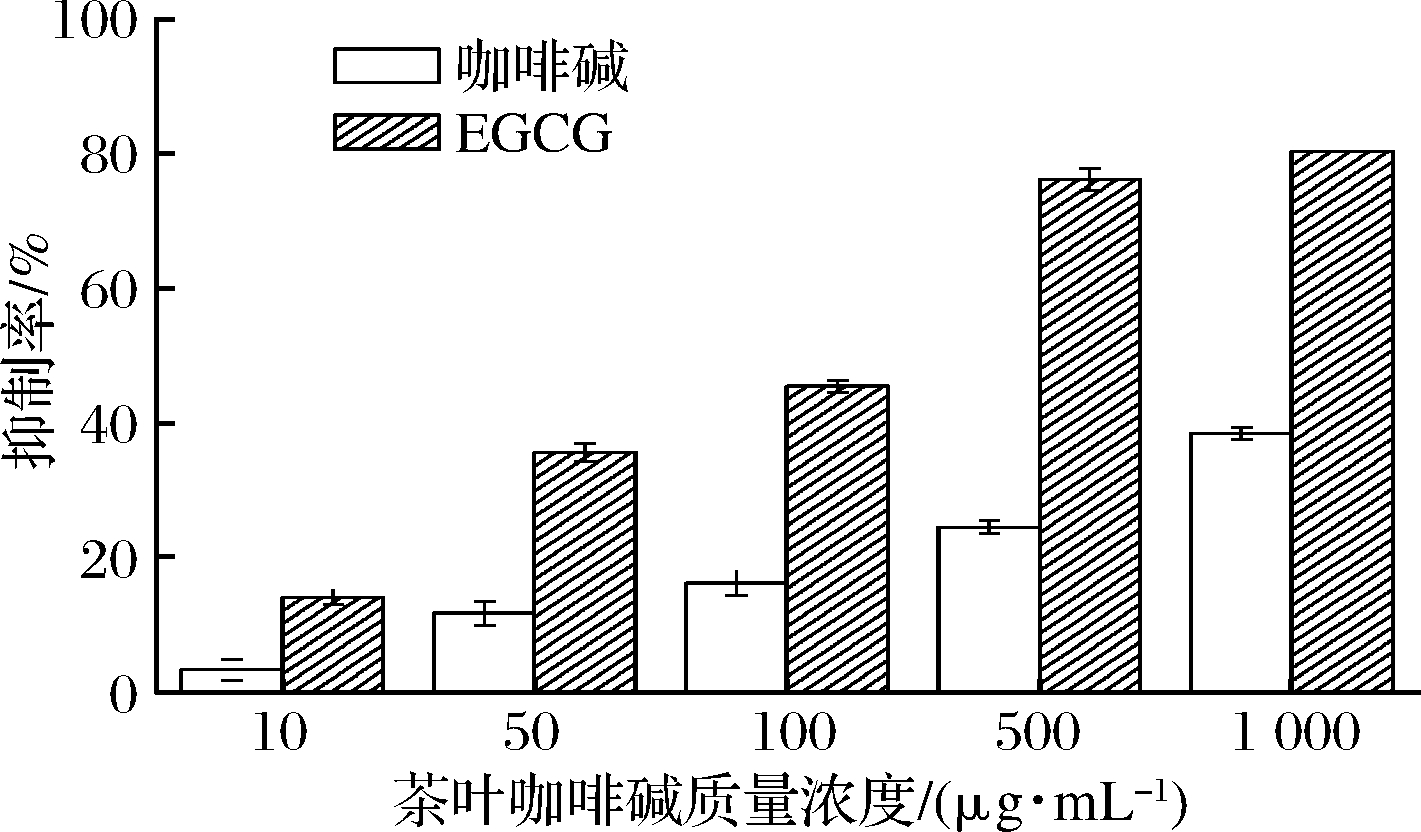
图5 不同浓度茶叶咖啡碱对弹性蛋白酶活性的抑制作用
Fig.5 Inhibitory effect of different concentrations of tea caffeine on elastase activity
3 结论
本文通过升华法对工业化生产茶多酚后的萃余液中的咖啡碱进行了纯化,探究了不同前处理剂对咖啡碱得率的影响,并在单因素实验基础上采用响应面法优化了升华工艺。结果表明,升华法纯化茶叶咖啡碱的最佳工艺条件为升华前使用碳酸钠处理萃余液、碳酸钠添加量与萃余液固形物的质量比为2.3∶1、升华温度214 ℃、升华时间28 min,在此条件下咖啡碱得率为76.21%,咖啡碱纯度>98.5%。升华工艺使用了更加安全廉价的碳酸钠代替常用的氧化钙,极大地提高了咖啡碱的得率,增加了咖啡碱的品质,同时具有操作简单、工序步骤少的优点,这对茶叶中活性物质的综合提取和工业化生产咖啡碱具有实际的指导意义。另外,茶叶咖啡碱对胶原酶和弹性蛋白酶具有一定的抑制作用,当茶叶咖啡碱的质量浓度为1 mg/mL时,对胶原酶和弹性蛋白酶的抑制率分别达到46.72%和38.43%,该实验结果表明茶叶咖啡碱具有减缓皮肤老化的潜力,适宜浓度的茶叶咖啡碱可添加到更多类型的护肤品中发挥其有益作用。
[1] TANG G Y, MENG X, GAN R Y, et al.Health functions and related molecular mechanisms of tea components:An update review[J].International Journal of Molecular Sciences, 2019, 20(24):6 196.
[2] 杨新, 陈莉, 卢红梅, 等.茶多酚提取与纯化方法及其功能活性研究进展[J].食品工业科技, 2019, 40(5):322-328;332.
YANG X, CHEN L, LU H M, et al.Research progress on extraction and purification methods of tea polyphenols and its functional activities[J].Science and Technology of Food Industry, 2019, 40(5):322-328;332.
[3] 卫哲, 肖维, 黎忠健, 等.应用转盘塔逆流萃取器从夏秋季次品茶中制备茶多酚[J].食品科学, 2013, 34(14):35-39.
WEI Z, XIAO W, LI Z J, et al.Preparation of tea polyphenols from summer-autumn low-grade tea by countercurrent extraction using rotary disc extractor[J].Food Science, 2013, 34(14):35-39.
[4] 陈琳, 吕杨俊, 张海华, 等.LP-8大孔树脂制备高含量酯型儿茶素茶多酚[J].食品科学, 2019, 40(7):68-73.
CHEN L, LYU Y J, ZHANG H H, et al.Use of macroporous resin LP-8 for preparing tea polyphenols rich in esterified catechins[J].Food Science, 2019, 40(7):68-73.
[5] 刘寒旸, 周艳, 龚宇, 等.咖啡因在肥胖、糖尿病和肿瘤中的研究进展[J].医学综述, 2016, 22(5):928-932.
LIU H Y, ZHOU Y, GONG Y, et al.Research progress of caffeine in obesity, diabetes and tumor[J].Medical Recapitulate, 2016, 22(5):928-932.
[6] MCLELLAN T M, CALDWELL J A, LIBERMAN H R.A review of caffeine′s effects on cognitive, physical and occupational performance[J].Neuroscience and Biobehavioral Reviews, 2016, 71:294-312.
[7] LIY F, OUYANG S H, TU L F, et al.Caffeine protects skin from oxidative stress-induced senescence through the activation of autophagy[J].Theranostics, 2018, 8(20):5 713-5 730.
[8] MICHAEL V, WASIM H, STEVEN F.Therapeutic use of caffeine in dermatology:A literature review[J].Journal of Dermatology and Dermatologic Surgery, 2020, 24(1):18-24.
[9] PETER M S, JUDITH E L, HARVERY A P, et al.Supercritical fluid extraction versus traditional solvent extraction of caffeine from tea leaves:A laboratory-based case study for an organic chemistry course[J].Journal of Chemical Education, 2012, 89(10):1 327-1 330.
[10] BERMEJO D V, REGLERO G, FORNARIET T, et al.Effect of cosolvents (ethyl lactate, ethyl acetate and ethanol) on the supercritical CO2 extraction of caffeine from green tea[J].The Journal of Supercritical Fluids, 2016, 107:507-512.
[11] 字成庭, 沈晓静, 张帮磊, 等.茶叶中天然咖啡因提取技术的比较与分析研究[J].广东化工, 2019, 46(10):73-77.
ZI C T, SHEN X J, ZHANG B L, et al.Comparison and analysis of extraction technology of natural caffeine from tea leaves[J].Guangdong Chemical Industry, 2019, 46(10):73-77.
[12] 张玉竹, 陈凯旋, 唐建城, 等.直接升华法从茶叶中提取咖啡因[J].成都工业学院学报, 2018, 21(2):54-57;89.
ZHANG Y Z, CHEN K X, TANG J C, et al.Direct separation of caffeine from tea by sublimation[J].Journal of Chengdu University of Technology, 2018, 21(2):54-57;89.
[13] 陈秀丽, 高海荣, 李新红, 等.用恒压漏斗从绿茶中提取天然咖啡因的研究[J].食品研究与开发, 2016, 37(5):42-45.
CHEN X L, GAO H R, LI X H, et al.Study on the extraction of natural caffeine from green tea by constant pressure funnel[J].Food Research and Development, 2016, 37(5):42-45.
[14] MAHDIEH S, JAVAD H, ELAHE M.Anti-elastase and anti-collagenase potential of Lactobacilli exopolysaccharides on human fibroblast[J].Artificial Cells, Nanomedicine, and Biotechnology, 2018, 46(sup1):1 051-1 061.
[15] 张琪, 徐维玲, 李翠芹.HPLC法同时测定茶叶中儿茶素类和咖啡因的含量[J].食品工业科技, 2015, 36(4):53-56.
ZHANG Q, XU W L, LI C Q.Simultaneous determination of some selected catechins and caffeine in tea by performance liquid chromatography[J].Science and Technology of Food Industry, 2015, 36(4):53-56.
[16] SATYAVANI K, GURUDEEBAN S, RAMANATHAN T.Inhibitory effect of Excoecaria Agallocha.L extracts on elastase and collagenase and identification of metabolites using HPLC-UV-MS techniques[J].Pharmaceutical Chemistry Journal, 2018, 51(11):960-964.
[17] NEMA N K, MAITY N, SARKAR B K, et al.Matrix metalloproteinase, hyaluronidase and elastase inhibitory potential of standardized extract of Centella asiatica[J].Pharmaceutical Biology, 2013, 51(9):1 182-1 187.
[18] CHEN X Q, DU Y, WU L, et al.Effects of tea polysaccharide conjugates and metal ions on precipitate formation by EGCG and caffeine, the key components of green tea infusion[J].Journal of Agricultural and Food Chemistry, 2019, 67(13):3 744-3 751.
[19] 杜钰. 儿茶素与咖啡碱形成沉淀的影响因素研究[D].武汉:湖北工业大学, 2018.
DU Y.Study on the factors affecting the precipitate formation of catechin and caffeine[D].Wuhan:Hubei University of Technology, 2018.
[20] 巫永华, 陆文静, 刘梦虎, 等.响应面优化超声波辅助双水相提取牛蒡多糖及抗氧化分析[J].食品与发酵工业, 2020, 46(5):215-223.
WU Y H, LU W J, LIU M H, et al.Optimization of ultrasonic-assisted aqueous two-phase extraction of burdock polysaccharide by response surface design and its antioxidant activities[J].Food and Fermentation Industries, 2020, 46(5):215-223.
[21] AGATA J T, MARZENA M, STANISLAW R.Matrix metalloproteinases (MMPs), the main extracellular matrix (ECM) enzymes in collagen degradation, as a target for anticancer drugs[J].Journal of Enzyme Inhibition and Medicinal Chemistry, 2016, 31(sup1):177-183.
[22] 闫晓佳, 梁秀萍, 李思琪, 等.表没食子儿茶素没食子酸酯性质、稳定性及其递送体系的研究进展[J].食品科学, 2020, 41(1):258-266.
YAN X J, LIANG X P, LI S Q, et al.Advances in the properties, stability and delivery systems of epigallocatechin gallate:A review[J].Food Science, 2020, 41(1):258-266.