木质纤维素是自然界中含量最丰富的一种清洁、可再生资源,其水解液可通过酿酒酵母(Saccharomyces cerevisiae)发酵生产纤维素乙醇,能有效缓解紧迫的能源危机和环境污染问题[1-2]。然而在木质纤维素水解液中存在多种抑制剂,会对酵母细胞生长和乙醇产量产生负面影响[3]。可以根据水解过程中产生的抑制物的化学性质不同分为以下几类:弱酸类(乙酰丙酸、甲酸、乙酸等)、呋喃类(糠醛、5-羟甲基糠醛等)和酚类物质(苯酚、香草醛、儿茶酚等)[4-5]。其中甲酸是呋喃类化合物进一步降解形成的,而乙酸则主要是在半纤维素脱乙酰的过程中产生的[6]。甲酸的浓度通常比乙酸低,但对酿酒酵母的毒性比乙酸高[7-8]。刘容等[9]研究了甲酸对季也蒙假丝酵母发酵木糖醇的影响,结果表明添加1 g/L甲酸对发酵具有较为明显的抑制作用,而添加5 g/L甲酸几乎完全抑制了发酵。李小娟等[10]也研究了甲酸对酿酒酵母生长、发酵过程的影响,结果表明酿酒酵母可耐受甲酸质量浓度为1.8 g/L,且随着甲酸浓度的增高,对酿酒酵母生长的抑制逐渐加强,且能抑制60%的乙醇生产。宋晓川等[11]研究了碳水化合物的降解产物对酿酒酵母NLH13乙醇发酵毒性的影响,在甲酸质量浓度达2 g/L时,糖利用率大幅度下降。尽管不容易阐明弱酸的抑制机制,但有人提出弱酸的抑制作用归因于解偶联理论和细胞内阴离子积累[12-13]。也有研究认为甲酸对微生物细胞的毒性与溶液的pH值有关[14-15]。WANG等[16]研究发现在酿酒酵母分批培养过程中,强酸胁迫(pH值为1.5)能明显抑制细胞的生长代谢。NIGAM[17]研究发现通过适当调节pH值可以减少甲酸的抑制作用,提高燃料乙醇生产效率。此外,甲酸对细胞的毒性作用可能跟胞内活性氧积累有关,LEE等[18]通过蛋白质组学研究发现甲酸会引起酿酒酵母细胞发生氧化应激,从而导致抑制的细胞分裂和死亡。杜林等[19]研究表明低浓度的甲酸可导致细胞内线粒体活性氧快速产生,对数期酿酒酵母细胞对甲酸更为敏感,死亡率更高。因此如何消减木质纤维素水解液中的酸类细胞抑制剂对水解和发酵的不利影响是提高乙醇转化效率的一个重要挑战。
本研究采用RNA-seq技术,对酿酒酵母在1.8 g/L甲酸培养条件下进行了测序分析,并结合生物信息学对差异表达基因进行GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)注释和富集分析,初步揭示了甲酸胁迫下酿酒酵母的分子响应机制,为进一步如何提高酿酒酵母木质纤维素水解产物抑制剂的耐受性提供了理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种
酿酒酵母(S.cerevisiae GGSF16)由广西科技大学微生物研究室保藏。
1.1.2 培养基
YPD培养基(g/L):酵母粉10,蛋白胨20,葡萄糖20,pH值自然,115 ℃灭菌30 min。
发酵培养基(g/L):酵母粉10,蛋白胨20,葡萄糖160,pH值自然,115 ℃灭菌30 min。
1.2 仪器与试剂
1.2.1 主要仪器
456-GC气相色谱仪,天美创科仪器(北京)有限公司;HITACHI高效液相色谱仪、HIMAC大容量冷冻离心机,日本株式会社日立制作所;DY-6D DNA电泳仪,北京市六一仪器厂;UV-1100紫外可见分光光度计,上海美谱达仪仪器有限公司;ZWYD-2402摇床、ZHJH-C112C超净台,上海智诚分析仪器制造有限公司;B-500微量分光光度计,上海元析仪器有限公司;H2100R离心机,湖南湘仪实验室仪器开发有限公司。
1.2.2 主要试剂
葡萄糖(BR),天津市科密欧化学试剂有限公司;蛋白胨(BR),广东环凯微生物科技有限公司;酵母粉(BR),合肥博美生物科技有限责任公司;甲酸(AR),西陇科学股份有限公司;RNA提取试剂盒,大连宝生物;DNA Marker,北京索莱宝科技有限公司;Tris,BioFroxx公司。
1.3 试验方法
1.3.1 甲酸对酿酒酵母细胞生长的影响
从斜面试管中挑取保藏的酵母菌株于YPD培养基中,在30 ℃,150 r/min摇床中培养14 h后,按照10%接种量接种于新鲜的YPD培养基中,在摇床中培养6 h至指数中期,初始酵母细胞数为4.2×107 CFU/mL。取30 mL菌液于12 000 r/min离心3 min,弃上清液,并加入无菌水制成10倍浓缩种子菌悬液。将种子浓缩菌悬液接种到含有终质量浓度为1.2、1.5、1.8、2.1 g/L甲酸溶液的发酵培养基中,以未添加甲酸的菌液作为对照组, 30 ℃培养24 h,每隔2 h取样在600 nm下测定光度吸收值,并绘制生长曲线。
1.3.2 甲酸对酿酒酵母发酵性能的影响
根据酿酒酵母的生长情况,选择1.8 g/L的甲酸进行发酵性能的测定。按照1.3.1的方法,以添加甲酸的菌液为实验组,未添加甲酸的菌液为对照组,在30 ℃,150 r/min摇床中培养24 h,每隔2 h取样,测残糖及乙醇含量。本次实验采用高效液相色谱仪检测糖类物质,用Alltima 5 μm Amino(250 mm×4.6 mm)柱子检测发酵液中葡萄糖的含量。液相色谱检测糖的方法为:V(色谱纯乙腈)∶V(超纯水)=80∶20的混合溶液,超声过滤后方可作为流动相使用,流速为1 mL/min,进样量为20 μL,示差折光检测器温度35 ℃。采用高效气相色谱仪检测发酵液中的乙醇含量,色谱柱为TM-930(25 m×0.53 mm×1 μm);气相色谱检测乙醇方法为:进样前溶剂清洗3次,样品清洗5次,进样后溶剂清洗3次;进样模式:进样口温度180 ℃,分流比20∶1,检测器温度 230 ℃;柱流量恒流2 mL/min;检测方法:初始温度40 ℃,以5 ℃/min的速率升至80 ℃,保持2 min,再以10 ℃/min的速率升至150 ℃;进样体积0.5 μL。
1.3.3 RNA提取、文库构建及测序
将活化的酵母菌种按照2%接种量接种于新鲜的YPD培养基中,在30 ℃,150 r/min摇床中培养 6 h 至对数中期,以添加1.8 g/L甲酸的菌液为实验组,未添加甲酸的菌液作为对照组,继续培养2 h,收集细胞用于后续RNA提取。本实验设置3个平行,对照组(ck1、ck2、ck3)和甲酸组(for1、for2、for3)。取新鲜培养的菌液200 μL,使用酵母RNA提取试剂盒说明书提取总RNA。采用1%(质量分数)琼脂糖凝胶电泳检测RNA完整性和纯度,微量分光光度计检测RNA浓度以及DNA和蛋白质污染情况,保证RNA浓度≥250 ng/μL,总量≥40 μg,且OD260/OD280和OD260/OD230均>1.8。酿酒酵母总RNA检测合格后,需要对样品中的mRNA进行富集,并去除rRNA、tRNA以及其他杂质。首先用带有Oligo(dT)的磁珠富集mRNA,随后加入适量的打断试剂使其片段化,再以片段化的mRNA为模板合成双链cDNA,经磁珠纯化、末端修复、加A并连接测序接头,最后进行PCR富集得到cDNA文库,构建好的文库经过质量检测合格后使用BGISEQ测序平台进行测序。cDNA文库构建以及测序工作均在深圳华大基因科技服务有限公司完成。
1.3.4 测序数据分析
对测序所得到的原始数据(raw reads)首先去除含有接头的reads、未知碱基N含量过高、低质量的reads得到clead reads,作为本研究的基本数据。使用HISAT将clead reads与指定的参考基因组进行序列比对,并用RSEM(RNA-Seq by expectation maximization)工具计算基因的表达水平,并使用R软件分析样品间基因表达水平相关性。使用DESeq2算法对2组样品进行差异表达分析,将差异显著性q值(q value<0.05)和差异倍数(fold change≥2)作为筛选标准进行差异表达基因的筛选。本试验研究采用DAVID和KOBAS软件对差异基因进行GO功能富集分析和KEGG通路富集分析等。
2 结果与分析
2.1 不同质量浓度甲酸对酵母细胞生长的影响
如图1所示,甲酸对酿酒酵母的生长抑制随着甲酸质量浓度的升高而增强。对照组在2 h进入对数期,6 h到达对数生长中期,8 h进入稳定期,其中添加1.2 g/L的甲酸对酵母细胞的生长影响不大。而在添加1.5 g/L甲酸的胁迫下,酵母细胞的生长立即受到抑制,但随着时间的推移,抑制作用逐渐减弱,最终生长速度略低于无甲酸处理组。甲酸质量浓度由1.5 g/L增至1.8 g/L时,酵母细胞生长明显受到抑制,在10 h才达到对数生长中期,且与无甲酸处理组相比,稳定时间得到延长。当甲酸质量浓度增至2.1 g/L时,酿酒酵母细胞几乎没有生长。而为了获得有价值的转录组学数据,本研究选择了添加1.8 g/L甲酸胁迫下的酵母细胞作为实验组。

图1 甲酸对酵母细胞生长的影响
Fig.1 The effect of formic acid on the growth of yeast cells
2.2 甲酸对酵母细胞发酵性能的影响
甲酸是木质纤维素水解液中一种酸类细胞抑制物,添加甲酸会抑制酵母细胞的生长,从而抑制葡萄糖的消耗和乙醇的生成,本次实验研究了在添加1.8 g/L甲酸胁迫条件下对酵母细胞发酵性能的影响。由图2可知,对照组在6~14 h葡萄糖消耗较快,在16 h时葡萄糖基本消耗完全,而添加甲酸后葡萄糖消耗延迟为10~18 h,在20 h时葡萄糖才基本消耗完全。此外,乙醇快速生成延迟为10~18 h,在相同时间点下对照组产乙醇量均比甲酸组要高。说明甲酸的添加明显延长了酵母细胞发酵的周期,降低了乙醇产量。
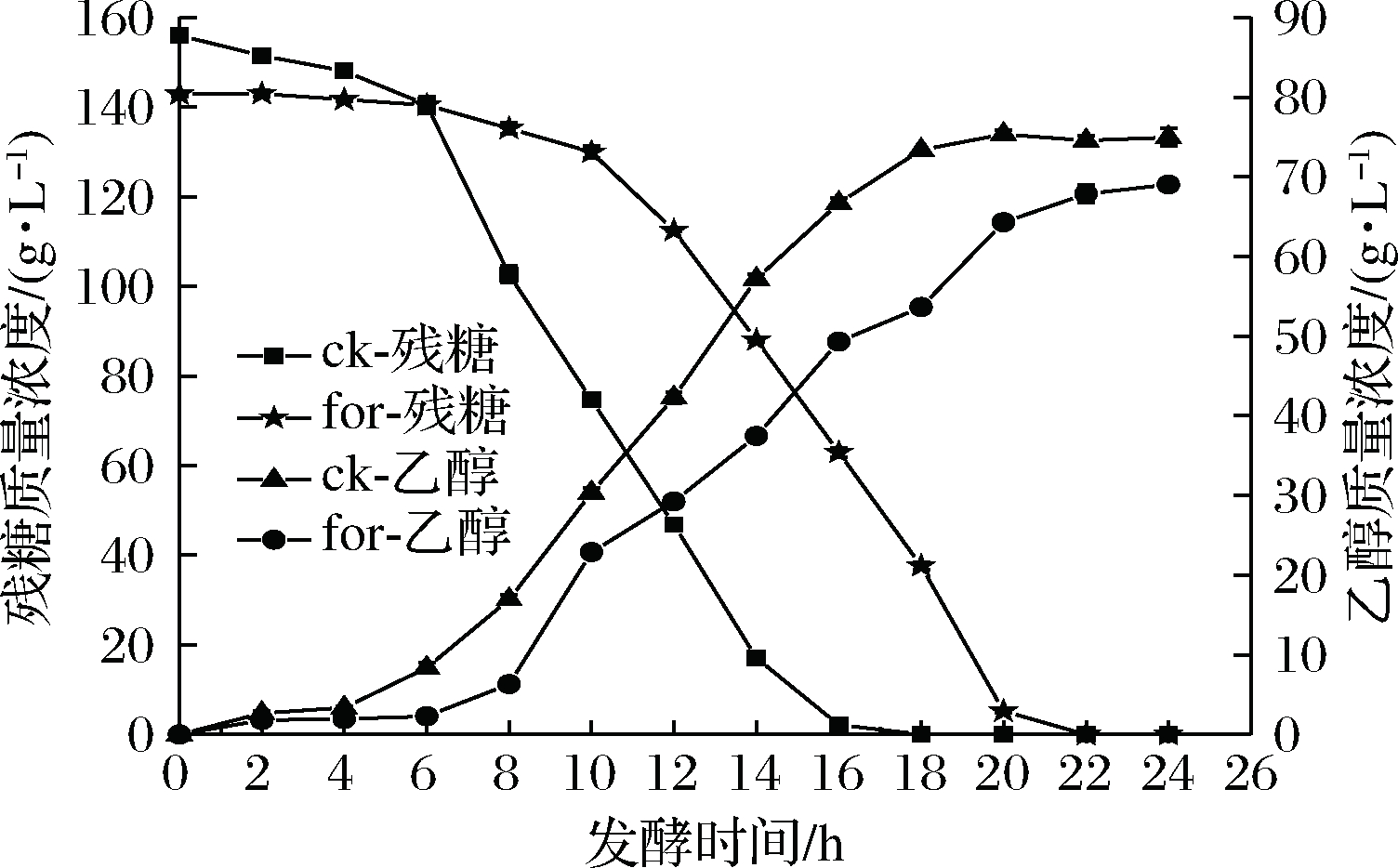
图2 甲酸对酵母细胞乙醇发酵性能的影响
Fig.2 Effect of formic acid on ethanol fermentation of yeast cells
2.3 RNA质量分析
转录组测序的RNA样品质量要求OD260/OD280为1.8~2.2、OD260/OD230>2时核酸的纯度较高,RNA完整性(RNA integrity number,RIN)为1~10,数值越接近10完整性越好。本次实验中,6个样品RNA质量浓度均>510 ng/μL,RIN均为10,28S/18S均在1.8~2.2,OD260/OD280和OD260/OD230均在要求范围内,说明提取的RNA纯度、浓度和完整度等质量指标均可满足实验要求,可用于后续建库测序。
2.4 测序数据质控
我们将原始数据经过一系列数据处理来过滤杂质得到过滤数据(clean reads)。由表1可知各样品clean read均达到6.41 Gb以上,对照组和甲酸组的Q20平均值分别为97.27%和97.26%,Q30平均值分别为89.73%和89.53%,表明原始测序质量合格,可用于后续数据分析。
表1 测序数据统计表
Table 1 Statistical table of sequencing data
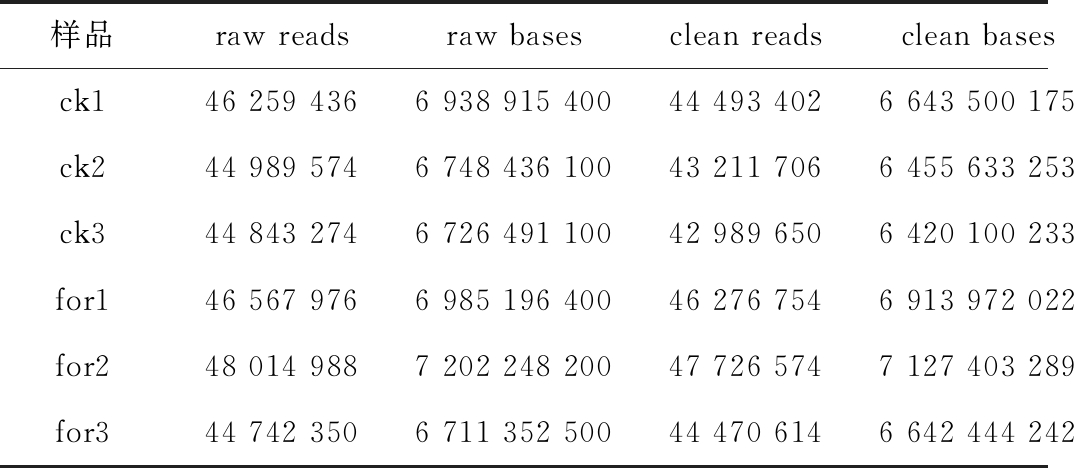
样品raw readsraw basesclean readsclean bases碱基错误率/%Q20/%Q30/%GC 含量%ck146 259 4366 938 915 40044 493 4026 643 500 1750.032 397.3189.8440.57ck244 989 5746 748 436 10043 211 7066 455 633 2530.032 997.1889.4640.93ck344 843 2746 726 491 10042 989 6506 420 100 2330.032 297.3189.940.96for146 567 9766 985 196 40046 276 7546 913 972 0220.032 797.2789.5640.69for248 014 9887 202 248 20047 726 5747 127 403 2890.032 497.3389.7840.65for344 742 3506 711 352 50044 470 6146 642 444 2420.033 297.1789.2440.72
注:raw bases为原始测序总数据量;clean reads为质控后测序数据的总条目数;clean bases为质控后测序总数据量;Q20、Q30为分别指测序质量在99%和99.9%以上的碱基占总碱基的百分比,一般Q20在85%以上,Q30在80%以上
2.5 与参考基因组比对统计
将获得clean reads使用HISAT软件比对到参考基因组序列,结果如表2所示。在Illumina产生的clean reads中,对照组和甲酸组分别有超过95.91% reads和96.31%覆盖到参考基因组上,多个比对位置的reads占比分别为1.27%和1.48%以上,唯一比对上的reads也分别超过了94.64%和94.83%。说明clean reads与参考基因组序列比对情况较好,测序数据原始数据结果可靠,可满足后续实验分析的需求。
表2 参考基因组比对结果统计
Table 2 Statistical results of reference genome comparison
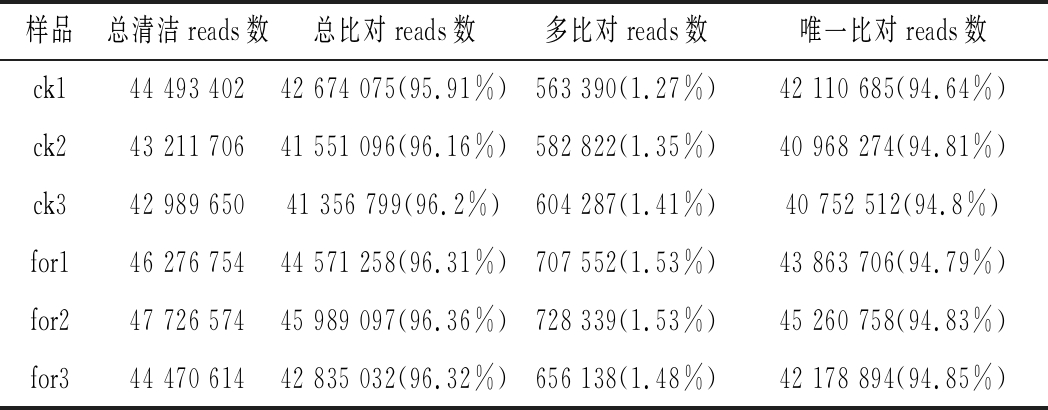
样品总清洁reads数总比对reads数多比对reads数唯一比对reads数ck144 493 40242 674 075(95.91%)563 390(1.27%)42 110 685(94.64%)ck243 211 70641 551 096(96.16%)582 822(1.35%)40 968 274(94.81%)ck342 989 65041 356 799(96.2%)604 287(1.41%)40 752 512(94.8%)for146 276 75444 571 258(96.31%)707 552(1.53%)43 863 706(94.79%)for247 726 57445 989 097(96.36%)728 339(1.53%)45 260 758(94.83%)for344 470 61442 835 032(96.32%)656 138(1.48%)42 178 894(94.85%)
2.6 测序样品相关性分析
本实验中对照组和甲酸组均有3个生物学重复,共有6组转录组测序数据。由图3可知,对照组与甲酸组组间相关性系数约为0.85,平行样品间相关系数为0.992,说明本研究中样品间重复性较好,2组差异相对较大,实验结果可靠,可用于后续分析。

图3 对照组和甲酸组相关性热图
Fig.3 Ck-for correlation heat map
2.7 差异表达基因分析
为了研究添加甲酸处理前后的差异表达基因,对2组测序后得到的所有基因进行差异表达筛选,以fold change≥2且q value<0.05作为筛选条件,共筛选出差异表达基因(different expression genes,DEGs)1 504个,其中上调基因797个,下调基因707个,分别占总DEGs的52.99%和47.01%,采用火山图和散点图来描述差异基因整体分布情况,如图4所示。
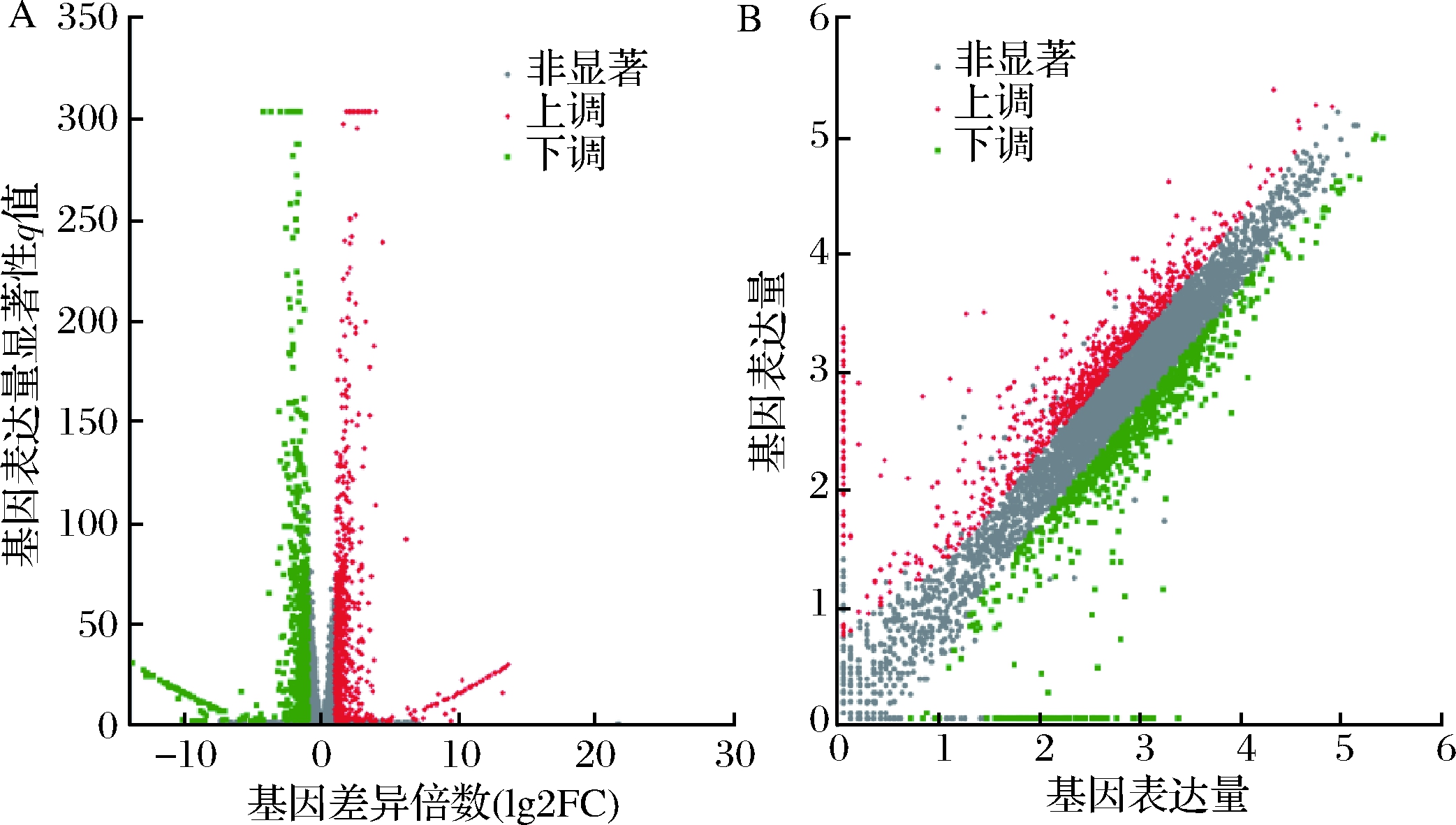
A-火山图;B-散点图
图4 对照组和甲酸组的火山图与散点图
Fig.4 Ck-for volcano map and scatter plot
注:图中1个点代表1个特定的基因,红色点表示显著上调的基因,
绿色点表示显著下调的基因,灰色点为非显著差异基因。
2.8 差异表达基因功能注释和富集分析
2.8.1 差异表达基因GO功能注释和富集分析
对筛选出来的差异表达基因进行GO功能分类,可以查看差异表达基因与哪些生物学功能显著相关。GO注释系统是一个有向无环图,包含3个主要分支,即生物学过程(biological process),细胞组成(cellular component)和分子功能(molecular function)[20]。本次研究GO共注释到45个GO term,挑选富集最显著的前20 GO term绘制差异表达基因GO功能柱状图,如图5所示。由图5可知,生物学过程有19个GO term,多数差异表达基因参与了细胞过程(cellular process)、代谢过程(metabolic process)、生物调节(biological regulation)以及对刺激的反应(response to stimulus)等;细胞组成中有13个GO term,主要有细胞器(organelle)、含蛋白质复合物(protein-containing complex)、膜部分(membrane part)、细胞外区域(extracellular region)等;分子功能中有13个GO term,多数基因参与了捆绑(binding)、催化活性(catalytic activity)、运输活动(transporter activity)、转录调节活性(transcription regulator activity)、抗氧化活性(antioxidant activity)以及蛋白质折叠伴侣(protein folding chaperone)等。我们对差异基因进一步进行了GO富集分析,图中横坐标为富集比例,纵坐标为富集的GO term,气泡的大小表示注释到某个GO term上的差异基因数目,颜色代表富集P值,颜色越深代表P值越小。由图6可知,差异表达基因主要富集在核糖核蛋白复合体(ribonucleoprotein complex)、细胞质翻译(cytoplasmic translation)、翻译(translation)、核糖体(ribosome)、rRNA加工(rRNA processing)、核糖体生物发生(ribosome biogenesis)、质膜部分(plasma membrane part)、跨膜转运蛋白活性(transmembrane transporter activity)、果糖跨膜转运蛋白活性(fructose transmembrane transporter activity)、运输活性(transporter activity)等GO term中。以上结果表明,在甲酸的胁迫下,酿酒酵母中大多数与核糖体有关的基因表达受到影响,进而影响了mRNA 翻译。IWAKI等[21]研究表明添加香兰素能够抑制酵母细胞中的翻译,朱宁等[22]探究微芯片脉冲电场技术对毕赤酵母的致死效果和致死机理,微芯片脉冲电场处理造成毕赤酵母基因损伤、蛋白质转录翻译受阻,蛋白功能被部分抑制,与本次试验结果基本一致。

图5 差异表达基因GO功能分类图
Fig.5 Differentially expressed gene GO function classification map
注:图中纵坐标表示GO term,横坐标表示比对上该
GO term的基因数量,颜色表示不同基因集
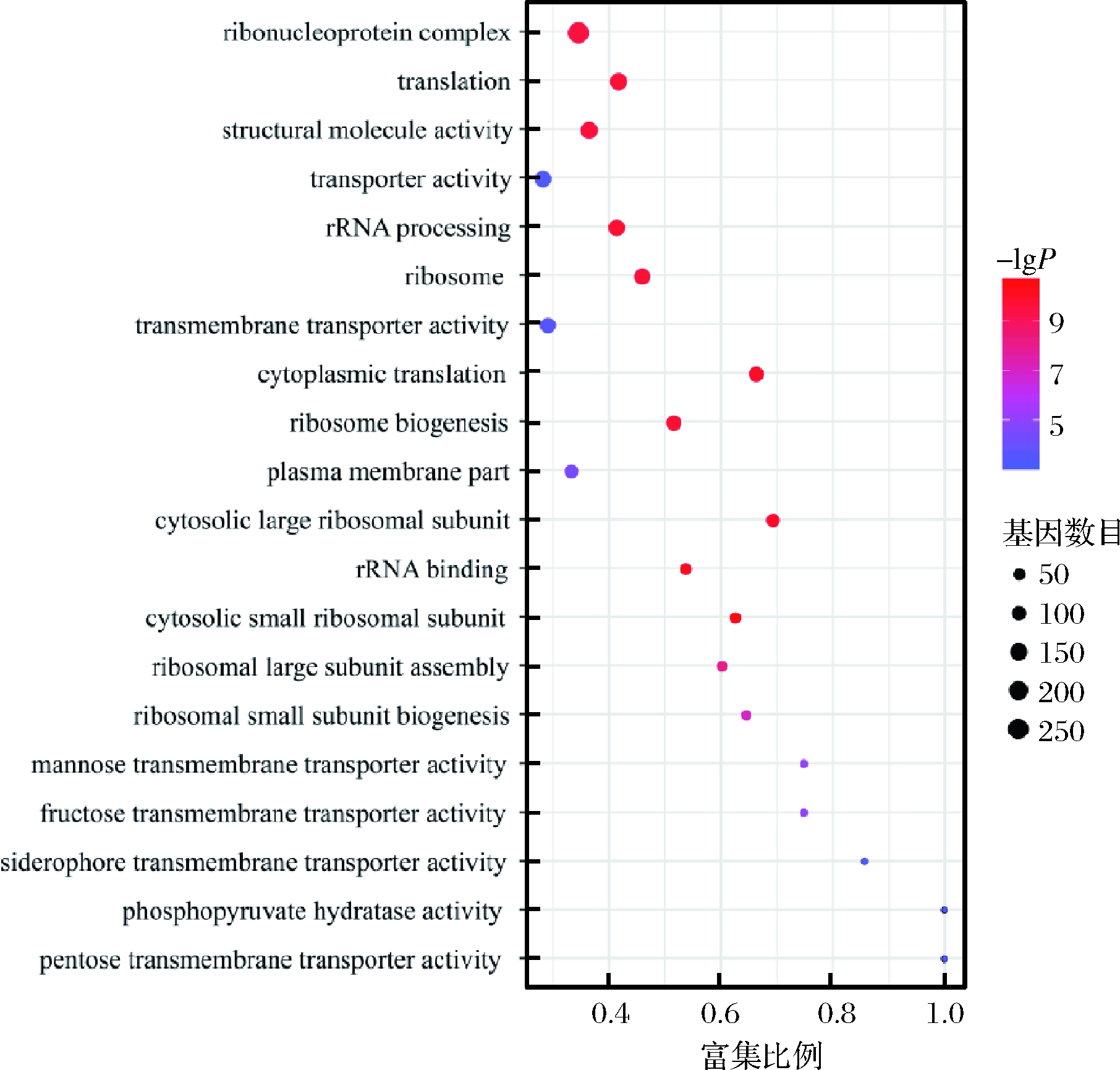
图6 差异表达基因GO富集图
Fig.6 Differentially expressed gene GO enrichment map
2.8.2 差异表达基因KEGG富集分析
KEGG 是有关基因通路的主要公共数据库[23],在生物体内,不同的基因产物相互协调来行使生物学功能,对差异表达基因的通路注释分析有助于进一步解读基因的功能,将基因根据参与的KEGG代谢通路分为5个分支:细胞过程(cellular processes)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、代谢(metabolism)及有机系统(organismal systems)。其结果如图7所示。由图7可知,在分类中代谢占据主导地位,主要以碳水化合物代谢、能量代谢、氨基酸代谢以及核苷酸代谢为主;其次在细胞过程中,以细胞生长与死亡、运输和分解代谢为主;在遗传信息处理中,折叠、分类、降解、翻译占比居多,其次是复制、修复、转录。在环境信息处理过程中,主要以信号转导为主。为了确定差异表达基因参与的最主要生化代谢途径和信号转导途径,本研究使用KOBAS软件进行KEGG通路富集分析,结果表明总共富集在101个通路中,我们将其中富集最显著的20条通路绘制差异基因KEGG通路富集散点图,如图8所示。由图8可知,添加甲酸组和对照组培养条件下的差异表达基因有116个DEGs富集在核糖体通路、38个DEGs富集在减数分裂-酵母、40个DEGs富集在丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路、27个DEGs富集在真核生物的核糖体生物发生、26个DEGs富集在糖酵解/糖异生、24个DEGs富集在嘌呤代谢、20个DEGs富集在半胱氨酸和蛋氨酸的代谢、20个DEGs富集在淀粉和蔗糖代谢、14个DEGs富集在过氧化物酶体、13个DEGs富集在三羧酸循环、12个DEGs富集在半乳糖代谢、10个DEGs富集在果糖和甘露糖代谢、8个DEGs富集在自噬、8个DEGs富集在缬氨酸,亮氨酸和异亮氨酸的生物合成、8个DEGs富集在脂肪酸降解、8个DEGs富集在硫代谢、7个DEGs富集在β-丙氨酸代谢、7个DEGs富集在泛酸和CoA生物合成、6个DEGs富集在ABC转运、5个DEGs富集在不饱和脂肪酸的生物合成。由此可见,核糖体在甲酸胁迫中起着重要的作用,且发现与细胞质核糖体生物合成相关的基因大部分下调,与线粒体核糖体上调。LI等[24]研究乙醇胁迫下酿酒酵母的响应机制,发现与核糖体、核糖体生物合成相关的基因大部分下调,与线粒体核糖体相关的基因表达没有出现明显的变化,与我们试验结果一致。减数分裂、糖酵解/糖异生和三羧酸循环等相关通路也发生了显著的变化,推测酿酒酵母可能进入有性生殖形成孢子,并在甲酸胁迫下产生子囊和子囊孢子,还可能通过糖代谢途径合成大量的ATP,为抵抗甲酸的胁迫提供了充足的能量,从而提高了甲酸的耐受性。此外,酿酒酵母也可以通过信号转导途径相关基因的表达来响应甲酸的胁迫。
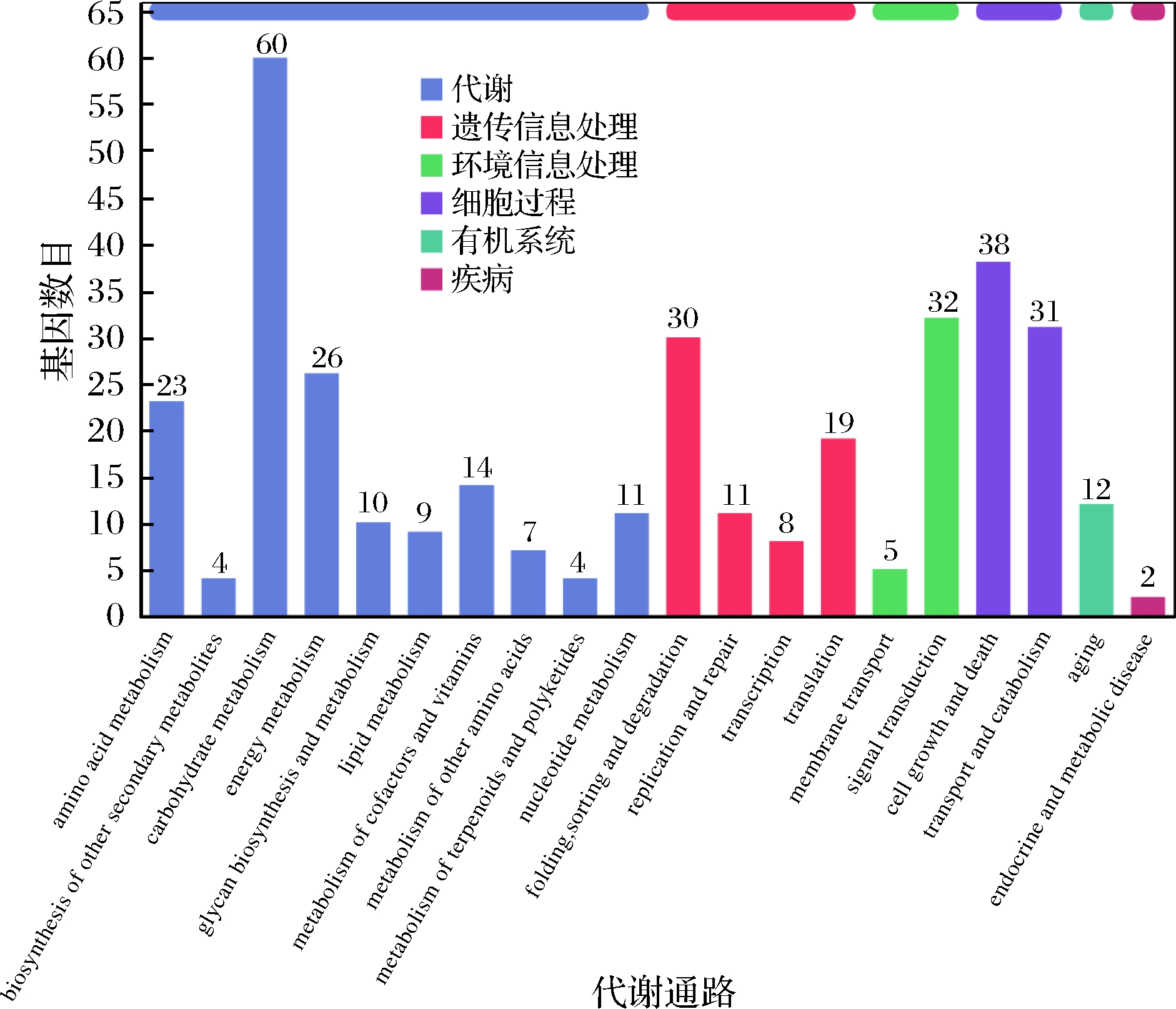
图7 差异表达基因KEGG通路分类图
Fig.7 Differentially expressed genes KEGG pathway classification map
注:横坐标为KEGG代谢通路的名称,纵坐标为注释到该通路
下的基因的数量
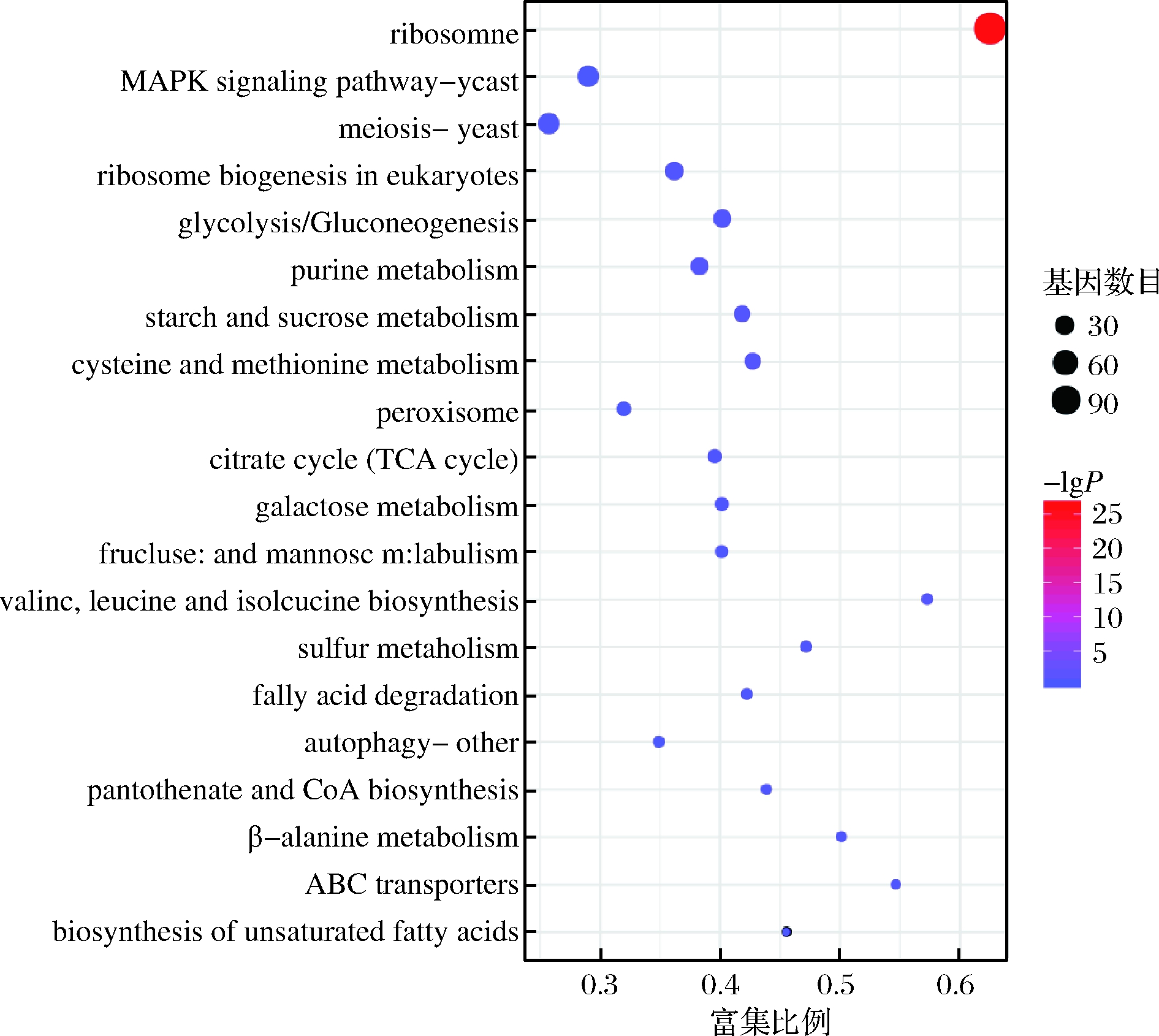
图8 差异表达基因KEGG通路富集图
Fig.8 Differentially expressed genes KEGG pathway enrichment map
注:图中横坐标表示富集比例,富集比例越大,则富集的程度越大,
纵坐标为通路,点的大小表示此通路中基因个数多少,颜色代表富集
的显著性大小
3 讨论与结论
本研究针对酿酒酵母在不同浓度甲酸的胁迫条件下进行发酵性能的测定,发现添加甲酸能明显地抑制酵母细胞的生长,延迟发酵周期并降低乙醇量。而我们根据酿酒酵母的生长情况,选择1.8 g/L的甲酸进行转录组测序分析,共获得38.46 Gb clean reads测序数据,我们以q value<0.05且fold change≥2为筛选条件,对照组和甲酸组共筛选出1 504个显著差异表达基因,其中上调基因797个,下调基因707个。通过GO富集以及KEGG通路富集分析表明,2组样品上调基因主要参与减数分裂-酵母、MAPK信号通路、淀粉和蔗糖代谢、糖酵解/糖异生、细胞周期、半乳糖代谢、果糖和甘露糖代谢等通路,而下调基因主要参与了核糖体通路、真核生物的核糖体生物发生、半胱氨酸和蛋氨酸的代谢、嘌呤代谢、缬氨酸、亮氨酸和异亮氨酸的生物合成、不饱和脂肪酸的生物合成、脂肪酸降解等通路。通过RNA-seq分析表明,在甲酸的胁迫下酿酒酵母响应分子机制可能有以下几点:首先,酿酒酵母为了响应甲酸的胁迫通过上调糖代谢以及氧化磷酸化相关基因的表达,为抵抗甲酸的胁迫提供充足的能量;其次,可以利用线粒体核糖体合成有关蛋白质来抵御甲酸的侵扰,并在甲酸胁迫下能够对自身产生的能量进行合理分配,合成应对胁迫所需物质对细胞进行保护;再次,半胱氨酸和蛋氨酸代谢、蛋白折叠和蛋白降解某些基因表达下调,猜测是甲酸的添加使细胞产生氧化胁迫,因此造成蛋白变性,而酿酒酵母则可以通过上调蛋白折叠和降解相关的基因表达,帮助酵母细胞蛋白质正确折叠、防止变性蛋白聚集,从而有助于细胞恢复正常的生理代谢功能;最后,通过上调减数分裂、细胞周期以及MAPK信号通路相关基因的表达,促进对营养物质的吸收,提高酿酒酵母对甲酸的耐受性。本研究初步揭示了酿酒酵母对甲酸的胁迫响应机制,但具体基因的作用效果和分子机制还有待进一步研究,后期我们将验证与胁迫响应相关的关键基因。本文为进一步提高酿酒酵母细胞酸类抑制剂的耐受性方法提供了科学依据。
[1] AUESUKAREE C.Molecular mechanisms of the yeast adaptive response and tolerance to stresses encountered during ethanol fermentation[J].J Biosci Bioeng, 2017, 124(2):133-142.
[2] 任俊莉, 刘慧莹, 王孝辉, 等. 木质纤维素资源化主要途径及半纤维素优先资源化利用策略[J]. 生物加工过程, 2020, 18(1): 1-12.
REN J L, LIU H Y, WANG X H, et al. Various approaches of lignocellulose utilization and strategies for hemicellulose preferred lignocellulose biorefinery[J]. Chinese Journal of Bioprocess Engineering, 2020, 18(1): 1-12.
[3] 张克俞, 张明明, 赵心清, 等. 关键基因过表达提高酿酒酵母抑制剂耐受性及乙醇发酵性能[J]. 应用与环境生物学报, 2018, 24(3): 541-546.
ZHANG K Y, ZHANG M M, ZHAO X Q, et al. Improvement of inhibitor stress tolerance and ethanol fermentation of Saccharomyces cerevisiae by overexpression of novel key genes[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(3): 541-546.
[4] 郭凯原, 石海强, 熊学东, 等. 木质纤维素水解过程中发酵抑制物的产生与脱毒[J]. 黑龙江造纸, 2016, 44(4): 16-21.
GUO K Y, SHI H Q, XIONG X D, et al. Research advance in fermentation inhibitors in lignocelluloses hydrolysate pretreated[J]. Heilongjiang Pulp & Paper, 2016, 44(4): 16-21.
[5] UNREAN P, G TGENS J, KLEIN B, et al.Elucidating cellular mechanisms of Saccharomyces cerevisiae tolerant to combined lignocellulosic-derived inhibitors using high-throughput phenotyping and multiomics analyses[J].FEMS Yeast Research, 2018, 18(8).DOI:10.1093/femsyr/foy106.
TGENS J, KLEIN B, et al.Elucidating cellular mechanisms of Saccharomyces cerevisiae tolerant to combined lignocellulosic-derived inhibitors using high-throughput phenotyping and multiomics analyses[J].FEMS Yeast Research, 2018, 18(8).DOI:10.1093/femsyr/foy106.
[6] 马静. 热水预处理杨木半纤维素的局部化学溶解机理[D]. 北京: 北京林业大学, 2015.
MA J. The mechanism of topochemical dissolving of hemicellulose during hydrothermal pretreatment of poplar[D]. Beijing: Beijing Forestry University, 2015.
[7] MART N C, WU G C, WANG Z, et al.Formation of microbial inhibitors in steam-explosion pretreatment of softwood impregnated with sulfuric acid and sulfur dioxide[J].Bioresource Technology, 2018, 262:242-250.
N C, WU G C, WANG Z, et al.Formation of microbial inhibitors in steam-explosion pretreatment of softwood impregnated with sulfuric acid and sulfur dioxide[J].Bioresource Technology, 2018, 262:242-250.
[8] D AZVILLANUEVA M J, CARACORPAS C, RUIZRAMOS E, et al.Olive tree pruning as an agricultural residue for ethanol production.Fermentation of hydrolysates from dilute acid pretreatment[J].Spanish Journal of Agricultural Research, 2012, 10(3):643.
AZVILLANUEVA M J, CARACORPAS C, RUIZRAMOS E, et al.Olive tree pruning as an agricultural residue for ethanol production.Fermentation of hydrolysates from dilute acid pretreatment[J].Spanish Journal of Agricultural Research, 2012, 10(3):643.
[9] 刘容, 孙卫东, 宗宝. 弱酸副产物对季也蒙假丝酵母发酵木糖醇的影响研究[J]. 轻工科技, 2012, 28(5): 21-23.
LIU R, SUN W D, ZONG B. The effect of weak acid by-products on the fermentation of xylitol by Candida guillum[J]. Light Industry Science and Technology, 2012, 28(5): 21-23.
[10] 李小娟, 黄瑞, 张超, 等. 湿氧化爆破副产物对酿酒酵母的生长和发酵过程的影响[J]. 可再生能源, 2013, 31(8): 64-67;74.
LI X J, HUANG R, ZHANG C, et al. Effects of by-products from wet-oxidation explosion on the growth and fermentation of Saccharomyces cerevisiae[J]. Renewable Energy Resources, 2013, 31(8): 64-67; 74.
[11] 宋晓川, 储秋露, 朱均均, 等. 碳水化合物降解产物对酿酒酵母乙醇发酵的影响[J]. 林产化学与工业, 2011, 31(1): 9-12.
SONG X C, CHU Q L, ZHU J J, et al. Effects of degradatjon products of carbohydrates on the fermentation of Saccharmyces cerevisiae[J]. Chemistry and Industry of Forest Products, 2011, 31(1): 9-12.
[12] GARC A-APARICIO M P, BALLESTEROS I, GONZ
A-APARICIO M P, BALLESTEROS I, GONZ LEZ A, et al.Effect of inhibitors released during steam-explosion pretreatment of barley straw on enzymatic hydrolysis[J].Applied Biochemistry & Biotechnology, 2006, 129(1-3):278-288.
LEZ A, et al.Effect of inhibitors released during steam-explosion pretreatment of barley straw on enzymatic hydrolysis[J].Applied Biochemistry & Biotechnology, 2006, 129(1-3):278-288.
[13] PAMPULHA M E, LOUREIRO-DIAS M C.Energetics of the effect of acetic acid on growth of Saccharomyces cerevisiae[J].FEMS Microbiology Letters, 2000, 184(1):69-72.
[14] TAHERZADEH M J, NIKLASSON C, LIPÉN G.Acetic acid—friend or foe in anaerobic batch conversion of glucose to ethanol by Saccharomyces cerevisiae[J].Chemical Engineering Science, 1997, 52(15):2 653-2 659.
[15] 刘兴艳, 贾博, 赵芳, 等. 酿酒酵母对弱有机酸胁迫的应激机制研究进展[J]. 食品与发酵工业, 2013, 39(6): 125-129.
LIU X Y, JIA B, ZHAO F, et al. Research progress on weak organic acid stress mechanism of Saccharomyces cerevisiae[J]. Food and Fermentation Industries, 2013, 39(6): 125-129.
[16] WANG D X, ZHANG J L, DONG Y Y, et al.Glutathione is involved in physiological response of Candida utilis to acid stress[J].Applied Microbiology and Biotechnology, 2015, 99:10 669-10 679.
[17] NIGAM J N.Ethanol production from hardwood spent sulfite liquor using an adapted strain of Pichia stipitis[J].Industrial Microbiology & Biotechnology, 2001, 26(3):145-150.
[18] LEE S E, PARK B S, YOON J J.Proteomic evaluation of cellular responses of Saccharomyces cerevisiae to formic acid stress[J].Mycobiology, 2010, 38(4):302-309.
[19] 杜林, 李莲. 酿酒酵母中线粒体活性对甲酸处理下细胞死亡率的影响[J]. 食品与发酵工业, 2012, 38(7): 73-76.
DU L, LI L. Effect of mitochondrial activity to the cell survivla rate of Saccharomyces cerevisiae after formic acid treatment[J]. Food and Fermentation Industries, 2012, 38(7): 73-76.
[20] 刘粉香, 杨文国, 孙勤红. 基于转录组测序数据分析及高通量GO注释理论的研究[J]. 安徽农业科学, 2018, 46(31): 88-91;100.
LIU F X, YANG W G, SUN Q H. Transcriptome sequencing data analysis and high-throughput GO annotation[J]. Journal of Anhui Agricultural Sciences, 2018, 46(31): 88-91; 100.
[21] IWAKI A, OHNUKI S, SUGA Y, et al.Vanillin inhibits translation and induces messenger ribonucleoprotein (mRNP) granule formation in Saccharomyces cerevisiae:Application and validation of high-content, image-Based profiling[J].PloS One, 2013, 8(4):e61 748.
[22] 朱宁, 于宁, 朱月, 等. 基于转录组研究MPEF对毕赤酵母的致死机理[J]. 食品科学, 2019, 40(4): 130-137.
ZHU N, YU N, ZHU Y, et al. Transcriptomic investigation of the mechanism of the lethal effect of microchip pulse electric field on pichia[J]. Food Science, 2019, 40(4): 130-137.
[23] KANEHISA M, ARAKI M, GOTO S, et al.KEGG for linking genomes to life and the environment[J].Nucleic Acids Research, 2008, 36:480-484.
[24] LI R X, XIONG G T, YUAN S K, et al.Investigating the underlying mechanism of Saccharomyces cerevisiae in response to ethanol stress employing RNA-seq analysis[J].World Journal of Microbiology and Biotechnology, 2017, 33:206.