几千年来,发酵食品和饮料一直在人类饮食习惯中占据重要地位[1]。食醋是一种用谷物酿造的传统酸性调味品,历史源远流长[2]。果醋富含多种小分子有机酸、多种酚类物质、多种维生素及矿物元素,在缓解人体疲劳、调节人体酸碱平衡、加速体内新陈代谢等方面有积极作用[3-4]。目前,中国销售的果醋产品多为勾兑果醋饮品,主要包括食醋与果汁勾兑或苹果醋与果汁勾兑,风味单一,口感不佳。欧美市场上,果醋产品主要是高酸度果醋(发酵),用于沙拉和烹饪调味,或直接饮用(稀释后),能平衡血糖和加速代谢。高酸度果醋在运输、贮存及销售中有较强的天然抑菌效果,具有质量稳定、风味丰富、节约成本和空间的优点。
高品质高酸度果醋的关键在于果醋专用醋酸菌(Acetobacter sp.)的筛选和发酵工艺的优化。发酵工艺优化相关的研究较多[5-6],但关于筛选果醋专用醋酸菌的研究较少。果汁发酵生产果酒,果酒氧化生产果醋,其果酒的乙醇含量和发酵温度是影响醋酸发酵的关键因素。乙醇作为醋酸发酵的底物,为醋酸菌的生长代谢提供能量,但乙醇具有一定的抑菌作用,在其含量超过4%(体积分数)时,醋酸菌的生长会受到抑制[7]。温度是影响细菌生长代谢的重要因素,醋酸菌的最适生长温度是30 ℃[8]。温度过高使醋酸菌发酵的基本酶类变性,细胞膜损伤,导致细胞分散[9],影响果醋质量。我国工业酿造食醋的醋酸菌菌株主要有A.pasteurianus AS1.41和沪酿1.01。它们适用于酿造谷物醋,但在果醋酿造时,不仅产酸能力、耐高温及耐乙醇能力不足,而且形成的风味也不佳[10-11]。因此,筛选出优良耐受性的果醋专用高产酸醋酸菌具有重要意义。
本研究以多种类型的水果样品(李子、水蜜桃、芒果、香蕉、枇杷)为研究对象。首先,通过钙平板、醋酸定性试验和产酸定量试验筛选高产醋酸菌株。其次,对高产醋酸菌株的耐受性(耐乙醇或耐高温)比较后筛选耐受性优良的菌株。为探索耐受性优良的菌株在发酵果醋中的应用,以产酸量和菌株生长情况为指标,对李子醋的发酵过程(高乙醇或高温)进行分析,同时对李子醋产品进行感官评价。最后,通过形态观察和16S rDNA 对优良菌株进行菌种鉴定。本研究从水果中筛选具有耐高浓度乙醇和耐高温特性的高产酸醋酸菌,并应用到李子醋产品中,不仅丰富了果醋醋酸菌种库,还为其在果醋产品的应用研究提供参考。
1 材料与方法
1.1 材料与试剂
李子,购于四川眉山、福建宁德、陕西渭南、山东临沂、云南昭通5个地区;水蜜桃、芒果、香蕉、枇杷,上海市农工商超市;
Ezup柱式细菌基因组DNA抽提试剂盒、通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、通用反向引物1492R(5′-AGAAAGGAGGTGATCCAGCC-3′)、DNA Maker(100~2 000 bp)、溴酚蓝、溴化乙锭、PCR mix、ddH2O,生工生物工程(上海)股份有限公司;其他试剂(分析纯),国药集团化学试剂有限公司;A.pasteurianus AS1.41,中国工业微生物菌种保藏中心。
1.2 仪器与设备
SW-CJ-1F型洁净工作台,上海博迅实业有限公司;LDZX-50KBS型立式压力蒸汽灭菌锅,上海申安医疗器械厂;JX-05型均质机,上海净信实业发展有限公司;E200MV型生物显微镜,南京尼康江南光学仪器有限公司;A300型梯度PCR仪,杭州朗基科学仪器有限公司;DYY-6C型电泳仪,北京市六一仪器厂;EC3 Imaging System型凝胶成像系统,美国Bio-Rad公司;Bioscreen C MBR全自动生长曲线分析仪,Oy Growth Curves AbLtd。
1.3 培养基
富集培养基(glucose yeast,GY)(g/L):葡萄糖10、酵母提取物10、MgSO4·7H2O 0.5,pH 4.5;
液体培养基(GYE):GY培养基灭菌后,待冷却到70 ℃左右时,加入体积分数3%无水乙醇。
分离培养基(GYECCa2+):GYE培养基加入18 g/L琼脂粉,灭菌后冷却到70 ℃左右时,加入6 g/L CaCO3和3%(体积分数)无水乙醇混匀;
固体培养基(GYEC):GY培养基加入18 g/L琼脂粉,灭菌后待冷却到70 ℃左右时,加入3%(体积分数)无水乙醇。
1.4 高产酸醋酸菌的筛选
1.4.1 醋酸菌初筛
称取水果的腐烂部分各(5.00±0.50)g,置于100 mL/250mL GY培养基的锥形瓶中,30 ℃,150 r/min振荡培养3 d。富集培养液梯度稀释后涂布于GYECCa2+培养基,30 ℃静置培养3 d。挑取透明圈较大的菌落,划线纯化后,-80 ℃保存[30%(体积分数)甘油]。
1.4.2 产酸定性实验[10]
分离菌株活化2次后,接种于50 mL/250 mL GYE培养基中,30 ℃,150 r/min振荡培养3 d。培养液4 000 r/min离心10 min,取5 mL上清液,中和后(0.05 mol/L NaOH溶液)滴加质量分数为5%氯化铁溶液5滴,4 000 r/min离心10 min。取上清液转移至干净试管中,沸水浴5 min,形成红褐色絮状沉淀则初步认定为醋酸产生菌。4 000 r/min离心5 min,红褐色絮状沉淀分离,加入1 mL浓硫酸,沉淀溶解。加入1 mL无水乙醇,加热至沸腾,有乙酸乙酯香味定为醋酸菌。
1.4.3 醋酸菌复筛[12]
分离菌株活化2次后,接种于GYE培养基,30 ℃,150 r/min振荡培养3 d,即得种子液。取3%(体积分数)种子液接种于GYE培养基中,30 ℃,150 r/min振荡培养。以第5天的产酸量为指标,筛选产酸量高于AS1.41的分离菌株。
取2 mL菌液,加50 mL蒸馏水,滴加2~4滴5 g/L酚酞酒精溶液为指示剂。用0.1 mol/L NaOH进行酸碱中和滴定,以消耗的NaOH体积计算菌株的产酸量,如公式(1)所示:
产酸量![]()
(1)
式中:V,滴定消耗的NaOH体积,mL;V0,以空白培养基为对照,滴定消耗的NaOH体积,mL;CNaOH,NaOH溶液浓度,mol/L;V样,发酵液样品体积,mL;60,醋酸相对分子质量。
1.5 醋酸菌菌株性能测定
1.5.1 产酸能力评价
分离菌种活化2次后,接种于50 mL/250 mL GYE培养基的锥形瓶中,30 ℃,150 r/min振荡培养3 d后,即得种子液。取3%(体积分数)种子液于100 mL/250 mL GYE培养基的锥形瓶,30 ℃,150 r/min振荡培养15 d,每隔24 h测1次产酸量,测定方法同1.4.3。
1.5.2 菌株耐温性和耐醇性测定
采用单因素试验考察不同乙醇体积分数[3%(30 ℃)、9%(30 ℃)、11%(30 ℃)]和不同温度[30 ℃(3%乙醇)、37 ℃(3%乙醇)、42 ℃(3%乙醇)]条件下醋酸菌的OD600,确定具有优良耐受能力的菌株。
分离菌株活化2次后,参照娄阳等[13]、LIANOU等[14]和LINDQVIST[15]的研究,使用全自动生长曲线仪监测各胁迫条件下的OD600。在Bioscreen配套的100微孔板中,预先吸取180 μL GYE培养基于孔板,吸取20 μL备用种子液接种至第1孔,以此为第1稀释度,移液枪吹打混匀后,吸取20 μL第1稀释度菌液至第2孔,依次稀释至第3孔中(第3孔吸取 20 μL 菌液舍弃)。以180 μL GYE培养基作为空白对照。将空白对照及样品液100微孔板放入样品槽中,设置为每30 min读取1次OD600值,监测时间为84 h。
1.6 优良菌株发酵李子醋的研究
将1.5.2的耐受性优良菌株与对比菌株AS1.41接种到自制李子酒中,分别在适宜环境[30 ℃、5%(体积分数)乙醇)]、高温环境[37 ℃、5%(体积分数)乙醇]和高乙醇环境[30 ℃、8%(体积分数)乙醇]中静置发酵12 d,每隔24 h测产酸量(测定方法同1.4.3)和OD600,每组试验重复3次。
感官评价:挑选10名经过感官培训的食品专业人员,参照段珍珍等[16]、赵方圆等[17]制定的评分标准(表1)对李子醋的色泽、气味、滋味、体态进行评分。
表1 李子醋感官评分标准
Table 1 Sensory evaluation standards of plum vinegar

感官指标感官品质特点及相应分值色泽(20分)颜色鲜艳、桃红有光泽(16~20分);颜色较浅、橘红有光泽(9~15分);颜色暗淡不鲜艳(1~8分)气味(30分)李子果香、醋香浓郁、香味柔和(24~30分);李子果香、醋香浓郁、香味不柔和(16~23分);无果香、气味刺激或过淡;(8~15分);无味或有异味(1~7分)滋味(30分)酸味柔和,有较强果香,爽口无异味(20~30分);酸味适中稍刺激,有淡淡果香,微涩(10~19分);酸味刺激或过淡,无果香,涩味明显(1~9分)体态(20分)清亮透明,无悬浮物及沉淀(13~20分);微浑浊,微量悬浮物及沉淀(6~12分);浑浊不透明,有明显悬浮物及沉淀(1~5分)
1.7 菌株的鉴定
通过光学显微镜观察菌株形态[18-19]。
按照Ezup柱式细菌基因组 DNA 抽提试剂盒说明书提取菌株基因组DNA,作为模板。PCR扩增的16S rDNA引物为27F和1492R。利用质量分数1%的琼脂糖凝胶电泳,确定PCR成功后,送至生物工程(上海)有限公司进行16S rDNA基因扩增序列测序。在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)在线数据库中进行同源序列检索,将目标菌株和在BLAST程序中检索到的与同属其他种的醋酸菌模式菌株作最大同源性比较分析,并利用系统发育软件 MEGA 7.01采用邻位相邻法构建系统发育树,同时进行重复次数为1 000次的 Bootstrap 测试,最终确定菌株的分类地位。
1.8 数据分析
每组试验设置3个平行,结果表示为平均值±标准差,使用Microsoft Excel 2016,Origin 9.0、Graphpad prism8.0 和Mega 7.0.1等软件处理试验数据。
2 结果与分析
2.1 高产酸醋酸菌的筛选
2.1.1 醋酸菌的初筛
本研究取9种水果样品(5种李子、水蜜桃、芒果、香蕉、枇杷)的腐烂部分富集培养后,通过钙圈法,将透明圈大的菌株分离纯化,共分离57株菌株。其中,5个地区的李子中分离筛选出37株,编号分别是G-1、H1~H8,C1~C5,PA1~PA5,PB1~PB6,PC1~PC7,PD1~PD5;从水蜜桃中分离筛选出6株,编号T1~T6;从芒果中分离筛选出5株,编号M1~M5;从香蕉中分离筛选出5株,编号Bn1~Bn5;从枇杷中分离筛选出5株,编号LO1~LO5。通过产酸定性试验,产生红褐色沉淀的菌株共42株,可以确定为产醋酸菌株。
2.1.2 醋酸菌的复筛
醋酸菌的产酸量作为最重要的指标之一,一直被研究者重视。李华敏等[20]筛选的A.cibinongensis YT17在6%(体积分数)乙醇下生长,在第8天时,其产酸量达到27.91 g/L。孙一帆等[21]筛选的A. pasteurianus SP001的最大产酸量为23.1 g/L。本研究以AS1.41为对比菌株,与初筛的42株产醋酸菌株进行产酸量对比(图1)。第5天时,菌株H4、H5、H7、H8、PB2、PD1、LO2、M1、M3的产酸量高于AS1.41(20.7 g/L),其产酸量分别为28.68、27.41、25.76、26.76、23.95、27.03、23.53、22.42、21.91 g/L。因此,将这9株菌用于后续研究。
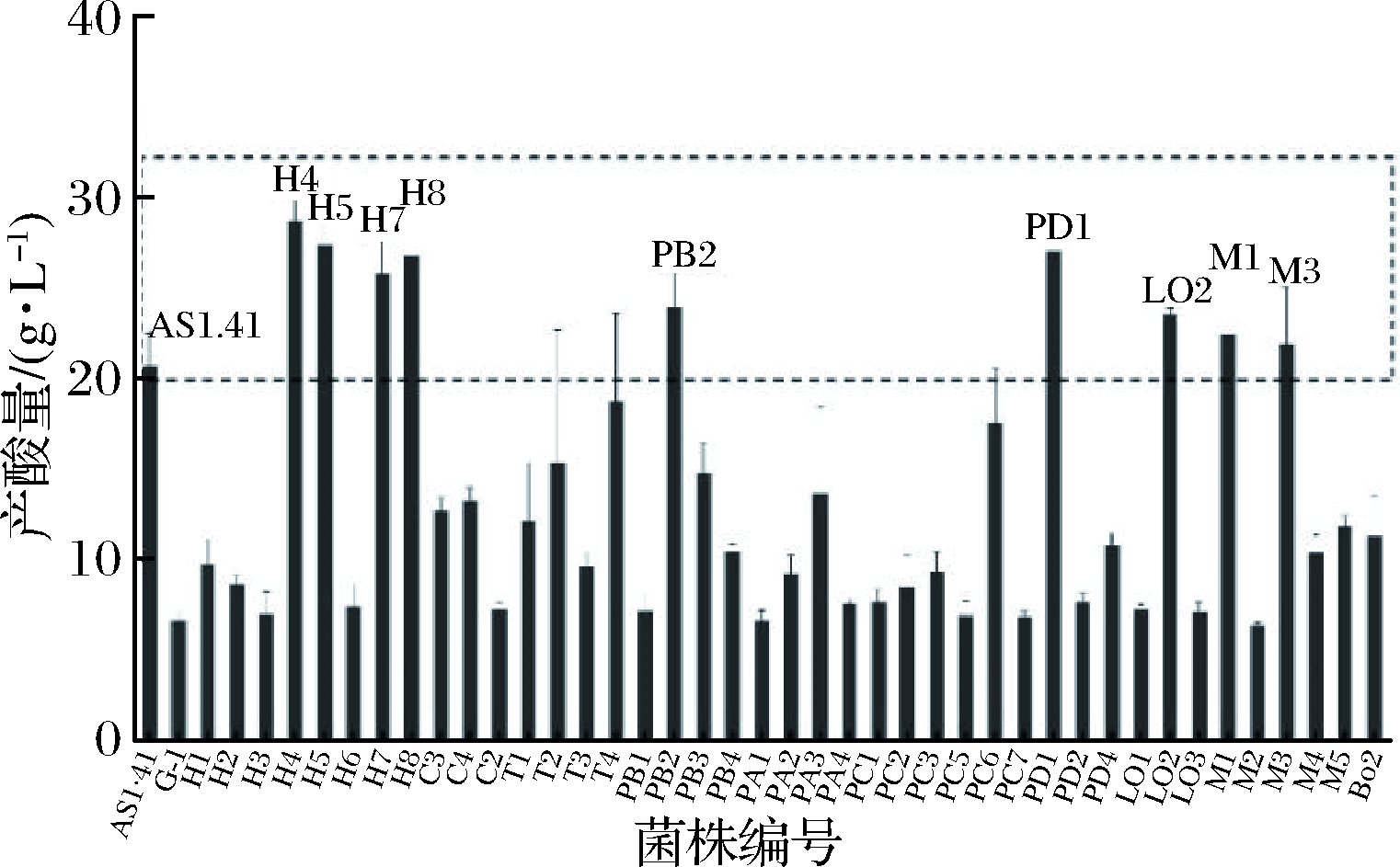
图1 产醋酸菌株产酸量对比
Fig.1 Acid production of producing acetic acid strains
2.1.3 醋酸菌产酸曲线
如图2所示,对比9株菌和AS1.41的产酸曲线可知,整个发酵过程中,醋酸产量随时间的延长而增大,发酵前6 d醋酸产量迅速增加,6 d后醋酸产量增长速度减缓,但总体酸含量增加。其中,PD1产酸量增幅较缓,上升趋势比较滞后。第8天时,AS1.41在产酸量达到最大后出现下降趋势。第12天后,PB2产酸量达到最大,且高于其他菌株,其他菌株的产酸速率和产酸量增加幅度与对比菌株AS1.41相差不大。14 d后,菌株PB2 (28.35 g/L)和LO2 (27.30 g/L)优于对比菌株AS1.41 (26.86 g/L),且比其他菌株有较大优势。
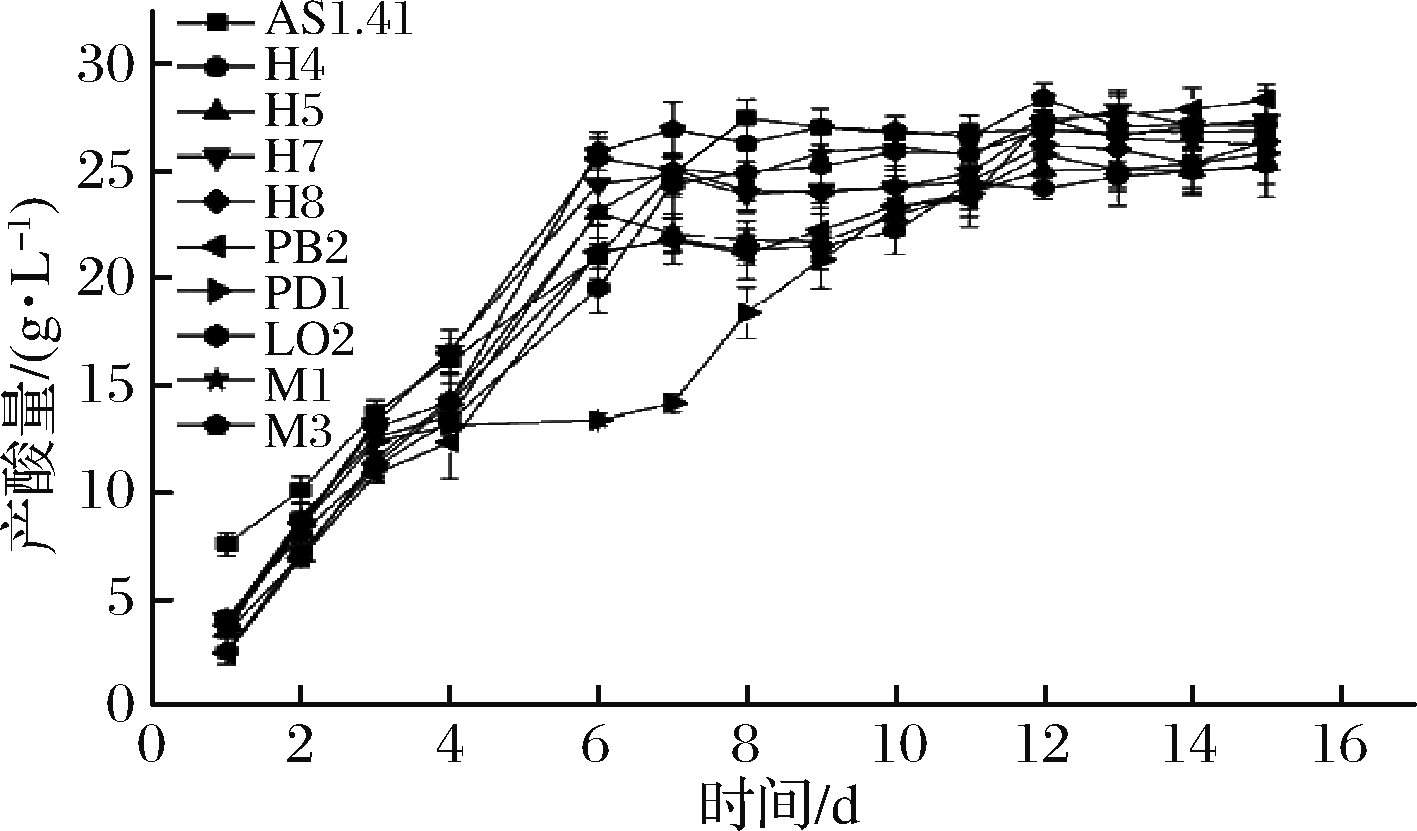
图2 高产酸菌株产酸曲线对比
Fig.2 Comparison of acid production curves of high-yielding acid strains
2.2 筛选优良耐受性的高产酸醋酸菌
乙醇是醋酸发酵的底物,底物(乙醇)含量直接影响着产物(乙酸)的含量。但乙醇也使醋酸菌细胞内的酶变性,对生长有一定的抑制作用。因此,具有一定耐乙醇特性的高产酸醋酸菌菌株在生产中具有优势。CHEN等[22]从醋醅中筛选的A.pasteurianus FY-24 和A.pasteurianus DY-5能在含有12%(体积分数)乙醇的培养液中生长。由图3可知,乙醇浓度影响醋酸菌的生长,随着乙醇浓度的增加,菌株逐渐被抑制,其OD600逐渐减小。由图3-b、图3-c、图3-f、图3-g和图3-i可知,PD1,PB2、H7、H8和M3在高乙醇浓度环境中完全不生长;由图3-a、图3-d和图3-e可知,LO2、H4和H5对高浓度乙醇具有一定耐受性,特别是LO2菌株,能在11%(体积分数)乙醇环境中生长。
醋酸菌是典型的嗜中温菌,温度影响醋酸菌的生长代谢,其生长的最适温度为30 ℃[8]。所以,具有耐温特性的高产酸醋酸菌在有效降低工业生产(冷却水)成本,减少环境污染等方面具有明显优势。SAKI等[23]分离出的耐热醋酸菌(A.pasteurianus SKU1108)被认为是最好的耐热醋酸菌之一,能在38~40 ℃环境下产生醋酸。PERUMPULI等[24]分离的耐高温菌株A.pasteurianus SL13E-2、SL13E-3、SL13E-4,40 ℃,4%(体积分数)乙醇和37 ℃,6%(体积分数)乙醇中产生醋酸。KANCHANARACH等[25]筛选的A.pasteurianus MSU10能在37 ℃生长和产酸。如图3所示,9株分离菌株和AS1.41在42 ℃下均未生长,37 ℃会明显抑制醋酸菌的生长。由图3-a、图3-e和图3-h可知,只有LO2、H5和M1三株菌能在37 ℃下生长,其中,LO2菌株生长良好,H5和M1菌株的生长被抑制。
综上,60 h后,LO2在各胁迫条件下[37 ℃或11%(体积分数)乙醇],OD600值没有明显区别(图3-a)。但胁迫环境明显影响了LO2菌株的生长,延长了延滞期。因此,高产酸菌株LO2具备良好的耐温性或耐醇性,是具有应用前景的醋酸菌。
2.3 优良菌株高温或高乙醇发酵李子醋
LO2菌株和AS1.41菌株在适宜环境[30 ℃、5%(体积分数)乙醇]、高乙醇环境[30 ℃、8%(体积分数)乙醇]和高温环境[37 ℃、5%(体积分数)乙醇]中静置发酵李子醋,结果分别如图4-a~图4-c所示。由图4-a可知,2株菌在适宜环境的生长和产酸性能相似,LO2菌株的最大产酸量(53.88 g/L)高于AS1.41菌株(51.64 g/L)。由图4-b知,高乙醇环境延长了醋酸菌的延滞期,抑制了醋酸菌的生长和产酸。8%(体积分数)乙醇环境下,LO2和AS1.41的生长和产酸有差距,LO2菌株的最大产酸量(59.80 g/L)高于AS1.41(47.78 g/L)。由图4-c可知,37 ℃时,AS1.41被明显抑制,LO2菌株产酸量(46.64 g/L)是AS1.41(25.92 g/L)的1.79倍。
综合图4-a和图4-b,高乙醇环境下,LO2的生长几乎未被明显影响,且产酸量提高(由53.88 g/L升高至59.80 g/L),但AS1.41的生长和产酸都略下降。因此,LO2菌株更适合在高乙醇[8%(体积分数)乙醇]环境下酿制李子醋。综合图4-a和图4-c,当温度由30 ℃上升至37 ℃时,LO2菌株的产酸略降低(由53.88 g/L降至46.64 g/L),但AS1.41的产酸量下降了近1倍(由51.64 g/L降至25.92 g/L)。因此,LO2菌株是具有工业应用潜力的、具有耐受性的高产酸果醋醋酸菌菌种。

a-LO2;b-PO1;c-PB2;d-H4;e-H5;f-H7;g-H8;h-M1;i-M3
图3 不同温度或乙醇浓度下高产酸菌株的生长情况对比
Fig.3 Comparison of the growth of high-yielding acid strain at different temperature or ethanol concentration
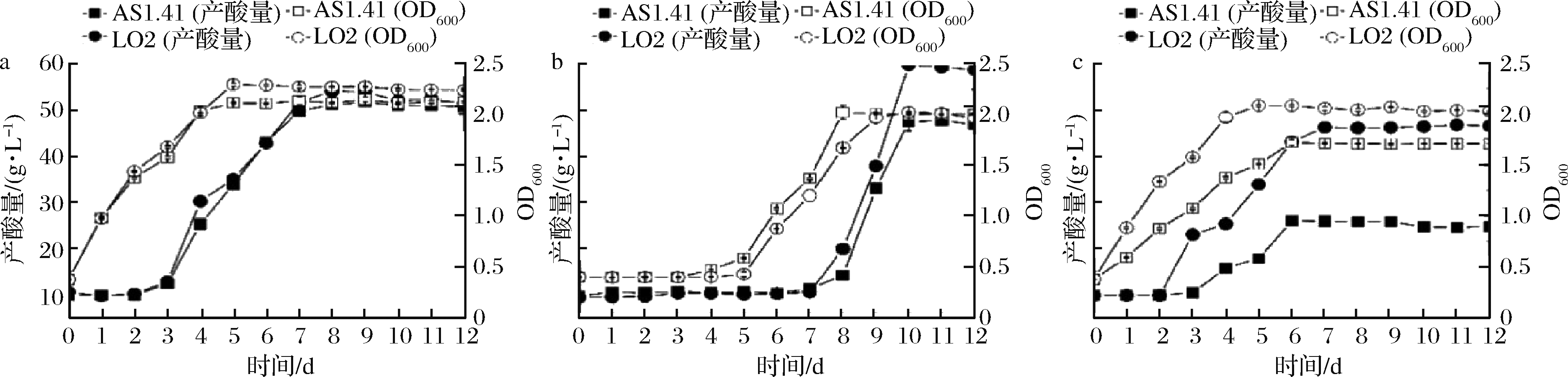
a-30 ℃、5%乙醇;b-30 ℃、8%乙醇;c-37 ℃、5%乙醇
图4 不同温度或乙醇浓度下LO2和AS1.41发酵李子醋的特性
Fig.4 Characteristics of plum vinegar fermented by LO2 and AS1.41 at different temperatures or ethanol concentrations
2.4 李子醋感官评定
2株菌在3种环境中酿造李子醋样品的感官评价如图5所示。6组李子醋样品评分相近,均颜色鲜艳、呈桃红色、有光泽,具有浓郁的果香味和醋香味、香味柔和、无异味,酸味柔和且爽口,清亮透明,没有明显的悬浮物和沉淀。其中,适宜环境时,AS1.41酿造的李子醋的口感协调性要略优于LO2。而高温环境中,LO2酿造的李子醋层次感更多,酸味更厚重。但高乙醇环境中,AS1.41酿造的李子醋酸味中带涩味,协调性欠佳。因此,高温或高乙醇环境下,LO2酿造的李子醋品质优良、与适宜环境发酵的李子醋口感差异性较小,且感官评分优于AS1.41酿造的李子醋。
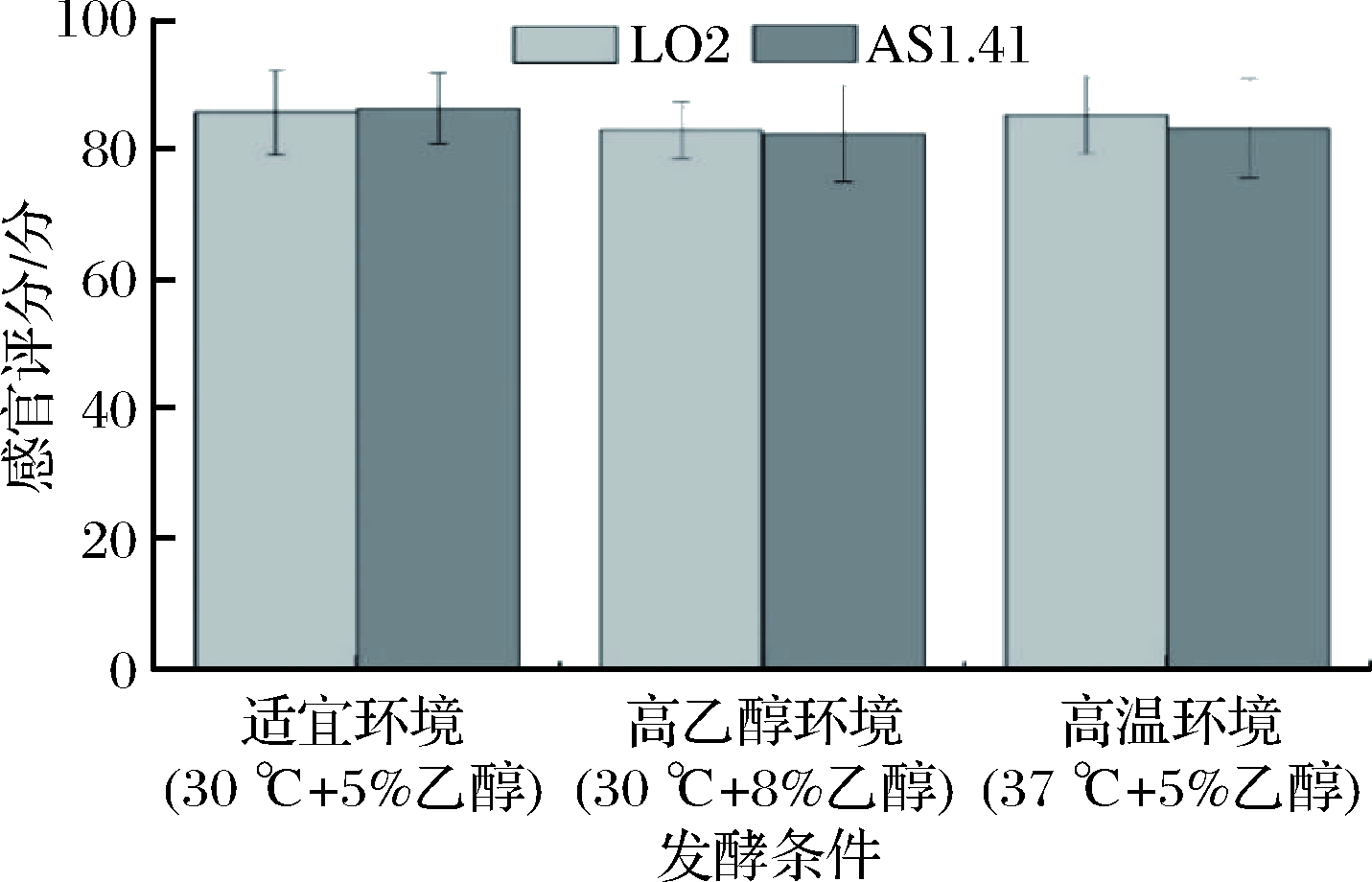
图5 不同条件发酵李子醋的感官评分
Fig.5 Sensory score of plum vinegar fermented under different conditions
2.5 菌株鉴定
2.5.1 菌株菌落形态
优良菌株LO2的菌落形态如图6-a和图6-b所示,乳白色圆形、表面突起、光滑湿润、边缘整齐、易挑取且产生溶钙圈。革兰氏染色如图6-c,革兰氏阴性菌,短杆状或椭圆状,单生或成对或成链生长。
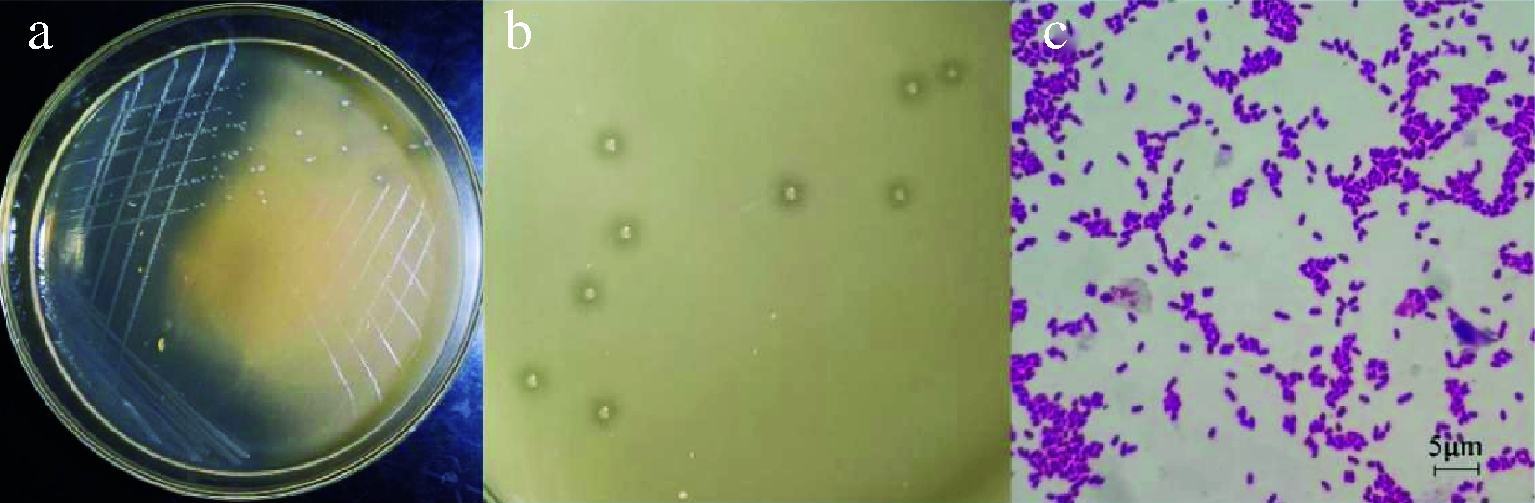
a-菌落形态图;b-单菌落形态图;c-革兰氏染色图
图6 LO2菌株形态特征
Fig.6 Features of strain LO2
2.5.2 16S rDNA鉴定
以LO2菌株的基因组DNA为模板,以27F和1492R为引物,PCR扩增后,用1%琼脂糖凝胶电泳对PCR扩增产物进行检测,在约1 000~2 000 bp处形成1条清晰的扩增条带。LO2菌株的序列在NCBI网站上经过序列比对后,采用MEGA 7.0.1软件构建系统发育树,进行1 000次bootstrap测试分析。菌株LO2与A. malorum NX-11位于同一族群,相似度达到100%。最终,将LO2菌株确定为Acetobacter sp.LO2(Genbank 序列号 MN602472)。

图7 菌株LO2的系统发育树
Fig.7 Phylogenetic tree based on the 16S rDNA sequnences of strain LO2
注:括号内为菌株的16S rRNA基因序列在GenBank中的登录号;标尺的数据为进化距离
3 结论
本研究以腐烂水果(李子、水蜜桃、芒果、香蕉和枇杷)为筛选样品,样品富集后,通过钙圈法初筛和产酸定量复筛后分离得到9株分离菌株。通过全自动生长曲线仪对9株分离菌株在不同乙醇浓度和不同温度条件下的生长情况进行比较,发现菌株LO2在高温(37 ℃)或高乙醇[11%(体积分数)]环境中的生长趋势与生长最佳条件[30 ℃,3%(体积分数)乙醇)]时一致。同时,LO2菌株能在高温或高乙醇下酿制李子醋,并具有较强且稳定的产酸能力,且几乎不影响风味。经形态观察和16S rDNA序列分析,确定LO2为Acetobacter sp.LO2。因此,LO2是1株具有优良耐受性的果醋专用高产酸醋酸菌,具有良好的工业应用前景,对推动我国果醋行业发展和产品结构调整有积极影响。
[1] MARCO M L, HEENEY D, BINDA S, et al.Health benefits of fermented foods:Microbiota and beyond[J].Curr Opin Biotechnol,2017, 44:94-102.
[2] 李先端, 顾雪竹, 毛淑杰, 等.醋的历史沿革及其保健功能[J].中国实验方剂学杂志, 2011, 17(18):295-297.
LI X D, GU X Z, MAO S J, et al.Historical evolution and health care function of vinegar[J].Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(18):295- 297.
[3] 刘凤珠, 李晓, 王颖颖, 等.水果醋中有机酸成分的分析[J].中国农学通报, 2010, 26(20):94-97.
LIU F Z, LI X, WANG Y Y, et al.Analysis of organic acids in fruit vinegar[J].Chinese Agricultural Science Bulletin, 2010, 26(20):94-97.
[4] 徐子婷, 周文美.绿色食品果醋开发的探讨[J].河北农业科学, 2010, 14(7):74-76.
XU Z T, ZHOU W M.Discussion on the development of green food vinegar[J].Journal of Hebei Agricultural Sciences, 2010,14(7):74-76.
[5] MUNDARAGI A, THANGADURAI D.Process optimization, physicochemical characterization and antioxidant potential of novel wine from an underutilized fruit Carissa spinarum L.Apocynaceae[J].Food Science and Technology,2018,38(3):428-433.
[6] DU J, HAN F, YU P, et al.Optimization of fermentation conditions for Chinese bayberry wine by response surface methodology and its qualities[J].Journal of the Institute of Brewing, 2016, 122(4):763-771.
[7] PITIWITTAYAKUL N, YUKPHAN P, SINTUPRAPA W, et al.Identification of acetic acid bacteria isolated in Thailand and assigned to the genus Acetobacter by groel gene sequence analysis[J].Annals of Microbiology, 2015, 65(3):1 557-1 564.
[8] HATTORI H, TOSHIHARU Y, MINENOSUKE M, et al.High-temperature sorbose fermentation with thermotolerant Gluconobacter frateurii CHM43 and its mutant strain adapted to higher temperature[J].Applied Microbiology & Biotechnology, 2012, 95(6):1 531-1 540.
[9] ORY I D, ROMERO L E, CANTERO D.Modelling the kinetics of growth of Acetobacter aceti in discontinuous culture:Influence of the temperature of operation[J].Applied Microbiology & Biotechnology, 1998, 49(2):189-193.
[10] 魏长庆, 王海庆, 张凌, 等.葡萄果醋发酵用醋酸菌的分离及鉴定[J].中国酿造, 2010(4):42-45.
WEI C Q, WANG H Q, ZHANG L, et al.Isolation and identification of acetic acid bacteria for grape vinegar fermentation[J].China Brewing, 2010(4):42-45.
[11] 杨颖, 刘欠欠, 陆胜民, 等.青梅果醋醋酸发酵菌种的筛选与鉴定[J].中国食品学报, 2010, 10(3):64-68.
YANG Y, LIU Q Q, LU S M, et al.Screening and identification of acetic acid fermentation strains of green plum vinegar[J].Journal of Chinese Institute of Food Science and Technology, 2010, 10(3):64-68.
[12] 李文, 王陶, 谢昊讯, 等.耐高温、高醇醋酸菌筛选、鉴定及低能离子选育[J].中国食品学报, 2018,18(8):107-114.
LI W, WANG T, XIE H X, et al.Screening, identification and low energy ion breeding of acetic acid bacteria with high temperature resistance and high alcohol content[J].Journal of Chinese Institute of Food Science and Technology, 2018,18(8):107-114.
[13] 娄阳, 张昭寰, 肖莉莉, 等.多重与单一耐药的副溶血性弧菌在纯培养及南美白对虾中生长动力学的参数比较研究[J].现代食品科技, 2015,31(5):181-186.
LOU Y, ZHANG Z H, XIAO L L, et al.Comparative study on growth kinetics of Vibrio parahaemolyticus with multiple and single drug resistance in pure culture and Penaeus vannamei[J].Modern Food Science and Technology, 2015,31(5):181-186.
[14] LIANOU A, KOUTSOUMANIS K P.Effect of the growth environment on the strain variability of Salmonella enterica kinetic behavior[J].Food Microbiology, 2011, 28(4):828-837.
[15] LINDQVIST R.Estimation of Staphylococcus aureus growth parameters from turbidity data:Characterization of strain variation and comparison of methods[J].Applied and Environmental Microbiology, 2006, 72(7):4 862-4 870.
[16] 段珍珍, 袁敏, 常荣, 等.有机酸及挥发性香气在枇杷醋加工中的变化及其对品质的影响[J].食品与发酵工业, 2017,43(12):114-123.
DUAN Z Z, YUAN M, CHANG R, et al.The change of organic acids and volatile flavor substances in the processing of loquat vinegar and its influence on the product quality[J].Food and Fermentation Industries, 2017, 43(12):114-123.
[17] 赵方圆, 李静媛.新型葡萄醋酿造工艺[J].食品与发酵工业, 2019, 45(2):128-132.
ZHAO F Y, LI J Y, Research on brewing process of new grape vinegar[J].Food and Fermentation Industries, 2019, 45(2):128-132.
[18] 周德庆. 微生物学教程[M].第3版.北京:高等教育出版社, 2011:336-338.
ZHOU D Q.Microbiology Course[M].3rd Edition.Beijing:Higher Education Press, 2011:336-338.
[19] R.E.布坎南.伯杰细菌鉴定手册[M].第8版.北京:科学出版社, 1984.
R.E BUCHANAN.Berger′s Handbook of Bacterial Identification[M].8th Edition.Beijing:Science Press, 1984.
[20] 李华敏, 李林, 黄萍萍, 等.苹果醋发酵用醋酸杆菌的筛选与鉴定[J].中国调味品, 2018, 43(10):22-25;36.
LI H M, LI L, HUANG P P, et al.Screening and identification of Acetobacter for apple vinegar fermentation[J].China Condiment, 2018, 43(10):22-25;36.
[21] 孙一帆, 梁新红, 高莹莹.自然发酵的葡萄醋中醋酸菌的分离鉴定[J].中国酿造, 2017, 36(11):28-32.
SUN Y F, LIANG X H, GAO Y Y.Isolation and identification of acetic acid bacteria from naturally fermented grape vinegar[J].China Brewing, 2017, 36(11):28-32.
[22] CHEN Y, BAI Y, LI D, et al.Correlation between ethanol resistance and characteristics of PQQ-dependent ADH in acetic acid acteria[J].European Food Research and Technology, 2016, 242:837-847.
[23] SAKI A, THEERAGOOL G, MATSUSHITA K, et al.Development ofthermotolerant acetic acid bacteria useful for vinegar fermentation at higher temperatures[J].Bioence Biotechnology & Biochemistry, 1997, 61(1):138-145.
[24] PERUMPULI P A B N, WATANABE T, TOYAMA H.Identification and characterization of thermotolerant acetic acid bacteria strains isolated from coconut water vinegar in Sri Lanka[J].Bioence Biotechnology & Biochemistry, 2014, 78(3):533-541.
[25] KANCHANARACH W, THEERAGOOL G, YAKUSHI T, et al.Characterization of thermotolerant Acetobacter pasteurianus strains and their quinoprotein alcohol dehydrogenases[J].Appl Microbiol Biotechnol, 2010, 85:741-751.