食品微生物检验是保证食品安全的重要措施,在检验过程中,需根据不同微生物种属的特点选择对应的培养基进行检测,因此培养基及试剂的质量控制尤为重要。早在20世纪80年代,国际食品微生物学和卫生学委员会培养基工作组(The International Committee for Food Microbiology and Hygiene,ICFMH)、国际标准化组织(International Standards Organization,ISO)、食品药品监督管理局(Food and Drug Administration,FDA)相继建立了完整的培养基质控体系[1-3]。近年来,国家颁布的各类标准都对培养基的质量控制制定了严格规定[4-8]。GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》提出用测试菌株来评价培养基的微生物性能指标,测试菌株是具有其代表种的稳定特性并能有效证明特定培养基最佳性能的一套菌株,主要购于标准菌种保藏中心,也可以是实验室自己分离的具有良好特性的菌株。此外,测试菌株最好使用从食品或水中分离的菌株[9]。
大肠埃希氏菌(Escherichia coli)属于革兰氏阴性短杆菌,是食源性疾病的主要病原菌之一。该菌作为常用质控菌株,已被广泛应用于食品、饲料、医药等多个领域[10-12]。GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D中,仅推荐了1株大肠埃希氏菌ATCC 25922,涉及评价6类共58种培养基的质量。质控实验室在验收培养基时,可采用多株特性良好的菌株进行质控。CICC 24652和CICC 24176为我国公开保藏菌株,分类学地位明确,分别来源于果仁菠菜和地表水。以这2株测试菌株为代表,考察其对培养基的灵敏度和指示能力,以期为国标中大肠埃希氏菌的补充或替换提供数据支持。
1 材料与方法
1.1 试验菌株
E.coli CICC 24176、CICC 24652保藏于中国工业微生物菌种保藏管理中心,E.coli ATCC 25922来源于美国典型菌种保藏中心。
1.2 培养基及试剂
营养琼脂(nutrient agar,NA)、胰蛋白胨大豆琼脂(tryptic soy agar,TSA)、平板计数琼脂(plate count agar,PCA)、麦康凯琼脂(macconkey agar,MAC)、伊红美蓝琼脂(eosin-methylene blue agar,EMB)、结晶紫中性红胆盐琼脂(violet red bile agar,VRBA)、HE琼脂(hektoen enteric agar,HE)、木糖赖氨酸脱氧胆盐琼脂(xylose lysine desoxycholate agar,XLD)、亚硫酸铋琼脂(bismuth sulfite agar,BS)、李氏增菌肉汤(Listeria enrichment broth base,LB1,LB2)、EC肉汤(E.Coli broth,EC)、三糖铁琼脂、尿素琼脂(pH 7.2)、月桂基磺酸盐胰蛋白胨肉汤(lauryl sulfate tryptose broth,LST)、煌绿乳糖胆盐肉汤(brilliant green lactose bile broth,BGLB)、脑心浸液、MUG-LST、氧化酶试剂等,北京陆桥技术股份有限公司;亚硒酸盐胱氨酸增菌液(selenite cystine broth,SC)、黏液酸发酵管,广东环凯微生物科技有限公司;缓冲动力硝酸盐发酵管,青岛海博有限公司。
1.3 实验方法
1.3.1 非选择性分离和计数固体培养基生长率定量测试方法
测试菌株与对照菌株分别制备浓度为200~2 000 CFU/mL的菌悬液,接种量为0.1 mL,均匀涂布于待测平板和TSA参比平板,每一稀释度接种2个平板。待测培养基及培养条件见GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D,NA、TSA在(36±1)℃培养24 h,PCA在(36±1)℃培养48 h。以生长率≥0.7为指标考察2株测试菌株的生长能力。生长率按公式(1)计算:
(1)
式中:PR,生长率;NS,待测培养基平板上得到的菌落总数;N0,参比培养基平板上获得的菌落总数。
1.3.2 选择性分离和计数固体培养基的测试方法
1.3.2.1 生长率定量测试方法
工作菌悬液制备及接种方法同1.3.1,培养基及培养条件见GB 4789.28—2013《食品安全国家标准食品微生物学检验培养基和试剂的质量要求》附录D,MAC、EMB、VRBA、VRB-MUG琼脂均在(36±1)℃培养24 h。对照ATCC 25922,以生长率及菌落特征为指标考察测试菌株的生长能力,要求菌株在选择性分离培养基上的生长率≥0.5,最低为0.1;在选择性计数培养基上的生长率≥0.7,特征反应与对照菌株表现一致。
1.3.2.2 (选择性)半定量测试方法
测试菌株与对照菌株分别接种于BHI肉汤,36 ℃培养18 h。用1 μL接种环取1环,在测试培养基上划6条平行直线,同时接种2个平板。培养基及培养条件见GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D,PALCAM琼脂、李斯特氏菌显色培养基、BS均在(36±1)℃培养48 h;改良CCD(modified CCD,mCCD)琼脂、Skirrow琼脂、Baird-Parker琼脂均在(42±1)℃培养48 h;甘露醇卵黄多粘菌素(mannitol egg yolk polymyxin,MYP) 琼脂在(30±2)℃培养48 h,其余培养基均在(36±1)℃培养24 h。对照ATCC 25922,以生长指数G<5为指标考察测试菌株生长能力。
生长指数G的计算方法是观察平板上6条线的生长情况,有比较稠密菌落生长的划线G为1,每个培养皿最多为6分。如果仅一半的线有稠密的菌落生长,则G为0.5。如果划线上没有菌落生长、生长量少于划线的一半或菌落生长微弱,则G为0。
1.3.2.3 (特异性)定性测试方法
工作菌悬液制备方法同1.3.2.2。用1 μL接种环取1环,分别在测试培养基表面四区划线。培养基及培养条件见GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D,沙门氏菌显色培养基、CT-SMAC、O157显色培养基、志贺氏菌显色培养基、阪崎克罗诺杆菌显色培养基均在(36±1)℃培养24 h;CIN-1、改良Y培养基均在(26±1)℃培养48 h。对照ATCC 25922,以典型菌落特征为指标考察测试菌株在不同培养基的特征反应能力。
1.3.3 选择性增菌培养基的半定量测试方法
测试菌株与对照菌株分别制备浓度为1 000~5 000 CFU/mL的菌悬液。接种1 mL菌液至10 mL增菌培养基中,2个平行管,同时倾注TSA平板确定接种量。培养后吸取10 μL培养液,均匀涂布TSA平板,每管接种1个平板。培养基及培养条件见GB 4789.28—2013《食品安全国家标准食品微生物学检验培养基和试剂的质量要求》附录D,LB1,LB2在(30±1)℃培养24 h,改良月桂基硫酸盐胰蛋白胨肉汤-万古霉素在(44±0.5)℃培养24 h;其余培养基均在(36±1)℃培养24 h。对照ATCC 25922,以培养后菌落数<100 CFU为指标考察测试菌株对选择性增菌培养基的识别能力。
1.3.4 选择性液体计数培养基的半定量测试方法
测试菌株与对照菌株分别制备浓度为10~100 CFU/mL的工作菌悬液。接种1 mL菌液至10 mL的培养基中,同时倾注TSA平板确定接种量,培养基及培养条件见GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D,LST、BGLB在(36±1)℃培养48 h;EC肉汤在(44.5±0.2)℃培养48 h。对照ATCC 25922,以培养后液体培养基生长浊度达到2为指标考察测试菌的生长能力。
1.3.5 悬浮培养基的定量测试方法
测试菌株与对照菌株分别制备浓度为100~1 000 CFU/mL的工作菌悬液。接种1 mL菌液至10 mL磷酸缓冲盐溶液(phosphate buffer saline,PBS)测试培养基中,2个平行管,混匀后每管取1 mL悬液倾注TSA平板,进行菌落计数。剩余已接种菌液的PBS培养基置(20~25)℃放置45 min后,再每管吸取1 mL倾注TSA平板。对照ATCC 25922,以放置后菌落数的变化程度在±50%为指标考察测试菌在PBS培养基中的稳定能力。
1.3.6 鉴定培养基测试
测试菌株与对照菌株分别接种BHI肉汤和TSA培养基,36 ℃培养18 h。培养基及培养条件见GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D,醋酸盐利用试验、黏液酸利用试验均在(36±1)℃培养48 h;含铁牛乳培养基在(46±0.5)℃培养2 h与5 h均观察;明胶培养基在(36±1)℃培养72 h;酪蛋白琼脂在(30±1)℃培养24 h;氧化酶试剂直接观察结果;其余培养基均在(36±1)℃培养24 h。对照ATCC 25922,以典型菌落特征为指标考察测试菌株在不同鉴定培养基上的生长情况。
2 结果与分析
2.1 非选择性分离和计数固体培养基生长率定量测试结果
生长率能客观地、量化地评估培养基对目标菌生长繁殖的影响[13],菌株生长率越高说明培养基对目标菌的促生长能力越强。GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D中,大肠埃希氏菌质控的非选择性固体培养基有营养琼脂NA、TSA和PCA,要求菌株生长率≥0.7,即培养基质量合格,因此,需要确认测试菌株在该类培养基上的生长能力。
NA、TSA和PCA作为通用培养基,适合大部分微生物的生长。测试菌株在该类培养基上的生长情况见表1,CICC 24176在3种培养基上生长率≥1.0,CICC 24652的生长率≥0.9,对照菌株ATCC 25922的生长率≥0.9。结果表明,2株测试菌生长能力良好,可用于该类培养基的定量质控。
表1 非选择性固体培养基生长率测试结果
Table 1 Result of growth rate test on non-selective separation medium

培养基培养基分类菌株名称及编号生长率(PR)E. coli ATCC 259221.1NAE. coli CICC 241761.1非选择性分离E. coli CICC 246520.9E. coli ATCC 259221.0TSAE. coli CICC 241761.1E. coli CICC 246521.0E. coli ATCC 259220.9PCA非选择性计数E. coli CICC 241761.0E. coli CICC 246520.9
2.2 选择性分离和计数固体培养基的测试结果
2.2.1 生长率定量测试结果
GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D中,大肠埃希氏菌质控的选择性分离和计数培养基有MAC、EMB、VRBA和VRB-MUG琼脂,这些培养基均用于大肠菌群的检测。标准要求大肠埃希氏菌作为目标菌,在选择性分离培养基上的生长率≥0.5,最低为0.1;在选择性计数培养基上的生长率≥0.7,即培养基质量合格。因此,需要确认测试菌株在该类培养基上的生长能力及特征反应。
由表2和图1可知,测试菌株在4种培养基上的生长率均≥0.8,菌落特征也与ATCC 25922表现一致。说明测试菌株生长能力良好,菌落特征明显,可用于该类培养基的定量质控。
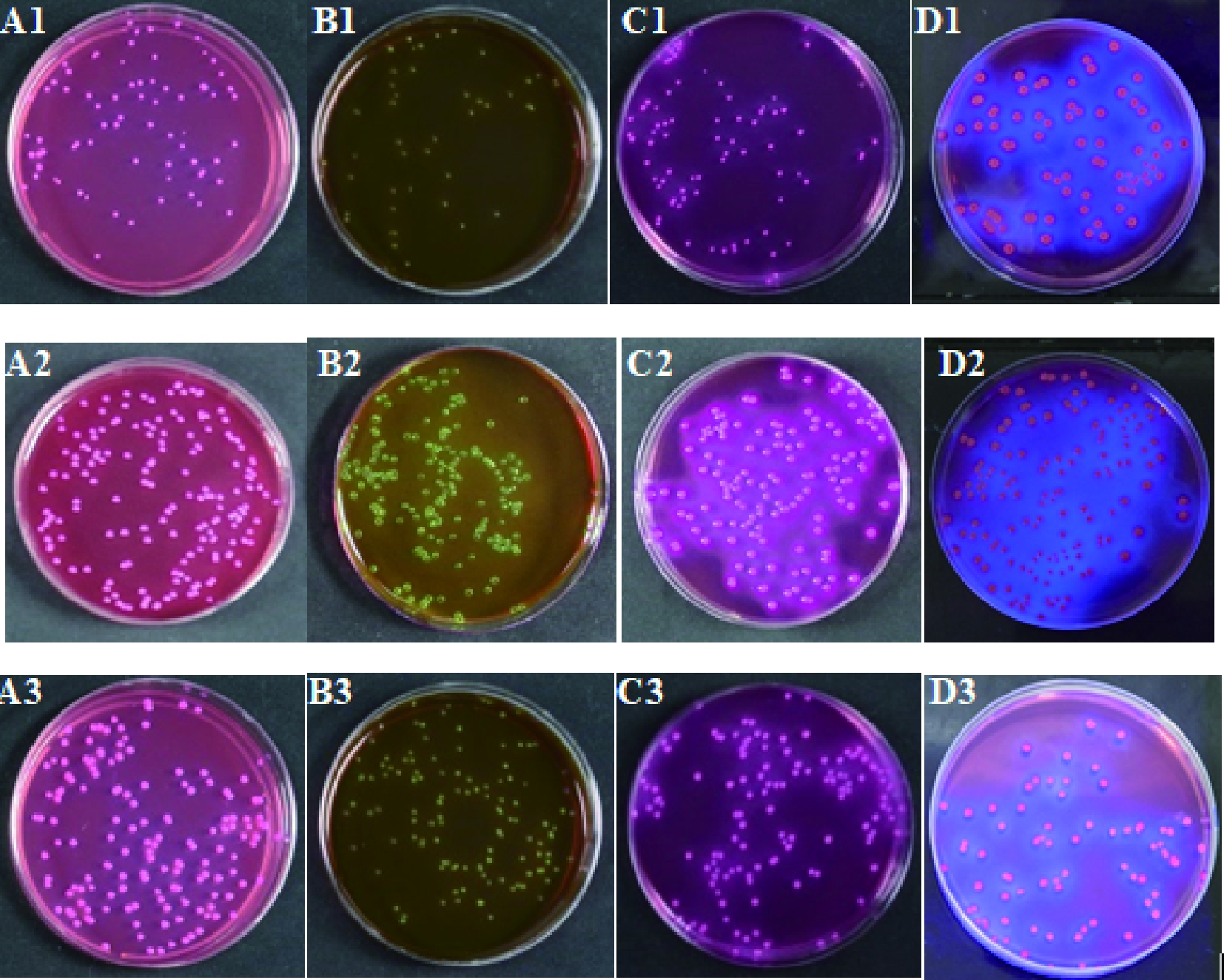
A1~D1、A2~D2、A3~D3分别为ATCC 25922、CICC 24176和
CICC 24652在4种培养基的菌落特征;
培养基A~D依次为MAC、EMB、VRBA和VRB-MUG
图1 菌株在4种培养基上的菌落特征
Fig.1 Characteristic reactions of strains on four medium
表2 生长率定量测试结果
Table 2 Result of growth rate quantitative test
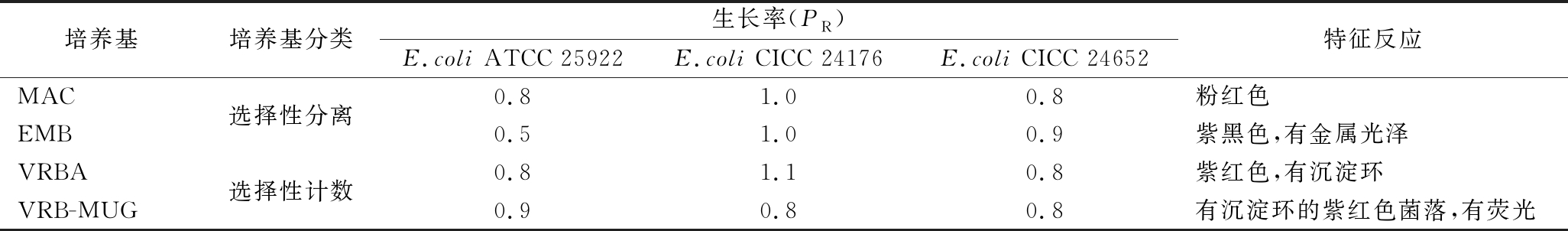
培养基培养基分类生长率(PR)E.coli ATCC 25922E.coli CICC 24176E.coli CICC 24652特征反应MAC选择性分离0.81.00.8粉红色EMB0.51.00.9紫黑色,有金属光泽VRBA选择性计数0.81.10.8紫红色,有沉淀环VRB-MUG0.90.80.8有沉淀环的紫红色菌落,有荧光
2.2.2 半定量(选择性)测试结果
选择性培养基是一类支持目标菌生长而抑制非目标菌生长的培养基,通过生长指数G来反映结果,G值越低,说明培养基对非目标菌的选择性越强。GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D将大肠埃希氏菌作为非目标菌评价培养基的选择性,要求生长指数G≤1,至少应达到<5。因此,需要确认测试菌株在该类培养基上的生长能力。
大肠埃希氏菌涉及评价13种选择性培养基,由表3可知,测试菌株呈现弱生长或被完全抑制。菌株CICC 24176在HE、XLD培养基的生长指数G=2,其余培养基生长指数G≤1。菌株CICC 24652仅在HE培养基的生长指数G=1.5,其余培养基生长指数G≤1。对照菌株ATCC 25922在HE、XLD培养基的生长指数1<G<5,其余培养基生长指数G≤1。结果表明,测试菌株在该类培养基上生长指数G均<5且特征反应与ATCC 25922表现一致,可用于选择性培养基的质量评价。
表3 半定量(选择性)测试结果
Table 3 Result of semi-quantitative(selective)test

培养基培养基分类GE.coli ATCC 25922E.coli CICC 24176E.coli CICC 24652特征性反应HE 221.5橙色菌落,圆形XLD1.520.5黄色菌落,圆形BS0.500.5-PALCAM 000-李斯特氏菌显色培养基选择性分离000-mCCD000-Skirrow000-TCBS000-弧菌显色培养基111-Baird-Parker琼脂000-PDA选择性计数000-孟加拉红培养基000-MYP000-
注:“-”表示标准未作要求
2.2.3 定性(特异性)测试结果
特异性培养基是一类通过显色反应区分目标菌和非目标菌的培养基,比如显色培养基是根据目标菌的一种或多种特异性的酶水解显色底物使菌落本身显色从而快速筛选目标菌的方法,而非目标菌通常会呈现其他颜色或被抑制[14-15]。国标要求大肠埃希氏菌作为非目标菌,应呈现相应的菌落特征。因此,需要确认测试菌株的指示能力。
参照产品说明,阪崎克罗诺杆菌显色培养基使用说明为阪崎肠杆菌显蓝绿色,其他肠杆菌无色或被抑制;改良Y和CIN-1培养基用于分离小肠结肠炎耶尔森氏菌;CT-SMAC用于大肠杆菌O157的分离培养;志贺氏菌显色培养基用于志贺氏菌的显色培养,应为白色,清晰的菌落,周围培养基紫红色,其他菌为黄色、蓝绿色或被抑制。由表4和图2可知,2株测试菌株在以上培养基上的特征反应均与ATCC 25922无差异。沙门氏菌在沙门氏菌显色培养上显紫色,其他菌为蓝绿色、无色或不生长。2菌株显色表现均为非沙门菌的特征,但CICC 24176菌落为白色,CICC 24652生长菌落为蓝绿色,ATCC 25922菌落亦为蓝绿色;O157显色培养基用于O157菌的显色培养,菌落显(淡)紫红色,其他菌为无色、蓝绿色或不生长。CICC 24176在此培养基上被抑制未生长,CICC 24652菌落为浅灰色,而ATCC 25922同样被抑制,仅在平皿一区生长了蓝绿色单菌落。不同菌株引起的特异性酶反应不同是产生菌株显色差异的主要原因。综上可知,2株测试菌株在部分培养基上存在生长特性的差异,但均是非目标菌的特征,可用于该类培养基的定性质控。
表4 定性(特异性)测试结果
Table 4 Result of qualitative(specificity)test
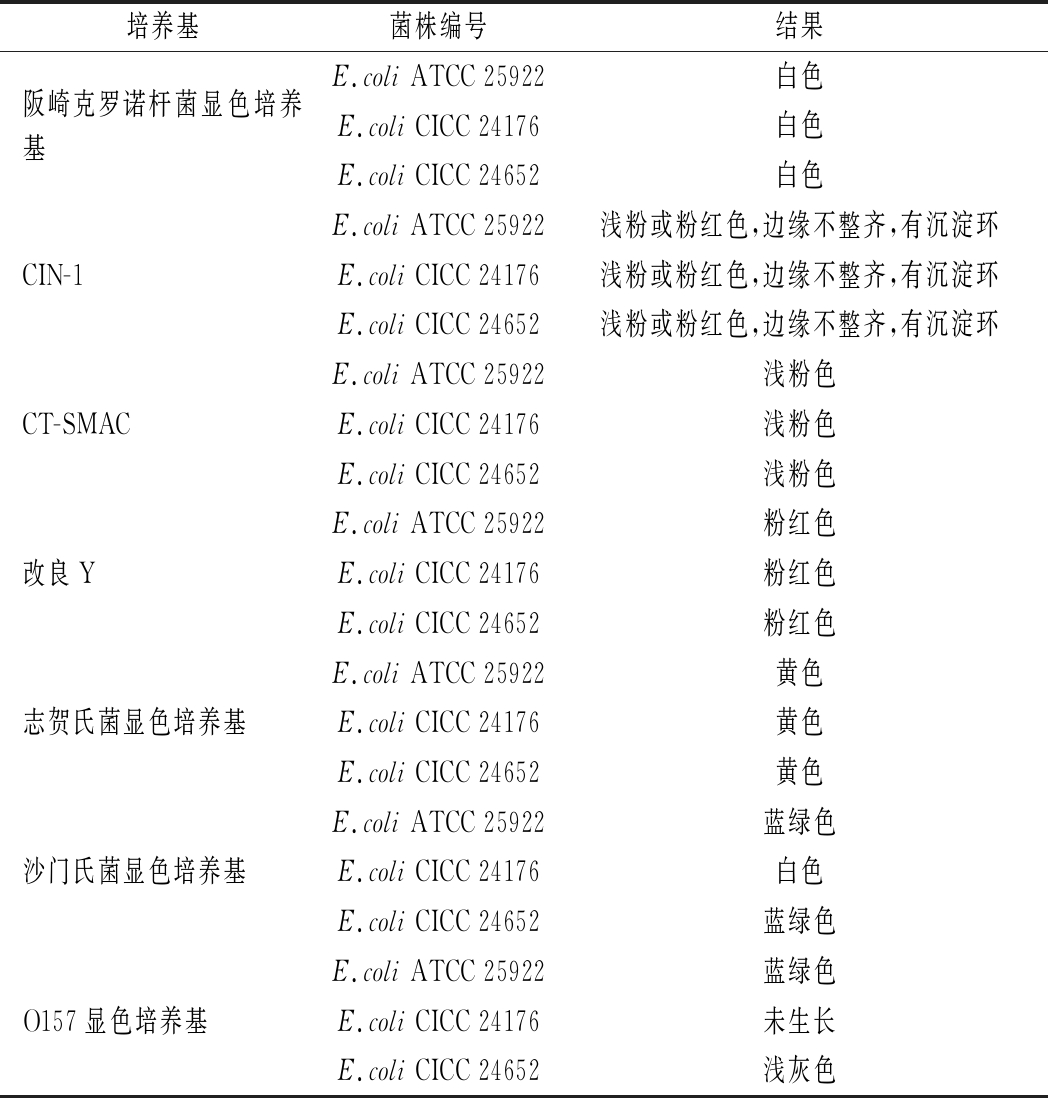
培养基菌株编号结果阪崎克罗诺杆菌显色培养基E.coli ATCC 25922白色E.coli CICC 24176白色E.coli CICC 24652白色CIN-1E.coli ATCC 25922浅粉或粉红色,边缘不整齐,有沉淀环E.coli CICC 24176浅粉或粉红色,边缘不整齐,有沉淀环E.coli CICC 24652浅粉或粉红色,边缘不整齐,有沉淀环CT-SMACE.coli ATCC 25922浅粉色E.coli CICC 24176浅粉色E.coli CICC 24652浅粉色改良YE.coli ATCC 25922粉红色E.coli CICC 24176粉红色E.coli CICC 24652粉红色志贺氏菌显色培养基E.coli ATCC 25922黄色E.coli CICC 24176黄色E.coli CICC 24652黄色沙门氏菌显色培养基E.coli ATCC 25922蓝绿色E.coli CICC 24176白色E.coli CICC 24652蓝绿色O157显色培养基E.coli ATCC 25922蓝绿色E.coli CICC 24176未生长E.coli CICC 24652浅灰色
2.3 选择性增菌培养基测试结果
选择性增菌培养基是能够允许特定微生物在其中繁殖,而部分或全部抑制其他微生物生长的培养基。GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D中,大肠埃希氏菌作为非目标菌涉及对9种选择性增菌培养基进行评价,要求菌株培养后菌落数应<100 CFU,即培养基合格。因此,需要考察测试菌株在该类培养基上的被抑制程度。

A1~G1、A2~G2、A3~G3分别代表菌株ATCC 25922,CICC 24176,CICC 24652的菌落特征;培养基A~G顺序依次为阪崎克罗诺杆菌显色、CIN-1、CT-SMAC、改良Y、志贺氏菌显色、沙门氏菌显色和O157显色培养基
图2 特异性培养基上的菌落特征
Fig.2 Characteristic reactions of strains on specific medium
由表5可知,菌株CICC 24652在9种培养基上生长均被有效抑制,与ATCC 25922表现一致,菌落数<100 CFU。CICC 24176在8种培养基上表现与ATCC 25922一致,仅在SC上培养后菌落数超过100 CFU。SC培养基可对伤寒及其他沙门菌做选择性增菌,其中的亚硒酸盐有剧毒,可抑制非沙门氏菌的大多数革兰氏阴性肠道菌,而菌株CICC 24176未被抑制,说明该菌对亚硒酸盐的毒性不敏感,这可能与该类菌具有某些特异性酶有关[13]。
表5 选择性增菌培养基测试结果
Table 5 Result of selective enrichment medium test
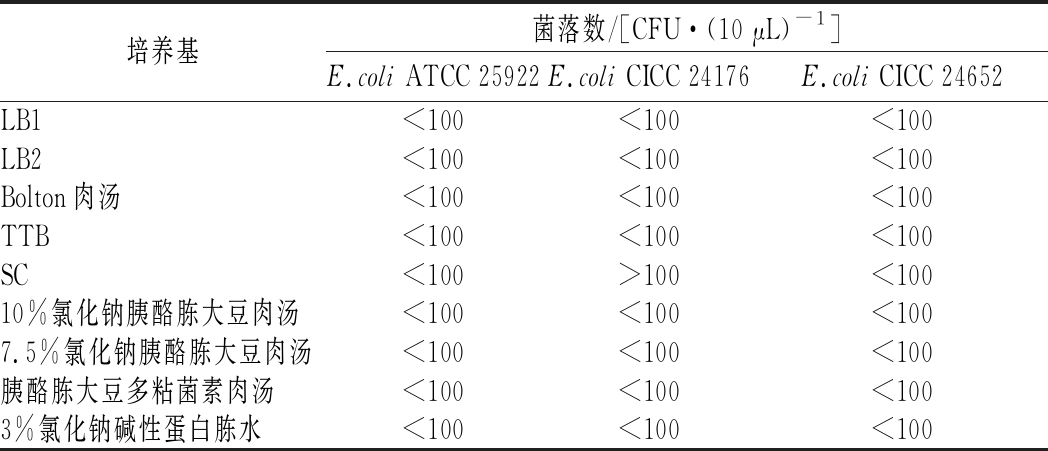
培养基菌落数/[CFU·(10 μL)-1]E.coli ATCC 25922E.coli CICC 24176E.coli CICC 24652LB1<100<100<100LB2<100<100<100Bolton肉汤<100<100<100TTB<100<100<100SC<100>100<10010%氯化钠胰酪胨大豆肉汤<100<100<1007.5%氯化钠胰酪胨大豆肉汤<100<100<100胰酪胨大豆多粘菌素肉汤<100<100<1003%氯化钠碱性蛋白胨水<100<100<100
2.4 选择性液体计数培养基测试结果
BGLB、LST肉汤均用于大肠菌群、大肠杆菌的测定;EC肉汤液体培养基用于粪大肠菌群、大肠杆菌的测定。 GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》规定用目测的浊度值评估结果,0表示无浑浊,1表示很轻微混浊,2表示严重混浊。要求大肠埃希氏菌作为目标菌,培养后浊度值应为2,产气应为1/3或以上,培养基才合格。因此,需要考察测试菌株在此类培养基上的生长能力。
由表6可知,测试菌株在3种肉汤液体培养基生长浊度均为2,产气情况为1/3,与ATCC 25922表现一致,可用于选择性液体计数培养基的质量评价。
表6 选择性液体计数培养基测试结果
Table 6 Result of selective liquid counting medium test
培养基菌株编号浊度值产气BGLB肉汤E.coli ATCC 2592221/3E.coli CICC 2417621/3E.coli CICC 2465221/3EC肉汤E.coli ATCC 2592221/3E.coli CICC 2417621/3E.coli CICC 2465221/3LST肉汤E.coli ATCC 2592221/3E.coli CICC 2417621/3E.coli CICC 2465221/3
2.5 悬浮培养基测试结果
PBS用于菌落总数,大肠菌群,金黄色葡萄球菌的样品制备。GB 4789.28—2013《食品安全国家标准食品微生物学检验培养基和试剂的质量要求》附录D要求大肠埃希氏菌在PBS中放置45 min前后菌落数变化在±50%,即培养基合格。因此,需要确认测试菌株在PBS中的稳定情况。
由表7可知,测试菌株的菌落数变化程度均<10%,ATCC 25922菌落数变化为20%,说明测试菌株的稳定性更好,可用于悬浮培养基的质量评价。
表7 悬浮培养基测试结果
Table 7 Result of suspension medium test

培养基菌株编号菌落数变化/%PBSE.coli ATCC 2592220E.coli CICC 241769E.coli CICC 246522.2
2.6 鉴定培养基及试剂测试结果
GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》附录D中大肠埃希氏菌共质控18种鉴定培养基,因此,需要确认测试菌株在相应培养基上的典型特征。由表8可知,菌株CICC 24176在18种鉴定培养基上呈现典型特征且与ATCC 25922一致,菌株CICC 24652在16种鉴定培养基上呈现典型特征且与ATCC 25922一致。由图3可知,菌株CICC 24652没有动力,在SIM(hydrogen sulfide indole motility)动力及缓冲动力硝酸盐培养基实验中表现为阴性。
表8 鉴定培养基测试结果
Table 8 Result of identification medium test

培养基菌株编号生化特征培养基菌株编号生化特征E. coli ATCC 25922生长良好,A/A;产气;不产硫化氢E. coli ATCC 25922阳性,培养基变黄三糖铁琼脂E. coli CICC 24176生长良好,A/A;产气;不产硫化氢乳糖发酵管E. coli CICC 24176阳性,培养基变黄E. coli CICC 24652生长良好,A/A;产气;不产硫化氢E. coli CICC 24652阳性,培养基变黄E. coli ATCC 25922生长良好,培养基变黄色E. coli ATCC 25922硫化氢- 动力+ 靛基质+尿素琼脂(pH 7.2)E. coli CICC 24176生长良好,培养基变黄色SIM动力培养基E. coli CICC 24176硫化氢- 动力+ 靛基质+E. coli CICC 24652生长良好,培养基变黄色E. coli CICC 24652硫化氢- 动力- 靛基质+E. coli ATCC 25922阳性,滴加靛基质试剂,显红色E. coli ATCC 259222~8 ℃呈固态蛋白胨水(靛基质试验)E. coli CICC 24176阳性,滴加靛基质试剂,显红色明胶培养基E. coli CICC 241762~8 ℃呈固态E. coli CICC 24652阳性,滴加靛基质试剂,显红色E. coli CICC 246522~8 ℃呈固态E. coli ATCC 25922阳性,培养基变黄E. coli ATCC 25922菌落周围无透明圈,培养基由绿变蓝葡萄糖发酵管E. coli CICC 24176阳性,培养基变黄酪蛋白琼脂E. coli CICC 24176菌落周围无透明圈,培养基由绿变蓝E. coli CICC 24652阳性,培养基变黄E. coli CICC 24652菌落周围无透明圈,培养基由绿变蓝E. coli ATCC 25922阳性,培养基变黄E. coli ATCC 25922阳性,有荧光甘露醇发酵管E. coli CICC 24176阳性,培养基变黄MUG-LSTE. coli CICC 24176阳性,有荧光E. coli CICC 24652阳性,培养基变黄E. coli CICC 24652阳性,有荧光E. coli ATCC 25922阳性,培养基不变色E. coli ATCC 25922扩散生长,加试剂后变红纤维二糖发酵管E. coli CICC 24176阳性,培养基不变色缓冲动力-硝酸盐E. coli CICC 24176扩散生长,加试剂后变红E. coli CICC 24652阳性,培养基不变色E. coli CICC 24652未扩散生长,加试剂后变红E. coli ATCC 25922阳性,培养基变黄缓冲葡萄糖蛋白E. coli ATCC 25922MR变红,V-P不变黏液酸利用试验E. coli CICC 24176阳性,培养基变黄胨水[甲基红(MR)E. coli CICC 24176MR变红,V-P不变E. coli CICC 24652阳性,培养基变黄和V-P试验]E. coli CICC 24652MR变红,V-P不变E. coli ATCC 25922不发酵E. coli ATCC 25922阴性,不变色含铁牛乳培养基E. coli CICC 24176不发酵氧化酶试剂E. coli CICC 24176阴性,不变色E. coli CICC 24652不发酵E. coli CICC 24652阴性,不变色E. coli ATCC 25922阳性,培养基变蓝色E. coli ATCC 25922阴性,红色杆状醋酸盐E. coli CICC 24176阳性,培养基变蓝色革兰氏染色液E. coli CICC 24176阴性,红色杆状E. coli CICC 24652阳性,培养基变蓝色E. coli CICC 24652阴性,红色杆状

从左至右菌株顺序为空白,ATCC 25922,CICC 24176,CICC 24652
a-SIM动力;b-缓冲动力硝酸盐
图3 SIM和缓冲动力硝酸盐实验结果
Fig.3 Test on SIM and buffer power nitrate
3 结论与讨论
通过研究测试菌株E.coli CICC 24176和CICC 24652在6类58种培养基上的生长特性,评估菌株质控食品检验培养基的适用性。2株测试菌分别在非选择性分离和计数固体培养基、选择性分离和计数固体培养基、选择性增菌培养基、选择性液体计数培养基、悬浮培养基和鉴定培养基上呈现各自特点。CICC 24176在57种培养基上呈现典型生长特性且与ATCC 25922表现一致,CICC 24652在56种培养基上呈现典型生长特性且与ATCC 25922表现一致,二者可分别用于评价相应培养基的微生物指标。本研究结果对补充新的大肠埃希氏菌质控菌株具有很好的借鉴意义。
研究发现,测试菌株虽然都是大肠埃希氏菌,但不同菌株间特性差异明显,在验证SC培养基时,大肠作为非目标菌生长应被抑制,但菌株CICC 24176未受影响。SC培养液中的亚硒酸盐并不能抑制所有大肠,有文献报道,某些菌株具有较高的超氧化物歧化酶活性可以抵抗亚硒酸盐的毒害作用[16]。同时本研究发现菌株CICC 24652无动力特性,鞭毛是细菌的运动器官,约50%左右的大肠埃希氏菌有鞭毛[17],而动力特性与菌株鞭毛的个数、长短及培养条件均有关[18-20]。后续将对这2株菌的相应特征进行深入研究,探究其中的机理。BARTL[21]在1985年曾提出用于培养基测试的质控菌株既要选择具有典型生长特性的菌株,也要兼顾呈现差异性生长的非典型菌株。本研究结果也证实了菌株水平间的差异,建议质控实验室使用多株菌对培养基质量进行验收,从而提高实验结果的可靠性。
[1] Quality assurance and quality control of microbiological culture media:Proceedings of the third international symposium, London, 9-13 January, 1984[J].International Journal of Food Microbiology, 1985, 2(1-2).DOI:10.1016/0168-1605(85)90046-7.
[2] National Committee for Clinical Laboratory Standard.NCCLS document M 22-A3 (ISBN 1-56238-536-4)[S].Pennsylvania:NCCLS,2004.
[3] ISO 11133-2014 Microbiology of food, animal feed and water preparation, production, storage and performance testing of culture media[S].Geneva:International Standards Organization, 2014.
[4] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 27405—2008 实验室质量控制规范食品微生物检测[S].北京:中国标准出版社, 2008.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China.China National Standardization Administration Committee.GB/T 27405—2008 Criterion on quality control of laboratories microbiological testing of food[S].Beijing:China Standards Press, 2008.
[5] 中国合格评定国家认可委员. CNAS-CL01-A001:2018 检测和校准实验室能力认可准则在微生物检测领域的应用说明[S].北京:中华人民共和国卫生部, 2018.
China National Accreditation Service for Conformity Assessment.CNAS-CL01-A001:2018 Guidance on the application of testing and calibration laboratory competence accreditation criteria in the field of microbiological testing[S].Beijing:Ministry of Health of the People′s Republic of China, 2018.
[6] 中华人民共和国国家卫生和计划生育委员会.WS/T 232—2002 商业性微生物培养基质量检验规程[S].北京:中华人民共和国卫生部, 2002.
National Health and Family Planning Commission of the People′s Republic of China.WS/T 232—2002 Performance standard of quality assurance for commercially prepared microbiological culture media[S].Beijing:Ministry of Health of the People′s Republic of China, 2002.
[7] 中华人民共和国国家质量监督检验检疫总局. SN/T 1538.2—2016 培养基制备指南第2部分:培养基性能测试实用指南[S].北京:中国标准出版社, 2016.
General Administration of Quality Supervision.SN/T 1538.2—2016 Guidelines on preparation and production of culture media-part 2:Practical guidelines on performance testing of culture media[S].Beijing:China Standards Press, 2016.
[8] 国家药典委员会. 中华人民共和国药典[M].北京:中国医药科技出版社, 2010.
National Pharmacopoeia Committee.Pharmacopoeia of People′s Republic of China[M].Beijing:The Medicine Science and Technology Press of China, 2010.
[9] 国家卫生和计划生育委员会. GB 4789.28—2013 食品安全国家标准 食品微生物学检验培养基和试剂的质量要求[S].北京:中国标准出版社, 2013.
National Health and Family Planning Commission.GB 4789.28—2013 National food safety standard food microbiological examination quality requirements of culture media and reagents[S].Beijing:China Standards Press, 2013.
[10] BAKER C N, HOLLIS D G, THORNSBERRY C, et al.Antimicrobial susceptibility testing of Francisella tularensis with a modified Mueller-Hinton broth[J].Journal of Clinical Microbiology, 1985, 22:212-215.
[11] WEINBERG Z G, CHEN Y, PINTO R, et al.Fate of inoculated Escherichia coli in hay[J].Journal of Applied Microbiology, 2007, 102(6):1 537-1 543.
[12] COYLE M B, LAMPE M F, AITKEN C L, et al.Reproducibility of control strains for antibiotic susceptibility testing[J].Antimicrobial Agents and Chemotherapy, 1976, 10(3):436-440.
[13] 容艳芬, 帅惠萍, 朱海明, 等.肠道致病菌选择性固体培养基质量性能评价方法的探讨[J].中国卫生检验杂志, 2013, 23(6):1 477-1 480.
RONG Y F, SHUAI H P, ZHU H M, et al.Study on method of evaluating the quality of selective solid media for enteric pathogenic bacteria[J].Chinese Journal of Health Laboratory Technology, 2013, 23(6):1 477-1 480.
[14] FRICKER M, REISSBRODT R, EHLING-SCHULZ M.Evaluation of standard and new chromogenic selective plating media for isolation and identification of Bacillus cereus[J].International Journal of Food Microbiology, 2008, 121(1):27-34.
[15] PENG H, FORD V, FRAMPTON E W, et al.Isolation and enumeration of Bacillus cereus from foods on a novel chromogenic plating medium[J].Food Microbiology (London), 2001, 18(3):231-238.
[16] SPRINGER S E, HUBER R E.Sulfate and selenate uptake and transport in wild and in two selenate-tolerant strains of E.coli K-12[J].Archives of Biochemistry and Biophysics, 1973, 156(2):595-603.
[17] BEBIEN M, LAGNIEL G, GARIN J, et al.Involvement of superoxide dismutases in the response of Escherichia coli to selenium oxides[J].Journal of Bacteriology, 2002, 184(6):1 556-1 564.
[18] 杨正时, 王晓新.四株大肠埃希氏菌国际参考菌株动力和鞭毛抗原检定的研究[J].微生物学报, 1990, 30(1):54-57.
YANG Z S, WANG X X.Study on identification for the motility and flagella antigen of four international reference strains of Escherichia coli[J]. Acta Microbiologica Sinica, 1990, 30(1):54-57.
[19] 史慧. 大肠杆菌鞭毛马达的动力学研究[D].合肥:中国科学技术大学, 2019.
SHI H.Studies on the dynamics of Escherichia coli flagellar motor[D].Hefei:University of Science and Technology of China, 2019.
[20] 田延, 丁雪燕, 岑雪, 等.大肠杆菌鞭毛研究进展[J].中国预防兽医学报, 2019, 41(6):649-653.
TIAN Y, DING X Y, CEN X.The research progress of Escherichia coli flagella[J].Chinese Journal of Preventive Veterinary Medicine, 2019, 41(6):649-653.
[21] BARTL V.Choice of test strains[J].International Journal of Food Microbiology, 1985, 2(1-2):99-102.