大米是我国主要粮食作物之一,每年全世界的粮食因霉变而造成的损失远远超过总产量的3%;其中黄曲霉及黄曲霉毒素污染危害最大,黄曲霉毒素B1(aflatoxin B1,AFB1)是黄曲霉菌和寄生曲霉菌的主要代谢产物[1],毒性极强,具有致癌、致畸和致突变作用,被国际癌症研究机构(International Agency for Research on Cancer, IARC)认定为 Ⅰ 类致癌物质,其污染水平受到各国严格控制[2],严重威胁粮食安全和人类健康。
远红外辐照(far infrared irradiation,FIR)是一项热技术,由于FIR范围(3~1 000 μm)内的大多数入射辐射能量都在食品表面吸收,FIR适用于食品的表面加热,且作为一种安全、非化学且快速的表面杀菌方法,被认为是常规化学消毒品如甲基溴的潜在替代品[3]。已有报道红外辐照技术对谷物表面蜡状芽孢杆菌[4]、中温细菌[5]、嗜温需氧菌[6]等细菌的杀灭作用,以及对谷物表面霉菌的灭活效果,刘其耸等[7]报道松花粉在远红外100 ℃加热15 min或110 ℃加热10 min 后,霉菌酵母数分别降低99.71%和99.73%;WILSON等[8]发现远红外处理在降低玉米水分含量的同时还能显著减少表面霉菌总数;王蓓[9]报道新收获的初始水分含量高于21.1% 的稻谷经远红外辐射至60 ℃,保温120 min后水分去除率最高为5.3%,且黄曲霉孢子对数值可降低达8.3 lg CFU/g。
红外线位于电磁波谱中的紫外线和微波之间,其杀菌机制类似于紫外线(DNA损伤)和微波加热(感应加热),主要依靠热效应及特征吸收[10]。目前认为远红外的热效应会破坏微生物细胞中的DNA、RNA、核糖体、细胞包膜和蛋白质,但作用机理尚不清楚,且关于远红外对黄曲霉产AFB1能力的影响鲜有报道。本文以接种黄曲霉孢子的大米为原料,在红外发射波长5~15 μm,以及前期确定远红外辐照最适条件115 ℃ 加热5 min的条件下[11],研究远红外辐照对大米表面黄曲霉孢子的杀灭效果以及对黄曲霉菌产AFB1能力的影响,同时测定其对黄曲霉孢子活力抑制率,观察细胞结构、膜通透性及胞内蛋白的变化,旨在为远红外杀菌机理研究提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌种与培养基
黄曲霉菌Aspergillus flavus CGMCC 3.4408,中国微生物菌种保藏管理中心;孟加拉红培养基,国药集团化学试剂有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、产毒培养基,实验室自制。
1.1.2 试验材料
粳米(二级,含水质量分数14.31%),上海祥森米业有限公司;AFB1标准品(纯度≥99%),以色列Fementek公司;碘化丙啶(propidium iodide, PI)、噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT),BD公司;乙腈为色谱纯,其余试剂均为分析纯。
1.1.3 仪器与设备
远红外层式烘箱,上海热丽科技集团有限公司研制;Waters e2695型高效液相色谱仪(配有荧光检测器),美国Waters公司;1510型全波长酶标仪,美国赛默飞世尔科技公司;DMi8型倒置生物荧光显微镜,德国Leica公司;XL-30型环境扫描电子显微镜,荷兰Philips公司;MOS-450型圆二色谱仪,法国Biologic公司;1300系列Ⅱ级A2型生物安全柜,赛默飞世尔(苏州)仪器有限公司;LHS-150HC-1型恒温恒湿培养箱,上海一恒科学仪器有限公司;MQD-S2R型振荡培养箱,上海旻泉仪器有限公司;UltraScan Pro1166型高精度分光测色仪,美国Hunterlab公司;UV-2600型紫外分光光度计,日本岛津公司。
1.2 实验方法
1.2.1 大米样品前处理
将已接种黄曲霉菌孢子的PDA培养基斜面试管置于28 ℃、湿度为70%的恒温恒湿箱中培养7 d,用无菌生理盐水冲洗斜面并收集孢子,过滤菌丝得到孢子悬液,用血球计数板调整孢子悬液浓度为106 CFU/mL。
称取适量大米,通过加入不同体积的孢子悬液配制不同含水率(moisture content,MC)的样品,充分混匀,4 ℃放置24 h,使水分平衡,选取含水率为(30.05±0.33)% 和(20.11±0.16)% 的样品作为试验对象。
1.2.2 远红外辐照与黄曲霉孢子杀菌效率测定
设置2个对照组:含水质量分数分别为20%、30%但未经远红外辐照处理的大米样品,表示为20%-对照、30%-对照;2个处理组:含水质量分数分别为20%、30%且经远红外辐照的大米样品,表示为20%+FIR、30%+FIR;取水分平衡后样品单层铺设于托盘,置于远红外烘箱中,以115 ℃辐照处理5 min后盖上盖子并立即取出,放置冷却室温,分别收集对照组与处理组的大米样品于不同无菌均质袋中,加入一定体积无菌生理盐水,利用拍打式均质器均质2 min,洗脱大米表面黄曲霉孢子于均质液中,分别作为对照组和处理组均质液,每组实验重复3次平行;
杀菌效率测定参考文献[11],用微生物对数降低值(lgS)表示。
1.2.3 远红外辐照黄曲霉孢子培养及AFB1提取
取1.2.2中对照组与处理组均质液等量分别于产毒培养基中,28 ℃,160 r/min条件下振荡培养7 d,滤纸过滤收集发酵液和菌丝体,菌丝体以蒸馏水洗涤3次,55 ℃烘干至恒重,称重得菌丝体干重;发酵液中AFB1提取参照文献方法[11],采用高效液相色谱-柱前衍生法测定;
单位菌体产毒量计算如公式(1)所示:
单位菌体产毒量![]()
(1)
产AFB1抑制率与单位菌体产毒抑制率计算如公式(2)、公式(3)所示:
产AFB1抑制率![]()
(2)
单位菌体产毒抑制率/%
(3)
1.2.4 远红外辐照黄曲霉孢子PI染色
处理组与对照组均质液于6 000 r/min离心10 min,除去上清液,沉淀物用PBS洗涤2次后重悬,调整浓度为106 CFU/mL,与PI溶液以1∶10的体积比混匀,室温静置10 min,倒置生物荧光显微镜下观察,激发波长为488 nm。
1.2.5 远红外辐照黄曲霉孢子扫描电镜结果观察
均质液6 000 r/min离心10 min,弃上清液,细胞沉淀物用PBS溶液洗涤2次后悬浮于10 mL PBS溶液中,加入预冷无菌的2.5%(体积分数)戊二醛溶液10 mL,4 ℃预固定0.5 h,6 000 r/min离心10 min,弃上清液。参照蔡雪薛[12]的方法制备样品,在15 kV发射场环境扫描电子显微镜下观察孢子并拍照。
1.2.6 远红外辐照黄曲霉孢子活力测定
测定前配制MTT溶液:37 ℃温浴溶解于0.01 mol/L、pH 7.4的PBS溶液中,质量浓度5 mg/mL,过滤除菌,置棕色小瓶中,4 ℃冰箱保存将均质液离心(6 000 r/min,10 min)弃上清液, PBS溶液洗涤2次后重新悬浮于PBS溶液中,调整孢子浓度为2×107 CFU/mL。将100 μL孢子悬液加入96孔板中,加入25 μL MTT,28 ℃避光静置孵育4 h 后加入150 μL 二甲基亚砜,以蒸馏水设置为空白组对照,酶标仪测定吸收波长在565 nm下的吸光度值。黄曲霉孢子线粒体膜上结合的琥珀酸脱氢酶能将外源性MTT还原为蓝紫色结晶甲瓒,甲瓒在565 nm下的吸光值与细胞活性成正比[13],利用吸光值变化计算抑制率,计算如公式(4)所示:
抑制率![]()
(4)
1.2.7 远红外辐照黄曲霉孢子胞内蛋白质二级结构测定
均质液6 000 r/min离心10 min,弃上清液,加入无菌水洗涤离心2次重悬于0.6 mL无菌水中,参照陶晓赟[14]的方法提取胞内蛋白。为研究红外结合保温过程对胞内蛋白质结构的影响,远红外115 ℃辐照含水质量分数为20%的样品5 min后,在70 ℃下保温15 min,并表示为20%+FIR+保温。圆二色谱仪测定以蒸馏水为空白,扫描波长范围为250~190 nm,扫描速度30 nm/min,扫描温度25 ℃,重复3次,记录圆二色谱(circular dichroism,CD)。采用SELCON3分析法分析数据。
1.2.8 数据分析
采用SPSS 19.0和 Origin 9.0对数据进行统计分析和制图。
2 结果与分析
2.1 远红外辐照对黄曲霉孢子生长与产毒能力的影响
由前期研究可知[11],远红外115 ℃处理5 min后,含水质量分数为30%和20%的大米表面黄曲霉孢子对数降低值分别为(2.96±0.28)lgS、(2.04±0.17)lgS。由表1可知,30%和20%含水质量分数大米远红外处理后,发酵液中AFB1总量分别下降63.34%和56.61%,单位菌体产毒量分别下降38.94%和27.64%。远红外辐照后,大米中黄曲霉孢子再培养时生长受到明显限制,产毒能力受到显著抑制(P<0.05),且水分含量较高的大米在红外处理后孢子损伤效果更为明显。这是因为水分含量与水分活度呈正相关,有报道红外加热灭活细菌芽孢效果与IR加热器的辐射光谱和初始Aw值有关[4, 15];且报道谷物初始含水质量分数在4.98%~27%,热效应灭活黄曲霉孢子的对数值随水分含量的增加而升高[16-19]。
表1 远红外辐照对黄曲霉菌生长与产毒能力的作用
Table 1 Effect of FIR on growth and toxin production ability of Aspergillus flavus
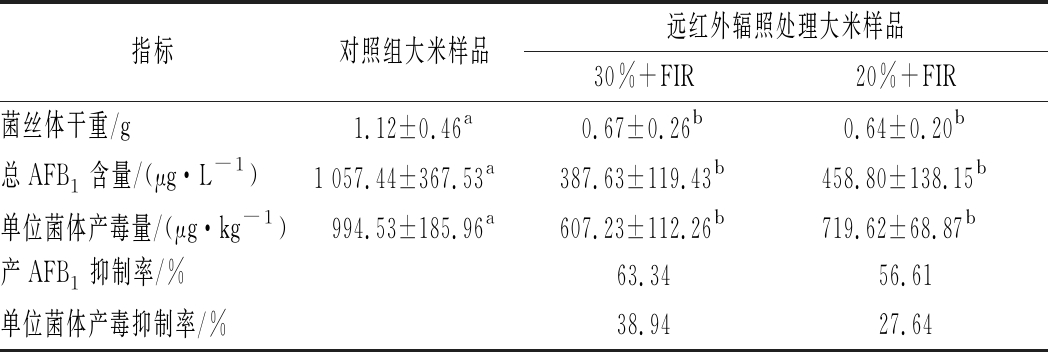
指标对照组大米样品远红外辐照处理大米样品30%+FIR20%+FIR菌丝体干重/g1.12±0.46a0.67±0.26b0.64±0.20b总AFB1含量/(μg·L-1)1 057.44±367.53a387.63±119.43b458.80±138.15b单位菌体产毒量/(μg·kg-1)994.53±185.96a607.23±112.26b719.62±68.87b产AFB1抑制率/%63.3456.61单位菌体产毒抑制率/%38.9427.64
注:同行不同字母表示组间差异显著,P<0.05;相同字母表示组间差异不显著,P>0.05
2.2 远红外辐照对黄曲霉孢子细胞膜的影响
PI是一种核酸结合的荧光探针,仅能穿透坏死细胞的细胞膜,致使胞核染色[20]。由图1-a、图1-b可知,远红外辐照前,黄曲霉孢子为活细胞,细胞膜完整,PI染料无法着色,而图1-c、图1-d中,处理后出现明显红色荧光,说明细胞膜被破坏,细胞核被染色。图1-d中的荧光强度较图1-c的荧光强度高,说明远红外处理水分含量较高的大米后,着色细胞数目增加。PI染色结果证明大米中水分含量越高,远红外处理后黄曲霉孢子的损伤越严重。这可能是由于高水分活度下微生物细胞膜对热敏感性增强[21],且报道指出磷酸缓冲液中大肠杆菌RNA、蛋白质和细胞壁对红外加热的耐受性较传导加热的热效应更差[22]。
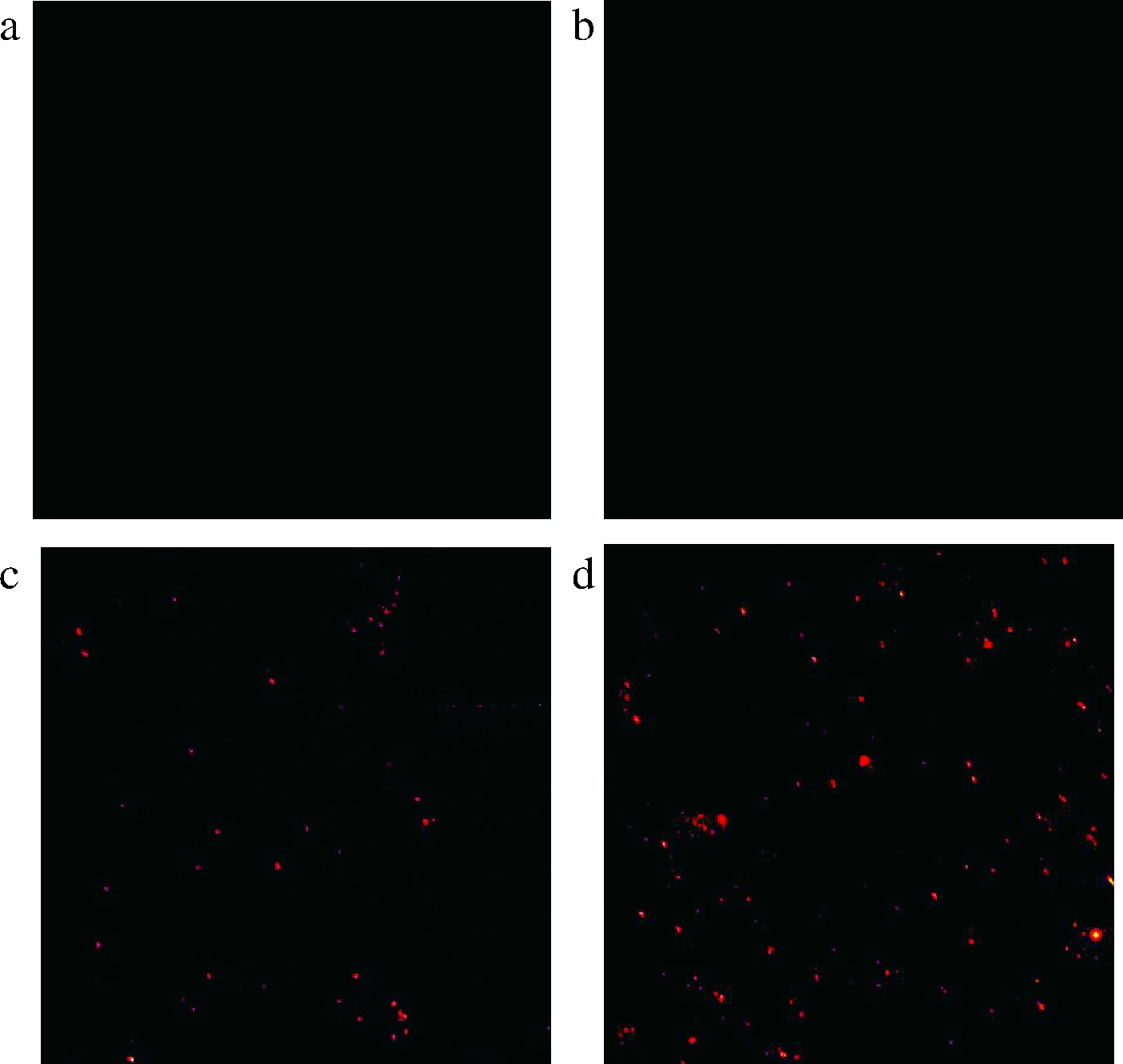
a、b-对照组,含水质量分数分别为20%、30%;c、d-FIR处理组,
含水质量分数分别为20%、30%
图1 黄曲霉孢子PI染色结果
Fig.1 The results of PI staining of A.flavus spores
2.3 远红外辐照对黄曲霉孢子显微结构的影响
图2显示的是远红外辐照前后黄曲霉孢子的扫描电镜图。未处理前孢子呈球形,表面粗糙,形状饱满,轮廓分明;远红外处理后,孢子皱缩凹陷、部分严重破碎,胞内物泄露,这可能是因为远红外辐射引起的热效应导致细胞膜出现孔洞或破损。紫外辐照和近红外加热相结合处理后鼠伤寒沙门氏菌与大肠杆菌的透射电镜观察结果显示,2种病原体的细胞包膜被显著破坏[23]。MEENU等[24]发现利用红外处理绿豆表面的黑曲霉与黄曲霉孢子后,其形态变得更光滑,完全破裂,细胞内含物泄漏到表面。

a-未经FIR处理;b-20%+FIR;c-30%+FIR
图2 黄曲霉孢子扫描电镜显微图
Fig.2 Scanning electron microscope pictures of A.flavus spores
2.4 远红外辐照对黄曲霉孢子活力影响
MTT测定结果如表2所示,远红外115 ℃处理5 min后OD565下降,大米含水质量分数分别为20%和30%时,远红外对黄曲霉孢子的抑制率分别达到38.27% 和57.36%,结果表明孢子活力受抑制程度随水分含量增加而增大。蛋白质的红外吸收范围在3~4 μm和6~9 μm[25],在本研究波长范围内对远红外有特定吸收,可引起其线粒体上琥珀酸脱氢酶(succinate dehydrogenase, SDH)的变性,细胞呼吸受阻,活力降低甚至死亡[26]。国外相关研究报道近红外辐射(850 nm)对大鼠中琥珀酸脱氢酶活性具有显著调节作用[27];远红外对小鼠黑素癌细胞的细胞活力有明显毒性作用并致使其下降[28]。
表2 远红外辐照后OD565值与黄曲霉孢子活力抑制率
Table 2 OD565 and inhibition rate of A.flavus spores′ viability after FIR treatment
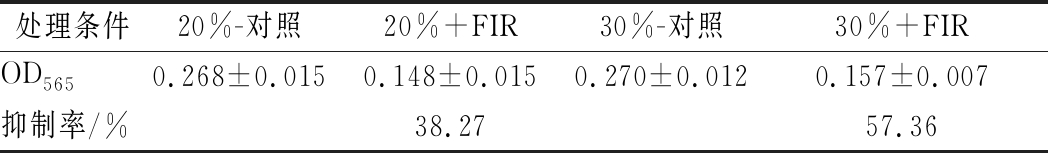
处理条件20%-对照20%+FIR30%-对照30%+FIROD5650.268±0.0150.148±0.0150.270±0.0120.157±0.007抑制率/%38.2757.36
注:表中数值为平均值±标准偏差
2.5 远红外辐照对黄曲霉孢子胞内蛋白二级结构影响
黄曲霉孢子胞内蛋白各二级结构的相对含量变化曲线如图3所示,圆色谱紫外区段(190~240 nm)的CD谱包含了生物大分子主链构象的信息,含水质量分数为30%时胞内蛋白在208、222 nm处呈强负吸收峰,反映了典型α-螺旋构象;β-折叠在217~218 nm处呈负峰,无规则卷曲在198 nm附近有1个负峰,在220 nm附近有正峰。
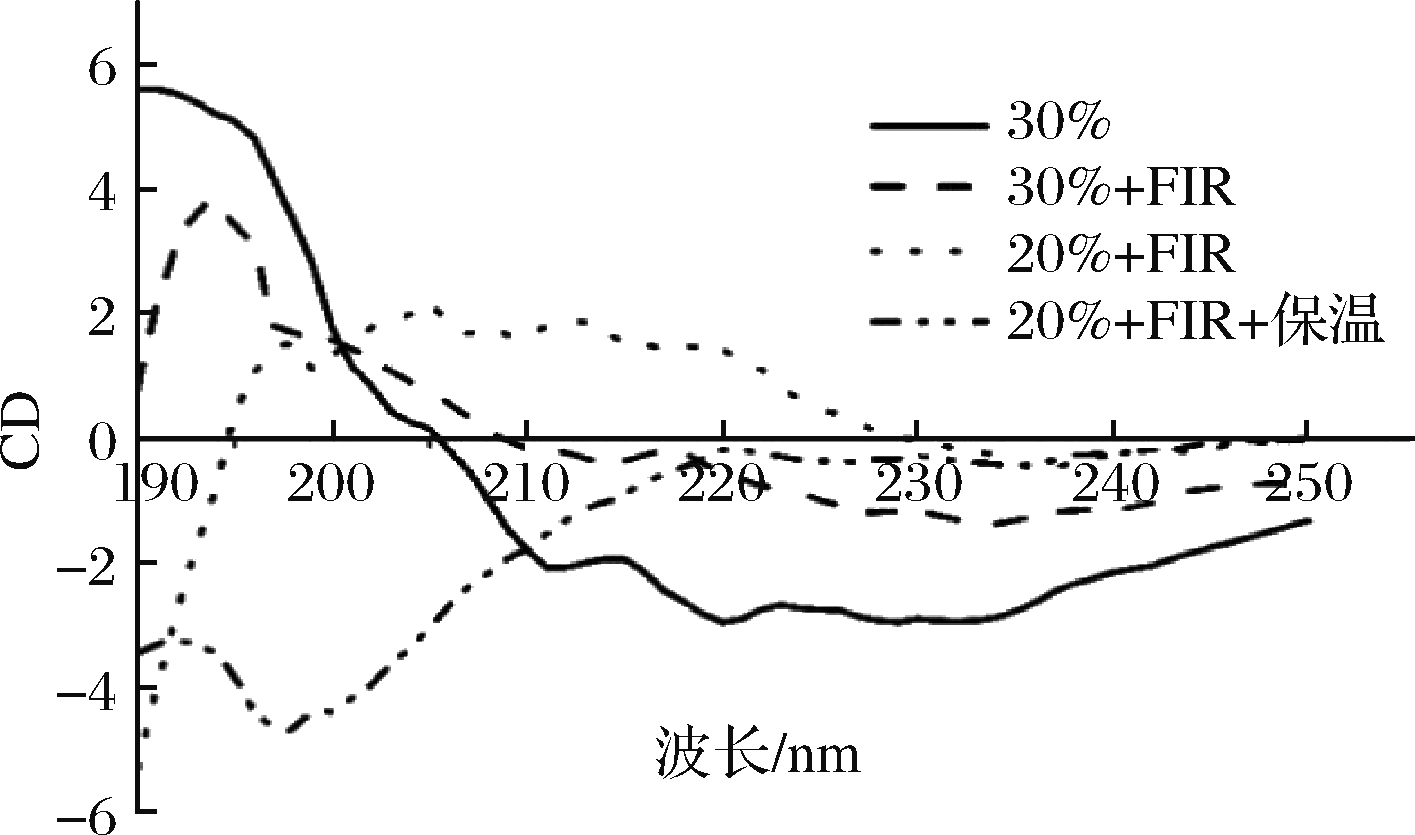
图3 黄曲霉孢子胞内蛋白的CD图
Fig.3 Circular dichroism spectra of intracellular protein in A.flavus spores
各二级结构相对含量见表3,结果显示含水质量分数为30%大米表面的黄曲霉孢子在FIR处理后,其胞内蛋白α-螺旋相对含量下降,β-折叠含量上升,β-转角和无规则卷曲相对稳定,蛋白二级结构主要为α-螺旋向β-折叠转变,且此过程不可逆,这与袁丽等[29]研究90 ℃ 加热处理30 min后鲢肌球蛋白CD谱表示的二级结构变化规律相似。对含水质量分数为20%的大米,进一步研究FIR结合保温处理对孢子胞内蛋白的作用,结果表明处理后α-螺旋构象相对含量低,变化幅度不大,β-折叠和β-转角相对含量下降,柔性大的无规则卷曲含量上升;史晓霞等[30]同样报道卵类黏蛋白随热处理温度与时间增加,其有序结构向无规卷曲结构转变增加。根据前面研究[11],FIR处理后样品表面温度为(59.0±3.0)℃,FIR联合保温70 ℃ 处理15 min后表面温度上升为(65.5±1.5)℃,这可能解释了保温阶段由温度导致的胞内蛋白肽链中的氢键断裂及重组加剧而使胞内蛋白质变性加速的现象。
表3 黄曲霉孢子胞内蛋白各二级结构相对含量 单位:%
Table 3 The relative content of secondary structure of intracellular proteins in A.flavus spores
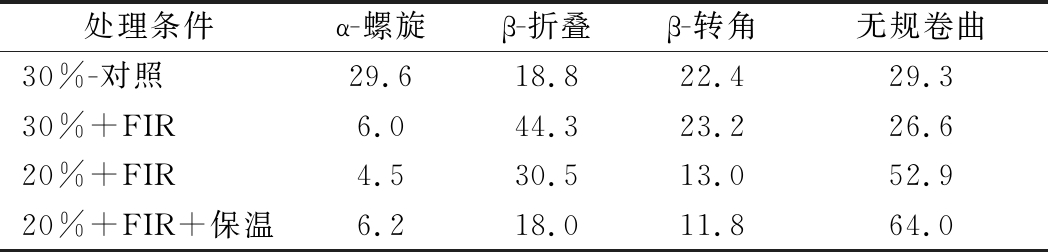
处理条件α-螺旋β-折叠β-转角无规卷曲30%-对照29.618.822.429.330%+FIR6.044.323.226.620%+FIR4.530.513.052.920%+FIR+保温6.218.011.864.0
3 结论
本研究结果表明采用远红外辐照115 ℃ 处理5 min,黄曲霉孢子生长能力受限制,产毒能力下降明显;且大米初始含水率越高,黄曲霉孢子热损伤越严重。远红外辐照后孢子细胞膜、细胞形态和胞内蛋白等发生变化,表现为通透性下降,出现破损、坍塌凹陷和胞内物质泄露等现象;当结合保温处理时,胞内酶等蛋白变性加速。本文初步探讨了远红外作用下黄曲霉孢子热损伤的机理,但未深入探讨非热效应对胞内细胞器与酶的作用。本文有望为远红外辐照杀灭大米中黄曲霉孢子与抑制其产毒能力的研究提供参考。
[1] PANKAJ S K, SHI H, KEENER K M.A review of novel physical and chemical decontamination technologies for aflatoxin in food [J].Trends in Food Science & Technology, 2018,113:74-85.
[2] ISMAIL A, GONCALVES B L, DE NEEFF D V, et al.Aflatoxin in foodstuffs:Occurrence and recent advances in decontamination [J].Food Res Int, 2018,71:73-83.
[3] RAMASWAMY R, KRISHNAMURTHY K, JUN S.Microbial Decontamination of Food by Infrared (IR) Heating [M].Microbial Decontamination in the Food Industry,2012:450-471.
[4] HAMANAKA D, UCHINO T, FURUSE N, et al.Effect of the wavelength of infrared heaters on the inactivation of bacterial spores at various water activities [J].Int J Food Microbiol, 2006,108(2):281-285.
[5] ELIASSON L, ISAKSSON S, LOVENKLEV M, et al.A comparative study of infrared and microwave heating for microbial decontamination of paprika powder [J].Front Microbiol, 2015,6:1 071-1 078.
[6] ![]() infrared and ultraviolet radiation as a combined method for surface pasteurization of black pepper seeds [J].Journal of Food Engineering, 2013,116(2):310-314.
infrared and ultraviolet radiation as a combined method for surface pasteurization of black pepper seeds [J].Journal of Food Engineering, 2013,116(2):310-314.
[7] 刘其耸,石丽花,赵巧丽,等.远红外处理延缓松花粉脂质的氧化作用 [J].现代食品科技, 2020, 36(4):63-72.
LIU Q S, SHI L H, ZHAO Q L, et al.Lipid oxidation deferring of pine pollen by far-infrared heating [J].Modern Food Science and Technology, 2020, 36(4):63-72.
[8] WILSON S A, OKEYO A A, OLATUNDE G A, et al.Radiant heat treatments for corn drying and decontamination [J].J Food Process Preserv, 2017,41(5):1-9.
[9] 王蓓. 脉冲强光、紫外和红外辐射对稻谷黄曲霉及其毒素的杀灭降解研究 [D].镇江:江苏大学,2014.
WANG B.Effective inactivation and degradation of Aspergillus flavus and aflatoxins in rough rice using pulsed light, ultraviolet and infrared radiation[D].Zhenjiang:Jiangsu University,2014.
[10] KRISHNAMURTHY K, SOOJIN J.Infrared heating in food processing:An overview [J].Comprehensive Reviews in Food Science and Food Safety, 2010, 7(1):2-13.
[11] 蒋婧,张玉明,全俊成,等.远红外辐照对大米黄曲霉孢子及其产毒能力的影响 [J].食品与机械, 2018, 34(4):75-79.
JIANG J, ZHANG Y M, QUAN J C, et al.Effect of far infrared irradiation on spore and aflation B1 production of Aspergillus flavus in rice [J].Food & Machinery, 2018, 34(4):75-79.
[12] 蔡雪薛. 单核细胞增生李斯特菌毒力相关基因的筛选鉴定及其功能研究 [D].扬州:扬州大学,2017.
CAI X X.Screening, identification and functional characterization associated with virulence in listeria monocytogenes[D].Yangzhou:Yangzhou University,2017.
[13] NAM H, KIM M M.Eugenol with antioxidant activity inhibits MMP-9 related to metastasis in human fibrosarcoma cells [J].Food Chem Toxicol, 2013, 55:106-112.
[14] 陶晓赟. 高压脉冲电场(PEF)对蓝莓汁品质及杀菌机理探究 [D].北京:北京林业大学, 2015.
TAO X Y.Effect of pulsed electric fields on blueberry juice and sterilization mechanism of PEF[D].Beijing:Beijing Forestry University,2015.
[15] STAACK N, AHRNE L, BORCH E, et al.Effect of infrared heating on quality and microbial decontamination in paprika powder [J].Journal of Food Engineering, 2008, 86(1):17-24.
[16] LEE S H, PARK S Y, BYUN K H, et al.Effects of microwaves on the reduction of Aspergillus flavus and Aspergillus parasiticus on brown rice (Oryza sativa L.) and barley (Hordeum vulgare L.) [J].Food Additives and Contaminants Part a-Chemistry Analysis Control Exposure & Risk Assessment, 2017,34(7):1 193-1 200.
[17] JIAO S S, ZHONG Y, DENG Y.Hot air-assisted radio frequency heating effects on wheat and corn seeds:Quality change and fungi inhibition [J].J Stored Prod Res,2016,69:265-271.
[18] ZHENG A, ZHANG L, WANG S.Verification of radio frequency pasteurization treatment for controlling Aspergillus parasiticus on corn grains [J].Int J Food Microbiol, 2017,249:27-34.
[19] WANG B, KHIR R, PAN Z L, et al.Effective disinfection of rough rice using infrared radiation heating [J].J Food Prot,2014, 77(9):1 538-1 545.
[20] WANG X, WANG Y, ZHOU Y, et al.Farnesol induces apoptosis-like cell death in the pathogenic fungus Aspergillus flavus [J].Mycologia,2014,106(5):881-888.
[21] 张鑫,曲文娟,马海乐,等.脱水菠菜的催化式红外辐射灭菌研究[J].食品科学,2013,34(23):133-137.
ZHANG X, QU W J, MA H L, et al.Effectiveness of catalytic infrared radiation in the sterilization of dehydrated spinach[J].Food Science,2013,34(23):133-137.
[22] SAWAI J, SAGARA, KASAI S.Far-infrared irradiation-induced injuries to Escherichia coli at below the lethal temperature [J].Journal of Industrial Microbiology & Biotechnology,2000,24:19-24.
[23] HA J W, KANG D H.Simultaneous near-infrared radiant heating and UV radiation for inactivating Escherichia coli O157:H7 and Salmonella enterica serovar Typhimurium in powdered red pepper (Capsicum annuum L.) [J].Appl Environ Microbiol, 2013,79(21):6 568-6 575.
[24] MEENU M, GUHA P, MISHRA S.Impact of infrared treatment on quality and fungal decontamination of mung bean (Vigna radiata L.) inoculated with Aspergillus spp [J].J Sci Food Agric,2018,98(7):2 770-2 776.
[25] 何建川,邵阳,张波.蛋白质和变性蛋白质二级结构的FTIR分析进展 [J].化学研究与应用, 2012, 24(8):1 176-1 180.
HE J C, SHAO Y, ZHANG B.Progress in study of protein secondary structure and denaturized protein by FTIR[J].Chemical Research & Application,2012,24(8):1 176-1 180.
[26] WU X Z, CHENG A X, SUN L M, et al.Plagiochin E, an antifungal bis(bibenzyl), exerts its antifungal activity through mitochondrial dysfunction-induced reactive oxygen species accumulation in Candida albicans [J].Biochim Biophys Acta, 2009, 1 790(8):770-777.
[27] KHUNDERYAKOVA N V, ZAKHARCHENKO A V, ZAKHARC-HENKO M V, et al.The effects of near infrared radiation on rats assessed by succinate dehydrogenase activity in lymphocytes in blood smears [J].Biophysics, 2015,60(6):917-920.
[28] PEIDAEE P, ALMANSOUR N M, PIROGOVA E.In vitro evaluation of low-intensity light radiation on murine melanoma (B16F10) cells [J].Medical & Biological Engineering & Computing, 2016, 54(2-3):325-332.
[29] 袁丽,孙楚楚,石彤,等.热诱导对鳙鱼肌球蛋白特性的影响 [J].中国食品学报, 2017,17(11):28-35.
YUAN L, SUN C C, SHI T, et al.Effect of thermal induction on the characteristic of silver carp myosin [J].Journal of Chinese Institute of Food Science and Technology,2017,17(11):28-35.
[30] 史晓霞,马美湖,王丽英,等.热处理对蛋清卵类粘蛋白过敏原性及构象的影响 [J].光谱学与光谱分析,2012,32(9):2 487-2 491.
SHI X X, MA M H, WANG L Y et al.Effect of heat treatment on the allergenicity and microstructure of ovomucoid [J].Spectroscopy and Spectral Analysis,2012,32(9):2 487-2 491.