萍乡搓菜是江西萍乡传统的蔬菜干腌制品,其制作工艺已有上百年的历史。萍乡搓菜在制作的过程中不添加食用盐,亚硝酸盐含量低,相比于传统发酵的泡菜、酸菜等产品更能满足人们对低盐健康食品的追求[1]。同时,由于搓菜产品是使用半干的蔬菜发酵而成,故其含水量较低,更利于保存和运输。但目前多是以自然发酵的方式生产,受自然条件因素影响很大,且耗时数月,极大地限制了搓菜的工业化生产及经济效益,因此,研究搓菜发酵所需的最佳菌剂配比,对于工业化生产搓菜尤为重要。
早期已有研究人员将Lactobacillus plantarum∶ Pichia kudriavzevii=1∶3混合投入发酵搓菜,结果发现投入复合发酵菌剂后可降低搓菜中亚硝酸盐含量,且风味物质种类与自然发酵相似,仅含量上略有差别[2]。本实验在前期研究的基础上,从自然发酵搓菜中分离筛选出多株优势菌种,通过研究各菌株的发酵性能及菌种间相互作用,将Lactobacillus buchneri、Lactobacillus sunkii、L.plantarum、Lactobacillus brevis、P.kudriavzevii、Kazachstania bulderi以不同配比发酵搓菜,对比自然与人工菌剂发酵搓菜的品质,选择出最佳发酵菌剂配比,以求在保证发酵搓菜品质稳定的基础上,进一步缩短搓菜的发酵周期。
1 材料与方法
1.1 材料与试剂
新鲜芥菜,南昌市上海北路菜市场;C5~C10、C10~C25正构烷烃,上海安谱实验科技股份有限公司;葡萄糖等培养基用试剂均为分析纯。
1.2 培养基
生长培养基:MRS液体培养基,YPD液体培养基。
初筛培养基:MRS固体培养基中加0.04%(质量分数)溴甲酚紫,YPD固体培养基。
鉴定培养基:糖发酵培养基,明胶液化培养基,硝酸盐培养基,产硫化氢试验培养基,吲哚培养基;碳源同化培养基,氮源同化培养基,产类淀粉培养基,无维生素培养基。
1.3 仪器与设备
LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗器械公司;TA-XT plus质构仪,英国Stable Micro System公司;3nh高精度色差仪,深圳市三恩驰科技有限公司;单重四级杆气相色谱-质谱联用仪,美国安捷伦公司等。
1.4 试验方法
1.4.1 菌种的筛选
用无菌生理盐水适当稀释搓菜样品,取不同稀释度涂布于初筛平板,倒置培养48 h,取平板上形态不同的菌落,分别在初筛培养基上划线分离,重复分离3~4次,镜检后于-20 ℃甘油保藏。
1.4.2 菌种的鉴定
1.4.2.1 生理生化鉴定
乳酸菌鉴定方法[3-4]:革兰氏染色、过氧化氢酶试验、硝酸盐还原试验、明胶液化试验、吲哚试验、产H2S试验、pH 4.5生长试验、糖或醇发酵试验、葡萄糖产酸产气试验。
酵母菌鉴定方法[5-6]:糖发酵试验、碳源同化试验,氮源同化试验、无维生素生长试验、37 ℃生长试验、产类淀粉试验。
1.4.2.2 分子生物学鉴定
通过生理生化鉴定初步判定后,进行基因测序鉴定,主要步骤为:提取DNA,PCR扩增,切胶纯化测序,拼接序列,最后与NCBI数据库进行比对,将同源性较高的典型菌株的序列用于构建系统发育树。
1.4.3 发酵搓菜用菌种的筛选
1.4.3.1 菌种间相互作用的分析
菌种间拮抗实验采用牛津杯法[7]。
1.4.3.2 乳酸菌产酸能力的测定
参照GB/T 12456—2008《食品中总酸的测定》,每4 h测酸度(以乳酸计)和pH值。
1.4.3.3 酵母菌耐酸能力的测定
在初始pH值为2、3、4、5、6的YPD液体培养基中培养一定时间后测菌液在600 nm处的OD值。
1.4.4 菌种内最佳配比的探究
1.4.4.1 发酵菌株菌种内配比的探究
将乳酸菌和酵母菌进行菌种内复配,20 ℃下培养一定时间,测定混合菌液在600 nm处的OD值,分别取酵母菌和乳酸菌菌种内配比生长状况较好的前3组,按酵母菌与乳酸菌3∶1的比例混合,以1%接种量接种于半干芥菜上,20 ℃发酵50 d,与自然发酵的产品对比。
1.4.4.2 质构与色泽的测定
质构:采用直径为5 mm的圆柱形探头进行质地多面分析(texture profile analysis,TPA)实验[8]。测试参数为:测前速度1 mm/s,测试速度1 mm/s,测后速度1 mm/s,压缩程度40%,2次压缩间隔时间为5 s,触发点负载5 g。
色泽:使用色度计测定搓菜的色泽[9],记录L*、a*、b*值,总色度C*的计算如公式(1)所示:
C*=(a2+b2)1/2
(1)
1.4.4.3 感官品质评价
邀请10名感官评价参与者对10种产品进行综合打分[10]。
1.4.5 发酵搓菜风味物质的分析
萃取条件:取4 g剪碎的搓菜,置于15 mL顶空瓶中,45 ℃下预热30 min,将顶空固相微萃取(headspace-solid phase micro extraction,HS-SPME)萃取头插入萃取瓶中,45 ℃萃取30 min,拔出萃取头插入GC-MS进样口,解吸5 min。
色谱条件:HP-5MS毛细管色谱柱(30 m×0.32 mm,0.25 μm),进样口温度250 ℃。升温程序:起始柱温35 ℃,保持3 min,5 ℃/min线性升温至100 ℃保持2 min,10 ℃/min线性升温至220 ℃保持15 min。载气为He,流量1 mL/min,不分流。
质谱条件:电子轰击离子源;电子能量70 eV,电离源温度230 ℃,传输线温度280 ℃;扫描范围50~550 u。
1.4.6 数据处理
利用C5~C10、C10~C25正构烷烃为混标计算各化合物的保留指数(retention index,RI)对化合物进行定性,用面积归一法计算百分含量。采用单因素方差分析(ANOVA)和Duncan检验,采用SPSS 25统计软件,以P<0.05为显著性差异。采用Excel 2016进行图表绘制。
2 结果与分析
2.1 菌种的筛选与鉴定
从自然发酵搓菜中分离筛得7种不同菌落形态的菌种,生理生化实验结果如表1和表2所示,菌种系统发育树如图1所示。
表1 乳酸菌生理生化实验
Table 1 Physiological and biochemical experiments of lactic acid bacteria

糖发酵试验菌株葡萄糖果糖木糖阿拉伯糖鼠李糖麦芽糖甘露糖甘露醇蔗糖乳糖半乳糖pH 4.5生长试验革兰氏染色过氧化氢酶试验硝酸盐还原实验明胶液化实验产H2S试验吲哚试验R1++---+++++--+-----R2++-+-+++++--+-----R3++-+-+++++--+-----R4++-+-+++++--+-----R5++---++-++--+-----
注:“-”表示阴性,“+”表示阳性(下同)
表2 酵母菌生理生化实验
Table 2 Physiological and biochemical experiments of yeast
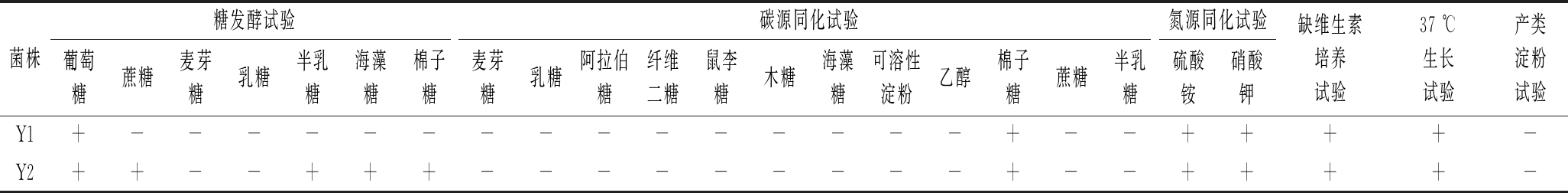
菌株糖发酵试验碳源同化试验氮源同化试验葡萄糖蔗糖麦芽糖乳糖半乳糖海藻糖棉子糖麦芽糖乳糖阿拉伯糖纤维二糖鼠李糖木糖海藻糖可溶性淀粉乙醇棉子糖蔗糖半乳糖硫酸铵硝酸钾缺维生素培养试验37 ℃生长试验产类淀粉试验Y1+---------------+--++++-Y2++--+++---------+--++++-
由生理生化试验及分子生物学鉴定得Y1为P. kudriavzevii、Y2为K. bulderi、R1为L. buchneri、R2为L. sunkii、R3为L.Alimentarius、R4为L. plantarum、R5为L. brevis,7株菌均为发酵蔬菜中的常见菌株。NGVYEN等[11]研究越南发酵蔬菜中乳酸菌组成,发现植物乳杆菌占比达17.1%,短乳杆菌占比0.5%。LIU等[12]发现发酵芥菜的块茎中L. Alimentarius丰度达85.8%。LIU等[13]发现发酵泡菜中大量存在P. kudriavzevii和K. bulderi。
2.2 发酵搓菜用菌种的筛选
2.2.1 菌种间的相互作用
酵母菌和乳酸菌的拮抗试验结果发现,R3与R1、R2、R4之间均有拮抗作用(R3菌液抑制R2、R4生长,R1菌液抑制R3生长)。研究表明,乳酸链球菌与保加利亚乳杆菌或干酪乳杆菌混合培养时出现相互拮抗作用,嗜热链球菌和保加利亚乳杆菌之间也有明显的拮抗作用[14]。本实验中,R3与R1、R2、R4之间有拮抗作用,可能是R3在生长的过程中产生某种酶或者细菌素对其他菌种生长有抑制作用。由菌种生长曲线试验结果可知,R3菌体密度最小,且与另外3株乳酸菌之间有拮抗作用,故R3将不被选为发酵菌剂菌种。
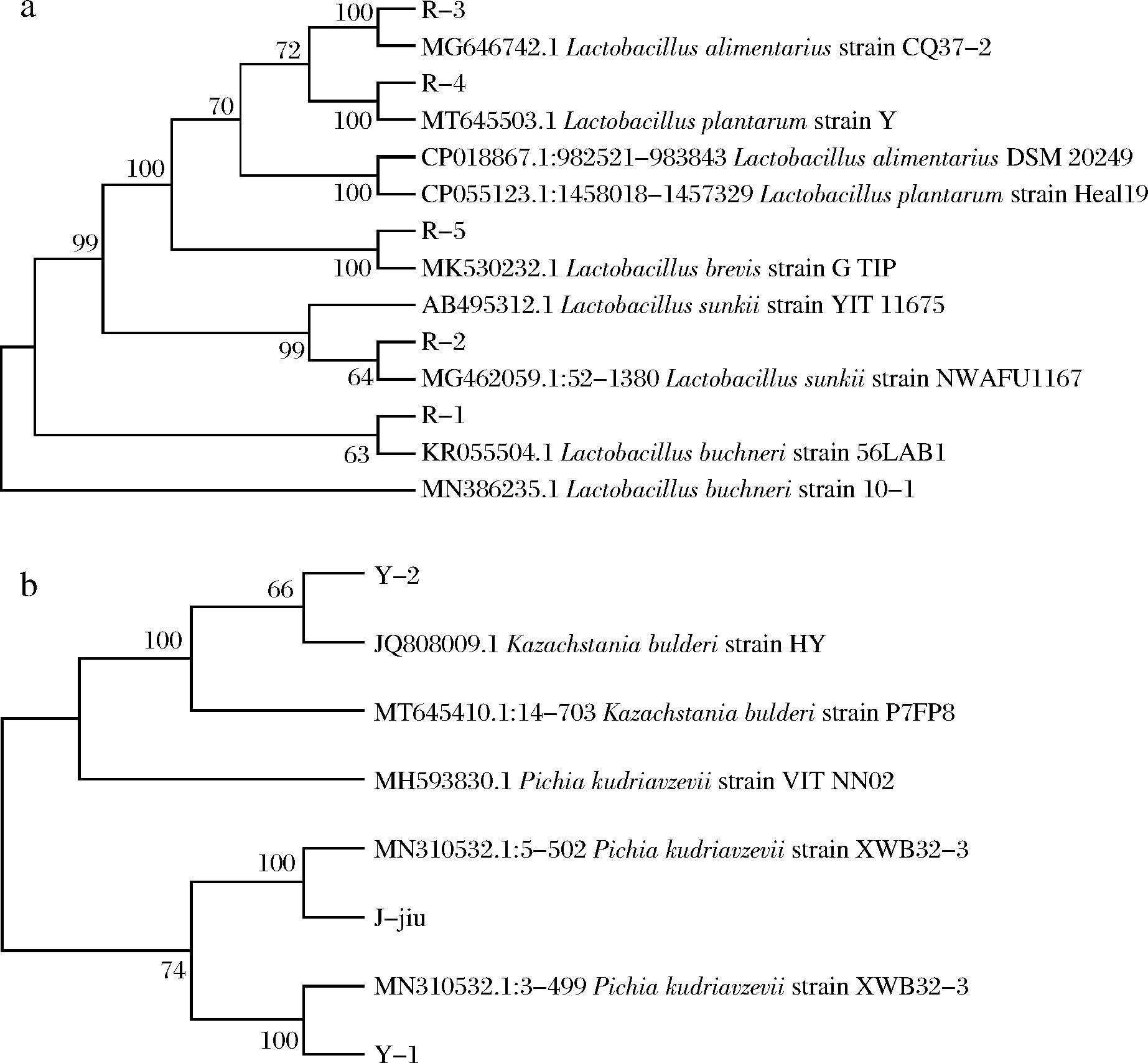
a-乳酸菌系统发育树;b-酵母菌系统发育树
图1 菌种系统发育树
Fig.1 Phylogenetic trees of strains
2.2.2 乳酸菌产酸能力的测定
乳酸菌产酸能力的强弱与其自身耐酸能力强弱相关,一般来说,菌种产酸能力越强,耐酸能力也越强。快速大量产酸不仅能快速抑制杂菌生长,保证产品质量,还能使产品快速达到发酵效果,缩短发酵时间[15]。由图2可知,各菌种在生长过程中酸度变化与pH变化结果相符,R1、R4、R5产酸能力相近,且较R2强,故在发酵菌种配比中将R1、R4、R5以1∶1∶1配比,并将其视为一个整体与R2进行配比。
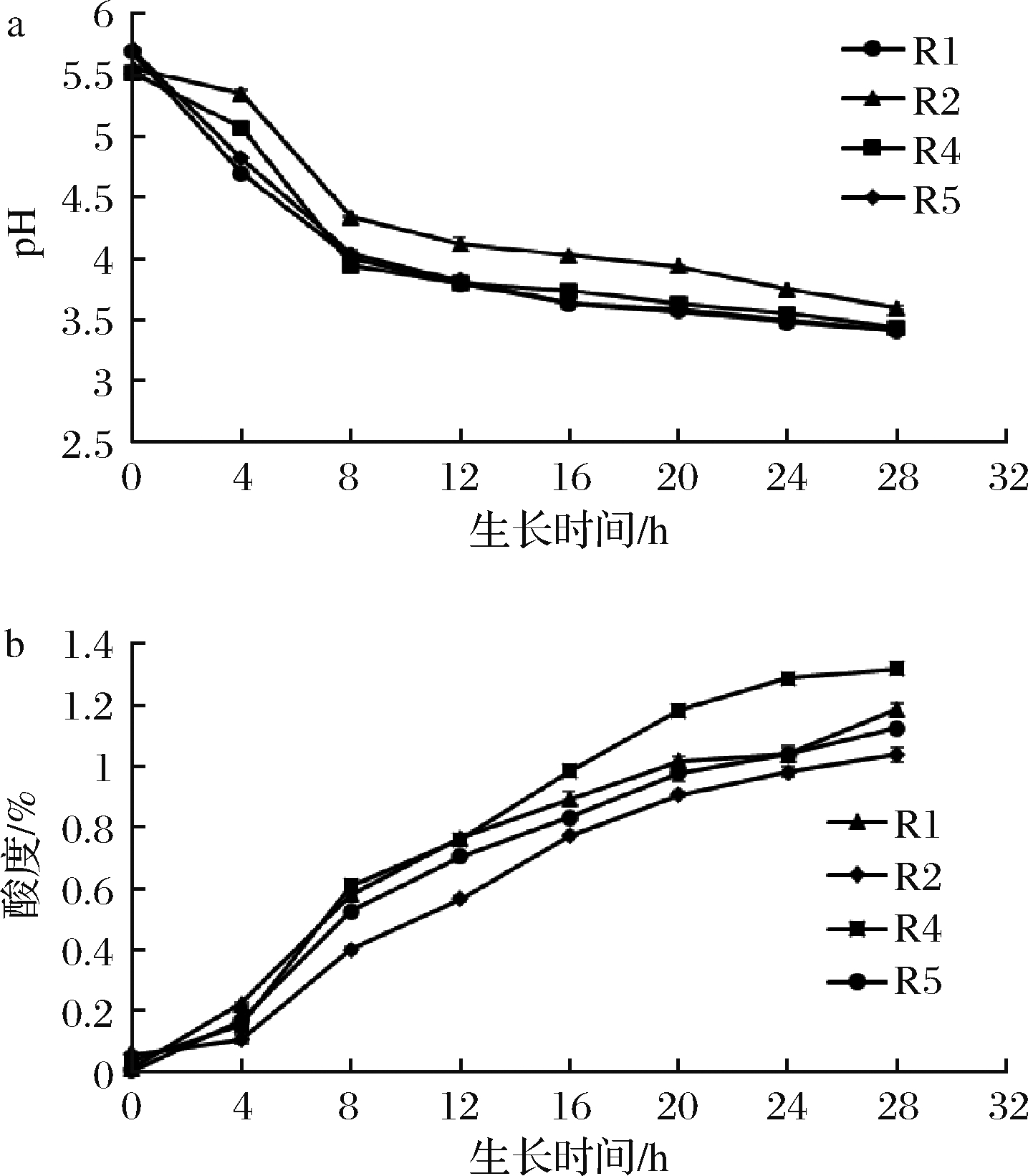
a-pH;b-酸度
图2 乳酸菌生长过程中pH和酸度变化
Fig.2 Variations of pH and acidity during the growth of lactic acid bacteria
2.2.3 酵母菌耐酸能力的测定
在乳酸菌与酵母菌混合发酵体系中,酵母菌的耐酸能力决定它能否在体系中正常生长。由图3可知,2株酵母菌对于低pH均有良好的耐受性,在pH值为2的条件下,酵母菌OD600nm值仍在0.4左右,且Y1在pH值为5时有最大菌体密度,此结果与刘春燕[16]研究结果相似。
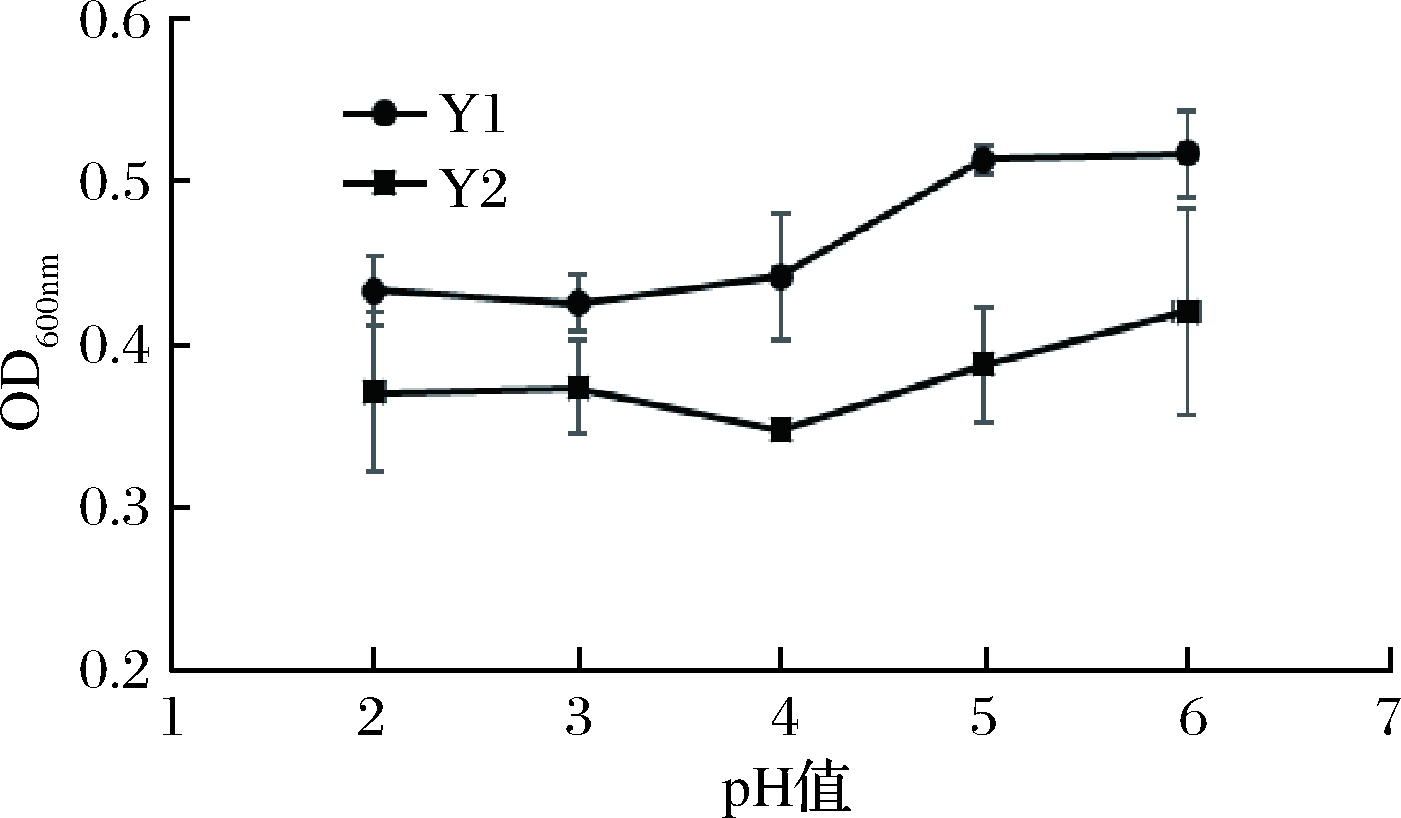
图3 酵母菌在不同pH条件的生长情况
Fig.3 Yeast growth at different pH conditions
2.3 菌种内最佳配比的探究
2.3.1 发酵菌株菌种内配比的探究
由图4可知,当乳酸菌(R1/R4/R5)∶R2=2∶1、3∶1、3∶2,酵母菌Y1∶Y2=1∶2、1∶3、2∶3时,菌体密度相对较高。在同一生长体系中,当多株菌种混合培养时,菌体密度相对较高,说明混合菌生长状态较好。因此选择乳酸菌(R1/R4/R5)∶R2=2∶1、3∶1、3∶2,酵母菌Y1∶Y2=1∶2、1∶3和2∶3进行后续菌种间配比试验。
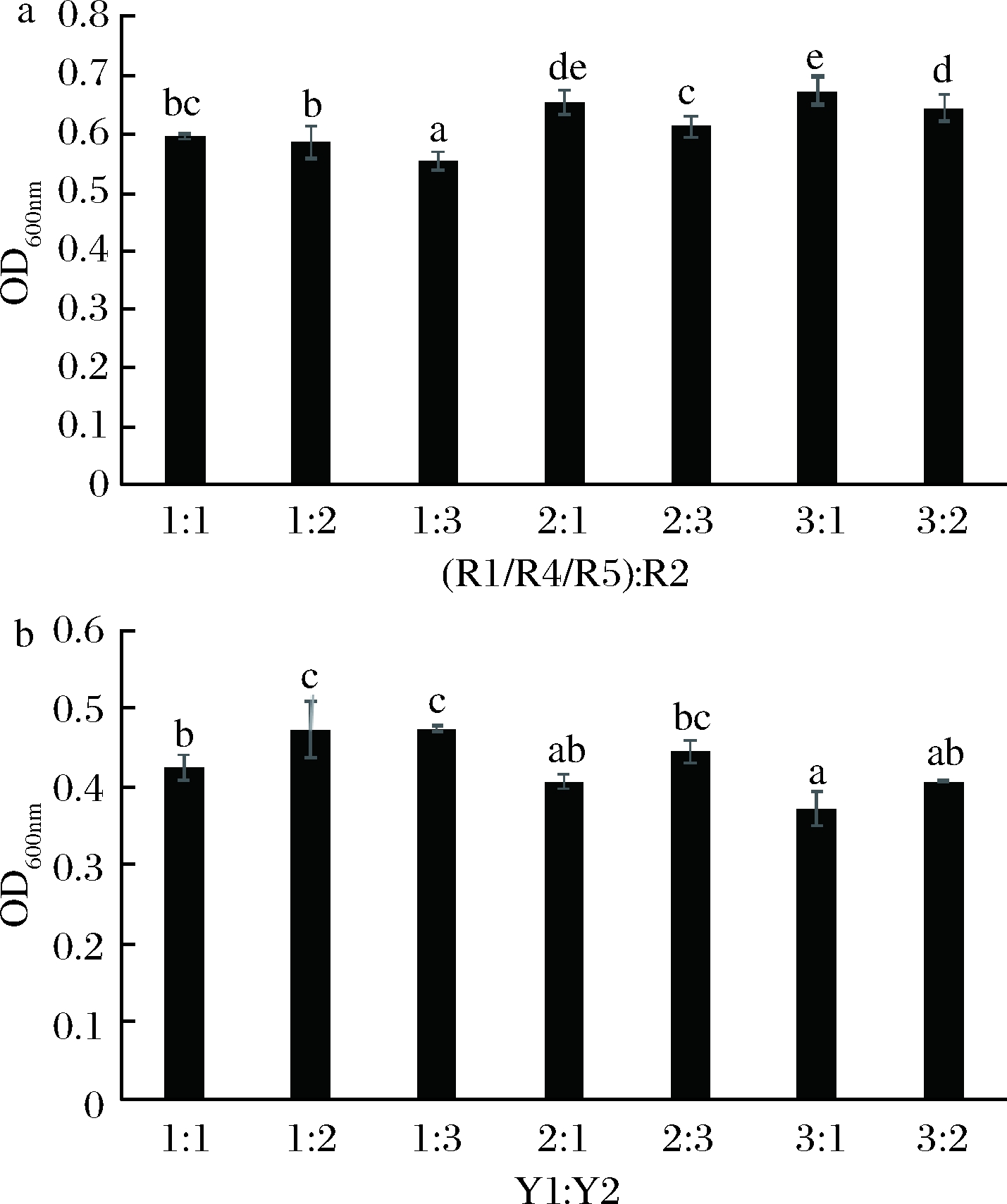
a-乳酸菌;b-酵母菌
图4 乳酸菌和酵母菌菌种内配比
Fig.4 Interspecific ratios of yeast and lactic acid bacteria
注:不同字母表示具有显著差异(P<0.05)(下同)
2.3.2 质构与颜色的测定
由图5可知,2、6、7、9及自然发酵组的质构结果相对较好,且2、6、7、9组的黏结性、咀嚼性、弹性均高于或持平于自然发酵组,6、7组的硬度与自然发酵组持平。从质构角度看,加入适宜比例的菌剂后,搓菜的品质有所改善,可能是由于适宜比例的菌剂能够使菌群生长代谢维持平衡,从而减弱搓菜组织细胞的破坏程度及细胞壁原果胶的水解程度,最终使发酵搓菜的咀嚼性、弹性、黏结性较好[17-18]。搓菜经发酵后,从颜色亮度和总色度上可看出6、7、9和自然发酵组较好,这两者反映的是搓菜颜色的饱满度及鲜亮度,亮度越高说明颜色越鲜亮,褐变的程度越小[19]。
2.3.3 感官评定
由感官评定结果可知,1、2、6、7组的总评分较高,感官评定色泽结果与色度计测定结果有略微差异,可能是由于各参评人员感官阈值有所不同。综合质构与色度结果可看出6、7组发酵效果最好,且其感官评定总评分高于自然发酵组。由于第6组感官评价总评分高于第7组,因此最终选定第6组菌种配比为最终搓菜复合发酵菌剂配比。最终发酵菌剂配比为酵母菌Y1∶Y2=1∶2,乳酸菌(R1/R4/R5)∶R2=3∶2。
表3 感官评价结果表
Table 3 Results of sensory evaluation

分组色泽香味滋味脆性总评18.800±1.229a8.200±1.033b7.200±1.135b7.200±1.476b7.850±0.893b28.160±1.859a7.830±1.476b7.430±1.621b7.900±1.350b7.820±1.061b38.180±1.121a7.300±1.337b7.390±1.516b7.830±1.000b7.639±0.932b48.350±1.055a7.600±1.430b6.770±1.731b7.200±1.398b7.451±1.075b58.400±1.350a7.950±1.536b7.200±1.751b6.880±2.246ab7.631±1.132b68.580±1.724a7.700±1.494b8.020±1.648b8.320±1.228b8.178±1.112b77.950±1.117a8.200±1.135b8.050±1.383b7.850±1.334b8.065±0.816b88.150±1.107a7.050±2.114b7.450±1.165b7.450±1.707b7.500±0.897b98.670±1.044a5.000±2.981a4.600±2.716a5.500±2.273a5.744±2.034a自然发酵8.500±1.716a7.000±2.224b7.250±2.045b8.250±1.399b7.655±1.248b
注:评分表示为平均值±标准差,n=10;总评=色泽×0.2+香味×0.3+滋味×0.3+脆性×0.2;分组1,2,3,4,5,6,7,8,9分别表示Y1∶Y2、(R1∶R4∶R5)∶R2为1∶3、2∶1,1∶3、3∶1,1∶3、3∶2,1∶2、2∶1,1∶2、3∶1,1∶2、3∶2,2∶3、2∶1,2∶3、3∶1,2∶3、3∶2,自然发酵组表示未接种菌剂
2.4 发酵搓菜风味物质的分析
利用HS-SPME-GC-MS测定了自然发酵与优选菌剂发酵搓菜中挥发性风味物质,结果如图6所示。

a-硬度;b-黏结性;c-咀嚼性;d-弹性;e-亮度;f-总色度
图5 发酵搓菜的质构与色泽
Fig.5 The texture and colors of fermented Cuocai
注:分组1,3,4,5,5,7,8,9分别表示YI∶Y2、(R1/R4/R5)∶R2为1∶3、2∶1,1∶3、3∶1,1∶3、3∶2,1∶2、2∶1,1∶2、3∶1,1∶2、
3∶2,2∶3、2∶1,2∶3、3∶1,2∶3、3∶2,自然发酵组表示未接种菌剂

a-种类数量;b-相对含量
图6 不同组搓菜产品中挥发性风味成分类别种数
和种类相对含量
Fig.6 The varieties and relative contents of volatile flavor components in different groups
优选菌剂发酵和自然发酵搓菜中挥发性风味物质的种类有部分相似,但含量有差别。优选菌剂发酵和自然发酵搓菜中分别检测出挥发性风味物质71种和53种。酯类物质是发酵蔬菜中最重要的一类风味物质,即使在低浓度下也能散发花香、水果味和蜂蜜味[20],自然发酵搓菜中含量最高的是硫氰酸香茅酯(2.15%),而优选菌剂发酵搓菜中异硫氰酸丁酯(4%)、甲酸反式-4-甲基环己酯(4.25%)十二内酯(5.32%)含量都相对较高。其中的异硫氰酸酯不仅是发酵蔬菜重要的特征性风味物质,同时也具有抗癌作用[21]。酯类物质在优选菌剂发酵组中的种类数和相对含量都比自然发酵组高,且是优选菌剂发酵组中含量及种类最丰富的一类物质,这与侯爱香等[22]研究结果一致。这种差异可能是由于自然发酵中有效微生物含量较少,发酵启动较慢,代谢产物相互作用产生酯类物质较少。
优选菌剂发酵过程中醇类相对含量最高的是具有清甜香气的苯乙醇,但在自然发酵中并未检测到,此结果与徐丹萍等[23]研究结果相似,在自然发酵泡菜中未检测到苯乙醇,但在老泡菜水发酵泡菜中含量却较高。优选菌剂发酵醇类物质(17.86%)相对含量高于自然发酵(12.99%),可能是由于优选菌剂发酵接种乳酸菌和酵母菌代谢产生大量醇类物质,使得优选菌剂发酵搓菜中醇类物质较为丰富。酮类和醛类具有较低的气味阈值和特殊的气味,醛类具有草本香气,是氨基酸分解代谢和不饱和脂肪酸自氧化产生的主要物质[24],而酮类化合物具有甘草味,但二者不稳定,在发酵后期可进一步反应形成酸和醇,优选菌剂发酵组中酮类物质的种类数和相对含量都较自然发酵组高,而醛类物质与之相反,可能是由于自然发酵搓菜启动较慢,相同条件下被还原的醛类物质相对较少,因此留在产品中醛类物质相对较多。
酸类、烃类和杂环类化合物气味阈值相对较高,本研究中杂环类化合物相对含量较高,尤其是在自然发酵搓菜中。酸类及烃类物质在两组间含量差异较大,但对风味直接贡献不大,仅可与其他物质相互作用或作为其他风味物质的前体[25]。
硫化物,芳香类及胺类物质在两组样品中相对含量都较低。芳香类中甲苯在自然发酵中相对含量较高,但在优选菌剂发酵中较低。硫化物和胺类化合物仅在含量上有差异,硫化物气味阈值较低,且有强烈的洋葱气味,对发酵蔬菜的整体嗅觉特性做出了重要贡献,是发酵蔬菜中最重要的挥发性风味物质之一[26]。
从挥发性风味物质组成看,优选菌剂发酵比自然发酵物质更为丰富,且重要挥发性风味物质占比更高,与感官评定结果相符。此结果进一步说明使用复合菌发酵搓菜可以替代自然发酵搓菜实现工业化生产。
3 结论
本研究从江西萍乡特色自然发酵搓菜中筛选出7株优势菌种,通过基础生理实验选择各项生理指标都较强的L. buchneri、L. sunkii、L. plantarum、L. brevis、P. kudriavzevii、K. bulderi作为最终的发酵菌株。经菌种内最佳配比实验得到乳酸菌(R1/R4/R5)∶R2为2∶1、3∶1、3∶2,酵母菌Y1∶Y2=1∶2、1∶3、2∶3时分别有相对较好的生长状态。在前期研究基础上以乳酸菌∶酵母菌=1∶3接种发酵搓菜,经过对发酵后搓菜质构、颜色分析及感官评定结果分析,发现当酵母菌Y1∶Y2=1∶2,乳酸菌(R1/R4/R5)∶R2=3∶2(即R1/R4/R5/R2=1∶1∶1∶2)时发酵所得搓菜综合评价最好。最后比较自然发酵与优选菌剂发酵搓菜的挥发性风味物质,发现优选菌剂发酵相比于自然发酵物质更为丰富,且重要挥发性风味物质占比更高。此研究结果可为快速高效的发酵萍乡搓菜提供科学的理论指导。
[1] 李凤姿, 张媛, 吴昊, 等.盐对发酵蔬菜微生物群体和发酵质量的影响[J].中国调味品, 2018, 43(3):150-154;200.
LI F Z, ZHANG Y, WU H, et al.Effects of salt on microbial population and fermentation quality of fermented vegetables[J].China Condiment, 2018, 43(3):150-154;200.
[2] CHEN X, ZHENG M, LIU J, et al.Selection and use of indigenous mixed starter cultures for mustard leaves fermentation and the improvement of cuocai characteristics[J].Journal of the Science of Food & Agriculture, 2017, 98(5):1 773-1 786.
[3] 赵改名, 李珊珊, 崔文明, 等.云南自然发酵火腿中乳酸菌的分离鉴定及发酵特性研究[J].食品与发酵工业, 2020, 46(1):56-61.
ZHAO G M, LI S S, CUI W M, et al.Isolation, identification and fermentation properties of lactic acid bacteria from naturally fermented ham in Yunnan[J].Food and Fermentation Industries, 2020, 46(1):56-61.
[4] 凌空, 翟磊, 姚粟, 等.新疆传统发酵食品中乳酸菌的分离鉴定及其生长代谢特性[J].食品与发酵工业, 2017, 43(3):123-129.
LING K, ZHAI L, YAO S, et al.Isolation, identification and characterization of lactic acid bacteria from traditionally fermented foods in Xinjiang [J].Food and Fermentation Industries, 2017, 43(3):123-129.
[5] 余婷婷, 赖世强, 曹文涛, 等.酱香型白酒高温堆积糟醅中耐高温酵母的筛选及鉴定[J].酿酒科技, 2014(6):24-26.
YU T T, LAI S Q, CAO W T, et al.Screening and identification of high temperature resistant yeast strains from high temperature stacking fermented grains of Jiangxiang Baijiu (liquor) [J].Liquor-Making Science & Technology, 2014(6):24-26.
[6] 李文亚, 常健, 王琪.晋西北酸粥发酵过程中酵母菌的分离鉴定[J].山西农业科学, 2016, 44(3):323-327.
LI W Y, CHANG J, WANG Q.Isolation and identification of yeasts in the fermentation process of northwestern Shanxi acid gruel[J].Journal of Shanxi Agricultural Sciences, 2016, 44(3):323-327.
[7] 吴颖, 侯潞丹, 张杰.复合微生物菌剂中各菌株间的拮抗试验及培养条件的筛选[J].浙江农业学报, 2016, 28(5):820-827.
WU Y, HOU L D, ZHANG J.Antagonistic effect of bacterial strains in complex microbial inoculants and the screening of their culture condition[J].Acta Agriculturae Zhejiangensis, 2016, 28(5):820-827.
[8] 岳喜庆, 杜书, 武俊瑞,等.酸菜自然发酵过程中的质地变化[J].食品与发酵工业, 2013, 39(4):68-71.
YUE X Q, DU S, WU J R, et al.Analysis of changes of texture propertise of Chinese sauerkraut during natural fermentation[J].Food and Fermentation Industries, 2013, 39(4):68-71.
[9] 顾东东. 甘薯茎尖色泽、脂溶性提取物抗氧化能力及其与β-胡萝卜素含量的关系[D].重庆:西南大学, 2016.
GU D D.The color value, antioxidant capacity of lipid-soluble extraction and their relationships with β-carotene content in sweetpotato vine tips[D].Chongqing:Southwest University, 2016.
[10] 李静鹏, 邓力, 陈烁, 等.蔬菜快速无水发酵工艺研究[J].中国酿造, 2015, 34(6):33-38.
LI J P, DENG L, CHEN S, et al.Research on rapid fermentation process of vegetables without soaking water[J].China Brewing, 2015, 34(6):33-38.
[11] NGVYEN D T L, VAN HOORDE K, CNOCKAERT M, et al.A description of the lactic acid bacteria microbiota associated with the production of traditional fermented vegetables in Vietnam[J].International Journal of Food Microbiology, 2013, 163(1):19-27.
[12] LIU D, TONG C.Bacterial community diversity of traditional fermented vegetables in China[J].LWT-Food Science and Technology, 2017, 86:40-48.
[13] LIU L, SHE X, QIAN Y, et al.Effect of different fermenting containers on the deterioration of Sichuan pickle[J].LWT-Food Science and Technology, 2019, 111:829-836.
[14] 郭本恒. 酸奶[M].北京:化学工业出版社, 2003.
GUO B H.Yogurt[M].Beijing:Chemical Industry Press, 2003.
[15] 姚沛琳, 苏博, 姚传倩,等.皖北地区腌制咸菜中乳酸菌的益生特性研究[J].兰州文理学院学报(自然科学版), 2019,33(2):46-51.
YAO P L, SU B, YAO C Q, et al.Study of probiotic property of lactic acid bacteria in pickles in northern Anhui province[J].Journal of Lanzhou University of Arts and Science (Natural Sciences Edition), 2019,33(2):46-51.
[16] 刘春燕. 传统四川泡萝卜发酵过程中酵母菌分离鉴定及其对泡菜风味的影响[D].雅安:四川农业大学, 2015.
LIU C Y.Isolation and separation of yeast during the fermentation of traditional Sichuan radish pickle and its effects on the flavor of pickle[D].Ya′an:Sichuan Agricultural University, 2015.
[17] LIU L, SHE X, CHEN X, et al.Microbiota succession and chemical composition involved in the radish fermentation process in different containers[J].Frontiers in Microbiology, 2020, 11:445.
[18] RAO Y, QIAN Y, TAO Y F, et al.Influence of oxygen exposure on fermentation process and sensory qualities of Sichuan pickle (Paocai)[J].RSC Advances, 2019, 9(66):38 520-38 530.
[19] 沈菲儿. 乳酸菌发酵对莲藕泡菜质构和风味影响的研究[D].扬州:扬州大学, 2016.
SHEN F E.Effect of lactic acid bacteria fermentation on texture and flavor of pickles in lotus root[D].Yangzhou:Yangzhou University, 2016.
[20] YANG X Z, HU W Z, XIU Z L, et al.Microbial dynamics and volatilome profiles during the fermentation of Chinese northeast sauerkraut by Leuconostoc mesenteroides ORC 2 and Lactobacillus plantarum HBUAS 51041 under different salt concentrations[J].Food Research International, 2020.DOI:10.1016/j.foodres.2019.108926.
[21] VEERANKI O L, BHATTACHARYA A, TANG L, et al.Cruciferous vegetables, isothiocyanates, and prevention of bladder cancer[J].Current Pharmacology Reports, 2015, 1(4):272.
[22] 侯爱香, 王一淇, 黄晴, 等.自然发酵与人工接种发酵湖南芥菜的挥发性风味组分和品质分析[J].食品科学, 2018, 39(6):237-245.
HOU A X, WANG Y Q, HUANG Q, et al.Research on volatile flavor compounds and quality between the natural fermentation and artificial inoculation Chinese leaf mustard (Brassica juncea Coss.) grown in Hunan province, China[J].Food Science, 2018, 39(6):237-245.
[23] 徐丹萍, 蒲彪, 刘书亮, 等.不同发酵方式的泡菜挥发性成分分析[J].食品科学, 2015,36(16):94-100.
XU D P, PU B, LIU S L, et al.Analysis of volatile components in pickles fermented with different starter cultures[J].Food Science, 2015,36(16):94-100.
[24] JAMPAPHAENG K, FERROCINO I, GIORDANO M, et al.Microbiota dynamics and volatilome profile during stink bean fermentation (Sataw-Dong) with Lactobacillus plantarum KJ03 as a starter culture[J].Food Microbiology, 2018, 76:91-102.
[25] BONTINIS T G, MALLATOU H, PAPPA E C, et al.Study of proteolysis, lipolysis and volatile profile of a traditional Greek goat cheese (Xinotyri) during ripening[J].Small Ruminant Research, 2012, 105(1-3):193-201.
[26] KINZURIK M I, HERBST-JOHNSTONE M, GARDNER R C.Evolution of volatile sulfur compounds during wine fermentation[J].Journal of Agricultural and Food Chemistry, 2015, 63(36):8 017-8 024.