生物胺(biogenic amine,BA)是一类具有生物活性的低分子质量含氮有机化合物[1],主要由氨基酸脱羧酶作用于氨基酸脱α羧基生成的化合物,其结构可看作生物胺经过转氨作用,氨分子的1~3个氢原子被烷基或芳基取代[2]。组胺作为最常见的生物胺,属于单胺类的神经递质,广泛存在于各类生物体、富含蛋白质和游离氨基酸的食物中[3],尤其是酸奶、奶酪等发酵乳制品中。适量的组胺在体内有血管舒张的作用,可增加血管通透性、降低血压,是人体不可缺少的一种化合物[4]。但当人体组胺含量积累到一定的水平或者摄入含量过高时则会导致严重的中毒症状[5],比如恶心、腹痛、血压升高、心悸胸闷,甚至呼吸困难[6],症状的严重程度取决于摄入的组胺含量和个体对组胺中毒的敏感性[7]。
分子印迹技术是人工合成具有特异性识别位点的高分子聚合物的技术[8]。其基本原理是模板分子与功能单体通过共价键或非共价键的形式组成预聚合物[9],在交联剂和引发剂的作用下形成均匀的印迹层,之后将印迹聚合物中的模板分子通过洗脱液洗脱,达到特异性吸附的效果。近年来,分子印迹聚合物由于制备简单[10],稳定性强[11],较好的选择吸附性[12],可与特定的目标分子结合[13]等优点,在有害物质的分离[14]、去除[15]、化学传感器[16]以及固相萃取[17-18]等方面实现了广泛应用。
组胺的分子印迹方法已有研究,GAO等[19]和MAEDEH等[20]采用本体聚合的方法制备了组胺印迹聚合物,将模板分子与功能单体在引发剂和交联剂的作用下形成固体块状、硬度较大的聚合物,但后期还需要进行机械研磨,研磨过程中易破坏印迹空腔,且由于模板分子包埋较深,后续洗脱过程耗时较长。表面分子印迹方法是指将分子识别位点设计在载体表面或接近表面的地方[21],与传统的本体聚合相比具有吸附更快、吸附容量更高的优点。本文基于分子印迹技术,制备了一种吸附速率快,吸附容量高的印迹聚合物,在后续的检测研究中起到快速高效的吸附效果。本文采用以乙烯基修饰的SiO2为载体,利用表面聚合的方法制备组胺的表面分子印迹聚合物(molecularly imprinted polymer,MIP),同时对其吸附性能进行了研究。
1 材料与方法
1.1 试剂与仪器
组胺(分析纯)、酪胺(优级纯)、二甲基丙烯酸乙二醇酯(纯度98%)、正硅酸乙酯(优级纯)、3-(三甲氧基甲硅基)甲基丙烯酸丙酯(纯度≥97%),美国Sigma-Aldrich公司;甲基丙烯酸(色谱纯),阿拉丁工业有限公司;无水乙醇(分析纯)、氨水(28%,分析纯)、甲醇(色谱纯)、乙酸(分析纯)、甲苯(色谱纯)、组氨酸(生物试剂),国药集团化学试剂有限公司;衣康酸(分析纯)、色胺(纯度98%),上海麦克林生化科技有限公司;偶氮二异丁腈(分析纯),天津市光复精细化工研究所。
TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限公司;SP200-2T多通道磁力搅拌器,杭州米欧仪器有限公司;KQ-400KDE高功率数控超声波清洗器,昆山市超声仪器有限公司;Sorvall ST 8R高速冷冻离心机,赛默飞世尔科技有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;Waterse 2695高效液相色谱仪、Hypersil ODS色谱柱(150.0 mm×4.6 mm,5 μm),美国沃特世公司。
1.2 印迹聚合物的合成
1.2.1 印迹载体SiO2-MPS的制备
向120 mL无水乙醇中搅拌加入50 mL超纯水、10 mL的正硅酸乙酯(tetraethyl orthosilicate,TEOS)和6 mL氨水(28%),在室温下旋匀8 h至溶液呈乳白色,得到SiO2微球悬浊液,离心并用乙醇清洗3遍后干燥备用。
称取1 g干燥的SiO2微球,加入3 mL 3-(三甲氧基甲硅基)甲基丙烯酸丙酯(3-(trimethoxysilyl)propyl methacrylate,MPS),并将其分散于100 mL甲苯中,90 ℃下搅拌24 h,将MPS修饰在硅球表面。反应结束后使用乙醇洗掉未结合的甲苯,干燥备用。
1.2.2 组胺表面分子印迹聚合物的制备
将11.1 mg的模板分子组胺与84.8 μL甲基丙烯酸(methacrylic acid,MAA)溶于15 mL无水乙醇溶液中,超声5 min混匀后在4 ℃下搅拌1 h进行预聚合。在上述溶液中加入200 mg的载体SiO2-MPS、754.4 μL交联剂二甲基丙烯酸乙二醇酯(ethylene glycol dimethacrylate,EGDMA)和10 mg引发剂偶氮二异丁腈(azodiisobutyronitrile,AIBN),氮吹20 min后密封烧瓶,在60 ℃条件下聚合20 h。聚合完成后,取出聚合物8 000 r/min (12 000×g)离心弃去上清液,使用无水乙醇洗掉未结合的试剂。取30 mL甲醇/乙酸(9∶1,体积比)作为洗脱溶液,磁力搅拌1 h后超声振荡30 min,7 000 r/min离心5 min后去除上清液,重复上述步骤5~6次,直至离心后的上清液中不含有组胺。非印迹聚合物(non imprinted polymer,NIP)除不使用组胺外,制备流程同上。
1.3 组胺分子印迹聚合物吸附平衡浓度和吸附时间的优化
称取等量10 mg的MIP,加入10 mL不同浓度的组胺溶液,混匀后吸附30 min,离心取上清液,测定210 nm处的吸光度值,根据吸附前后溶液中含有的组胺的浓度变化,采用差减法计算MIP的吸附容量Q[22],如公式(1)所示:
(1)
式中:c0,组胺溶液的初始浓度,μmol/L;c1,吸附后溶液中组胺的浓度,μmol/L;V,吸附时的溶液体积,L;M,组胺的相对分子质量,g/moL;m,印迹聚合物的质量,g。
称取等量10 mg的MIP和NIP,加入10 mL 的0.5 mmol/L组胺溶液,混匀后分别吸附10、20、30、60、90、120 min后离心取上清液,测定210 nm处的吸光度值。分子印迹中通常使用印迹因子(imprinting factor,IF)来表示印迹效果[22],按公式(2)进行计算:
(2)
式中:QMIP,MIP的吸附容量,mg/g;QNIP,NIP的吸附容量,mg/g。
1.4 组胺分子印迹聚合物特异性吸附
由于不同的基团其紫外吸收最大波长也不同,因此分别测量组氨酸、苯乙胺、酪胺3种组胺结构类似物的最大吸收波长后,确定其各自的标准曲线。分别配制相同浓度的组氨酸溶液、酪胺溶液和苯乙胺溶液各10 mL,加入等量的10 mg的MIP,混匀后吸附同样的时间,离心取上清液,测定吸附前后210 nm处紫外吸光度值的变化,计算吸附容量。
1.5 对酸奶中组胺的吸附
在当地超市选购酸奶,利用所制备的印迹聚合物进行组胺的加标回收检测。取4 mL酸奶样品,加入1 mL不同浓度的组胺标准液,静置30 min,旋匀使其加标浓度分别为200、300、500 μmol/L,然后加入20 mL 0.1%的三氯乙酸和5 mL 2%的乙酸铅振荡5 min,7 000 r/min离心后抽滤上清液。每一个加标浓度的酸奶样品分别制备3批样品以进行平行实验。将10 mg的印迹聚合物与10 mL加标的实际样品进行10 min的旋匀结合,吸附后离心取上清液进行紫外吸收光谱测定,并计算其吸附容量。同时,利用高效液相色谱仪进行验证测定。
色谱条件:A相为90%乙腈和10%的水相(0.77 g乙酸铵溶于10 mL乙酸溶液后定容至1 L),B相为90%水相和10%的乙腈;梯度洗脱程序表参考GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》。
2 结果与分析
2.1 功能单体种类及比例的筛选
模板分子与功能单体的比例对印迹聚合物的吸附性能有比较重要的影响。功能单体过多时,较大的空间位阻可能会导致模板分子在后续洗脱过程中难以洗脱干净;功能单体比例较少时,制备的印迹聚合物对模板分子的非特异性吸附要多于特异性吸附,可能会出现假阳性的结果。
由于组胺分子含有的氨基和含氮杂环易与单体形成氢键结构[23],因此可以通过紫外分光光度计测定和衣康酸(itaconic acid,ITA)2种功能单体与组胺的结合情况。分别配制1 mmol/L的组胺-乙醇溶液、5 mmol/L的MAA-乙醇溶液和5 mmol/L的ITA-乙醇溶液,以MAA为例,于7个烧瓶中分别加入100 μL的组胺-乙醇溶液,然后加入不同体积的MAA-乙醇溶液,分别配制成7种不同组胺与单体比例的10 mL混合溶液,体积比分别为1∶2、1∶4、1∶6、1∶8、1∶10、1∶12、1∶15,超声混匀后在4 ℃培养箱中反应1 h。根据吸光度的加和性,若2种物质不发生反应,则其混合溶液的吸光度理论上为两者单独吸光度的加和;两者发生反应后吸光度会发生变化,并随着反应结合能力的增强,其变化越明显[24]。根据此原理测定了预聚合溶液在190~240 nm的紫外吸收光谱,并对结合前后的最大吸收峰值进行差值比较,结果如图1所示。

a-紫外吸收扫描曲线;b-紫外吸光值变化
图1 不同功能单体与模板预聚合后的紫外吸收扫描曲线和210 nm紫外吸光值的变化
Fig.1 UV absorption scanning curves and the absorbance changes at 210 nm of the prepolymer with different functional monomers and template
由图1-a所示,当以MAA为功能单体时,组胺与MAA预结合后,其吸光度差值最大的比例为1∶8;而以ITA为功能单体时,其最佳结合比例为1∶10。因此,在交联剂和引发剂固定的情况下,分别比较了不同功能单体比例(1∶4、1∶6、1∶8、1∶10和1∶12)下MAA、ITA所制备的印迹聚合物的吸附容量,进而确定单体以及单体与模板的比例。结果如图2所示,在模板与单体的比例为1∶10时,MAA和ITA对组胺的吸附容量均高于1∶8比例时的吸附容量,其中MAA对组胺的吸附容量达到1.9 mg/g,远高于ITA的吸附容量(0.55 mg/g)。综合以上结果,ITA与组胺分子结合能力强,应当归因于ITA分子中的2个羧基容易与组胺结合,但其分子结构要比MAA大,且在分子印迹过程中,产生的印迹空腔要比MAA少,因此考虑MAA作为最终的功能单体,单体与模板比例采用1∶10。
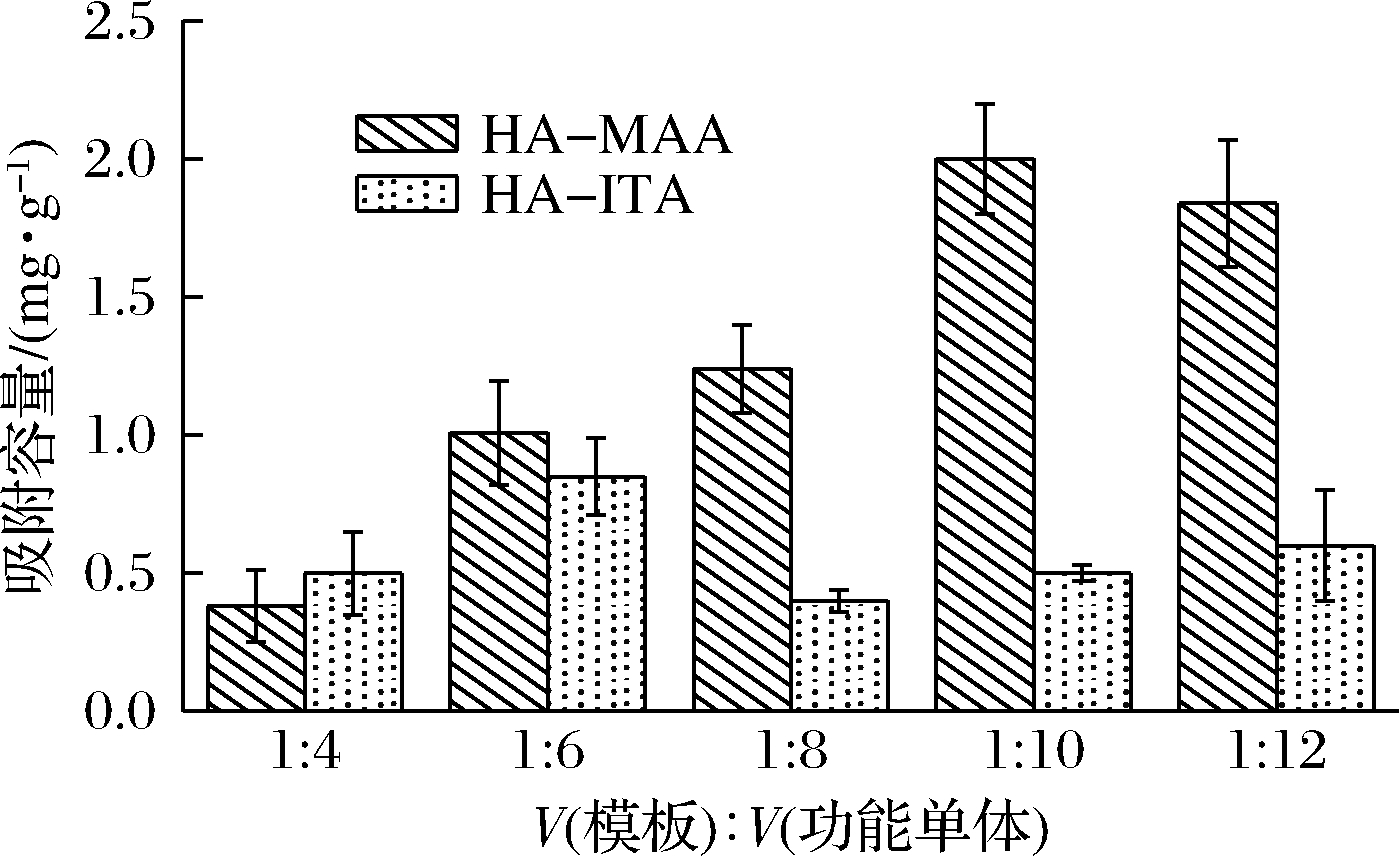
图2 MAA和ITA制备的表面印迹聚合物对组胺的吸附容量
Fig.2 Histamine adsorption of surface imprinted
polymers prepared by MAA and ITA
2.2 交联剂含量优化
在聚合过程中,交联剂的作用是将预结合后的单体与载体之间形成交联,形成具有一定结构的高分子聚合物,在模板分子去除后形成与其形状互补的孔穴。交联剂的种类和数量会直接影响MIP的吸附性能,交联剂过少会导致聚合物无法支撑孔穴结构,过多则会导致聚合物交联成块,影响模板的洗脱和后续检测时对模板的识别与吸附。
本文比较了不同含量的交联剂对印迹聚合物吸附性能的影响。将11.1 mg的模板分子组胺与84.8 μL的MAA溶于15 mL的无水乙醇溶液中,超声混匀后4 ℃下搅拌1 h。在固定了组胺和MAA含量的情况下,分别加入94.3、188.6、377.2、565.8、754.4、943.0 μL的EGDMA,配制6种模板与交联剂不同含量比例的印迹聚合物,比例分别为1∶5、1∶10、1∶20、1∶30、1∶40、1∶50。
印迹聚合物的吸附容量结果如图3所示,随着交联剂的用量从94.3 μL增加到754.4 μL,模板与交联剂EGDMA的体积比从1∶5增加到1∶40,相应制备的印迹聚合物的吸附容量也从2.3 mg/g增加到5.99 mg/g。而当交联剂含量增加至943.0 μL时,模板与交联剂体积比达到1∶50,吸附容量仅有2 mg/g,此时的印迹聚合物中含有的交联剂过多,形成的印迹聚合物反而不利于模板分子的识别。由于2.1小节中优化的模板与功能单体的最佳比例为1∶10,后续实验中将模板、功能单体和交联剂的比例确定为1∶10∶40。
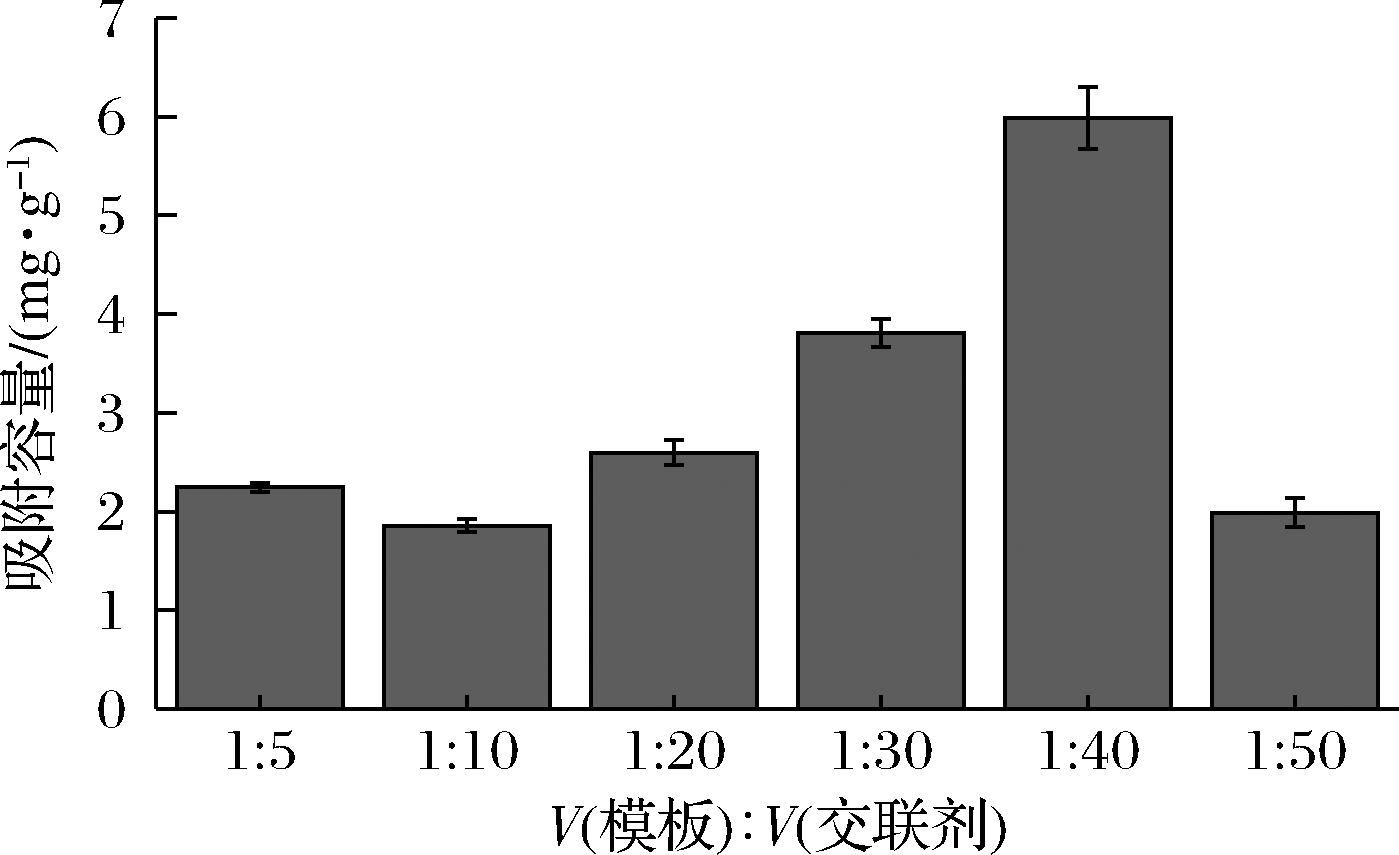
图3 不同交联剂比例下MIP的吸附容量
Fig.3 Adsorption capacity of MIP with different crosslinking agent ratio
2.3 印迹聚合物MIP的结构表征
利用透射电子显微镜对聚合物的形状与粒径进行分析,由图4-a可以看出,所制备的SiO2分散均匀,形态均一呈圆球型,直径在300~400 nm。在印迹聚合物(b)的透射电镜显微图中,可看到在SiO2微球表面覆盖了一层厚度约40~50 nm的印迹层,表明印迹聚合物已在微球表面制备成功。

图4 硅球载体(a)和带有印迹聚合物的硅球(b)的透射电镜显微图
Fig.4 Transmission electron microscope of silica ball carrier (a) and silica ball with imprinted polymer (b)
同时利用红外光谱仪,对载体和聚合物进行了红外光谱分析。图5展示了SiO2-MPS、未洗脱模板的MIP-HA和洗脱模板后的MIP的红外光谱图。

a-MIP;b-MIP-HA;c-SiO2-MPS
图5 SiO2-MPS、未洗脱模板的MIP-HA和洗脱模板后的MIP的红外光谱图
Fig.5 Infrared spectra of SiO2 MPs, MIP-HA without eluting template and MIP after eluting template
图5-a中,1 093 cm-1处出现的吸收峰为Si—O—Si的伸缩振动峰,表明SiO2的成功合成,2 983和1 867 cm-1的吸收峰分别为MPS中C—H的振动峰和羰基C![]() O的伸缩振动峰,均表明已成功将MPS修饰在了SiO2表面。
O的伸缩振动峰,均表明已成功将MPS修饰在了SiO2表面。
与图5-a曲线(b)相比,曲线(c)中1 726 cm-1处C![]() O的吸收峰明显增强,2 967 cm-1处的C—H也有所增强,2处的特征峰均来源于MIP中含有的EGDMA,表明MIP-HA的成功合成。离心洗脱后的上清液紫外扫描曲线中,洗脱6次后吸光度已降至0.02,同时在图5-a曲线(a)中800 cm-1左右的N—H振动吸收峰经过洗脱已消失,MIP制备完成。
O的吸收峰明显增强,2 967 cm-1处的C—H也有所增强,2处的特征峰均来源于MIP中含有的EGDMA,表明MIP-HA的成功合成。离心洗脱后的上清液紫外扫描曲线中,洗脱6次后吸光度已降至0.02,同时在图5-a曲线(a)中800 cm-1左右的N—H振动吸收峰经过洗脱已消失,MIP制备完成。
2.4 组胺分子印迹聚合物的吸附特性
为了探究印迹聚合物对组胺分子的吸附效果,在0.1~0.6 mmol/L的组胺加标浓度范围内以吸附容量作为指标,进行了吸附试验。如图6所示,在0.1~0.5 mmol/L的浓度范围内随着组胺浓度的增加,印迹聚合物的吸附容量也随之增加。组胺浓度为500 μmoL/L时,MIP对模板分子的吸附容量达到最大值,为13.1 mg/g。
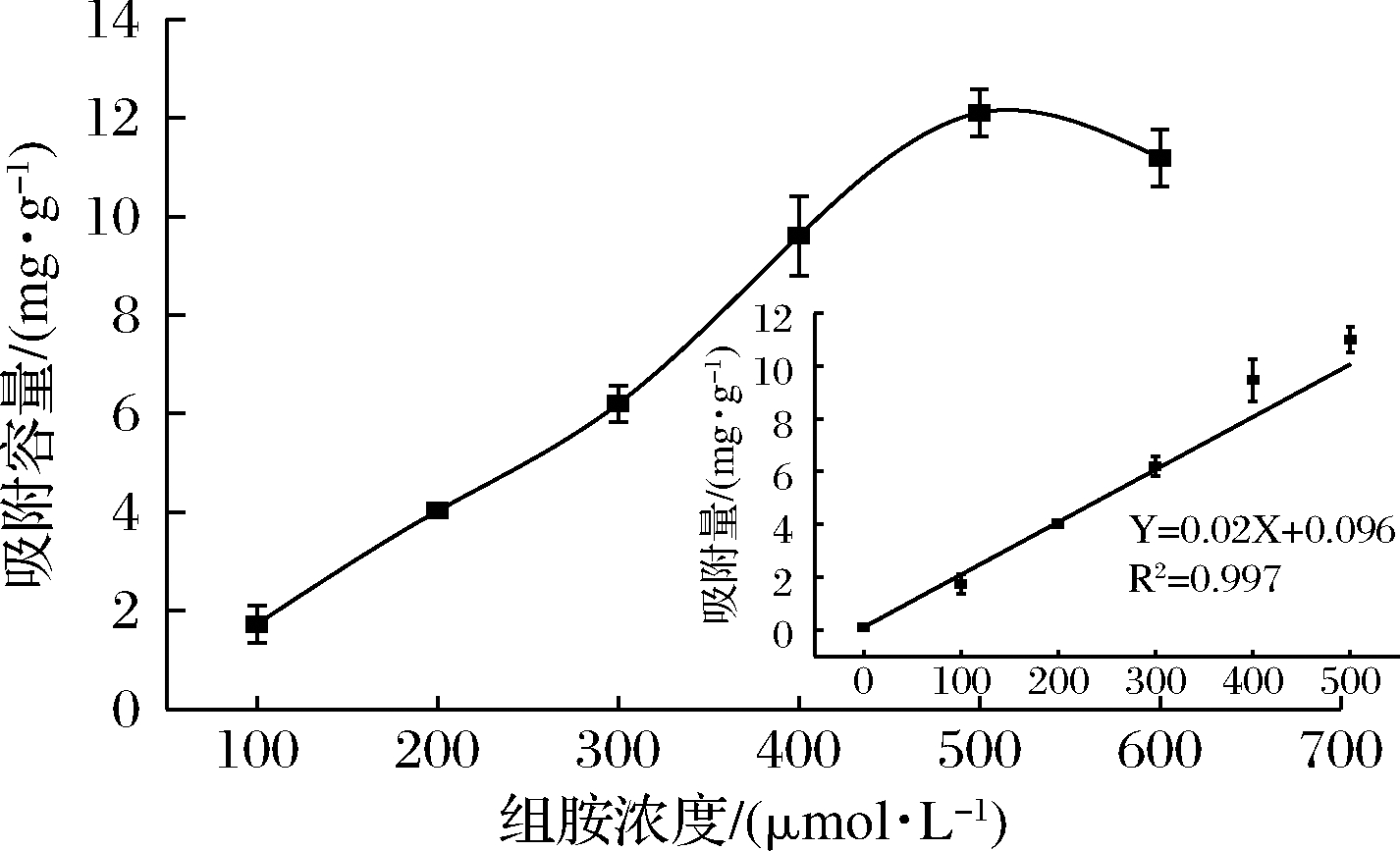
图6 组胺印迹聚合物的吸附等温线
Fig.6 Adsorption isotherms of histamine imprinted polymers
2.5 组胺分子印迹聚合物的动力学分析
吸附平衡时间反应了印迹聚合物的吸附效率。相同浓度下的吸附时间变化如图7所示。在最初10 min内,组胺的吸附容量迅速增加,达到一个几乎随时间延长而保持不变的最大值,说明印迹聚合物的吸附过程已达到平衡。而且MIP的最大吸附容量为13.1 mg/g时,NIP的吸附容量仅有3.3 mg/g,MIP的吸附能力约是NIP的4倍,因此MIP对组胺分子的亲和性和特异选择性要比NIP好。并且与以往研究中本体聚合方法[25]所制备的印迹聚合物相比,本研究制备的聚合物吸附速率快,到达吸附平衡的时间更短。
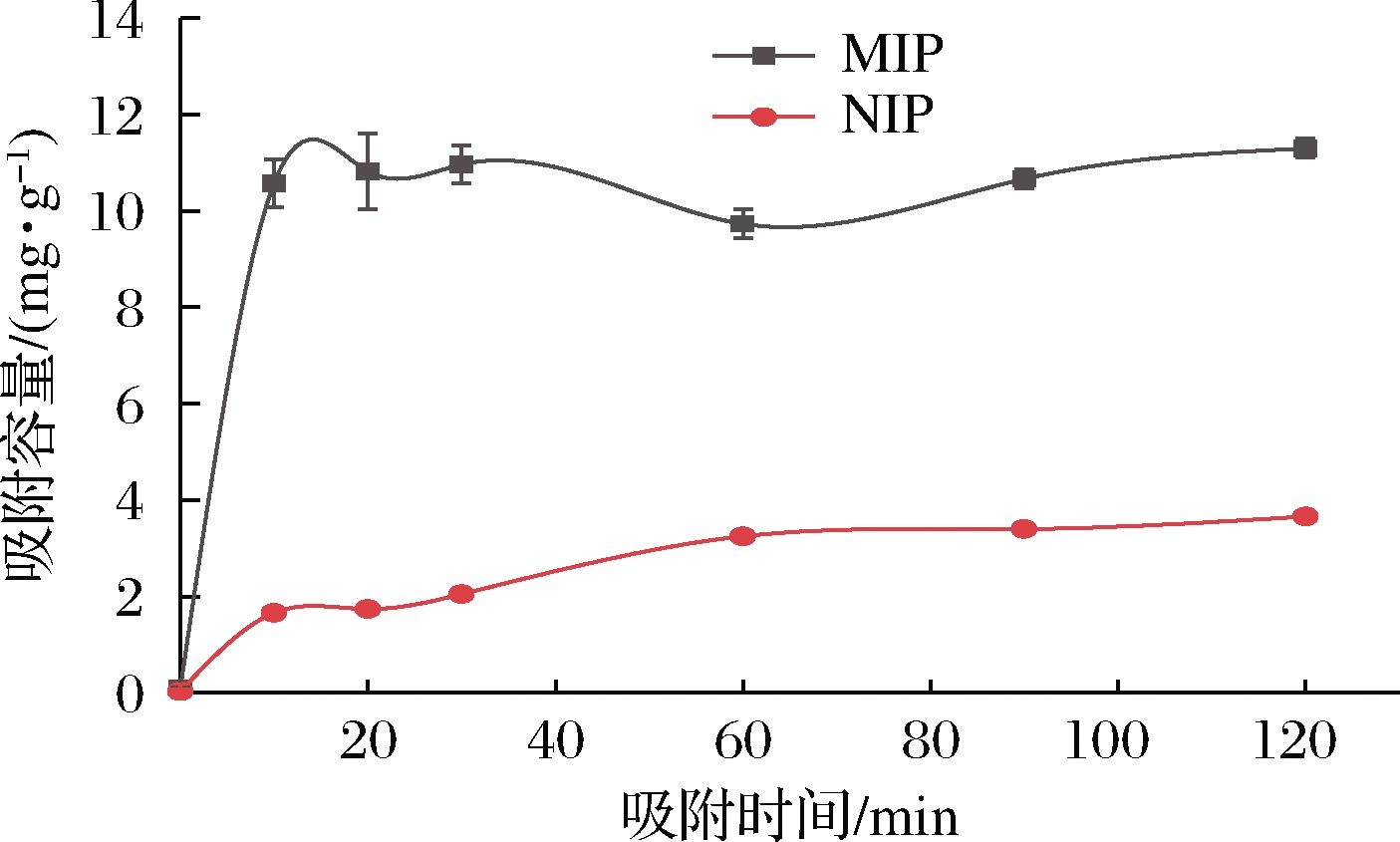
图7 组胺印迹聚合物的动力学吸附曲线
Fig.7 Kinetic adsorption curve of histamine imprinted polymer
2.6 印迹聚合物的特异性分析
选取组氨酸、酪胺和苯乙胺这3种组胺的结构类似物,将所制备的印迹聚合物与之反应,进行吸附容量测定,结果如图8所示。在500 μmol/L加标浓度下,所制备的印迹聚合物对组胺有很好的吸附性,对结构类似物的吸附性较低。与组胺的前体物质组氨酸相比,所制备的印迹聚合物对组胺的吸附容量是组氨酸吸附容量的13倍。
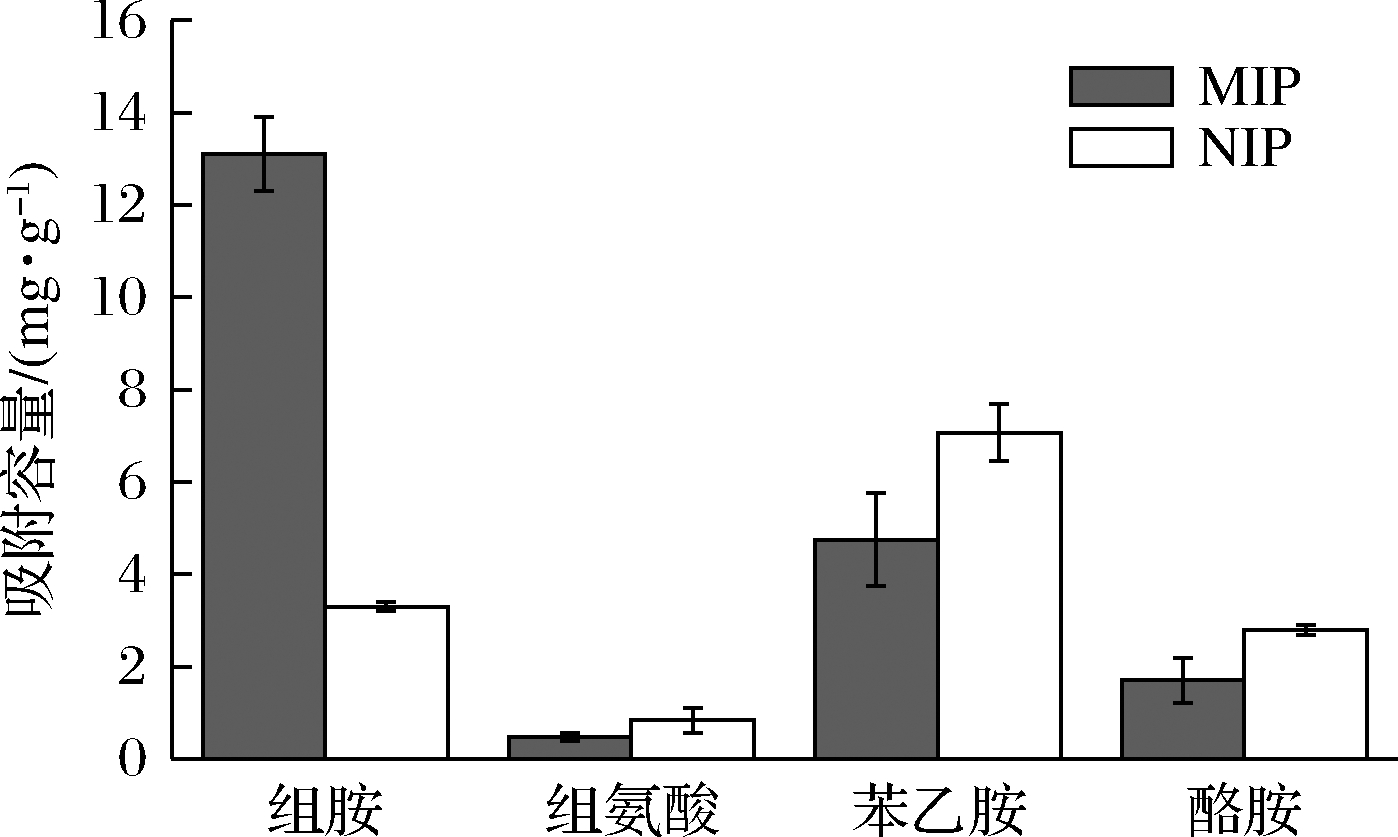
图8 印迹聚合物对组胺及其结构类似物的吸附能力
Fig.8 Adsorption capacity of imprinted polymers for histamine and its analogues
2.7 与以往研究的对比
在以往组胺分子印迹聚合物的研究当中,通常采用本体聚合的方法,所需吸附时间为1~4 h,无法达到快速检测的目的。本研究方法可在10 min内快速达到吸附平衡且吸附容量高于其他已公开的印迹聚合物制备方法(表1)。
表1 研究方法对比
Table 1 Comparison of research methods
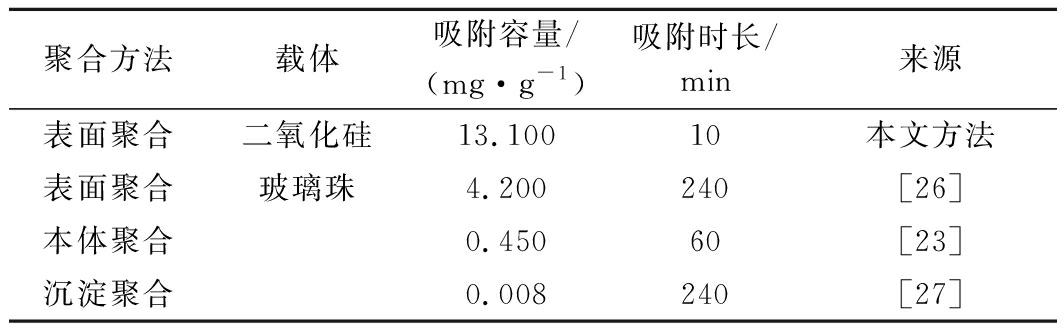
聚合方法载体吸附容量/(mg·g-1)吸附时长/min来源表面聚合二氧化硅13.10010本文方法表面聚合玻璃珠4.200240[26]本体聚合0.45060[23]沉淀聚合0.008240[27]
2.8 对酸奶中组胺的吸附
以1,7-二氨基庚烷为内标,组胺的液相色谱图如图9所示,以组胺的峰面积与内标峰面积为比值,绘制标准曲线。通过对酸奶样品进行200、300和500 μmol/L这3个水平的组胺加标,使用高效液相色谱测定了该MIP在实际样品中的吸附性能,如表2所示,当组胺浓度为500 μmol/L时,MIP的吸附容量达到8.35 mg/g,并且通过与组胺标准溶液中的吸附性能进行比较,结果显示在酸奶样品中,该印迹聚合物仍具有良好的吸附性能,10 mg的印迹聚合物去除率达到20%,后续可通过增加聚合物的使用量来进一步增大去除率。
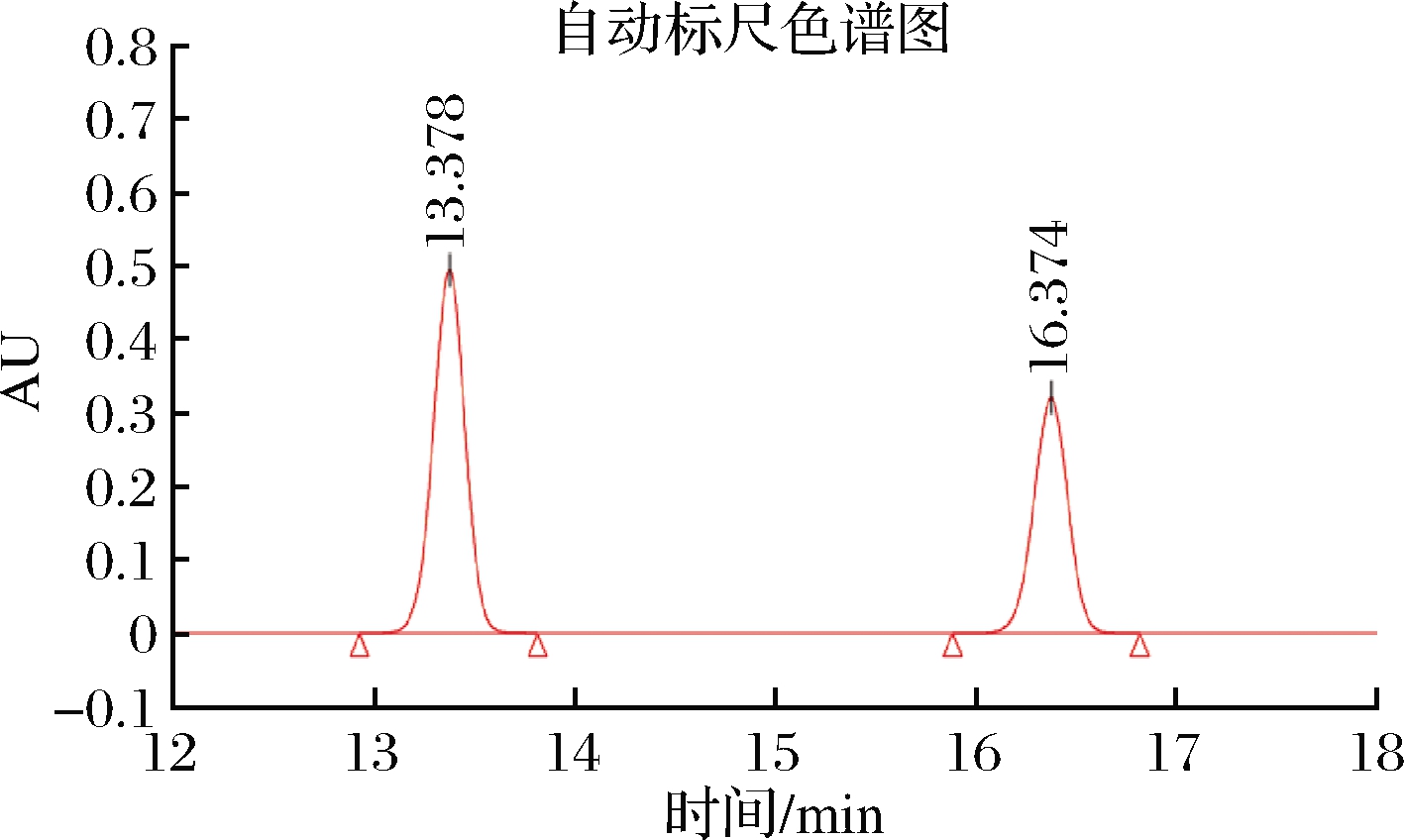
图9 组胺和内标的高效液相色谱图
Fig.9 High performance liquid chromatography of histamine and internal standard
表2 实际样品的吸附测定
Table 2 Adsorption determination of actual samples
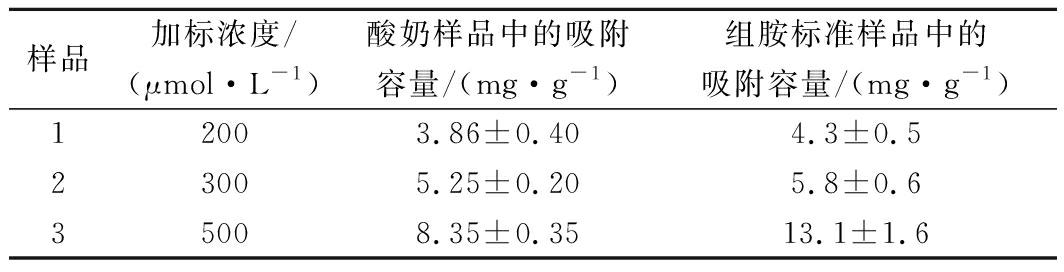
样品加标浓度/(μmol·L-1)酸奶样品中的吸附容量/(mg·g-1)组胺标准样品中的吸附容量/(mg·g-1)12003.86±0.404.3±0.523005.25±0.205.8±0.635008.35±0.3513.1±1.6
3 结论
以组胺为模板分子,甲基丙烯酸为功能单体,无水乙醇为溶剂,在双键修饰的二氧化硅表面上制备了具有特异性的表面分子印迹聚合物,并通过红外光谱和透射电镜进行表征,验证了表面印迹聚合物的合成。与传统的本体聚合方法相比,该表面印迹聚合物对组胺有更大的吸附容量(13.1±1.6) mg/g,吸附速度更快,可在10 min内达到吸附平衡。该表面印迹聚合物也展现出了良好的选择性,其吸附容量是结构类似物组氨酸的13倍,该聚合物也被成功应用于实际样品酸奶中组胺的吸附。
[1] PARK Y K,LEE J H,MAH J H.Occurrence and reduction of biogenic amines in traditional Asian fermented soybean foods:A review[J].Food Chemistry,2019,278:1-9.
[2] LUCIANO M,HEITOR D,LA D,et al.A multi-purpose tool for food inspection:Simultaneous determination of various classes of preservatives and biogenic amines in meat and fish products by LC-MS[J].Talanta,2018,178:1 053-1 066.
[3] 吴训忠, 支菁蕾,阚建全,等.发酵辣椒中生物胺含量及其品质分析[J].食品与发酵工业,2020,46(11):288-294.
WU X Z,ZHI J L,KAN J Q,et al.Biogenic amine and quality analysis of fermented chili[J].Food and Fermentation Industries,2020,46(11):288-294.
[4] LIU S C,LIN C S,CHEN S G,et al.Effect of budesonide and azelastine on histamine signaling regulation in human nasal epithelial cells[J].European Archives of Oto-Rhino-Laryngology,2017,274(2):845-853.
[5] FABIO M C,PATRIZIA C,ENRICA C,et al.Histamine food poisonings:A systematic review and meta-analysis[J].Critical Reviews in Food Scionce and Nutrition,2018,58(7):1 131-1 151.
[6] AMARILLA M,ASAKO N,THOMAS E.Histamine,histamine receptors,and anti-histamines in the context of allergic responses[J].Lymphosign Journal,2019,6(2):35-51.
[7] KHAN S,CARNEIRO L S A,VIANNA M S,et al.Determination of histamine in tuna fish by photoluminescence sensing using thioglycolic acid modified CdTe quantum dots and cationic solid phase extraction[J].Journal of Luminescence,2017,182:71-78.
[8] 陈静钰, 黄鑫,王力,等.同时脱除吡虫啉和啶虫脒农残的虚拟模板表面分子印迹的制备和应用[J].食品与发酵工业,2020,46(5):91-97.
CHEN J Y,HUANG X,WANG L,et al.Synthesis of molecularly imprinted polymers of virtual template surface and its application on simultaneously remove imidacloprid and acetamiprid[J].Food and Fermentation Industries,2020,46(5):91-97.
[9] 齐小玲, 王悦秋,张朔瑶,等.分子印迹聚合物的制备方法及应用进展[J].化学研究与应用,2009,21(4):441-449.
QI X L,WANG Y Q,ZHANG S Y,et al.The synthetic methods and application of molecularly printed polymers[J].Chemical Research and Application,2009,21(4):441-449.
[10] XIONG Y,YE Z B,XU J,et al.A microvolume molecularly imprinted polymer modified fiber-optic evanescent wave sensor for bisphenol A determination[J].Analytical and Bioanalytical Chemistry,2014,406(9-10):2 411-2 420.
[11] XU S,LIN G Y,ZHAO W,et al.Necklace-like molecularly imprinted nanohybrids based on polymeric nanoparticles decorated multi-walled carbon nanotubes for highly sensitive and selective melamine detection[J].ACS Applied Materials & Interfaces,2018,10(29):24 850-24 859.
[12] LIU X,ZHOU T,DU Z,et al.Recognition ability of temperature responsive molecularly imprinted polymer hydrogels[J].Soft Matter,2011,7(5):1 986-1 993.
[13] TERRY T J,MASON A F,MARRESE C A.Molecularly imprinted polymers:United States,US2011303611[P].2011-12-15.
[14] LI Y,LI X,DONG C K,et al.Selective recognition and removal of chlorophenols from aqueous solution using molecularly imprinted polymer prepared by reversible addition-fragmentation chain transfer polymerization[J].Biosensors and Bioelectronics,2009,25(2):306-312.
[15] S NCHEZ-POLO M,VELO-GALA I,L
NCHEZ-POLO M,VELO-GALA I,L PEZ-PE
PEZ-PE ALVER J J,et al.Molecular imprinted polymer to remove tetracycline from aqueous solutions[J].Microporous and Mesoporous Materials,2015,203(203):32-40.
ALVER J J,et al.Molecular imprinted polymer to remove tetracycline from aqueous solutions[J].Microporous and Mesoporous Materials,2015,203(203):32-40.
[16] CHEN P Y,NIEN P C,WU C T,et al.Fabrication of a molecularly imprinted polymer sensor by self-assembling monolayer/mediator system[J].Analytica Chimica Acta,2009,643(1-2):38-44.
[17] ASHLEY J,SHAHBAZI M A,KANT K,et al.Molecularly imprinted polymers for sample preparation and biosensing in food analysis:Progress and perspectives[J].Biosensors & Bioelectronics,2017,91:606-615.
[18] SOLEDADRODR GUEZ B,FERN
GUEZ B,FERN NDEZHERNANDO P,GARC-INU
NDEZHERNANDO P,GARC-INU OMART
OMART NEZ R M,et al.Effective determination of ampicillin in cow milk using a molecularly imprinted polymer as sorbent for sample preconcentration[J].Food Chemistry,2017,224:432-438.
NEZ R M,et al.Effective determination of ampicillin in cow milk using a molecularly imprinted polymer as sorbent for sample preconcentration[J].Food Chemistry,2017,224:432-438.
[19] GAO F,GRANT E,LU X N.Determination of histamine in canned tuna by molecularly imprinted polymers-surface enhanced raman spectroscopy[J].Analytica Chimica Acta,2015,901:68-75.
[20] AKHOUNDIAN M,RUTER A,SHINDE S.Ultratrace detection of histamine using a molecularly-imprinted polymer-based voltammetric sensor[J].Analytic (Basel),2017,17(3):645-654.
[21] 丛姣姣, 罗静,高雅涵,等.表面分子印迹研究进展[J].高分子通报,2015(5):10-20.
CONG J J,LUO J,GAO Y H,et al.Research progress of surface molecular imprinting technique[J].Polymer Bulletin,2015(5):10-20.
[22] 王遵臣, 于海宁,沈生荣,等.辣椒素分子印迹聚合物的制备及其在固相萃取中的应用[J].食品科学,2013,34(12):45-50.
WANG Z C,YU H N,SHEN S R,et al.Preparation of capsaicin molecular imprinting polymers and application to solid phase extraction[J].Food Science,2013,34(12):45-50.
[23] TRIKKA F A,YOSHIMATSU K,YE L,et al.Molecularly imprinted polymers for histamine recognition in aqueous environment[J].Amino Acids,2012,43(5):2 113-2 124.
[24] 李璐, 周刘梅,解新安,等.溴氰菊酯农药残留检测的分子印迹预聚体系筛选及吸附性能[J].农业工程学报,2019,35(1):269-277.
LI L,ZHOU L M,XIE X A,et al.Screening of molecularly imprinted pre-assembly system for detection of deltamethrin pesticide residues and its specific adsorption properties[J].Transactions of the Chinese Society of Agricultural Engineering,2019,35(1):269-277.
[25] SAHEBNASAGH A,KARIMI G,MOHAJERI S A.Preparation and evaluation of histamine imprinted polymer as a selective sorbent in molecularly imprinted solid-phase extraction coupled with high performance liquid chromatography analysis in canned fish[J].Food Analytical Methods,2014,7(1):1-8.
[26] FENG X T,ASHLEY J,ZHOU T C,et al.A facile molecularly imprinted polymer-based fluorometric assay for detection of histamine[J].RSC Advances,2018,8(5):2 365-2 372.
[27] MATTSSON L,XU J J,PREININGER C,et al.Competitive fluorescent pseudo-immunoassay exploiting molecularly imprinted polymers for the detection of biogenic amines in fish matrix[J].Talanta,2018,181:190-196.