抗冻蛋白(antifreeze proteins,AFPs) 是生物为适应极端寒冷环境而产生的一类特异性糖肽或多肽[1],它能够以非依数的形式降低溶液的冰点而不改变其熔点,从而导致溶液的熔点和冰点之间出现差值,这种差值称为热滞活性[1-2]。AFPs还可通过氢键吸附于冰晶表面,从而控制冰晶生长以及抑制冰晶之间发生重结晶。AFPs的热滞活性及重结晶抑制活性使得其能减少或防止在冻融循环过程中冰晶对细胞和组织的伤害,并在结冰或亚结冰条件下保护生物体不受伤害[3],因而在食品、血液以及器官和组织的冷冻储存中有广泛的应用前景[4]。
迄今为止,人们在植物、海洋鱼类、昆虫及真菌中都发现了不同类型的AFPs[5-6],但成本高、产率低等不足仍是限制AFPs产业化制备的主要因素,因而寻找合适的AFPs原料并提取出高热滞活性的AFPs是亟需解决的问题。动物皮是胶原蛋白的主要载体,从胶原蛋白的特异性氨基酸序列及空间结构分析,胶原蛋白可能含有高活性的胶原抗冻肽[7]。我国具有丰富的牦牛资源,牦牛皮中胶原蛋白的含量达到其干重的70%以上。但目前牦牛皮主要应用于皮革的制作,利用率较低。因而利用牦牛皮作为提取AFPs的原料不仅可以有效利用畜禽加工副产物实现价值增值的目的,还能满足市场对高性价比AFPs的需求。
胶原抗冻肽的分子质量对其抗冻特性有着显著影响。BAR DOLEV等[8]研究发现南极细菌Marinomonas primoryensis 能分泌具有附着性的AFP1,使细菌附着在冰顶部以获得氧气和营养物质。该AFP是1种由 5 个不同区域组成的长蛋白质,相对分子质量 1.5 MDa,其中第4个相对分子质量为 34 kDa的特定区域能与冰晶发生特异性的结合。DAMODARAN等[9]利用蛋白酶水解鱼皮明胶,证实了分子质量在1 000~2 500 Da的明胶多肽具有抑制冰晶生长的作用。这些实验表明了不同分子质量的抗冻肽抑制冰晶生长的能力并不相同,但目前对不同分子质量的胶原抗冻肽抑制冰晶生长作用机理的研究却很少。因此本实验采用热水抽提耦合酶水解法,制备了胶原蛋白酶解产物,并应用超滤膜技术得到了<1 k、1~3 k、3~5 k及>5 kDa这4种不同分子质量的胶原抗冻肽。在此基础上,对不同分子质量范围胶原抗冻肽的热滞活性、重结晶抑制能力及修饰冰晶生长的特性进行了研究,同时总结了胶原抗冻肽与冰晶相互作用的机理。
1 材料与方法
1.1 实验材料
新鲜牦牛皮,青海省屠宰场。将牦牛皮去毛、洗净、绞碎,并采用质量分数为5%的 Na2CO3 溶液脱脂18 h,进一步采用质量分数为5%的NaCl溶液去除盐溶性非胶原成分,蒸馏水漂洗后贮藏于-20 ℃备用;牛血清白蛋白(bovine serum albumin,BSA),上海伯奥生物科技有限公司;木瓜蛋白酶(200 NFU/mg),南宁庞博公司;其余试剂均为分析纯,国药集团化学试剂有限公司。
1.2 实验仪器
Pyris Diamond差示扫描量热仪,美国Perkin Elmer 公司;RO-UF-4010(MSM-1812)型膜分离装置超滤纳滤反渗透,1 kDa、3 kDa、5 kDa等0.2 m2卷式膜组件,上海摩速科学器材有限公司;BP211D型天平,德国赛多利斯公司 (精确到0.01 mg) ; J-20XP型冷冻离心机,上海安亭科学仪器厂;BX51显微镜,日本奥林巴斯公司;FDCS冷热台,英国LinKam公司;Waters2414示差折光检测器,美国沃特斯公司;Kje ltec 8400型全自动凯氏定氮仪, 丹麦福斯集团公司;LD85B3型真空冷冻干燥机,美国MillRock科技公司;TLID-2005袖珍型低温恒温槽,金坛市华峰仪器有限公司;Agilent1100型氨基酸自动分析仪,美国Agilent公司;79-1恒温磁力搅拌器,宁波天恒仪器厂。
1.3 实验方法
1.3.1 牦牛皮常规成分的测定
牦牛皮中的水分含量采用常压干燥法测定(GB 5009.3—2016);粗蛋白含量采用微量凯氏定氮法测定(GB 5009.5—2016);粗脂肪含量采用索氏抽提法测定(GB 5009.6—2016)。
1.3.2 牦牛皮中胶原蛋白的提取
称取20 g牦牛皮置于烧杯中,以1∶30的料液比(g∶mL)添加蒸馏水,在微沸状态下加热5 h,待溶液冷却至室温后置于酶反应器内。参考WANG等[10]的方法,并通过预实验得到胶原蛋白的最佳酶解条件为:木瓜蛋白酶添加量2 000 U/g,温度55 ℃,酶解时间48 h。酶解完成后5 000 r/min离心30 min,取上清液测定羟脯氨酸(Hyp)含量。
1.3.3 胶原蛋白含量测定
胶原蛋白含量采用WOESSNER[11]的方法进行测定。称取4 g牦牛皮,加入30 mL 3 mol/L HCl 溶液于105 ℃下水解 16 h,水解完毕后过滤,获得上清液。取4 mL稀释好的上清液于比色管中,加入2 mL 14.1 g/mL氯胺T溶液,充分混匀后置于室温下放置20 min以氧化Hyp;再加入2 mL显色剂(10 g对二氨基苯甲醛,35 mL高氯酸,65 mL异丙醇,临用前配制),并于60 ℃水浴加热20 min;反应完毕后,在波长 560 nm 处测定溶液的吸光值,并建立Hyp标准曲线;根据标准曲线的公式和样品吸光值计算胶原蛋白中Hyp 的含量,如公式(1)所示,胶原蛋白含量按公式(2)计算:
Hyp含量![]()
(1)
胶原蛋白含量/%=Hyp含量×7.46
(2)
式中:7.46为换算系数。
1.3.4 氨基酸组成
分别称取10 mg不同分子质量的胶原抗冻肽于水解管中,加入2 mL 6 mol/L HCl溶液,再加入3~4滴苯酚;将水解管放入冰盐水中预冷3~5 min,抽真空并封口,然后在110 ℃下水解 22 h;将水解后的样品液转移后过滤后转移至量瓶内,用水定容至刻度,振荡混匀。取1 mL滤液用氮吹仪60 ℃吹干,残留物用柠檬酸钠缓冲液复溶后取样上机测定。色谱条件:C18柱(4.0 mm×125 mm);柱温40 ℃;样品流速1.0 mL/min;检测波长440 nm(Hyp、Pro),570 nm(除Hyp、Pro以外的氨基酸);流动相A为20 mmol醋酸钠溶液,B为V(20 mmol醋酸钠溶液)∶V(甲醇)∶V(乙腈)=1∶2∶2。
1.3.5 胶原酶解产物分子质量分布的测定
采用水相凝胶渗透色谱法对酶解液中的多肽进行相对分子质量分布的测定。色谱条件:Waters2414示差折光检测器;Waters凝胶色谱柱;流动相为0.1 mol/L的NaNO3溶液;流速0.5 mL/min;柱温40 ℃。酶解液冻干粉配成5 mg/mL的溶液,进样体积50 μL。
1.3.6 胶原蛋白酶解液的膜分离处理及得率计算
选择截留分子质量分别为5、3和1 kDa的超滤膜对胶原蛋白酶解液的上清液依次进行超滤,如图1所示。
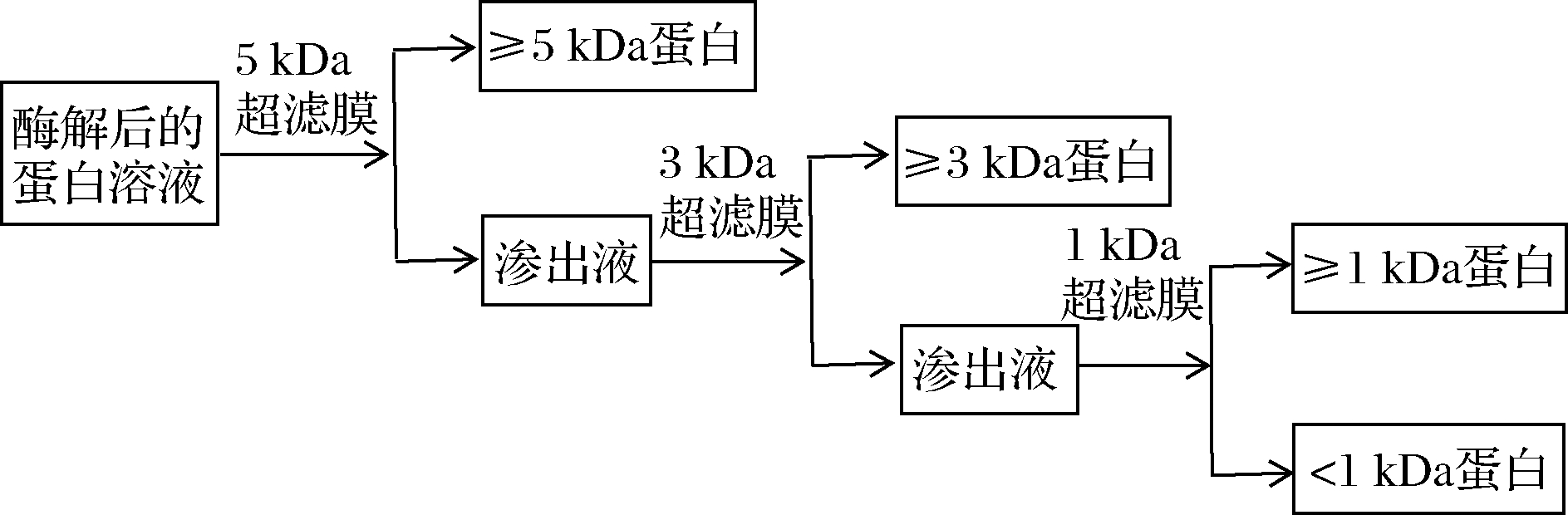
图1 不同分子质量胶原抗冻肽制备工艺流程图
Fig.1 Preparation process of collagen antifreeze peptides with different molecular weights
膜分离设备的参数:压力0.2 MPa,温度25 ℃。根据1.3.3中的方法测定不同组分超滤液中胶原蛋白的含量,并根据公式(3)计算其得率:
胶原抗冻肽的得率![]()
(3)
式中:m1,膜分离后一定分子质量范围内的胶原抗冻肽总质量,g;m2,牦牛皮的总质量,g。
1.3.7 不同分子质量胶原抗冻肽的热滞活性测定
称取约10 mg样品密封于铝皿内,并放置于差示扫描量热议内。当仪器充满液氮并稳定后,以10 ℃/min的速率将样品降温至-20 ℃并保持5 min;然后以5 ℃/min的速率升温至样品呈固液共存状态,即到达其保留温度(holding temperature,Th),保持5 min;再将温度以1 ℃/min的速率从Th降至-20 ℃。重复上述升降温程序,分别记录样品的起始结晶温度(T0)以及结晶热(ΔHr)[9],并分别按照公式(4)计算热滞活性值。以无抗冻活性的BSA作为对照。
热滞活性=Th-T0
(4)
1.3.8 不同分子质量胶原抗冻肽的重结晶抑制效应
以质量分数40%的蔗糖溶液为溶剂,配制质量浓度100 mg/mL的抗冻肽溶液,利用低温显微镜观察其重结晶抑制能力。首先以10 ℃/min的速率将样品温度从25 ℃降至1 ℃,保持1 min以防止表面起雾;然后以90 ℃/min的速率降温至-50 ℃以生成微小的冰晶,保持1 min;再以10 ℃/min的速率升温至-6 ℃,保持40 min[12];图像收集和分析由软件IMAGE-PRO PLUS完成,图像放大倍数为500倍。
1.3.9 不同分子质量胶原抗冻肽对冰晶生长形态的修饰
以40%的蔗糖溶液为溶剂,将制得的抗冻肽配制成100 mg/mL的溶液,并利用低温显微镜观察其对冰晶生长形态的影响。首先以10 ℃/min的速率将温度从25 ℃降至-30 ℃,生成微小的冰晶,保温1 min;然后以4 ℃/min的速率升温,直至出现单冰晶,再以0.1 ℃/min的速率降温,使冰晶生长[12]。图像放大倍数为500倍,图像收集和分析由软件IMAGE-PRO PLUS完成,通过计算冰晶面积,评估添加不同分子质量抗冻肽的冰晶面积与降温时间的关系。
2 结果与讨论
2.1 牦牛皮的主要成分
牦牛皮的主要成分含量如表1所示。牦牛皮中水分含量最高,达到64.87%。除水分外,牦牛皮中蛋白质的含量达到28.17%,占干重质量的80.19%。牦牛皮中的蛋白主要为胶原蛋白,占总蛋白含量的91.91%。而猪皮、鹅皮和鱼皮等动物皮中不仅总蛋白含量低于牦牛皮,胶原蛋白含量也仅占总蛋白含量的65%~85%[13-15],由此可见牦牛皮中胶原蛋白的含量十分丰富。
表1 牦牛皮的主要成分
Table 1 Main ingredients of yak hide
主要成分水分蛋白质脂肪胶原蛋白含量/%64.8728.171.5725.89
2.2 不同分子质量胶原抗冻肽的得率及分子质量分布
经过膜分离后,不同分子质量胶原肽的得率如表2所示。可见,热水耦合酶水解法对胶原肽的得率可达77%。其中,对小分子质量(<1 kDa)胶原肽的得率最高,为61.6%,其余依次为3~5 kDa、>5 kDa和1~3 kDa的胶原肽。不同分子质量胶原肽的分子质量分布如图2所示,可见其主要为<1 kDa的胶原肽。
表2 不同分子质量胶原抗冻肽的得率
Table 2 Contents of different peptides of collagen antifreeze peptide
相对分子质量/kDa>53~51~3<1得率/%5.396.163.0861.6
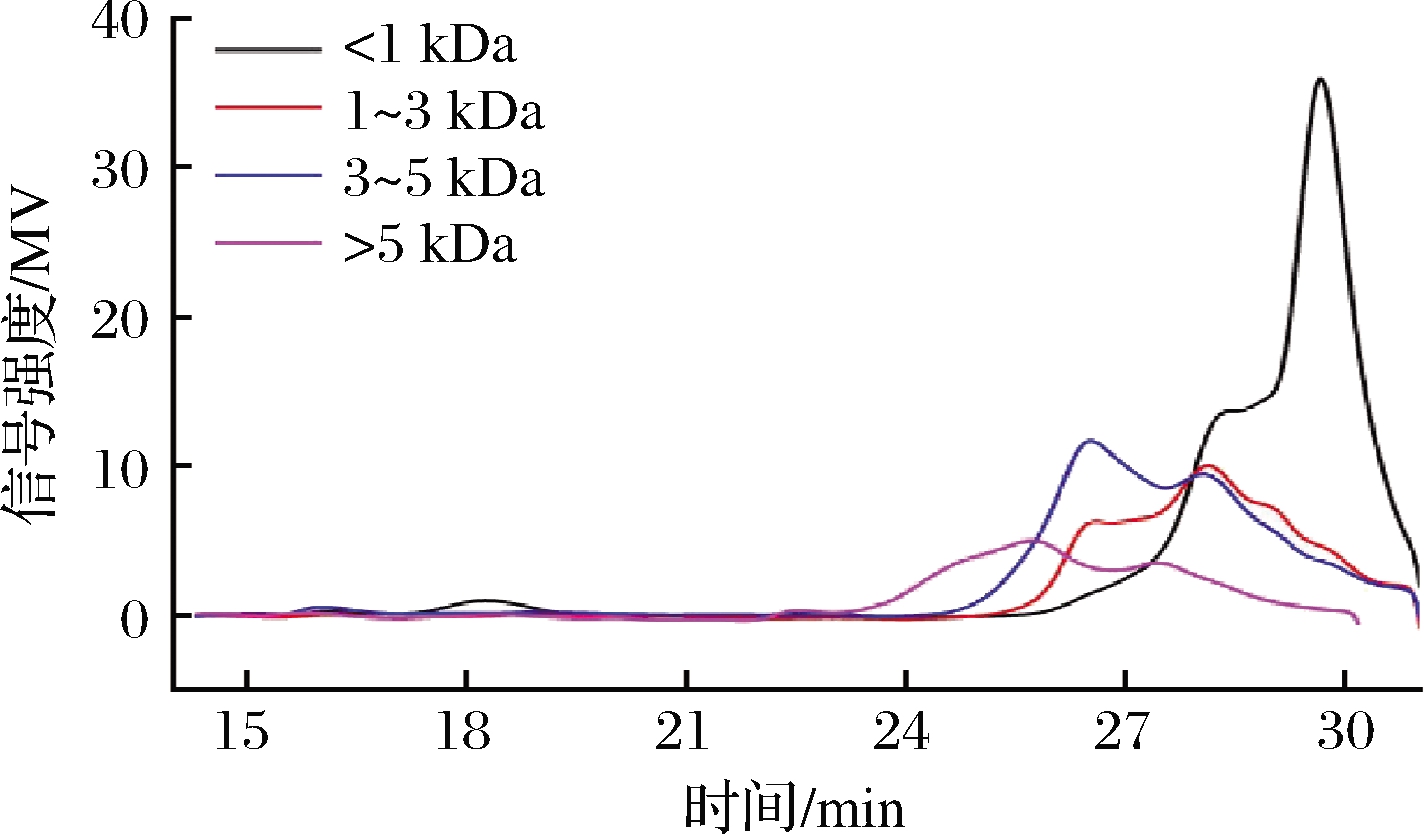
图2 不同分子质量胶原抗冻肽的分子质量分布图
Fig.2 Molecular weight distribution of collagen antifreeze peptides with different molecular weights
2.3 不同分子质量胶原抗冻肽的氨基酸组成
采用氨基酸自动分析仪分析了不同分子质量胶原肽的氨基酸组成,结果如表3所示。在不同分子质量胶原肽的氨基酸组成中,甘氨酸(Gly)、脯氨酸(Pro)和Hyp含量较高,其中,Gly几乎占了1/3,Pro含量约占9.6%~10.6%,Hyp含量约占3.4%~5.5%,为典型的胶原蛋白的氨基酸组成模式。胶原蛋白的氨基酸序列通常被描述为-(Gly-X-Y)n-,其中X通常为Pro或Hyp[9]。这一重复序列与GRAHAM等[16]从雪蚤中提取的AFP的重复序列-Gly-X-X-非常相似。
表3 不同分子质量胶原抗冻肽的氨基酸组成 单位:个/1 000个残基
Table 3 Amino acid composition of collagen antifreeze peptides with different molecular weights
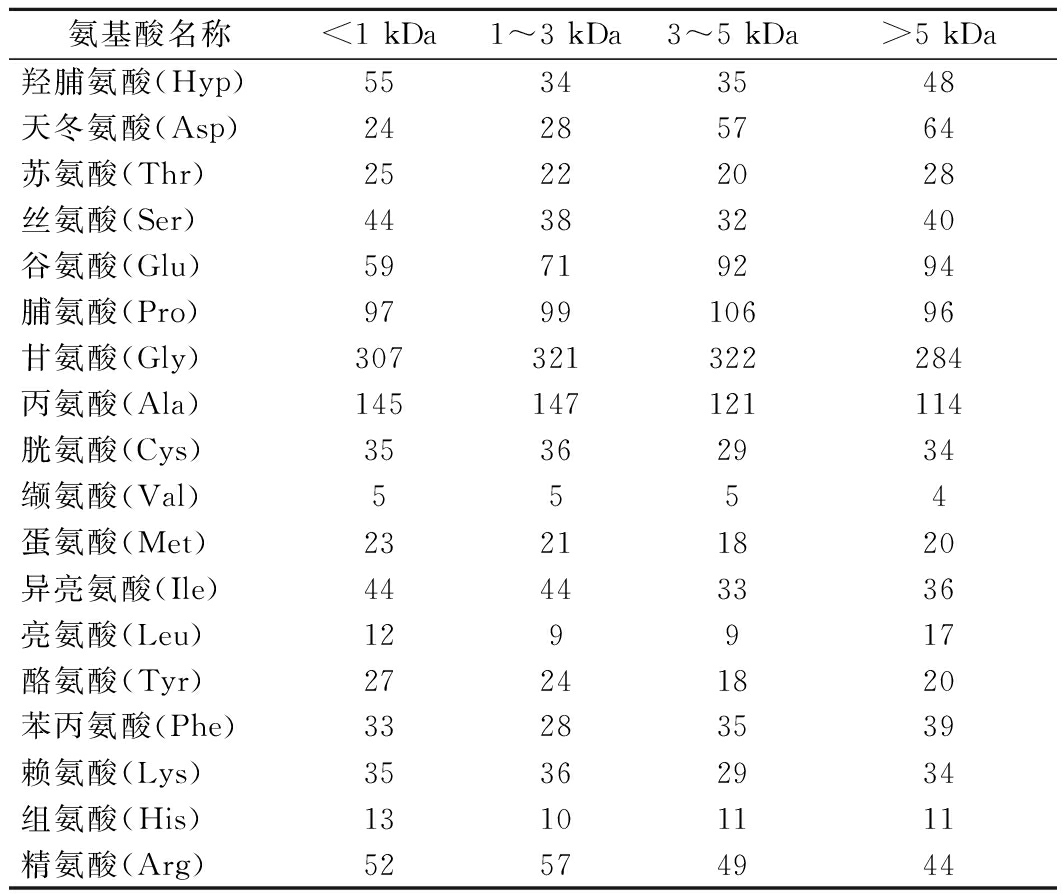
氨基酸名称<1 kDa1~3 kDa3~5 kDa>5 kDa羟脯氨酸(Hyp)55343548天冬氨酸(Asp)24285764苏氨酸(Thr)25222028丝氨酸(Ser)44383240谷氨酸(Glu)59719294脯氨酸(Pro)979910696甘氨酸(Gly)307321322284丙氨酸(Ala)145147121114胱氨酸(Cys)35362934缬氨酸(Val)5554蛋氨酸(Met)23211820异亮氨酸(Ile)44443336亮氨酸(Leu)129917酪氨酸(Tyr)27241820苯丙氨酸(Phe)33283539赖氨酸(Lys)35362934组氨酸(His)13101111精氨酸(Arg)52574944
在4种不同分子质量的胶原肽中,<1 kDa和>5 kDa胶原肽的Hyp含量显著高于其他分子质量的胶原多肽,分别达到5.5%和4.8%。已有研究发现,Hyp具有亲水性,可通过羟基与冰晶棱面结合,从而抑制冰晶的生长,因而其对冰晶的重结晶抑制效应有显著影响[17]。4种不同分子质量胶原肽中高含量的脯氨酸残基的烷基侧链可提供非极性环境从而起到稳定氢键的作用[7]。
2.4 不同分子质量胶原抗冻肽的热滞活性
以无抗冻活性的BSA为对照,采用差示扫描量热法测定了不同分子质量胶原抗冻肽的热滞活性,结果如图3所示。
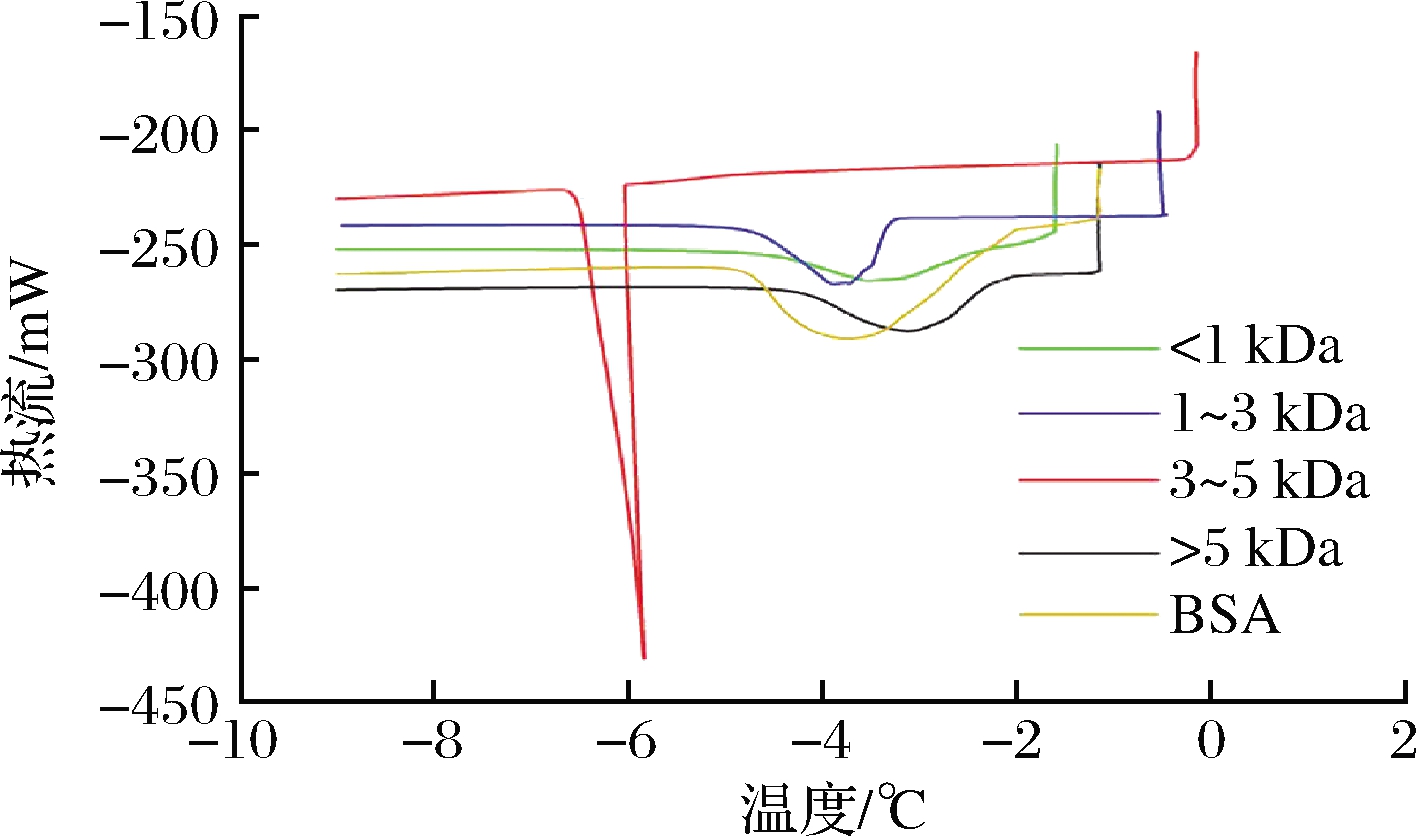
图3 不同分子质量胶原抗冻肽的热滞活性
Fig.3 Thermal hysteresis activity of collagen antifreeze peptides with different molecular weights
相比较于无抗冻活性的BSA,1~3 kDa和3~5 kDa胶原抗冻肽的结晶峰出现明显延迟,热滞活性值分别达到2.66和5.77 ℃。<1 kDa和>5 kDa的胶原抗冻肽表现出轻微的热滞活性,分别为0.05 和0.92 ℃。热滞活性较高的1~3 kDa和3~5 kDa胶原抗冻肽的氨基酸组成中Hyp具有较低的比例,这与之前文献报道的结果一致[18]。AFPs可分为“中等活跃”AFPs和“超级活跃”AFPs,“中等活跃”的AFPs可以使冰点降低不超过1 ℃,与冰晶的相互作用仅限于特定的非基底面;而“超级活跃”的AFPs可以结合多个冰晶面,甚至可使冰点下降3~6 ℃[19]。所以<1 kDa、>5 kDa的胶原抗冻肽可被归类为中等活跃AFPs,1~3 kDa、3~5 kDa的胶原抗冻肽可被归类为超级活跃AFPs。
2.5 不同分子质量胶原抗冻肽的重结晶抑制作用
以40%的蔗糖溶液为空白对照,利用低温显微镜观察了不同分子质量抗冻肽的重结晶抑制作用,冰晶在-50 ℃和-6 ℃保持40 min的状态如图4所示。

a~e-40%蔗糖;f~j-<1 kDa的多肽;k~o-1~3 kDa的多肽;p~t-3~5 kDa的多肽;u~y->5 kDa的多肽
图4 不同分子质量胶原抗冻肽的重结晶抑制活性
Fig.4 Recrystallization inhibition activity of collagen antifreeze peptides with different molecular weights
在样品溶液从室温降温至-50 ℃的过程中,样品由液体状态转变成由多个单冰晶紧密结合组成的固体状态,此时显微形貌变暗(图4-a)。随着样品温度从-50 ℃缓慢增加至-6 ℃,部分冰晶融化形成弥散状态(图4-b)。继续在-6 ℃保持40 min后,冰晶发生了重结晶现象,主要有融化与消失收缩、保持相对圆形均匀生长和多个小冰晶合并成较大的冰粒[20-22]等3种不同的形式。胶原抗冻肽的添加显著抑制了冰晶的重结晶,不同样品抑制重结晶的程度也出现了显著的差异。在40%的蔗糖溶液中形成的典型圆形冰晶,随着在-6 ℃保温时间的延长,仍呈圆形均匀生长,但冰晶颗粒的平均尺寸显著高于添加胶原抗冻肽的冰晶;添加<1 kDa和>5 kDa 胶原抗冻肽的样品在-6 ℃保温40 min后,其冰晶数量及尺寸没有发生显著变化,冰晶形状多呈有棱角状和拉长型;而添加1~3 kDa和3~5 kDa胶原抗冻肽样品中的冰晶在-6 ℃保温40 min后,部分冰晶融化和消失导致冰晶数量减少,冰晶形状包括圆形、有棱角型、拉长型,其中圆形占有较大比例。可见,<1 kDa和>5 kDa的胶原抗冻肽表现出了更好的重结晶抑制活性,这可能与<1 kDa和>5 kDa的胶原抗冻肽具有较高含量的Hyp有关。1~3 kDa和3~5 kDa的胶原抗冻肽虽具有较高的热滞活性,但抑制重结晶活性的效果并不佳,表明热滞活性与重结晶抑制活性并不呈正相关,这与YU等[23]的研究结果一致。
胶原抗冻肽结合于冰晶表面的特定区域进而抑制了这些方向晶体的生长,这可以作为解释冰晶形态发生变化的原因。胶原抗冻肽抑制冰晶重结晶的机理则可以通过“石头压海绵”模型来进行解释。如图5所示,白色圆圈代表AFPs,大面积的黑色部分代表冰晶,黑色小点代表游离的水。在冰晶重结晶过程中,AFPs附着在冰晶表面,好像“石头”压在“海绵”上,从而阻碍了冰晶平滑曲面的生长,游离的水只能冻结/附着在AFPs附着点之间的冰晶上,冰晶在AFPs附着点之间的位置凸起生长,使冰晶表面弯曲造成局部表面的曲率变大,进而通过Gibbs-Thompson效应或Kelvin效应降低冰晶的局部冰点,晶体停止生长[24-25]。
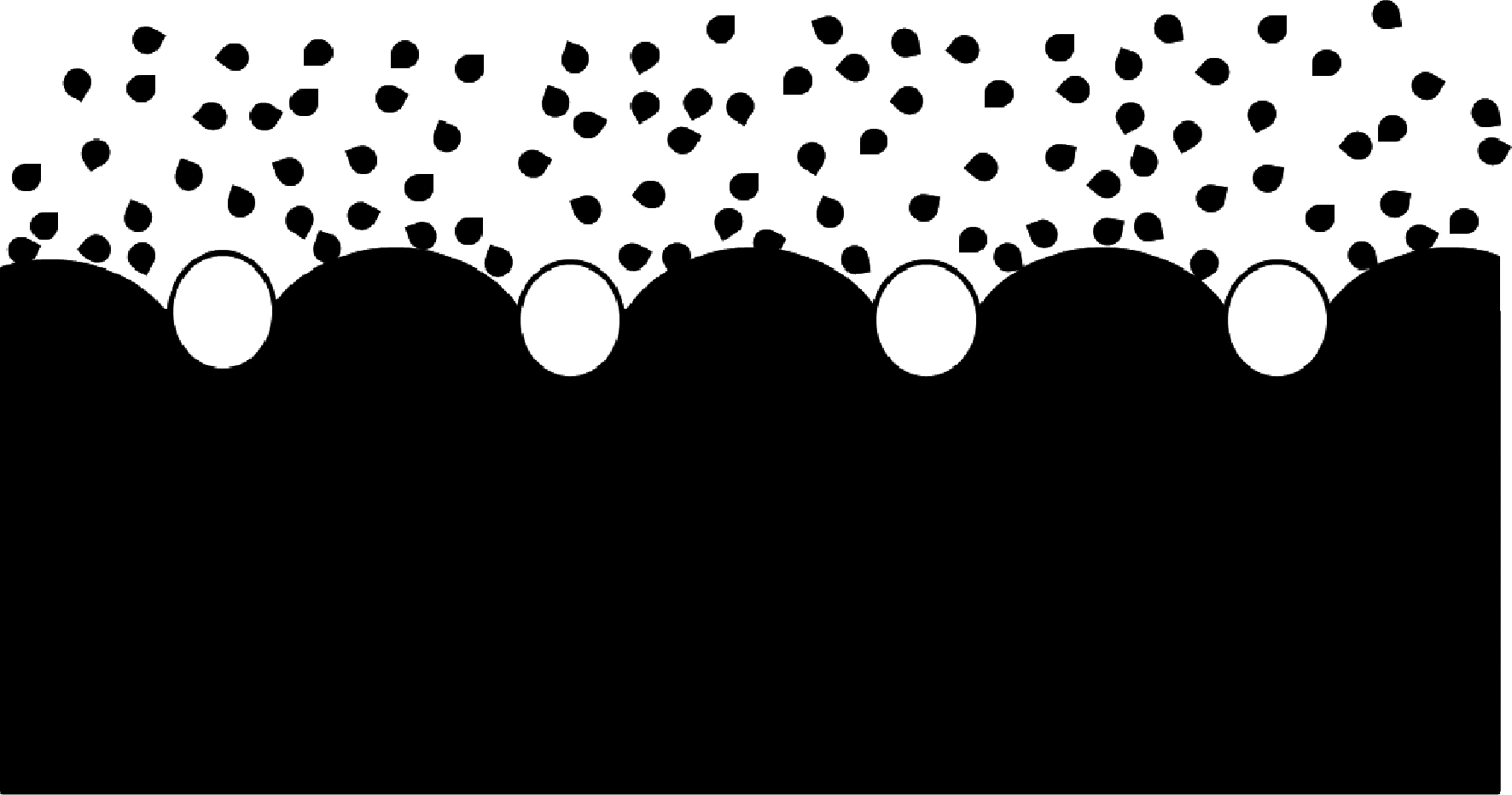
图5 AFPs抑制重结晶机理图
Fig.5 Mechanism of AFPs inhibiting recrystallization
2.6 不同分子质量胶原抗冻肽对单冰晶生长形态的修饰效应
以40%的蔗糖溶液为空白对照,利用低温显微镜观察了不同分子质量胶原抗冻肽修饰单冰晶生长的作用,结果如图6所示。

a~d-40%蔗糖;e~h-<1 kDa的多肽;i~l-1~3 kDa的多肽;
m~p-3~5 kDa的多肽;q~t->5 kDa的多肽
图6 不同分子质量胶原抗冻肽对单冰晶生长形态的修饰作用
Fig.6 Effects of collagen antifreeze peptides with different molecular weights on growth morphology of single ice crystals
由图6可见,随着样品温度的缓慢降低,40%蔗糖溶液中的冰晶始终保持圆形的形态,冰晶面积迅速生长扩大(图6-a~图6-d);而添加了胶原抗冻肽的样品中(图6-e~图6-t),冰晶最初以六角型生长,在经过冰点时,冰晶在6个方向上迅速生长“爆裂”,其中<1 kDa和>5 kDa胶原抗冻肽导致冰晶呈六角星型扩张,而1~3 kDa和3~5 kDa胶原抗冻肽导致冰晶呈树突状扩张[26]。添加不同分子质量胶原抗冻肽的冰晶在经过冰点温度时出现的形状差异是其热滞活性的显著差别导致的。<1 kDa和>5 kDa的胶原抗冻肽为中等活跃的AFPs,会导致冰晶沿平行于c轴的方向爆发,而1~3 kDa和3~5 kDa的胶原抗冻肽为高度活跃的AFPs,会导致冰晶垂直于c轴爆发。在昆虫[12]和细菌[27]的AFPs中可以观察到类似的冰晶生长模式。
采用IMAGE-PRO PLUS软件计算了不同分子质量胶原抗冻肽溶液中单个冰晶在缓慢降温时的生长面积值(μm2)与时间(s)的关系,它们的斜率表示冰晶的生长速率。由图7可见,40%蔗糖、<1 kDa、1~3 kDa、3~5 kDa和>5 kDa胶原抗冻肽溶液中的冰晶面积随着时间生长的斜率值分别为395.36、185.82、266.42、149.50和180.60 μm2/s。很显然,3~5 kDa胶原抗冻肽溶液中冰晶生长的斜率值最低,表明添加3~5 kDa的胶原抗冻肽能够显著延缓冰晶的生长。这可能是由于3~5 kDa胶原抗冻肽具有最高的热滞活性,其与冰晶的多个平面,包括基底面都具有较强的亲和力,从而能够更均匀地与整个冰面结合,进而抑制冰晶的生长。
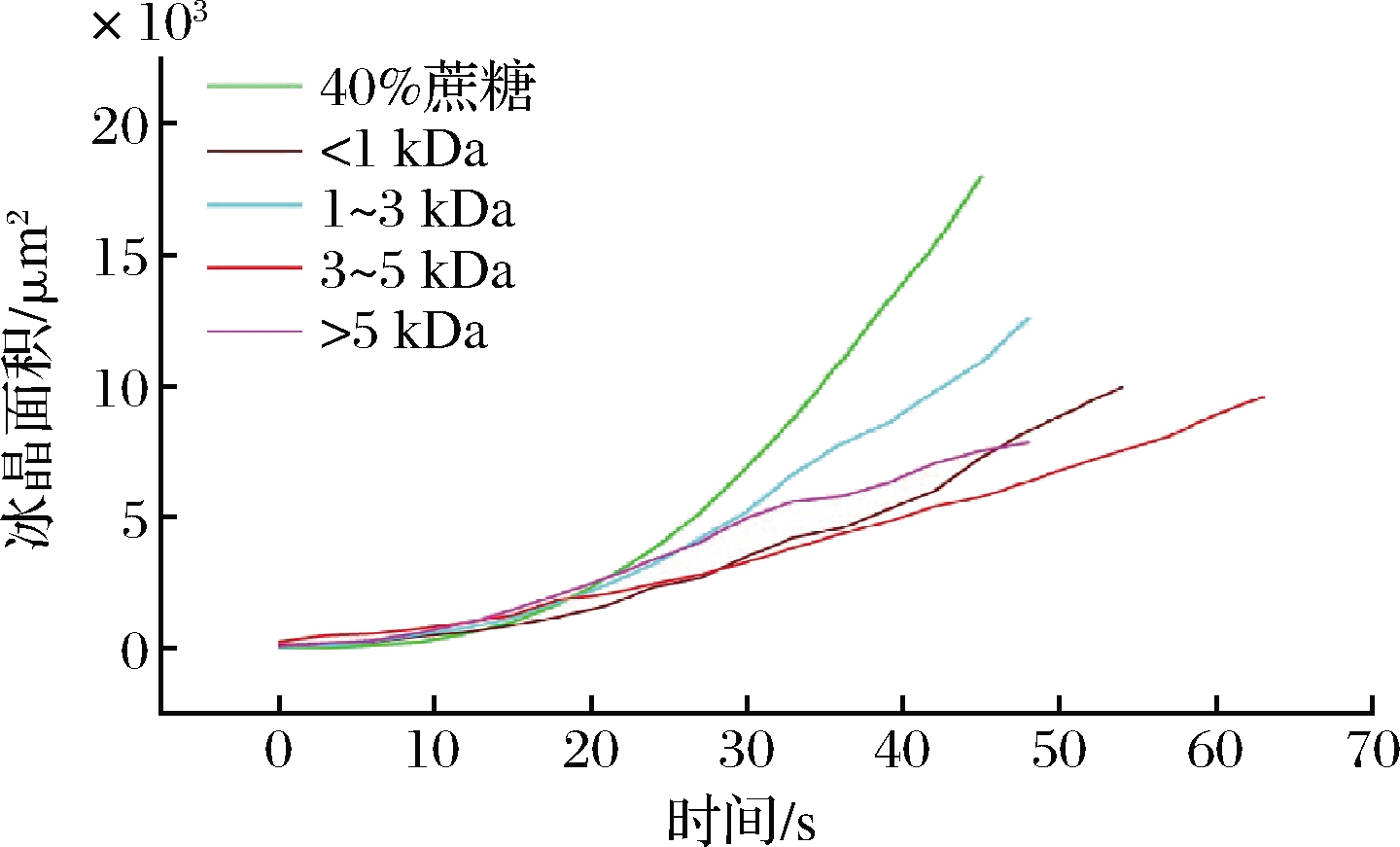
图7 不同分子质量胶原抗冻肽对单个冰晶生长速率的影响
Fig.7 Effect of antifreeze peptides with different molecular weights on growth rate of individual ice crystals
胶原抗冻肽的-Gly-X-Y-重复序列中存在分子质量较小的氨基酸残基,由于没有构象/空间约束,这些氨基酸残基中的羰基氧原子可与冰核中的氧-氧键在同一个肽平面上排列。冰核中2个氧原子之间距离为4.52 Å,与三肽重复序列中氧原子距离4.538 Å十分接近,因此肽链中形成的氧平面可通过氢键相互作用与冰晶表面形成互补的结构,使胶原抗冻肽吸附在冰晶表面[28-29]。冰面在胶原抗冻肽吸附点之间的位置生长,造成表面曲率增加进而引起平衡蒸气压的移动,导致冰晶局部冻结温度非平衡性下降。当表面达到一个特征曲率时冰晶停止生长,此时冰与水之间的蒸汽压处于平衡状态,不发生额外的结晶。继续降低温度使特征曲率增加,当温度到达滞回冰点时,曲率达到了最大凸度,进一步冷却导致冰晶体的“爆发”,即以一种看上去爆炸性的方式生长。
3 结论
本文主要研究了<1 kDa、1~3 kDa、3~5 kDa和>5 kDa等4种不同分子质量胶原抗冻肽的热滞活性、重结晶抑制能力及修饰单冰晶生长的能力。结果表明,不同分子质量胶原抗冻肽均具有调节冰晶生长和热滞的能力。其中3~5 kDa的胶原抗冻肽热滞活性最高,表明其可以显著降低结冰点,能够在低温度下保护样品的生理功能。<1 kDa和>5 kDa的胶原抗冻肽重结晶抑制活性最好,表明其可保护样品组分不受大冰晶的侵害。4种不同分子质量的胶原抗冻肽均具有修饰冰晶生长形态的效应,其中3~5 kDa的胶原抗冻肽具有最强地抑制单冰晶生长的能力。综上可见,胶原抗冻肽的分子质量分布对其冰结构活性至关重要,因而在实际应用过程中,可以通过调整酶解参数控制胶原抗冻肽的分子质量,使之满足于不同的需求。
[1] DEVRIES A L,WOHLSCHLAG D E.Freezing resistance in some antarctic fishes[J].Science,1969,163(3 871):1 073-1 075.
[2] KNIGHT C A,DUMAN J G.Inhibition of recrystallization of ice by insect thermal hysteresis proteins:A possible cryoprotective role[J].Cryobiology,1986,23(3):256-262.
[3] 汪少芸, 李晓坤,周焱富,等.抗冻蛋白的作用机制及基因工程研究进展[J].北京工商大学学报(自然科学版),2012,30(2):58-63.
WANG S Y,LI X K,ZHOU Y F,et al.The mechanism of antifreeze protein and the research progress of genetic engineering[J].Journal of Beijing Technology and Business University(Natural Science Edition),2012,30(2):58-63.
[4] KNIGHT C A.Adding to the antifreeze agenda[J].Nature,2000,406:249-251.
[5] MIZUNO A,MITSUIKI M,TOBA S,et al.Antifreeze activities of various food components[J].Journal of Agricultural and Food Chemistry,1997,45(1):14-18.
[6] 胡小颖,沈继红.抗冻蛋白的特性、来源及其应用研究进展[J].海洋科学,2008,32(3):77-82.
HU X Y,SHEN J H.Advances in study of properties,resources and potential uses of antifreeze proteins[J].Marine Sciences,2008,32(3):77-82.
[7] 阮功成,曹慧,徐斐,等.胶原酶解复合物的制备及其抗冻活性[J].食品与发酵工业,2015,41(2):7-12.
NGUYEN C T,CAO H,XU F,et al.Enzymatic preparation and biological antifreeze activity of pigskin collagen hydrolysates[J].Food and Fermentation Industries,2015,41(2):7-12.
[8] BAR DOLEV M,BERNHEIM R,GUO S,et al.Putting life on ice:Bacteria that bind to frozen water[J].Journal of The Royal Society Interface,2016,13(121):20160210.
[9] DAMODARAN S,WANG S Y.Ice crystal growth inhibition by peptides from fish gelatin hydrolysate[J].Food Hydrocolloids,2017,70:46-56.
[10] WANG S Y,DAMODARAN S.Ice-structuring peptides derived from bovine collagen[J].Journal of Agricultural & Food Chemistry,2009,57(12):5 501-5 509.
[11] WOESSNER J F.The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid[J].Archives of Biochemistry and Biophysics,1961,93(2):440-447.
[12] SONG D H,KIM M,JIN E S,et al.Cryoprotective effect of an antifreeze protein purified from Tenebrio molitor larvae on vegetables[J].Food Hydrocolloids,2019,94:585-591.
[13] 朱玉兵,曹慧,徐斐,等.应用差示扫描量热法测定胶原蛋白热滞活性[J].食品与发酵工业,2013,39(10):63-68.
ZHU Y B,CAO H,XU F,et al.Differential scanning calorimetry studies on the thermal hysteresis activity of collagen[J].Food and Fermentation Industries,2013,39(10):63-68
[14] 丁琳.鹅皮胶原蛋白的提取及功能性研究[D].宁波: 宁波大学,2014.
DING L.Extraction of collagen of goose skin and studies on the character of its biologically active peptide[D].Ningbo: Ningbo University,2014.
[15] 廖伟,夏光华,王佳媚,等.金鲳鱼鱼皮酶溶性胶原蛋白的提取工艺优化及基本特性[J].食品工业科技,2017,38(19):142-147.
LIAO W,XIA G H,WANG J M,et al.Optimization of extraction process and basic properties for pepsin-soluble collagen from Golden pompano skin[J].Science and Technology of Food Industry,2017,38(19):142-147.
[16] GRAHAM L A,DAVIES P L.Glycine-rich antifreeze proteins from snow fleas[J].Science,2005,310(5747):461.
[17] CORCILIUS L,SANTHAKUMAR G,STONE R S,et al.Synthesis of peptides and glycopeptides with polyproline II helical topology as potential antifreeze molecules[J].Bioorganic & Medicinal Chemistry,2013,21(12):3 569-3 581.
[18] 朱玉兵.胶原抗冻肽的制备及其功能特性研究[D].上海:上海理工大学,2013.
ZHU Y B.Preparation and functional properties of collagen antifreeze peptide[D].Shanghai:University of Shanghai for Science and Technology,2013.
[19] BAYER-GIRALDI M,WEIKUSAT I,BESIR H,et al.Characterization of an antifreeze protein from the polar diatom Fragilariopsis cylindrus and its relevance in sea ice[J].Cryobiology,2011,63(3):210-219.
[20] REID D S.The properties of water in foods ISOPOW 6[M].Boston: Springer US,1998.
[21] HARTEL R W.Crystallization in foods[M].Gaithersburg:Aspen publisher,2001.
[22] VOETS I K.From ice-binding proteins to bio-inspired antifreeze materials[J].Soft Matter,2017,13(28):4 808-4 823.
[23] YU S O,BROWN A,MIDDLETON A J,et al.Ice restructuring inhibition activities in antifreeze proteins with distinct differences in thermal hysteresis[J].Cryobiology,2010,61(3):327-334.
[24] SANDER L M,TKACHENKO A V.Kinetic pinning and biological antifreezes[J].Physical Review Letters,2004,93(12):128 102.
[25] RAYMOND J A,DEVRIES A L.Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J].Proceedings of the National Academy of Sciences,1977,74(6):2 589-2 593.
[26] SCOTTER A J,MARSHALL C B,GRAHAM L A,et al.The basis for hyperactivity of antifreeze proteins[J].Cryobiology,2006,53(2):229-239.
[27] CELIK Y,GRAHAM L A,MOK Y F,et al.Superheating of ice crystals in antifreeze protein solutions[J].Proceedings of the National Academy of Sciences,2010,107(12):5 423-5 428.
[28] DAMODARAN S.Inhibition of ice crystal growth in ice cream mix by gelatin hydrolysate[J].Journal of Agricultural and Food Chemistry,2007,55(26):10 918-10 923.
[29] LI Q,LUO L.A study of the growth rates and growth habits of ice crystals in a solution of antifreeze(glyco) proteins[J].Chemical Physics Letters,1996,263(5):651-654.