南美白对虾(Litopenaeus vannamei)富含蛋白质、纤维素、矿物质元素、维生素和多种对人体有益的氨基酸,肉质鲜美,营养价值高,深受广大消费者喜爱[1-2]。去壳虾仁是虾加工的主要产品,但外壳通过表皮内纤维紧密地附着在表皮上,同时表皮内纤维通过微管相互交叉牢固地连接在肌肉上[3],使得鲜虾壳难以剥离。因此,剥壳前需进行预处理使壳肉间的紧密连接松动。常用的壳肉松动方法是速冻后进行解冻再剥壳或采用超高压技术,但都易造成虾仁品质劣变,限制了其产业化应用[4]。
近年来,常用酶解虾壳或虾头来回收蛋白质,或得到富含多肽的酶解产物[5-7]。罗春燕等[8]通过响应面法优化了鱿鱼须胰酶脱皮的工艺参数,得到的样品白度值较好,原料保留率高,且质构特性与肌纤维组织均无显著变化;DANG等[10]报道了Endocut-03L和Exocut-A0复合蛋白酶促进冻虾(Pandalus borealis)剥壳的效果,虾壳和表皮的大分子蛋白质降解破坏壳肉连接,是酶法便捷剥壳的主要原因[11]。但关于酶法预处理促进鲜虾便捷剥壳的研究及其对虾肉品质的影响则鲜有报道。本研究以鲜活南美白对虾为原料,基于质构仪以剥壳单位功为响应值,优化酶促剥壳的工艺参数;并探讨酶法前处理对虾仁品质的影响,为机械剥壳的产业应用提供技术支持。
1 材料与方法
1.1 材料与试剂
鲜活南美白对虾,于2019年8~10月购于广州超市,虾体规格长11~13 cm,20 min内运往实验室。固定液:4%(质量分数)多聚甲醛 0.1 mol/L 磷酸缓冲液(pH 7.3)、中性蛋白酶(≥200 U/mg)、碱性蛋白酶(≥200 U/mg)、风味蛋白酶(≥15 U/mg)和动物蛋白水解酶(≥90 U/mg),博美生物技术有限公司;中性蛋白酶活性测定试剂盒,北京索莱宝科技有限公司;NaCl为食品级,其他试剂均为分析纯。
1.2 主要仪器与设备
QTS-25质构仪,英国CNS FARNEL有限公司;IKA-T25组织匀浆机,德国IKA公司;CR-400色差计,日本KONICA MINOLTA公司;3K30台式高速冷冻离心机,德国Sigma公司;Sunrise-basic吸光酶标仪,德国 TECAN 公司;BX53显微镜,日本OLYMPUS。
1.3 实验方法
1.3.1 样品的处理
鲜虾洗净,加冰猝死,去除虾头、虾足,放入自封袋备用[9]。酶处理过程如下:以20 g/L的标准盐水溶液配制不同质量浓度的酶溶液,取酶液倒入烧杯中,放入12只虾(3节虾身),约(50±5)g,完全浸没。为保证酶液的均匀分布和虾肉品质,以280 r/min的速度搅拌,酶液的温度为(5±2) ℃,直至剥壳。取出样品,滤去多余的水分,称重并记录质量(m)。一批置于-20 ℃冰箱中冷冻24 h,流水解冻后剥壳。以冷冻24 h后脱壳的虾仁和新鲜虾仁为对照,对酶促剥壳的虾肉品质进行评价。
1.3.2 剥壳效果测定
参考YANG等[11]的方法,如图1所示用质构仪分析虾体剥壳效果。将顶部探针穿过虾体背部壳肉之间(图1-b),底部基座上的针插入虾身肌肉中间(图1-c),进行张力测试,同时将壳从虾体剥离(图1-d),测定条件:测试速度 2.5 mm/s;目标距离 60 mm;触发力5.0 g。剥壳后,分为完全剥壳的虾(虾壳完全剥掉)和未完全剥壳的虾(虾壳没有剥掉或有部分破碎虾壳粘连在肉上),只有完全剥壳的虾用于计算虾的剥壳用功,记为剥壳单位功(mJ/g,下同)。

图1 剥壳方法及过程
Fig.1 The method and procession of shrimp peeling
1.3.3 蛋白酶的筛选
选取中性蛋白酶、碱性蛋白酶、风味蛋白酶和动物蛋白水解酶,为保证酶液的作用活性一致,酶添加量分别为0.500、0.500、6.667、1.111 g/500 mL,自然pH值,样品与酶液之比为1∶10(g∶mL),酶液的温度为(5±2) ℃,酶解时间2 h。对照处理采用20 g/L标准盐水浸泡。
1.3.4 单因素试验
在酶处理温度(5±2) ℃,自然pH下,分别研究不同质量浓度的酶液(0.25、0.5、0.75和1.00 mg/mL)、酶解时间(1、2、3、4和5 h)和料液比(1∶2、1∶4、1∶6、1∶8、1∶10和1∶12,g∶mL)对虾体剥壳单位功的影响。
1.3.5 响应面优化
根据单因素试验结果,选取酶解时间(A)、酶质量浓度(B)、料液比(C)为响应因素,以剥壳单位功(mJ/g)为响应值,实验因素及水平见表1。
表1 响应面实验的因素及水平
Table 1 Factors and levels of Box-Behnken
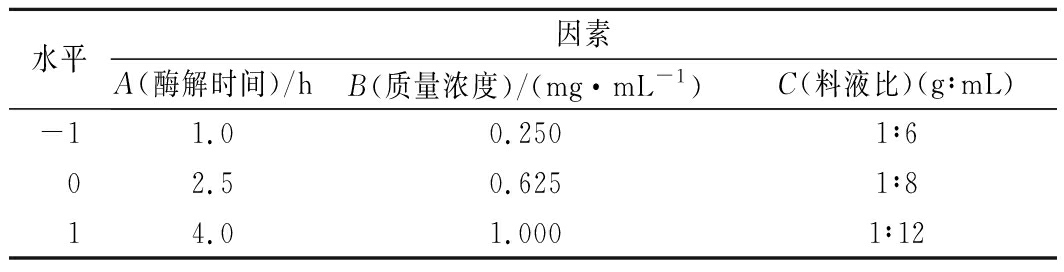
水平因素A(酶解时间)/hB(质量浓度)/(mg·mL-1)C(料液比)(g∶mL)-11.00.2501∶602.50.6251∶814.01.0001∶12
1.3.6 酶液的重复利用
为探究酶液的重复利用问题,每轮实验结束后,取出3节虾身,测定剥壳单位功,同时测定酶活性(初始和每轮处理后酶活性)和酶液的颜色。中性酶活性的测定采用中性酶活性检测试剂盒,每组测2次,结果用U/mL表示。
1.3.7 虾肉品质测定
pH值:参考GB 5009.237—2016《国家食品安全标准 食品中pH值的测定方法》。每组取5 g虾肉,加入45 mL蒸馏水,充分均质后,静置30 min过滤,取滤液测pH值,平行3次。
色泽的测定:根据XU等[12]的方法,测量虾仁第2节腹侧的L*、a*、b*值。每组6个平行,色差计事先用标准白板校正。
质构特性的测定:参考LI等[13]方法对虾仁第2腹节做质地多面分析(texture profile analysis,TPA)测试。将样品置于平台上,用直径为4 mm的TA44圆柱形探头进行两循环咀嚼试验,轴向压缩距离(应变):5 mm;触发力,5 g;恒速测试,1.0 mm/s;返回速度为1.0 mm/s。获取硬度(N)、弹性(mm)、咀嚼性和内聚性等TPA参数。每组样品8个平行。
肌肉组织微观结构:参考LIN等[14]的方法,取虾第1腹节肌肉切成0.5 cm×0.5 cm×0.5 cm的小块。4 ℃条件下固定24 h,梯度乙醇(30%、50%、70%、90%和100%)脱水,用二甲苯浸泡至透明后浸蜡,切片(横截面和纵截面)。将切片平贴于载玻片上,烘干后进行苏木精和伊红染色,光学显微镜下观察其肌肉组织微观结构并拍照。
1.4 数据分析
使用SPSS Statistics 22.0对数据进行统计分析,每组处理3次平行,结果为均值±标准差(SD)。以one-way ANOVA法及 Duncan 检验对实验数据进行组间比较和差异显著性分析,显著性水平定义为P<0.05。
2 结果与讨论
2.1 蛋白酶筛选结果
所用4种酶的适宜pH范围均在6.5~8.0之间[15-16],考虑到pH对虾肉品质的影响,选择自然pH,不同蛋白酶预处理后所需剥壳单位功如图2所示。加酶处理能促进虾剥壳,特别是中性蛋白酶,剥壳所用功为2.14 mJ/g,明显低于对照和其他3种蛋白酶处理组(P<0.05)。中性蛋白酶是自然pH条件下具有很强活力的内切酶,可催化壳、表皮及壳肉连接的蛋白质肽键水解且催化反应速度快,破坏壳-肉之间的连接[9]。结合经济成本,选用中性蛋白酶对酶处理辅助剥壳工艺进行优化。
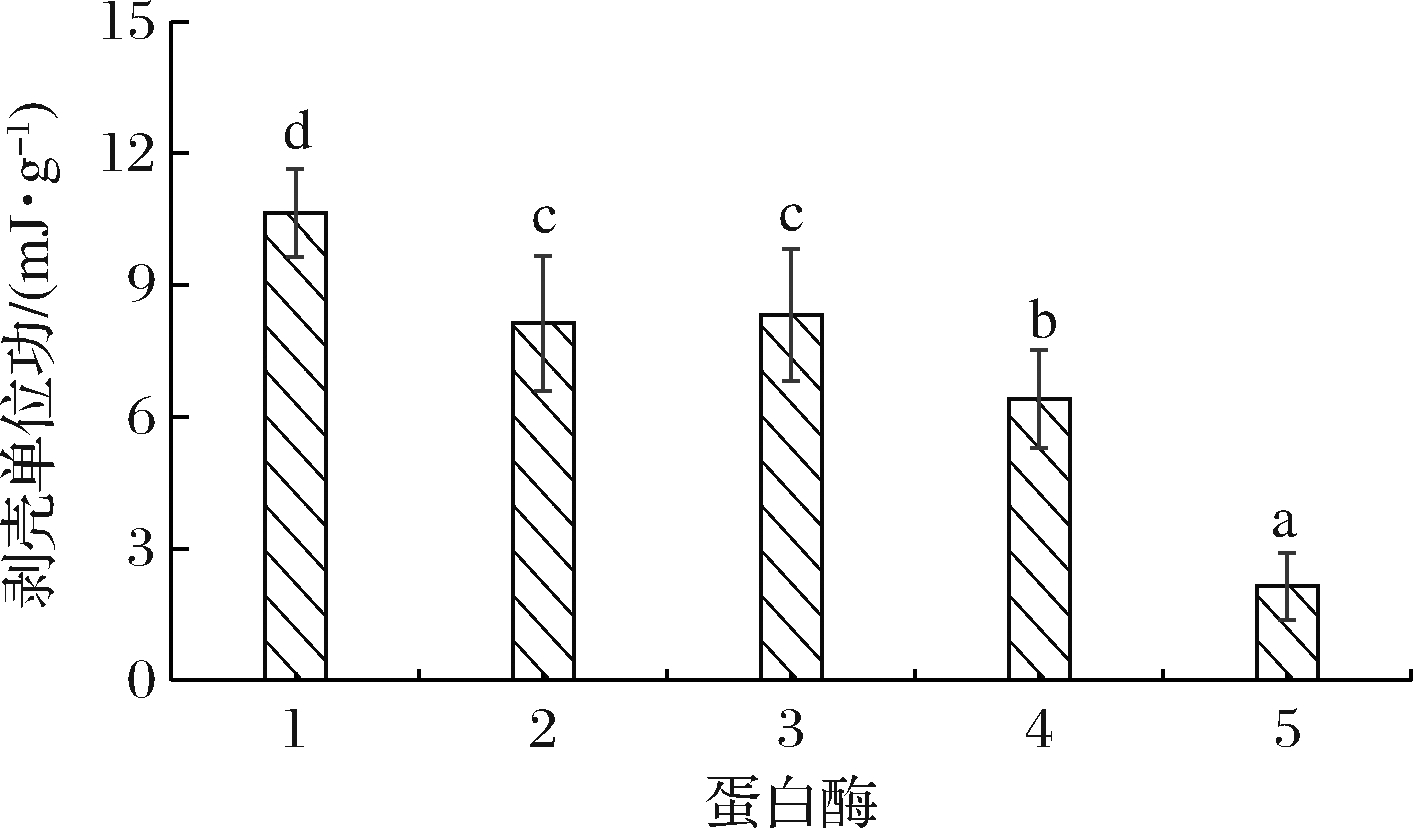
1-对照;2-风味蛋白酶;3-动物蛋白水解酶;4-碱性蛋白酶;5-中性蛋白酶
图2 不同蛋白酶对剥壳单位功的影响
Fig.2 Effect of different proteases on the peeling work
注:不同字母表示差异显著(P<0.05)(下同)
2.2 单因素试验结果
2.2.1 酶质量浓度对剥壳的影响
中性蛋白酶的质量浓度对虾体剥壳的影响如图3所示,质量浓度从0.25 mg/mL增加到1 mg/mL时,剥壳所需单位功由6.24 mJ/g降低至1.37 mJ/g。说明随着质量浓度的增加,单位体积内蛋白酶与虾壳、表皮及壳肉连接的蛋白质的接触机会增加,水解作用增强[17],壳肉之间的紧密连接发生松动,剥壳所需的功减小。当质量浓度超过0.5 mg/mL时,剥壳用功下降幅度减弱;质量浓度为1 mg/mL时,剥壳用功虽然减少(P<0.05),但实验中观察到虾壳变脆弱,虾壳是否完全剥掉,不仅依赖于壳肉连接的紧密性,而且与虾壳的性质相关[9],酶解过度会使虾壳的强度降低,剥壳时虾壳易破碎,部分虾壳仍留在虾肉上,影响剥壳的完整性。综合经济效益考虑,确定合适的酶质量浓度为0.5 mg/mL。
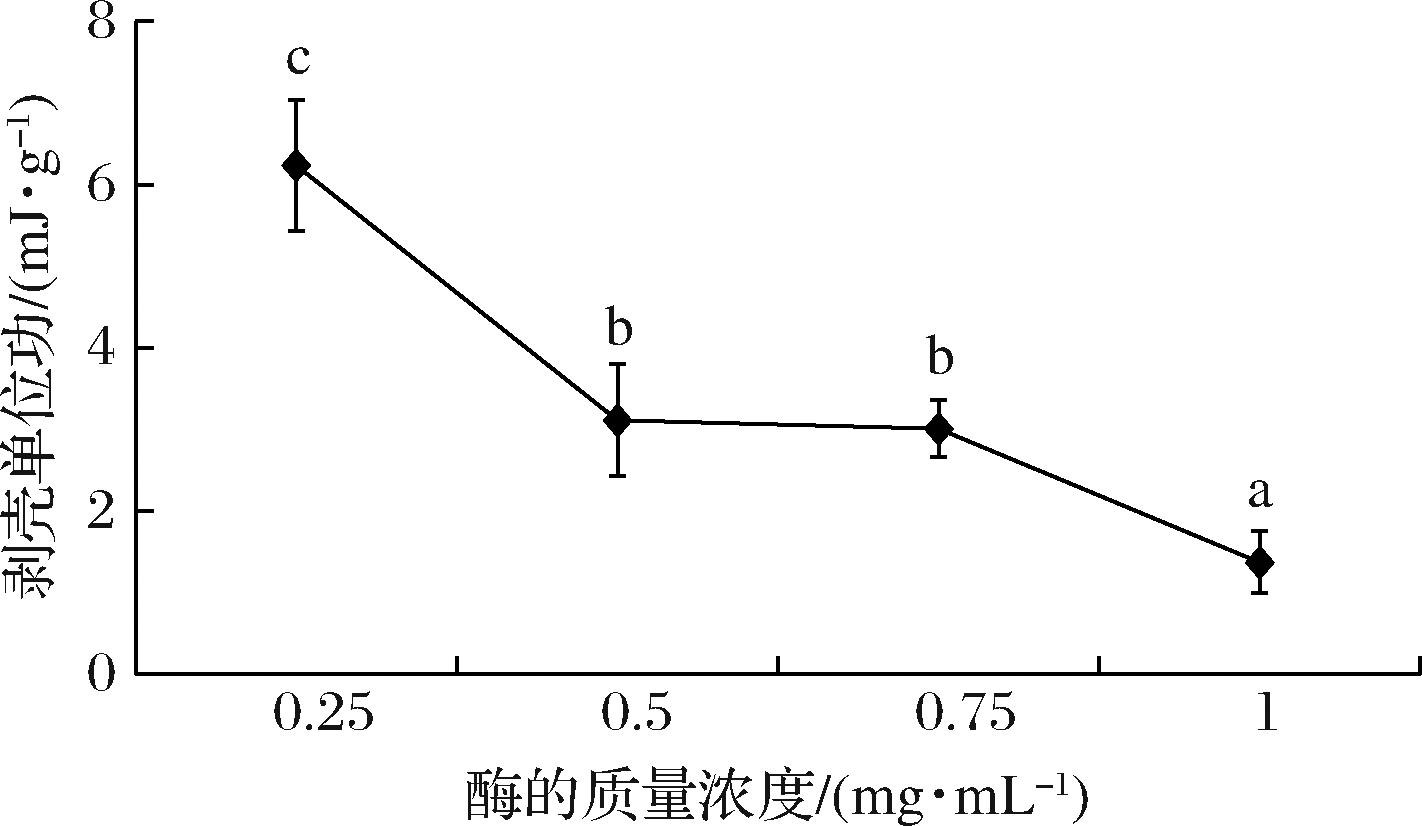
图3 酶的质量浓度对于剥壳单位功的影响
Fig.3 Effect of concentrations of protease on the peeling work
2.2.2 酶解时间对剥壳的影响
如图4所示,在2 h内,虾剥壳单位功显著减少(P<0.05),其剥壳单位功为4.21 mJ/g,随着时间的延长,剥壳所需单位功差异不显著(P>0.05)。初始酶液中的酶量相对较高,与底物的充分接触,使虾壳-肉间松动的增加幅度较大,随着反应的进行,酶被消耗,酶活力开始下降,剥壳单位功的减小趋于平缓(P>0.05),与酶解时间对秘鲁鱿鱼环齿的脱离的影响具有相似性[18],所以合适的酶解时间为2 h。
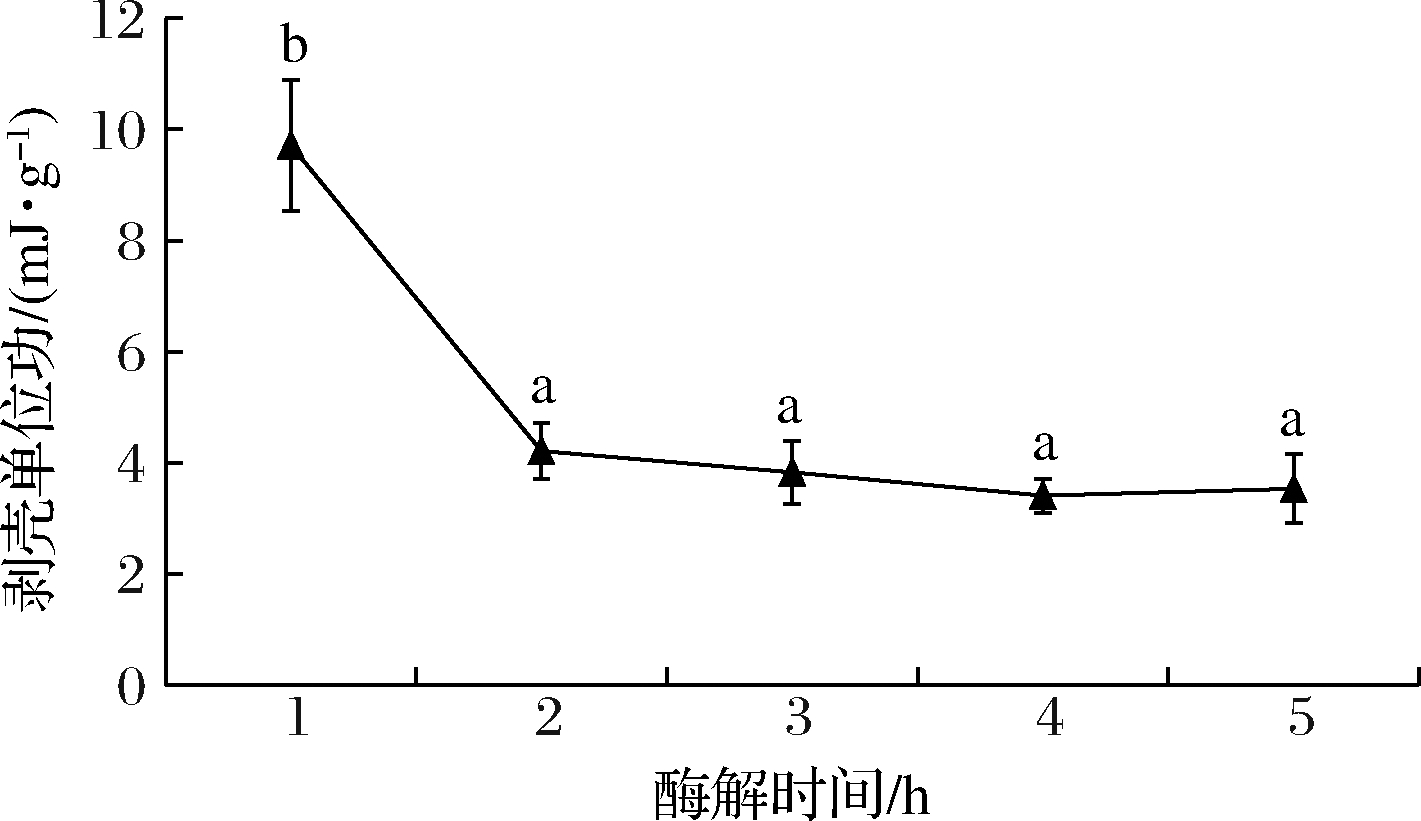
图4 酶解时间对于虾剥壳单位功的影响
Fig.4 Effect of enzymalysis time on the peeling work
2.2.3 料液比对剥壳的影响
在酶质量浓度为0.5 mg/mL,处理时间为2 h的条件下,不同的料液比下对虾剥壳影响如图5所示,料液比为1∶2和1∶4(g∶mL)时,酶解对虾壳-肉连接部分的作用有限,虾壳基本不能完整地被剥除。此后,随着料液比的减小,即酶液体积的增加,作用于样品底物的酶量增加,酶解作用接触位点增多,剥壳单位功减小,料液比超过1∶8时(g∶mL),剥壳用功差异不显著(P>0.05),因此确定料液比为1∶8(g∶mL)。
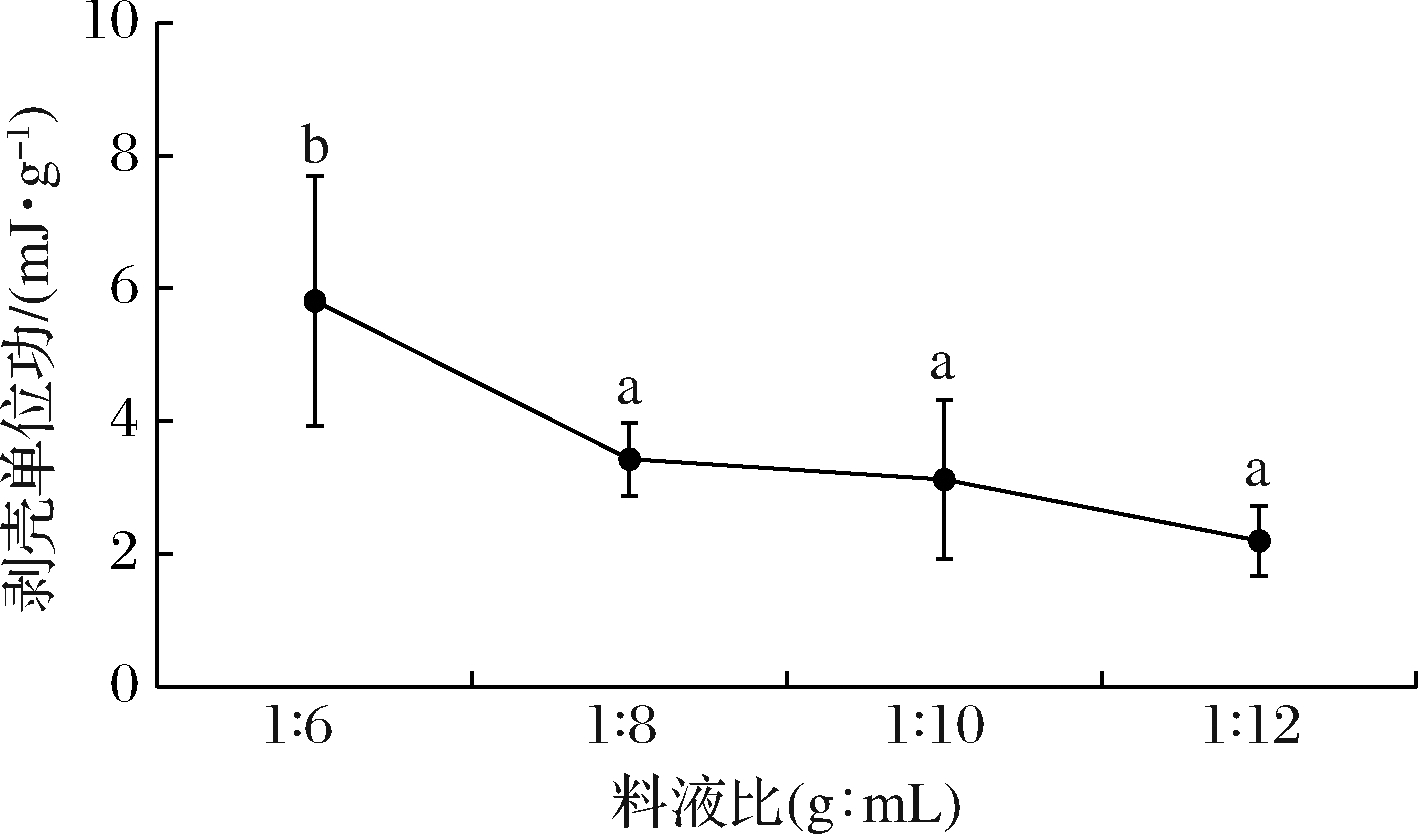
图5 料液比对虾剥壳单位功的影响
Fig.5 Effect of material-liquid ratio on the peeling work
2.3 响应面优化分析
2.3.1 实验设计及结果
在单因素试验的基础上,利用响应面法对酶解时间(A)、中性蛋白酶的质量浓度(B)、料液比(C)进一步优化,采用 Box-Behnken 原理,以剥壳单位功(Y)为响应值设计实验,根据 Design-Expert 10设计试验方案,结果见表2。
表2 Box-Behnken优化设计及结果
Table 2 Box-Behnken design and results

序号A(酶解时间)/hB(质量浓度)/(mg·mL-1)C(料液比)(g∶mL)(Y)(单位功)/(mJ·g-1)12.50.2501∶127.4222.51.0001∶124.5632.50.6251∶84.9442.50.6251∶84.7751.00.6251∶67.9864.00.2501∶82.8871.00.2501∶89.4182.50.2501∶68.4592.50.6251∶85.44102.50.6251∶84.79111.00.6251∶126.47121.01.0001∶85.88132.50.6251∶85.20142.51.0001∶65.74154.01.0001∶82.72164.00.6251∶121.15174.00.6251∶61.96
2.3.2 响应面模型的建立及方差分析
利用Design-Expert 10软件对表2中的结果进行多元回归拟合,建立了剥壳单位功与3个因素之间的回归方程:Y=5.03-2.63A-1.160B+0.57C+0.84AB-0.17AC+0.04BC-0.98A2+1.17B2+0.34C2。对所建的回归模型进行方差分析及显著性检验(表3),结果表明回归模型极显著(P<0.001),失拟项P=0.147 9>0.05不显著,说明以剥壳单位功为响应值建立的实验方法可靠且模型较稳定;相关系数R2=0.986 4,调整回归系数![]() 说明回归方程模型拟合度较好,模型建立合理。分析模型各个系数的P值,其中因素A、B、C、AB、A2、B2的P<0.01,对剥壳单位功的影响极显著;由表中的F值可看出,各因素对剥壳单位功的影响程度依次是:酶质量浓度(B)>酶解时间(A)>料液比(C)。
说明回归方程模型拟合度较好,模型建立合理。分析模型各个系数的P值,其中因素A、B、C、AB、A2、B2的P<0.01,对剥壳单位功的影响极显著;由表中的F值可看出,各因素对剥壳单位功的影响程度依次是:酶质量浓度(B)>酶解时间(A)>料液比(C)。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
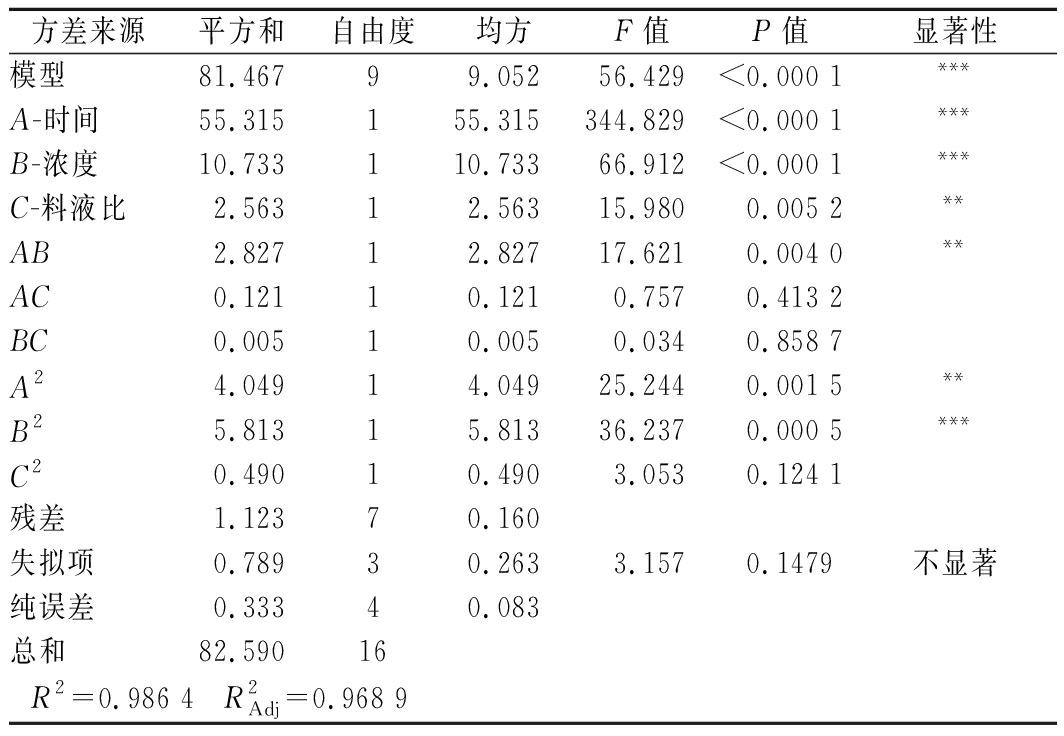
方差来源平方和自由度均方F值P值显著性模型81.46799.05256.429<0.000 1***A-时间55.315155.315344.829<0.000 1***B-浓度10.733110.73366.912<0.000 1***C-料液比2.56312.56315.9800.005 2**AB2.82712.82717.6210.004 0**AC0.12110.1210.7570.413 2BC0.00510.0050.0340.858 7A24.04914.04925.2440.001 5**B25.81315.81336.2370.000 5***C20.49010.4903.0530.124 1残差1.12370.160失拟项0.78930.2633.1570.1479不显著纯误差0.33340.083总和82.59016R2=0.986 4 R2Adj=0.968 9
注:***,P<0.001;**,P<0.01;*,P<0.05
2.3.3 响应曲面交互作用分析
由图6可知,酶解时间(A)和酶质量浓度(B)交互作用的响应面坡度较陡,说明因素间的交互作用对剥壳单位功影响显著,其等高线呈椭圆形,表示这2个因素间交互作用显著;酶解时间(A)和料液比(C)、酶质量浓度(B)和料液比(C)交互作用的响应面坡度较平缓,其等高线呈圆形,说明AC、BC因素间的交互作用剥壳单位功影响较弱,分析结果与表3具有一致性。

图6 各因素交互作用对剥壳单位功影响的响应面和等高线
Fig.6 Response surface and contour lines of interactions of various factors on the peeling work
2.3.4 模型的优化和验证
根据响应面优化实验的结果,结合实际生产中的操作和成本,确定的优化值为:处理时间3.5 h、酶质量浓度0.7 mg/mL、料液比1∶10(g∶mL),此时预测得到的剥壳单位功为2.61 mJ/g。为了验证模型预测的准确性,用此优化条件重复试验3次,实际得到的虾剥壳单位功为2.65 mJ/g,非常接近该二次回归模型的预测值(>0.05),充分验证了模型的准确性,因此,采用Design-Expert 10响应面分析法优化得到的酶促脱壳条件参数准确可靠。
2.4 酶液的循环利用
酶液循环使用对剥壳单位功的影响如图7所示。随使用次数的增加,酶液活性呈下降趋势,循环使用4次后,由初始的62.34 U/mL降为9.77 U/mL,而剥壳用功则由2.25 mJ/g增加为5.94 mJ/g,两者的变化具有一致性;循环使用4次均无壳破碎粘连在虾肉上,但循环使用3次后,酶液活性显著下降至24.62 U/mL(P<0.05),剥壳单位功明显增加。且随循环使用次数增加,酶液颜色变黑,建议此酶液循环使用3次。

图7 酶液循环使用轮数对酶活性和剥壳单位功的影响
Fig.7 Effect of reusing of enzyme solution on proteolytic activity and peeling work
2.5 不同预处理剥壳对虾仁品质的影响
2.5.1 pH值和色泽
虾体死后,体内糖原降解影响肌肉pH值,所以通常把pH值作为判断虾体新鲜度的指标,且在pH值达到7.7前认为虾肉质量良好[19]。鲜虾死后pH值为6.88,这与XU等[12]测定的虾初始pH值 6.92相似。与鲜虾相比,冷冻和酶解处理后的虾仁pH值分别为6.80和6.78,差异不显著(P>0.05),说明酶解剥壳对虾肉鲜度影响不明显,且得到的虾肉质量良好。色泽是影响消费者购买的主要因素[20]。冷冻和酶法剥壳处理可增加虾仁L*,说明冷冻和酶处理均能增加虾仁的亮度,这是由于冷冻-解冻过程中,肌肉组织细胞内形成的冰晶融化、水分溢出引起的光吸收和光散射的变化[21];部分虾仁表皮可能被酶解,同样残留在表面的酶液也增加了光的反射作用。酶法处理对a*和b*影响与鲜虾无异,冷冻后的虾仁表面b*值为-2.61,与对照相比显著增加(P<0.05)。综合来看,酶处理对色泽的影响较小,可能是因为其处理时间相对较短且虾体无冻结,能保留产品原有的色泽。
表4 剥壳预处理对虾pH值和色泽的影响
Table 4 Effect of pretreatment on the pH and color of shrimps
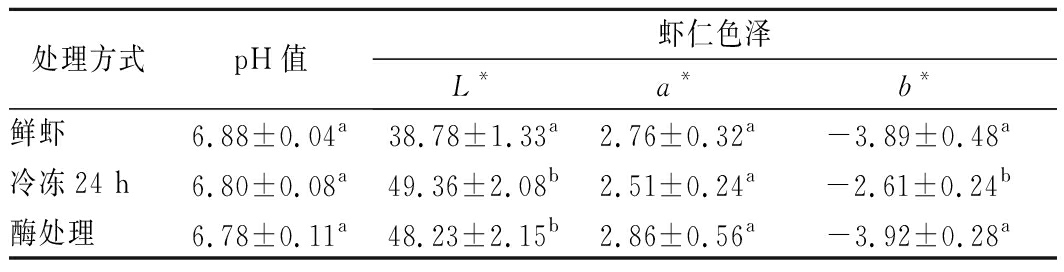
处理方式pH值虾仁色泽L*a*b*鲜虾6.88±0.04a38.78±1.33a2.76±0.32a-3.89±0.48a冷冻24 h6.80±0.08a49.36±2.08b2.51±0.24a-2.61±0.24b酶处理6.78±0.11a48.23±2.15b2.86±0.56a-3.92±0.28a
2.5.2 对虾仁质构的影响
质构特性极大地影响了消费者的可接受性,因此在产品的加工中起重要作用[22]。冷冻和酶处理剥壳后虾仁的质构参数如表5所示,虾仁的硬度、弹性、内聚性咀嚼性均有不同程度的变化。与鲜虾相比,冷冻24 h后,虾仁的硬度和咀嚼性显著下降,弹性和内聚性无明显变化,可能是冷冻后解冻,大冰晶的形成及融化造成虾肉纤维组织结构被破坏[23],且由冷冻引起的肌原纤维蛋白的降解或结缔组织的变化使持水性下降,虾肉变软[24-25];而酶处理的虾仁硬度只略微降低(P>0.05),这表明蛋白酶没有过度水解虾肉的肌原纤维和胶原蛋白,因为肌原纤维和胶原蛋白水解很大程度上会导致肌肉质地软化[26];弹性、内聚性、咀嚼性均显著低于鲜虾,咀嚼性和冷冻24 h相差不明显,咀嚼性是硬度、黏性、弹性结合起来的综合性质,猜测是在处理过程中2%的钠盐的作用,能够轻微降低肌肉的硬度并较大程度地降低咀嚼性[27]。
表5 剥壳预处理对虾仁质构的影响
Table 5 Effect of pretreatments on the texture of shrimps
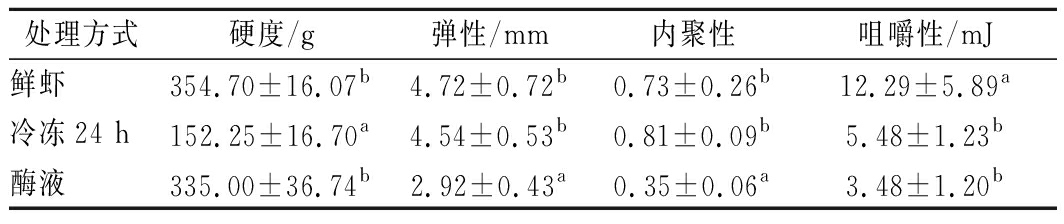
处理方式硬度/g弹性/mm内聚性咀嚼性/mJ鲜虾354.70±16.07b4.72±0.72b0.73±0.26b12.29±5.89a冷冻24 h152.25±16.70a4.54±0.53b0.81±0.09b5.48±1.23b酶液335.00±36.74b2.92±0.43a0.35±0.06a3.48±1.20b
2.5.3 对肌肉组织微观结构的影响
肌肉的微观结构是对虾肌肉品质变化的微观表现,能直接反映肌肉组织细胞结构的完整性[28]。新鲜虾仁的肌肉组织排列整齐彼此紧密相连,肌内膜表面光滑,呈典型的多边型;肌束呈纵向排列,肌纤维排列致密,肌节丰满,肌纤维束呈狭长柱状(图8-a1,图8-a2)。冷冻24 h后剥壳的虾仁,肌肉纤维之间的细胞外空间明显增加,肌纤维的横截面呈不同的碎裂形状,肌内膜和肌束膜破裂;此外,一些肌肉纤维不连贯,甚至出现断裂,肌节受到机械损伤明显(图8-b1,图8-b2),这表明由于冷冻形成的冰晶大分子对肌肉组织结构的损伤较大。酶处理后的虾仁,虽然肌肉细胞间的缝隙增大,但变化程度小于冷冻组;肌肉纵切面,肌纤维空隙略有增大,但并无出现大量断裂现象,细胞维持着较好的完整性(图8-c1,图8-c2)。综合来说,冷冻处理后剥壳对虾仁肌肉结构破坏较为明显,酶处理后剥壳则相对较为轻微。

a1-鲜虾横切片;a2-鲜虾纵切片;b1-冷冻剥壳横切片;
b2-冷冻剥壳纵切片;c1-酶促剥壳横切片;c2-酶促剥壳纵切片
图8 剥壳预处理对虾仁微观结构的影响(40×)
Fig.8 Effect of pretreatments on microscopy of shrimp tissue
3 结论
自然pH值下,中性蛋白酶在对虾便捷剥壳过程中发挥良好的酶促效果,所需剥壳单位功最少且剥壳效果好。优化得到酶促剥壳条件为:酶质量浓度0.7 mg/mL,料液比1∶10(g∶mL),酶解时间 3.5 h,在此条件下实验得到的剥壳单位功为2.65 mJ/g,与理论预测值2.61 mJ/g基本一致,说明在该实验范围内建立的二次线性回归模型准确有效,有一定的实用价值。该条件下酶液可重复使用3次,之后酶液活性减小至较低水平,且酶液颜色变暗。与鲜虾仁相比,酶促剥壳对虾仁pH及硬度影响不明显,与冷冻剥壳后的虾仁相比,b*与鲜虾类似,显著好于冷冻剥壳后的虾仁,酶处理更能保持虾肉的原有的色泽。微观结构观察表明冷冻处理对虾仁纤维破坏较为明显,酶处理后的虾肉肌纤维较为完整,排列相对紧密,没有出现肌内膜和肌纤维束断裂的情况,说明酶促剥壳可显著提高鲜虾剥壳便捷性,保持虾仁较好的品质,为促进对虾机械剥壳的应用提供参考依据。
[1] 中华人民共和国农业部渔业局.中国渔业统计年鉴[M].北京:中国农业出版社,2019.
Fishery Bureau of the Ministry of Agriculture of the People’s Republic of China.China fishery statistical yearbook[M].Beijing:China Agricultural Press,2019.
[2] 王芸,李正,段亚飞,等.红景天提取物对凡纳滨对虾抗氧化系统及抗盐度胁迫的影响[J].南方水产科学,2018,14(1):9-19.
WANG Y,LI Z,DUAN Y F,et al.Effect of dietary Rhodiola rosea extract on antioxidant system and anti-low salinity stress of Litopenaeus vannamei[J].South China Fisheries Science,2018,14(1):9-19.
[3] TALBOT P,CLARK J,LAWRENCE A L.Ultrastructural observations of the muscle insertion and modified branchiostegite epidermis in the larval brown shrimp,Penaeus aztecus[J].Tissue and Cell,1972,4(4):613-628.
[4] 郝淑贤,杨肖杰,黄卉,等.虾类剥壳加工现状及预处理便捷剥壳技术[J].南方水产科学,2020,16(4):121-128.
HAO S X,YANG X J,HUANG H,et al.Status of shrimp peeling and pretreatment technology for facilitating peeling[J].South China Fisheries Science,2020,16(4):121-128.
[5] DE HOLANDA H D,NETTO F M.Recovery of components from shrimp (Xiphopenaeus kroyeri) processing waste by enzymatic hydrolysis[J].Journal of Food Science,2006,71(5):C298-C303.
[6] 刘云姣,张海燕,刘淑晗,等.响应面优化南极磷虾蛋白酶解工艺及蛋白肽组分分析[J].现代食品科技,2019,35(1):144-151;280.
LIU Y J,ZHANG H Y,LIU S H,et al.Response surface optimization of proteolytic process and protein peptide composition analysis of Antarctic krill[J].Modern Food Science & Technology2019,35(1):144-151;280.
[7] 夏松养.酶技术在鱿鱼脱皮中的应用研究[J].食品工业科技,2004,25(6):82-84.
XIA S Y.Study on the application of enzyme technique on squid skin peeling[J].Science and Technology of Food Industry,2004,25(6):82-84.
[8] 罗春艳,汪振涛,傅鹏程,等.响应面优化鱿鱼须酶法脱皮工艺及其质构特性[J].食品科学,2015,36(6):29-34.
LUO C Y,WANG Z T,FU P C,et al.Optimization of enzymatic deskinning of squid tentacles using response surface methodology and measurement of textural properties[J].Food Science,2015,36(6):29-34.
[9] DANG T T,GRINGER N,JESSEN F,et al.Enzyme-assisted peeling of cold water shrimps (Pandalus borealis)[J].Innovative Food Science & Emerging Technologies,2018,47:127-135.
[10] DANG T T,JESSEN F,MARTENS H J,et al.Proteomic and microscopic approaches in understanding mechanisms of shell-loosening of shrimp (Pandalus borealis) induced by high pressure and protease[J].Food Chemistry,2019,289:729-738.
[11] YANG X J,HAO S X,PAN C,et al.A quantitative method to analysis shrimp peelability and its application in the shrimp peeling process[J].Journal of Food Processing and Preservation,2020.DOI:10.1111/jfpp.14882.
[12] XU N,SHI W Z,WANG X C,et al.Effect of ice water pretreatment on the quality of Pacific white shrimps (Litopenaeus vannamei)[J].Food Science & Nutrition,2019,7:645-655.
[13] LI X X,LIU S,SU W C,et al.Physical quality changes of precooked Chinese shrimp Fenneropenaeus chinensis and correlation to water distribution and mobility by low-field NMR during frozen storage[J].Journal of Food Processing and Preservation,2017,41(6).DOI:10.1111/jfpp.13220.
[14] LIN T,WANG J J,LI J B,et al.Use of acidic electrolyzed water ice for preserving the quality of shrimp[J].Journal of Agricultural and Food Chemistry,2013,61(36):8695-8702.
[15] 王燕,邓放明,刘焱,等.酶法提取克氏原螯虾头和虾壳的中蛋白质[J].食品科学,2013,34(12):1-5.
WANG Y,DENG F M,LIU Y,et al.Enzymatic extraction of protein from Crayfish head and shell[J].Food Science,2013,34(12):1-5.
[16] 杨昭,姚玉静,黄佳佳,等.五种蛋白酶对牡蛎酶解产物滋味特性的影响[J].食品工业科技,2020,41(21):53-57;66.
YANG Z,YAO Y J,HUANG J J,et al.Effects of five proteases on the taste characteristics of Oyster hydrolysates[J].Science and Technology of Food Industry,2020,41(21):53-57;66.
[17] 魏微,张玲云,陆晓丹,等.响应面法优化大黄鱼鱼卵油的酶法提取工艺[J].食品工业科技,2020,41(5):145-150.
WEI W,ZHANG L Y,LU X D,et al.Optimization of enzymatic extraction technology of fish roe oil from large yellow croaker by response surface methodology[J].Science and Technology of Food Industry,2020,41(5):145-150.
[18] 叶开,陈小娥,袁高峰,等.秘鲁鱿鱼吸盘环齿脱离工艺条件优化及其结构特性分析[J].核农学报,2019,33(10):2 023-2 032.
YE K,CHEN X E,YUAN G F,et al.Optimization of enzymatic separation process and structural characteristics of sucker ring teeth of Dosidicus gigas[J].Journal of Nuclear Agricultural Sciences,2019,33(10):2 023-2 032.
[19] PAN C,CHEN S,HAO S,et al.Effect of low-temperature preservation on quality changes in Pacific white shrimp,Litopenaeus vannamei:A review[J].Journal of the Science of Food and Agriculture,2019,99(14):6 121-6 128.
[20] OKPALA C O R.The Physicochemical changes of farm-raised Pacific white shrimp (Litopenaeus vannamei) as influenced by iced storage[J].Food & Nutrition Sciences,2016,6(10):906-922.
[21] 郝淑贤,邓建朝,林婉玲,等.冻结速率对凡纳滨对虾虾仁贮藏特性的影响[J].现代食品科技,2013,29(9):51-54.
HAO S X,DENG J C,LIN W L,et al.Effect of frozen temperature on quality of Penaeus Vannamei during frozen storage[J].Modern Food Science & Technology,2013,29(9):51-54.
[22] CHAN J T Y,OMANA D A,BETTI M.Application of high pressure processing to improve the functional properties of pale,soft,and exudative (PSE)-like turkey meat[J].Innovative Food Science & Emerging Technologies,2011,12(3):216-225.
[23] BADII F H,N.K.Changes in the texture and structure of cod and haddock fillets during frozen storage[J].Food Hydrocolloids,2002,16(4):313-319.
[24] YU L X,JIANG Q,YU D W,et al.Quality of giant freshwater prawn (Macrobrachium rosenbergii) during the storage at -18 ℃ as affected by different methods of freezing[J].International Journal of Food Properties,2018,21(1):2 100-2 109.
[25] 易俊洁,丁国微,胡小松,等.南美白对虾脱壳工艺比较及其对虾仁品质的影响[J].农业工程学报,2012,28(17):287-292.
YI J J,DING G W,HU X S,et al.Comparison of shucking techniques for white shrimp and its effect on quality of peeled shrimp[J].Transactions of the Chinese Society of Agricultural Engineering,2012,28(17):287-292.
[26] TAKEI R,HAYASHI M,UMENE S,et al.Changes in physical properties of enzyme-treated beef before and after mastication[J].Journal of Texture Studies,2015,46(1):3-11.
[27] 吴燕燕,陶文斌,郝志明,等.含盐量对腌制大黄鱼鱼肉品质的影响[J].食品与发酵工业,2019,45(21):102-109.
WU Y Y,TAO W B,HAO Z M,et al.Effects of different salt concentration on the quality of cultured Large yellow croaker (Larimichthys crocea)[J].Food and Fermentation Industries,2019,45(21):102-109.
[28] 杨帆,万金庆,厉建国.微冻贮藏虾仁的水分迁移与品质变化[J].食品与发酵工业,2019,45(20):68-74.
YANG F,WANG J Q,LI J G,et al.Study on water migration and quality changes of shrimp in hyper-chilling storage[J].Food and Fermentation Industries,2019,45(20):68-74.