蛋黄中富含蛋白质、脂质、维生素和矿物质等多种营养物质,具有很高的营养价值,同时还具有优良的乳化性、凝胶性等功能特性,是一种具有极高应用价值的食品原料[1]。蛋黄卵磷脂是蛋黄中一种重要的功能活性成分,因其具有调节脂质代谢、改善神经功能、抗氧化等功能[2],在食品、医药、化妆品等行业应用前景广阔。随着蛋品精深加工技术的发展,对蛋黄卵磷脂的工业化提取技术的研究与应用不断深入。然而现有工艺在提取蛋黄中优质卵磷脂的同时会产生大量的脱脂蛋黄粉副产品,由于在提取过程中使用了酒精等有机溶剂[3-4],脱脂蛋黄粉中的蛋白严重变性,其原有功能特性基本丧失,应用价值显著降低,目前大多只能用作动物饲料,造成蛋白资源的极大浪费。如何对提取卵磷脂之后的低值脱脂蛋黄粉副产品进行深入利用,提高原料利用效率和产品附加值成为目前蛋品深加工行业亟待解决的问题之一。
近年来,许多学者已从鸡蛋黄中分离得到了多种活性多肽,目前已发现卵黄蛋白活性肽具有抗氧化[5]、降血压[6]、促进矿物质元素吸收[7]、免疫调节[8]等多种生理功能,可广泛地应用于食品、保健品和药品等相关领域[9]。然而现有对于卵黄多肽的研究主要集中在其功能性方面[10],而对于卵黄多肽的制备工艺,主要集中在实验室规模对酶解工艺的优化等方面,并且研究采用的原料多为经索氏提取法制备的脱脂蛋黄粉,这种蛋黄粉的变性程度相对较低,性质与工业化提取卵磷脂后剩余的脱脂蛋黄粉相差较大。
本研究在前人研究的基础上,采用工业上提取蛋黄卵磷脂后剩余的变性严重的脱脂蛋黄粉为原料,进行卵黄多肽的制备及脱色工艺研究,并对工艺进行优化,以期提供一种适合于工业化生产的卵黄多肽制备与脱色方法,从而使低值脱脂蛋黄粉副产品得到有效利用,提高脱脂蛋黄粉的产品附加值,拓宽蛋黄产品深加工产业链。
1 材料与方法
1.1 材料与试剂
原料:提取蛋黄卵磷脂后剩余的脱脂蛋黄粉(自制)。
中性蛋白酶、碱性蛋白酶、复合蛋白酶、95%乙醇、NaOH、盐酸、H2SO4、CuSO4·5H2O、K2SO4、去离子水、活性炭、硅藻土,所用试剂均为国产分析纯。
1.2 仪器与设备
AB204-N分析天平、pH计,梅特勒-托利多仪器公司;VCX500超声细胞破碎仪,Sonics公司;DKY-11 恒温调速回转式摇床,上海社科自动化设备有限公司;S3500激光粒度分析仪,美国Microtrac公司;UH5300紫外分光光度计,日本日立公司;K9840微量凯氏定氮仪,济南海能仪器股份有限公司;5430R冷冻离心机,德国Eppendrof公司;SD-1500立式喷雾干燥机,上海沃迪科技有限公司;1260自动氨基酸分析仪,美国Agilent公司;GST-3-1200马弗炉,上海广树机电有限公司。
1.3 实验方法
1.3.1 卵黄多肽制备工艺
卵黄多肽制备工艺如图1所示。
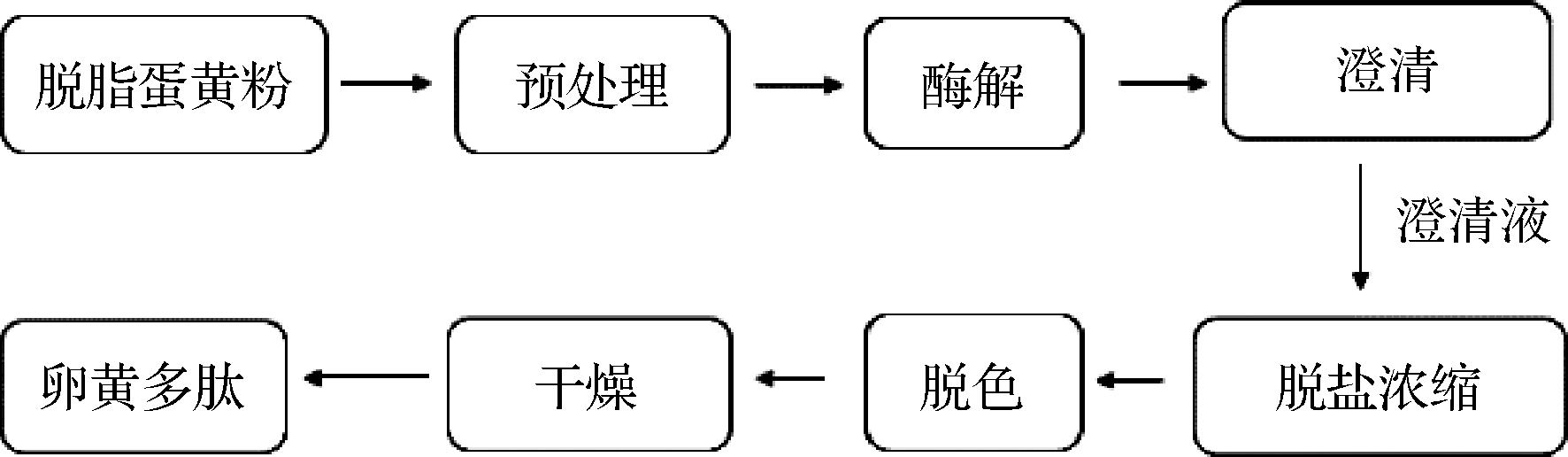
图1 工艺流程图
Fig.1 Process flow diagram
1.3.1.1 脱脂蛋黄粉组分测定
脱脂蛋黄粉中的蛋白质、脂质、水分以及灰分含量,分别采用GB 5009.5—2016、GB 5009.6—2016、GB 5009.3—2016、GB 5009.4—2016测定。
1.3.1.2 预处理
对脱脂蛋黄粉分别进行3种不同方式的预处理:(1)脱脂蛋黄粉经粉碎后过200目筛,再以1∶9(g∶mL)的料液比与去离子水混匀;(2)脱脂蛋黄粉以1∶9(g∶mL)的料液比与去离子水混匀后,300 W超声处理5 min;(3)脱脂蛋黄粉以1∶9(g∶mL)的料液比与去离子水混匀,90 ℃保温10 min。以脱脂蛋黄粉不进行预处理,直接以1∶9(g∶mL)的料液比与去离子水混匀后的样品作为对照对以上4个体系,调节pH值到7.0,以2 000 U/g的酶底比加入中性蛋白酶,50 ℃下搅拌酶解3 h,澄清后通过凯氏定氮法测定卵黄多肽得率,以确定最适预处理工艺。
1.3.1.3 酶解
对预处理后的样品进行酶解,酶解条件参考秦嘉炎等[11]的酶解工艺,并进行优化。分别将体系pH值调节到7.0、10.0、10.0,用中性蛋白酶、碱性蛋白酶、复合蛋白酶进行充分酶解,以2 000 U/g的酶底比分别加入3种蛋白酶,50 ℃下搅拌酶解3 h。通过凯氏定氮法测定卵黄多肽得率,以确定最适酶解用酶。
1.3.1.4 澄清
将酶解后体系中的不溶性杂质除去,酶解液中的杂质主要是不可被酶解的卵黄高磷蛋白,通过调节pH到卵黄高磷蛋白的等电点使其沉淀,然后采用离心、板框过滤等方式进行固液分离。
1.3.1.5 脱色
对脱色的研究采用单因素实验,对脱色剂的种类、用量、脱色pH、温度、时间等脱色工艺进行研究。
(1)选用7种不同类型的活性炭(编号1~7)为脱色剂,添加量为20 g/L多肽液,在60 ℃、pH 4.3(澄清后多肽液的pH)条件下脱色2 h,脱色后澄清,测脱色率。
(2)采用(1)中确定的脱色剂,添加量分别设定为5、10、15、20 g/L多肽液,在60 ℃、pH 4.3条件下脱色2 h,脱色后澄清,测脱色率。
(3)体系pH值分别设置为3、5、7、9、11,加入(1)中确定的脱色剂,添加量为20 g/L多肽液,60 ℃脱色2 h,脱色后澄清,测脱色率。
(4)脱色温度分别设置为30、40、50、60 ℃,加入(1)中确定的脱色剂,添加量为20 g/L多肽液,在pH 4.3的条件下脱色2 h,脱色后澄清,测脱色率。
(5)脱色时间分别设置为0.5、1、1.5、2 h,加入(1)中确定的脱色剂,添加量20 g/L多肽液,在pH 4.3、60 ℃条件下脱色,脱色后澄清,测脱色率。
通过单因素实验确定最适脱色条件后,在最适条件下进行验证实验,验证脱色效果。
1.3.1.6 板框二次澄清
为除去添加的脱色剂,利用板框进行二次过滤,以硅藻土为助滤剂循环过滤,待澄清后收集透过液。
1.3.1.7 脱盐浓缩
采用100 Da纳滤膜,在800 kPa压力下进行脱盐浓缩,浓缩至固形物含量为15%时,加入3倍体积水继续脱盐至固形物含量为15%时停止。
1.3.1.8 喷雾干燥
多肽耐热性较好[12],所以选用常温立式喷雾干燥,进风温度180~190 ℃,出风温度70~80 ℃。
1.3.2 产品检测方法
1.3.2.1 卵黄多肽得率测定
采用凯氏定氮法,分别检测脱脂蛋黄粉和多肽液中的蛋白含量,以公式(1)计算多肽得率。
多肽得率![]()
(1)
式中:V,多肽液的体积,mL;с1,多肽液中的蛋白含量,%;m,脱脂蛋白粉的质量,g;с2,脱脂蛋白粉的蛋白含量,%。
1.3.2.2 多肽脱色率测定
参考张毅等[13]的方法,进行修改,取脱色后的多肽液用0.45 μm滤膜过滤,在450 nm波长下,测定滤液吸光值,以公式(2)计算脱色率。
脱色率![]()
(2)
式中:OD1,脱色前样品的吸光值;OD2,脱色后样品的吸光值。
1.3.2.3 多肽回收率测定
采用凯氏定氮法,检测脱色前后多肽液中的蛋白含量,以公式(3)计算多肽回收率。
多肽回收率![]()
(3)
式中:с1,脱色后多肽液中的蛋白含量,%;с2,脱色前多肽液中的蛋白含量,%。
1.3.2.4 多肽液氨基酸组成分析
称取0.5 mL样品至水解管中,加入8 mL 6 mol/L HCl溶液,在氮气保护下酒精喷灯封口,120 ℃水解22 h,加入4.8 mL 10 mol/L NaOH溶液中和,然后用去离子水定容至25 mL,过滤,15 000 r/min离心30 min,取上清液,用0.22 μm滤膜过滤,采用氨基酸分析仪进行分析,按公式(4)计算滤液中人体必需氨基酸的比例。
人体必需氨基酸比例![]()
(4)
1.3.2.5 多肽液肽段分子质量分布分析
采用高效液相色谱法,色谱条件:Waters 600高效液相色谱仪(配2487紫外检测器和M 32工作站),TSKgelG 2000 SW×L 300 mm×7.8 mm,流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1,检测波长220 nm,流速0.5 mL/min,柱温30 ℃。
1.3.2.6 产品水分测定
根据GB 5009.3—2016测定产品水分。
1.3.2.7 产品灰分测定
根据GB 5009.4—2016测定产品灰分。
1.3.3 数据分析
使用Origin 8.0软件处理数据,所有定量数据均为平均值±标准偏差。
2 结果与讨论
2.1 原料组成成分
对脱脂蛋黄粉进行成分测定,结果如表1所示。说明提取卵磷脂以后的脱脂蛋黄粉中蛋白质纯度较高,有利于进行多肽的开发利用,并且脂质含量低,在一定程度上可以减少酶解过程中可能出现的乳化现象,有利于工艺的开发。
表1 原料成分组成 单位:%
Table 1 Composition of raw materials
组成蛋白质脂质水分灰分其他脱脂蛋黄粉85.7±1.52.6±0.26.3±0.33.5±0.11.9±0.4
2.2 不同预处理方法对多肽得率的影响
对脱脂蛋黄粉分别进行200目粉碎、300 W超声5 min、90 ℃加热10 min的方式进行预处理,以不进行预处理的样品作为对照,研究预处理方式对最终多肽得率的影响。由图2可知,原料经200目粉碎处理可以显著提高卵黄多肽产品的得率,卵黄多肽得率可达72.6%,相比于超声预处理和加热预处理(卵黄多肽得率分别为56.3%和59.2%),粉碎更适用于作为卵黄多肽生产的预处理工艺。主要原因是脱脂蛋黄粉在卵磷脂提取过程中,经酒精等有机溶剂处理后蛋白严重变性,蛋白聚集结块,分散性差,不易溶解在水中。粉碎预处理会使脱脂蛋黄粉均匀地分散在溶液中,更有利于后续酶解过程中酶和底物蛋白的充分接触,进而促进了酶解的进行,提高了卵黄多肽得率。
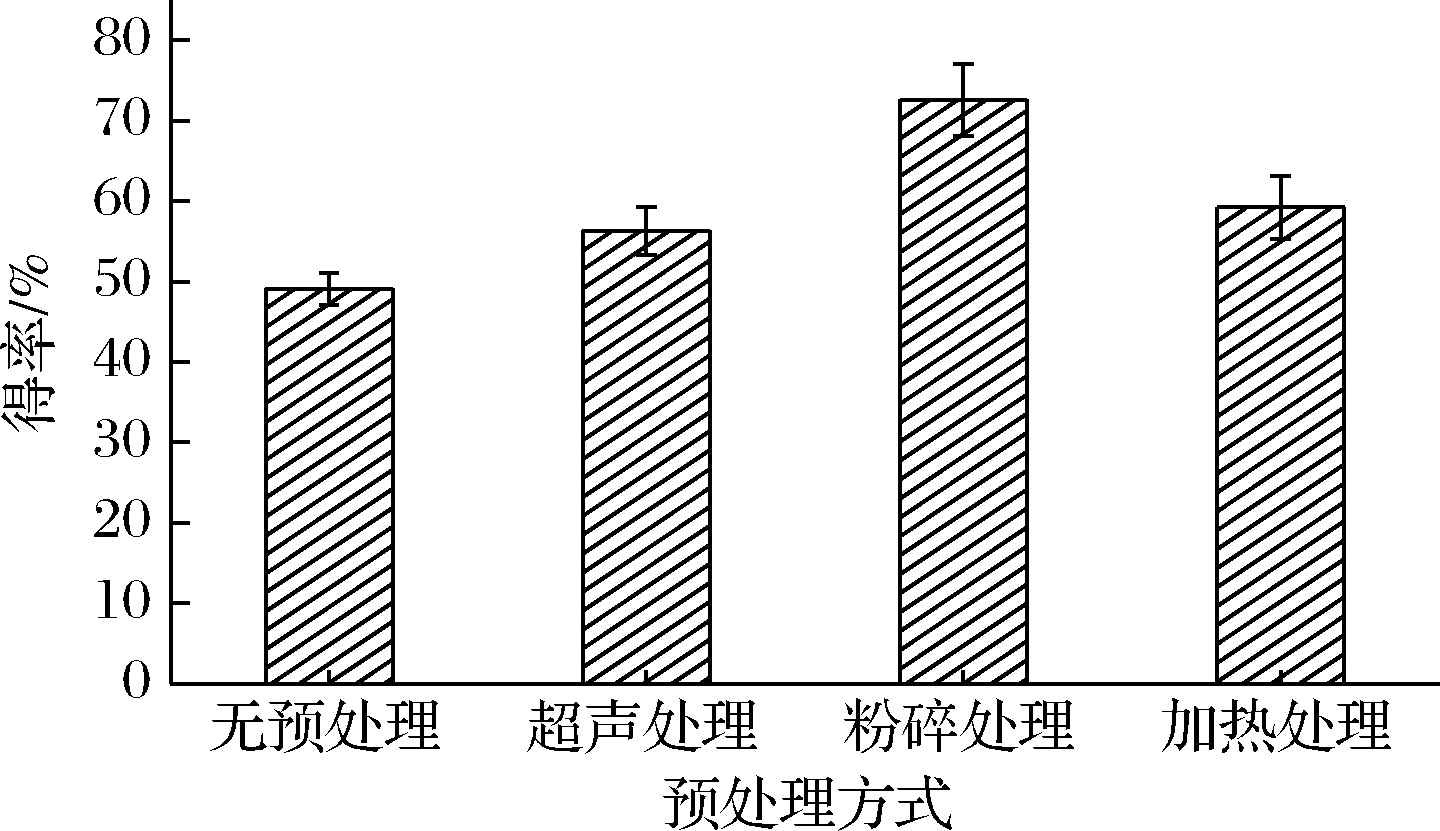
图2 不同预处理方式对多肽得率的影响
Fig.2 Effects of different pretreatment methods on polypeptide yield
2.3 不同酶种类对卵黄多肽得率的影响
分别用中性蛋白酶、碱性蛋白酶、复合蛋白酶对预处理后的体系进行酶解,图3表明,中性蛋白酶酶解后卵黄多肽的得率最高为72.6%,另外2种蛋白酶作用后的得率也接近70%,三者差距不大,但是考虑到后续需要调节pH使杂蛋白沉淀,为减少酸碱用量,降低后续脱盐处理的工作量,选择中性蛋白酶进行酶解。

图3 不同酶对多肽得率的影响
Fig.3 Effects of different enzymes on polypeptide yield
2.4 不同澄清工艺的影响
为了除去不溶性杂质,分别尝试了离心和板框过滤的方式,结果表明两者均可达到固液分离的目的。离心分离的条件为6 500 r/min、10 min,板框过滤的过滤压力为200 kPa。相比之下,板框过滤更适宜于工业化大规模澄清操作,考虑到工业化效益,选择采用板框过滤的方式进行澄清。
2.5 不同脱色剂对卵黄多肽脱色效果的影响
实验选用了7种不同的活性炭脱色剂,1~7号活性炭的粒度依次降低。如图4所示,7号活性炭的脱色效果较好,脱色率高达69.7%,可能是因为7号活性炭粒度为200目,相比其他活性炭颗粒比表面积大,对有色物质吸附效果好。因此选择7号活性炭作为脱色剂,进行后续的脱色工艺优化。
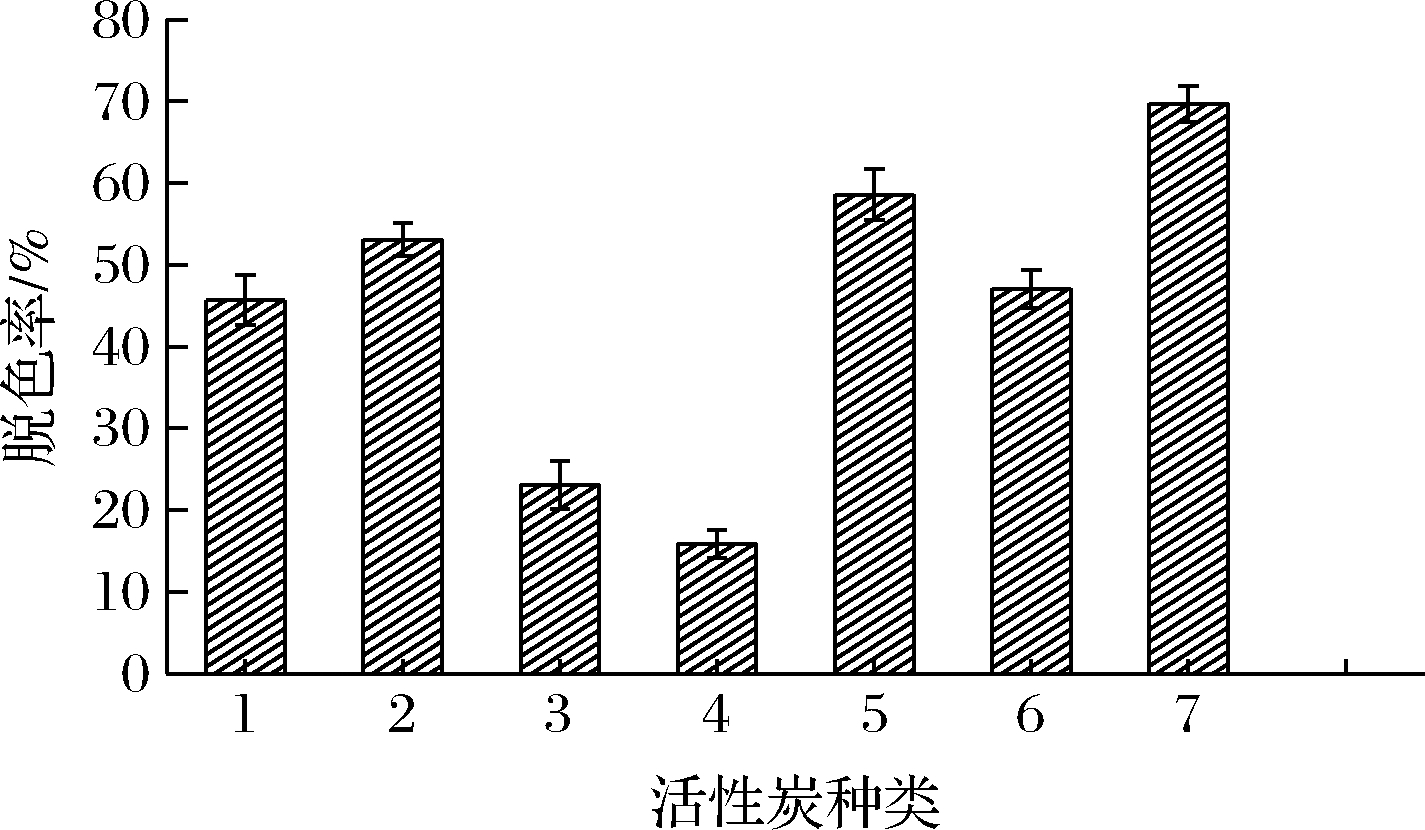
图4 不同脱色剂种类对脱色效果的影响
Fig.4 Effect of different kinds of decolorizing agents on decolorization
2.6 体系pH值对脱色效果的影响
实验设置了pH 3、5、7、9、11五个梯度,结果表明随着体系pH值的升高,卵黄多肽脱色率降低(图5),在pH 3的时候,脱色率最高为88%,表明在酸性条件下活性炭的脱色效率优于碱性条件,可能是因为7号活性炭的等电点在6.8,体系pH越低活性炭所带正电荷越多。多肽液中的呈色物质可能是带负电荷,静电相互作用力使得体系在酸性条件下脱色效果比较好,这与之前报道的pH对其他多肽脱色的影响规律一致[14-16];多肽回收率随着pH的升高变化趋势不明显,可能是因为肽段带电荷比较少,受pH影响不大[17]。由于多肽液的初始pH值为4.3左右,为简化操作工艺,可在此pH条件下直接脱色。

图5 体系pH对脱色效果的影响
Fig.5 Effect of system pH on decolorization
2.7 脱色温度对脱色效果的影响
实验设置了30、40、50、60 ℃四个梯度,图6结果表明当脱色温度从30 ℃升高到50 ℃时,脱色率由17.5%上升到67.3%,多肽回收率由97.4%下降到了62.7%;温度继续升高两者变化均不大,因此50 ℃是比较合适的脱色温度。在30~50 ℃,随着温度升高,活性炭对呈色物质和多肽的吸收率都会上升,导致脱色率和多肽损失率同时上升,50 ℃可能是活性炭的最适吸附温度,因此超过50 ℃,二者变化均不明显。在50 ℃时,脱色率与多肽回收率都超过60%,综合考虑脱色率与多肽回收率,选择50 ℃为脱色温度。

图6 体系温度对脱色效果的影响
Fig.6 Effect of system temperature on decolorization
2.8 脱色时间对脱色效果的影响
实验设置了30、60、90、120 min四个时间梯度,图7结果表明,随着脱色时间延长,脱色率为65%~70%,变化不大,这表明脱色剂添加量为20 g/L时,30 min内脱色剂已经基本可以饱和吸附,延长吸附时间对脱色剂吸附效果影响不大,多肽回收率也在60%~70%,说明脱色时间对多肽回收率的影响同样不明显,因此选择30 min作为吸附时间,并进一步研究确定脱色剂的添加量。

图7 脱色时间对脱色效果的影响
Fig.7 Effect of system time on decolorization
2.9 脱色剂添加量对脱色效果的影响
实验设置了5、10、15、20g/L四个脱色剂添加量梯度,结果如图8所示,脱色剂的添加量从5 g/L增加到10 g/L,脱色率明显上升,添加量超过10 g/L后,脱色率提高不明显,但是多肽回收率会较大幅度下降。在添加量为10 g/L时,脱色率可以达到72%,而多肽回收率可以达到87%,综合考虑脱色率和多肽回收率这2个指标,10 g/L的脱色剂添加量是比较合理的。

图8 脱色剂添加量对脱色效果的影响
Fig.8 Effect of amount of decolorizer added on decolorization
2.10 最适脱色条件下进行的脱色验证
综上所述,向多肽液中添加10 g/L的7号活性炭,在50 ℃、pH 4.3的条件下脱色30 min进行验证,结果测定脱色率为72.34%,多肽回收率为84.76%,可以满足卵黄多肽工业化生产的要求。
2.11 脱色前后卵黄多肽的氨基酸组成分析
对脱色前后的多肽液进行氨基酸序列分析,探究脱色工艺对多肽样品氨基酸组成的影响。氨基酸组成是评价多肽营养性的重要指标[18],为确定脱色过程对卵黄多肽氨基酸组成的影响,对脱色前后的多肽液氨基酸组成进行分析,结果如表2所示,活性炭脱色会同时吸附一部分氨基酸,主要是谷氨酸和天冬氨酸等酸性氨基酸,以及脯氨酸和亮氨酸等非极性氨基酸,这是因为天冬氨酸和谷氨酸的等电点<4.3,而7号活性炭的等电点为6.8,在体系pH值为4.3时,活性炭带正电荷,而天冬氨酸和谷氨酸带负电,因此容易被活性炭吸附。活性炭本身是非极性吸附剂,所以也会对非极性的氨基酸有比较强的吸附能力。丝氨酸和酪氨酸在酸水解处理中会有不同程度的破坏[19],测定值偏低,色氨酸完全破坏,无法检测。但是脱色后的多肽液中人体必需氨基酸(除色氨酸)比例达到32.9%,含量丰富,表明卵黄多肽产品具有较高的营养价值。
表2 脱色前后氨基酸的组成与含量 单位:mg/mL
Table 2 Composition and content of amino acids before and after decolorization

名称吸附前含量吸附后含量天冬氨酸 Asp2.6742.269 谷氨酸 Glu4.6243.926 丝氨酸 Ser2.2611.949 组氨酸His0.4930.416 甘氨酸Gly2.2121.908 苏氨酸Thr1.1831.011 精氨酸Arg2.6862.278 丙氨酸Ala2.0401.742 酪氨酸Tyr1.1951.012 胱氨酸Cys-s2.6322.193 缬氨酸Val1.7771.509 甲硫氨酸Met0.8250.703 苯丙氨酸Phe1.3761.171 异亮氨酸Ile1.6301.385 亮氨酸Leu3.2312.752 赖氨酸Lys2.6232.231 脯氨酸Pro3.9053.218 总氨基酸含量37.36831.674 必需氨基酸含量12.26910.411 必需氨基酸比例/%32.832.9
2.12 脱色前后多肽液的肽段分子质量分析
对脱色前后的多肽液进行肽段分子质量分布分析,结果见表3。结果表明脱色前后多肽的主要肽段分子质量均集中在180~500 Da区间,表明卵黄多肽产品中含量最高的是二肽至五肽的小肽,这些小肽段最易被人体吸收[20-22],表明卵黄多肽产品具有良好的体内吸收性能。
表3 脱色前后的肽段分子质量分布
Table 3 Molecular weight distribution of peptides before and after decolorization
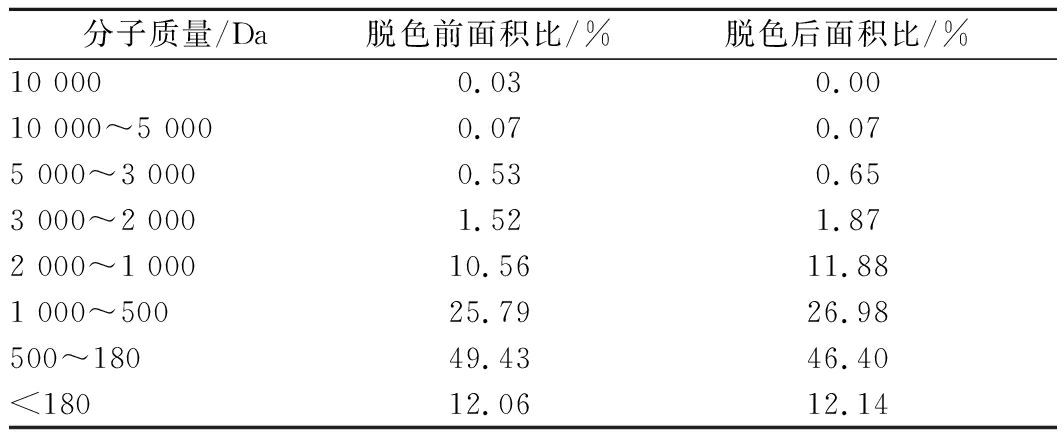
分子质量/Da脱色前面积比/%脱色后面积比/%10 0000.030.0010 000~5 0000.070.075 000~3 0000.530.653 000~2 0001.521.872 000~1 00010.5611.881 000~50025.7926.98500~18049.4346.40<18012.0612.14
2.13 产品水分与灰分测定
对喷雾干燥后的卵黄多肽进行水分测定,结果见表4,产品水分为(6.3±0.5)%,灰分为(3.9±0.3)%,均符合大豆多肽和胶原蛋白肽的国标要求,因此可以满足普通多肽的产品标准。
表4 产品中的水分和灰分含量 单位:%
Table 4 Moisture and ash content in the product

指标水分灰分卵黄多肽6.3±0.53.9±0.3大豆多肽(国标)<7.0<6.5胶原蛋白多肽(国标)<7.0<20
3 结论
本实验以工业化提取蛋黄卵磷脂后剩余的低值脱脂蛋黄粉副产品为原料,研究了一种具有工业化应用前景的卵黄多肽生产工艺,结果显示,将脱脂蛋黄粉原料粉碎至200目,经中性蛋白酶酶解后,经板框过滤澄清得到卵黄多肽清液,多肽得率可达到72.6%。选用7号活性炭,在添加量为10 g/L、50 ℃、pH 4.3、吸附30 min的条件下,脱色率可达72.34%,多肽回收率为84.76%。最后的产品分析表明,脱色后产品必需氨基酸占比高达32.9%,氨基酸组成均衡、肽段组成主要为二肽到五肽,是最适合人体吸收的肽段形式。本工艺具备良好的工业化应用前景,产品具有较高的营养价值和较好的人体吸收性能,可实现低值脱脂蛋黄粉副产品的综合利用,有效提高产品附加值,丰富蛋品精深加工产品种类,拓宽蛋制品深加工的产业链。
[1] 谢云霄,耿放,王金秋.蛋黄主要蛋白质研究进展[J].食品工业,2019,40(7):266-270.
XIE Y X,GENG F,WANG J Q,Research advances in the major proteins of egg yolk[J].The Food Industry,2019,40(7):266-270.
[2] 王轩, 李全霞,刘伟,等.食品中卵磷脂的检测技术研究进展[J].食品与发酵工业,2018(8):322-327.
WANG X,LI Q X,LIU W,et al.Research progress of the determination of lecithin content in food[J].Food and Fermentation Industries,2018(8):322-327.
[3] GLADKOWSKI W,CHOJNACKA A,KIELBOWICZ G,et al.Isolation of pure phospholipid fraction from egg y olk[J].Journal of the American Oil Chemists’ Society(JAOCS),2012,89(1):179-182.
[4] 吴汉东,佟伟.高纯度蛋黄卵磷脂的提取工艺研究[J].安徽农业科学,2010(14):7 537-7 538.
WU H D,TONG W,Study on the extraction technology of high-purity egg yolk lecithin[J].Journal of Anhui Agri,2010(14):7 537-7 538.
[5] ECKERT E,ZAMBROWICZ A,POKORA M,et al.The application of microbial proteases to obtain egg yolk protein hydrolysates with antioxidant and antimicrobial activity[J].Zywnosc Nauka Technologia Jakosc,2013(20):105-11.
[6] YOSHII H,DETACIH N,OHBA R,et al.Antihypertensive effect of ACE inhibitory oligopeptides from chicken egg yolks[J].Comparative Biochemistry and Physiology Parts C,2001,128(1):27-33.
[7] 江波, MINE Y.卵黄髙磷蛋白磷酸肽的制备及钙结合性质的研究[J].无锡轻工大学学报,2000,19(4):325-330.
JIANG B,MINE Y.Preparation and their calcium binding properties of novel functional oligo-phosphopeptides from egg yolk phosvitin[J].Journal of Wuxi University of Light Industry,2000,19(4):325-330.
[8] 于娜. 卵黄多肽的分离纯化及降血脂活性研究[D].沈阳:沈阳农业大学,2012.
YU N.Studies on the isolation and purification of egg peptides and their activity of reducing blooding fat[D].Shenyang:Shenyang Agricultural University,2012.
[9] ZAMBROWICZ A,ZABLOCKA A,BOBAK L,et al.A simple and rapid method of isolation of active polypeptide complex,yolkin,from chicken egg yolk[J].Food Chemistry.2017;230:705-711.
[10] ZAMBROWICZ A,DABROWSKA A,BOBAK L,et al.Egg yolk proteins and peptides with biological activity[J].Postepy Higieny I Medycyny Doswiadczalnej,2014,68:1 524-1 529.
[11] 秦嘉炎,于娜,岳喜庆,等.酶法水解卵黄蛋白制备多肽的工艺优化[J].食品科学,2012,33(1):147-151.
QIN J Y,YU N,YUE X Q,et al.Process optimization for enzymatic preparation of polypeptides from egg yolk protein[J].Food Science,2012,33(1):147-151.
[12] 白洁,何应.喷雾干燥技术在蛋白多肽类药物微球制备中的应用[J].药学进展,2007,31(7):298-302.
BAI J,HE Y.Application of spray drying technique to preparation of protein and peptide-ioaded microspheres:A review[J].Progress in Pharmaceutical Sciences,2007,31(7):298-302.
[13] 张毅,华欲飞,孔祥珍,等.活性炭对大豆多肽脱色效果的研究[J].粮食与饲料工业,2010(8):31-33.
ZHANG Y,HUA Y F,KONG X Z,et al.Effect of active carbon on decoloralion of soybean peptides[J].Vereal & Feed Industry,2010(8):31-33.
[14] 徐曼,马寒冰,李铮,等.粉末活性炭脱色豆粕蛋白酶解液的条件优化[J].食品工业科技,2013.34(11):263-266.
XU M,MA H B,LI Z,et al.Optimization of conditions for soybean meal protease hydrolysate decolourization with powdered activated carbon[J].Science and Technology of Food Industry,2013.34(11):263-266.
[15] 章绍兵,甘晓露,龚琴,等.花生蛋白酶解液的活性炭脱色工艺研究[J].河南工业大学学报(自然科学版),2011,32(2):10-14.
ZHANG S B,GAN X L,GONG Q.Study on decoloration of enzymatic hydrolysate of peanut protein by activated carbon[J].Journal of Henan University of Technology (Natural Science Edition),2011,32(2):10-14.
[16] 盛洁,胡凌豪,陈建康,等,凤尾鱼酶解产物脱腥脱色工艺优化[J].食品工业科技,2020,41(7):190-196;202.
SHENG J,HU L H,CHEN J K,et al,Optimization of deodorization and decolorization process of anchovy fish enzymatic hydrolysate[J].Science and Technology of Food Industry,2020,41(7):190-196;202.
[17] 王松,李成辉,王洪彩,等,大豆肽的硅藻土脱色工艺优化[J].中国油脂,2020,45(6):41-44.
WANG S,LI C H,WANG H C,et al,Optimization of bleaching of soybean peptide by diatomite[J]China Oils and Fats,2020,45(6):41-44.
[18] LATIF S,PFANNSTIEL J,MAKKAR H P S,et al.Amino acid composition,antinutrients and allergens in the peanut protein fraction obtained by an aqueous enzymatic process[J].Food Chemistry,2013,136(1):213-217.
[19] 陈泽宪,徐辉碧.蛋白质水解阶段对氨基酸组成分析的影响[J].分析科学学报,2002,18(1):80-85.
CHEN Z X,XU H B.Effects of hydrolysis on amino acid composition analysis of proteins[J].Journal of Analytical Science,2002,18(1):80-85.
[20] 解冰心,唐善虎,郑渝川,等.肉及其副产物中生物活性肽研究进展[J].食品研究与开发,2017,38(6):206-212.
XIE B X,TANG S H,ZHENG Y C.et al.Progress of studies on bioactive peptides derived from meat and its by-product[J].Food Research and Development,2017,38(6):206-212.
[21] 赵磊,张雅莉,张晓蕾,等.鹿茸蛋白水解肽的抗炎及肠吸收机制[J].中国食品学报,2018,18(10):45-51.
ZHAO L,ZHANG Y L,ZHANG X L,et al.Anti-inflammatory and intestinal absorption mechanism of peptides hydrolyzed from velvet antler protein[J].Journal of Chinese Institute of Food Science and Technology,2018,18(10):45-51.
[22] 刘文颖,周明,冯晓文,等.乳清低聚肽的血管紧张素转化酶抑制作用及其稳定性研究[J].食品与发酵工业,2020,46(16):24-29;36.
LIU W Y,ZHOU M,FENG X W,et al.Study on stability and ACE inhibitory activity of whey oligopeptides[J].Food and Fermentation Industries,2020,46(16):24-29;36.