解淀粉芽胞杆菌α-淀粉酶(Bacillus amyloliquefaciens α-amylase,BAA)可以随机水解直链淀粉或支链淀粉分子中的α-1,4糖苷键,生成麦芽糊精和少量葡萄糖,是一种内切型液化酶,最适作用温度为55 ℃、最适作用pH为6~7,是一种典型的钙离子依赖型淀粉液化酶[1-2]。BAA在淀粉液化、织物退浆和食品加工等工业中具有重要应用价值,是工业上产量最大、应用领域最广的中温型α-淀粉酶[3-4]。
BAA作为我国开发应用较早的工业酶制剂之一,早在19世纪60年代就开始了工业化生产,但发酵水平一直停滞在300~500 U/mL,且酶制剂产品质量不稳定、货架期太短(3个月左右)。2009年前后,经过分子育种技术,在改善BAA酶制剂质量和货架期的同时,BAA发酵生产水平提高至1 500 U/mL以上,由此确立了BAA生产的世界领先地位[5]。但是,针对BAA工业应用属性的研究,一直以来未有很大的突破。现有针对BAA的分子进化研究,主要包括:LEE等[6]对BAA编码基因进行随机突变,发现233位的氨基酸残基与BAA的酶学性能有关;CORNELIUS等[7]通过易错PCR与DNA体外随机重排技术(DNA shuffling)对BAA编码基因进行改造,得到水解活力提高8倍的突变体BAA29,比酶活性由15 U/mg提高至140 U/mg;WU等[8]通过易错PCR对BAA编码基因进行随机突变,得到Ca2+依赖性降低的突变体Q264S;林碧瑜[9]发现BAA第28位氨基酸由天冬氨酸突变为谷氨酸可以提高比酶活性,与野生型BAA相比突变体的比酶活性提高了约30%。
BAA工业应用属性有待改善的主要方面:1)酶活性的钙离子依赖型,即如何降低其在实际工业应用中氯化钙或碳酸钙等钙盐的补加;2)如何适度提高其最适作用温度,有利于淀粉液化和加工工艺的实施。为此,本文在前期研究积累[9]的基础上,进一步对其特定氨基酸残基进行突变并解析酶学性质,研究结果对后续进一步提升BAA的应用具有显著价值。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
含有BAA突变体2M6表达质粒的Bacillus subtilis 2M6-A1为本实验室前期构建与保藏;B.subtilis 1A717为本实验室保藏,用于质粒构建;载体pHY-WZX为本实验室前期构建[10],用于BAA及其突变体的表达;Bacillus licheniformis Z902(Δamy)[11]为酶高效表达宿主细胞,由本实验室前期通过分子改造B.licheniformis CBBD302[12]获得。
1.1.2 酶与试剂
中温α-淀粉酶工业产品,江苏锐阳生物科技有限公司;Pyrobest DNA聚合酶,Takara公司;限制性内切酶Xba I、Sma I、T4 DNA连接酶和DNA分子量标准,上海生工生物工程股份有限公司;琼脂糖凝胶DNA回收试剂盒和小量DNA产物纯化试剂盒,北京庄盟生物科技有限公司,其他试剂除特殊要求外均为国产分析纯。
1.1.3 培养基
LB培养基(g/L):酵母浸出物5,蛋白胨10,氯化钠10;固体培养基添加20 g/L琼脂。必要时在培养基中添加终质量浓度为20 μg/mL的硫酸卡那霉素。
产酶鉴定培养基:在固体LB培养基的基础上,加入1%可溶性淀粉[13]。
发酵培养基(g/L):CaCl2 0.3,(NH4)2SO4 3,棉籽粉20,α-乳糖20,KH2PO4 10,K2HPO4 20,pH 7.2[13]。
1.2 实验方法
1.2.1 常规分子克隆操作
质粒DNA的提取、酶切、转化子筛选等均按照实验室常规方法进行[14];枯草杆菌与地衣芽胞杆菌的遗传转化按照文献进行[15-16];DNA纯化按照试剂盒说明书进行。
1.2.2 定点突变
以突变体2M6编码基因为模板,按照文献方法进行定点突变[5]。具体步骤为:以baa-28a(5′-CGATAAATGTTCCGCATCATTCTG-3′)和baa-28b(5′-CAGAATGATGCGGAACATTTATCG-3′)为突变引物,引入突变位点D28E,与两端引物BAA-1(5′-TACTCTAGAGTAAATGGCACGCTGATGCAGTAT-3′)和BAA-2(5′-TTTCTGAACATAAATGGAGCAGG-3′)组合,通过PCR扩增获得上下游两段DNA片段;再以此两段DNA片段为模板,以BAA-1和BAA-2为引物,将上下游两段DNA片段融合为突变体E2M6全长基因。采用Sanger核苷酸序列测定法确认突变基因序列。
1.2.3 突变体的表达、制备与纯化
将突变体全长编码DNA片段纯化后经Xba I酶切,并克隆入表达载体pHY-WZX的Xba I/Sma I位点,转化入枯草杆菌1A717构建重组质粒pHY-E2M6,正确构建的质粒转化入地衣芽胞杆菌Z902中,获得产酶重组菌地衣芽胞杆菌Z-E2M6。
将Z-E2M6接种入盛有50 mL发酵培养基的250 mL摇瓶,37 ℃、220 r/min条件下培养120 h;发酵结束后离心收集上清液,即为突变体粗酶液。酶液经饱和度为30%~40%的硫酸铵沉淀,再经凝胶层析柱Superdex-G75进一步纯化。纯化蛋白经SDS-PAGE分析[17],蛋白质浓度用Bradford法测定[18]。
1.2.4 酶活测定
中温α-淀粉酶酶活力按照GB 1886.174—2016《食品安全国家标准 食品添加剂 食品工业用酶制剂》进行测定[19]。酶活性定义为:1 mL液体酶在60 ℃、pH 6.0条件下,1 h液化1 g可溶性淀粉即为1个酶活力单位,以U/mL表示。
1.2.5 酶学性质分析
1.2.5.1 最适作用温度及热稳定性
将酶样在不同温度(30~90 ℃)下测定酶活力,最高酶活力值以100%计,计算其不同温度下的相对酶活力,确定最适作用温度。将酶样用pH 6.0缓冲液进行适当稀释,在不同温度(50、55、60、65 ℃)下保温1 h,间隔10 min取样,测定残余酶活力,未经热处理的酶活力值以100%计,计算处理后酶样的相对酶活力。
1.2.5.2 最适作用pH及pH稳定性
将酶样用不同pH(4~8)缓冲液进行稀释,并用对应pH缓冲液测定酶活力,最高酶活力值以100%计,计算其不同pH条件下的相对酶活力,确定最适作用pH。将酶样与不同pH值缓冲液以1∶10(体积比)混合,37 ℃静置1 h,测定酶样的残余酶活力值。未经处理的酶活力值以100%计,计算处理后酶样的相对酶活力。
1.2.5.3 金属离子及化学试剂对酶活的力影响
在反应体系中加入不同金属离子和化学试剂,终浓度为1 mmol/L或5 mmol/L,在酶的最适反应条件下测定样品酶活力,未经处理的酶活力值以100%计。
1.2.5.4 酶动力学参数的测定
将酶样用最适作用pH缓冲液适当稀释后,以不同质量浓度(0.4、1、2、4,10和20 mg/mL)可溶性淀粉溶液为底物,在最适反应条件下按照实验室常规方法[9]进行测定,并以双倒数法(Lineweaver-Burk法)作图,计算酶的动力学参数。
2 实验结果
2.1 突变体的构建与制备
以突变体2M6编码基因为模板,特异性引物序列介导BAA编码基因的定点突变,获得突变体E2M6全长编码基因。将此基因酶切后克隆入表达载体pHY-WZX中,获得了重组表达载体pHY-E2M6。进一步将此表达质粒转化入地衣芽胞杆菌Z902中,获得产酶重组菌地衣芽胞杆菌Z-E2M6。
经摇瓶发酵制备酶液,并经硫酸铵沉淀和凝胶过滤色谱进行纯化,获得了纯化的BAA突变体E2M6,经SDS-PAGE电泳鉴定,呈现单一纯蛋白条带(图1),分子质量为58 kDa,与理论大小相符。
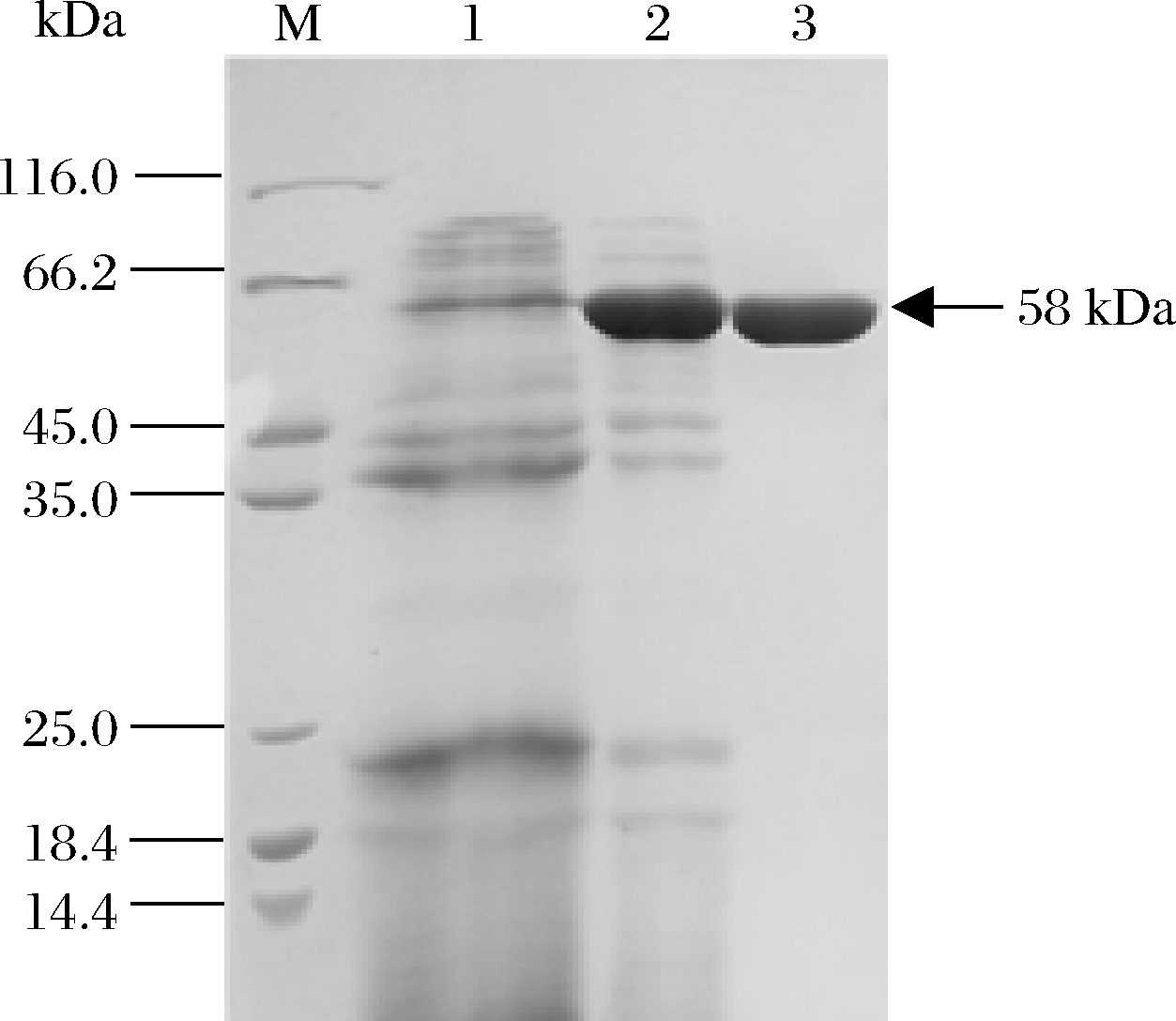
M-蛋白分子量标准;1-B.licheniformis Z902发酵酶液;
2-E2M6粗酶液;3-纯化后的E2M6
图1 纯化突变体E2M6的SDS-PAGE图谱
Fig.1 The SDS-PAGE profile of mutant E2M6
2.2 突变体的酶学性质
2.2.1 最适作用温度与最适作用pH
由图2-a可知,突变体E2M6的最适作用温度为60 ℃,60~70 ℃之间维持较高活性,突变体的最适酶活较野生型BAA提高了至少5 ℃;在30~60 ℃温度范围内,突变体E2M6与BAA的变化趋势大致相同;当温度升至80 ℃时,野生型BAA的酶活力明显下降(小于40%),突变体E2M6仍保留70%以上的酶活力;当反应温度升至90 ℃时,突变体E2M6仍保留20%以上的酶活力,而BAA仅残余约10%的酶活力。可见,对BAA的突变拓宽了BAA的作用温度范围。
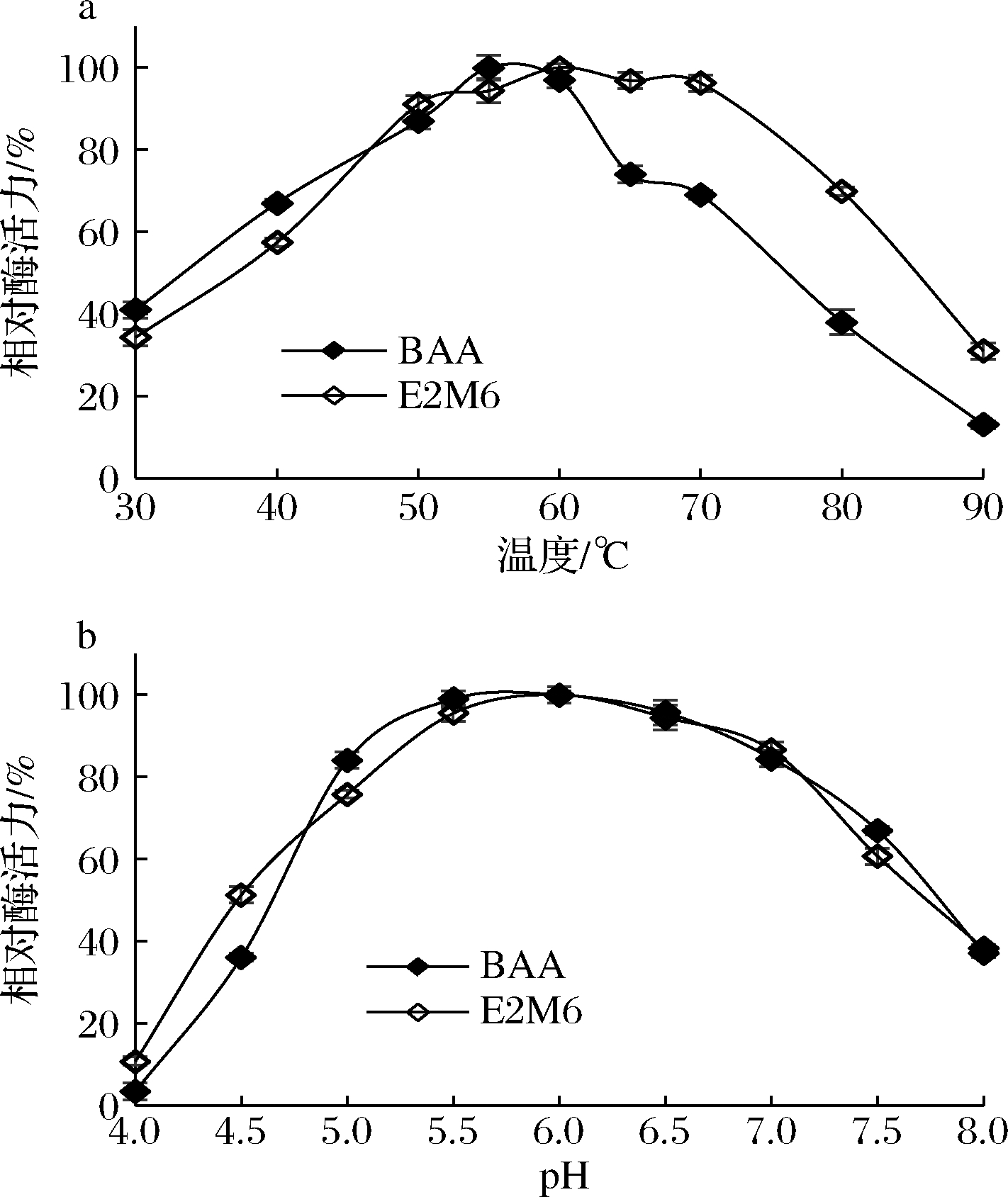
a-温度;b-pH
图2 突变体E2M6的最适作用温度与最适作用pH
Fig.2 Optimum temperature and pH optimal of mutant E2M6
在60 ℃条件下,测定不同pH(4.0~8.0)条件下的酶活力,结果如图2-b所示。突变体E2M6与BAA的最适作用pH相同,都为pH 6.0,且两者在不同pH条件下的酶活力大致相同,在pH 5.0~7.0范围内皆具有较高活性。
2.2.2 热稳定性与pH稳定性
BAA突变体的热稳定性和pH稳定性如图3所示。突变体在50 ℃下保温1 h后,E2M6与BAA分别保留80%、60%以上的酶活力;55 ℃保温1 h后E2M6与BAA分别保留60%、40%以上酶活力;60 ℃保温1 h后E2M6与BAA分别保留50%、30%以上的酶活力;65 ℃保温1 h后E2M6与BAA分别保留40%、15%以上的酶活力(图3-a)。综上,E2M6热稳定性较BAA有所提升。
突变体E2M6与BAA的pH稳定性趋势大致相同。当pH在6.0~9.0范围内,pH的升高对BAA及E2M6酶活力影响较小,相对酶活力保持在80%以上(图3-b)。

a-热稳定性;b-pH稳定性
图3 突变体E2M6的热稳定性与pH稳定性
Fig.3 The thermostability and pH stability of the mutant E2M6
2.2.3 金属离子和化学试剂对酶活性的影响
不同金属离子及化学试剂对突变体酶活性的影响结果如表1。与BAA相比,突变体E2M6酶活力对Ca2+、Mg2+、Na+等金属离子的依赖性降低;SDS对BAA及突变体E2M6酶活均有抑制作用,但与BAA相比E2M6对SDS更敏感。
表1 不同金属离子和化学试剂对突变体E2M6的影响
Table 1 Effect of different metal ions and chemicals on E2M6
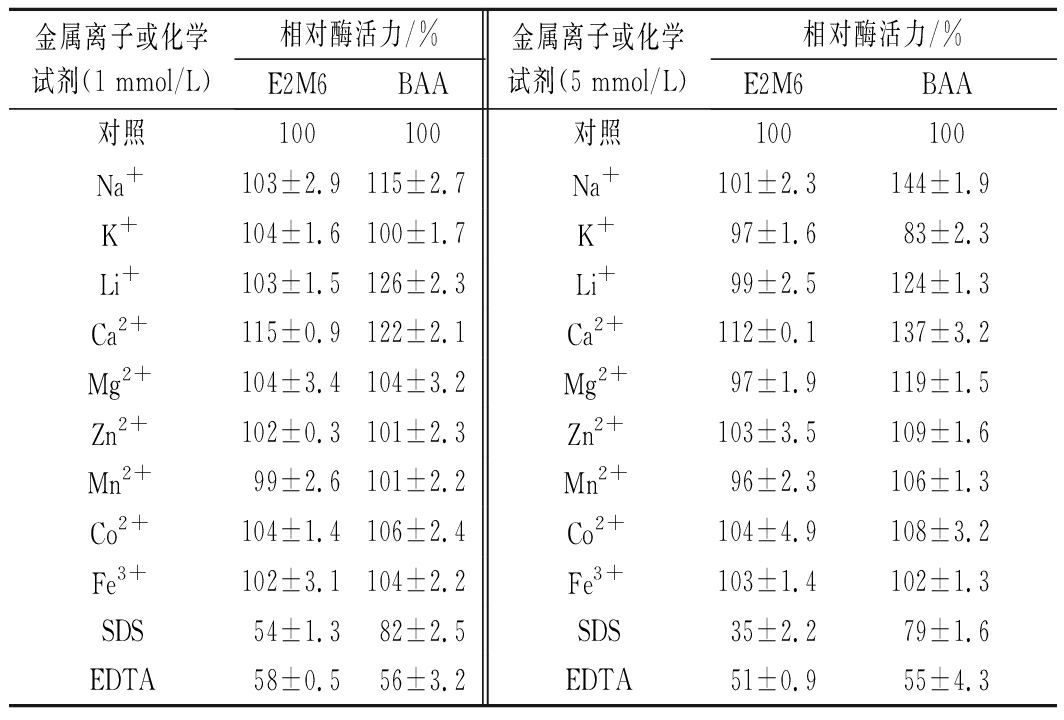
金属离子或化学试剂(1 mmol/L)相对酶活力/%E2M6BAA金属离子或化学试剂(5 mmol/L)相对酶活力/%E2M6BAA对照100100对照100100Na+103±2.9115±2.7Na+101±2.3144±1.9K+104±1.6100±1.7K+97±1.683±2.3Li+103±1.5126±2.3Li+99±2.5124±1.3Ca2+115±0.9122±2.1Ca2+112±0.1137±3.2Mg2+104±3.4104±3.2Mg2+97±1.9119±1.5Zn2+102±0.3101±2.3Zn2+103±3.5109±1.6Mn2+99±2.6101±2.2Mn2+96±2.3106±1.3Co2+104±1.4106±2.4Co2+104±4.9108±3.2Fe3+102±3.1104±2.2Fe3+103±1.4102±1.3SDS54±1.382±2.5SDS35±2.279±1.6EDTA58±0.556±3.2EDTA51±0.955±4.3
2.2.4 突变体E2M6动力学特征
测定突变体E2M6的比酶活力数据与动力学常数,结果汇总于表2。突变体E2M6比酶活力为185 U/mg,较BAA提高了约66%;突变体E2M6的底物亲和力较BAA显著提高,最大反应速度虽有所降低,但突变体E2M6的淀粉水解效率(κcat/Km)有所提升,较BAA提高了1.75倍。
表2 突变体E2M6的酶促学动力学特征
Table 2 The kinetic parameters of the mutant E2M6
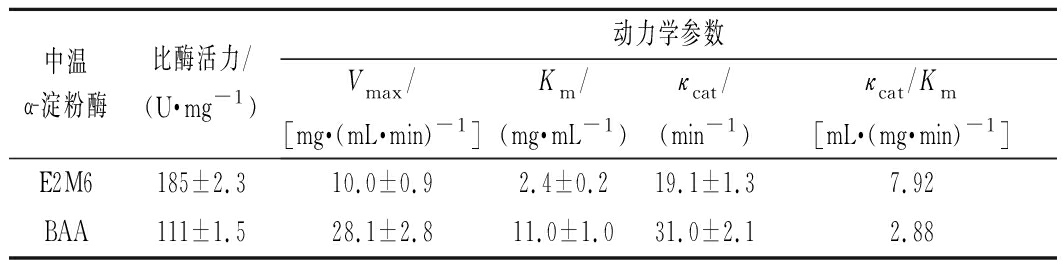
中温α-淀粉酶比酶活力/(U·mg-1)动力学参数Vmax/[mg·(mL·min)-1]Km/(mg·mL-1)κcat/(min-1)κcat/Km[mL·(mg·min)-1]E2M6185±2.310.0±0.92.4±0.219.1±1.37.92BAA111±1.528.1±2.811.0±1.031.0±2.12.88
3 结论
通过研究,本文获得了BAA工业应用性能显著提升的突变体,其活力的钙离子依赖性显著降低,最适作用温度有所提高,更适合淀粉加工工业应用需求。
[1] 范如意. 基因工程技术改造地衣芽孢杆菌实现中温α-淀粉酶高效表达[D].无锡:江南大学,2014.
FAN R Y.Heterologous expression of α-amylase in Bacillus licheniformis with genetic engineering modification[D].Wuxi:Jiangnan University,2014.
[2] 姜锡瑞,段刚.酶制剂实用技术手册[M].北京:中国轻工业出版社,2002.
JIANG X R,DUAN G.Practical technical manual of enzyme preparation[M].Beijing:China Light Industry Press,2002.
[3] SIVARAMAKRISHNAN S,GANGADHARAN D,NAMPOOTHIRI K M,et al.α-Amylases from microbial sources-an overview on recent developments[J].Food Technology & Biotechnology,2006,44(2):173-184.
[4] 刘洋,沈微,石贵阳,等.中温α-淀粉酶的酶学性质研究[J].食品科学,2008,29(9):373-377.
LIU Y,SHEN W,SHI G Y,et al.Enzymatic properties of mesophilic α-amylase from Bacillus amyloliquefaciens M23[J].Food Science,2008,29(9):373-377.
[5] 刘洋. 中温α-淀粉酶编码基因剂量对其生产水平提高的重要作用[D].无锡:江南大学,2009.
LIU Y.The important role of α-amylase gene dosages on the increase of its production[D].Wuxi:Jiangnan University,2009.
[6] LEE S,MOURI Y,MINODA M,et a1.Comparison of the wild-type α-amylase and its variant enzymes in Bacillus amyloliquefaciens in activity and thermal stability,and insights into engineering the thermal stability of Bacillus α-amylase[J].Journal Biochemistry,2006,139(6):1 007-1 015.
[7] CORNELIUS B,JUTTA S,KARL H M,et al.Directed evolution of a bacterial-amylase:Toward enhanced pH-performance and higher specific activity[J].Protein Science,2003,12(10):2 141-2 149.
[8] WU H Y,TIAN X J,DONG Z X,et al.Engineering of Bacillus amyloliquefaciens α-amylase with improved calcium independence and catalytic efficiency by error-prone PCR[J].Starch-Stärke,2018,70:3-4.
[9] 林碧瑜. 解淀粉芽胞杆菌α-淀粉酶的高效制备[D].福州:福州大学,2019.
LIN B Y.Efficient preparation of Bacillus amyloliquefaciens α-amylase[D].Fuzhou:Fuzhou University,2019.
[10] NIU D D,WANG Z X.Development of a pair of bifunctional expression vectors for Escherichia coli and Bacillus licheniformis[J].Journal of Industrial Microbiology & Biotechnology,2007,34(5):357-362.
[11] 方安然,牛丹丹,乔舰,等.耐热异淀粉酶的高效表达及其在麦芽糖浆制备中的作用[J].食品与发酵工业,2016,42(7):23-29.
FANG A R,NIU D D,QIAO J,et al.Overexpression of thermotolerant isoamylase and its application in maltose syrup preparation[J].Food and Fermentation Industries,2016,42(7):23-29.
[12] NIU D D,ZUO Z R,SHI G Y,et al.High yield recombinant thermostable α-amylase production using an improved Bacillus licheniformis system[J].Microbial Cell Factories,2009,8(1):58.
[13] 刘雪莲, 申培立,牛丹丹,等.地衣芽胞杆菌α-淀粉酶耐热耐酸突变体的酶学性质[J].食品与发酵工业,2020,46(2):7-10.
LIU X L,SHEN P L,NIU D D,et al.Biochemical sharacterization of heat-and acid-resistant mutant of Bacillus licheniformis α-amylase[J].Food and Fermentation Industries,2020,46(2):7-10.
[14] SAMBROOK J,RUSSELL D W.Molecular cloning:A laboratory manual[M].New York:Cold Spring Harbour Laboratory Press,2001.
[15] ANAGNOSTOPOULOS C,SPIZIZEN J:Requirements for transformation in Bacillus subtilis[J].Journal of Bacteriol,1961,81:741-746.
[16] 徐敏,马骏双,王正祥.高参透压对细菌电转化率的影响[J].无锡轻工大学学报,2004(4):98-100.
XU M,MA J S,WANG Z X.Effect of high osmolarity on electrotransformation efficiency of bacteria[J].Journal of Wuxi University of Light Industry,2004(4):98-100.
[17] 诸葛健, 王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994.
ZHU G J,WANG Z X.Industrial Microbiology:a laboratory manual[M].Beijing:China Light Industry Press,1994.
[18] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[19] 中华人民共和国国家卫生和计划生育委员会.GB 1886.174—2016 食品安全国家标准 食品添加剂 食品工业用酶制剂[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission of the People’s Republic of China.GB 1886.174—2016 National standards for food safety food additives enzyme preparation for food industry[S].Beijing:China Standards Press,2016.