黄精(Polygonatum sibiricum),系百合科黄精属多年生草本植物的干燥根茎,是我国重要的药食同源性中药材,有着上千年的食用和药用历史。黄精富含多糖、皂苷、黄酮、木脂素等多种功能成分[1],其中多糖是黄精中主要活性物质。研究表明黄精多糖具有良好的抗氧化、抑菌、降血糖和免疫调节等作用[2-3],在医药、食品、化妆品等行业应用前景广阔。
黄精多糖的提取通常采用热水浸提法,该方法简单、易操作,但耗时长、提取率低,且长时间热处理容易引起多糖结构破坏[4]。自2003年ABBOTT等[5]首次提出低共熔溶剂(deep eutectic solvents,DESs)概念以来,DESs在生物活性成分的提取上的应用备受关注。DESs是一种新型、绿色的溶剂,性质类似离子液体,且价格低、易获得,具有较好的生物可降解性、稳定性,低毒或无毒[6],目前已被广泛应用于多酚[7]、黄酮[8]、多糖[9-10]的提取。DESs具有极强的溶解能力与极广的溶解范围,因此采用DESs提取植物中有效成分其提取率普遍高于传统溶剂,且生物活性也更强[11-12]。氯化胆碱-尿素(choline chloride-urea,CCU)是常用的DESs,其具有易制备、成本低、无毒等特点。STEFANOVIC等[13]采用量子力学和分子动力学模拟法,检测几类以氯化胆碱为供氢体的DESs的纳米结构,发现CCU比其他DESs具有更加完善的氢键网络,而氢键的形成是 DESs 影响活性成分提取率的重要因素。本课题组前期研究也表明,采用CCU提取淮山多糖,提取率显著高于热水浸提法[14]。然而,现有的文献多集中在如何利用DESs提高活性成分提取率[15],对其影响提取成分的理化性质、结构功能的研究却很少。
为揭示DESs对黄精多糖理化性质和功能特性的影响规律,本研究以多花黄精为原料,分别对CCU和热水提取的黄精多糖分子质量、单糖组成等基本性质进行分析,并比较2种方法提取的黄精多糖抗氧化能力和抑制晚期糖基化末端产物能力的差异,以期为黄精多糖的提取及开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
多花黄精(P.cyrtonema Hua,PcH),产自新化县绿源农林科技有限公司万宝山基地;葡聚糖标准品(Mw 1 152、11 600、23 800、48 600、80 900、148 000、273 000、409 800 Da)、鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖标准品、氨基胍(纯度≥98%),美国Sigma公司;荧光素钠、奎诺二甲基丙烯酸(水溶性维生素E,纯度为97%)、偶氮二异丁脒盐酸盐(AAPH,纯度为97%)、葡萄糖分析对照品(纯度≥99%),上海麦克林生化科技有限公司;1,1-二苯基-2-苦肼基自由基(DPPH,纯度>97%),梯希爱(上海)化成工业发展有限公司;2,2′-联氨-双 (3-乙基苯并噻唑啉-6-磺酸)二铵盐 (ABTS,纯度≥98%)、2,4,6-三吡啶基三嗪(TPTZ,纯度≥98%),上海瑞永生物科技有限公司;氯化胆碱、尿素、牛血清蛋白、硫酸、甲醇、乙醇等均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
AL204电子天平,梅特勒-托利多仪器(上海)有限公司;小型液氮冷冻低温粉碎机,上海净信有限公司;SCIENTZ-18 N冷冻干燥机,宁波新芝生物科技股份有限公司;冷冻离心机,长沙英泰仪器有限公司;PHS-3C pH计,上海精密科学仪器有限公司;H-8数显恒温水浴锅,上海浦东物理光学仪器厂;RE-2000B旋转蒸发器,巩义市予华有限责任公司;SHZ-D(Ⅲ)W循环水式多用真空泵,上海力辰邦西仪器科技有限公司;FJ-7200型可见分光光度计,尤尼柯(上海)仪器有限公司;Varioskan Flash多功能读数仪,美国赛默飞世尔科技有限公司;LC-10A高效液相色谱仪、QP2010plus气相色谱质谱联用仪、IRAffinity-1傅里叶红外光谱仪,日本岛津有限公司;JSM-6380LV扫描电子显微镜,日本电子株式会社;BRT105-104-102串联凝胶柱(8 mm×300 mm)、RXI-5 SIL MS色谱柱(30 m×0.25mm×0.25 μm),博瑞糖生物技术有限公司;RI-502SHODEX示差折光检测器,日本Shodex公司。
1.3 实验方法
1.3.1 黄精多糖的制备
原料处理:鲜黄精洗净、切片,60 ℃热风干燥至含水量<10%,由冷冻低温粉碎机研磨成细粉,密封保存备用。
参照中国药典(2015版)热水回流法提取黄精多糖[16]。准确称取10 g黄精粉于圆底烧瓶中,按料液比1∶30 (g∶mL)加入体积分数80%的乙醇热水回流1 h,趁热抽滤,将残渣置烧瓶中,按料液比1∶30(g∶mL)加入蒸馏水,置沸水浴中加热回流1 h,趁热抽滤,残渣重复提取1次,合并滤液,采用Sevage试剂[V(正丁醇)∶V(三氯甲烷)=1∶4]除蛋白,滤液经旋转蒸发至200 mL,加入4倍体积的无水乙醇于4 ℃冰箱醇沉12 h,离心(5 000 r/min,10 min),沉淀经冷冻干燥,得到水提黄精多糖(Polygonatum cyrtonema Hua polysaccharides extracted by water,WPcHP)。
参照文献[9]稍加改动,将氯化胆碱与尿素按摩尔比1∶2进行混合,设置含水量为30%,60 ℃水浴搅拌至完全溶解,配制成清澈透明的DESs,备用。准确称取10 g黄精粉于锥形瓶中,按料液比1∶30(g∶mL)加入DESs,放入90 ℃水浴锅中提取40 min,取出冷却后加入4倍体积无水乙醇于4 ℃冰箱醇沉12 h,离心,沉淀采用一定体积蒸馏水复溶,过滤除渣,滤液采用Sevage试剂除蛋白,旋转蒸发浓缩至200 mL,再次加入4倍体积无水乙醇,于4 ℃冰箱醇沉6 h,离心,沉淀经冷冻干燥,得到DESs提黄精多糖(Polygonatum cyrtonema Hua polysaccharides extracted by CCU,CCUPcHP)。
1.3.2 黄精多糖提取率计算
采用蒽酮硫酸法测定提取液中多糖含量[16]。以葡萄糖质量浓度为横坐标,吸光度为纵坐标,制作标准曲线,得到线性回归方程为y=0.134 2x+0.002 2,R2=0.999 6。将黄精多糖提取液稀释至一定质量浓度,按标准曲线制作步骤,于波长582 nm处测定吸光度。多糖提取率按公式(1)计算:
提取率![]()
(1)
式中:C,标准曲线计算出的黄精多糖质量浓度,mg/mL;V,样品体积,mL;N,稀释倍数;m1,黄精粉质量,g。
1.3.3 黄精多糖纯度(以总糖含量计)的测定
分别准确称取WPcHP、CCUPcHP各10 mg,配制成1 mg/mL的黄精多糖溶液,将其稀释至一定质量浓度后,按1.3.1中标准曲线制作步骤,采用蒽酮硫酸法测定所得黄精多糖的总糖含量,计为多糖纯度。多糖纯度按公式(2)计算:
多糖纯度![]()
(2)
式中:0.9,多糖校正系数;m2,黄精多糖质量,g。
1.3.4 分子质量测定
采用高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)测定黄精多糖的重均分子质量[17]。以不同分子质量的葡聚糖为标准品,绘制标准品重均分子质量的对数lgMw与保留时间的标准曲线,样品重均分子质量由保留时间根据标准曲线方程计算。
色谱条件:以去离子水作流动相,流速0.8 mL/min;进样量20 μL;柱温35 ℃。
1.3.5 单糖组成分析
准确称取2 mg黄精多糖,加入1 mL 2 mol/L的三氟乙酸水解90 min,减压浓缩蒸干,残基中加入2 mL双蒸水,待残基溶解后,加入100 mg硼氢化钠还原8 h,加入冰乙酸中和,置于110 ℃烘箱中烘干,烘干后加入1 mL乙酸酐在100 ℃下乙酰化1 h,冷却,然后加入3 mL甲苯,减压浓缩至蒸干,重复4次,除尽多余的乙酸酐。在得到的黄精多糖乙酰化产物中加入3 mL三氯甲烷溶解,转至分液漏斗,加入少量蒸馏水充分摇匀后,除去上层水溶液,重复4次。得到的三氯甲烷层用适量的无水硫酸钠干燥,定容至10 mL,采用气相色谱-质谱联用仪测定样品单糖组成[18]。
GC-MS条件:RXI-5 SIL MS色谱柱(30 m×0.25 mm×0.25 μm);程序升温条件:起始温度120 ℃,以3 ℃/min升温至250 ℃/min;保持5 min;进样口温度250 ℃,检测器温度250 ℃/min,载气为氦气,流速1 mL/min。
1.3.6 傅立叶红外光谱扫描
称取1 mg黄精多糖置于研钵中,加入100 mg干燥至恒重的KBr,研磨均匀,电动压片机压片,在波数4 000~400 cm-1范围内进行红外扫描。
1.3.7 多糖微观形态观察
取黄精多糖样品适量,铺于样品台上,喷金镀膜后置于扫描电子显微镜(scanning electron microscope,SEM)下观察并照相。
1.3.8 黄精多糖抗氧化活性的测定
氧自由基吸收能力(oxygen radical absorbance capacity, ORAC)法根据ZAR等[19]的方法进行;DPPH法与铁离子还原能力(ferric ion reducing antioxidant power, FRAP)法根据ZHAO等[4]的方法进行;ABTS法根据CHENG等[20]的方法进行。
1.3.9 黄精多糖抗糖基化能力的测定
参照杨生辉等[21]的方法,配制20 mg/mL的牛血清蛋白(bovine serum albumin,BSA)溶液与0.5 mol/L的葡萄糖(glucose,Glu)溶液,以体积比1∶1混合,备用。取3 mL BSA-Glu混合液,分别加入1 mL样品溶液和6 mL磷酸缓冲溶液,混合均匀,于恒温培养箱37 ℃孵育1周,以氨基胍(aminoguanidine,AG)为对照,测定糖基化终末产物(advanced glycation end-products,AGEs)在激发波长370 nm,发射波长440 nm处的荧光值,黄精多糖对AGEs生成的相对抑制率按公式(3)计算:
相对抑制率![]()
(3)
式中:Fc,对照组荧光值;Fs,样品荧光值;Fs1,反应体系中以磷酸缓冲溶液代替Glu样品的荧光值;Fs2,反应体系中以磷酸缓冲溶液代替BSA样品的荧光值
1.3.10 数据分析
试验数据均用“平均值±标准偏差”表示,采用Origin 8.5进行绘图,采用SPSS 19 LSD法进行方差分析,P<0.05为差异显著。
2 结果与分析
2.1 提取方法对黄精多糖提取率与纯度的影响
热水提取的黄精多糖提取率为(8.38±0.10)%,而采用DESs提取黄精多糖,提取率高达(28.50±0.04)%。相较于热水,DESs具有更出色的溶解能力,采用DESs提取黄精多糖可大大提高多糖的提取率。但CCUPcHP纯度为(65.99±0.55)%,显著低于WPcHP[(83.12±0.36)%],这可能是因为DESs溶解范围广,在提取多糖的同时,原料中有其他成分溶出,从而降低了多糖纯度。
2.2 提取方法对黄精多糖基本性质的影响
2.2.1 分子质量比较
WPcHP与CCUPcHP对应的HPGPC图谱非单一对称峰(图1),说明2种方法提取的黄精多糖为杂多糖[22]。WPcHP具有2个峰,其保留时间分别为37.428、42.785 min,由葡聚糖标准曲线方程计算可得到其重均分子质量分别为73 369、3 499 Da;而CCUPcHP具有的3个峰,保留时间分别在32.579、38.086、43.218 min,对应的重均分子质量分别为1 152 818、50 487、2 736 Da。2种方法提取所得黄精多糖分子质量差异较大,CCUPcHP分子质量分布范围更广,可能与DESs溶解能力强,能够降解热水所不能提出的多糖有关。
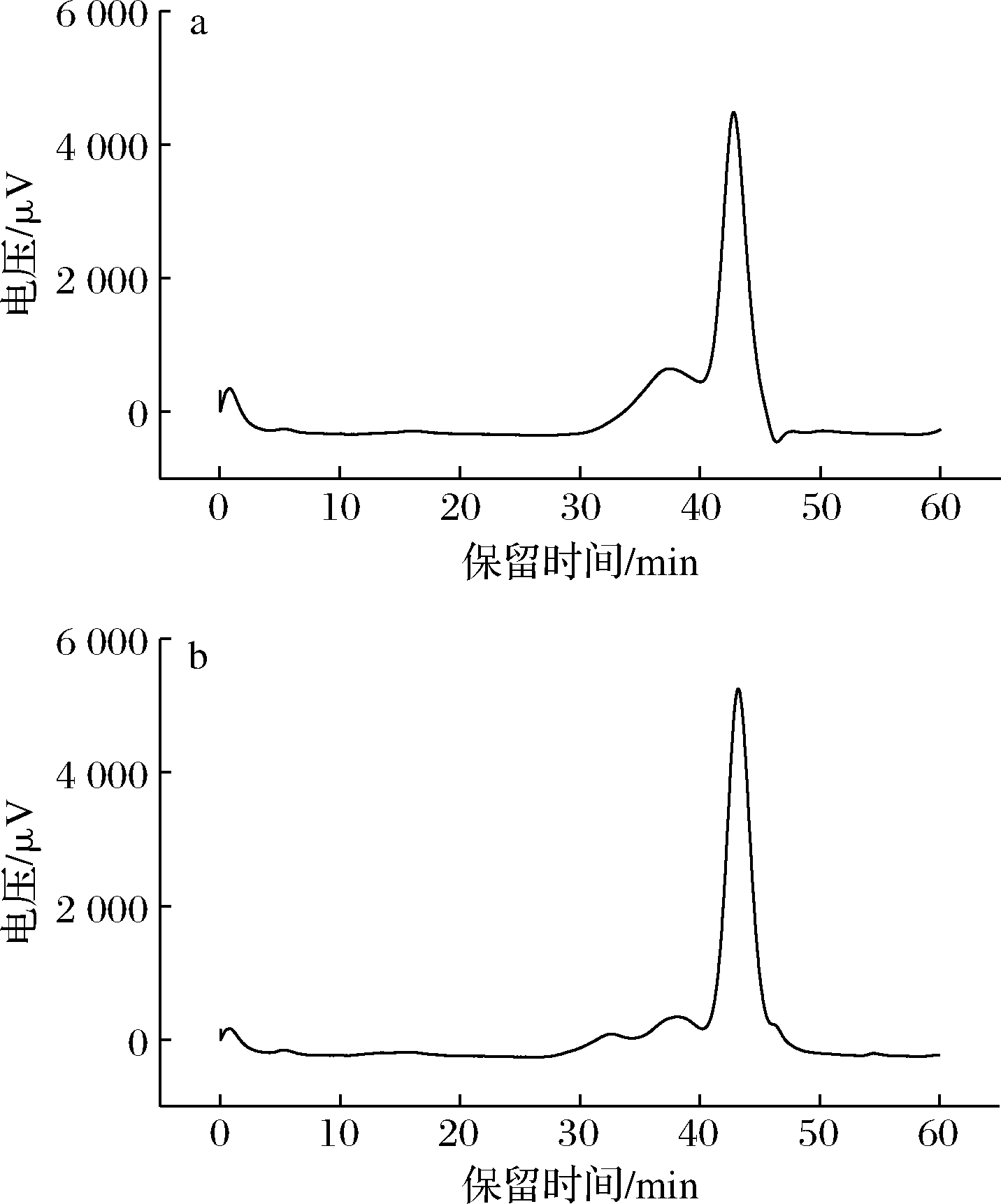
a-WPcHP;b-CCUPcHP
图1 黄精多糖高效凝胶渗透色谱图
Fig.1 HPGPC spectra of PcHP
2.2.2 单糖组成比较
将2种方法所提黄精多糖的GC-MS图谱与混合单糖标准品图谱进行对照。如图2所示,WPcHP有2种单糖出峰时间与标准品一致,表明其含有2种单糖,分析表明WPcHP主要由葡萄糖(95%)组成,并含有少量甘露糖(5%);CCUPcHP有6种单糖出峰时间与标准品一致,表明其含有6种单糖,其中甘露糖(42.3%)所占比例最大,葡萄糖次之(23.9%),半乳糖与阿拉伯糖分别占19.8%、11.9%,鼠李糖(1.3%)与木糖(0.9%)所占比例小。由DESs所提取的黄精多糖的单糖组分多于热水提取,可能与DESs溶解能力更强有关,从两者相对分子质量的差异也能得到印证(图1)。
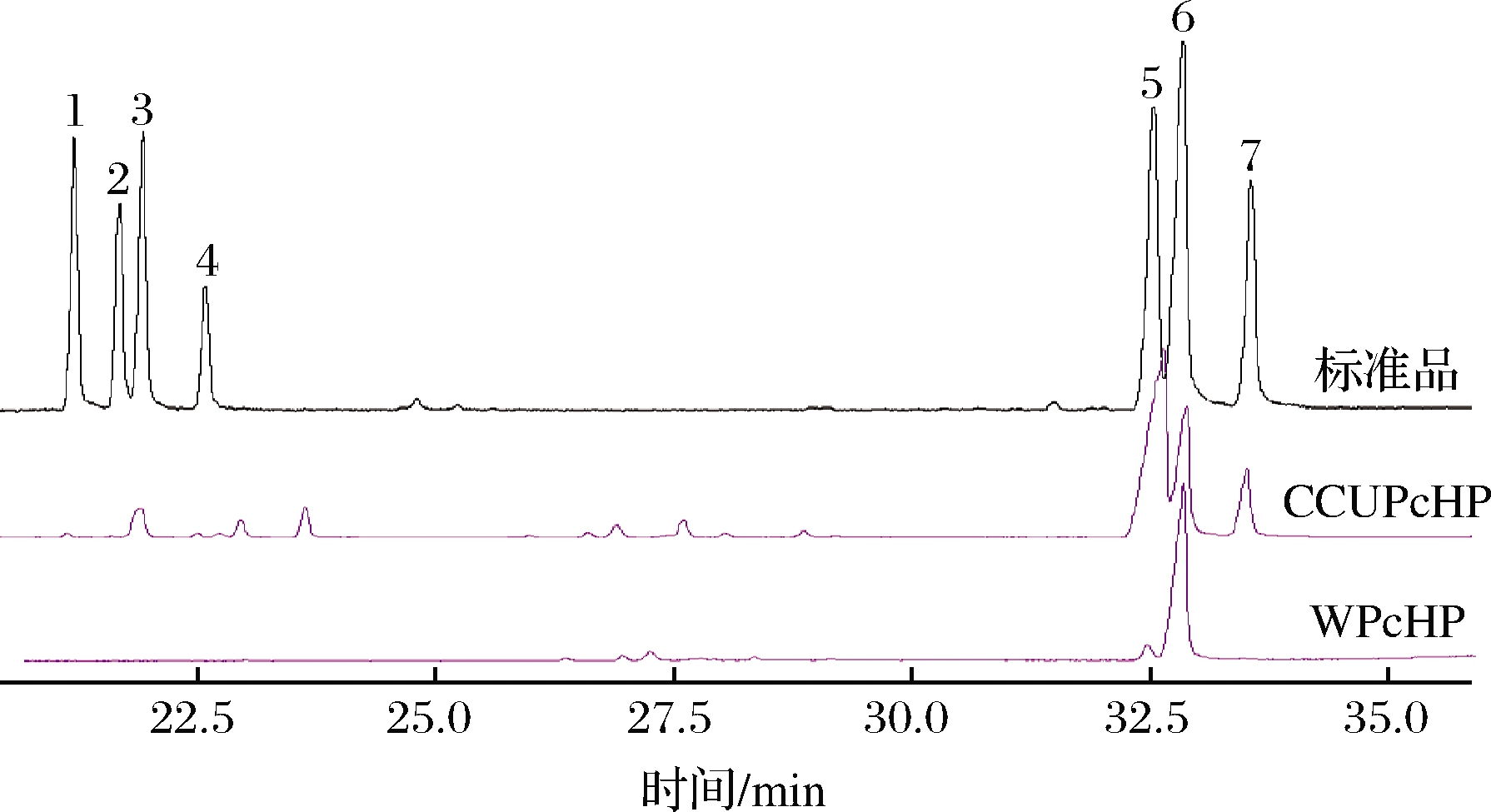
图2 黄精多糖GC-MS图谱
Fig.2 GC-MS spectra of PcHP
注:1~7分别为鼠李糖、岩藻糖、阿拉伯糖、木糖、
甘露糖、葡萄糖、半乳糖单糖标准品
单糖组成结果表明,黄精多糖主要由葡萄糖与甘露糖组成,但刘娜[23]的研究表明,黄精多糖的单糖组成以鼠李糖、半乳糖为主,甘露糖、葡萄糖与木糖含量相对较少,与本结果差异明显,原因可能是黄精产地不同以及本研究黄精多糖皆为粗多糖。
2.2.3 红外光谱比较
CCUPcHP与WPcHP具有相似的红外图谱,均含有典型的多糖特征吸收峰(图3)。在3 387.51和3 414 cm-1处有一个宽展圆滑的强吸收峰为分子内羟基O—H或分子间氢键的伸缩振动,2 931.80 和2 933.73 cm-1处的弱吸收峰为甲基或亚甲基的C—H键的伸缩振动,这都是多糖的特征吸收峰。1 741.72和1 739.79 cm-1附近的弱吸收峰为C![]() O 酰胺羰基的伸缩振动,1 666.49、1 622.13、1 631.78及1 244.08、1 253.73 cm-1附近的峰为—COOH的C
O 酰胺羰基的伸缩振动,1 666.49、1 622.13、1 631.78及1 244.08、1 253.73 cm-1附近的峰为—COOH的C![]() O键对称与非对称伸缩振动,表明CCUPcHP与WPcHP均为酸性多糖[24-25]。1 300~800 cm-1为指纹区域,出峰归因于分子振动和分子结构,1 026.13和1 029.99 cm-1处的强吸收峰为吡喃糖的特征峰,说明CCUPcHP、WPcHP均为吡喃糖,810.10 和808.17 cm-1处的弱吸收峰表明CCUPcHP与WPcHP含α糖苷键,而WPcHP在931.62 cm-1处的弱吸收峰表明其也含有β糖苷键[26]。
O键对称与非对称伸缩振动,表明CCUPcHP与WPcHP均为酸性多糖[24-25]。1 300~800 cm-1为指纹区域,出峰归因于分子振动和分子结构,1 026.13和1 029.99 cm-1处的强吸收峰为吡喃糖的特征峰,说明CCUPcHP、WPcHP均为吡喃糖,810.10 和808.17 cm-1处的弱吸收峰表明CCUPcHP与WPcHP含α糖苷键,而WPcHP在931.62 cm-1处的弱吸收峰表明其也含有β糖苷键[26]。
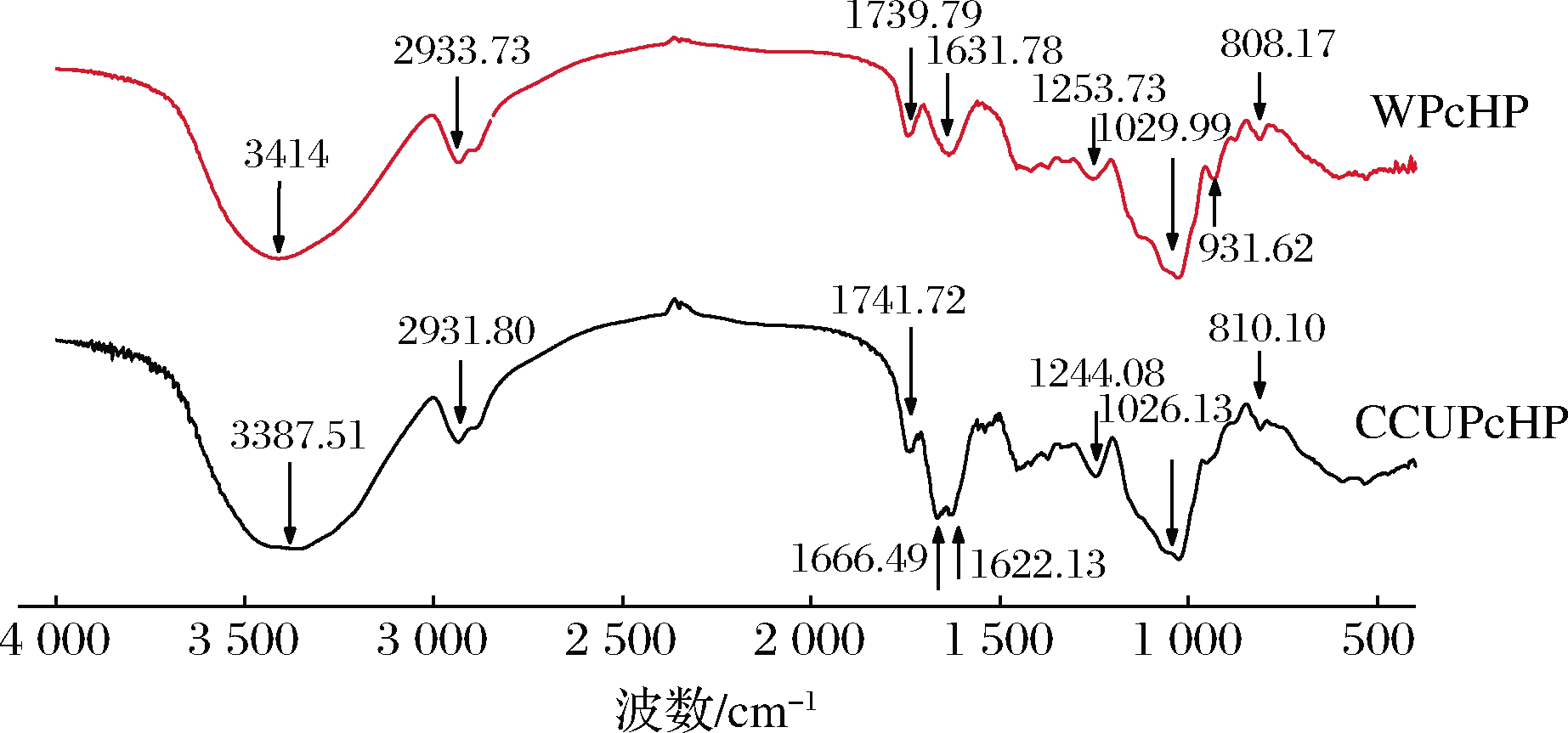
图3 两种方法提取所得黄精多糖红外光谱图比较
Fig.3 FTIR spectra of PcHP extracted with two solvents
2.2.4 微观结构比较
SEM常用于观察物质的表面形态结构,通过电子束对样品表面进行扫描,从而获得样品表面的三维空间信息[27]。如图4 所示,同一放大倍数下,2种方法提取所得黄精多糖表面结构均较疏松,为多网孔片状结构,但CCUPcHP片状结构更粗,表面更光滑(图4-b),而WPcHP表现为表面粗糙和具有更多不规则的碎片(图4-a)。王艺[28]在研究黄精多糖结构表征中发现,黄精多糖SEM图有多网孔片状、多分支链聚集与网链结构3种,而本研究只发现多网孔片状结构。

a-WPcHP;b-CCUPcHP
图4 两种方法提取所得黄精多糖扫描电镜图
Fig.4 SEM micrographs of PcHP extracted with two solvents
2种提取方法黄精多糖微观结构的不同可能与提取条件的作用强度有关,采用DESs提取黄精多糖,作用条件较热水温和,多糖结构所受的破坏较小。ZHAO等[4]研究表明不同提取方式对淮山多糖的微观结构影响较大,其中采用温水提取的多糖表面形貌为有规律的、光滑均一的形态,而超声辅助提取的多糖表现为表面粗糙的小颗粒块状。
2.3 提取方法对黄精多糖抗氧化活性影响
2.3.1 ORAC值与 FRAP值的比较
ORAC法最接近真实生理环境氧化过程,它具有可操作性强、灵敏度高等优点,被广泛应用于食品中功能成分抗氧化能力的检测[29]。如图5所示,CCUPcHP的ORAC值(170.99±6.88)μmol/g显著大于WPcHP(35.82±3.22)μmol/g,表明CCUPcHP抗氧化能力显著强于WPcHP。
酸性条件下,Fe3+在TPTZ溶液中呈橘黄色,在遇到抗氧化物质后,Fe3+被还原成Fe2+,使溶液成蓝色,蓝色越深则表明抗氧化能力越强。如图5 所示,2种方法所得黄精多糖均具一定的铁离子还原能力,但CCUPcHP的FRAP值显著大于WPcHP,说明CCUPcHP的铁离子还原能力显著优于WPcHP。
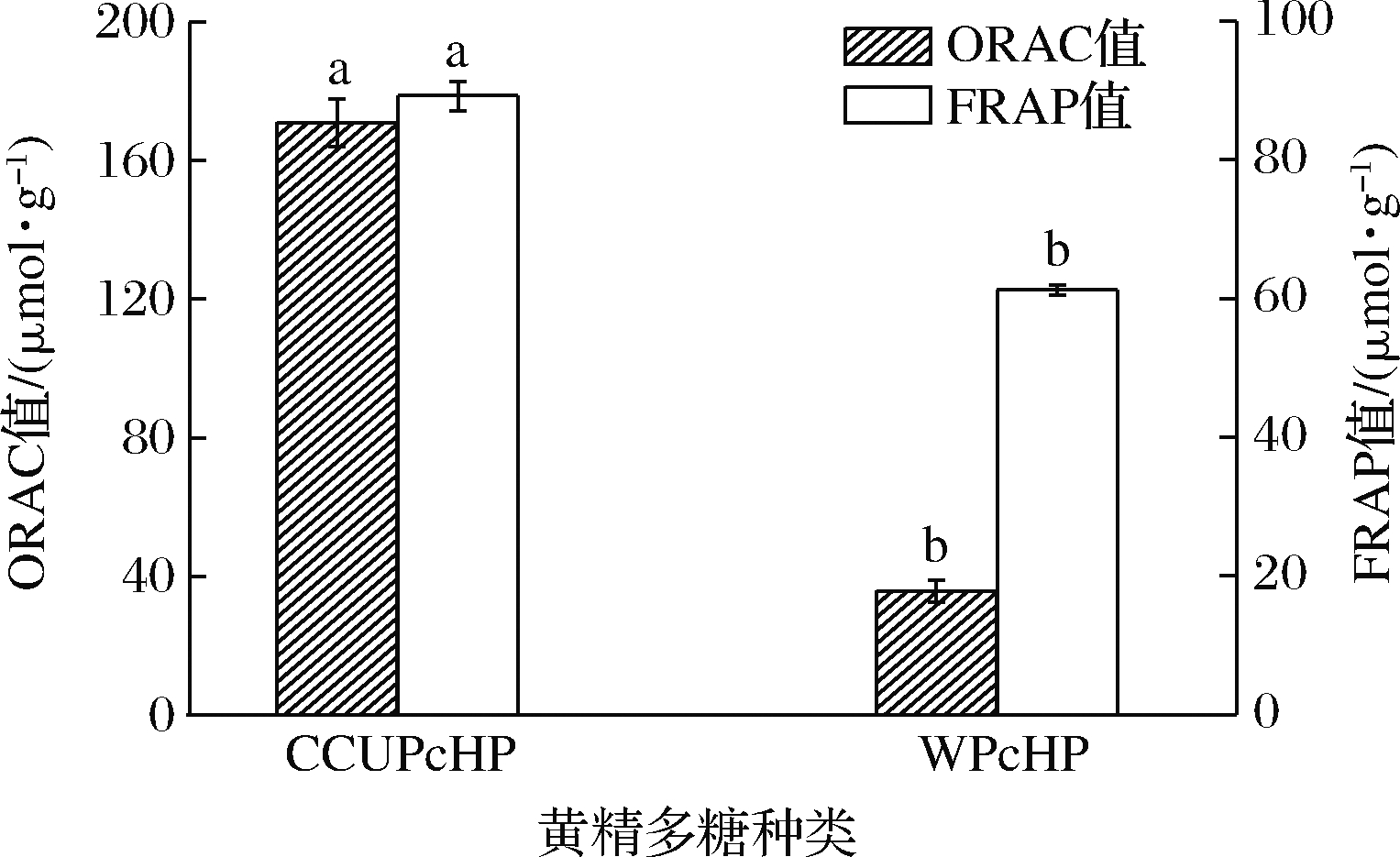
图5 两种方法提取所得黄精多糖ORAC值与FRAP值比较
Fig.5 The ORAC and FRAP value of PcHP extracted with two solventsed
2.3.2 DPPH自由基清除能力比较
如图6所示,2种方法提取所得黄精多糖对DPPH自由基具有一定的清除能力,清除效果具有明显的质量浓度依赖性,与Vc相比,多糖的清除效果显著低于Vc。多糖质量浓度<5 mg/mL时,DPPH自由基清除率<10%,随着浓度的增大,清除率不断上升。多糖质量浓度为20 mg/mL时,WPcHP对DPPH自由基的清除率为32.05%,CCUPcHP的清除率为36.35%,表明在较高浓度时,CCUPcHP对DPPH自由基清除能力强于WPcHP。
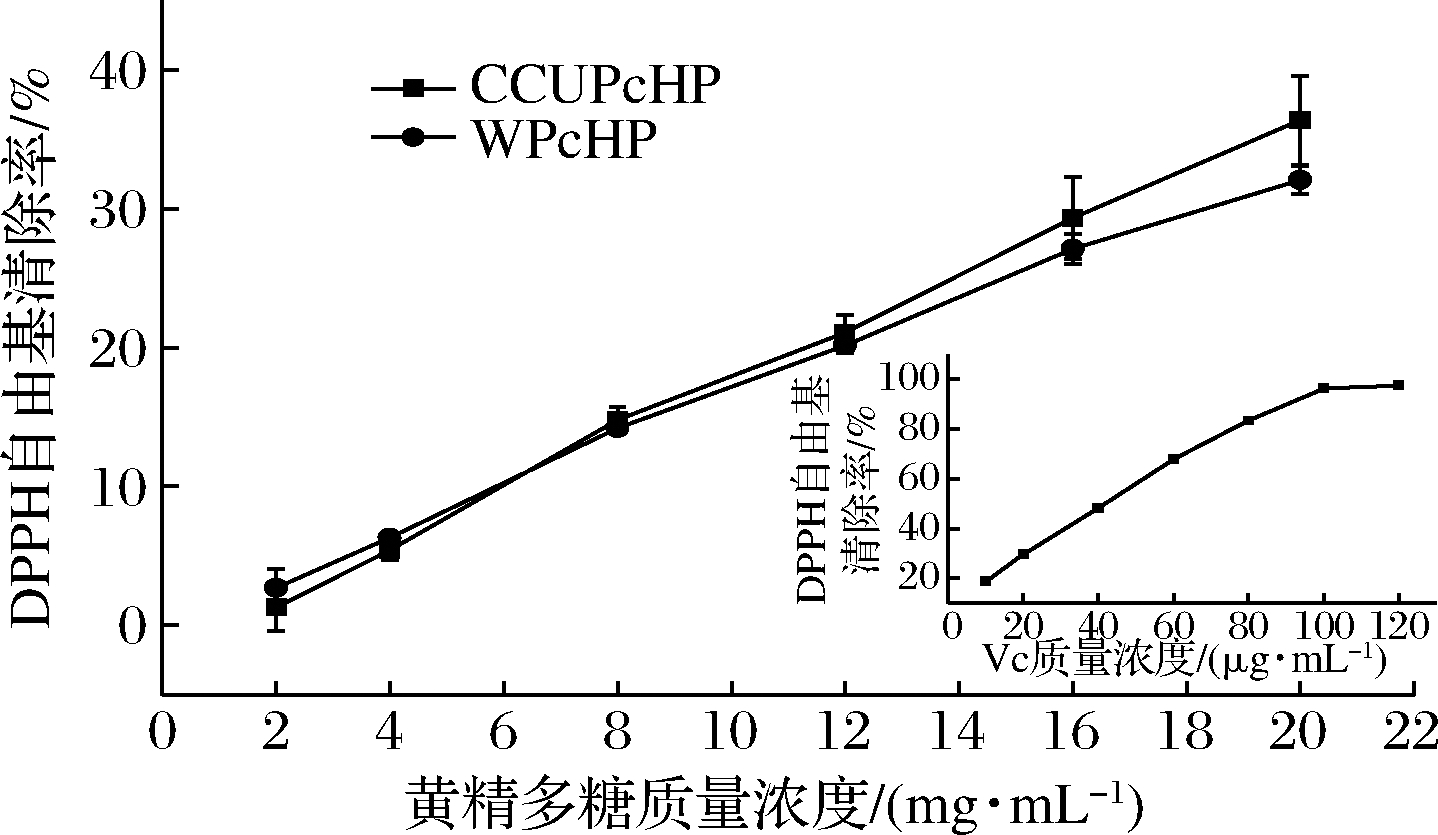
图6 两种方法提取所得黄精多糖DPPH自由基清除能力比较
Fig.6 DPPH free radical scavenging capacity of PcHP extracted with two solvents
2.3.3 ABTS阳离子自由基清除能力比较
如图7所示,随着黄精多糖质量浓度增大,其对ABTS阳离子自由基的清除率也不断增大,多糖的ABTS阳离子自由基清除效果显著低于Vc。CCUPcHP对ABTS阳离子自由基的清除能力显著强于WPcHP,在多糖质量浓度为8 mg/mL时,CCUPcHP的清除能力>60%,相同质量浓度下,WPcHP的清除能力为49.7%。当CCUPcHP质量浓度增至16 mg/mL时,清除率达95.33%,趋于平缓;而WPcHP质量浓度增至20 mg/mL时,清除率为89.78%。
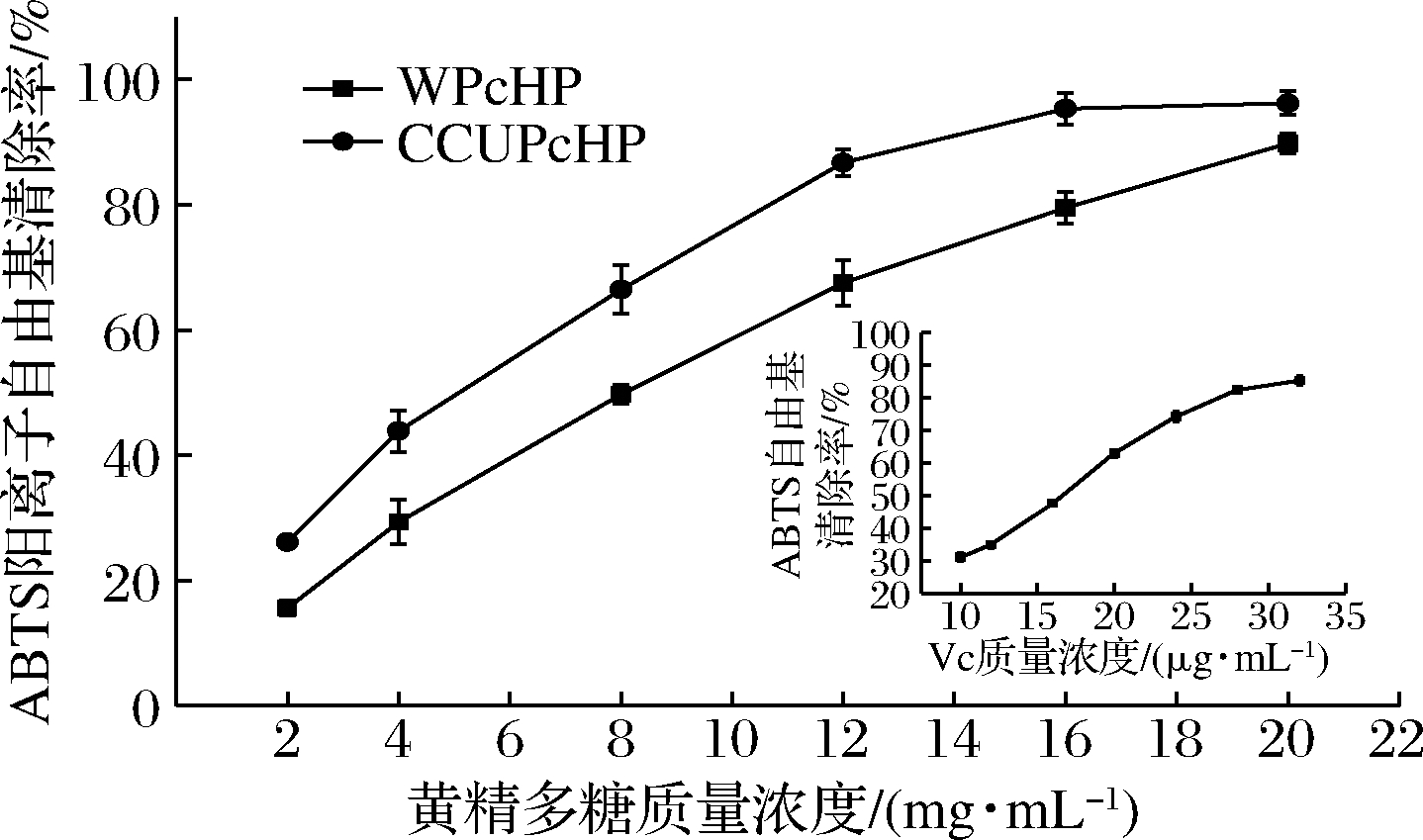
图7 两种方法提取所得黄精多糖ABTS阳离子
自由基清除能力比较
Fig.7 ABTS free radical scavenging capacity of PcHP extracted with two solvents
2.4 提取方法对黄精多糖抗糖基化活性的影响
AGEs可在人体内自发生成并累积,与人体糖尿病、阿尔兹海默症以及心脑血管疾病的发生密切相关[30]。由图8可知,尽管2种方法提取得到的黄精多糖对BSA-Glu体系中AGEs生成的抑制作用均低于同浓度阳性对照AG,但也显示出其对AGEs生成具有良好的抑制作用,抑制效果具有明显浓度依赖性。CCUPcHP抑制AGEs生成能力显著高于WPcHP。当质量浓度为2 mg/mL时,CCUPcHP和WPcHP对AGEs的抑制能力分别达到78.01%和73.14%,均有望用于生产天然、安全的AGEs抑制剂或相关的功能食品。
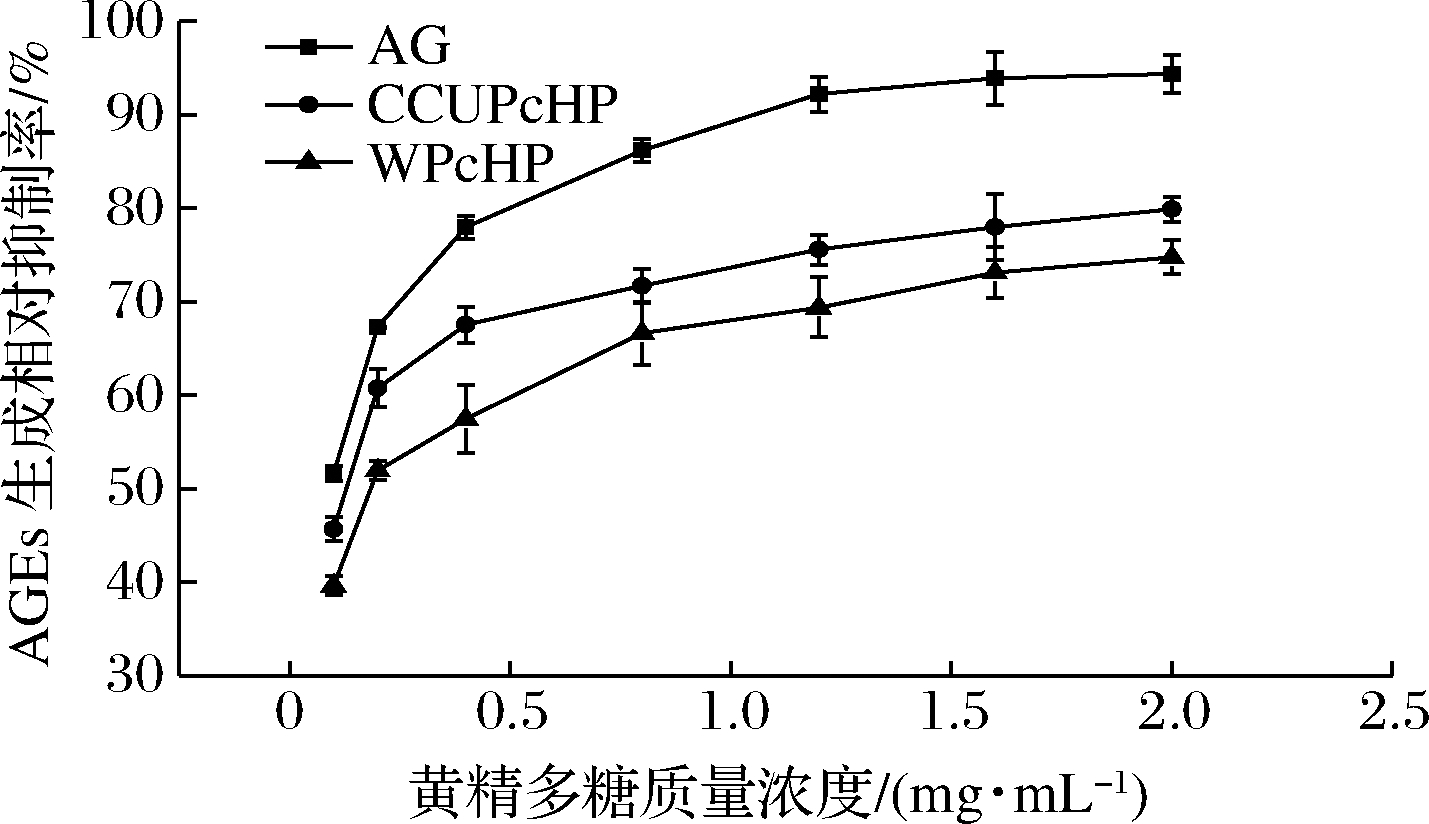
图8 两种方法提取所得黄精多糖抑制AGEs生成能力比较
Fig.8 AGEs inhibition rates of PcHP in BSA-Glu model extracted with two solvents
3 结论
DESs比热水具有更强的黄精多糖溶出能力,采用DESs提取黄精多糖,提取率高达28.50%,为热水提取的3.40倍,但由DESs提取的黄精多糖(CCUPcHP)纯度显著低于热水提取的黄精多糖(WPcHP)。
不同提取溶剂对黄精多糖基本性质与生物活性的影响较大。CCUPcHP的分子质量与单糖组成跟WPcHP相比差异显著,CCUPcHP含有甘露糖、葡萄糖、半乳糖、阿拉伯糖、鼠李糖、木糖等6种单糖,而WPcHP仅含甘露糖与葡萄糖。2种方法提取所得黄精多糖表面结构均较疏松,为多网孔片状结构,但CCUPcHP片状结构更粗,主要呈现出有规律的光滑片状,而WPcHP表现为表面粗糙的碎片状。
通过4种不同的抗氧化方法测定黄精多糖的抗氧化活性,结果均表明,CCUPcHP抗氧化能力显著强于WPcHP;抗糖基化结果表明,2种方法提取所得黄精多糖对AGEs的生成均具有良好的抑制作用,在相同质量浓度下,CCUPcHP抗糖基化能力显著高于WPcHP。
[1] TANG C,YU Y M,GUO P,et al.Chemical constituents of Polygonatum sibiricum[J].Chemistry of Natural Compounds,2019,55:331-333.
[2] LI L,THAKUR K,LIAO B Y,et al.Antioxidant and antimicrobial potential of polysaccharides sequentially extracted from Polygonatum cyrtonema Hua[J].International Journal of Biological Macromolecules,2018,114:317-323.
[3] 李玲.连续制备的多花黄精多糖的理化性质及活性研究[D].合肥: 合肥工业大学,2018.
LI L.Studies on the physicochemical properties and activities of polysaccharides sequentially extracted from Polygonatum cyrtonema Hua[D].Hefei:Hefei University of Technology,2018.
[4] ZHAO C C,LI X,MIAO J,et al.The effect of different extraction techniques on property and bioactivity of polysaccharides from Dioscorea hemsleyi[J].International Journal of Biological Macromolecules,2017,102:847-856.
[5] ABBOTT A P,CAPPER G,DAVIES D L,et al.Novel solvent properties of choline chloride/urea mixtures[J].Chemical Communications.2003,9(1):70-71.
[6] DAI Y T,VAN SPRONSEN J,WITKAMP G J,et al.Natural deep eutectic solvents as new potential media for green technology[J].Analytica Chimica Acta,2013,766:61-68.
[7] BUBALO M C,CURKO N,TOMASEVIC M,et al.Green extraction of grape skin phenolics by using deep eutectic solvents[J].Food Chemistry,2016,200(JUN.1):159-166.
[8] QI X L,PENG X,HUANG Y Y,et al.Green and efficient extraction of bioactive flavonoids from Equisetum palustre L.by deep eutectic solvents-based negative pressure cavitation method combined with macroporous resin enrichment[J].Industrial Crops & Products,2015,70:142-148.
[9] 梁静.基于深度共熔溶剂提取铁皮石斛多糖及其生物活性的评价[D].广州: 华南理工大学,2018.
LIANG J.Extraction and bioactivity of polysaccharides from Dendrobium officinale by deep eutectic solvents[D].Guangzhou:South China University of Technology,2018.
[10] ZDANOWICZ M,WILPISZEWSKA K,SPYCHAJ T.Deep eutectic solvents for polysaccharides processing.A review[J].Carbohydrate Polymers,2018,200:361-380.
[11] 徐凯佳.低共熔溶剂应用于生物大分子的分离分析研究[D].长沙: 湖南大学,2018.
XU K J.The application of deep eutectic solvent in the separation and analysis of biomacromolecules[D].Changsha: Hunan University,2018.
[12] 周立锦,董哲,杜会枝.低共熔溶剂在中药成分提取中的研究进展[J].中草药,2020,51(1):236-244.
ZHOU L J,DONG Z,DU H Z.Research progress on deep eutectic solvents in extraction of Chinese materia medica ingredients[J].Chinese Traditional and Herbal Drugs,2020,51(1):236-244.
[13] STEFANOVIC R,LUDWIG M,WEBBER G B,et al.Nanostructure,hydrogen bonding and rheology in choline chloride deep eutectic solvents as a function of the hydrogen bond donor [J].PhyChem Chem Phy,2017,19(4):3 297-3 306.
[14] 张锦钰.低共熔溶剂提取淮山多糖及其结构、生物活性研究[D].长沙: 湖南农业大学,2020.
ZHANG J Y.Study on structure ad bioactivity of polysaccharides extracted from Chinese Yam using deep eutectic solvents[D].Changsha:Hunan Agricultral University,2020.
[15] ZHANG L,WANG M .Optimization of deep eutectic solvent-based ultrasound-assisted extraction of polysaccharides from Dioscorea opposita Thunb[J].International Journal of Biological Macromolecules,2017,95:675-681.
[16] 张静,任菲菲,郑艳青,等.中华人民共和国药典[M].第一部.北京: 中国医药科技出版社,2015.
ZHANG J,REN F F,ZHENG Y Q,et al. Chinese pharmacopoeia[M].Part One.Beijing:China Medical Science and Technology Press,2015.
[17] LI X,WANG L,WANG Z.Structural characterization and antioxidant activity of polysaccharide from,Hohenbuehelia serotina[J].International Journal of Biological Macromolecules,2017,98:59-66.
[18] XU Y Q,CAI F,YU Z Y,et al.Optimisation of pressurised water extraction of polysaccharides from blackcurrant and its antioxidant activity[J].Food Chemistry,2016,194:650-658.
[19] ZAR P P K,MORISHITA A,HASHIMOTO F,et al.Anti-inflammatory effects and molecular mechanisms of loquat (Eriobotrya japonica) tea[J].Journal of Functional Foods,2014,6:523-533.
[20] CHENG H R,FENG S L,JIA X J,et al.Structural characterization and antioxidant activities of polysaccharides extracted from Epimedium acuminatum.[J].Carbohydr Polym,2013,92(1):63-68.
[21] 杨生辉,陈海亮,王文琴,等.玉米须总黄酮抗糖基化、乙酰胆碱酯酶和α-葡萄糖甘酶抑制活性分析[J].天然产物研究与开发,2019,31(7):1 230-1 239;1 264.
YANG S H,CHEN H L,WANG W Q,et al.Antiglycation activity,acetylcholine esterase and α-glucosidase inhibitory activity of total flavonoids from corn silk [J].Natural Product Research and Development,2019,31(7):1 230-1 239;1 264.
[22] 丁侃.中药多糖结构与功能及其机制[M].北京: 科学出版社,2016.
DING K.Structure,function and mechanism of polysaccharides in traditional Chinese medicine[M].Beijing:Science Press,2016.
[23] 刘娜.黄精多糖的分离、鉴定及免疫调节功效研究[D].济南: 山东大学,2017.
LIU N.Isolation,identification and study on the immunomodulatory effect of polysaccharide from Polygonatum sibiricum[D].Jinan:Shandong University,2017.
[24] MIN L,WANGJINSONG Y,YONGFA Z,et al.Characterization,antioxidant and antiinflammation of mycelia selenium polysaccharides from Hypsizygus marmoreus SK-03[J].Carbohydrate Polymers,2018,201:566-574.
[25] 方园.黄精多糖和低聚糖的分离与结构解析[D].无锡: 江南大学,2011.
FANG Y.Extraction,structural investigation of polysaccharides and oligasaccharides from Polygonatum sibiricum redoute[D].Wuxi:Jiangnan University,2011.
[26] CHEN W B,ZHU X L,MA J J,et al.Structural elucidation of a novel pectin-polysaccharide from the petal of Saussurea laniceps and the mechanism of its anti-HBV activity[J].Carbohydrate Polymers,2019,223:115 077.
[27] ZHU Y P,YANG L,ZHANG C N,et al.Structural and functional analyses of three purified polysaccharides isolated from Chinese Huaishan-yams[J].International Journal of Biological Macromolecules,2018,120:693-701.
[28] 王艺.黄精、滇黄精多糖的结构表征与降血糖活性分析[D].西安: 陕西师范大学,2019.
WANG Y.Structure characterization and hypoglycemic activity analysis of polysaccharides from Polygonatum sibiricum Red.and Polygonatum kingianum Coll.et Hemsl[D].Xi’an: Shaanxi Normal University,2019.
[29] 张迪,籍保平,周峰,等.食品体外抗氧化能力评价方法探讨[J].北京工商大学学报(自然科学版),2012,30(1):20-25.
ZHANG D,JI B P,ZHOU F,et al.Advances in antioxidant activity assessment assays for food[J].Journal of Beijing Technology and Business University(Natural Science Edition),2012,30(1):20-25.
[30] 范智义,袁晓金,贾本盼,等.天然酚类化合物对晚期糖基化末端产物抑制作用研究进展[J].中国食品学报,2019,19(3):306-316.
FAN Z Y,YUAN X J,JIA B P,et al.Research progress of inhibitory effect of natural-derived phenolic compounds on advanced glycation end products[J].Journal of Chinese Institute of Food Science and Technology,2019,19(3):306-316.