透明质酸(hyaluronic acid,HA)是由D-葡萄糖醛酸和N-乙酰氨基葡糖的双糖单位聚合而成的酸性黏多糖,通过β-1,3和β-1,4糖苷键连接[1]。由于其独特的流变学特性、生物相容性及非免疫原性,被广泛应用于医药、化妆品和保健食品等领域[2-3]。随着需求量的日益增大,HA的市场价值预计在2025年会达到154亿美元[4]。目前,HA主要有2种生产方法,即动物组织提取法和微生物发酵法。微生物发酵生产较传统提取法有不受动物原料资源限制、易于大规模生产、无动物源致病病毒感染的危险和分离纯化成本低等优点[5-6],已成为工业化生产HA的主要方式。在工业上,HA的常用生产菌株为兽疫链球菌和马链球菌[7],产量可达到6~7 g/L[8],但同时产生透明质酸酶和链球菌溶血素,其中透明质酸酶会降低HA的产量[9],链球菌溶血素可引起溶血[10]。近年来,以安全的(generauy recognized as safe,GRAS)微生物菌株为生产菌株发酵生产HA,成为一种比较理想的替代选择[11]。如枯草芽孢杆菌[12]、乳酸菌[13]、大肠杆菌[14]和谷氨酸棒杆菌[15]等,但是重组菌株的HA生产成本相对较高[4]。IZAWA等[16-17]通过GRAS菌株嗜热链球菌发酵生产HA,优化发酵条件后的HA产量为208 mg/L。由于此类GRAS菌株的HA产量较低,这极大地限制了工业应用。因此,通过菌株的诱变选育和发酵工艺的优化来提高GRAS菌株的HA产量势在必行。
本研究以实验室保藏GRAS透明质酸产生菌株Bacillus velezensis Z1为出发菌株,通过紫外诱变,筛选出高产HA且稳定性良好的突变株,对其摇瓶发酵的培养基成分与发酵条件进行优化,以期进一步提高其HA产量。
1 材料与方法
1.1 材料
1.1.1 菌株
贝莱斯芽孢杆菌(Bacillus velezensis)Z1,本实验室保藏,从猪鼻黏膜中分离得到。
1.1.2 培养基
血琼脂平板培养基(g/L):牛肉浸膏10.0,胰蛋白胨5.0,NaCl 5.0,琼脂15.0,pH值为7.0,在121 ℃下灭菌20 min,待冷却至50 ℃,在无菌条件下加入5%无菌脱纤维羊血。
透明质酸培养基(g/L):胰蛋白胨15.0,酵母粉5.0,K2HPO4·3H2O 2.0,MgSO4·7H2O 0.5,HA 1.0,琼脂20.0,pH值为7.0,在121 ℃下灭菌20 min。
种子培养基(g/L):葡萄糖12.5,酵母浸膏12.5,胰蛋白胨12.5,MgSO4·7H2O 0.5,KH2PO4 2.0,pH值为7.0,在121 ℃下灭菌20 min。
发酵基础培养基(g/L):葡萄糖40.0,牛肉浸膏10.0,胰蛋白胨10.0,MgSO4·7H2O 1.0,KH2PO4 2.0,pH值为7.0,在121 ℃下灭菌20 min。
1.2 实验方法
1.2.1 培养方法
种子培养:挑取2~3环初始菌株,接入装有50 mL种子培养基的250 mL锥形瓶中,150 r/min,37 ℃振荡培养。
摇瓶发酵:按体积分数10%的接种量将种子液接入装有100 mL发酵培养基的500 mL锥形瓶中,150 r/min,37 ℃振荡培养。
1.2.2 紫外诱变实验
(1)菌悬液的制备:将菌株Z1接入种子培养基中培养12 h,菌液经4 200 r/min离心10 min,弃上清液,用无菌生理盐水洗涤2次,再重悬于无菌生理盐水中,调整菌悬液浓度至107 CFU/mL,并放在无菌环境中保存备用[18]。
(2)紫外诱变与突变株的筛选:紫外灯功率为30 W,照射距离为30 cm,需提前预热20 min。将5 mL的菌悬液和无菌回形针放入直径为6 cm的无菌培养皿中,并置于磁力搅拌器上搅拌。照射时间分别为0、20、40、50、60、70、80、100 s。诱变结束后,倒入新的种子培养基,在暗室内37 ℃静置培养12 h,以避免光复活对诱变的影响[19]。将所得菌液梯度稀释至10-4~10-6倍,各取100 μL涂布于血琼脂平板上,在避光条件下,37 ℃培养24 h。按公式(1)计算致死率[20]:
致死率![]()
(1)
在血琼脂平板上挑取菌落直径与黏度较大的菌株,再划线于透明质酸平板上,选取不产生透明圈的单菌落,种子培养14 h,摇瓶发酵16 h,测定HA产量,筛选出产量较高菌株。
(3)突变株的传代稳定性实验:将筛选到的突变株作为第1代接种到血琼脂平板上,传代至第4代,并测定摇瓶发酵后的HA产量,进一步筛选出产量较高且稳定的突变株。
1.2.3 发酵工艺的优化
1.2.3.1 发酵培养基成分的优化
将HA产量较高且稳定的突变株接入种子培养基,种子培养14 h,再摇瓶发酵24 h,测定HA产量。
单因素试验:
(1)碳源:以初始发酵培养基为基础,改变其中的葡萄糖质量浓度(20、40、60、80、100 g/L),测定HA产量。
(2)氮源:以初始发酵培养基为基础,选择胰蛋白胨和牛肉浸膏进行复配[21],测定HA产量。
(3)无机盐:以初始发酵培养基为基础,分别考察MgSO4·7H2O质量浓度(0.5、1.0、1.5、2.0、2.5 g/L)和KH2PO4质量浓度(1.0、1.5、2.0、2.5、3.0 g/L)对HA产量的影响。
响应面优化:
在发酵培养基成分单因素试验的基础上,根据Box-Behnken设计原理,选取葡萄糖质量浓度、胰蛋白胨质量浓度、牛肉浸膏质量浓度和MgSO4·7H2O质量浓度4个因素,HA产量为响应值,进行响应面试验。
1.2.3.2 发酵条件的优化
单因素试验:
(1)装液量:在培养基成分优化的基础上,以不同的装液量(60、80、100、120、140 mL)装入锥形瓶中,测定HA产量。
(2)初始pH值:在培养基成分优化的基础上,改变发酵培养基的初始pH值(6.2、6.6、7.0、7.4、7.8),测定HA产量。
(3)温度:在培养基成分优化的基础上,调整发酵温度(31、33、35、37、39 ℃),测定HA产量。
(4)摇床转速:在培养基成分优化的基础上,调整摇床转速(50、100、150、200 r/min),测定HA产量。
正交优化:
根据发酵条件单因素试验结果,确定装液量、初始pH值、温度和摇床转速的因素水平,进行4因素3水平的正交优化试验。
1.2.4 HA产量的测定
参照Bitter-Muir法[22]。取5 mL发酵液,4 200 r/min离心15 min,上清液加入2倍体积的无水乙醇,4 ℃静置1 h,再次离心取沉淀,加入一定体积的去离子水,振荡溶解,然后进行HA产量的测定。
1.2.5 数据处理
每组试验均有3个平行。采用软件Design-Expert V 8.0.6进行响应面的数据分析与处理。采用软件SPSS Statistics 21.0进行正交试验设计与处理。采用Origin Pro 9.0软件绘图。
2 结果与分析
2.1 紫外诱变
2.1.1 紫外诱变时间的确定
由图1可知,随着紫外照射时间的增加,菌株致死率也在不断提高。据文献报道,致死率一般应控制在80%~90%为宜[23]。当照射时间为60 s时,菌株致死率为82.88%,70~100 s时,致死率均在90%以上。因此,确定紫外照射时间60 s为菌株Z1的最佳诱变时间。
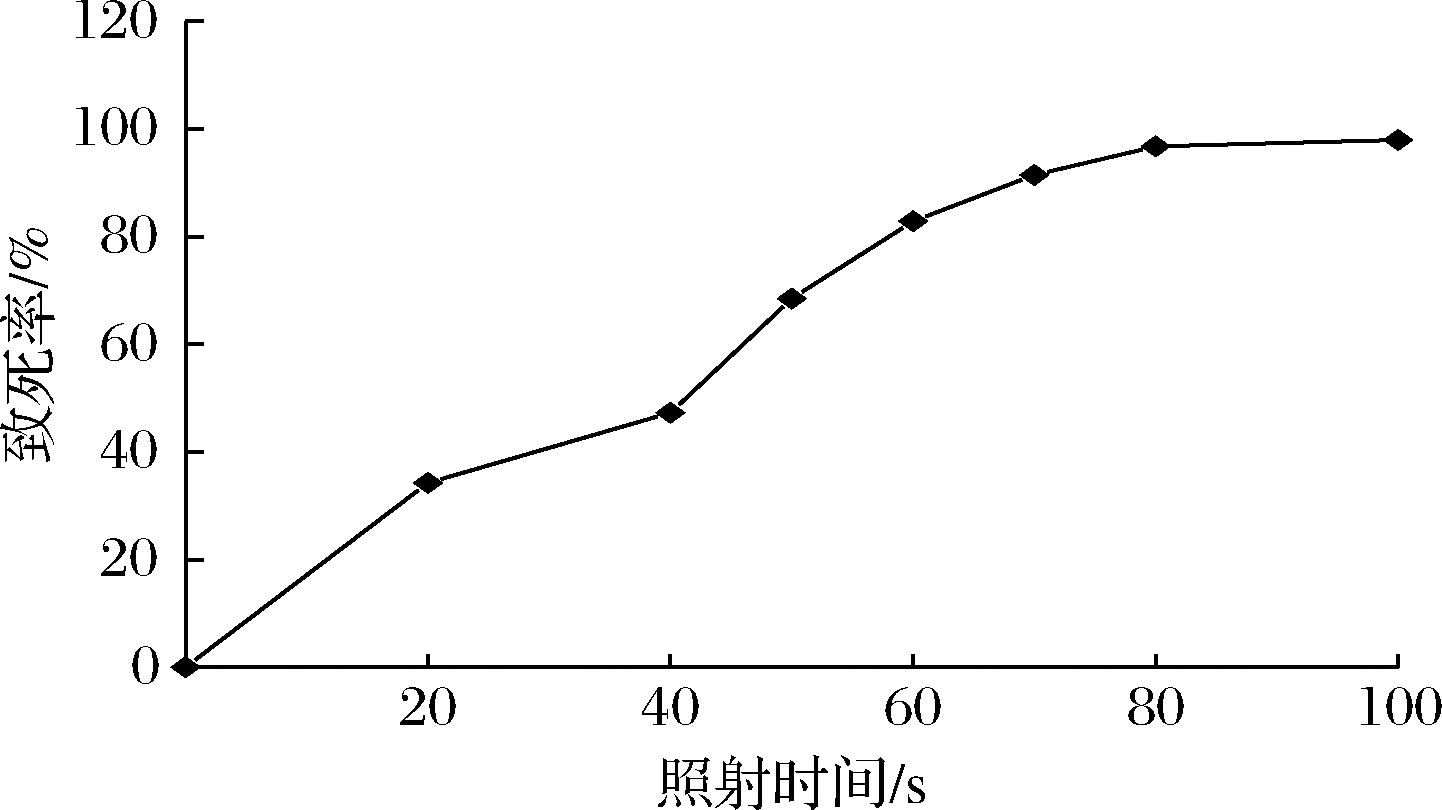
图1 紫外诱变时间对B.velezensis Z1致死率的影响
Fig.1 Effect of UV mutation time on the mortality of B.velezensis Z1
2.1.2 高产HA突变株的筛选
菌株Z1的菌悬液经过紫外照射60 s后,涂布于血琼脂平板37 ℃培养24 h。在血琼脂平板上挑取菌落直径较大、黏度较大的单菌落[5,24],摇瓶发酵后测定其HA产量,各突变株的HA产量如表1所示。其中,突变株ZV2、ZV7、ZV13的HA产量提高了5%~10%,突变株ZV1、ZV3、ZV11、ZV12的HA产量提高了10%~25%,正突变率达到41.18%。
表1 突变株的HA产量
Table 1 The HA yield of the mutant strains
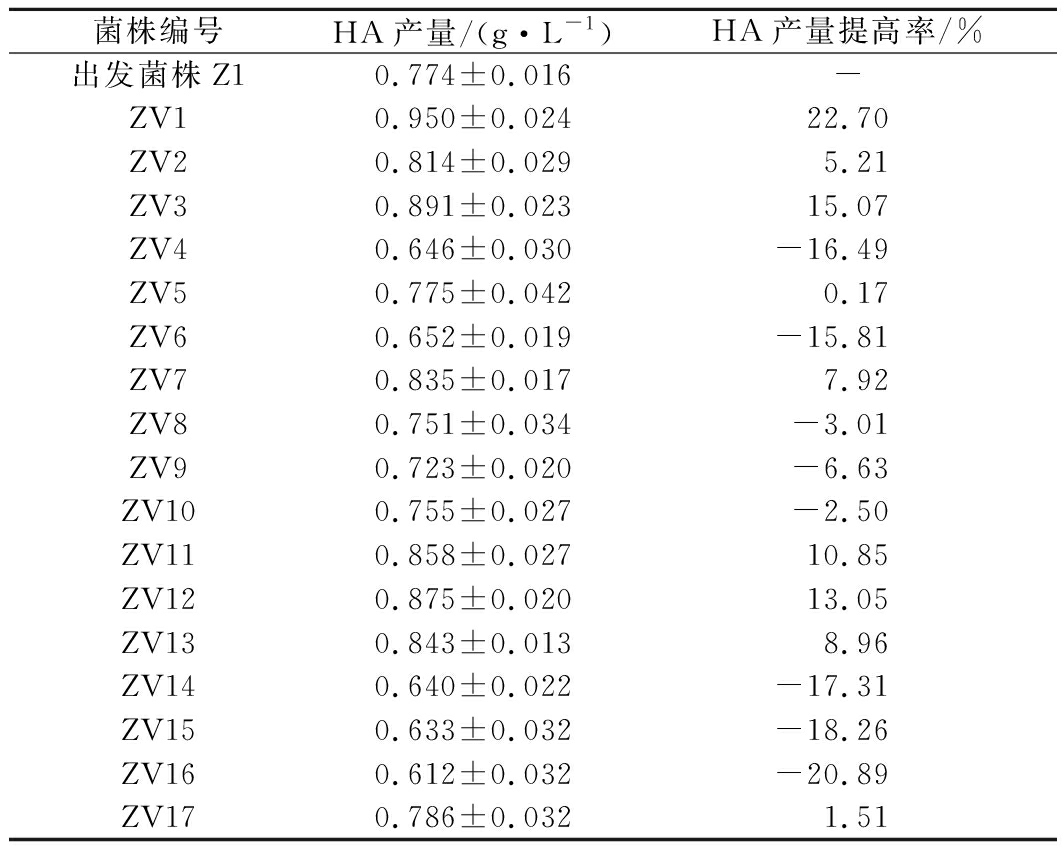
菌株编号HA产量/(g·L-1)HA产量提高率/%出发菌株Z10.774±0.016-ZV10.950±0.02422.70ZV20.814±0.0295.21ZV30.891±0.02315.07ZV40.646±0.030-16.49ZV50.775±0.0420.17ZV60.652±0.019-15.81ZV70.835±0.0177.92ZV80.751±0.034-3.01ZV90.723±0.020-6.63ZV100.755±0.027-2.50ZV110.858±0.02710.85ZV120.875±0.02013.05ZV130.843±0.0138.96ZV140.640±0.022-17.31ZV150.633±0.032-18.26ZV160.612±0.032-20.89ZV170.786±0.0321.51
注:-,表示以出发菌株Z1为对照
由前期实验可知,出发菌株Z1在透明质酸平板上有轻微的透明圈产生,紫外诱变后,将上述4株突变株分别在透明质酸平板上划线,菌落周围无透明圈产生,表明这些突变株均为透明质酸酶阴性菌株,不产透明质酸酶,这有利于维持HA产量的稳定。
2.1.3 高产HA突变株的遗传稳定性
对HA产量提升较大的突变株(ZV1、ZV3、ZV11、ZV12)进行稳定性试验,共传代4次,经过摇瓶发酵测定HA产量,结果如图2所示。其中,突变株ZV1的HA产量在每一代中相比于其他突变株较高,其产HA能力无显著性差异(P>0.05),说明该菌株具有稳定的遗传性。因此,选取突变株ZV1进行发酵工艺的优化。

图2 突变株的传代稳定性
Fig.2 The genetic stability of the mutant strains
2.2 发酵培养基成分的优化
2.2.1 单因素试验
对于碳源而言,以葡萄糖为单一碳源时,突变株ZV1发酵生产HA的效果较好,与之前的研究相似[25]。以初始发酵培养基为基础,不同葡萄糖质量浓度对HA产量的影响如图3-a所示。当葡萄糖质量浓度增加到60 g/L时,HA产量最高,确定葡萄糖质量浓度优选为60 g/L。

a-葡萄糖;b-胰蛋白胨;c-牛肉浸膏;d-MgSO4·7H2O;e-KH2PO4
图3 培养基成分对B.velezensis ZV1 HA产量的影响
Fig.3 The effect of medium components on HA yield of B.velezensis ZV1
对于氮源而言,经预实验发现,选择多种氮源进行复配,更有利于HA产生菌株的发酵生产[21]。复配方式:牛肉浸膏质量浓度10 g/L,与不同质量浓度的胰蛋白胨进行复配添加;胰蛋白胨质量浓度10 g/L,与不同浓度的牛肉浸膏进行复配添加,复配氮源对HA产量的影响如图3-b和图3-c所示。在胰蛋白胨质量浓度达到10 g/L之后,HA产量开始降低,确定胰蛋白胨质量浓度优选为10 g/L;在牛肉浸膏质量浓度达到15 g/L之前,HA产量在不断增加,随后HA产量开始下降,确定牛肉浸膏质量浓度优选为15 g/L。
对于无机盐而言,在合成HA的过程中,适当质量浓度的Mg2+可保证菌体的生长和HA的生产,K+可用于维持细胞内环境的稳定[19]。分别考察MgSO4·7H2O和KH2PO4质量浓度对HA产量的影响,结果如图3-d和图3-e所示。不同质量浓度的MgSO4·7H2O对HA产量有显著性差异(P<0.05),
MgSO4·7H2O的质量浓度为1.5 g/L时,HA产量达到最大值,为0.55 g/L;不同KH2PO4质量浓度下,HA产量在0.35~0.44 g/L之间,说明KH2PO4质量浓度对于HA产量的影响可忽略,与CHEN等[10]的研究相似。
2.2.2 响应面法设计及结果分析
根据单因素试验结果,选取葡萄糖质量浓度、胰蛋白胨质量浓度、牛肉浸膏质量浓度和MgSO4·7H2O质量浓度作为4个因素。利用Box-Behnken中心组合设计原理,对4因素3水平进行响应面分析,试验结果见表2。
表2 Box-Behnken试验设计及实验结果
Table 2 Experimental design and results of Box-Behnken
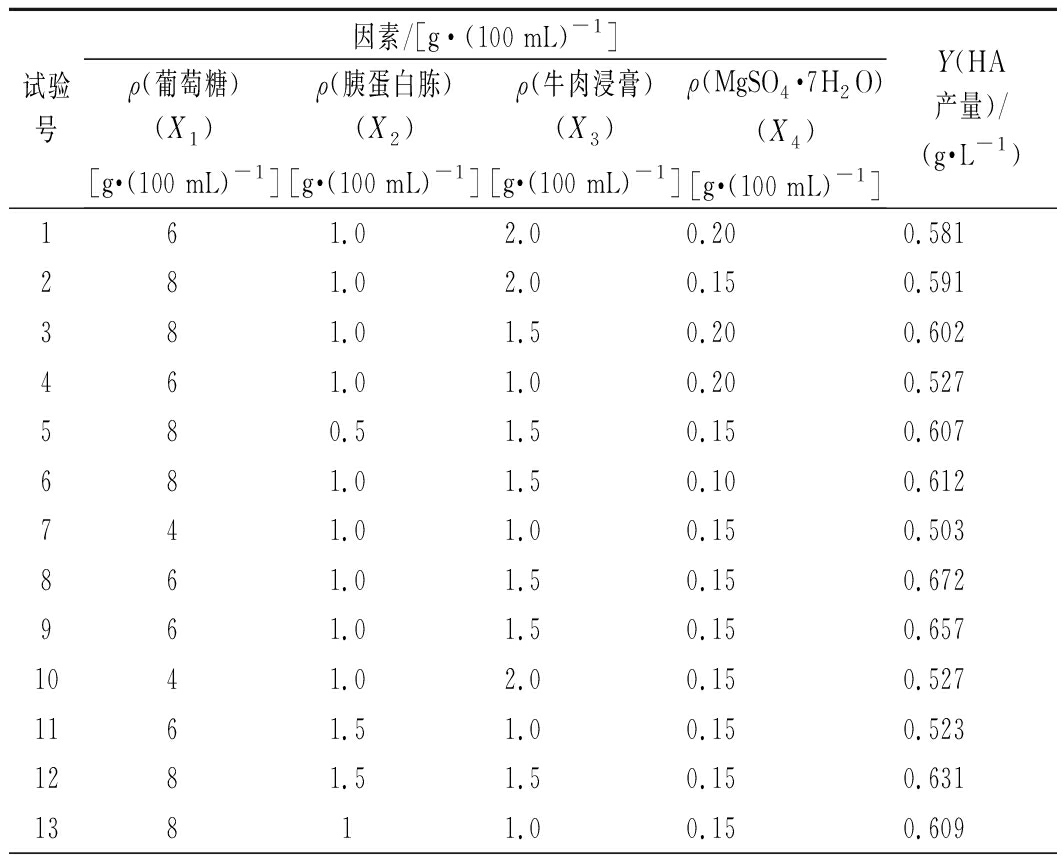
试验号因素/[g·(100 mL)-1]ρ(葡萄糖)(X1)[g·(100 mL)-1]ρ(胰蛋白胨)(X2)[g·(100 mL)-1]ρ(牛肉浸膏)(X3)[g·(100 mL)-1]ρ(MgSO4·7H2O)(X4)[g·(100 mL)-1]Y(HA产量)/(g·L-1)161.02.00.200.581281.02.00.150.591381.01.50.200.602461.01.00.200.527580.51.50.150.607681.01.50.100.612741.01.00.150.503861.01.50.150.672961.01.50.150.6571041.02.00.150.5271161.51.00.150.5231281.51.50.150.63113811.00.150.609
续表2
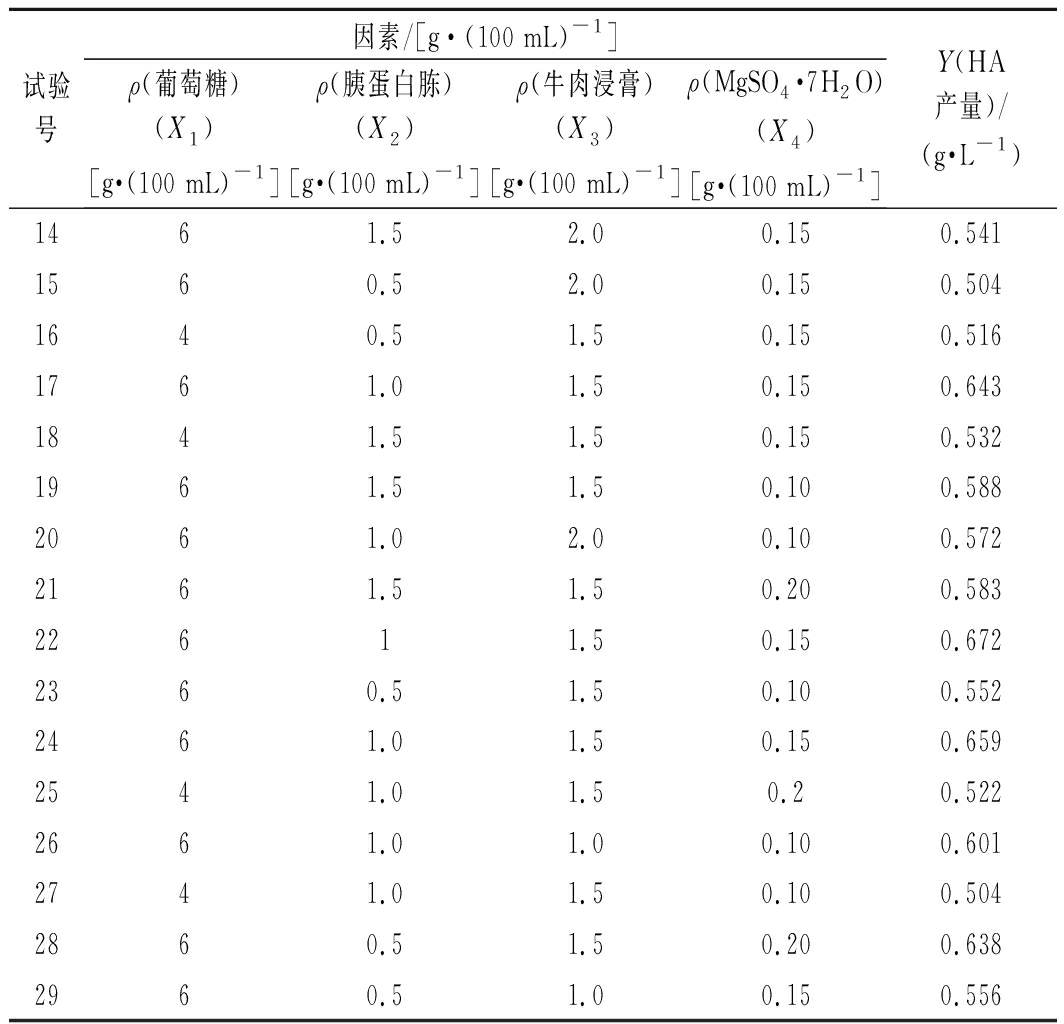
试验号因素/[g·(100 mL)-1]ρ(葡萄糖)(X1)[g·(100 mL)-1]ρ(胰蛋白胨)(X2)[g·(100 mL)-1]ρ(牛肉浸膏)(X3)[g·(100 mL)-1]ρ(MgSO4·7H2O)(X4)[g·(100 mL)-1]Y(HA产量)/(g·L-1)1461.52.00.150.5411560.52.00.150.5041640.51.50.150.5161761.01.50.150.6431841.51.50.150.5321961.51.50.100.5882061.02.00.100.5722161.51.50.200.58322611.50.150.6722360.51.50.100.5522461.01.50.150.6592541.01.50.20.5222661.01.00.100.6012741.01.50.100.5042860.51.50.200.6382960.51.00.150.556
运用Design-Expert V8.0.6软件对试验结果进行分析,建立二次多项式回归模型。模型的方差分析见表3,得到拟合二次回归方程如下: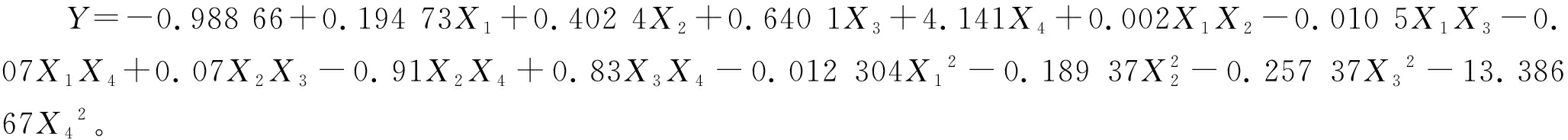
由表3可知,该模型的P<0.000 1,极显著,失拟项的P值为0.064 5(P>0.05),差异不显著,说明该模型回归显著,失拟不显著;拟合优度判定系数(R2)为0.901 1,说明该模型拟合程度较好,可用于发酵培养基优化时HA产量的预测。
表3 回归模型的方差分析
Table 3 Variance analysis of regression model
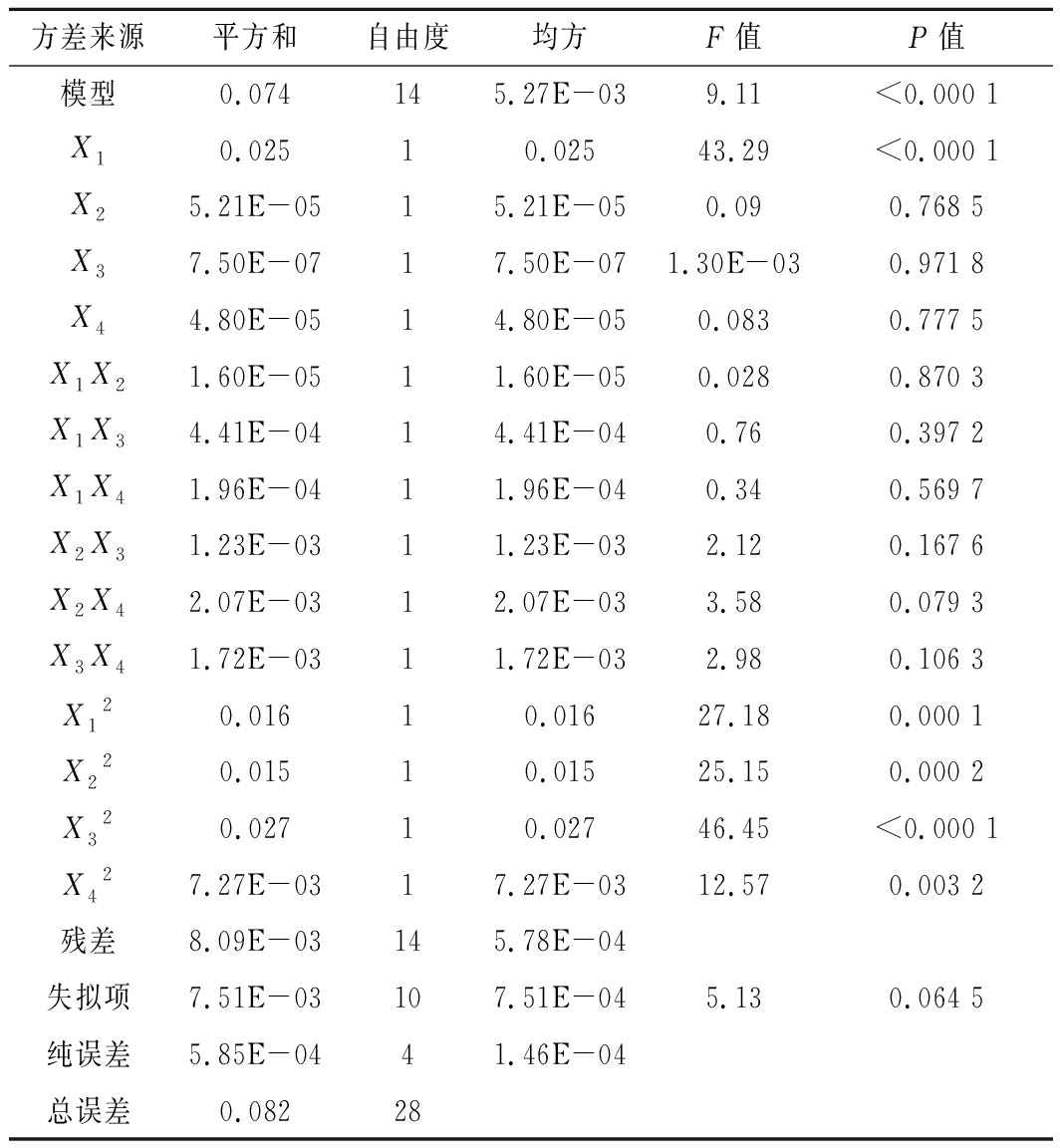
方差来源平方和自由度均方F值P值模型0.074145.27E-039.11<0.000 1X10.02510.02543.29<0.000 1X25.21E-0515.21E-050.090.768 5X37.50E-0717.50E-071.30E-030.971 8X44.80E-0514.80E-050.0830.777 5X1X21.60E-0511.60E-050.0280.870 3X1X34.41E-0414.41E-040.760.397 2X1X41.96E-0411.96E-040.340.569 7X2X31.23E-0311.23E-032.120.167 6X2X42.07E-0312.07E-033.580.079 3X3X41.72E-0311.72E-032.980.106 3X120.01610.01627.180.000 1X220.01510.01525.150.000 2X320.02710.02746.45<0.000 1X427.27E-0317.27E-0312.570.003 2残差8.09E-03145.78E-04失拟项7.51E-03107.51E-045.130.064 5纯误差5.85E-0441.46E-04总误差0.08228
注:![]()
其中,交互项(X1X2,X1X3,X1X4,X2X3,X2X4,X3X4)的P值均大于0.05,表明任意2种因素对响应值的交互作用影响不显著。响应面图可反映交互作用的影响程度,等高线的形状趋近于圆形表明交互作用不显著,趋近于椭圆形则表明显著[26]。如图4所示,交互项等高线的形状趋近于圆形,表明各因素间的交互作用不显著,与方差分析结果相一致。

图4 各因素交互作用对B.velezensis ZV1 HA产量影响的响应面图
Fig.4 Response surface for the alternative effects of various factors on HA yield of B.velezensis ZV1
通过Design-Expert软件分析得到最优发酵培养基成分为(g/L):葡萄糖69.5,胰蛋白胨10.2,牛肉浸膏14.8,MgSO4·7H2O 1.5,HA产量的最大预测值为 0.671。为了验证响应面分析的准确性,进行3次验证实验,测得HA产量的平均值为0.690 g/L,与模型预测值有较高的一致性。
2.3 发酵条件的优化
对发酵条件中的温度、pH值、装液量和摇床转速进行单因素试验,结果如图5所示。

a-温度;b-pH值;c-装液量;d-摇床转速
图5 发酵条件对B.velezensis ZV1 HA产量的影响
Fig.5 The influence of fermentation conditions on HA yield of B.velezensis ZV1
在发酵条件的单因素试验基础上,采用正交设计试验L9(34),结果如表4所示。因此,最佳发酵条件为:pH值 7.0,摇床转速150 r/min,温度35 ℃,装液量140 mL。按照上述发酵条件进行3次验证试验,HA产量平均值达到0.972 g/L,与正交试验分析结果基本一致。
表4 正交试验设计及结果
Table 4 Design and results of orthogonal experiment
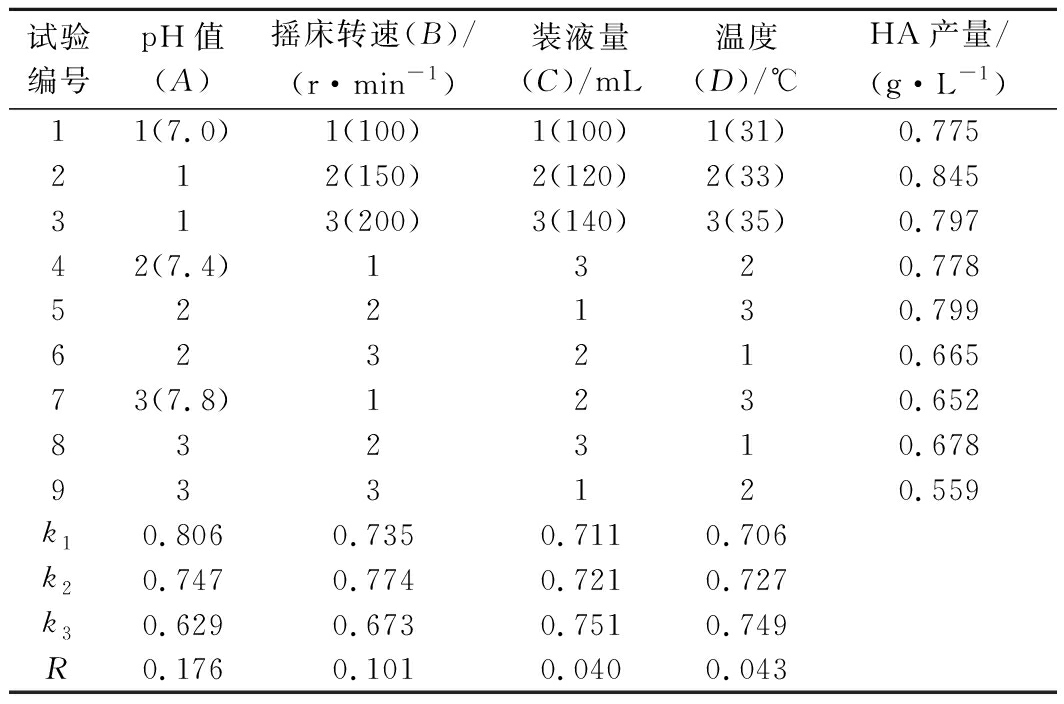
试验编号pH值(A)摇床转速(B)/(r·min-1)装液量(C)/mL温度(D)/℃HA产量/(g·L-1)11(7.0)1(100)1(100)1(31)0.775212(150)2(120)2(33)0.845313(200)3(140)3(35)0.79742(7.4)1320.778522130.799623210.66573(7.8)1230.652832310.678933120.559k10.8060.7350.7110.706k20.7470.7740.7210.727k30.6290.6730.7510.749R0.1760.1010.0400.043
注:k,每个因素各个水平下的指标均值;R,极差
2.4 最优发酵工艺条件下突变株ZV1的测定
经紫外诱变所得的突变株ZV1,在最优发酵培养基成分与最佳发酵条件的发酵工艺下,发酵16 h,突变株ZV1的HA产量达到最大值,为1.169 g/L,相较于出发菌株Z1(0.774 g/L)提高了51.03%,比IZAWA等[17]优化后的GRAS菌株HA产量(208 mg/L)要高,更具有工业化的应用潜力。
3 结论
本研究以GRAS透明质酸产生菌株Bacillus velezensis Z1为出发菌株,经过紫外诱变后,得到1株高产HA且稳定性良好、透明质酸酶阴性的突变株ZV1。利用Box-Behnken中心组合设计和响应面法分析,得到最优发酵培养基成分:葡萄糖69.5 g/L,胰蛋白胨10.2 g/L,牛肉浸膏14.8 g/L,MgSO4·7H2O 1.5 g/L;再通过正交试验得到最佳发酵条件:pH值7.0,摇床转速150 r/min,温度35 ℃,装液量140 mL。在此最优发酵工艺条件下,突变株ZV1的HA产量最大可达到1.169 g/L,比出发菌株Z1提高了51.03%。因此,菌株的诱变选育与发酵工艺的优化可有效提高HA产量,这对于此类GRAS透明质酸产生菌株在HA工业化的发酵生产有一定的应用价值。
[1] KOGAN ![]() R,et al.Hyaluronic acid:A natural biopolymer with a broad range of biomedical and industrial applications[J].Biotechnology Letters,2007,29(1):17-25.
R,et al.Hyaluronic acid:A natural biopolymer with a broad range of biomedical and industrial applications[J].Biotechnology Letters,2007,29(1):17-25.
[2] WALIMBE T,PANITCH A,SIVASANKAR P M.A review of hyaluronic acid and hyaluronic acid-based hydrogels for vocal fold tissue engineering[J].Journal of Voice,2017,31(4):416-423.
[3] LIU L,LIU Y F,LI J H,et al.Microbial production of hyaluronic acid:Current state,challenges,and perspectives[J].Microbial Cell Factories,2011,10(1):1-9.
[4] FALLACARA A,BALDINI E,MANFREDINI S,et al.Hyaluronic acid in the third millennium[J].Polymers,2018,10(7):701.
[5] 丁勇,周楠,石孝勇.透明质酸产生菌的复合诱变及摇瓶发酵条件的优化[J].中国酿造,2011,30(12):100-103.
DING Y,ZHOU N,SHI X Y.Compound mutation and rocker fermentation conditions optimization of high hyaluronic acid producing strain[J].China Brewing,2011,30(12):100-103.
[6] MURADO M A,MONTEMAYOR M I,CABO M L,et al.Optimization of extraction and purification process of hyaluronic acid from fish eyeball[J].Food and Bioproducts Processing,2012,90(3):491-498.
[7] LU J F,ZHU Y,SUN H L,et al.Highly efficient production of hyaluronic acid by Streptococcus zooepidemicus R42 derived from heterologous expression of bacterial haemoglobin and mutant selection[J].Letters in Applied Microbiology,2016,62(4):316-322.
[8] BOERIU C G,SPRINGER J,KOOY F K,et al.Production methods for hyaluronan[J].International Journal of Carbohydrate Chemistry,2013,2013:1-14.
[9] 刘玉川, 李宇兴,赖永勤,等.透明质酸生产菌溶血素S基因缺失突变菌株的构建及其特性[J].微生物学报,2016,56(11):1 755-1 765.
LIU Y C,LI Y X,LAI Y Q,et al.Construction and characterization of hemolysin S gene mutant strain producing hyaluronic acid[J].Acta Microbiologica Sinica,2016,56(11):1 755-1 765.
[10] CHEN Y H,LI J,LIU L,et al.Optimization of flask culture medium and conditions for hyaluronic acid production by a Streptococcus equisimilis mutant nc2168[J].Publication of the Brazilian Socioty for Microbiology,2012,43(4):1 553-1 561.
[11] OLIVEIRA J D,CARVALHO L S,GOMES A M V,et al.Genetic basis for hyper production of hyaluronic acid in natural and engineered microorganisms[J].Microbial Cell Factories,2016,15(1):1-19.
[12] JIN P,KANG Z,YUAN P H,et al.Production of specific-molecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168[J].Metabolic Engineering,2016,35:21-30.
[13] KAUR M,JAYARAMAN G.Hyaluronan production and molecular weight is enhanced in pathway-engineered strains of lactate dehydrogenase-deficient Lactococcus lactis[J].Metabolic Engineering Communications,2016,3:15-23.
[14] LIU H W,RAMOS K R M,VALDEHUESA K N G,et al.Metabolic engineering of Escherichia coli for biosynthesis of D-galactonate[J].Bioprocess and Biosystems Engineering,2014,37(3):383-391.
[15] CHENG F Y,GONG Q Y,YU H M,et al.High-titer biosynthesis of hyaluronic acid by recombinant Corynebacterium glutamicum[J].Biotechnology Journal,2016,11(4):574-584.
[16] IZAWA N,HANAMIZU T,IIZUKA R,et al.Streptococcus thermophilus produces exopolysaccharides including hyaluronic acid[J].Journal of Bioscience and Bioengineering,2009,107(2):119-123.
[17] IZAWA N,HANAMIZU T,SONE T,et al.Effects of fermentation conditions and soybean peptide supplementation on hyaluronic acid production by Streptococcus thermophilus strain YIT 2084 in milk[J].Journal of Bioscience and Bioengineering,2010,109(4):356-360.
[18] 诸葛健.工业微生物实验与研究技术[M].北京:科学出版社,2007.
ZHUGE J.Industrial microorganism experiment and research technology[M].Beijing:Science Press,2007.
[19] 董志红.发酵法生产透明质酸的诱变育种及分子量可控工艺研究[D].杭州:浙江工业大学,2017.
DONG Z H.Study on strain breeding and process for production of hyaluronic acid with controllable molecular weight[D].Hangzhou:Zhejiang University of Technology,2017.
[20] 卢承蓉,叶美芝,上官文丹,等.高产胞外多糖乳酸菌的诱变育种及其益生特性[J].食品与发酵工业,2020,46(12):14-20.
LU C R,YE M Z,SHANGGUAN W D,et al.Mutation breeding for high-yield exopolysaccharide lactic acid bacteria and evaluation of its probiotic properties[J].Food and Fermentation Industries,2020,46(12):14-20.
[21] 刘丽.透明质酸菌株发酵条件优化、制备及应用研究[D].北京:中国农业科学院,2010.
LIU L.Study on fermentation conditions optimization of streptococcus equis for preparation and application of hyaluronic acid[D].Beijing:Chinese Academy of Agricultural Sciences,2010.
[22] BITTER T,MUIR H M.A modified uronic acid carbazole reaction[J].Analytical Biochemistry,1962,4(4):330-334.
[23] 马振贵,马伟超,蒲建平,等.马铃薯渣高效降解菌的紫外诱变选育及发酵试验[J].中国酿造,2011,30(1):123-126.
MA Z G,MA W C,PU J P,et al.UV mutagenesis in efficient degradation strains of potato pulp and fermentation[J].China Brewing,2011,30(1):123-126.
[24] LI W,MUTUVULLA M,CHEN X H,et al.Isolation and identification of high viscosity-producing lactic acid bacteria from a traditional fermented milk in Xinjiang and its role in fermentation process[J].European Food Research and Technology,2012,235(3):497-505.
[25] 陈永浩.透明质酸发酵法制备及其复合改性研究[D].无锡:江南大学,2010.
CHEN Y H.Study on preparation of hyaluronic acid by fermentation and its composite modification[D].Wuxi:Jiangnan University,2010.
[26] 余文晖,王金锋,谢晶.响应面法优化金枪鱼复合冰衣液配比[J].食品与发酵工业,2020,46(3):174-179.
YU W H,WANG J F,XIE J.Response surface methodology for optimizing the proportion of tuna compound ice coating solution[J].Food and Fermentation Industries,2020,46(3):174-179.