纳豆激酶(nattokianse,NK)是在纳豆发酵过程中由纳豆枯草杆菌(Bacillus subtilis natto)产生的一种具有纤溶活性的丝氨酸蛋白酶[1],因可用于治疗血栓、高血压、阿尔茨海默氏病和玻璃体视网膜等领域而被广泛关注[2-9]。
食物中主要含有4种嘌呤,分别为腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤,而人体痛风是由于长期嘌呤代谢障碍、血尿酸升高引起组织损伤的一类疾病[10]。然而,多种NK冻干粉产品中均具有较高含量的嘌呤类物质,不利于痛风患者的食用。目前,对NK研究主要集中在具有高酶活性微生物的筛选[11]、新型酶的纯化以及特性研究[12-13]。因此,筛选出一种具有高NK酶活性、低嘌呤含量的发酵菌株,并在此基础上对其液体发酵条件进行优化,可为进一步开发高NK酶活性、低嘌呤产量的枯草芽孢杆菌发酵产品奠定研究基础。
1 材料与方法
1.1 实验材料
大酱,四川大凉山农户。
1.2 培养基
酪蛋白平板培养基(g/L):酪蛋白胨20,葡萄糖5,K2HPO4·3H2O 1,KH2PO4 0.5,MgSO4·7H2O 0.1,琼脂15,pH 7.0,121 ℃灭菌15 min。
种子培养基、LB 培养基(g/L):蛋白胨10,酵母浸粉5,NaCl 10(固体培养基加15 g/L 琼脂),121 ℃灭菌15 min。
初始液体发酵培养基(g/L):胰蛋白胨20,乳糖20,Na2HPO4·12H2O 5,NaH2PO4·2H2O 1,CaCl2 0.2,MgSO4·7H2O 0.5,pH 7.0,121 ℃灭菌15 min。
1.3 实验方法
1.3.1 枯草芽孢杆菌的筛选
产NK菌株筛选:取1 g大酱,放入装有9 mL 无菌生理盐水的试管中振荡5 min,沸水浴加热10 min,10 000 r/min离心5 min,取上清液进行梯度稀释,以划线分离法将上清液涂布于酪蛋白平板上,放入恒温培养箱中,37 ℃培养24 h观察平板透明圈直径大小并进行测量,选取透明圈直径大者转接LB斜面培养。
摇瓶筛选:取初筛所得菌株接种于LB 培养基中,37 ℃,180 r/min 恒温培养12 h,接入液体种子培养基,37 ℃,180 r/min 恒温培养12 h。按2%(体积分数)的接种量将种子液接种至液体发酵培养基中,37 ℃,180 r/min 恒温培养24 h,测定发酵液NK酶活力及嘌呤含量。
1.3.2 NK酶活力及嘌呤含量测定方法
1.3.2.1 NK酶活力测定
采用酪蛋白消化法[14]测定发酵液中NK酶活力。
粗酶液制备:将发酵获得的菌液于4 ℃、10 000 r/min离心10 min,取上清液经过0.22 μm膜过滤即为粗酶液。
酶反应:取1 mL粗酶液,加入2 mL 0.5%酪蛋白,混合均匀,40 ℃ 孵育10 min;加入3 mL 10% 三氯乙酸终止反应,8 000 r/min离心5 min。设立对照组,对照组为加入酶液前加入3 mL 三氯乙酸。
显色反应:取1 mL酶反应液,加入5 mL 0.55 mol/L NaCO3溶液和1 mL福林酚溶液,迅速混匀,40 ℃ 恒温水浴中显色20 min,测定吸光度(A680)。
酶活力定义:1 min内形成1 μg酪氨酸所需的NK剂量。
1.3.2.2 嘌呤含量测定
采用高效液相色谱法[15]对发酵液中的嘌呤含量进行检测。
前处理:取2 mL发酵上清液于25 mL具塞管中,加入2 mL 3 mol/L硫酸溶液,加塞后立即置于沸水浴水解10 min,冰浴冷却,调pH至2.0~8.0,定容至10 mL。再以0.22 μm针式过滤头过滤,即得待测样品,备用。
色谱条件:色谱柱:ZORBAX NH2(4.6 mm×250 mm,5.0 μm);流动相:A相,10 mmol/L乙酸铵,B相,乙腈;流速:0.8 mL/min;柱温:25 ℃;进样量:20 μL;紫外检测波长:254 nm。
1.3.3 菌种鉴定
通过16S rRNA序列对菌株进行鉴定。采用TIANamp细菌DNA试剂盒提取总DNA。使用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增。扩增程序如下:95 ℃预变性5 min,95 ℃变性30 s,退火温度55 ℃,复性30 s,72 ℃延伸5 min,进行34个循环。PCR产物经生工生物工程(上海)股份有限公司测序,测序结果经BLAST(NCBI)比对分析。
1.3.4 单因素试验
(1)培养基碳源优化:以初始培养基为基础,分别使用葡萄糖、蔗糖、乳糖、麦芽糖、可溶性淀粉和甘油为碳源,测定粗酶液中NK酶活力和嘌呤含量。
(2)培养基氮源优化:在现有优化基础上,分别使用胰蛋白胨、酪蛋白胨、大豆蛋白胨和蛋白胨,测定粗酶液中NK酶活力和嘌呤含量。
(3)培养基接种量优化:以初始培养基为基础,将种子液以不同接种量(体积分数1%、2%、3%、4%、5%)接入发酵培养基中,测定粗酶液中NK酶活力和嘌呤含量。
(4)培养基初始pH优化:在现有优化基础上,改变发酵培养基的初始pH(5、6、7、8、9),测定粗酶液中NK酶活力和嘌呤含量。
(5)培养温度优化:在现有优化基础上,调整发酵温度(31、33、35、37、39 ℃),测定粗酶液中NK酶活力和嘌呤含量。
(6)培养时间优化:在现有优化基础上,调整发酵时间(24、36、48、60、72 h),测定粗酶液中NK酶活力和嘌呤含量。
1.3.5 Plackett-Burman试验设计
在单因素试验的基础上,利用Design-expert软件进行n=12的 Plackett-Burman试验设计,其各因素与水平如表1所示。
表1 Plackett-Burman 试验因素水平
Table 1 Factors and levels of Plackett-Burman design

变量水平-11X1:接种量/%24X2:pH68X3:发酵温度/℃3539X4:发酵时间/h3660
1.3.6 最陡爬坡试验
爬坡试验依据 Plackett-Burman 试验结果确定各显著影响因素及正负效应,设定步长及变化方向,以快速逼近最佳区域。
1.3.7 Box-Behnken中心组合试验
利用最陡爬坡试验得出中心点,设计3因素3水平优化试验,采用Box-Behnken中心组合试验进行实验条件优化。试验设计的各因素与水平如表2所示。
表2 Box-Behnken design 试验因素与水平
Table 2 Levels and factors of Box-Behnken design

因素区间和水平-101X1:接种量/%22.53X2:pH66.57X3:发酵温度/℃373839
2 结果与分析
2.1 菌株筛选及鉴定
酪蛋白平板筛选得到3株产透明圈菌株,摇瓶发酵分别测定其NK酶活力和嘌呤含量,SH21酶活力最高,嘌呤含量最低(表3)。
表3 三种菌株发酵液中纳豆激酶活性和嘌呤含量的比较
Table 3 Comparison of nattokinase activity and purine of the three strains

样品NK酶活力/(U·mL-1)嘌呤含量/(mg·L-1)SH21166.99±0.86a75.4±0.83cSH24156.21±0.58b103.52±2.14aSH28160.08±3.16b85.06±0.98b
注:不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)(下同)
对SH21进行PCR扩增,产生了一段1 378 bp的DNA片段。经BLAST比对,发现与枯草芽孢杆菌(Genbank:MK860024)和枯草芽孢杆菌(Genbank:KP717559)的16S rDNA基因序列具有100%的同源性,结合其形态和生理特性,SH21被鉴定为枯草芽孢杆菌(Genbank:MN756647)。
2.2 单因素试验结果
2.2.1 最佳碳源的确定
不同碳源对NK酶活力及嘌呤含量的影响如图1-a所示。当碳源为葡萄糖时酶活力最高,为165.77 U/mL,嘌呤含量为91.54 mg/L;而碳源为蔗糖时嘌呤含量仅为43.01 mg/L,酶活力为134.04 U/mL,综合考虑选择蔗糖作为发酵培养基的碳源。

a-碳源种类对发酵产纳豆激酶和嘌呤的影响;b-氮源种类对发酵产纳豆激酶和嘌呤的影响;c-pH对发酵产纳豆激酶和嘌呤的影响;
d-接种量对发酵产纳豆激酶和嘌呤的影响;e-温度对发酵产纳豆激酶和嘌呤的影响;f-时间对发酵产纳豆激酶和嘌呤的影响
图1 各因素对酶活力以及嘌呤含量的影响
Fig.1 The influence of various factors on enzyme activity and purine content
2.2.2 最佳氮源的确定
对于氮源而言(图1-b),酶活力最高为酪蛋白胨,其值达到160.07 U/mL。其主要原因在于前期筛菌时采用的氮源为酪蛋白胨,因此对菌株具有一定的驯化作用[16],故以酪蛋白胨为氮源时酶活力较为显著。而嘌呤含量虽以胰蛋白胨为氮源时嘌呤含量最低,但其相差不是很大,在21.78~39.33 mg/L之间,综合比较选取酪蛋白胨作为最佳氮源。
2.2.3 最佳pH的确定
pH对酶活力和嘌呤影响如图1-c所示。随着pH的升高,酶活力先上升后下降,而嘌呤先下降然后上升后下降。当pH为7时,酶活力最高,为119.19 U/mL,而嘌呤含量虽然以pH为9时其嘌呤含量最低,但其差异不显著,同时考虑到NK在中性条件下酶活力较为稳定[17],且该 pH 条件下适宜枯草芽孢杆菌的生长,故pH取7。
2.2.4 最佳接种量的确定
接种量在1%~3% 时,酶活力逐渐增加,嘌呤含量下降。当接种量大于3%,酶活性降低,嘌呤含量增加(图1-d)。接种量在1%~3% 时,随着接种量的增加,菌体繁殖速度加快,酶活也相应增加,当接种量大于3% 后,由于营养物质匮乏导致其生命活力逐渐降低,酶活力也相应降低[16]。故接种量设为3%。
2.2.5 最佳发酵温度的确定
温度对酶活力和嘌呤影响如图1-e所示。随着温度的提高,酶活力逐渐增加,在37 ℃时酶活力达到最大值(128.96 U/mL),此时嘌呤含量为45.77 mg/L,随后酶活力开始下降,嘌呤含量开始增加。故发酵温度设为37 ℃。
2.2.6 最佳发酵时间的确定
不同发酵时间对NK酶活力及嘌呤含量的影响如图1-f所示。在24~48 h时,酶活力逐渐增加,嘌呤含量逐渐下降。之后,随着时间增加,酶活力降低,嘌呤含量增加,推测发酵时间过长,菌体生长进入衰亡期,甚至产生自溶,使得大量DNA释放,导致酶活力下降,进而产生更多的嘌呤类物质[18]。因此最佳发酵时间为48 h。
2.3 Plackett-Burman试验结果与分析
试验结果见表4。由表5方差分析结果可知,酶活力模型的P值 0.001<0.05,模型选择正确。接种量、pH、发酵温度的P值均小于0.05,对NK酶活力影响显著,发酵时间对酶活力影响不显著;嘌呤模型的P值为0.010 6<0.05,模型选择正确,各变量 P 值均小于0.05,对嘌呤影响均显著。综合考虑选择接种量、pH和发酵温度进行下一步的优化。
表4 Plackett-Burman试验结果
Table 4 Results of Plackett-Burman experiments
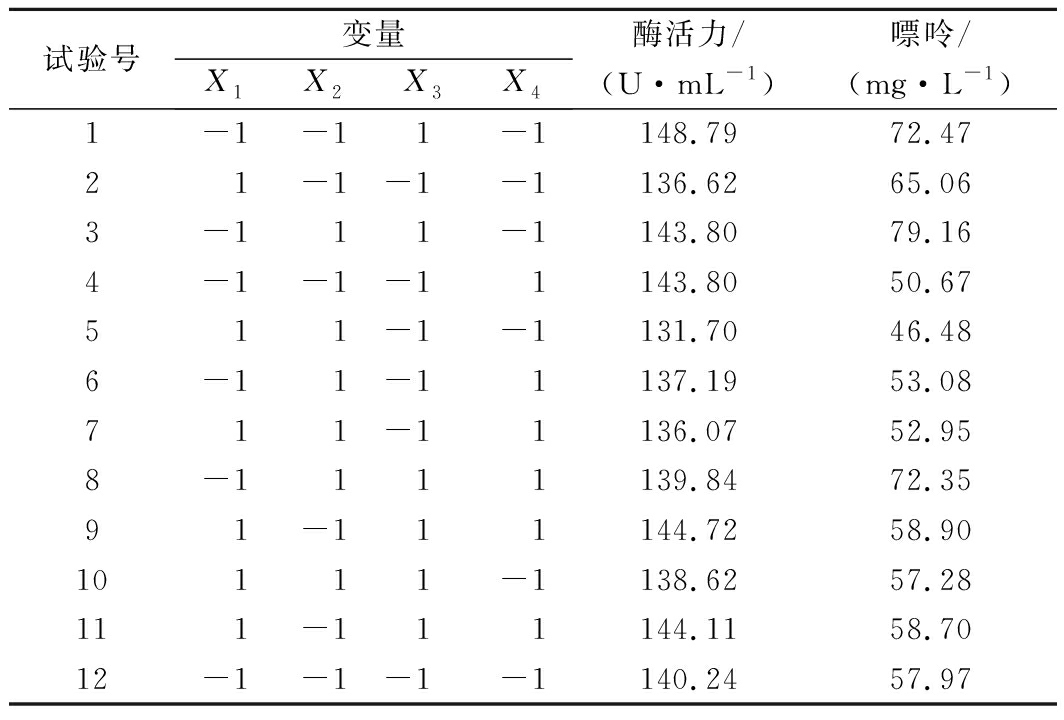
试验号变量X1X2X3X4酶活力/(U·mL-1)嘌呤/(mg·L-1)1-1-11-1148.7972.4721-1-1-1136.6265.063-111-1143.8079.164-1-1-11143.8050.67511-1-1131.7046.486-11-11137.1953.08711-11136.0752.958-1111139.8472.3591-111144.7258.9010111-1138.6257.28111-111144.1158.7012-1-1-1-1140.2457.97
表5 方差分析结果
Table 5 The results of ANOVA
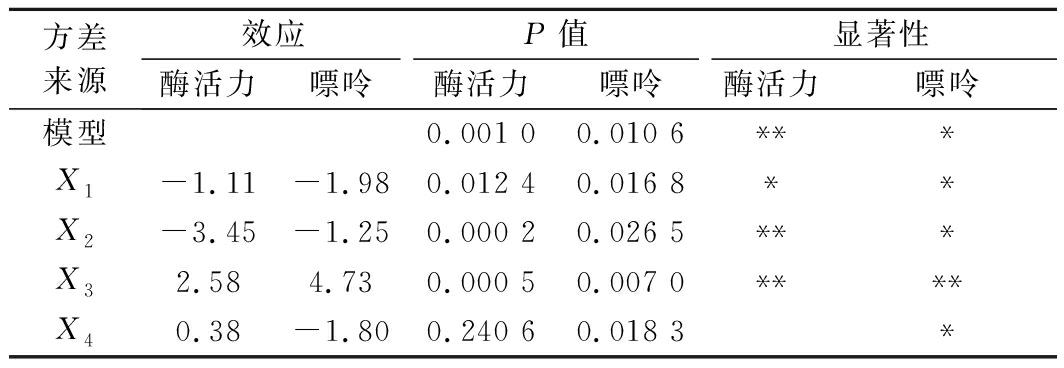
方差来源效应P值显著性酶活力嘌呤酶活力嘌呤酶活力嘌呤模型0.001 00.010 6***X1-1.11-1.980.012 40.016 8**X2-3.45-1.250.000 20.026 5***X32.584.730.000 50.007 0****X40.38-1.800.240 60.018 3*
注:**表示极显著(P<0.01),*表示显著(0.01<P<0.05)(下同)
2.4 最陡爬坡试验
以接种量、pH和发酵温度为自变量,各因素试验设计如表6所示。接种量2.5%,pH 6.5,发酵温度38 ℃时,酶活力最高,嘌呤含量最低。因此,以第4组试验水平作为 Box-Behnken中心点,进行优化试验。
表6 最陡爬坡试验设计及结果
Table 6 Design and results of steepest ascent experiment
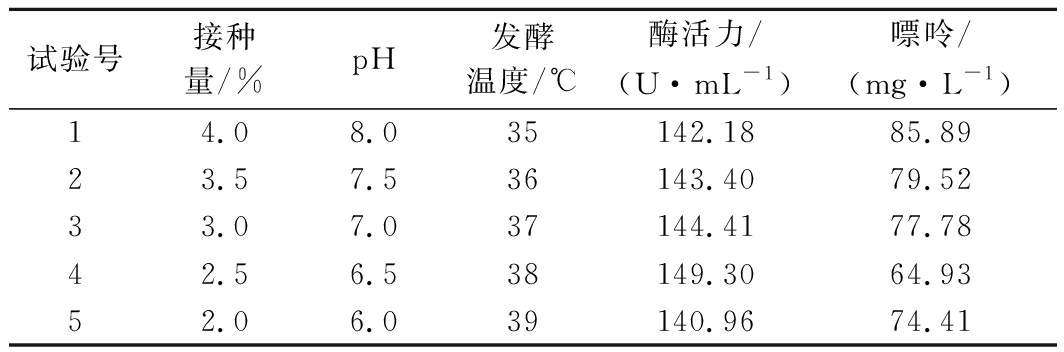
试验号接种量/%pH发酵温度/℃酶活力/(U·mL-1)嘌呤/(mg·L-1)14.08.035142.1885.8923.57.536143.4079.5233.07.037144.4177.7842.56.538149.3064.9352.06.039140.9674.41
2.5 响应面试验
2.5.1 试验设计及结果分析
以接种量、pH、发酵温度为自变量,测定NK酶活力和嘌呤。试验结果如表7所示。利用 Design-expert对试验结果进行分析,得到2个回归方程: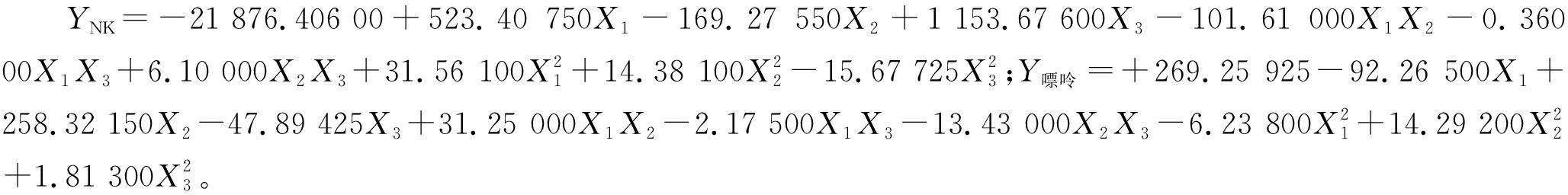
表7 Box-Behnken design 试验结果
Table 7 Results of Box-Behnken design experiments
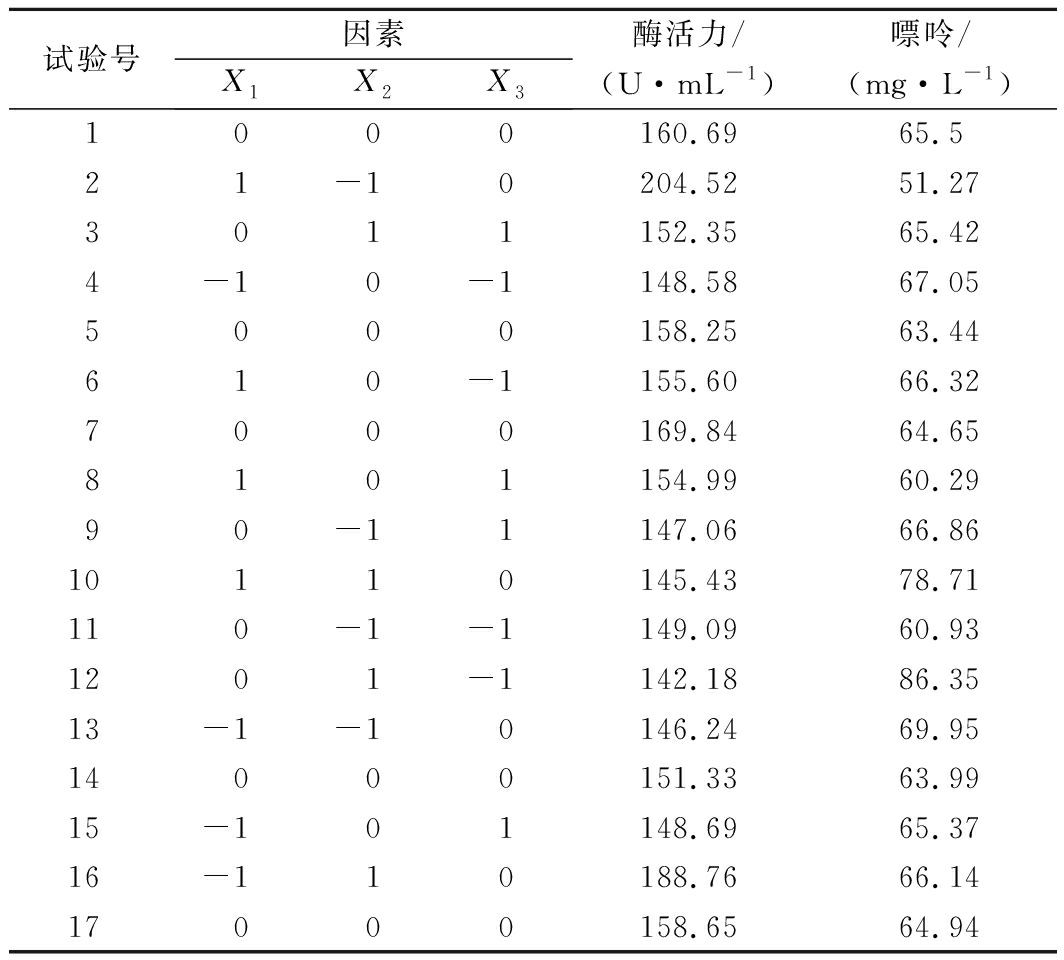
试验号因素X1X2X3 酶活力/(U·mL-1)嘌呤/(mg·L-1)1000160.6965.521-10204.5251.273011152.3565.424-10-1148.5867.055000158.2563.44610-1155.6066.327000169.8464.658101154.9960.2990-11147.0666.8610110145.4378.71110-1-1149.0960.931201-1142.1886.3513-1-10146.2469.9514000151.3363.9915-101148.6965.3716-110188.7666.1417000158.6564.94
方差分析结果如表8和表9所示。所选模型P值均小于0.01,差异极显著,说明回归方程模型具有高度显著性;失拟项 P 值均大于0.05,差异不显著,说明模型对试验拟合程度良好;相关系数R2均在0.9以上,可以预测实验结果。
表8 酶活力回归模型的方差分析
Table 8 Variance analysis (ANOVA) of enzyme activity regression model
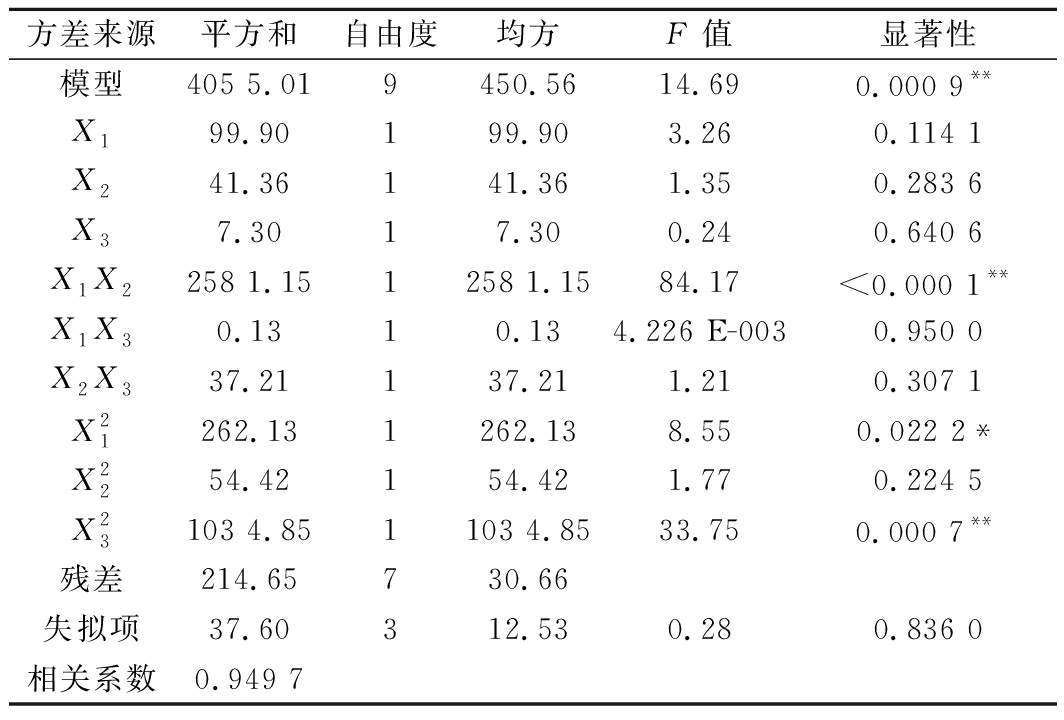
方差来源平方和自由度均方F 值显著性模型405 5.019450.5614.690.000 9**X199.90199.903.260.114 1X241.36141.361.350.283 6X37.3017.300.240.640 6X1X2258 1.151258 1.1584.17<0.000 1**X1X30.1310.134.226 E-0030.950 0X2X337.21137.211.210.307 1X21262.131262.138.550.022 2*X2254.42154.421.770.224 5X23103 4.851103 4.8533.750.000 7**残差214.65730.66失拟项37.60312.530.280.836 0相关系数0.949 7
表9 嘌呤回归模型的方差分析
Table 9 Variance analysis (ANOVA) of purine content regression model
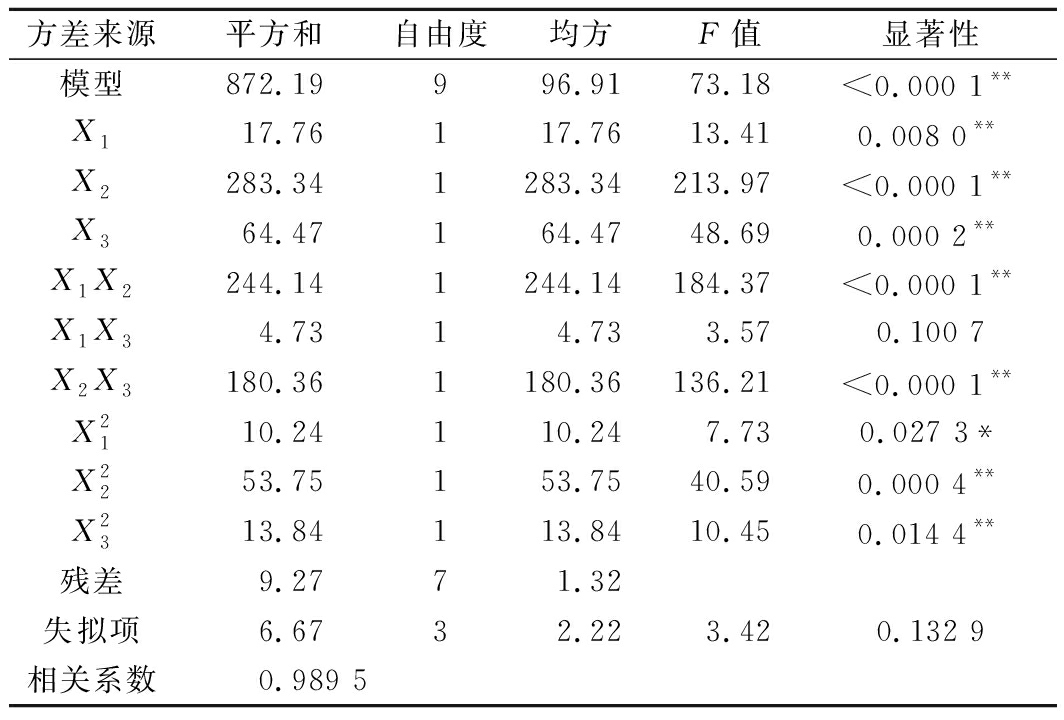
方差来源平方和自由度均方F值显著性模型872.19996.9173.18<0.000 1**X117.76117.7613.410.008 0**X2283.341283.34213.97<0.000 1**X364.47164.4748.690.000 2**X1X2244.141244.14184.37<0.000 1**X1X34.7314.733.570.100 7X2X3180.361180.36136.21<0.000 1**X2110.24110.247.730.027 3*X2253.75153.7540.590.000 4**X2313.84113.8410.450.014 4**残差9.2771.32失拟项6.6732.223.420.132 9相关系数0.989 5
2.5.2 模型预测与验证实验
利用Design-expert软件,分析3种显著因素(接种量、pH、温度)的响应面和等高线。预测得到发酵培养基最佳参数为接种量3%,pH 6.0,温度37.93 ℃,理论最高酶活力可达到202.53 U/mL,嘌呤含量最低为50.068 mg/L。考虑实际限制,将发酵温度调整为38 ℃。为了验证响应面分析的可靠性,利用上述最佳参数进行3次平行验证,实际测定酶活力为204.52 U/mL,嘌呤含量为51.27 mg/L,接近模型预测。
3 结论
通过两步法从大酱中筛选得到1株低嘌呤、高酶活力的枯草芽孢杆菌SH21,在单因素试验的基础上,利用 Plackett-Burman设计筛选得到pH、接种量和发酵温度这3个显著因素,利用 Box-Behnken 中心组合设计确定最优发酵条件,确定了优化后的发酵培养基为20 g/L蔗糖、20 g/L酪蛋白胨、5 g/L Na2HPO4·12H2O、1 g/L NaH2PO4·2H2O、0.2 g/L CaCl2、0.5 g/L MgSO4·7H2O;优化后的发酵条件为pH 6.0,接种量3%,发酵温度38 ℃,发酵时间 48 h,在此条件下,NK酶活力提高了1.22倍,嘌呤含量降低了32%,本研究提高了产酶水平并降低了生产成本,为开发高NK酶活性、低嘌呤产量的枯草芽孢杆菌发酵产品奠定研究基础。
[1] CHEN H J,MCGOWAN E M,REN N N,et al.Nattokinase:A promising alternative in prevention and treatment of cardiovascular diseases[J].Biomarker Insights,2018,13(13).DOI:10.1177/1177271918785130.
[2] LEE D L,HONG S Y,JANG Y S,et al.The evaluation of antithrombotic and fibrinolytic activities of nattokinase from Bacillus subtilis natto[J].KSBB Journal,2012,27(6):375-380.
[3] MILNER M,MAKISE K.Natto and its active ingredient nattokinase:A potent and safe thrombolytic agent[J].Alternative and Complementary therapies,2002,8(3):157-164.
[4] XU J P,DU M,YANG X L,et al.Thrombolytic effects in vivo of nattokinase in a carrageenan-induced rat model of thrombosis[J].Acta Haematologica,2014,132(2):247-253.
[5] JENSEN G S,LENNINGER M,ERO M P,et al.Consumption of nattokinase is associated with reduced blood pressure and von Willebrand factor,a cardiovascular risk marker:Results from a randomized,double-blind,placebo-controlled,multicenter North American clinical trial[J].Integrated Blood Pressure Control,2016,9:95-104.
[6] FUJITA M,OHNISHI K,TAKAOKA S,et al.Antihypertensive effects of continuous oral administration of nattokinase and its fragments in spontaneously hypertensive rats[J].Biological and Pharmaceutical Bulletin,2011,34(11):1 696-1 701.
[7] BHATT P C,PATHAK S,KUMAR V,et al.Attenuation of neurobehavioral and neurochemical abnormalities in animal model of cognitive deficits of Alzheimer’s disease by fermented soybean nanonutraceutical[J].Inflammopharmacology,2018,26(2):105-118.
[8] HAMZA A.Miracle enzymes serrapeptase and nattokinase mitigate neuroinflammation and apoptosis associated with Alzheimer’s disease in experimental model[J].World Journal of Pharmacy and Pharmaceutical Sciences,2014,3(2):876-891.
[9] TYAGI M G.Nattokinase enzyme;An evaluation of its cellular and potential therapeutic actions[J].European Journal of Pharmaceutical and Medical Research,2016,1(18):411-414.
[10] 尹潍. 高尿酸血症和痛风[J].国外医学(内分泌学分册),2003,23(4):219-221.
YIN W.The hyperuricemia and gout[J].Foreign Medical Sciences (Section of Endocrinology),2003,23(4):219-221.
[11] MAN L L,XIANG D J,ZHANG C L.Strain screening from traditional fermented soybean foods and induction of nattokinase production in Bacillus subtilis MX-6[J].Probiotics and Antimicrobial Proteins,2019,11(1):283-294.
[12] HUA Y,JIANG B,MINE Y,et al.Purification and characterization of a novel fibrinolytic enzyme from Bacillus sp. nov.SK006 isolated from an Asian traditional fermented shrimp paste[J].Journal of Agricultureal and Food Chemistry,2008,56(4):1 451-1 457.
[13] WONG A H K,MINE Y.Novel fibrinolytic enzyme in fermented shrimp paste,a traditional Asian fermented seasoning[J].Journal of Agricultural and Food Chemistry,2004,52(4):980-986.
[14] DUBEY R,KUMAR J,AGRAWALA D,et al.Isolation,production,purification,assay and characterization of fibrinolytic enzymes (nattokinase,streptokinase and urokinase) from bacterial sources[J].African Journal of Biotechnology,2011,10(3):1 408-1 420.
[15] LI S P,LI P,LAI C M,et al.Simultaneous determination of ergosterol,nucleosides and their bases from natural and cultured Cordyceps by pressurised liquid extraction and high-performance liquid chromatography[J].Journal of Chromatography A,2004,1 036(2):239-243.
[16] 鲁洋,钱和,张伟国.低嘌呤、高酶活纳豆芽孢杆菌液态发酵条件的优化[J].食品工业科技,2014,35(18):221-224;235.
LU Y,QIAN H,ZHANG W G.Optimization of Bacillus natto liquid fermentation for low purine and high enzyme activity[J].Science and Technology of Food Industry,2014,35(18):221-224;235.
[17] DABBAGH F,NEGAHDARIPOUR M,BERENJIAN A,et al.Nattokinase:production and application[J].Applied Microbiology and Biotechnology,2014,98(22):9 199-9 206.
[18] 冒鑫哲,彭政,周冠宇,等.枯草芽孢杆菌高产角蛋白酶发酵条件优化[J].食品与发酵工业,2020,46(17):138-144.
MAO X Z,PENG Z,ZHOU G Y,et al.Optimized fermentation for improving keratinase production by Bacillus subtilis WB600[J].Food and Fermentation Industries,2020,46(17):138-144.