竹笋是广泛分布于亚洲地区的禾本科、竹亚科多年生常绿植物,其新生芽或嫩茎可食用[1],在中国、日本等亚洲国家是一种食品和药材来源[2]。竹笋作为绿色产品,口感丰富且富含膳食纤维、酚类、多糖、黄酮等营养成分[3-6],具有抗氧化、抑菌、降血糖、抗肿瘤[7-9]等生物活性,已被开发成了竹笋功能饮料[10]、防腐剂[11]等。然而随着中国竹笋加工工业的迅猛发展,产生了大量的加工剩余物如笋壳、笋篼、笋煮水等[12]。这些剩余物给环境带来污染的同时也对资源造成了极大的浪费,因此如何处理竹笋加工剩余物也越来越受到人们的重视。
黄酮类物质作为竹笋加工剩余物中一类营养成分[13],具有多种生理活性,可清除体内自由基[14]、抗肿瘤[15]、降血糖[16]等。黄酮类物质种类丰富,目前对于竹笋加工剩余物中黄酮类物质构成研究主要集中于笋壳、竹叶等,其碳苷类物质主要为牡荆苷、异牡荆苷、荭草苷、异荭草苷[17]。对于其他竹笋加工剩余物如笋篼中的黄酮类物质构成尚不明确。
笋篼位于竹笋根部,在竹笋加工中是直接被弃用的部分,但是这一部分在竹笋加工剩余物中占比约60%。目前,利用细胞的体外培养研究笋篼黄酮(flavonoids from bamboo shoot processing residue,BSDF)相关活性的文献报道尚不多见。因此,本实验以笋篼为研究对象,醇提法提取笋篼中的黄酮类物质,并利用响应面对其提取条件进行了优化。同时,利用液质联用技术对BSDF中黄酮碳苷类物质进行鉴定,得到主要成分。最后,通过分析加入BSDF后HepG2细胞的活性变化及HepG2-IR细胞葡萄糖消耗量的变化研究了BSDF的体外抗肿瘤及降血糖活性。本文研究了竹笋加工剩余物中BSDF的提取、结构和生物活性,为其工业化应用提供了理论基础。
1 材料与方法
1.1 材料与仪器
笋篼(烘干、粉碎),浙江省杭州市余杭区径山竹茶园;芦丁标准品(纯度≥98%),阿拉丁试剂有限公司;95%乙醇(分析纯)、石油醚(30~60 ℃)、Al(NO3)3、NaNO2、NaOH、甲酸,成都市科隆有限公司;甲醇(色谱醇),羽宸精细化工有限公司;DMEM高糖培养基,武汉Procell公司;葡萄糖检测试剂盒,金客隆生物技术有限公司;CCK-8,北京智杰方远科技有限公司。
恒温水浴锅、电子天平,常州市亿能实验仪器厂;旋转蒸发仪,上海亚荣生化;冷冻干燥机,厦门东亚机械工业;可见分光光度计,上海美析仪器;UPLC-Triple-TOF/MS系统:AcquityTM ultra型高效液相色谱仪,美国沃特世;Triple TOF 5600+型飞行时间质谱,美国丹纳赫;Eppendorf minispan离心机,德国艾本德。
1.2 实验方法
1.2.1 笋篼预处理
新鲜笋篼洗净烘干、磨碎。称取适量样品,加入一定体积65%(体积分数)乙醇溶液,70 ℃水浴60 min。重复抽滤2次后合并滤液,浓缩冻干后保存备用。
1.2.2 芦丁标准曲线的绘制
以王杰等[18]的方法为基础,略有修改。芦丁溶解在60%乙醇中,配制成2 mg/mL的母液,然后用水稀释10倍。吸取0、0.25、0.5、1、2、3、4、6 mL到25 mL试管中,加1 mL 50 g/L的NaNO2溶液,摇匀静置6 min;加1.5 mL 100 g/L的Al(NO3)3溶液,摇匀静置6 min;加4 mL 200 g/L的NaOH溶液,使用体积分数60%的乙醇定容。摇匀静置15 min,在波长510 nm处测定吸光度。得到芦丁标准曲线为y=0.098 31x-0.004 75,R2=0.999 11。
1.2.3 BSDF含量测定
称取适量冻干后的BSDF样品,用体积分数60%的乙醇稀释到适宜浓度。按照1.2.2 中方法测定BSDF的吸光值。用标准曲线计算得出BSDF样液中黄酮浓度。计算如公式(1)所示:
(1)
式中,ρ,提取液浓度,mg/L;V,提取液体积,L;N,稀释倍数;m,笋篼原料质量,g。
1.2.4 BSDF提取条件优化
分别以乙醇体积分数(45%、55%、65%、75%、85%)、液料比(15∶1、20∶1、25∶1、30∶1、35∶1)(mL∶g)、提取时间(20、40、60、120、180 min)提取温度(30、40、50、60、70 ℃)为单因素检测不同条件下BSDF的提取率。响应面设计提取条件优化实验见表1。
表1 响应面因素水平表
Table 1 Response surface experimental design

水平因素A乙醇体积分数/%B液料比/(mL∶g)C提取时间/min15520∶15026525∶16037530∶170
1.2.5 BSDF碳苷类物质的UPLC-Triple-TOF/MS检测
采用聚酰胺树脂吸附纯化BSDF样品,收集40%乙醇的洗脱溶液,浓缩后冻干,备用。取适量冻干后BSDF样品用色谱级甲醇溶解,离心后用0.45 μm有机微孔滤膜过滤,备用。
色谱条件:流动相A为0.2%磷酸溶液,流动相B为体积分数0.2%的磷酸乙腈溶液;线性梯度洗脱:0 min,5%B;10 min,40%B;17 min,95%B;洗脱流速0.5 mL/min;柱温40 ℃;λ=280 nm;进样量4 μL。质谱条件:正负离子扫描模式;m/z 100~1 500;雾化气(GS1、GS2)55 psi;气帘气(CUR)35 psi;离子源温度600 ℃(正)、550 ℃(负);离子源电压-4 500 V(负)、5 500 V(正)。
1.2.6 BSDF生物活性研究
1.2.6.1 BSDF对HepG2细胞的抑制作用
本实验以HepG2细胞来研究BSDF体外抗肿瘤活性。采用DMEM高糖培养基在37 ℃,体积分数5% CO2培养箱里培养HepG2细胞。当细胞贴壁率达80%以上,弃去原培养基,PBS清洗2遍后用胰蛋白酶消化细胞。消化完成后用DMEM重悬细胞轻轻吹打均匀,细胞计数板计数后调整细胞密度,按照1.5×104 cells/mL、200 μL每孔铺板于96孔板中培养24 h。实验组分为低、中、高剂量组,BSDF质量浓度分别为200、400、800 μg/mL,对照组则继续用培养基培养。继续培养24 h后,每孔加入20 μL CCK-8试剂,继续培养1 h后,用酶标仪在波长450 nm处检测各孔吸光度。细胞增殖越多,则颜色越深,吸光值越大;细胞毒性越大,则颜色越浅,吸光值越小。细胞抑制率按公式(2)计算:
细胞抑制率![]()
(2)
1.2.6.2 BSDF降糖活性研究
按照1.2.6.1中方法处理细胞,调整细胞密度为1.5×104 cell/mL,然后以200 μL每孔铺板于96孔板中。培养24 h后,正常组更换DMEM完全培养基,模型组更换为胰岛素培养基(15 μg/mL)以建立胰岛素抵抗模型。继续培养24 h,建立正常组(对照组)、胰岛素抵抗模型组(IR)、二甲双胍阳性对照组(MET,100 μg/mL)、BSDF低、中、高浓度组(200、400、800 μg/mL),继续培养24 h。取各组细胞上清液2 μL,分别加入葡萄糖检测试剂200 μL,继续培养1 h后在波长505 nm处检测各孔吸光度值。以不加细胞实验组为空白组,葡萄糖消耗量=空白组细胞葡萄糖含量-给药组细胞葡萄糖含量。以CCK-8法测定细胞毒性。
2 结果与讨论
2.1 单因素实验结果
2.1.1 乙醇体积分数对BSDF提取率的影响
图1中,BSDF提取率在乙醇体积分数小于65%时呈上升趋势,大于65%后呈下降趋势,最高值在65%处。因此,提取溶剂体积分数选择65%。
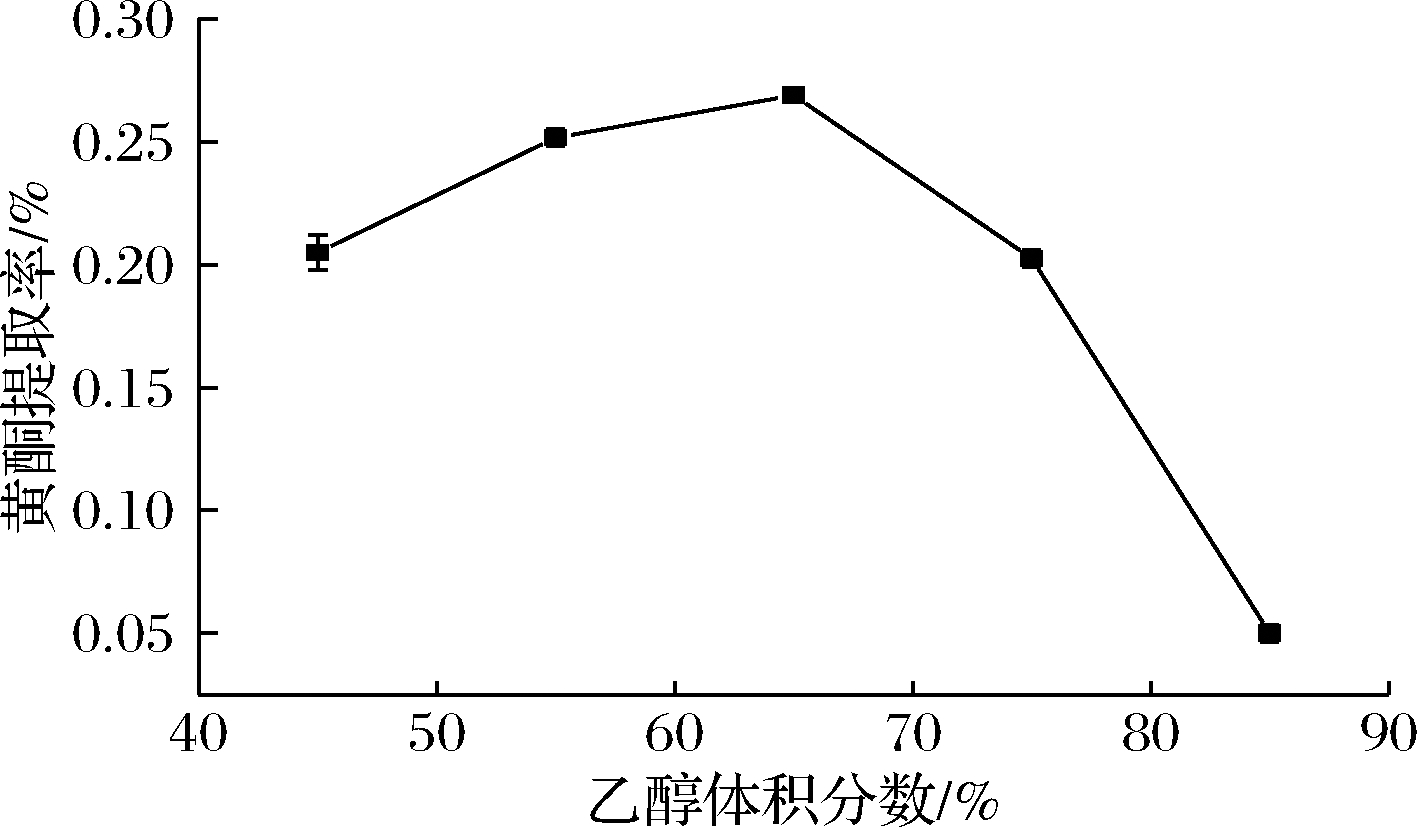
图1 乙醇体积分数对BSDF提取率的影响
Fig.1 Effect of ethanol concentration on extraction rate of BSDF
2.1.2 提取时间对BSDF提取率的影响
如图2所示,随提取时间延长,BSDF提取率也逐渐上升。在50~60 min时,BSDF提取率提升较大。这是由于当提取时间较短时,笋篼黄酮类化合物不能充分溶解出来。实验应在尽量短的时间内高效提取出黄酮,因此选择60 min来提取BSDF。
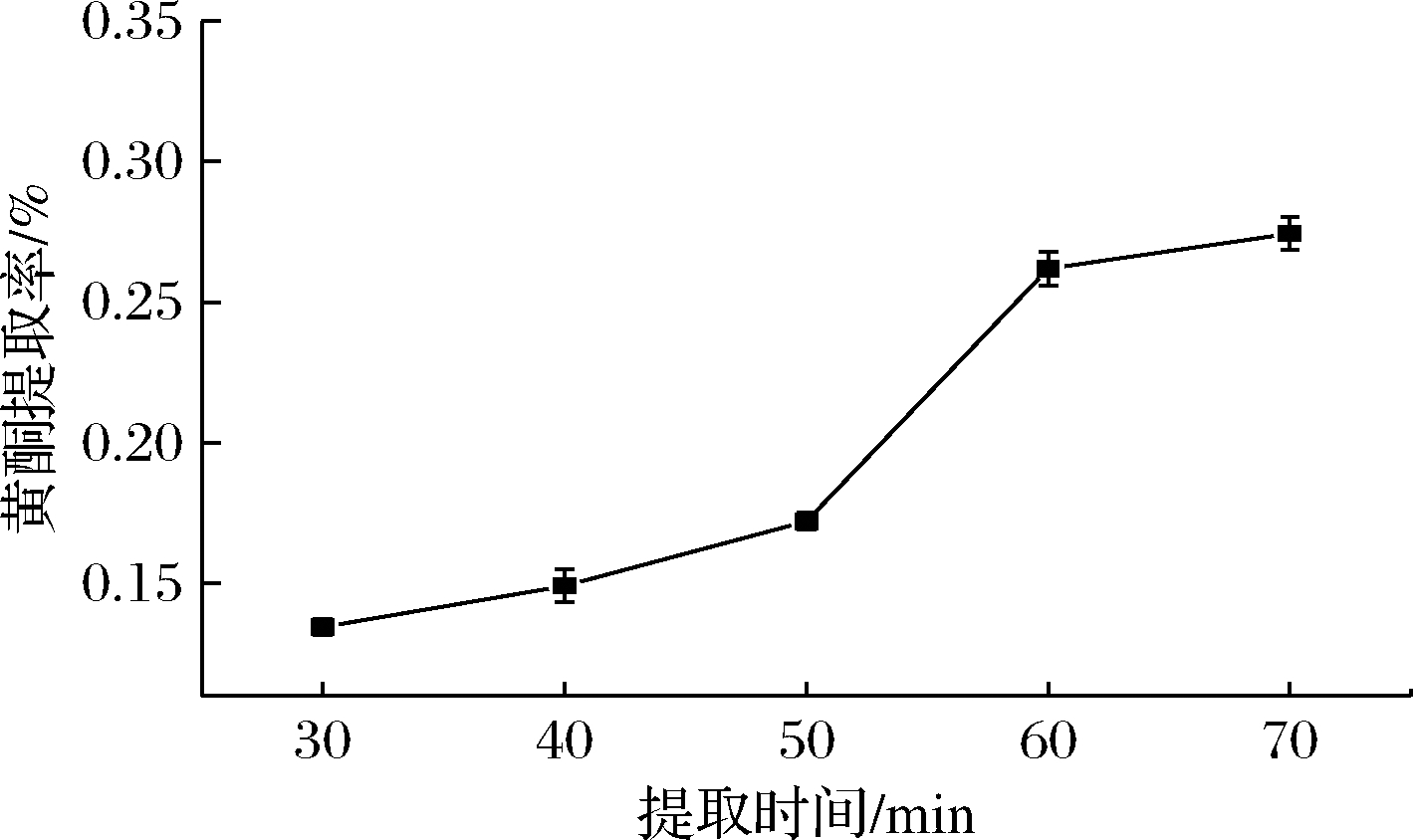
图2 提取时间对BSDF提取率的影响
Fig.2 Effect of time on extraction rate of BSDF
2.1.3 液料比对BSDF提取率的影响
如图3所示,BSDF提取率变化情况与图1相似,最高值出现在液料比为25∶1(mL∶g)。因此,以25∶1(mL∶g)为BSDF提取液料比。
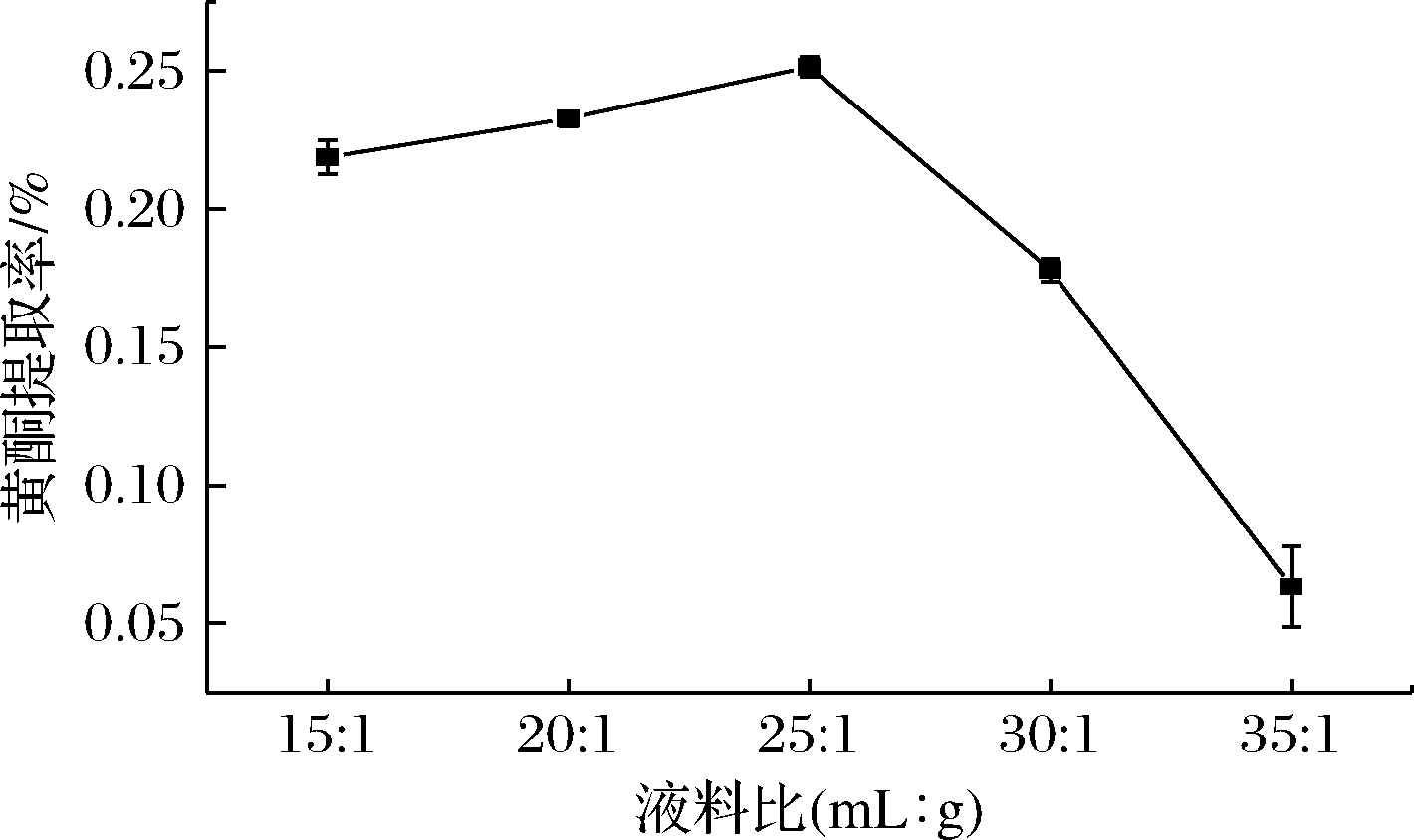
图3 液料比对BSDF提取率的影响
Fig.3 Effect of liquid-solid ratio on extraction rate of BSDF
2.1.4 提取温度对BSDF提取率的影响
如图4所示,BSDF提取率随温度的上升而增加,这可能是由于温度升高增大了黄酮在乙醇中的溶解度。但当温度过高,易造成提取液中活性成分被破坏,考虑乙醇沸点为78.4 ℃,选取70 ℃为实验温度。
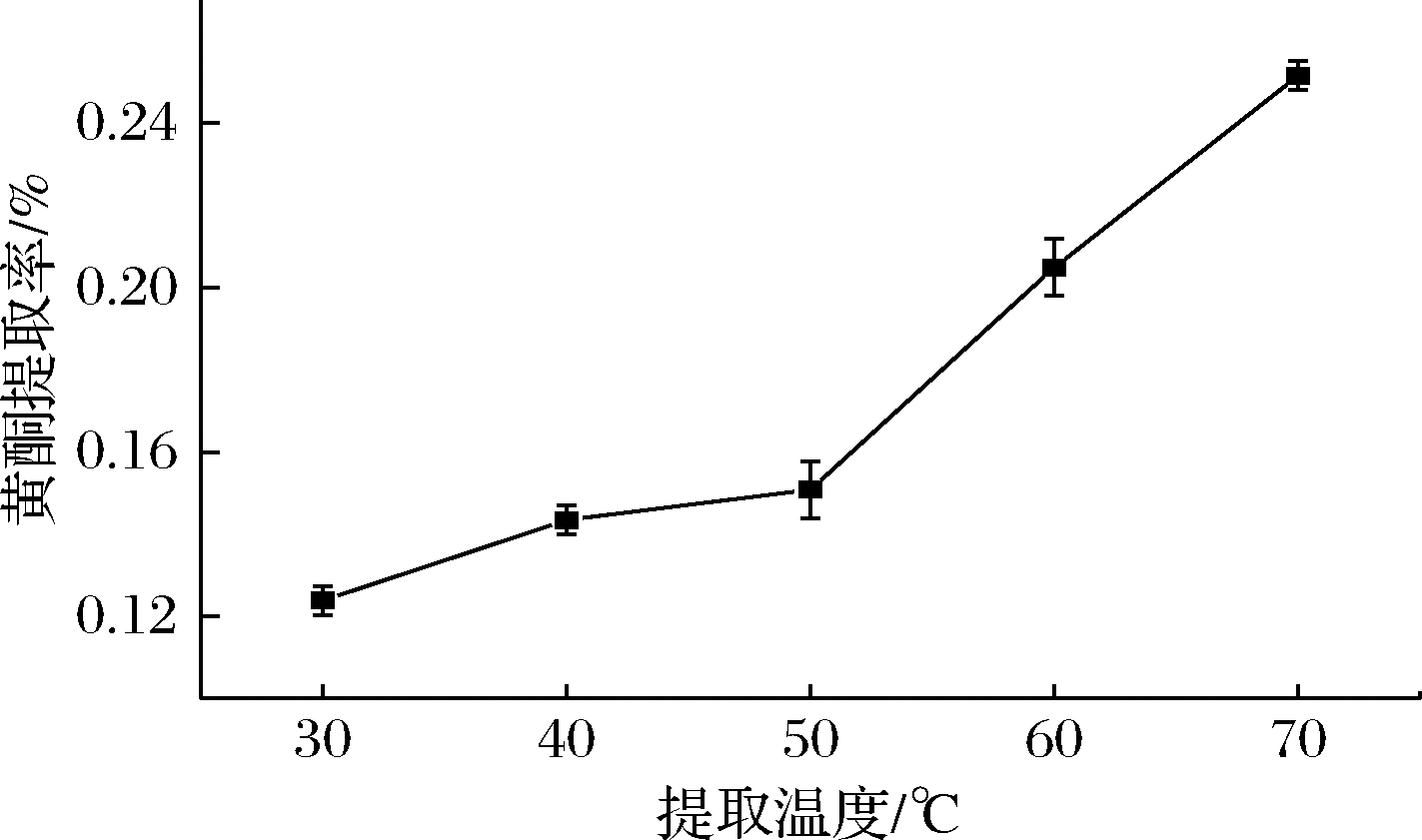
图4 提取温度对BSDF提取率的影响
Fig.4 Effect of temperature on extraction rate of BSDF
2.2 BSDF的提取优化结果
2.2.1 响应面回归模型建立及分析
本研究根据 Box-Benhnken 原理在单因素试验的基础上,设计3因素3水平的响应面试验,共计17 组。其方差分析如表2所示。
表2 响应面方差分析
Table 2 Response surface analysis of variance
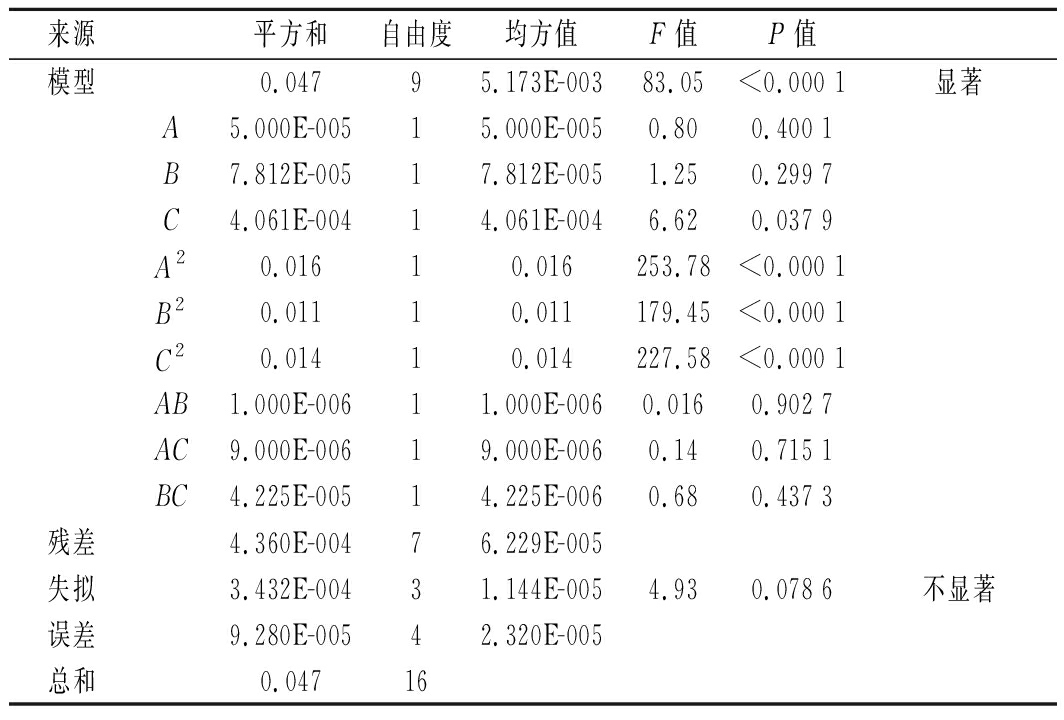
来源平方和自由度均方值F值P值模型0.04795.173E-00383.05<0.000 1显著A5.000E-00515.000E-0050.800.400 1B7.812E-00517.812E-0051.250.299 7C4.061E-00414.061E-0046.620.037 9A20.01610.016253.78<0.000 1B20.01110.011179.45<0.000 1C20.01410.014227.58<0.000 1AB1.000E-00611.000E-0060.0160.902 7AC9.000E-00619.000E-0060.140.715 1BC4.225E-00514.225E-0060.680.437 3残差4.360E-00476.229E-005失拟3.432E-00431.144E-0054.930.078 6不显著误差9.280E-00542.320E-005总和0.04716
由表2可知,响应值BSDF提取率模型显著。交互二次回归方程的F检验和失拟性检验结果表明,模型P<0.000 1,失拟项P>0.05,说明模型极显著且拟合程度好,故该模型可用来进行分析和预测。
2.2.2 交互项的响应面曲线图
交互作用的响应面曲线图(图5)反映了各因素对BSDF提取率的影响。由回归方程预测到最优提取组合为乙醇体积分数55%、液料比27∶1(mL∶g)、提取时间66 min,此条件下提取率最高为0.33%。

a-乙醇体积分数与液料比;b-乙醇体积分数与提取时间;c-液料比与提取时间
图5 三因素交互作用对BSDF提取率影响
Fig.5 The interaction of three factors affects the extraction rate of BSDF
2.3 笋篼黄酮碳苷类物质UPLC-Triple-TOF/MS鉴定结果
将经过聚酰胺树脂纯化后的BSDF样品进行UPLC-Triple-TOF/MS测定,得到其中主要的组成成分,并明确其中的黄酮苷类物质。发现笋篼黄酮类物质中主要含有黄酮苷类、黄酮醇类等物质。总离子流如图6所示,其中主要的黄酮苷类物质鉴定为以下4种。

图6 总离子流图
Fig.6 Total ion mass spectrogram
对图7的4种化合物1、2级质谱图进行分析,得到化合物Ⅰ(4.062 min):1 级质谱中准分子离子峰[M-H]-563.137 9,分子式为C26H28O14;二级质谱中生成m/z 503 [M-H-60]-、m/z 473 [M-H-90]-、m/z 443 [M-H-120]-、m/z 383 [M-H-120-60]-和m/z 353 [M-H-120-90]-的碎片离子。可知化合物Ⅰ主要裂解失去的碎片为黄酮C-苷类物质的特征碎片:60、90、120 Da。此结果与刘芹燕等[19]的实验进行对照,说明此化合物为夏佛塔苷。

a-化合物Ⅰ;b-化合物Ⅱ;c-化合物Ⅲ;d-化合物Ⅳ
图7 四种BSDF碳苷类化合物的1、2级质谱图
Fig.7 Compound Ⅳ mass spectrogram
化合物Ⅱ(4.719 min):1 级质谱中准分子离子峰[M-H]-533.127 0,分子式为C25H26O13;二级质谱中生成m/z 515 [M-H-H2O]-、m/z 443 [M-H-90]-、m/z 383 [M-H-120-60]-和m/z 353 [M-H-120-90]-的碎片离子,也属于黄酮C-苷类物质的特征离子。结合化合物分子式结构,推断该化合物应为芹菜素-6,8-C-二那阿拉伯糖苷。
化合物Ⅲ(5.459 min)和化合物Ⅳ(5.628 min):两者为同分异构体,1级质谱中它们的准分子离子峰分别为[M-H]-547.1469、[M-H]-547.1437,分子式为C26H28O13;在二级质谱中两者都含有m/z 487 [M-H-60]-、m/z 457 [M-H-90]-、m/z 427 [M-H-120]-,这些都是黄酮C-苷类化合物特征离子碎片。结合文献[20],化合物Ⅲ为白杨素-6-C-β-D-葡萄糖苷-8-C-α-L-阿拉伯糖苷,化合物Ⅳ为白杨素-6-C-阿拉伯糖-8-C-葡萄糖苷。
2.4 BSDF的生物活性研究
2.4.1 BSDF的抗肿瘤活性检测结果
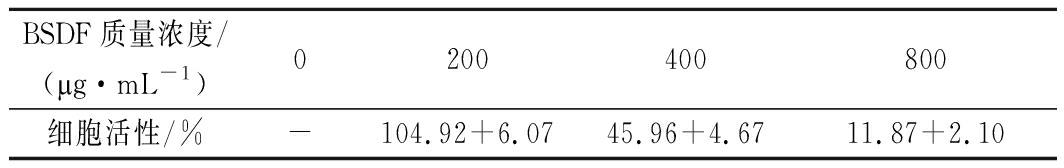
黄酮类物质的抗肿瘤活性近年来一直被人们广泛关注[21]。加入不同浓度BSDF(低、中、高)后HepG2细胞的活性如表3所示。与对照组相比,BSDF质量浓度与HepG2细胞活性抑制率成正比,随着BSDF质量浓度的增加细胞活性逐渐降低。一般认为,肿瘤药物敏感性试验结果与体内化疗疗效总符合率达到85%[22],这说明BSDF对HepG2细胞增殖具有较强的抑制作用。
表3 不同浓度BSDF对HepG2细胞活性的影响
Table 3 Effect of BSDF concentration on cell viability of HepG2
2.4.2 BSDF的降血糖活性检测结果
本实验通过高浓度胰岛素诱导HepG2细胞,建立体外胰岛素抵抗模型来判断BSDF的降糖活性。胰岛素抵抗是Ⅱ型糖尿病主要的诱因之一,是指组织对胰岛素的敏感性下降,代偿性引起胰岛β细胞分泌胰岛素增加,从而产生高胰岛素血症,其实质为胰岛素介导的细胞糖代谢能力的减低[23]。建立胰岛素抵抗模型可通过高糖、高脂、高胰岛素来进行诱导,本实验选择高浓度胰岛素诱导HepG2细胞建立,因此,需要选择合适的胰岛素浓度,建模成功后给药,通过葡萄糖消耗量的变化确定BSDF的降糖效果。
加入胰岛素(2.5,5,15,30,60 μg/mL)诱导HepG2细胞,葡萄糖含量检测结果见表4。当胰岛素质量浓度在15 μg/mL时,与对照组相比,葡萄糖消耗量降低2.01 mmol/L,说明此浓度下的胰岛素影响了HepG2细胞正常的葡萄糖摄取,产生了胰岛素抵抗的效果。而且此浓度对细胞活性影响最小。因此,选择15 μg/mL来建立HepG2-IR模型。
表4 不同质量浓度胰岛素对HepG2细胞葡萄糖消耗量及细胞活性的影响
Table 4 Effect of insulin concentration on glucose consumption and cell viability of HepG2
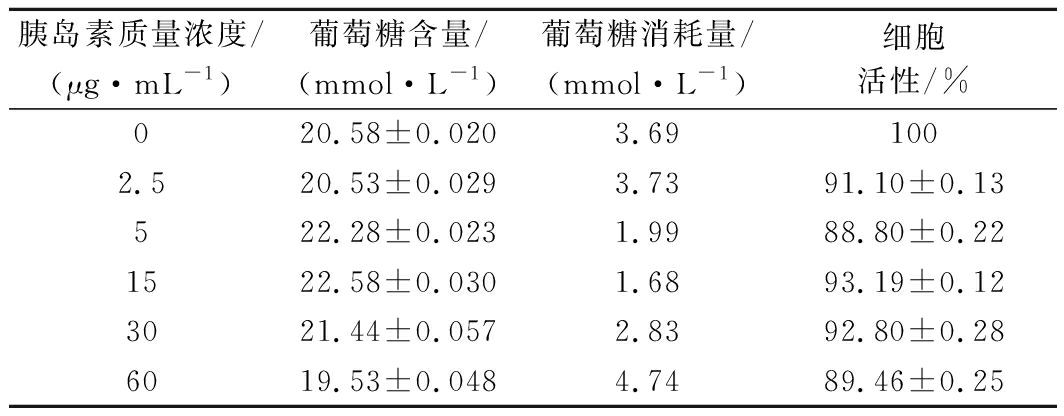
胰岛素质量浓度/(μg·mL-1)葡萄糖含量/(mmol·L-1)葡萄糖消耗量/(mmol·L-1)细胞活性/%020.58±0.0203.691002.520.53±0.0293.7391.10±0.13522.28±0.0231.9988.80±0.221522.58±0.0301.6893.19±0.123021.44±0.0572.8392.80±0.286019.53±0.0484.7489.46±0.25
2.4.3 BSDF对HepG2-IR细胞的影响
成功建立HepG2-IR细胞模型后,分别加入200、400、800 μg/mL的BSDF继续培养。24 h后测定其葡萄糖消耗量及细胞活性。发现仅在BSDF-800组细胞活性降低到95%左右,如图8所示,而其余组细胞活性没有明显变化。图9中,BSDF各组与IR组相比葡萄糖消耗量有所增加,具有显著性差异。这说明不同浓度下的BSDF都能够促进IR组细胞对葡萄糖的摄取利用,综合图8结果来看,当BSDF质量浓度为400 μg/mL时具有最佳的降糖效果。
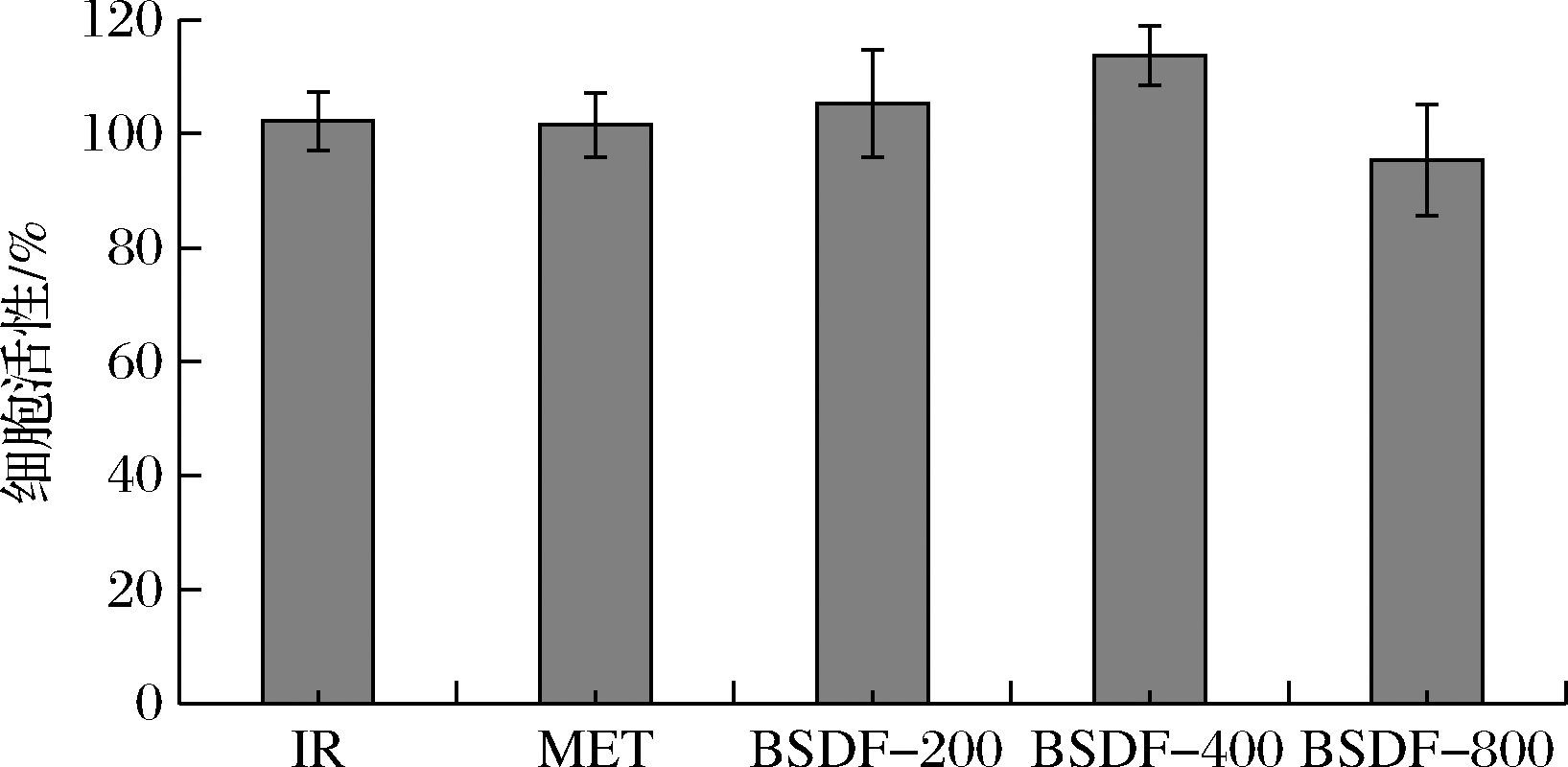
图8 不同质量浓度对HepG2-IR细胞活性的影响
Fig.8 Effect of BSDF concentration on cell viability of HepG2
注:IR为模型组;MET为二甲双胍组;BSDF-200、BSDF-400、
BSDF-800为BSDF不同浓度组(下同)
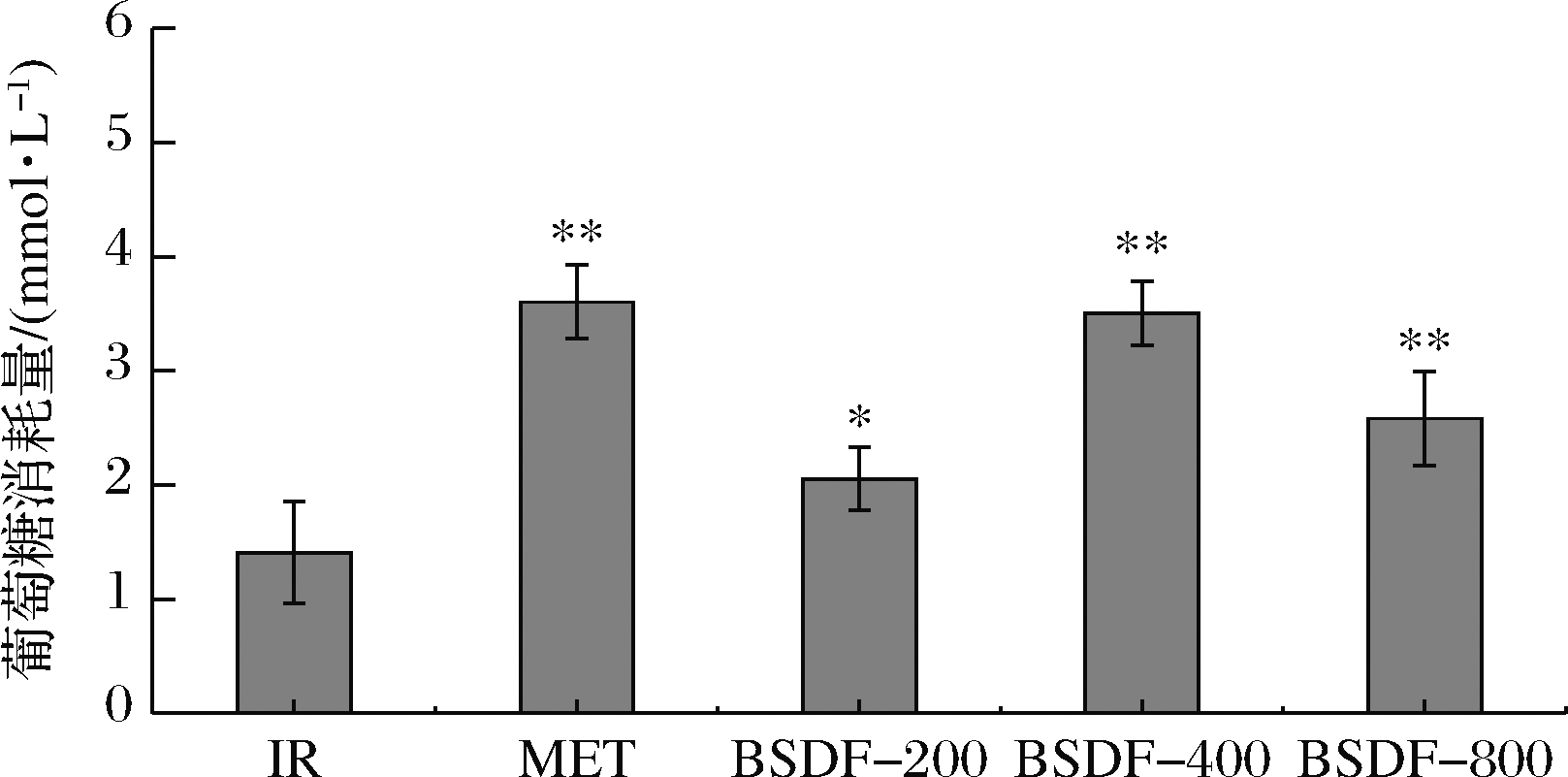
图9 不同质量浓度BSDP对HepG2-IR细胞
葡萄糖消耗量的影响
Fig.9 Effect of BSDF concentration on glucose consumption of HepG2.
3 结论
本研究以笋篼为原料,并从中提取功能性成分黄酮。利用响应面优化了BSDF提取最佳工艺为:乙醇体积分数55%、液料比27∶1(mL∶g)、提取时间66 min,BSDF提取率最高为0.33%。对经过聚酰胺树脂柱纯化后的BSDF干粉通过UPLC-Triple-TOF/MS技术,鉴定BSDF中碳苷类物质,发现主要有4种。以质谱图为依据,根据碎片离子峰,推断出这4种化合物可能为夏佛塔苷、白杨素-6-C-阿拉伯糖-8-C-葡萄糖苷、芹菜素-6,8-C-二那阿拉伯糖苷、白杨素-6-C-β-D-葡萄糖苷-8-C-α-L-阿拉伯糖苷。但这4种化合物准确的结构信息还有待进一步鉴定分析。BSDF体外活性研究表明,BSDF对人肝癌细胞HepG2有一定的抑制作用,且随着浓度增加其抑制作用也呈现增强趋势;在降糖方面,BSDF可以改善15 μg/mL胰岛素诱导的HepG2细胞葡萄糖消耗情况,起到一定的降糖作用。其中,降糖效果最佳且不对细胞活性造成影响的BSDF质量浓度为400 μg/mL。这表明HepG2细胞对胰岛素的敏感性可能是BSDF防治2型糖尿病的作用机制之一[24]。然而,当BSDF质量浓度为800 μg/mL时,HepG2细胞活性降低,因此其降糖作用也不能排除细胞增殖方面的影响,这还有待进一步研究。
本研究对BSDF的提取条件进行了优化,鉴定了BSDF中碳苷类化合物,并对其体外活性进行了简单的研究探讨,明确了其部分结构信息及活性。但是,对BSDF活性方面的研究还需要更深入的了解,对于其活性机制如蛋白、基因等方面的表达还有待进一步探讨。
[1] HE M X,WANG J L,QIN H,et al.Bamboo:A new source of carbohydrate for biorefinery[J].Carbohydrate Polymers,2014,111(20):645-654.
[2] ZHAO H L,MIKIO K.Plantation future of bamboo in China[J].Journal of Forestry Research,2004,15(3):233-242.
[3] WU W J,HU J,GAO H Y,et al.The potential cholesterol-lowering and prebiotic effects of bamboo shoot dietary fibers and their structural characteristics[J].Food Chemistry,2020,332:127 372.
[4] WANG Y L,CHEN J,WANG D M,et al.A systematic review on the composition,storage,processing of bamboo shoots:Focusing the nutritional and functional benefits[J].Journal of Functional Foods,2020,71:104 015.
[5] CHEN G J,CHEN X H,YANG B,et al.New insight into bamboo shoot (Chimonobambusa quadrangularis) polysaccharides:Impact of extraction processes on its prebiotic activity[J].Food Hydrocolloids,2019,95:367-377.
[6] 晏俊玲, 樊扬,秦川,等.苦竹笋总黄酮大孔树脂纯化工艺及其体外抗炎活性研究[J].食品与发酵工业,2020,46(23):184-192.
YAN J L,FAN Y,QIN C,et al.Purification of total flavonoids from bamboo shoots of Pleioblastus amarus with macroporous resin and its anti-inflammation activity[J].Food and Fermentation Industries,2020,46(23):184-192.
[7] CHEN G J,BUN F,CHEN X H,et al.Ultrasonic extraction,structural characterization,physicochemical properties and antioxidant activities of polysaccharides from bamboo shoots (Chimonobambusa quadrangularis) processing by-products[J].International Journal of Biological Macromoleculer,2018,112:656-666.
[8] 彭昕,黄亮,王平,等.雷竹笋总黄酮和总甾醇的抗氧化性与抑菌性[J].经济林研究,2017,35(3):179-185.
PENG X,HUANG L,WANG P,et al.Antioxidant and bacteriostatic properties of total flavonoids and total sterols in Phyllostachys edulis[J].Economic Forest Research,2017,35(3):179-185.
[9] LI X F,FU B T,GUO J,et al.Bamboo shoot fiber improves insulin sensitivity in high-fat diet-fed mice[J].Journal of Functional Foods,2018,49:510-517.
[10] 赵益臻.雷竹笋笋汁饮料的生产加工[J].现代食品,2019(2):161-164.
ZHAO Y Z.The production and processing of Thunder bamboo shoot juice beverage[J].Modern Food,2019(2):161-164.
[11] 胡永乐,张传海,张媛,等.竹屑制备天然防腐剂的工艺优化及抑菌性能研究[J].福建农业学报,2020,35(2):226-234.
HU Y L,ZHANG C H,ZHANG Y,et al.Study on the process optimization of preparing natural preservative of bamboo chips and its antibacterial property[J].Fujian Journal of Agriculture Science,2020,35(2):226-234.
[12] CHEN G J,LI C F,WANG S S,et al.Characterization of physicochemical properties antioxidant activity of polysaccharides from shoot residues of bamboo (Chimonobambusa quadrangularis):Effect of drying procedures[J].Food Chemistry,2019,292:281-293.
[13] 张静,王淑培,阙茂垚,等.竹笋加工废弃物中总黄酮的提取工艺研究[J].食品研究与开发,2017,1:23-27.
ZHANG J,WANG S P,QUE M Y,et al.Study on extraction technology of total flavonoids from bamboo shoot processing waste[J].Food Research and Development,2017,1:23-27.
[14] 段丽娜,郭磊,刘超,等.响应面法优化龙竹竹叶黄酮的提取工艺及抗氧化研究[J].安徽农业科学,2018,46(27):169-172.
DUAN L N,GUO L,LIU C,et al.Study on optimization of extraction technology and antioxidant of flavonoids from Bambusa edulis by response surface method[J].Journal of Anhui Agriculture Science,2018,46(27):169-172.
[15] 李夏冰,金昭君,荀航,等.竹叶总黄酮对脂肪酸合酶及人乳腺癌细胞的抑制作用[J].林产化学与工业,2017,37(5):113-118.
LI X B,JIN Z J,XUN H,et al.Inhibitory effect of total flavones in bamboo leaves on fatty acid synthase and human breast cancer cells[J].Chemistry and Industry of Forest Products,2017,37(5):113-118.
[16] LI P C,TANG Y F,LIU L M,et al.Therapeutic potential of buckwheat hull flavonoids in db/db mice,a model of type 2 diabetes[J].Journal of Functional Foods,2019(52):284-290.
[17] 陈丹丹,郭雪峰,赵蕾,等.HPLC法同时检测刚竹属竹叶中4种黄酮碳苷的含量[J].林产化学与工业,2019,39(5):108-114.
CHEN D D,GUO X F,ZHAO L,et al.HPLC method was used to simultaneously detect the contents of four flavonoid carbenosides in the leaves of Phyllostachys gonophora[J].Chemistry and Industry of Forest Products,2019,39(5):108-114.
[18] 王杰,王瑞芳,王园,等.响应面优化马齿苋黄酮水提工艺及其抗氧化活性评[J].食品与发酵工业,2020,46(19):197-204.
WANG J,WANG R F,WANG Y,et al.Optimization of water extraction process and antioxidant activity of portulaca flavone by response surface[J].Food and Fermentation Industries,2020,46(19):197-204.
[19] 刘芹燕,巫兴东,陈东,等.苏黄止咳胶囊中非挥发性成分的LC-MS分析[J].中成药,2019,41(6):1 434-1 445.
LIU Q Y,WU X D,CHEN D,et al.LC-MS analysis of non-volatile components in Suhuang Zhike Capsule[J].Chinese Traditional Patent Medicine,2019,41(6):1 434-1 445.
[20] 彭春,唐玲,王燕.基于UPLC-Q-TOF/MS技术的三黄片化学成分解析[J].中国医院药学杂志,2020,40(7):757-764.
PENG C,TANG L,WANG Y.Chemical composition analysis of Sanhuang Tablets based on UPLC-Q-TOF/MS technology[J].China Journal of Hospital Pharmacy,2020,40(7):757-764.
[21] WEI Y,WU T H Y,LRUNG S S Y,et al.Flavonoids potentiated anticancer activity of cisplatin in non-small cell lung cancer cells in vitro by inhibiting histone deacetylases[J].Life Science,2020,258:118 211.
[22] 杨慧敏,吴良如,杨金来,等.12种竹笋蛋白对肿瘤细胞体外增殖的抑制作用[J].安徽农业科学,2019,47(12):181-186.
YANG H M,WU L R,YANG J L,et al.Inhibitory effect of 12 kinds of bamboo shoot proteins on proliferation of tumor cells in vitro[J].Journal of Anhui Agricultural Sciences,2019,47(12):181-186.
[23] 舒成闯.马齿苋多糖改善HepG2细胞胰岛素抵抗的研究[D].南昌:江西科技师范大学,2016.
SHU C C.Study on improvement of Insulin resistance in HepG2 cells by Portulaca polysaccharide[D].Nanchang:Jiangxi Science and Technology Normal University,2016.
[24] 苏瑾,焦钧,于莲,等.山药多糖对人肝癌HepG2细胞葡萄糖消耗能力及胰岛素抵抗的影响[J].中国药房,2015,26(4):458-460.
SU J,JIAO J,YU L,et al.Effects of Chinese yam polysaccharide on glucose consumption and insulin resistance of human Hepatocellular carcinoma HepG2 cells[J].China Pharmacy,2015,26(4):458-460.