唾液酸(sialic acids,SA),又称神经氨酸,是一类含有9碳的酸性氨基糖[1],主要在糖蛋白和糖脂的末端以短链残基的形式存在[2]。唾液酸广泛分布于自然界各种生物体中,在哺乳动物的脑、乳、血液和神经组织黏蛋白中含量较高[3],积极参与体内蛋白水解保护、细胞识别、生殖、感染、免疫和认知发育等生物学作用[4]。
母乳中含量丰富的唾液酸,对婴幼儿神经系统的发育以及抵抗肠道感染发挥重要作用[5]。当母乳不足时,婴儿配方粉成为母乳主要的替代品。然而婴儿配方粉中的唾液酸在含量、种类以及结构方面与母乳差异较大[6],有研究表明,母乳喂养的婴儿在认知发育方面的总体得分高于婴儿配方奶粉喂养。为了更好地匹配母乳成分,婴儿配方奶粉已经将唾液酸作为奶粉优化的参数之一[7]。
唾液酸的检测方法主要有分光光度法[8]、高效液相色谱法[9-10]、气相色谱法[11]、质谱分析法[12-13]和核磁共振法等[11]。分光光度法的优点是简单快捷,但不能区分唾液酸的结构,且对样品的纯度要求较高;高效液相色谱法和气相色谱法都需要衍生处理,实验过程复杂;液相色谱-质谱联用灵敏度高,不需要衍生,然而回收率较差;核磁共振法的样品需求量大且灵敏度较差,更适合对唾液酸的定性[11]。
高效阴离子交换色谱-脉冲安培检测法(high-performance anion-exchange chromatography with pulsed amperometric detection,HPAEC-PAD)主要用于糖类物质的检测。此方法不需要衍生、操作简单、具有良好的选择性、灵敏度较高且环境友好,适用于乳源唾液酸的检测。TANG等[14]采用HPAEC-PAD法对牛乳及制品中的Neu5Ac和Neu5Gc同时进行检测,但该方法不能适用于婴儿配方粉中唾液酸的检测,因为婴儿配方粉中含有的杂质化合物会干扰唾液酸的离子峰图。有报道采用离子色谱法测定母乳中游离唾液酸[15],但还未应用于母乳中总唾液酸的检测,目前,能同时应用于母乳和婴儿配方粉中唾液酸的检测方法国内外还未见报道。
本文采用酸水解法提取不同结合形态中的唾液酸,使用离子色谱前处理柱纯化婴儿配方粉水解液,建立了高效阴离子色谱-脉冲安培法测定母乳和婴儿配方粉中Neu5Ac和Neu5Gc的方法,并应用该方法测定不同泌乳期母乳及不同阶段市售婴儿配方粉中唾液酸的含量。
1 材料与方法
1.1 仪器
Dionex ICS-6000离子色谱、Dionex CarboPac PA20分析柱(3 mm×150 mm,填料:树脂)、Dionex CarboPac PA20保护柱(3 mm×30 mm,填料:树脂),Thermo Scientific公司;Cleanert IC-A前处理小柱(1cc 50/pkg)、0.22 μm滤膜,Agela公司;Milli-Q.A10超纯水净化器,美国MILLIPORE公司;3K-15高速冷冻离心机,美国Sigma公司;Polystat K6恒温水浴锅,德国Huber公司;AL104电子天平,梅特勒-托利多仪器有限公司。
1.2 样品与试剂
母乳(初乳、过渡乳、成熟乳),北京三元食品股份有限公司国家母婴乳品健康工程技术研究中心提供;婴儿配方奶粉(Ⅰ段、Ⅱ段、Ⅲ段),各大超市;N-乙酰神经氨酸(Neu5Ac,色谱纯,纯度≥97%)、醋酸钠,Sigma公司;N-羟乙酰神经氨酸(Neu5Gc,色谱纯,纯度≥98.2%),源叶生物;NaOH、甲酸、H2SO4、盐酸、三氟乙酸、三氯乙酸,均为分析纯,Fisher Scientific公司;试验用水为超纯水。
1.3 标准溶液的配制
称取一定质量的标品,将Neu5Ac溶于超纯水中,Neu5Gc分别溶于超纯水和50 mmol/L NaCl溶液,并按表1中的质量浓度配制混合标准系列工作液。
表1 标准系列工作液中Neu5Ac和Neu5Gc的质量浓度
Table 1 Mass concentrations of Neu5Ac and Neu5Gc in standard series working solutions
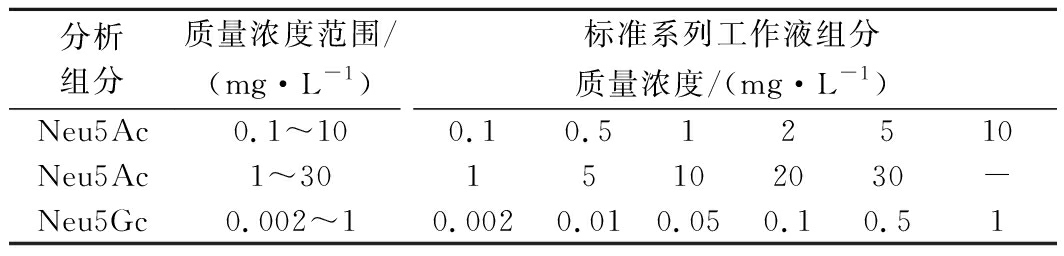
分析组分质量浓度范围/(mg·L-1)标准系列工作液组分质量浓度/(mg·L-1)Neu5Ac0.1~100.10.512510Neu5Ac1~3015102030-Neu5Gc0.002~10.0020.010.050.10.51
1.4 样品前处理
母乳和婴儿配方粉样品的前处理过程如图1所示。
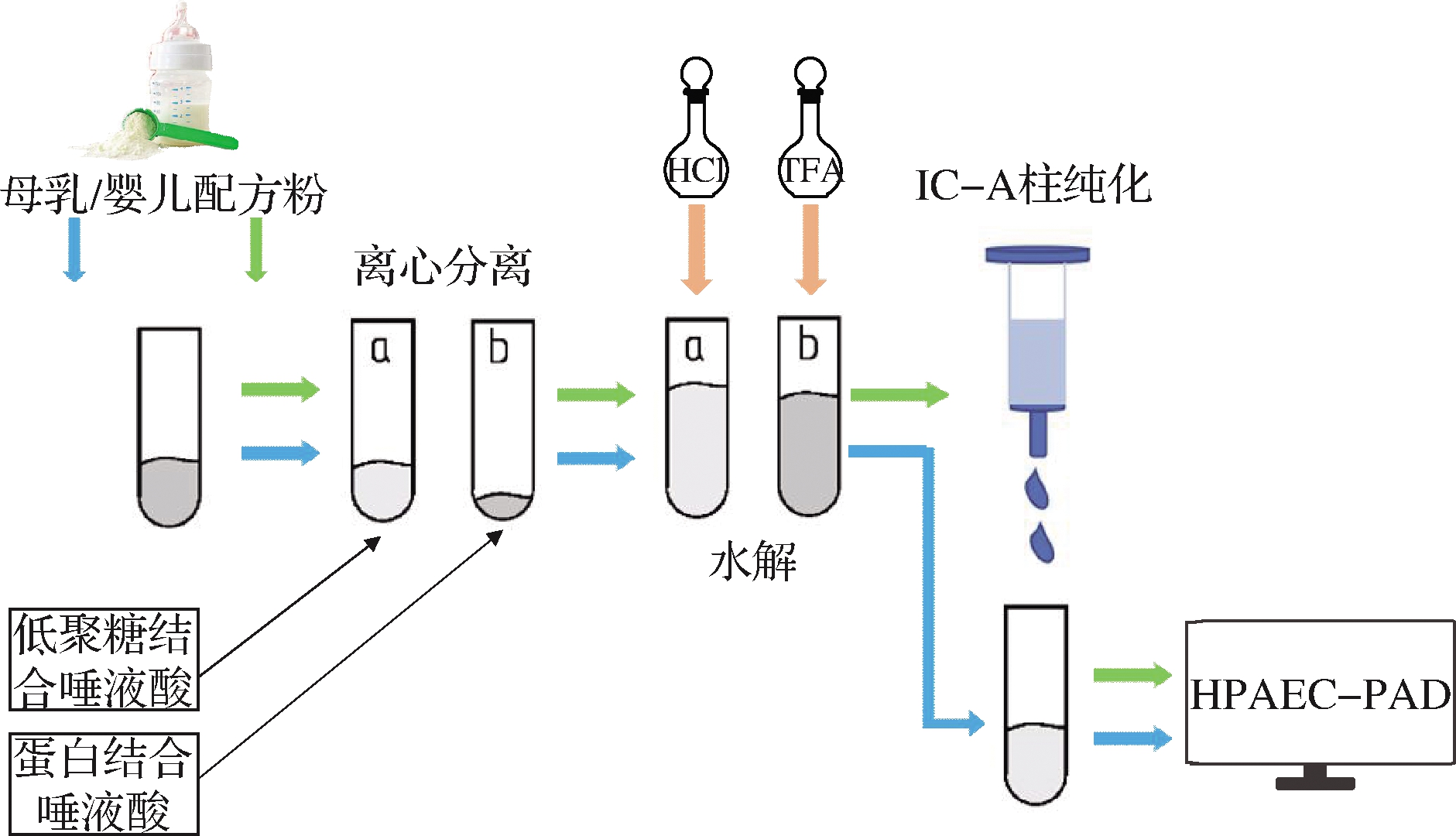
图1 样品前处理流程图
Fig.1 Flow chart of sample pretreatment
1.4.1 母乳
吸取200 μL母乳于离心管中,加入200 μL质量分数20%的三氯乙酸溶液沉淀蛋白,混匀后冰浴10 min,在4 ℃、3 000 r/min条件下离心30 min。将上清液移入新的离心管,于沉淀中加入500 μL冷的5%的三氯乙酸溶液洗涤,充分混匀后继续在4 ℃、3 000 r/min条件下离心30 min,吸取上清液到第1次的上清液中。合并上清液并加入1 mL 0.1 mol/L三氟乙酸溶液80 ℃水解30 min。将处理后的沉淀中加入1 mL 体积分数0.1%盐酸,80 ℃水解 75 min,取出后冷却至室温。将2组水解液混合,用超纯水定容至10 mL,混匀。吸取1 mL母乳定容液过0.22 μm有机滤膜,滤液按色谱条件分析。
1.4.2 婴儿配方粉
精确称量1 g奶粉于10 mL超纯水中,加热至50 ℃,使奶粉充分溶解。按1.4.1的方法对复溶婴儿配方粉进行处理,并定容至10 mL进行纯化。首先将Cleanert IC-A小柱用10 mL超纯水活化,静置10 min,然后加入1 mL奶粉定容液。用5 mL的超纯水清洗,以去除树脂中任何未带电的残余化合物。最后用5 mL的50 mmol/L NaCl溶液将结合在树脂上的唾液酸洗脱下来。吸取1 mL洗脱液过0.22 μm有机滤膜,滤液按色谱条件分析。
1.5 色谱条件
采用CarboPac PA20(3 mm×150 mm)分析柱,Dionex CarboPac PA20(3 mm×30 mm)保护柱,ED6000脉冲安培检测器,Au工作电极,Ag/AgCl参比电极,糖标准四电位波形。柱温30 ℃,检测器温度30 ℃,流速0.5 mL/min,进样量为10 μL,以A:超纯水、B:1 mol/L醋酸钠、C:200 mmol/L NaOH为淋洗液进行梯度洗脱,洗脱程序如表2所示。
表2 梯度洗脱程序表
Table 2 Gradient elution procedure
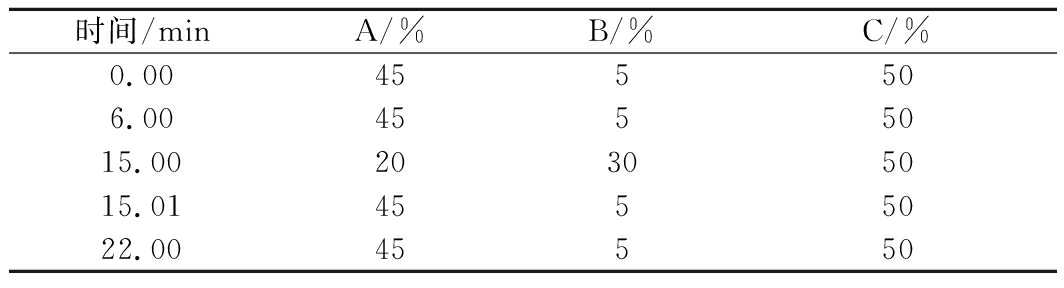
时间/minA/%B/%C/%0.00455506.004555015.0020305015.014555022.0045550
2 结果与分析
2.1 色谱条件优化
CarboPac PA20色谱柱具有柱容量小、能分离常见的单糖和多糖等特点,更加适合分离保留性较强和复杂基质的化合物。在CarboPac PA20柱上等度洗脱和梯度洗脱对Neu5Ac和Neu5Gc的影响如图2所示,采用50 mmol/L的醋酸钠和100 mmol/L NaOH溶液对2种标品进行等度洗脱,发现此时Neu5Ac的响应值高且分离度达到4.51,但Neu5Gc的响应值和分离度过低(图2-a)。而采用20~300 mmol/L的醋酸钠和100 mmol/L NaOH溶液在5~15 min进行梯度洗脱时(图2-b),发现Neu5Gc的响应值高,分离度达到3.43,但Neu5Ac的分离度却又降低,且基线不稳定。结合这2种洗脱方法,不断优化,最终的梯度洗脱程序如表2所示。离子流图如图2-c所示,此时的峰形尖锐、对称性好、基线稳定、响应值和分离度都高,更有利于含量较低的Neu5Gc的检测和定量。
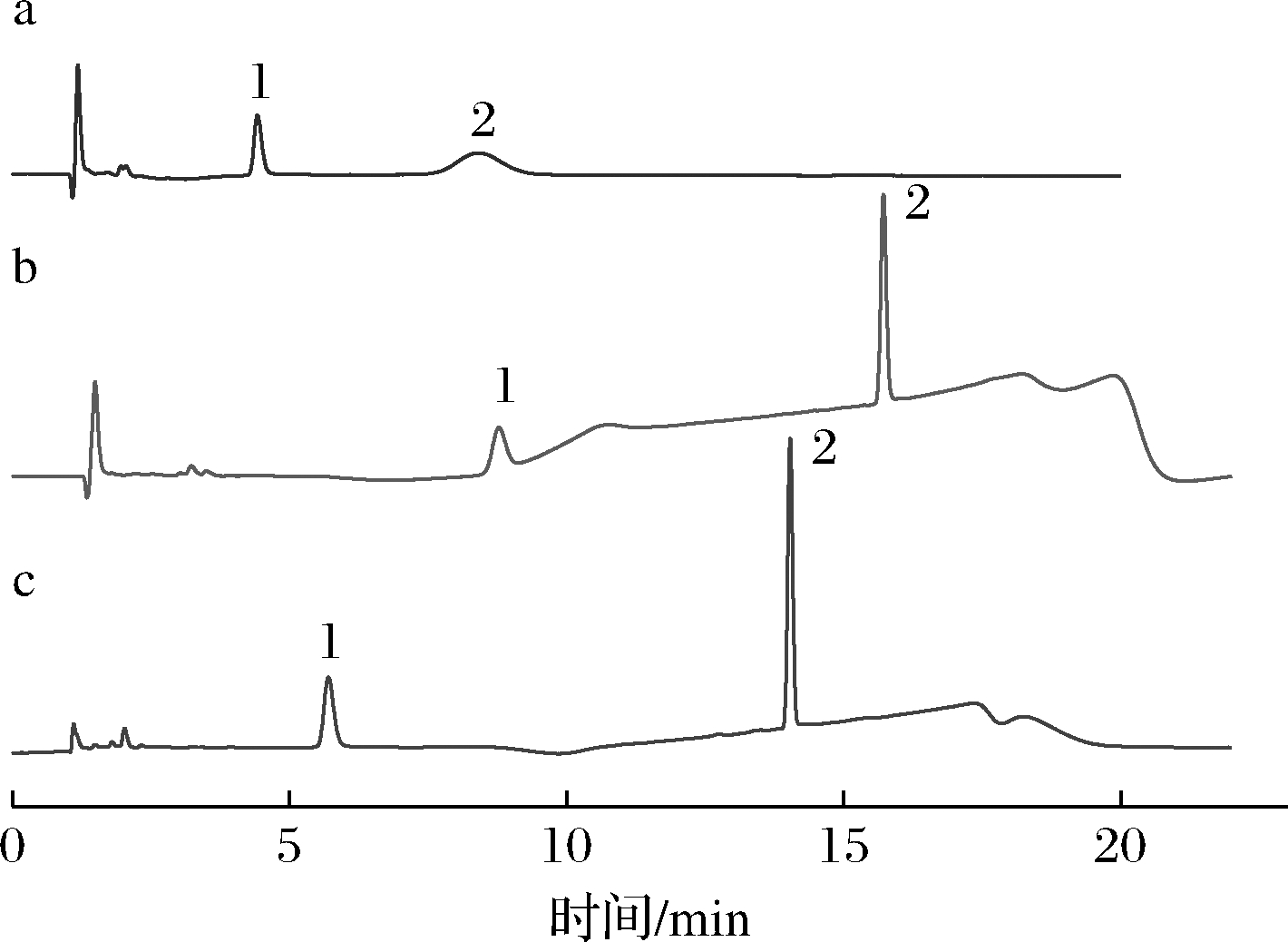
a-等度洗脱;b-梯度洗脱1;c-梯度洗脱2;1-Neu5Ac;2-Neu5Gc
图2 不同洗脱程序的离子流图
Fig.2 Ion flow diagram of different elution procedures
2.2 样品前处理优化
2.2.1 酸水解时间优化
唾液酸在母乳中主要与低聚糖结合,而在婴儿配方粉中主要与蛋白质结合,再加上母乳和婴儿配方粉含有大量乳糖、半乳糖、低聚糖等碳水化合物复杂基质,使得乳中唾液酸的检测极具挑战性[10]。为了能够更好地检测唾液酸的含量,一般通过化学水解法将唾液酸从结合态中释放出来。
酸水解法是目前应用最广泛的方法,通过温和的酸加热样品至70~90 ℃实现水解。由于唾液酸在乳品中存在不同的结合形式,有研究通过离心分离低聚糖和蛋白,然后采用不同的水解条件对唾液酸进行处理,从而达到更好的水解效果[16]。LACOMBA等[17]对不同水解酸(稀盐酸、三氟乙酸、稀硫酸、乙酸)进行了比较研究,结果显示稀盐酸和三氟乙酸的水解效果最好。本研究在此基础上以母乳为对象,分别考察了盐酸对沉淀部分(蛋白结合唾液酸)和三氟乙酸对上清液部分(低聚糖结合唾液酸)水解时间的影响。如图3所示,盐酸在75 min时对蛋白结合唾液酸的释放效果最好,而低聚糖结合唾液酸在30 min时水解效果最佳。
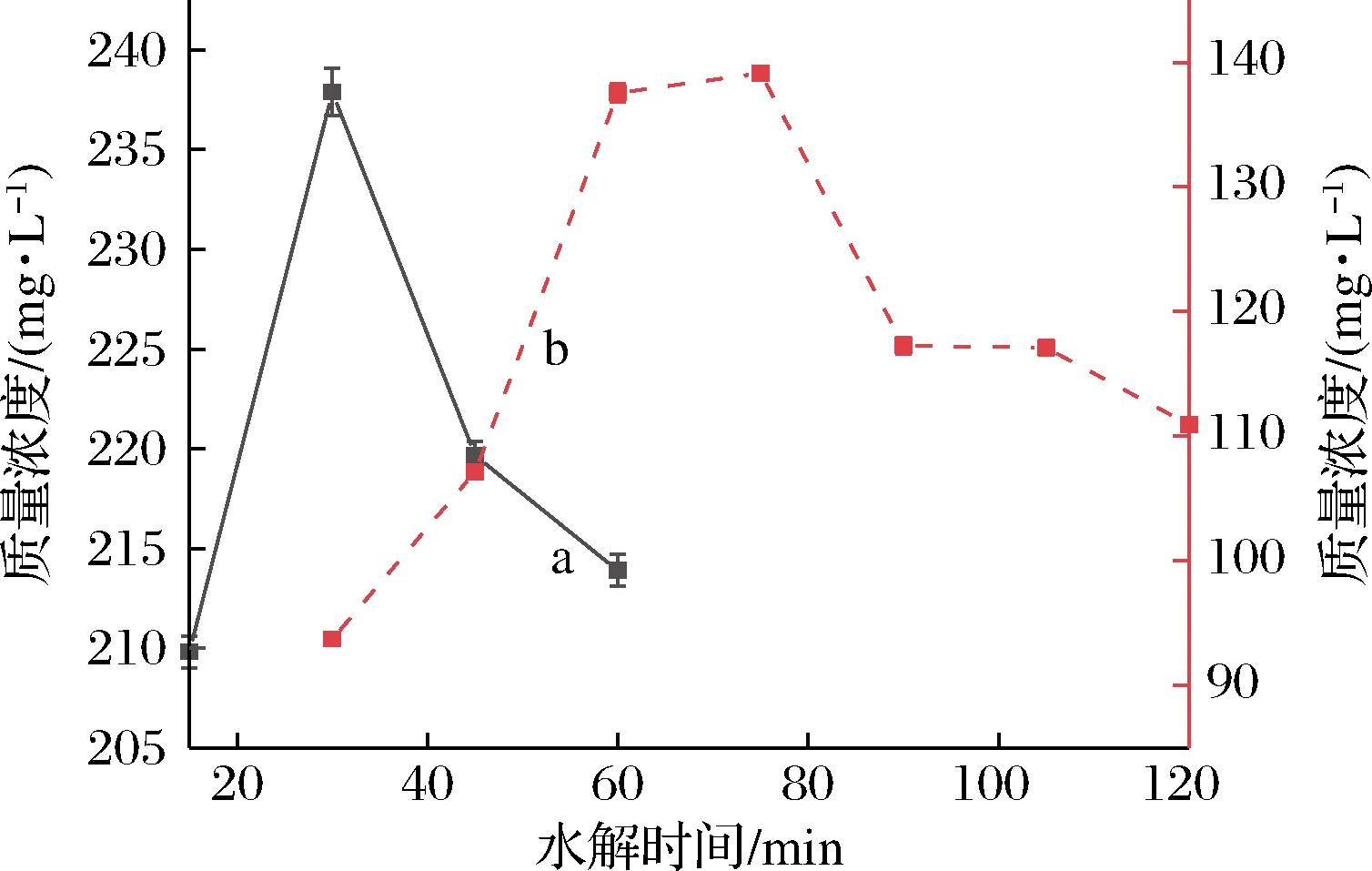
a-低聚糖结合唾液酸;b-蛋白结合唾液酸;
a对应左侧纵坐标;b对应右侧纵坐标
图3 唾液酸水解时间曲线
Fig.3 Hydrolysis time curve of sialic acids
2.2.2 婴儿配方粉纯化条件优化
考察了不同浓度NaCl溶液(30、40、50、60、70、80 mmol/L)对唾液酸洗脱回收率的影响,由图4可知,50 mmol/L NaCl溶液洗脱唾液酸的效果最好。然而由于奶粉样品中增加了一定浓度的NaCl溶液,导致Neu5Gc的平均保留时间从13.916 min提前至13.666 min,HURUM等[9]的解决方案是继续对洗脱液进行1∶2.5倍的稀释,通过稀释NaCl的浓度来消减其产生的影响。然而此方法会导致待测样品中Neu5Gc的含量过低,从而影响样品检测。与此方法相比,本文通过将Neu5Gc溶于50 mmol/L NaCl溶液的方法来消除实验误差,能够对纯化后的奶粉样品进行更加精准的检测。
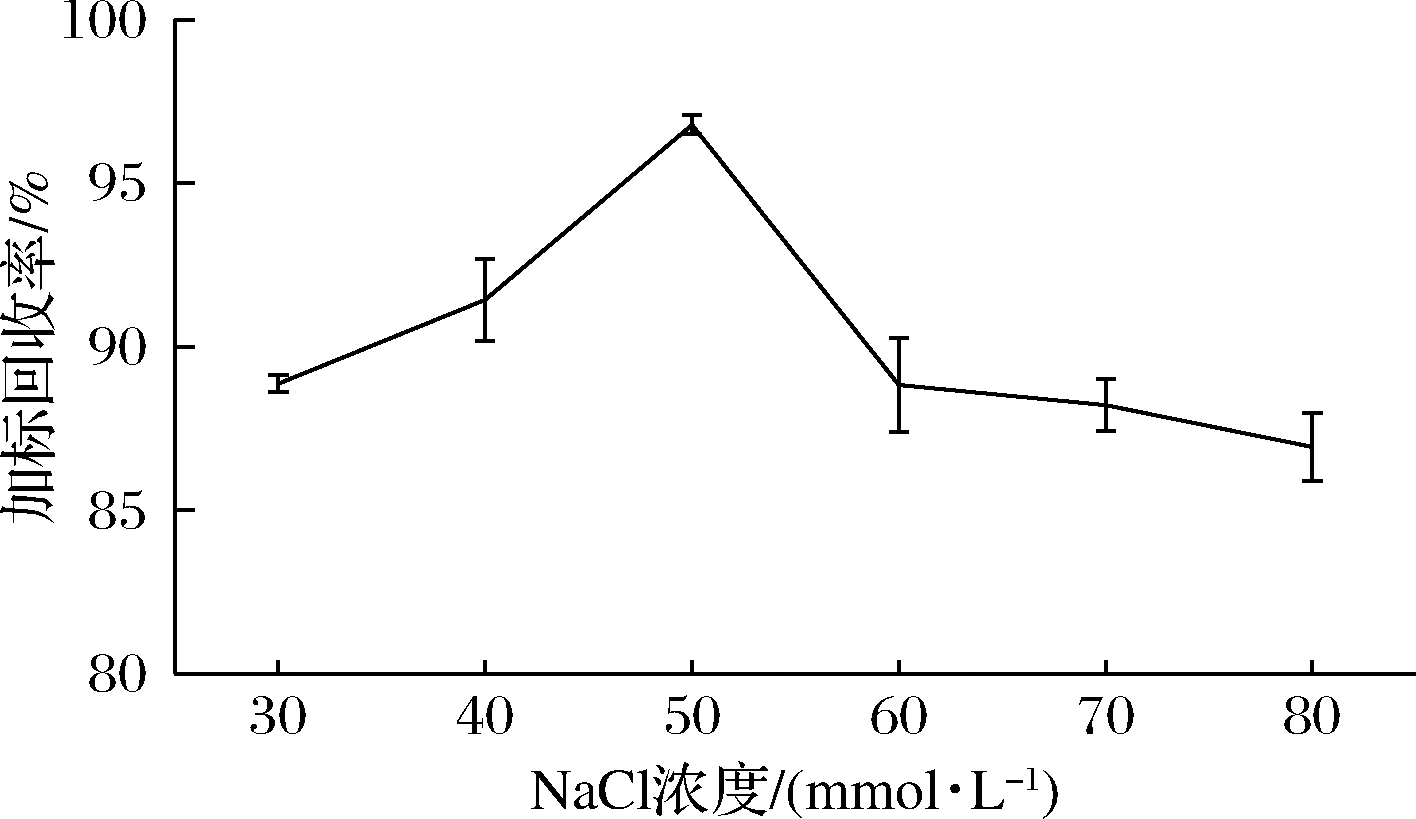
图4 不同浓度NaCl溶液对唾液酸洗脱回收率的影响
Fig.4 Effect of different concentrations of NaCl solution on the elution recovery rate of sialic acid
2.3 方法学验证
2.3.1 线性
在1.5条件下,对标准系列工作液进样检测,以质量浓度为横坐标,以对应峰面积为纵坐标绘制标准曲线,计算标准曲线方程。如表3所示,Neu5Ac质量浓度在0.1~10 mg/L,与峰面积的线性关系良好,线性相关系数为0.999 9,此线性范围适合检测奶粉中Neu5Ac;由于母乳在不同泌乳期唾液酸的总量差别较大,因此需要用更大的线性范围进行校正。Neu5Ac在线性范围内均有良好的线性关系,相关系数均>0.999,各组分保留时间相对标准偏差(relative standard deviation,RSD)均<0.97%。
表3 Neu5Ac和Neu5Gc的线性范围和标准曲线
Table 3 Linear range and standard curve of Neu5Ac and Neu5Gc

分析组分线性范围/(mg·L-1)保留时间/min线性方程相关系数/R2保留时间RSD%Neu5Ac0.1~105.544y=0.281 2x-0.003 90.999 90.78Neu5Ac1~305.546y=0.280 1x+0.000 50.999 80.97Neu5Gc0.002~113.916y=1.153 8x+0.001 10.999 60.02Neu5Gc0.002~113.666y=1.201 8x-0.008 30.999 20.37
2.3.2 精密度
取30 mg/L的Neu5Ac和1 mg/L的Neu5Gc标品溶液按1.5条件连续进样6次,离子峰面积RSD分别为1.26%和0.99%,表明此方法精密度良好。
2.3.3 检出限和定量限
取一定浓度的Neu5Ac和Neu5Gc标品溶液,加水逐级稀释,结果表明Neu5Ac的检出限为3 μg/L,定量限为10 μg/L;Neu5Gc的检出限为2 μg/L,定量限为6 μg/L,更适用于唾液酸的检测。该方法与陈海娇等[10]建立的液相色谱法相比,具有更低的检出限,更适用于唾液酸的检测,尤其是针对含量较低于Neu5Gc。
2.3.4 重复性
按1.4实验条件对母乳和婴儿配方粉进行前处理,并按1.5色谱条件对其唾液酸含量进行检测,每组实验6个平行。母乳样品中Neu5Ac的RSD为4.51%,婴儿配方粉样品中Neu5Ac和Neu5Gc的RSD分别为1.1%和5.22%,说明该检测方法的重复性良好。
2.3.5 稳定性
分别取1份母乳和婴儿配方粉样品,按1.4实验条件处理后,分别在0、2、4、6、8、24、48、72、96 h上机检测,平行测定3次,取其平均值。测得的样品含量如图5所示,样品各组分含量随时间增长逐渐减少,样品8 h的RSD均<2.4%,检测了4 d的日间稳定性,其RSD均<5.21%,结果表明样品可以在较长时间保持稳定。

a-日内稳定性;b-日间稳定性;1-母乳Neu5Ac;
2-婴儿配方粉Neu5Ac;3-婴儿配方粉Neu5Gc
图5 母乳与婴儿配方粉样品中唾液酸的日内和日间稳定性
Fig.5 Intraday and inter-day stability of sialic acid in the samples of human milk and infant formula
2.3.6 加标回收率
取母乳和婴儿配方粉样品,分别按表4加入低、中、高浓度的标品,测定唾液酸含量,平行测定3次,取其平均值,计算回收率。各组分RSD均<2.65%,回收率在87.65%~102.33%,说明该方法具有良好的回收率。
表4 母乳和婴儿配方粉样品加标回收率
Table 4 Spiked recoveries of milk and infant formula samples
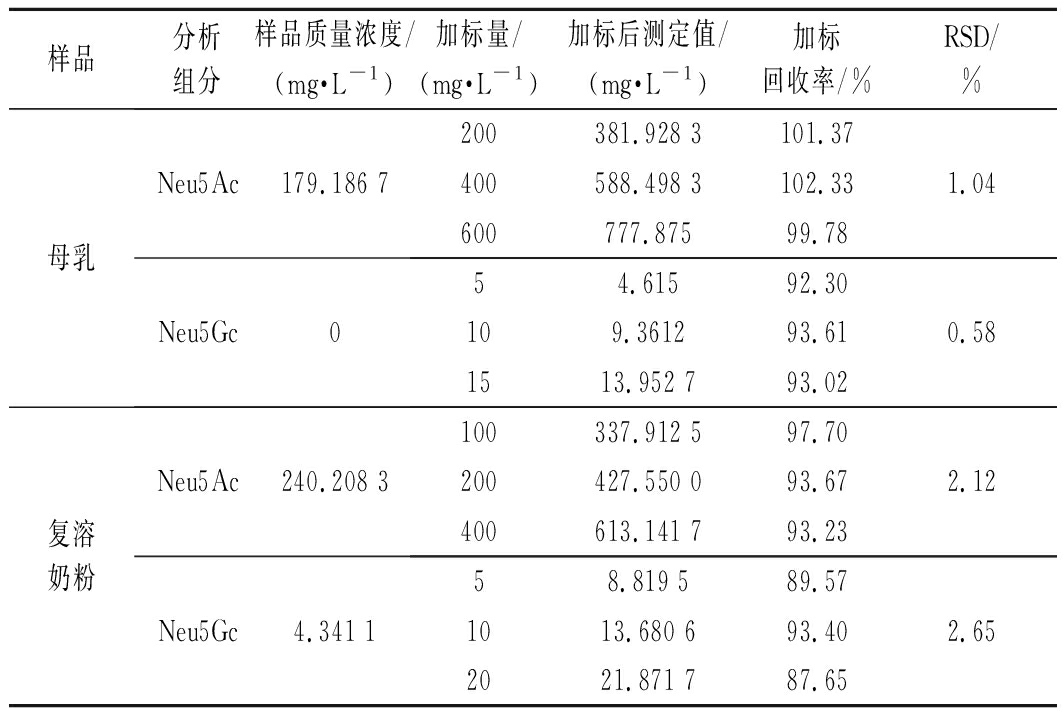
样品分析组分样品质量浓度/(mg·L-1)加标量/(mg·L-1)加标后测定值/(mg·L-1)加标回收率/%RSD/%母乳Neu5Ac179.186 7200381.928 3101.37400588.498 3102.331.04600777.87599.78Neu5Gc054.61592.30109.361293.610.581513.952 793.02复溶奶粉Neu5Ac240.208 3100337.912 597.70200427.550 093.672.12400613.141 793.23Neu5Gc4.341 158.819 589.571013.680 693.402.652021.871 787.65
2.3.7 样品分析
分别取3个母亲(A、B、C)的初乳、过渡乳和成熟乳,3个市售品牌(D、E为牛乳基婴儿配方粉,F为羊乳基婴儿配方粉)的Ⅰ、Ⅱ、Ⅲ段婴儿配方粉,按照建立的方法进行唾液酸检测,每个样品平行测定3次,以绘制的标准校正曲线进行定量。
由表5可知,母乳各阶段的唾液酸含量在483.534~1 595.897 mg/L,随着泌乳期的增加,母乳中唾液酸含量逐渐减少(P<0.05),这与CLAUMARCHIRANT等[19]的报道一致,表明该方法具有较大的浓度检测范围。值得注意的是,由于本方法的检出限低,能够在部分母乳样本中检测到Neu5Gc,但人体本身不产生Neu5Gc,因这可能与人食用含有Neu5Gc的食物有关,如鸡蛋、红肉和乳制品等[20],LACOMBA[17]和QUIN等[21]的报道也支持该观点。不同品牌和不同阶段婴儿配方粉中的唾液酸含量差异较大,这与配料以及各阶段婴儿配方粉的国家标准不同有关。其中,羊乳基婴儿配方粉中Neu5Gc的含量高达54.85 mg/100 g,显著高于牛乳基婴儿配方粉中的含量(P<0.05)。现有的奶粉检测方法大多只针对Neu5Ac,而本方法Neu5Gc的定量限为6 μg/L,能够对其准确定量。文献中报道的牛乳基婴儿配方粉中Neu5Ac和Neu5Gc的含量分别在71~389 和3.8~5.5 mg/100g之间,本研究检测结果也与文献中报道的一致[8-9,16-21],但未在其他文献中找到有关羊乳基婴儿配方粉唾液酸含量的报道。
表5 不同泌乳期的母乳和不同阶段婴儿配方粉的唾液酸含量
Table 5 Sialic acid content of human milk and infant formula at different lactation stages

样品质量浓度 (母乳:mg/L,婴儿配方粉:mg/100 g)初乳/Ⅰ 段过渡乳/Ⅱ 段成熟乳/Ⅲ 段Neu5AcNeu5GcNeu5AcNeu5GcNeu5AcNeu5GcA1 595.897±1.27a-1 443.722±1.28b-598.294±1.94c-B1 378.814±3.43a-1 319.552±2.33b-893.228±3.58c-C1 511.725±0.87a-1 390.553±0.61b-483.534±4.21c-D167.575±1.85a3.662±0.3a257.202±1.28b8.538±0.29b241.05±0.73c5.788±0.11aE119.438±0.14a4.85±0.1a178.562±2.79b5.675±0.1b171.988±0.51b5.438±0.19a,bF43.4±0.56a45.81±0.49a49.613±1.66b51.275±2.03a54.85±9.48c49.538±1.56a
注:同行同一指标不同上标字母表示差异性显著(P<0.05)
3 结论
采用高效阴离子色谱-脉冲安培检测法建立了能同时应用于母乳和婴儿配方粉中唾液酸的检测方法,通过离子色谱前处理柱纯化唾液酸样品,能够有效减少样品中的杂质,更适用于基质复杂的唾液酸样品检测。与传统的液相色谱法相比,该方法不需要衍生,操作简单,具有较好的重复性及稳定性。该方法的精密度高、检出限低、检测范围广,能够广泛应用于不同泌乳期的母乳及婴儿配方粉中唾液酸的定量分析。
[1] AZURMENDI H F,VIONNET J,WRIGHTSON L,et al.Extracellular structure of polysialic acid explored by on cell solution NMR[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(28):11 557-11 561.
[2] SHEN G J,DATTA A K,IZUMI M,et al.Expression of α2,8/2,9-polysialyltransferase from Escherichia coli K92.Characterization of the enzyme and its reaction products[J].Journal of Biological Chemistry,1999,274(49):35 139-35 146.
[3] BIANCO A,MELCHION I C.Neuraminic acid-structure,chemistry,biological activity[J].Studies in Natural Products Chemistry,2002,27:103-154.
[4] VARKI A.Sialic acids in human health and disease[J].Trends in Molecular Medicine,2008,14(8):351-360.
[5] WANG B,BRAND-MILLER J.The role and potential of sialic acid in human nutrition[J].European Journal of Clinical Nutrition,2003,57(11):1 351-1 369.
[6] WANG B,MCVEAGH P,PETOCZ P,et al.Brain ganglioside and glycoprotein sialic acid in breastfed compared with formula-fed infants[J].The American Journal of Clinical Nutrition,2003,78(5):1 024-1 029.
[7] ANDERSON J W,JOHNSTONE B M,REMLEY D T.Breast-feeding and cognitive development:A meta-analysis[J].The American Journal of Clinical Nutrition,1999,70(4):525-535.
[8] SALCEDO J,LACOMBA R,ALEGR A A,et al.Comparison of spectrophotometric and HPLC methods for determining sialic acid in infant formulas[J].Food Chemistry,2011,127(4):1 905-1 910.
A A,et al.Comparison of spectrophotometric and HPLC methods for determining sialic acid in infant formulas[J].Food Chemistry,2011,127(4):1 905-1 910.
[9] HURUM D C,ROHRER J S.Determination of sialic acids in infant formula by chromatographic methods:A comparison of high-performance anion-exchange chromatography with pulsed amperometric detection and ultra-high-performance liquid chromatography methods[J].Journal of Dairy Science,2012,95(3):1 152-1 161.
[10] 陈海娇, 王萍,陈越,等.高效液相色谱法测定母乳中唾液酸含量[J].食品科学,2011,32(16):308-311.
CHEN H J,WANG P,CHEN Y,et al.Determination of total sialic acid content in human milk by HPLC-FLD[J].Food Science,2011,32(16):308-311.
[11] LACOMBA R,SALCEDO J,ALEGRíA A,et al.Determination of sialic acid and gangliosides in biological samples and dairy products:A review[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51(2):346-357.
[12] 李秀英, 黄伟乾,黄荣荣,等.高效液相色谱-串联质谱法测定母乳中的N-乙酰神经氨酸[J].食品安全质量检测学报,2016,7(5):1 901-1 907.
LI X Y,HUANG W Q,HUANG R R,et al.Determination of N-acetylneuraminic acid in breast milk by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety and Quality,2016,7(5):1 901-1 907.
[13] 刘彦品, 刘利娟,牟光庆,等.超高效液相色谱-串联四极杆质谱法测定奶粉中唾液酸的含量[J].中国奶牛,2015(17):44-48.
LIU Y P,LIU L J,MU G Q,et al.Determination of sialic acid in formula using UPLC-MS/MS[J].China Dairy Cattle,2015(17):44-48.
[14] TANG K T,LIANG L N,CAI Y Q,et al.Determination of sialic acid in milk and products using high performance anion-exchange chromatography coupled with pulsed amperometric detection[J].Chinese Journal of Analytical Chemistry,2008,36(11):1 535-1 538.
[15] 陈磊, PHILIP H,田芳,等.离子色谱法测定母乳中的寡聚糖与游离唾液酸[J].中国食品学报,2019,19(10):227-234.
CHEN L,PHILIP H,TIAN F,et al.Determination of oligosaccharides and free sialic acid in human milk by ion chromatography[J].Journal of Chinese Institute of Food Science and Technology,2019,19(10):227-234.
[16] WANG B,BRAND-MILLER J,MCVEAGH P,et al.Concentration and distribution of sialic acid in human milk and infant formulas[J].The American Journal of Clinical Nutrition,2001,74(4):510-515.
[17] LACOMBA R,SALCEDO J,ALEGRíA A,et al.Sialic acid (N-acetyl and N-glycolylneuraminic acid) and ganglioside in whey protein concentrates and infant formulae[J].International Dairy Journal,2011,21(11):887-895.
[18] 李金慧, 赵非,刘璇,等.奶粉中N-乙酰神经氨酸的检测[J].中国乳品工业,2020,48(1):47-50.
LI J H,ZHAO F,LIU X,et al.Determination of N-acetylneuraminic acid in milk powder[J].China Dairy Industry,2020,48(1):47-50.
[19] CLAUMARCHIRANT L,SANCHEZ-SILES L M,MATENCIO E,et al.Evaluation of sialic acid in infant feeding:Contents and bioavailability[J].Journal of Agricultural and Food Chemistry,2016,64(44):8 333-8 342.
[20] 伍晓燕. 基于HPLC的燕窝与食品中唾液酸的含量测定及比较[D].上海:上海交通大学,2019.
WU X Y.Determination and comparison of sialic acid content in bird’s nest and foods based on HPLC[D].Shanghai:Shanghai Jiaotong University,2019.
[21] QUIN C,VICARETTI S D,MOHTARUDIN N A,et al.Influence of sulfonated and diet-derived human milk oligosaccharides on the infant microbiome and immune markers[J].The Journal of Biological Chemistry,2020,295(12):4 035-4 048.