尿酸是嘌呤代谢的终产物,当人体摄入过多或者嘌呤代谢紊乱,则体内尿酸滞留过多,容易导致高尿酸血症[1-3]。根据近年各地高尿酸血症患病率的报道,目前我国约有高尿酸血症者1.2亿,且患病率呈逐年上升趋势[4-5]。现代研究表明,高尿酸血症不仅是痛风的重要生化基础,还是某些疾病并发症的独立危险因子,与高血压、肥胖、高脂血症、内分泌代谢紊乱以及动脉粥样硬化均有密切关联[6]。
我国现代饮食习惯中嘌呤含量较高的食品逐渐占主体地位,而饮食习惯对痛风和高尿酸血症的发生有重要影响[7-8]。饮酒会提高血清尿酸水平,酒精摄入过量会增加痛风的发病风险[9-10]。酒类的嘌呤主要以游离碱基形式存在,比普通食品中的嘌呤更容易被吸收,同时由于酒精代谢产物对尿酸排泄有抑制作用,可以在短时间内迅速提高血尿酸水平。目前,对酒类食品中嘌呤测定的研究主要集中在啤酒上[11]。黄酒是我国的一种传统发酵酒,营养丰富,享有“液体蛋糕”的美名且具有一定的药用价值,深受消费者的喜爱,但关于黄酒中嘌呤含量的文献报道较少。
现有关于食品中嘌呤检测的报道中少有提及样品的净化步骤,一般将样液或样品水解液过滤膜后进样[12-14]。针对少部分黄酒如清爽型黄酒,直接进样法可以满足分析要求[15-16],但是对于大部分黄酒,由于糖类、蛋白质、氨基酸、多肽、色素、生物胺等化合物的影响,存在加标回收率低、色谱峰重叠、检出限高等问题。固相萃取技术是食品检测中常用的样品前处理技术,可利用固体吸附剂、淋洗液以及洗脱液对样品中目标化合物及干扰杂质的不同吸附、洗脱能力,达到分离和富集目标化合物的目的。本研究根据嘌呤化合物的酸碱性,建立了一种同时测定黄酒中腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤的离子交换固相萃取-高效液相色谱法。
1 实验部分
1.1 材料与试剂
腺嘌呤(纯度≥99.5%)、鸟嘌呤(纯度≥99%)、黄嘌呤(纯度≥98%)、次黄嘌呤(纯度≥99%),阿拉丁; 磷酸(质量分数85%,AR)、KH2PO4(AR)、KOH(AR)、盐酸(AR)、氨水(质量分数25%~28%,AR),国药集团化学试剂有限公司;甲醇(色谱纯),Merck KGaA;MCX混合阳离子交换固相萃取小柱(500 mg,6 mL)、SCX强阳离子交换固相萃取小柱(500 mg,6 mL)、WCX弱阳离子交换固相萃取小柱(500 mg,6 mL),上海安谱实验科技股份有限公司。
黄酒样品全部为市售商品,产品类型包括甜型、干型、半干型、半甜型。
1.2 仪器与设备
LC-20ADXR高效液相色谱仪,日本岛津公司;ME204E精密电子天平、S220酸度计,梅特勒-托利多公司;N-EVAP-24氮吹仪,美国Organomation公司。
1.3 分析方法
1.3.1 色谱条件
色谱柱:Waters Atlantis T3(4.6 mm×150 mm,3 μm);柱温:30 ℃;流动相:0.02 mol/L KH2PO4-H3PO4缓冲溶液(pH=4.06±0.02);流速:1 mL/min;进样量:10 μL;检测器:紫外检测器(UV);检测波长:254 nm。
1.3.2 标样配制
准确称取腺嘌呤、鸟嘌呤、黄嘌呤和次黄嘌呤标样25 mg,分别用超纯水定容至25 mL,配制成质量浓度为1 mg/mL的标准储备溶液(嘌呤不易溶于水,可加入NaOH溶液助溶)。标准储备溶液储存于2~4 ℃冰箱中,使用前用超纯水稀释到一定质量浓度。
1.3.3 黄酒样品除乙醇
取25 mL黄酒样品,煮沸至酒样体积约为20 mL,冷却至室温后,用蒸馏水将酒样定容至25 mL。
1.3.4 样品的净化
MCX混合阳离子交换小柱预先用5 mL甲醇、5 mL 0.1 mol/L盐酸活化。取2 mL预先除去乙醇样品,加1 mL 0.1 mol/L盐酸酸化后上样,以5 mL 0.1 mol/L盐酸淋洗小柱,抽干,以10 mL氨水-甲醇(体积比1∶3)洗脱。分别收集淋洗液和洗脱液,氮吹至近干,残留物以10 mL超纯水定容。过0.45 μm微孔滤膜后进液相色谱仪分析。
2 结果与讨论
2.1 色谱分析条件的确认
本研究参考文献[17]的方法并做适当调整,采用Waters AtlantisT3柱进行分离,结果如图1所示。
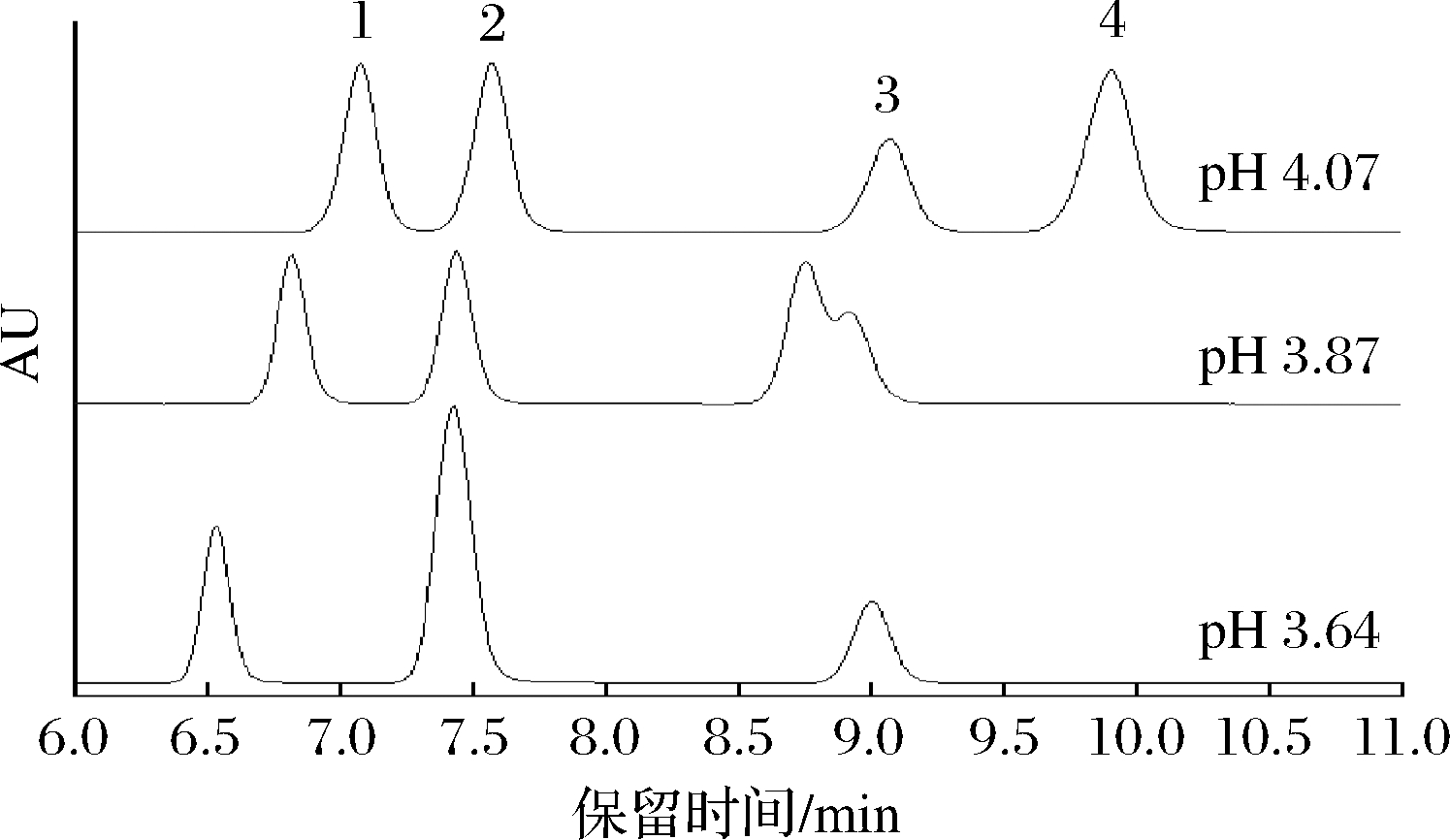
1-鸟嘌呤;2-次黄嘌呤;3-黄嘌呤;4-腺嘌呤
图1 不同pH下4种嘌呤标准品液相色谱图
Fig.1 Chromatogram of four purine standards with mobile phase of different pH
腺嘌呤、鸟嘌呤、黄嘌呤和次黄嘌呤这4种组分可实现完全分离,且峰形好,无拖尾。流动相pH对4种嘌呤分离影响显著,对流动相pH进行优化,发现以0.02 mol/L KH2PO4-H3PO4缓冲溶液(pH=4.06±0.02)为流动相,4种嘌呤组分可实现完全分离。
2.2 离子交换固相萃取法净化酒样
2.2.1 固相萃取小柱的选择
嘌呤在酸性条件下为阳离子,可以采用离子交换固相萃取技术对其进行分离、富集。MCX混合型阳离子交换柱是将磺酸基键合在高度交联的苯乙烯/二乙烯基苯(PS/DVB)表面得到的混合型强阳离子交换吸附剂[18],具有反相和阳离子交换双重保留性能,对碱性化合物有良好的保留能力。SCX强阳离子交换柱是硅胶基质的苯磺酸基填料,其负电性的磺酸基具有很强的阳离子交换能力,此外苯环有一定的疏水作用,能萃取碱性化合物。WCX弱阳离子交换固相萃取小柱是以大孔PS/DVB为基质,经羧基修饰的混合型弱阳离子吸附剂,也适合碱性化合物的提取[19]。加标回收试验表明(见附件),MCX小柱净化效果优于SCX小柱和WCX小柱。SCX小柱对鸟嘌呤、次黄嘌呤和腺嘌呤的吸附作用强,但是对黄嘌呤的保留能力弱,在淋洗液中检出黄嘌呤。MCX小柱对4种嘌呤的均有强保留,在淋洗液中无嘌呤检出,在洗脱液中检出4种嘌呤,且浓度与未净化样品差别不大。因此选择MCX混合型阳离子交换柱。
2.2.2 活化液及洗脱液的选择
离子交换固相萃取包含4个过程。(1)吸附剂的活化:使用1个柱体积的甲醇润湿吸附剂,使用合适pH的缓冲溶剂置换甲醇并调整小柱的pH;(2)上样:调节样品pH后上样;(3)淋洗除去干扰物:用合适pH的缓冲液淋洗柱管,去除基质干扰物,同时要维持目标分析物的保留;(4)洗脱:使用一定浓度的氨水-甲醇缓冲液洗脱,收集目标分析物。整个过程中,pH的控制尤为重要,其可以改变目标物/吸附剂的离子化或质子化程度。目标物必须完全离子化才可以保证其被吸附剂完全吸附保留,需要满足2个条件:(1)环境的pH必须使分析物和吸附剂带相反电荷;(2)环境不能含有高浓度带有和分析物相同电荷的竞争化合物。有机化合物的pKa值是决定环境pH值的重要依据。
上样时,为使该化合物99%离子化,样品基质的pH应低于该化合物pKa至少2个pH单位[20]。洗脱时,要使99%该化合物脱附,体系环境的pH值必须高于该化合物pKa至少2个pH单位。鸟嘌呤pKa=9.92,次黄嘌呤pKa=8.7,黄嘌呤pKa=9.95,腺嘌呤pKa=4.12,因此在上样前,用0.1 mol/L盐酸调节样品pH至2以下,以保证所有嘌呤化合物完全离子化。用5 mL 0.1 mol/L盐酸活化小柱,用5 mL 0.1 mol/L盐酸作为淋洗液,以保持环境pH,在除去杂质的同时维持所有嘌呤化合物在阳离子交换柱上的保留。离子交换固相萃取小柱中键合吸附剂与分析物之间的非极性部分之间的次级相互作用,会造成洗脱不彻底的现象,需要向洗脱液中加入有机溶剂甲醇,以提高分析物的回收率,因此使用氨水-甲醇(体积比1∶3,pH=12)作为洗脱液。采用HPLC法分析样品原液、盐酸淋洗液、目标物洗脱液,其液相色谱图如图2所示,目标化合物峰面积未减少,说明4种嘌呤均有较高回收率;离子交换固相萃取净化法可将黄酒样品中与腺嘌呤出峰时间相近(11 min左右)、光谱谱图相似的假阳性物质全部除去,提高了分析准确度与实验效率。
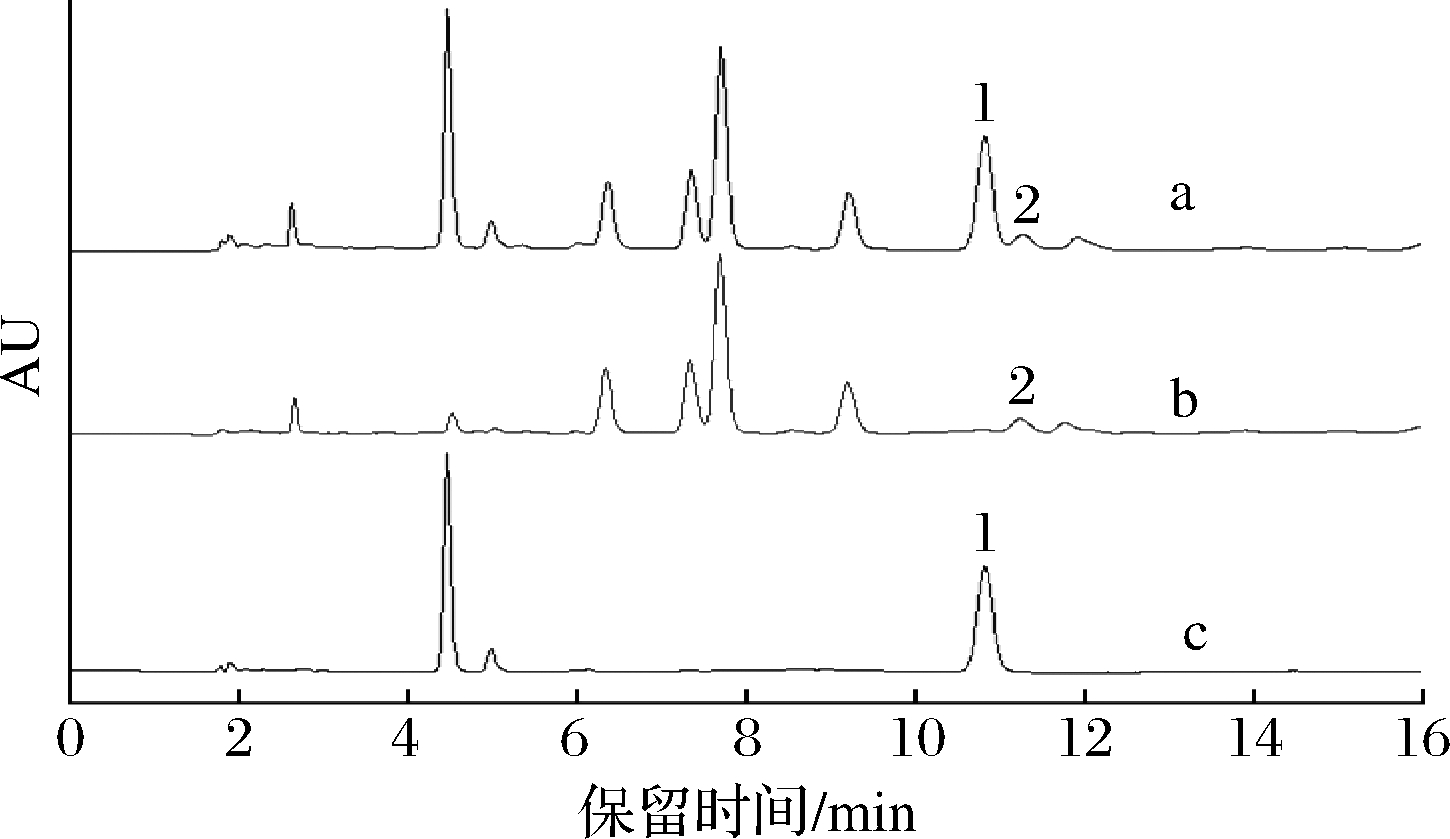
a-未净化样液;b-氨水甲醇洗脱液(净化后样液);
c-盐酸淋洗液;1-假阳性物质;2-腺嘌呤
图2 MCX小柱净化黄酒样品的洗脱液和淋洗液高效液相色谱图
Fig.2 Chromatogram of compounds in Huangjiu sample determined by HPLC-UV
2.3 方法性能
在优化条件下,将标准储备溶液逐级稀释,得质量浓度为0.1~25 mg/L混合标准工作溶液,对其进行测定,以保留时间结合紫外全光谱对目标化合物定性,以峰面积外标法定量。由表1可知,在0.1~25 mg/L质量浓度范围内,4种嘌呤的峰面积与质量浓度呈良好的线性关系,相关系数R>0.999 9。通过在1天内对同一样品测定6次和连续6 d对同一样品进行测定,4种嘌呤的日内和日间精密度均小于4%,说明该方法具有较高的重复性。
表1 四种嘌呤的线性方程、相关系数、日内及日间精密度
Table 1 Regression equation,correlation coefficients,LODs,intra-day and inter-day variations
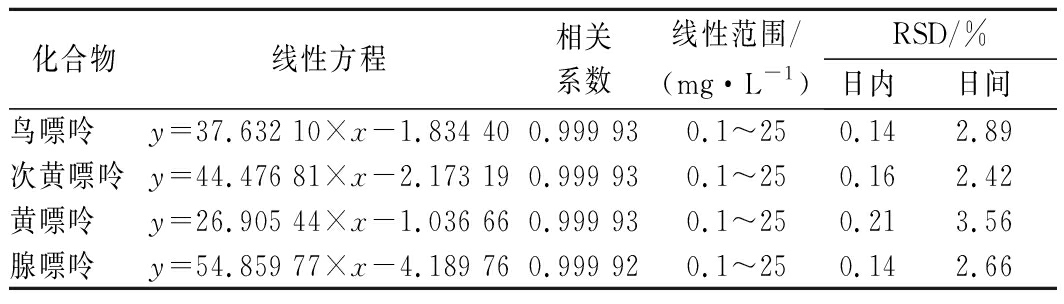
化合物线性方程相关系数线性范围/(mg·L-1)RSD/%日内日间鸟嘌呤y=37.632 10×x-1.834 400.999 930.1~250.142.89次黄嘌呤y=44.476 81×x-2.173 190.999 930.1~250.162.42黄嘌呤y=26.905 44×x-1.036 660.999 930.1~250.213.56腺嘌呤y=54.859 77×x-4.189 760.999 920.1~250.142.66
注:y,峰面积;x,化合物在仪器进样液中质量浓度
准确度通过向半干型黄酒样品中添加3个质量浓度水平的嘌呤混标,计算回收率来确定,每个质量浓度做6次平行试验。由表2可知,4种嘌呤的回收率在83.13%~98.32%,精密度为1.63%~9.62%。以信噪比3∶1 确定检出限。
表2 半干型黄酒中4种嘌呤检出限及不同质量浓度下加标回收率(回收率±RSD)
Table 2 LODs and recovery rates of the purines added to semi-dry Huangjiu samples spiked with three different concentrations of the standard solution(means±RSD)

化合物检出限/(mg·L-1)本底质量浓度/(mg·L-1)不同加标量下回收率±RSD/%50%a100%a200%a鸟嘌呤0.12.59583.13±7.1589.73±7.8187.78±1.87次黄嘌呤0.127.0285.83±2.8194.16±6.5591.89±1.63黄嘌呤0.238.6291.61±2.3797.53±5.2994.18±1.86腺嘌呤0.12.14084.67±9.6290.83±8.4798.32±3.48
注:a加标量相对于样品本底质量浓度百分比
对甜型、半甜型、干型黄酒也做了加标回收试验,加标质量浓度与样品本底浓度相等,每个样品做6次平行试验,其回收率与精密度见表3。4种嘌呤的回收率在87.5%~112.5%,精密度在0.39%~9.12%,符合日常分析要求。
表3 不同类型黄酒中4种嘌呤加标回收率(回收率±RSD)
Table 3 Recovery rates of the purines added to different types of Huangjiu samples(means±RSD)

黄酒类型本底质量浓度/(mg·L-1)回收率±RSD/%a鸟嘌呤次黄嘌呤黄嘌呤腺嘌呤鸟嘌呤次黄嘌呤黄嘌呤腺嘌呤甜型1.75513.8219.904.750105.5±8.25112.5±1.69103.0±0.6490.91±9.12半甜型3.03015.6016.384.13587.50±1.99102.1±1.2899.19±1.7898.83±4.84干型2.92518.8630.254.00592.19±4.24103.4±0.39101.2±0.7598.08±1.99
注:a加标量与样品本底质量浓度相同
2.4 实际样品的测定
为了验证本方法的有效性,对市售15份黄酒样品中的鸟嘌呤、次黄嘌呤、黄嘌呤和腺嘌呤进行了测定,结果见图3。3种类型黄酒中均能检测到4种游离嘌呤,总含量在50~90 mg/L,其中次黄嘌呤和黄嘌呤的含量高于鸟嘌呤和腺嘌呤。
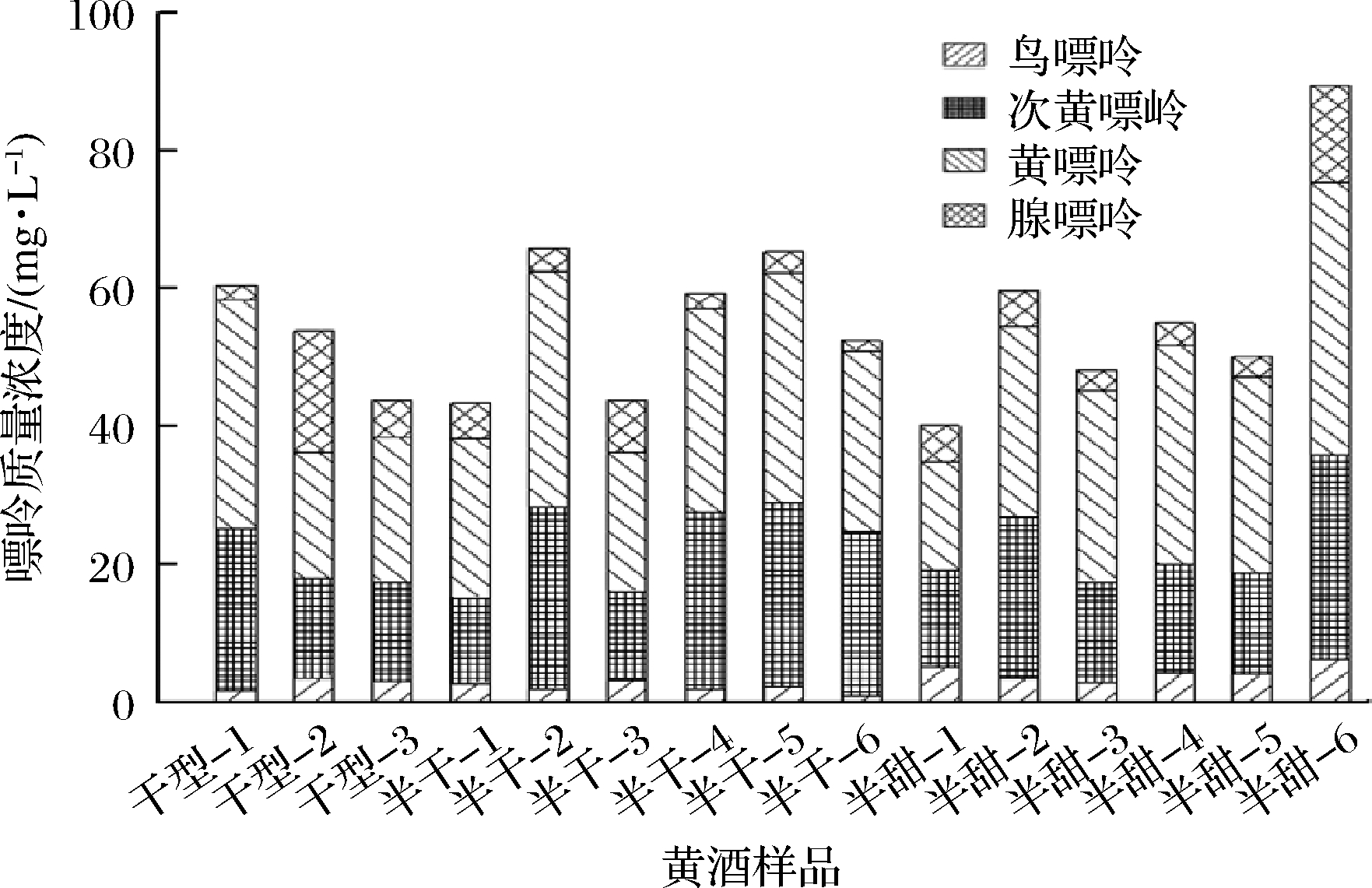
图3 黄酒样品中嘌呤质量浓度
Fig.3 Purine contents of Huangjiu samples
3 结论
建立了同时测定黄酒中游离鸟嘌呤、次黄嘌呤、黄嘌呤和腺嘌呤的高效液相色谱-紫外分光光度法。对色谱条件进行优化,以0.02 mol/L KH2PO4-H3PO4缓冲液为缓冲液,pH值为(4.06±0.02)时,其分离效果最好。使用MCX混合阳离子交换固相萃取小柱进行样品净化,减少了杂质干扰,提高了方法的选择性与灵敏度。4种嘌呤的回收率在83.13%~98.32%之间,日内和日间的精密度、检测限和线性均能满足日常分析要求。结果表明,该方法简便、快速、灵敏度高、重复性好,可用于黄酒中游离嘌呤的分析检测。
[1] PLESKACOVA A,BREJCHA S,PACAL L,et al.Simultaneous determination of uric acid,xanthine and hypoxanthine in human plasma and serum by HPLC-UV:Uric acid metabolism tracking[J].Chromatographia,2017,80(4):529-536.
[2] GOLDBERG E L,ASHER J L,MOLONY R D,et al.β-Hydroxybutyrate deactivates neutrophil NLRP3 inflammasome to relieve gout flares[J].Cell Reports,2017,18(9):2 077-2 087.
[3] MAIUOLO J,OPPEDISANO F,GRATTERI S,et al.Regulation of uric acid metabolism and excretion[J].International Journal of Cardiology,2016,213:8-14.
[4] 中华医学会内分泌学分会.高尿酸血症和痛风治疗的中国专家共识[J].中华内分泌代谢杂志,2013,29(11):913-920.
Endocrine Society of Chinese Medical Association.Chinese expert consensus on the treatment of hyperuricemia and gout[J].Chinese Journal of Endocrinology and Metabolism,2013,29(11):913-920.
[5] 陈莉惠, 陈海冰.青少年高尿酸血症和痛风的流行现状、病因及临床特征[J].海南医学,2020,31(12):1 618-1 620.
CHEN L H,CHEN H B.Epidemiology,etiology and clinical characteristics of adolescent hyperuricemia and gout[J].Hainan Medical Journal,2020,31(12):1 618-1 620.
[6] 董梦青,王欣,吴千蔚.高尿酸血症的针刺治疗与认识[J].中国医药指南,2020,18(19):32-33;46.
DONG M Q,WANG X,WU Q W.Acupuncture treatment and recognition of hyperuricemia[J].Guide of China Medicine,2020,18(19):32-33;46.
[7] WU B W,ROSELAND J M,HAYTOWITZ D B,et al.Availability and quality of published data on the purine content of foods,alcoholic beverages,and dietary supplements[J].Journal of Food Composition and Analysis,2019,84:1-8.DOI:10.1016/j.jfca.2019.103281.
[8] 丁玉庭,张静,周绪霞,等.常见食品及调味品中嘌呤类组分含量分析及分布规律[J].食品与发酵工业,2020,46(15):276-281.
DING Y T,ZHANG J,ZHOU X X,et al.Analysis and distribution of purine components in common foods and condiments[J].Food and Fermentation Industries,2020,46(15):276-281.
[9] FUKUUCHI T,YASUDA M,INAZAWA K,et al.A simple HPLC method for determining the purine content of beer and beer-like alcoholic beverages[J].Analytical Sciences,2013,29(5):511-517.
[10] 沈宁. 饮酒与痛风发作风险相关性的Meta分析[D].杭州:浙江大学,2016.
SHEN N.Alcohol consumption and gout risk:An update meta-analysis[D].Hangzhou:Zhejiang University,2016.
[11] 杨帆, 王德才.啤酒嘌呤含量检测与分析[J].酿酒,2016,43(4):96-98.
YANG F,WANG D C.Detection and analysis of purine content in beer[J].Liquor Making,2016,43(4):96-98.
[12] 郜景涛, 孙军勇,孙鹏飞,等.市售啤酒中嘌呤含量评价指标的研究[J].食品安全质量检测学报,2013,4(2):389-394.
GAO J T,SUN J Y,SUN P F,et al.Study on evaluation indices of purine content in commercial beers[J].Journal of Food Safety and Quality,2013,4(2):389-394.
[13] RONG S Z,ZOU L N,ZHANG Y N,et al.Determination of purine contents in different parts of pork and beef by high performance liquid chromatography[J].Food Chemistry,2015,170:303-307.
[14] 王静莹, 薄海波,吉生军,等.高效液相色谱法测定牛羊杂碎等肉类中嘌呤及尿酸[J].食品与发酵工业,2017,43(4):232-237.
WANG J Y,BO H B,JI S J,et al.Determination of purine and uric acid in cooked cow and sheep offal by high performance liquid[J].Food and Fermentation Industries,2017,43(4):232-237.
[15] 夏小乐, 夏梅芳,杨海麟,等.LC-MS/MS法分析清爽型黄酒中的嘌呤含量[J].现代食品科技,2010,26(12):1 399-1 402.
XIA X L,XIA M F,YANG H L,et al.LC-MS/MS analysis of purine content in light Chinese rice wine[J].Modern Food Science and Technology,2010,26(12):1 399-1 402.
[16] 刘镇, 王灵芝,章姗姗,等.反相高效液相色谱法同时测定黄酒中4种游离嘌呤[J].酿酒科技,2017(4):100-102.
LIU Z,WANG L Z,ZHANG S S,et al.Simultaneous determination of four free purines in yellow rice wine by reversed phase HPLC[J].Liquor-Making Science & Technology,2017(4):100-102.
[17] 凌云, 王新宴,雍炜,等.高效液相色谱法检测肉类食品中4种嘌呤碱[J].分析化学,2008,36(6):724-728.
LING Y,WANG X Y,YONG W,et al.Determination of four purines in meat by high performance liquid chromatography[J].Chinese Journal of Analytical Chemistry,2008,36(6):724-728.
[18] ZHAO Z Y,ZHANG Y M,XUAN Y F,et al.Ion-exchange solid-phase extraction combined with liquid chromatography-tandem mass spectrometry for the determination of veterinary drugs in organic fertilizers[J].Journal of Chromatography B,2016,1 022:281-289.
[19] 赵静, 李琛,郭自国,等.固相萃取/高效液相色谱-串联质谱法测定水中百草枯与敌草快残留[J].分析测试学报,2018,37(5):626-629;634.
ZHAO J,LI C,GUO Z G,et al.Determination of paraquat and diquat residues in water by high performance liquid chromatography-tandem mass spectrometry with solid phase extraction[J].Journal of Instrumental Analysis,2018,37(5):626-629;634.
[20] MOLDOVEANU S,DAVID V.Modern sample preparation for chromatography chapter 7-solid-phase extraction[M].Amsterdam:Elsevier,2015:225-226.