在生产过程中极易被微生物污染从而导致牛乳变质,因此微生物超标在牛乳生产过程中是一个重要的卫生安全问题[1]。大肠杆菌是乳品国家标准中规定菌群检测项目的主要目标物,同时也是食品中粪源性污染卫生细菌学指标[2]。常见的大肠杆菌检测方法主要有平板计数法和分子生物学方法[3]。平板计数法是依据GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》[4]对乳品中大肠杆菌进行检测,该方法操作简单但会漏检活的非可培养状态菌[5]。同时,过长的检测时间会导致检测结果无法及时指导生产[6]。分子生物学方法中的聚合酶链式反应法(polymerase chain reaction,PCR)[7]及实时荧光PCR法(quantitative real-time PCR,qPCR)[8]可以缩短检测时间并测定少量核酸,但无法进行绝对定量分析[9]。同时需要安装大体积的仪器,无法用于食品现场快速检测[10]。牛乳中大肠杆菌的有效控制,要求其得到快速准确的检测,因此,迫切需要建立一种大肠杆菌快速检测新方法以满足市场需求。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是由日本科学家NOTOMI等[11]率先建立的新型核酸扩增方法,该方法具有特异性强等特点[12],且在微生物检测领域具有广泛的应用前景[13]。LAMP反应产物的检测可以通过肉眼观察法观察白色焦磷酸镁沉淀[14]以及采用电泳法观察梯形条带[15],但肉眼观察法易受观察者主观影响,电泳法操作繁琐且会造成假阳性污染[16]。数字化LAMP虽可利用泊松分布的原理对核酸分子进行绝对定量,但通常需要使用微流控芯片进行检测,操作复杂且耗时长[17]。
MITRA等[18]建立的扩增方法,即在聚丙烯酰胺水凝胶中进行数字PCR扩增并使扩增产物限制在模板附近从而实现绝对定量分析。本研究通过优化数字化LAMP反应体系的各项参数,用于实现乳品中大肠杆菌的快速定量。由于水凝胶基质的限制作用,一个细菌的特定基因序列只会产生一个扩增子荧光亮点。因此,本研究使用荧光显微镜成像并通过扩增点计数来确定样品细菌浓度,从而建立牛乳中大肠杆菌的快速检测方法。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及试剂
大肠杆菌CICC 10907菌株、单核李斯特菌CICC 21633菌株、伤寒沙门氏菌 CICC 10871菌株,中国工业微生物菌种保藏管理中心;牛乳样品,当地市场。
10×Isothermal Amplification Buffer、Bst 2.0 WarmStartTM DNA聚合酶、MgSO4、dNTPs,New England Biolab公司;引物、DEPC水,生工生物工程(上海)股份有限公司;4臂-聚乙二醇-丙烯酸酯(分子质量10 kDa)、巯基-聚乙二醇-巯基(分子质量3 400 Da),Laysan Bio公司;Eva Green,上海闪晶分子生物科技有限公司;溶菌酶,Thermo Fisher Scientific公司;密封小室(frame-seal),Bio-rad公司;牛血清白蛋白(bovine serum albumin,BSA),宝日安生物技术(北京)有限公司。
1.1.2 仪器与设备
MiniT-C型小型金属浴,杭州奥盛仪器有限公司;Applied BiosystemsTM型实时PCR仪,Thermo Fisher Scientific公司;Leica DMi8型荧光显微镜,徕卡显微系统(上海)贸易有限公司。
1.2 实验方法
1.2.1 引物设计
本研究中使用HILL等[19]设计的6条特异性引物并将其用于数字化LAMP检测,包括2条内引物(FIP/BIP),2条外引物(F3/B3),2条环引物(Loop F/Loop B),详见表1。
表1 大肠杆菌数字化LAMP引物
Table 1 The E.coli primer for digital LAMP
将活化的大肠杆菌、单核李斯特菌、伤寒沙门氏菌分别接种于10 mL LB、BHI和TSB液体培养基中,37 ℃、150 r/min过夜培养12~14 h。细菌浓度可以通过将10 μL不同稀释程度的菌液分散在LB营养琼脂平板上,在37 ℃下孵育12 h并计数菌落形成单位(CFU)来量化。过夜培养后,取1 mL新鲜细菌菌液,细菌经玻璃珠振荡破壁后,利用 PureLinkTM Genomic DNA Mini Kit试剂盒提取细菌DNA。
1.2.3 数字化LAMP反应体系及特异性
对于在聚丙烯酰胺水凝胶内部进行的LAMP反应,需要将2种聚丙烯酰胺水凝胶单体添加到LAMP反应体系中以确保水凝胶交联,最终反应混合物(25 μL)由以下成分组成:1.6 mg 4臂-聚乙二醇-丙烯酸酯,1.1 mg 巯基-聚乙二醇-巯基,2.5 μL 10× Isothermal Amplification Buffer,6 mmol/L total MgSO4、1.4 mmol/L dNTPs,640 U/mL Bst 2.0 Warm Start聚合酶,1.6 μmol/L FIB和BIP,0.2 μmol/L F3和B3,0.4 μmol/L LF和LB,1×Eva Green和2.5 μL模板或真实样品。
将上述25 μL水凝胶反应混合液加载到密封孵化小室中,盖上盖玻片,室温下放置3~5 min使其交联,并在小型金属浴上进行等温扩增反应。扩增反应结束后将载玻片置于荧光显微镜下观察,使用Image J计数软件对荧光扩增点进行计数。为了记录实时扩增曲线,将水凝胶反应混合物添加到八联管中,并使用实时PCR仪在65 ℃下孵育30 min,每隔1 min监测反应的荧光强度。
1.2.4 数字化LAMP反应条件优化
通过改变体系中环引物浓度(0、0.4、0.8 μmol/L)探究其对扩增反应的影响。同时在65 ℃条件下对水凝胶混合液分别加热10、20、30 min 并记录荧光点数目,探究时间对扩增点数目的影响,优化反应时间以提高反应效率。
1.2.5 DNA热变性对反应的影响
对DNA进行热变性预处理,即在85和95 ℃条件下分别加热2、5、8 min,加热结束后置于冰盒中以保证DNA处于单螺旋状态,并进行数字化LAMP反应,通过记录和比较荧光点数目探究DNA热变性对反应的影响。
1.2.6 数字化LAMP反应检测大肠杆菌及特异性
为了进一步减少繁琐的实验步骤,本实验通过在水凝胶中加入溶菌酶和BSA,以有效裂解细菌细胞壁和防止细菌吸附到离心管管壁上,并直接进行细菌检测。通过优化溶菌酶和BSA浓度得到最准确的细菌数目,从而进行定量分析。
1.2.7 人工污染牛乳
在人工污染前,按照国标法检测证实样品不含大肠杆菌。然后对1 mL不含大肠杆菌的牛乳样品污染不同浓度的大肠杆菌,依次为4.0×102~2.0×104 CFU/mL。往水凝胶体系中加入2.5 μL人工污染牛乳样品,此时每个实验组中大肠杆菌的个数为1~50。
1.2.8 数字化LAMP反应特异性
为了探究反应的特异性,往水凝胶体系中分别加入相同浓度的大肠杆菌DNA、单核李斯特菌DNA和伤寒沙门氏菌DNA,在65 ℃条件下对水凝胶混合液加热30 min并记录荧光点数目。
1.2.9 数据处理与分析
所有实验数据均以平均值±标准差表示,实验重复3次。原始图像用于数据分析,并通过Image J软件测量荧光点数目。Origin Pro 9.0软件用于统计分析和图表绘制。对于图7-e,使用线性函数y=ax+b拟合数据。
2 结果与分析
2.1 数字化LAMP检测大肠杆菌方法的建立
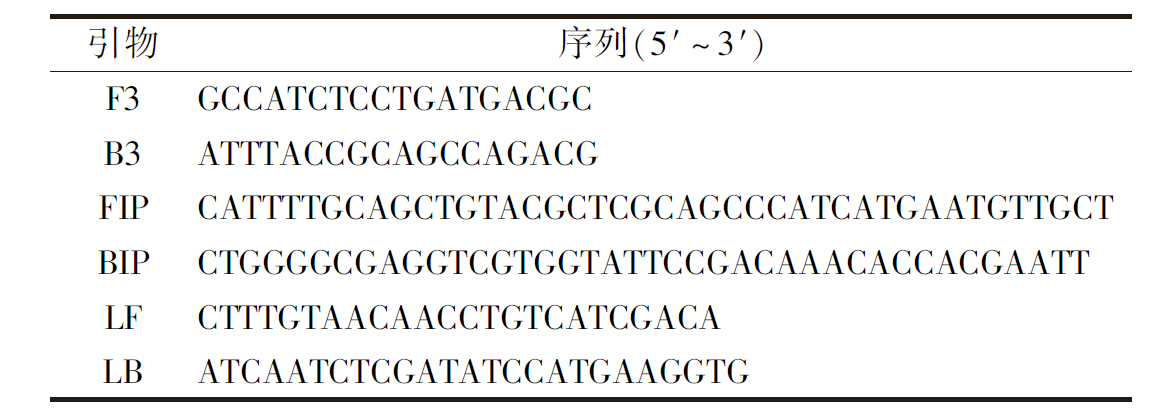
如图1所示,随着反应的进行,水凝胶阳性对照样品中荧光强度缓慢增加,当反应进行至6 min时,管内荧光强度开始大幅增加,反应至12 min时,荧光信号增加强度逐渐变缓直至反应结束,说明溶液中发生了扩增反应。同时,水凝胶阴性对照组荧光曲线一直处于相对平滑的状态,直到反应终止都没有明显变化,说明没有发生扩增反应。该结果表明,水凝胶的加入不会影响LAMP扩增。
1-水凝胶阳性对照,DNA浓度为1.0×105 copy/mL;2-水凝胶阴性对照
图1 数字化LAMP检测结果
Fig.1 Detection results of digital LAMP
2.2 环引物浓度对数字化LAMP的影响
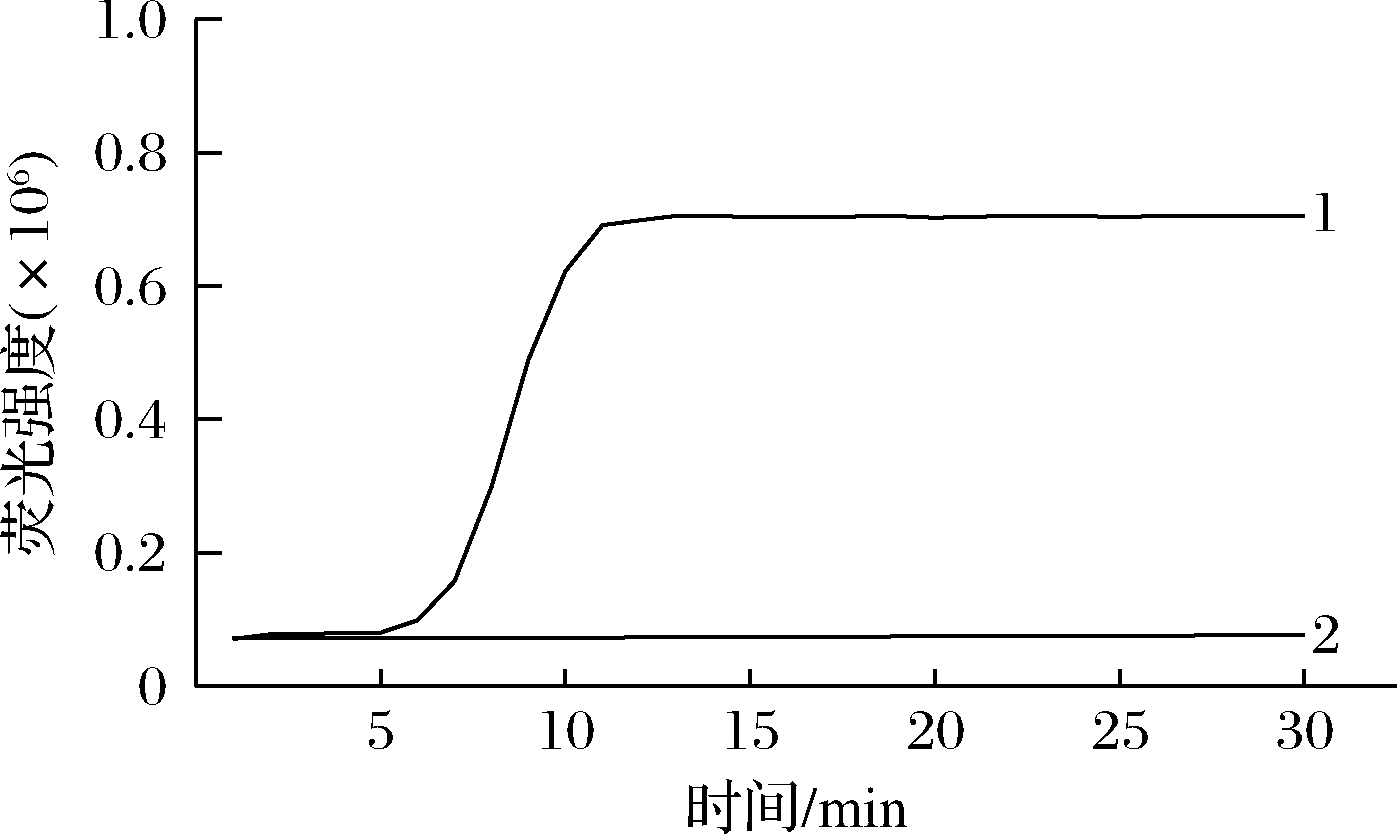
环引物浓度通常影响LAMP反应的效率。由图2可知,随着环引物浓度增加,反应出峰时间从15 min降至2 min,同时荧光信号达到最大值所用时间从20 min降至8 min。说明环引物浓度的增加可以提高反应效率,减少反应时间。
1~3 环引物浓度LF/LB由高到低分别为0.8、0.4 和0 μmol/L,DNA浓度为1.0×105 copy/mL
图2 环引物浓度对数字化LAMP的影响
Fig.2 Impact of loop primer concentration on the digital LAMP
2.3 时间对数字化LAMP的影响
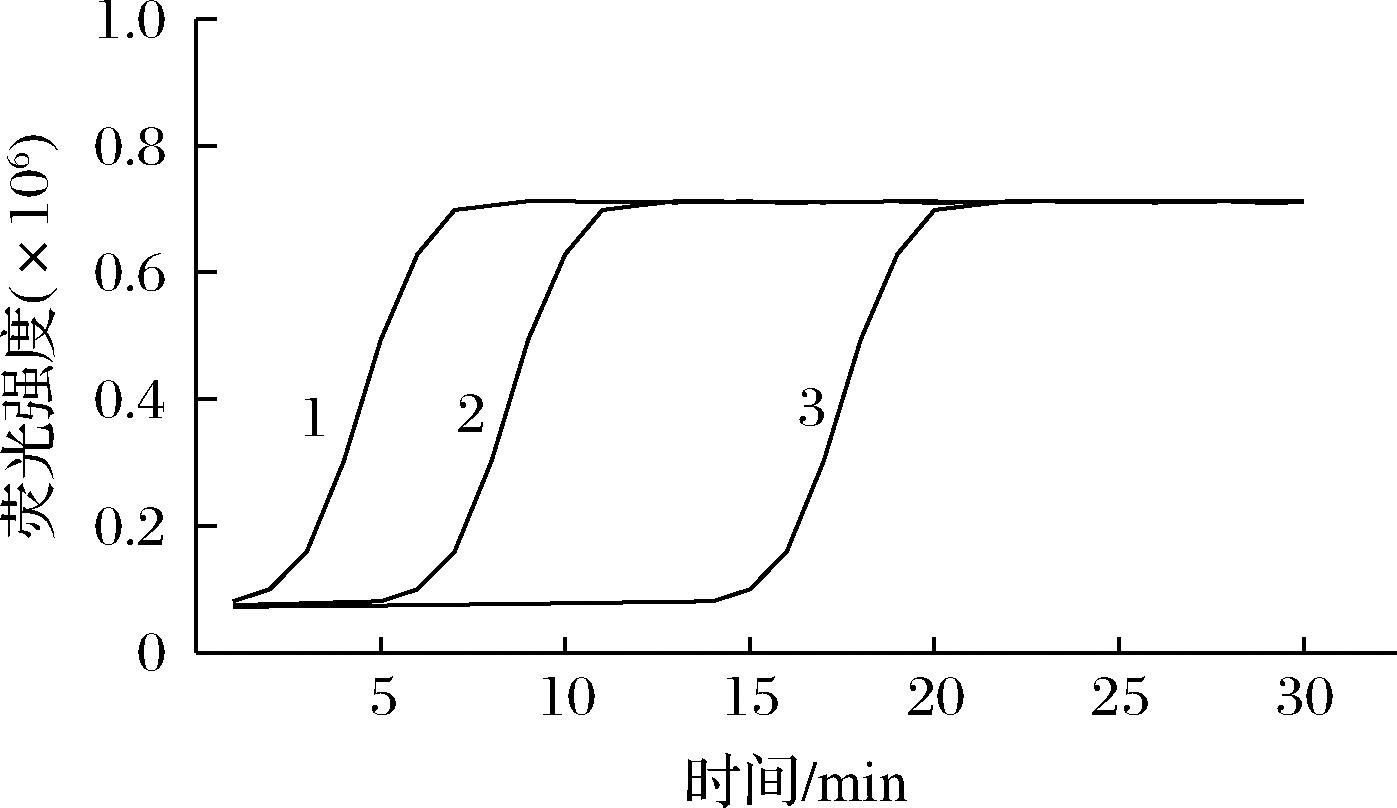
本实验通过改变扩增时间来确定数字化LAMP反应中荧光扩增点数目的变化情况。如图3所示,随着扩增时间的增加,扩增点数目逐渐增大并在20 min达到最大值,而在此之后荧光扩增点的数目变化不大,这可能是因为在20 min左右反应已经基本完成扩增。本实验中主要讨论的是如何在较短的时间内如何更高效率检测出大肠杆菌,因此,选择扩增时间为20 min。
图3 扩增时间对数字化LAMP扩增点数目的影响
Fig.3 Impact of reaction time on the number of digital LAMP amplicon dots
注:每个反应中大肠杆菌基因组的浓度相同且均为42 copies/μL
2.4 DNA热变性对数字化LAMP的影响
为进一步优化数字化LAMP扩增点的数目,对DNA进行热变性预处理,即分别在85和95 ℃加热不同时间,DNA双链部分或全部解螺旋以便于促进扩增反应的进行。如图4所示,随着加热时间的增长和加热温度的升高,扩增点数目均出现了不同程度的下降,这可能是因为过长的加热时间和过高加热温度会对DNA造成破坏,从而影响扩增反应。
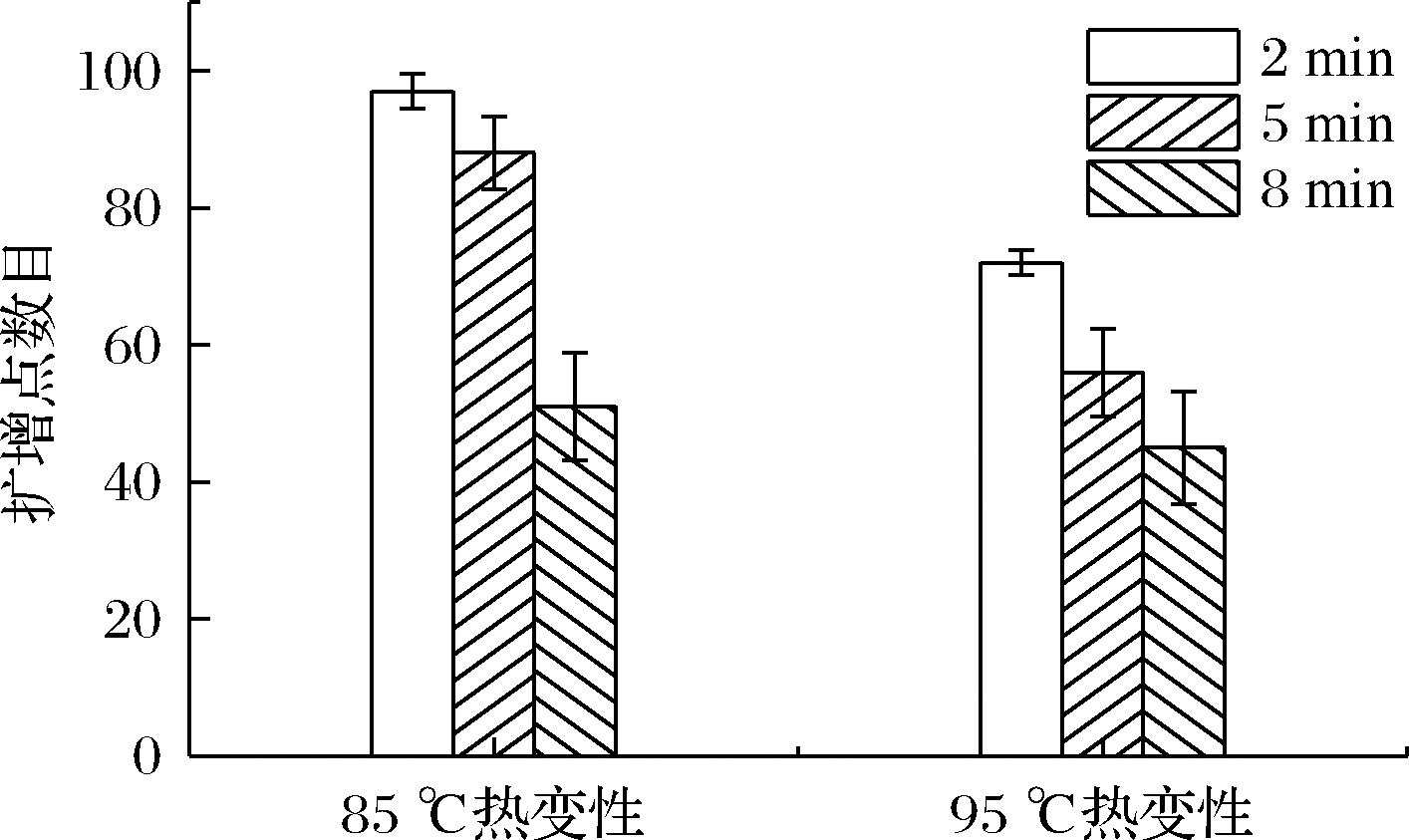
图4 DNA热变性对数字化LAMP扩增点数目的影响
Fig.4 Impact of DNA denature on the number of digital LAMP amplicon dots
注:每个反应中大肠杆菌基因组的浓度相同且均为100 copies/μL
2.5 溶菌酶对数字化LAMP的影响
为实现对大肠菌的直接检测,往体系中加入溶菌酶水解细菌细胞壁,并对释放的基因组进行直接扩增,同时将未添加溶菌酶的实验组作为空白对照组。如图5所示,添加溶菌酶实验组扩增点数目与提取的DNA处理组扩增点数目十分接近,而未添加溶菌酶的空白对照组数目远远少于2个实验组的扩增点数目,因此溶菌酶可用于细菌的裂解和直接扩增实验。

a-DNA热变性预处理;b-添加溶菌酶实验组;
c-未添加溶菌酶对照组
图5 溶菌酶对数字化LAMP的影响
Fig.5 Impact of lysozyme on the digital LAMP
注:每个反应中大肠杆菌的浓度相同且均为42 CFU/μL
2.6 BSA对数字化LAMP的影响
本实验使用按DEPC水梯度稀释的大肠杆菌菌液以及溶菌酶进行数字化LAMP反应,并对BSA质量浓度进行优化。如图6所示,随着BSA质量浓度的增加,荧光扩增点的个数增加,实验结果越接近给定菌液浓度,可信度越高,同时应尽量避免高质量浓度BSA抑制扩增反应,因此,选择适宜的BSA质量浓度为1.0 mg/mL。
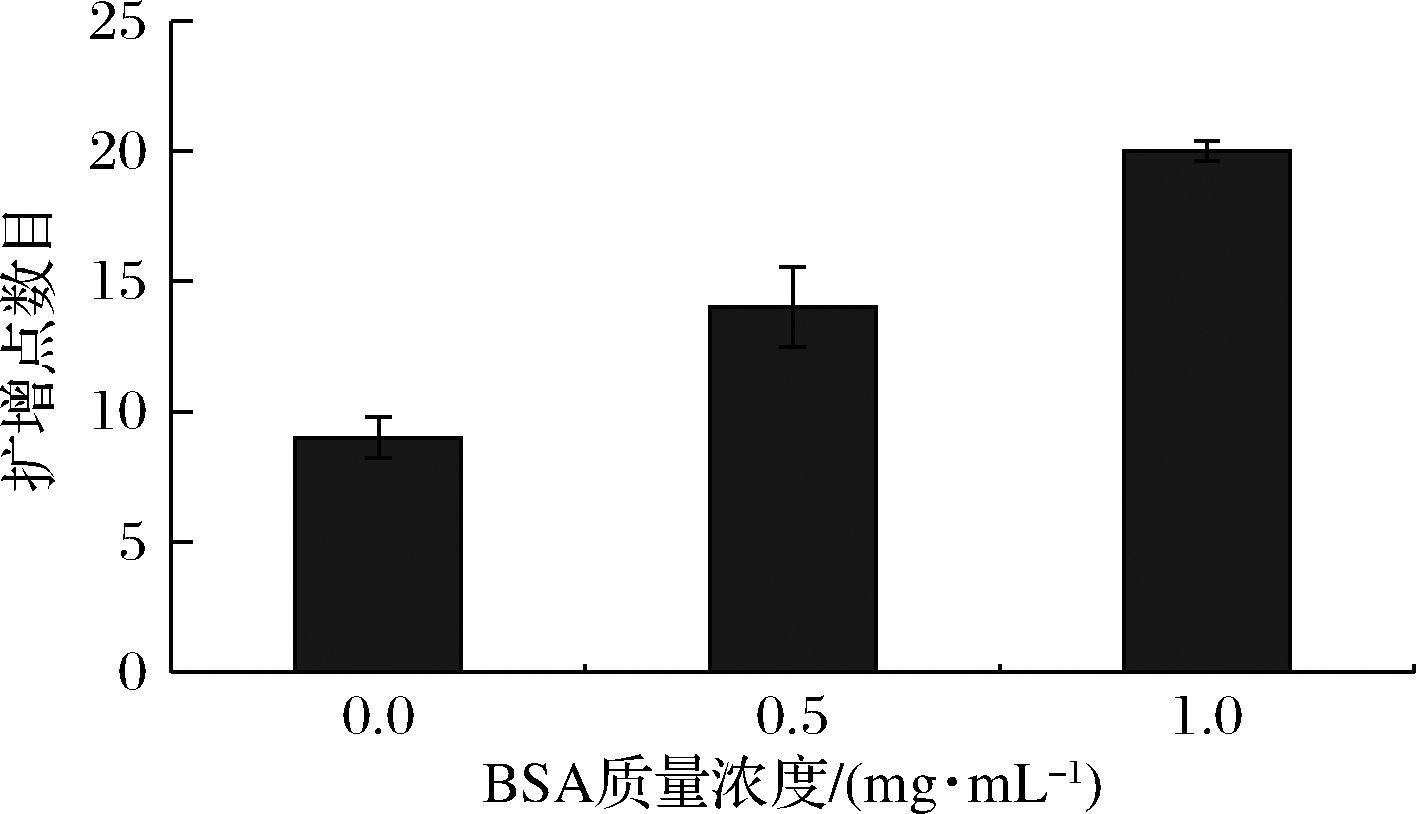
图6 BSA对数字化LAMP扩增点数目的影响
Fig.6 Impact of BSA concentration on the number of digital LAMP amplicon dots
注:每个反应中大肠杆菌的浓度相同且均为20 CFU/μL
2.7 数字化LAMP检测牛乳样品中大肠杆菌及反应特异性
用优化的方法对牛乳中大肠杆菌进行快速检测。牛乳中菌液浓度与所检测到的荧光点个数成线性关系,如图7所示。该方法所得到的结果与平板培养法非常接近(R2=0.999 8)。同传统平板计数法相比,本方法检测可在20 min左右完成,灵敏度可降至单个细菌,大大缩短检测周期而且操作简便。同时在加入相同浓度的大肠杆菌DNA、单核李斯特菌DNA和伤寒沙门氏菌DNA后,仅有大肠杆菌DNA实验组观测到荧光点,如图7-f所示,这是因为本实验中所提供的引物序列主要用于检测大肠杆菌,说明该方法具有很高的特异性。

a-1个大肠杆菌荧光图;b-10个大肠杆菌荧光图;c-25个大肠杆菌荧光图;d-50个大肠杆菌荧光图;
e-菌液浓度和扩增点个数拟合图;f-特异性
图7 数字化LAMP检测牛乳中大肠杆菌关系图及反应特异性
Fig.7 Detection plot of digital LAMP amplicon dots derived from milk inoculated with E.coli and response specificity
本实验建立的数字化LAMP可以快速准确定量样品中大肠杆菌的数目,检测限可低至0.4 CFU/μL,因此本研究所建立的一种基于数字化LAMP计数检测牛乳中大肠杆菌的方法具有可行性。
3 结论
本研究利用LAMP反应产物在聚乙二醇水凝胶中发生数字化扩增并与荧光染料结合发出荧光的特点,并在扩增结束后通过荧光显微镜观察到明显的荧光扩增点,通过改变BSA质量浓度、扩增时间等条件优化实验结果,使用图像处理软件Image J 计数来实现绝对定量检测和分析,建立了一种基于数字化环介导等温扩增技术检测大肠杆菌的方法。与普通基因检测方法相比,本研究所提出的数字化LAMP方法特点是:(1)具有很高的特异性和灵敏度,可以达到单拷贝基因检测的水平,实现DNA的绝对定量分析;(2)相比PCR,本技术不需要热循环,只需恒温加热即可;(3)不需要对细胞破碎以提取DNA,从而简化实验步骤,缩短了检测周期,提高了检测效率。通过对人工污染的样品进行检测,结果表明经过20 min就可完成牛乳中大肠杆菌的检测。本研究探索了一种特异性强、灵敏度高、操作便捷的分子检测大肠杆菌的技术,为大肠杆菌及其他细菌的快速检测提供了新的发展方向。
[1] 陈嘉惠, 陈沁,钮冰.乳品中有害微生物检测技术的研究进展[J].中国乳品工业,2019,47(5):32-36.
CHEN J H,CHEN Q,NIU B.Research progress on detection techniques of harmful microorganisms in dairy products[J].China Dairy Industry,2019,47(5):32-36.
[2] 陈盼, 贺稚非,龚霄,等.食品中大肠杆菌的快速检测方法[J].食品工程,2008(1):58-61.
CHEN P,HE Z F,GONG X,et al.Rapid methods for detection of Escherichia coli[J].Food Engineering,2008(1):58-61.
[3] 赵艳坤, 陈贺,王帅,等.生鲜乳中微生物检测技术研究进展[J].中国奶牛,2019(4):52-56.
ZHAO Y K,CHEN H,WANG S,et al.Research status of microbial detection technology in raw milk[J].China Dairy Cattle,2019(4):52-56.
[4] 国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.3—2016 食品安全国家标准 食品微生物学检验 大肠菌群计数[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission,National Medical Products Administration.GB 4789.3-2016 National standards for food safety Microbiological inspection of food Coliform population count[S].Beijing:China Standards Press,2016.
[5] 周威, 胡梁斌,李红波,等.食物中食源性病原菌检测技术研究进展[J].食品研究与开发,2017,38(9):213-216.
ZHOU W,HU L B,LI H B,et al.Advances in detection of foodborne pathogens in food[J].Food Research and Development,2017,38(9):213-216.
[6] 马冬. 乳品卫生指标大肠杆菌及检测技术的研究[D].西安:陕西科技大学,2009.
MA D.Study on important sanitation indexes and detecting technology of E.coli in milk[D].Xi’an:Shaanxi University of Science & Technology,2009.
[7] 方婷子, 史贤明,施春雷.沙门氏菌血清型快速PCR鉴定方法的建立[J].中国食品学报,2017,17(2):212-219.
FANG T Z,SHI X M,SHI C L.Development of rapid PCR determination method of Salmonella serovars[J].Journal of Chinese Institute of Food Science and Technology,2017,17(2):212-219.
[8] 杜雄伟,李叶,冮洁,等.肉制品中沙门氏菌invA基因实时荧光定量PCR检测方法的建立[J].食品工业科技,2013,34(12):68-70;80.
DU X W,LI Y,GANG J,et al.Establishment of real-time fluorescent PCR detection method of invA gene in Salmonella[J].Science and Technology of Food Industry,2013,34(12):68-70;80.
[9] HEYRIES K A,TROPINI C,VANINSBERGHE M,et al.Megapixel digital PCR[J].Nature Methods,2011,8(8):649-651.
[10] LIN X Y,HUANG X,ZHU Y Z,et al.Asymmetric membrane for digital detection of single bacteria in milliliters of complex water samples[J].ACS Nano,2018,12(10):10 281-10 290.
[11] NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12).DOI:10.1093/nar/28.12.e63.
[12] 郭建平,万佳佳,陆兆新,等.基于可视化环介导等温扩增技术快速检测金黄色葡萄球菌[J].食品科学,2019,40(20):325-331.
GUO J P,WAN J J,LU Z X,et al.Rapid visual detection of Staphylococcus aureus using loop-mediated isothermal amplification[J].Food Science,2019,40(20):325-331.
[13] SONG H,BAE Y C,KWON H,et al.Loop-mediated isothermal amplification assays for Enterococcus sp.,Escherichia coli and Staphylococcus aureus in chicken[J].FEMS Microbiology Letters,2019,366(5).DOI:10.1093/femsle/fnz042.
[14] 申培立, 王羽,李志辉,等.变形杆菌环介导等温扩增检测法的可视化方法的比较[J].河北农业大学学报,2016,39(9):73-77;82.
SHEN P L,WANG Y,LI Z H,et al.Comparison of the visualization methods of loop-mediated isothermal amplification for detecting Proteus[J].Journal of Agricultural University of Hebei,2016,39(9):73-77;82.
[15] 王瑾, 林丽萍,郜彦彦,等.实时荧光环介导等温扩增快速检测鸡肉中沙门氏菌[J].食品科学,2016,37(24):170-174.
WANG J,LIN L P,GAO Y Y,et al.Development and application of a real-time loop-mediated isothermal amplification assay for rapid detection of Salmonella enterica ser.enteritis retrieved from chicken[J].Food Science,2016,37(24):170-174.
[16] 魏桢元. 环介导等温扩增技术在食源性沙门氏菌检测中的应用研究进展[J].江苏农业科学,2020,48(3):80-85.
WEI Z Y.Research progress on application of loop-mediated isothermal amplification (LAMP) for detection of Salmonella in food[J].Jiangsu Agricultural Sciences,2020,48(3):80-85.
[17] YUAN H,CHAO Y C,SHUM H C.Droplet and microchamber-based digital loop-mediated isothermal amplification (dLAMP)[J].Small,2020,16.DOI:10.1002/smll.201904469.
[18] MITRA R D,CHURCH G M.In situ localized amplification and contact replication of many individual DNA molecules[J].Nucleic Acids Research,1999,27(24),e34-e39.
[19] HILL J,BERIWAL S,CHANDRA I,et al.Loop-mediated isothermal amplification assay for rapid detection of common strains of Escherichia coli[J].Journal of Clinical Microbiology,2008,46(8):2 800-2 804.