随着生物学技术及交叉学科的发展进步,各类快速、灵敏、通量大的微生物新型检验方法的开发验证逐渐成为关注热点[1-5]。ATP生物荧光增幅法是本课题组基于ATP生物荧光技术建立的一套微生物快速检验方法[6-8]。该方法利用微生物体内的腺苷酸激酶AK催化外源添加的二磷酸腺苷ADP转换为三磷酸腺苷ATP,短时间内实现ATP增幅,通过检测荧光信号的强度判断测试样品中是否含有微生物污染[9]。经前期方法学验证,该方法与《化妆品安全技术规范》(2015版)[10](以下简称《规范》)中菌落总数、霉菌和酵母菌总数检验标准方法具有部分等效性[11]。
耐热大肠菌群、铜绿假单胞菌和金黄色葡萄球菌是《规范》中要求每克或每毫升化妆品产品中不得检出的三类污染菌[10]。其中,耐热大肠菌群是指一群需氧及兼性厌氧的革兰氏阴性无芽胞杆菌,为化妆品粪便污染指标菌;铜绿假单胞菌和金黄色葡萄球菌则是具有潜在风险的机会致病菌[12]。为证明ATP生物荧光增幅法可同步筛查化妆品中控制菌污染,本研究参照《中国药典》(2020版)[13]药品微生物检验替代方法验证指导原则中定性检验方法的验证要求,收集清洁类、护理类、美容修饰类等6种化妆品,从专属性、检测限、重现性和耐用性4个方面开展了ATP生物荧光增幅法与《规范》中上述3种控制菌标准检验方法的部分等效性验证研究,以期明确ATP生物荧光增幅法的使用范围,并为将其推广应用于食品、水、环境等领域的微生物快速检测提供借鉴。
1 试验方法
1.1 试验产品
依据GB/T 18670—2017《化妆品分类》的分类原则[14],从清洁类、护理类、美容修饰类中选取洗发水、沐浴液、护发素、定型水、面霜和面膜共6种市售产品,每个产品选择3个不同批次。
1.2 试验菌株
研究表明《规范》中耐热大肠菌群检验方法的实际目标菌为具耐热性能的大肠埃希氏菌[15]。结合化妆品生产环境、原料和配方等特性,收集了环境和工业等不同来源的大肠埃希氏菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)和金黄色葡萄球菌(Staphylococcus aureus)各20株(共60株),用于测试改良TAT(MTAT)培养基的促生长能力,并以大肠埃希氏菌(E.coli)CICC 10389(=CMCC(B)44102)、铜绿假单胞菌(P.aeruginosa)CICC 10419(=CMCC(B)10104)和金黄色葡萄球菌(S.aureus)CICC 10384(= CMCC(B)26003)作为代表性控制菌株用于方法验证研究,以上菌株均由中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)提供。
1.3 仪器与试剂
HG-50高压灭菌器,日本平山制作所株式会社;Celsis®Advance II 光度计,Charles River Laboratories;BHG—8082型恒温培养箱、THZ-98C恒温振荡培养箱,上海一恒科学仪器有限公司;往复式摇床,Eberbach;AC2-4S1生物安全柜,新加坡艺思高科技有限公司。
双倍乳糖胆盐(含中和剂)培养基、大豆酪蛋白消化卵磷脂聚山梨酯肉汤(soya casein digest lecithin polysorbate broth,SCDLP)液体培养基、Baird-Parker琼脂、十六烷三甲基溴化铵琼脂,北京陆桥技术股份有限公司;改良TAT(MTAT)培养基 (g/L):TAT肉汤 22.50、硫代硫酸钠 0.50、组氨酸 0.10、蛋白胨 7.50、葡萄糖 15.00、氯化钠 0.85、卵磷脂1.43和吐温80 39.00,pH值调至7.0±0.1;ATP生物荧光增幅法试剂,Charles River Laboratories Celsis®AMPiScreenTM。
1.4 试验方法
依据《中国药典》(2020版)微生物检验替代方法验证指导原则中定性检验方法的验证要求,从专属性、检测限、重现性和耐用性4个方面,开展ATP生物荧光增幅法和《规范》中耐热大肠菌群、铜绿假单胞菌和金黄色葡萄球菌检验方法的部分等效性验证。
1.4.1 专属性
专属性参数的验证包括ATP生物荧光增幅法是否能够适用于3种控制菌的富集生长,且有产品存在时该方法是否能够检测出其中的控制菌。本研究通过测定MTAT富集培养基对3种控制菌的促生长能力和人工污染样品来评价方法专属性。
为全面考察方法所用培养基对3种控制菌的促生长能力,将收集的不同来源的60株控制菌株制备为10~100 CFU/10 mL的菌悬液,接种至90 mL MTAT富集培养基,于(30±2) ℃,200 r/min,振荡培养48 h,吸取50 μL富集培养液进行ATP生物荧光增幅法检测,同时,观察培养液浊度确认是否有微生物生长,以此评价富集培养基MTAT的促生长能力。
人工污染样品的测定以大肠埃希氏菌(E.coli) CICC 10389、铜绿假单胞菌(P.aeruginosa) CICC 10419和金黄色葡萄球菌(S.aureus)CICC 10384作为代表菌株。参照Charles River公司提供仪器使用说明书对试验选择的6种化妆品进行样品影响测试和接菌试验。样品影响测试通过的标准为培养基空白的信号值低于1 000 RLU,产品样品的信号值低于3倍培养基空白的信号值,ATP对照、微生物对照、ATP样品和微生物样品的信号值高于3倍培养基空白的信号值,且产品ATP回收率应高于25%(推荐值),计算公式(1)为:
ATP回收率![]()
(1)
平板确认阴性无可见菌落生长。接菌试验通过的标准为微生物样品和微生物对照的检测结果为阳性,未接菌的产品样品检测结果为阴性,且平板确认无菌落生长。
1.4.2 检测限
使用生理盐水将大肠埃希氏菌(E.coli)CICC 10389、铜绿假单胞菌(P.aeruginosa) CICC 10419和金黄色葡萄球菌(S.aureus)CICC 10384均制备为梯度是100、10和1 CFU/mL的接种液,并按照产品目标污染浓度10、1和0.1 CFU/g进行接种,分别使用ATP生物荧光增幅法和《规范》中标准方法进行检测。利用Fisher exact test对2种方法的检测结果进行统计分析,评价2种方法的检测限是否存在差异,并分别计算每种方法对3株控制菌株50%检出时的检出限(LOD50)。
ATP生物荧光增幅法检测:取10 g产品加入90 mL MTAT富集培养基中制备为产品稀释液,将3株控制菌株的3个梯度的接种液分别取1 mL接种于上述制备的产品稀释液中,混匀,吸取10 mL于90 mL MTAT富集培养基,置于(30±2) ℃,200 r/min,振荡培养48 h,取样上机进行ATP生物荧光增幅法检测。每个产品重复5次。
标准方法检测:取10 g产品加入90 mL生理盐水中制备为产品稀释液,将3株控制菌株的3个梯度的接种液分别取1 mL接种于上述制备的产品稀释液中,混匀。分别按照《规范》中3种控制菌的检测方法进行检测。大肠埃希氏菌的判断标准为双倍乳糖胆盐(含中和剂)培养基,培养24 h,产酸产气报告阳性,不产酸产气,继续培养至48 h,如仍既不产酸也不产气,报告阴性,否则报告阳性。铜绿假单胞菌的判断标准为十六烷三甲基溴化铵琼脂培养48 h,无铜绿假单胞菌典型菌落生长[10],报告阴性,有则报告阳性。金黄色葡萄球菌的判断标准为Baird-Parker培养基培养48 h,无金黄色葡萄球菌典型菌落生长[10],报告阴性,有则报告阳性。每个产品重复5次。
1.4.3 重现性
以金黄色葡萄球菌(S.aureus)CICC 10384为代表进行重现性试验,将菌株CICC 10384按照目标污染浓度10~30 CFU/g接种于同批次的护发素产品中,选择3家不同实验室分别使用ATP生物荧光增幅法和标准方法对同一人工污染样品进行检测,并通过Fisher exact test统计方法对检测结果进行分析,评价3家不同实验室的检测结果是否存在显著性差异。
1.4.4 耐用性
MTAT富集培养基的促生长能力是ATP生物荧光增幅法检测的关键,为保证其中和效果和增菌能力,团队前期进行了大量试验研究优化培养基成分。因此,本研究通过考察不同品牌的TAT肉汤配制的MTAT富集培养基的促生长能力来进行耐用性评价。选取3种不同品牌的TAT肉汤,配制MTAT富集培养基,以金黄色葡萄球菌(S.aureus)CICC 10384为代表菌株开展耐用性试验,将菌株按照目标污染浓度10~30 CFU/g接种于不同MTAT富集培养基稀释的护发素产品中,使用ATP生物荧光增幅法进行检测。比较不同TAT基础培养基配制的MTAT是否会对ATP生物荧光增幅法检测结果产生影响。
2 结果与讨论
2.1 专属性
促生长试验结果显示(表1),在无产品干扰情况下,60株控制菌株经MTAT培养基振荡培养48 h后菌液均浑浊,且ATP生物荧光增幅法检测结果均为阳性,表明ATP生物荧光增幅法使用的MTAT富集培养基对3种控制菌的富集能力良好。
表1 MTAT富集培养基促生长试验结果
Table 1 Growth promotion test results of MTAT broth
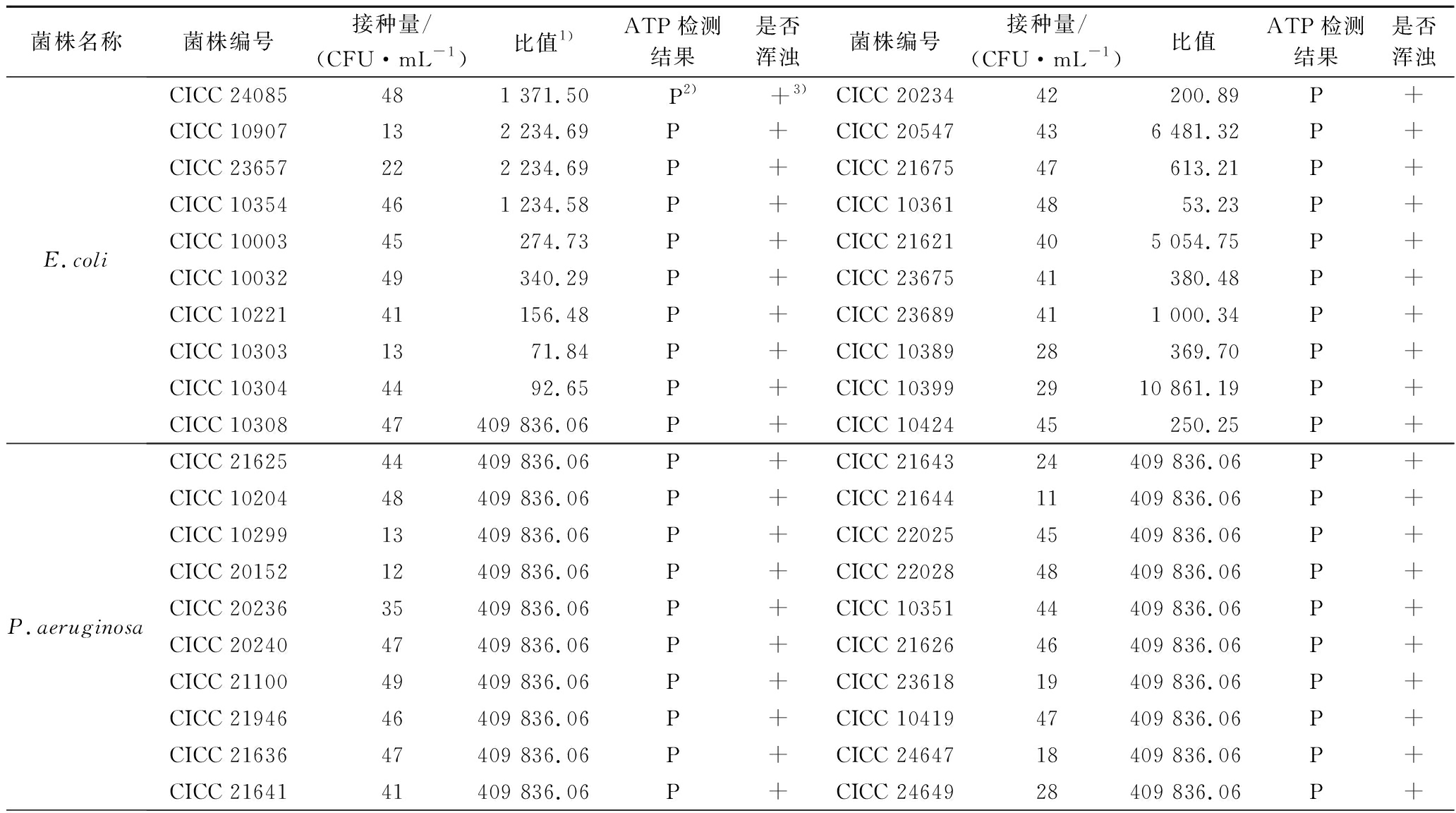
菌株名称菌株编号接种量/(CFU·mL-1)比值1)ATP检测结果是否浑浊菌株编号接种量/(CFU·mL-1)比值ATP检测结果是否浑浊E.coliCICC 24085481 371.50P2)+3)CICC 2023442 200.89P+CICC 10907132 234.69P+CICC 20547436 481.32P+CICC 23657222 234.69P+CICC 2167547613.21P+CICC 10354461 234.58P+CICC 103614853.23P+CICC 1000345274.73P+CICC 21621405 054.75P+CICC 1003249340.29P+CICC 2367541380.48P+CICC 1022141156.48P+CICC 23689411 000.34P+CICC 103031371.84P+CICC 1038928369.70P+CICC 103044492.65P+CICC 103992910 861.19P+CICC 1030847409 836.06P+CICC 1042445250.25P+P.aeruginosaCICC 2162544409 836.06P+CICC 2164324409 836.06P+CICC 1020448409 836.06P+CICC 2164411409 836.06P+CICC 1029913409 836.06P+CICC 2202545409 836.06P+CICC 2015212409 836.06P+CICC 2202848409 836.06P+CICC 2023635409 836.06P+CICC 1035144409 836.06P+CICC 2024047409 836.06P+CICC 2162646409 836.06P+CICC 2110049409 836.06P+CICC 2361819409 836.06P+CICC 2194646409 836.06P+CICC 1041947409 836.06P+CICC 2163647409 836.06P+CICC 2464718409 836.06P+CICC 2164141409 836.06P+CICC 2464928409 836.06P+
续表1

菌株名称菌株编号接种量/(CFU·mL-1)比值1)ATP检测结果是否浑浊菌株编号接种量/(CFU·mL-1)比值ATP检测结果是否浑浊S.aureusCICC 2392618201.04P+CICC 2369912979.34P+CICC 10145432 190.11P+CICC 10384164 163.96P+CICC 10201214 116.41P+CICC 10473111 645.44P+CICC 1030146409 836.06P+CICC 1078649277.05P+CICC 10306451 753.22P+CICC 10789431 962.68P+CICC 10307482 069.98P+CICC 10790235 541.64P+CICC 21648111 278.16P+CICC 24065144 468.39P+CICC 21600334 180.77P+CICC 24066437 596.26P+CICC 23463254 059.74P+CICC 248174730.70P+CICC 23478456 182.25P+CICC 24818251 106.94P+
注:1)比值,微生物样品RLU值与培养基空白RLU值的比值;2),“P”表示ATP生物荧光增幅法检测结果为阳性,即微生物样品RLU值与培养基空白RLU值的比值大于3;3),“+”表示菌株培养液浑浊
样品影响测试结果显示,培养基空白的荧光信号值在167~285 RLU,远低于检测方法要求的1 000 RLU,产品样品的荧光信号值在87~199 RLU,符合低于3倍培养基空白信号值的要求,且经涂布平板培养后确认化妆品样品中未见微生物污染;同时,ATP对照、微生物对照、ATP样品和微生物样品的荧光信号值均大于3倍培养基空白的信号值,且测试产品的ATP回收率区间为73.8%~106.8%,均高于25%的推荐值,表明6种产品均通过了样品影响测试。此外,接种控制菌株的微生物样品ATP生物荧光增幅法检测结果均为阳性,未接菌产品样品的检测结果均为阴性,表明6种产品均通过了接菌试验。综合分析培养基促生长测试、样品影响测试和接菌试验的结果,表明ATP生物荧光增幅法具有良好专属性。
2.2 检测限
ATP生物荧光增幅法和《规范》中标准方法对3株控制菌株的检测结果见表2和表3。对于大肠埃希氏菌(E.coli)CICC 10389,当污染浓度为10 CFU/g时,标准方法与ATP生物荧光增幅法对6种产品均有5次阳性检出,检出率均为100%;当污染浓度为1 CFU/g时,标准方法对部分产品存在阳性检出,整体检出率为26.7%,ATP生物荧光增幅法对6种产品均有5次阳性检出,检出率为100%;当污染浓度为0.1 CFU/g时,标准方法对6种产品均无阳性检出,ATP生物荧光增幅法对沐浴液、护发素和面霜有阳性检出,检出率为10%。综合比较2种方法对3个浓度6种人工污染产品的大肠埃希氏菌检测结果,标准方法在90次检测中得到38次阳性检出,检出率为42.2%,LOD50为1.05 CFU/g,ATP生物荧光增幅法在90次检测中得到63次阳性检出,检出率为70%,LOD50为0.20 CFU/g;经Fisher exact test统计分析,ATP生物荧光增幅法显著优于标准方法(P=0.000 3)。
表2 检测限检测结果
Table 2 Limit of detection(LOD)test results
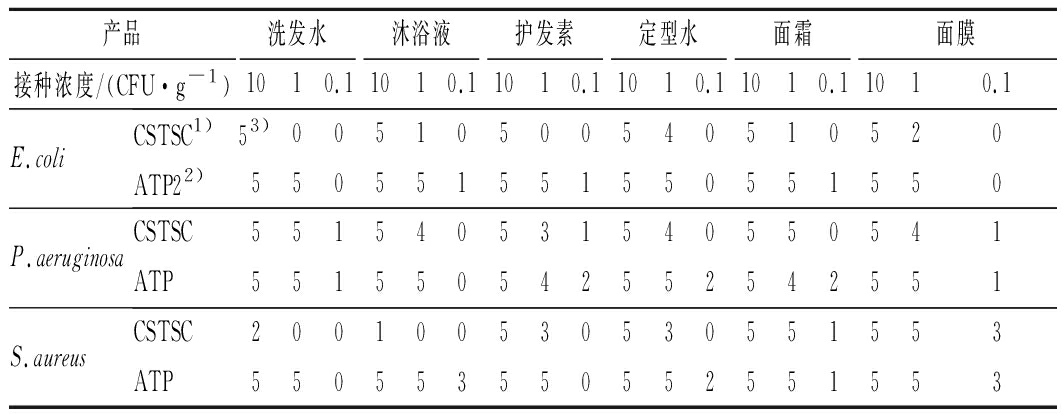
产品洗发水沐浴液护发素定型水面霜面膜接种浓度/(CFU·g-1)1010.11010.11010.11010.11010.11010.1E.coliCSTSC1)53)00510500540510520ATP22)550551551550551550P.aeruginosaCSTSC551540531540550541ATP551550542552542551S.aureusCSTSC200100530530551553ATP550553550552551553
注:1)CSTSC,《化妆品安全技术规范》(2015版)标准方法;2)ATP表示ATP生物荧光增幅法检测结果;3)表示5次重复试验中阳性结果数量(表3、表4同)
表3 检测限检测结果统计分析
Table 3 Statistical analysis of LOD test results
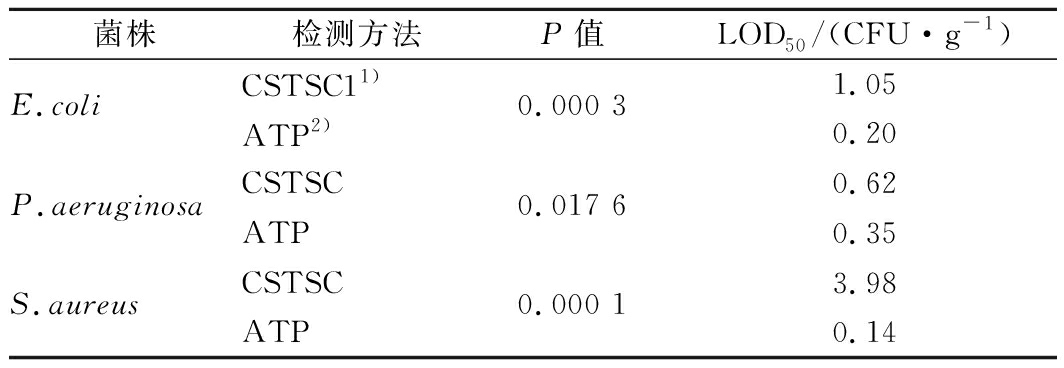
菌株检测方法P值LOD50/(CFU·g-1)E.coliCSTSC11)0.000 31.05ATP2)0.20P.aeruginosaCSTSC0.017 60.62ATP0.35S.aureusCSTSC0.000 13.98ATP0.14
对于铜绿假单胞菌(P.aeruginosa)CICC 10419,当污染浓度为10 CFU/g时,标准方法与ATP生物荧光增幅法对6种产品均有5次阳性检出,检出率均为100%;当污染浓度为1 CFU/g时,30次检测中,标准方法得到25次阳性检出,检出率为83.3%,ATP生物荧光增幅法得到28次阳性检出,检出率为93.3%;当污染浓度为0.1 CFU/g时,标准方法对洗发水、护发素和面膜3种产品各有1次阳性检出,检出率为10%,ATP生物荧光增幅法仅对沐浴液无阳性检出,6种产品检出率为26.7%。综合比较2种方法对3个浓度6种人工污染产品的铜绿假单胞菌检测结果,标准方法在90次检测中得到58次阳性检出,检出率为64.4%,LOD50为0.62 CFU/g,ATP生物荧光增幅法在90次检测中得到66次阳性检出,检出率为73.3%,LOD50为0.35 CFU/g;经Fisher exact test统计分析,ATP生物荧光增幅法显著优于标准方法(P=0.017 6)。
对于金黄色葡萄球菌(S.aureus)CICC 10384,当污染浓度为10 CFU/g时,30次检测中,标准方法得到23次阳性检出,检出率均为76.7%;ATP生物荧光增幅法全部阳性检出,检出率为100%;当污染浓度为1 CFU/g时,标准方法对部分产品存在阳性检出,检出率为53.3%,ATP生物荧光增幅法对6种产品均有5次阳性检出,检出率为100%;当污染浓度为0.1 CFU/g时,标准方法仅对面霜和面膜存在阳性检出,检出率为13.3%,ATP生物荧光增幅法对4种产品有9次阳性检出,检出率为30%。综合比较2种方法对3个浓度6种人工污染产品的金黄色葡萄球菌检测结果,标准方法在90次检测中得到43次阳性检出,检出率为47.8%,LOD50为3.98 CFU/g,ATP生物荧光增幅法在90次检测中得到69次阳性检出,检出率为76.7%,LOD50为0.14 CFU/g;经Fisher exact test统计分析,ATP生物荧光增幅法显著优于标准方法(P=0.017 6)。
统计结果显示,ATP生物荧光增幅法对大肠埃希氏菌、铜绿假单胞菌和金黄色葡萄球菌的检测结果与标准方法检测结果相比均存在显著性差异(P<0.05),表明ATP生物荧光增幅法在进行耐热大肠菌群、铜绿假单胞菌和金黄色葡萄球菌检验时的检测限均优于标准方法。同时,进一步分析2种方法在低浓度污染下的检测结果,当污染浓度为1 CFU/g时,ATP生物荧光增幅法对大肠埃希氏菌、铜绿假单胞菌和金黄色葡萄球菌的检出率分别为100%、93.3%和100%,等于或大于标准方法的检出率;且该方法LOD50分别为0.20、0.35和0.14 CFU/g,均远小于标准方法的LOD50,表明ATP生物荧光增幅法灵敏度高,在低浓度污染下检出效果更好。ATP生物荧光增幅法的高灵敏度与方法所用培养基的中和体系密不可分。化妆品中一般富含适宜于微生物生长和繁殖的营养成分,为预防生产和使用过程中发生微生物污染,化妆品生产过程中通常会额外添加限定剂量的防腐剂或其他抑菌物质[16-18]。
本方法建立过程中,对方法的中和效果进行了重点关注,结合现有化妆品防腐体系特点,在MTAT富集培养基中使用含量为4.5%的卵磷脂和吐温80[19-20]等中和剂,可有效消除所选化妆品产品的抑菌作用,更加真实反映产品中微生物的污染情况,保证检验结果的可靠性。
2.3 重现性
重现性检测结果显示(表4),3家不同实验室使用2种方法对同一护发素污染样品的金黄色葡萄球菌阳性检出结果均相同,经Fisher exact test统计分析,检测结果无统计学差异(P>0.05),表明ATP生物荧光增幅法具有良好的重现性。
表4 ATP生物荧光增幅法重现性试验结果
Table 4 Reproducibility test results of amplification ATP biofluorescence method

菌株检测方法检测结果实验室1实验室2实验室3P值S.aureusCSTSC1)53)551.000ATP2)5551.000
2.4 耐用性
课题组在前期方法建立过程中已证明上样量、培养温度等参数有小的刻意变化时,ATP生物荧光增幅法检测结果不受影响。本研究以对该方法检测结果同样具有重要影响的MTAT培养基为耐用性试验对象,结果显示(表5),3种不同品牌TAT肉汤配制的MTAT富集培养基空白荧光信号值均远小于1 000 RLU,满足ATP生物荧光增幅法检测的要求;3种MTAT培养基接种金黄色葡萄球菌(S.aureus)CICC 10384富集培养,ATP生物荧光增幅法检测结果均为阳性。表明该方法具有良好的耐用性。
表5 ATP生物荧光增幅法耐用性试验结果
Table 5 Durability test results of amplification ATP biofluorescence method
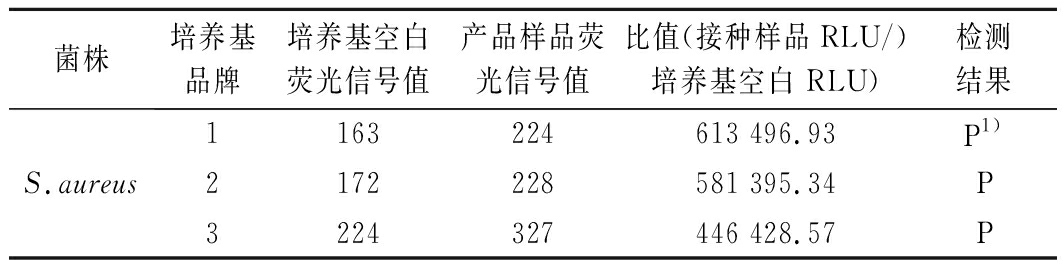
菌株培养基品牌培养基空白荧光信号值产品样品荧光信号值比值(接种样品RLU/)培养基空白 RLU)检测结果S.aureus1163224613 496.93 P1)2172228581 395.34P3224327446 428.57P
注:1)“P”表示ATP生物荧光增幅法检测结果为阳性,即样品RLU值与培养基空白RLU值的比值>3
ATP生物荧光增幅法专属性、重现性和耐用性良好,灵敏度更高,检出效果显著优于标准方法,团队前期研究结果表明该方法可用于化妆品中菌落总数、霉菌和酵母菌的检验;本研究结果进一步证明该方法在化妆品控制菌检验方面与标准方法具有部分等效性;这对于实现使用一种快速筛选方法同时进行《化妆品安全技术规范》(2015版)中要求的多种微生物检验,提高检测效率,缩短检测周期,加快产品放行,节省企业库存成本,满足新形势下化妆品电商快速流通需求具有重要理论指导意义。
3 结论
本研究从专属性、检测限、重现性和耐用性4个参数上证明ATP生物荧光增幅法与《规范》中耐热大肠菌群、铜绿假单胞菌和金黄色葡萄球菌标准检验方法具有部分等效性,结合本课题组前期研究成果,该方法可实现《规范》中各类微生物指标48 h同步筛查。
[1] LUCA M,BOLFONI M,BILZON V,et al.Preliminary evidence of a molecular detection method to analyze bacterial DNA as a quality indicator in cosmetics[J].Cosmetics,2020,7(3):54.
[2] 文霞,杨秀茳,谢小保.化妆品微生物检测技术的研究进展[J].日用化学工业,2015,45(2):110-114.
WEN X,YANG X J,XIE X B.Progress of microbiological detection technology of cosmetics[J].China Surfactant Detergent & Cosmetics,2015,45(2):110-114.
[3] 文霞,李彩玲,刘静霞,等.化妆品中耐热大肠菌群快速检测方法的研究[J].日用化学工业,2019,49(6):410-414.
WEN X,LI C L,LIU J X,et al.Research on rapid detection method of thermotolerant coliforms in cosmetics[J].China Surfactant Detergent & Cosmetics,2019,49(6):410-414.
[4] 高飞, 白东亭,黄杰,等.化妆品中金黄色葡萄球菌的PCR快速检测[J].环境与健康杂志,2016(33):814-816.
GAO F,BAI D T,HUANG J,et al.Rapid detection of Staphylococcus aureus in cosmetics by PCR[J].Journal of Environment and Health,2016(33):814-816.
[5] 仝微微,鲍其泠,罗利,等.ATP检测方法在化妆品微生物检测中的应用研究[C].第三届全国香料香精化妆品专题学术论坛,2013:194-198.
TONG W W,BAO Q L,LUO L,et al.The application research of ATP rapid microbial testing in cosmetics[C].The 3rd National Symposium on Fragrance and Flavor Cosmetics,2013:194-198.
[6] SPAETH S,TRAN Q,LIU Z.Evaluation of an ATP-Bioluminescence rapid microbial screening method for in-process biologics[J].PDA Journal of Pharmaceutical Science and Technology,2018,72(6):574-583.
[7] LIEBERS V,BACHMANN D,FRANKE G,et al.Determination of ATP-activity as a useful tool for monitoring microbial load in aqueous humidifier samples[J].International Journal of Hygiene and Environmental Health,2015,218:246-253.
[8] 魏树源,杨京生,陈晓琦,等.三磷酸腺苷生物发光快速微生物检测法在疫苗中间无菌试验中的应用[J].中国生物制品学杂志,2010,23(10):1 120-1 124.
WEI S Y,YANG J S,CHEN X Q,et al.Application of rapid determination of microorganisms by ATP bioluminescence assay to sterility test of intermediate product of vaccine[J].Chinese Journal of Biologicals,2010,23(10):1 120-1 124.
[9] 翟磊,葛媛媛,洪海军,等.ATP生物荧光增幅法在微生物检测中的可行性研究—应用于化妆品领域[J].食品与发酵工业,2020,46(21):201-206.
ZHAI L,GE Y Y,HONG H J,et al.Feasibility study on the amplified ATP bioluminescence assay in microbial detection-Application in cosmetics field[J].Food and Fermentation Industries,2020,46(21):201-206.
[10] 国家食品药品监督管理总局.《化妆品安全技术规范》(2015版)[S].2015.
National Medical Products Administration.“Safety and Technical Standards for Cosmetics”(2015)[S].2015.
[11] 翟磊,葛媛媛,崔生辉,等.ATP生物荧光增幅法在化妆品微生物检测中的验证研究[J].日用化学工业,2020,50(11):771-775;782.
ZHAI L,GE Y Y,CUI S H,et al.Validation study of amplified ATP bioluminescence assay for microbial detection in cosmetics[J].China Surfactant Detergent & Cosmetics,2020,50(11):771-775;782.
[12] 陈文胜, 谭慧嘉,罗建波,等.化妆品中金黄色葡萄球菌和铜绿假单胞菌检测能力验证实施研究[J].中国卫生检验杂志,2013,23(2):366-369.
CHEN W S,TAN H J,LUO J B,et al.Proficiency testing of Staphylococcus aureus and Pseudomonas aeruginosa detection in cosmetics[J].Chinese Journal of Health Laboratory Technology,2013,23(2):366-369.
[13] 国家药典委员会.中华人民共和国药典(第四卷)[S].北京:中国医学科学出版社,2020.
Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia(The fourth volume)[S].Beijing:China Medical Science,2020.
[14] 中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会.GB/T 18670—2017 化妆品分类[S].北京:中国标准出版社,2017.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration Committee.GB/T 18670—2017 Cosmetic classification[S].Beijing:China Standards Press,2017.
[15] 葛媛媛,张奇,冯慧军,等.《化妆品安全技术规范》耐热大肠菌群检验方法中目标菌的研究[J].日用化学品科学,2017,40(4):1-6.
GE Y Y,ZHANG Q,FENG H J,et al.Research on the target bacteria for thermotolerant coliform test method in “China safety and technical standards for cosmetice(2015)”[J].Detergent & Cosmetics,2017,40(4):1-6.
[16] 朱丽华.婴幼儿化妆品防腐体系有效性、稳定性及安全性评价[D].上海:上海交通大学,2010.
ZHU L H.The effectivity,stability and safety of baby cosmetics’ preservative system[D].Shanghai:Shanghai Jiao Tong University,2010.
[17] 方碧娟.化妆品用防腐剂的复配及其防腐效果评价[D].上海:上海应用技术大学,2016.
FANG B J.The praparation and efficacy of a mixture preservation in cosmetics[D].Shanghai:Shanghai Institute of Technology,2016.
[18] 谢小保,杨秀茳,孙廷丽,等.化妆品微生物检验影响因素的探讨[J].日用化学工业,2014,44(11):628-630;634.
WIE X B,YANG X J,SUN T L,et al.Study on affecting factors of microbiological inspection of cosmetics[J].China Surfactant Detergent & Cosmetics,2014,44(11):628-630;634.
[19] 高飞, 张庆生,崔生辉,等.卵磷脂和吐温80中和化妆品中防腐剂及影响细菌生长研究[J].环境与健康杂志,2012,29(11):1 023-1 025.
GAO F,ZHANG Q S,CUI S H,et al.Research on iecithin and tween 80 neutralizing preservatives in cosmetics and affecting bacteria growth[J].Journal of Environment and Health,2012,29(11):1 023-1 025.
[20] 郑萍,孙宗科,丁培,等.中和剂对化妆品中霉菌和酵母菌检测结果的影响[J].环境与健康杂志,2015,32(3):249-251.
ZHENG P,SUN Z K,DING P,et al.Effects of neutralizers on test results of molds and yeasts in cosmetics[J].Journal of Environment and Health,2015,32(3):249-251.