芹菜籽是芹菜的种子,《中华本草·维吾尔药卷》将芹菜籽列为维药的一种常用药材[1]。芹菜籽中含有丰富的功能性成分,如黄酮、挥发性成分、脂肪酸和氨基酸等[2-5],具有降血压、抗氧化、抗肿瘤和降血脂等多种药理功效[6-9]。近年来,芹菜籽开始作为一种保健产品在市场上兴起,前景广阔。
黄酮是植物体内产生的一类次生代谢产物,泛指通过中央三碳原子连接2个含酚羟基的苯环而形成的化合物。其基本结构母核为2-苯基色原酮,主要可分为黄酮类、黄酮醇类、二氢黄酮类等。芹菜苷、芹菜素、芦丁、木犀草素、槲皮素、柯伊利素等是芹菜籽中的代表性黄酮类成分[10-12]。研究表明,黄酮具有抗肿瘤[13]、抗氧化[14]、镇静[15]、降血压血脂[16]等作用。
目前,常见的黄酮检测方法有紫外分光光度法、薄层色谱法、高效液相色谱法及液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry, LC-MS/MS)等[17-18]。其中,紫外分光光度法一般测定样品中总黄酮含量,不能用于痕量分析;薄层色谱法准确度较低,难以区分相似化合物[19];高效液相色谱法存在对多种黄酮分离难度大,分析时间长,专属性差等不足[20];LC-MS/MS具有高灵敏度,强选择性,定量准确,黄酮成分分离及结构分析过程简单等优点[21]。因此,本文采用LC-MS/MS建立了同时测定芹菜籽中9种黄酮含量的方法,同时对前处理和检测条件进行优化,为芹菜籽中黄酮的研究提供技术支持。
1 材料与方法
1.1 材料与试剂
芹菜籽(实芹籽、冬芹籽、西芹籽),天津市购;芹菜苷、芦丁、黄芩苷、黄芩素、汉黄芩素、芹菜素、柯伊利素,中国食品药品检定研究院;木犀草素、槲皮素,中国药品生物制品检定所。
Al(NO3)3、NaNO2,均为分析纯,天津市凯通化学试剂有限公司;NaOH(分析纯),天津市华东试剂厂;甲醇(质谱纯)、乙腈(质谱纯),德国Merck公司;甲酸(色谱纯),CNW.EU公司;纯净水,广州屈臣氏食品饮料有限公司;AB-8、D3520、X-5、NKA-9型大孔树脂、无水乙醇(色谱纯),天津市光复精细化工研究所。
1.2 仪器与设备
1200 series液相色谱-6410三重四极杆串联质谱仪,美国Agilent公司;TU-1900紫外-可见分光光度计,北京普析通用仪器公司;KQ-5200E型超声清洗机,昆山市超声仪器有限公司;FW135中草药粉碎机,天津市泰斯特仪器有限公司;RE-52A旋转蒸发仪,广东昆山仪器有限公司。
1.3 实验方法
1.3.1 芹菜籽中黄酮提取
以实芹籽为原料对芹菜籽中黄酮提取、纯化方法进行优化。实芹籽除杂、粉碎,过40目筛,石油醚脱脂,40 ℃干燥至恒重,备用。单因素试验结合正交试验优化芹菜籽中总黄酮的提取工艺:称取脱脂后的芹菜籽粉1.0 g,超声提取,3 000 r/min离心10 min,过滤,取上清液NaNO2-Al(NO3)3-NaOH显色[22],紫外-可见分光光度计测吸光度,按公式(1)计算总黄酮提取率:
总黄酮提取率![]()
(1)
式中:C,样品中黄酮含量相当于标准芦丁浓度,mg/mL;V,提取液体积,mL;D,稀释倍数;m,样品质量,g。
1.3.2 粗黄酮纯化
按1.3.1优化后条件提取芹菜籽中黄酮,取过滤后上清液旋蒸,除去乙醇,冻干样品,得到黄酮粗品,配制1.0 mg/mL的黄酮水溶液,待用。按冯靖等[23]的方法,对4种型号大孔树脂(AB-8、D3520、X-5、NKA-9)进行预处理。称取大孔树脂3 g,加入30 mL 1.0 mg/mL的黄酮溶液,100 r/min下摇床振荡,使吸附平衡,取样测吸光度,按公式(2)计算吸附率。称取吸附平衡的大孔树脂3 g,加入30 mL 70%体积分数乙醇水溶液,100 r/min下摇床振荡,使解吸平衡,取样测吸光度,按公式(2)计算解吸率。
吸附率(解吸率)![]()
(2)
式中:ρ0,吸附或解吸前溶液黄酮质量浓度,mg/mL;ρt,吸附或解吸后溶液黄酮质量浓度,mg/mL。
1.3.3 LC-MS/MS检测
按1.3.1优化后条件提取、纯化芹菜籽中黄酮,取解吸平衡后溶液旋蒸、冻干,用甲醇溶解并定容至10 mL,过0.22 μm有机滤膜,液相色谱-串联质谱仪检测。
1.3.4 标准溶液的配制
分别用甲醇将芹菜苷、芦丁、黄芩苷、黄芩素、木犀草素、槲皮素、汉黄芩素、芹菜素、柯伊利素9种黄酮标准品溶解,定容得到1.0 mg/mL的标准储备液,再用甲醇将上述储备液稀释成不同质量浓度梯度的标准工作液。
1.3.5 液相色谱条件
色谱柱ZORBAX Eclipse XDB-C18(4.6 mm×150 mm,3.5 μm);柱温30 ℃;进样量10 μL;流动相V(乙腈)∶V(0.1%体积分数甲酸水溶液)=3∶7;流速0.4 mL/min。
1.3.6 质谱条件
电喷雾离子源,负离子扫描方式,多反应监测(multiple reaction monitoring,MRM)模式,离子源温度350 ℃,毛细管电压4.0 kV,N2流速10 L/min,雾化气压力40 psi。优化后的母离子、子离子、去簇电压以及碰撞电压具体参数见表1。
表1 九种黄酮的母离子、子离子、去簇电压与碰撞电压
Table 1 Precursor ions,product ions,uncluster voltage and collision energy of nine flavonoids
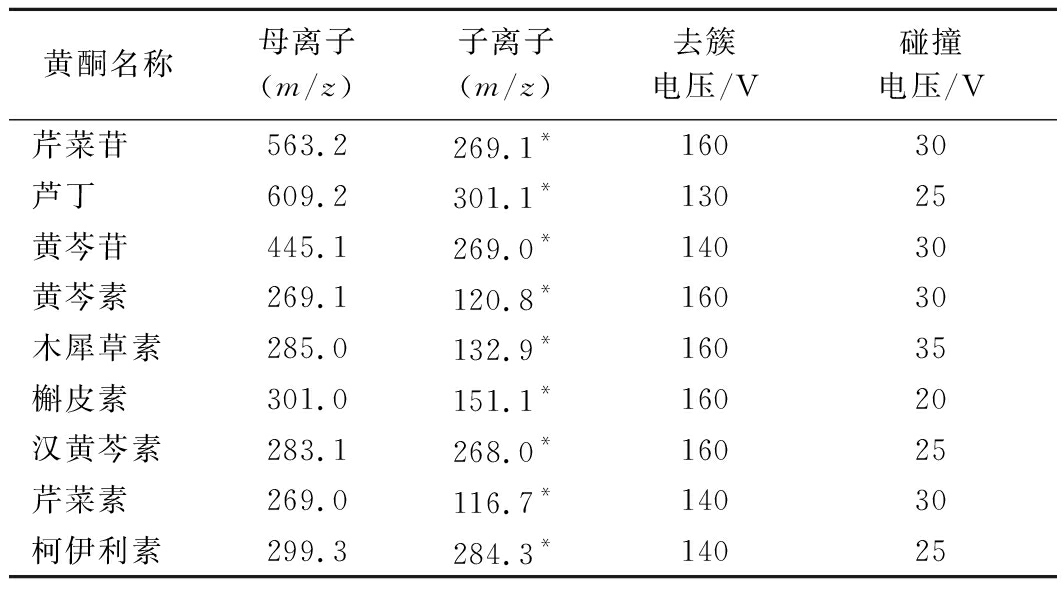
黄酮名称母离子(m/z)子离子(m/z)去簇电压/V碰撞电压/V芹菜苷563.2269.1*16030芦丁609.2301.1*13025黄芩苷445.1269.0*14030黄芩素269.1120.8*16030木犀草素285.0132.9*16035槲皮素301.0151.1*16020汉黄芩素283.1268.0*16025芹菜素269.0116.7*14030柯伊利素299.3284.3*14025
注:*表示定量离子
2 结果与分析
2.1 色谱柱的选择
实验比较了ZORBAX Eclipse XDB-C18 (4.6 mm×150 mm,3.5 μm)、ZORBAX Eclipse Plus C18(2.1 mm×100 mm,3.5 μm)和HyPMRITY C18 (4.6 mm×250 mm,5.0 μm) 3种色谱柱对9种黄酮的分离效果。结果表明,HyPMRITY C18柱和Eclipse Plus C18柱无法分离开9种黄酮,响应信号低;XDB-C18柱对9种黄酮出峰明显且能很好分离,响应值高,见图1。因此,实验选用ZORBAX Eclipse XDB-C18色谱柱。
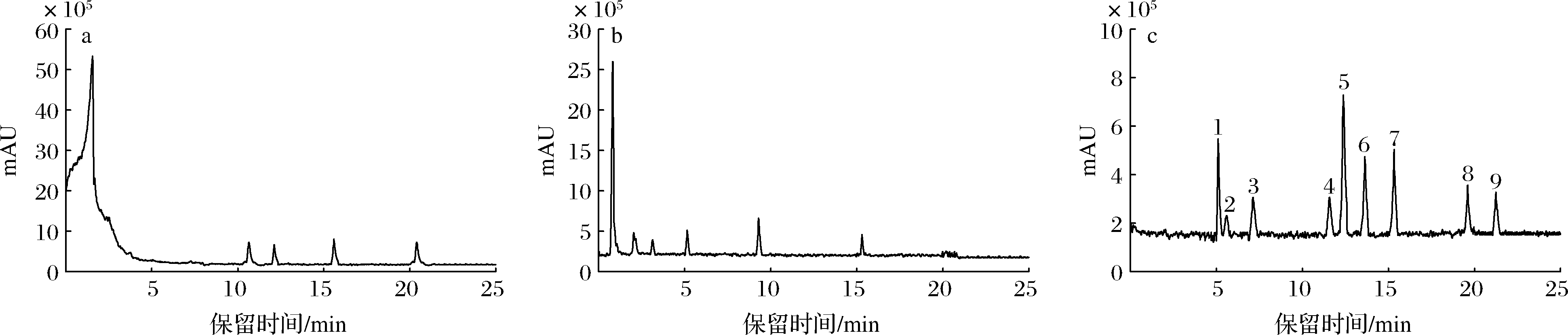
a-HyPΜRITY C18色谱柱;b-ZORBAX Eclipse Plus C18色谱柱;c-ZORBAX Eclipse XDB-C18色谱柱
图1 不同色谱柱对9种黄酮的分离效果
Fig.1 Separation effect of nine flavonoids by different chromatographic columns
注:1~9分别为芹菜苷、芦丁、黄芩苷、黄芩素、木犀草素、槲皮素、汉黄芩素、芹菜素、柯伊利素(下同)
2.2 流动相及其比例的优化
2.2.1 流动相的优化
考察甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水4种流动相对9种黄酮的分离效果,在前3种流动相条件下,9种黄酮分离效果不佳。因此选择乙腈-0.1%甲酸水溶液作为本方法的流动相,结果见图2。
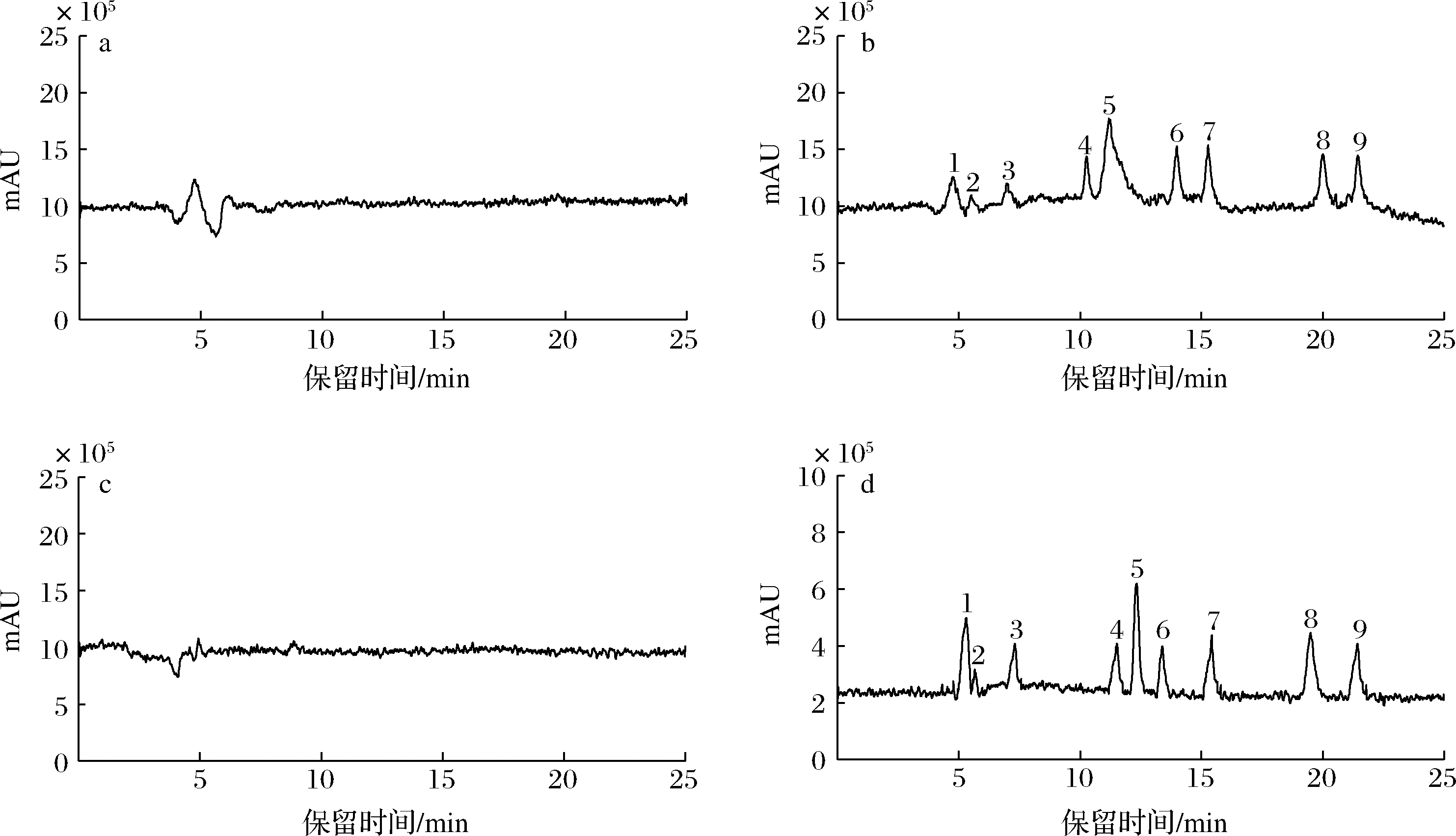
a-甲醇-水;b-乙腈-水;c-甲醇-0.1%甲酸水;d-乙腈-0.1%甲酸水
图2 不同流动相对9种黄酮的分离效果
Fig.2 Separation effect of nine flavonoids by different mobile phases
2.2.2 流动相比例的优化
比较不同体积比例(2∶8、3∶7、4∶6)流动相乙腈-0.1%甲酸水对9种黄酮分离效果的影响。当流动相比例为V∶V=3∶7时,9种黄酮分离较好而且响应值较高,如图3所示。
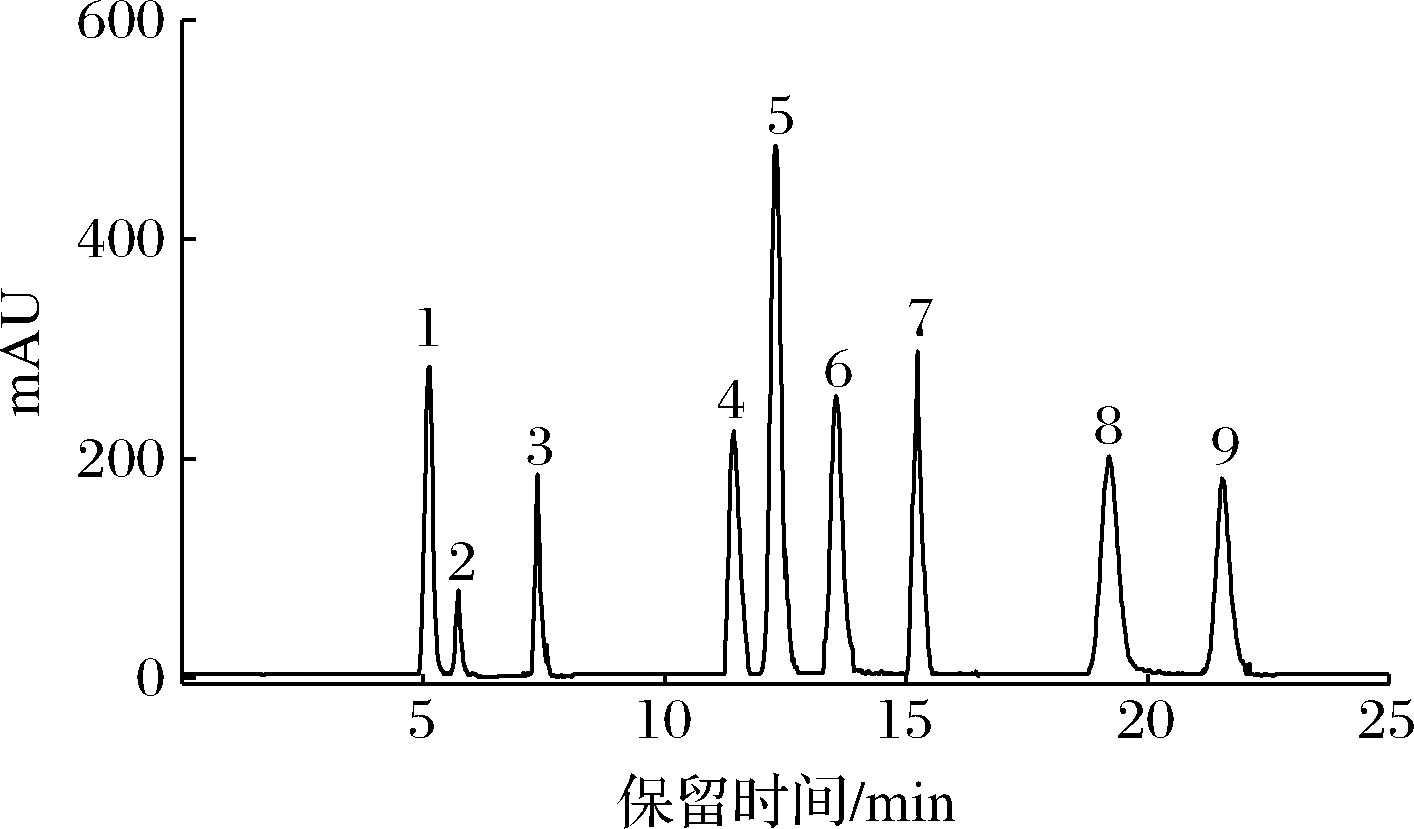
图3 乙腈-0.1%甲酸水体积比为3∶7对9种黄酮的分离效果
Fig.3 Separation effect of acetonitrile-0.1% formic acid water ratio 3∶7 on nine flavonoids
2.3 质谱条件优化
通过优化去簇电压和碰撞电压,得到芹菜苷、芦丁、黄芩苷、黄芩素、木犀草素、槲皮素、汉黄芩素、芹菜素、柯伊利素9种黄酮的二级质谱图,见图4。

a~i图分别为芹菜苷、芦丁、黄芩苷、黄芩素、木犀草素、槲皮素、汉黄芩素、芹菜素、柯伊利素
图4 九种黄酮结构式及二级质谱图
Fig.4 Structural formulas and secondary mass spectra of nine flavonoids
2.4 前处理过程优化
2.4.1 芦丁标准曲线的绘制
无水乙醇溶解芦丁标准品,NaNO2-Al(NO3)3-NaOH显色处理[22],紫外-可见分光光度计测吸光度,绘制芦丁标准曲线方程为y=21.157 1x+0.002 9(R2=0.999 5)。
2.4.2 提取工艺条件的优化
如表2所示,正交试验结果表明RB>RC>RA,料液比是影响芹菜籽中黄酮提取的最主要因素,其次是提取时间,最后是乙醇体积分数。根据K值分析,选择A2B3C3,即70%体积分数乙醇水溶液,料液比1∶20(g∶mL),提取时间60 min,作为超声辅助提取芹菜籽中黄酮的最佳工艺条件。通过3次重复性验证试验,得到芹菜籽中总黄酮平均提取率为3.78%,高于此前王文君等[24]的提取率1.67%,与徐斌等[25]的提取率13.54%存在差异,原因可能是芹菜籽品种和产地的不同,以及后者测定的是脱脂脱蛋白后芹菜籽中黄酮提取率。
表2 正交试验设计表及结果
Table 2 Orthogonal test design and results
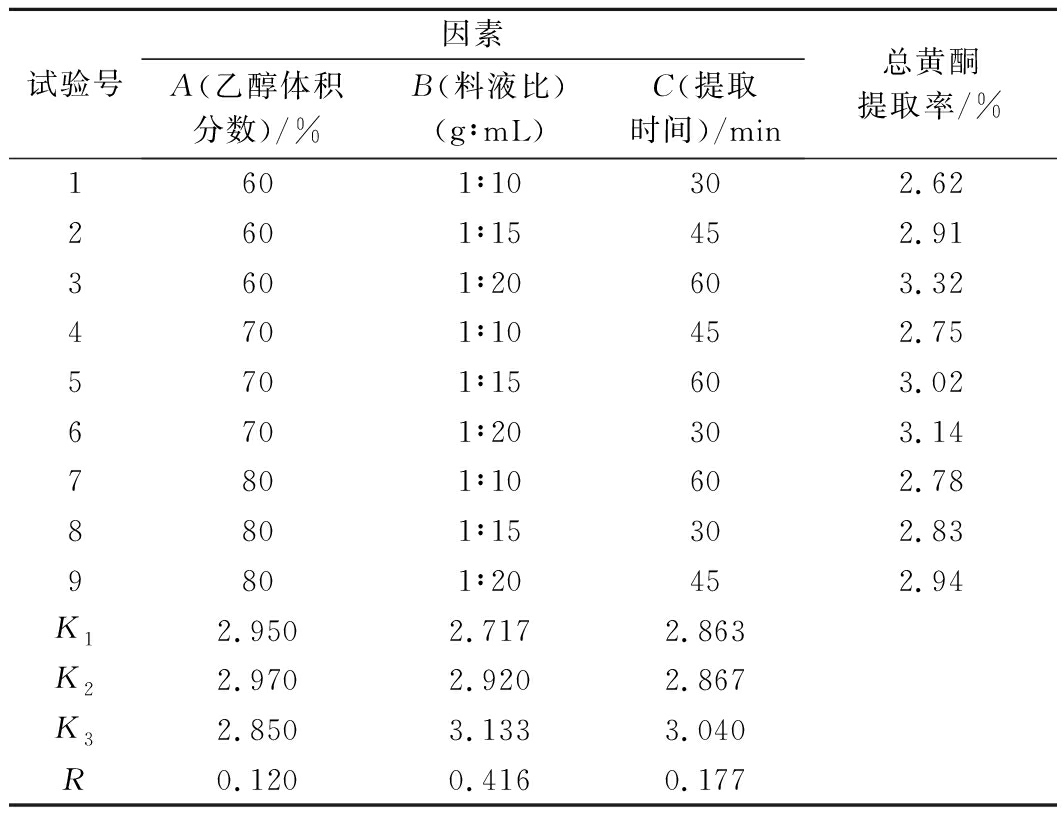
试验号因素A(乙醇体积分数)/%B(料液比)(g∶mL)C(提取时间)/min总黄酮提取率/%1601∶10302.622601∶15452.913601∶20603.324701∶10452.755701∶15603.026701∶20303.147801∶10602.788801∶15302.839801∶20452.94K12.9502.7172.863K22.9702.9202.867K32.8503.1333.040R0.1200.4160.177
2.4.3 大孔树脂选择
4种大孔树脂吸附和解吸平衡时的吸附率、解吸率见表3。
表3 四种大孔树脂的吸附与解吸效果比较
Table 3 Comparison of adsorption and desorptioneffects of four macroporous resins
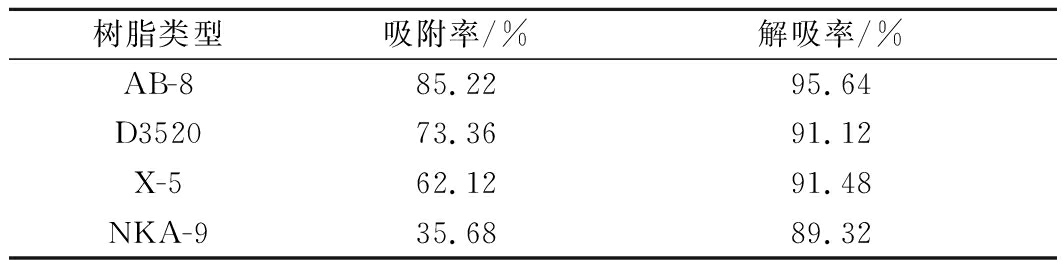
树脂类型吸附率/%解吸率/%AB-885.2295.64D352073.3691.12X-562.1291.48NKA-935.6889.32
由表3可知,AB-8大孔树脂的吸附率和解吸率均高于其他3种大孔树脂,故选择AB-8大孔树脂进行纯化。在林薇薇等[26]的方法上进行修改,上样液质量浓度1.0 mg/mL、pH 6.0、上样液流速2 BV/h、洗脱液乙醇体积分数70%、洗脱液流速2 BV/h,黄酮纯度由3.4%提高到25.2%。
2.5 线性范围、标准曲线和检出限
分别配制质量浓度0.5、1.0、2.0、5.0、10.0、20.0 μg/mL的9种黄酮标准混合液,采用LC-MS/MS检测。以质量浓度为横坐标,MRM模式下的峰面积作为纵坐标,绘制标准曲线,得到线性方程和线性相关系数R2。检出限按信噪比S/N=3计算[27],结果见表4。
表4 九种黄酮线性方程、线性范围、线性相关系数
Table 4 Linear equations,linear ranges,and linear correlation coefficients of nine flavonoids
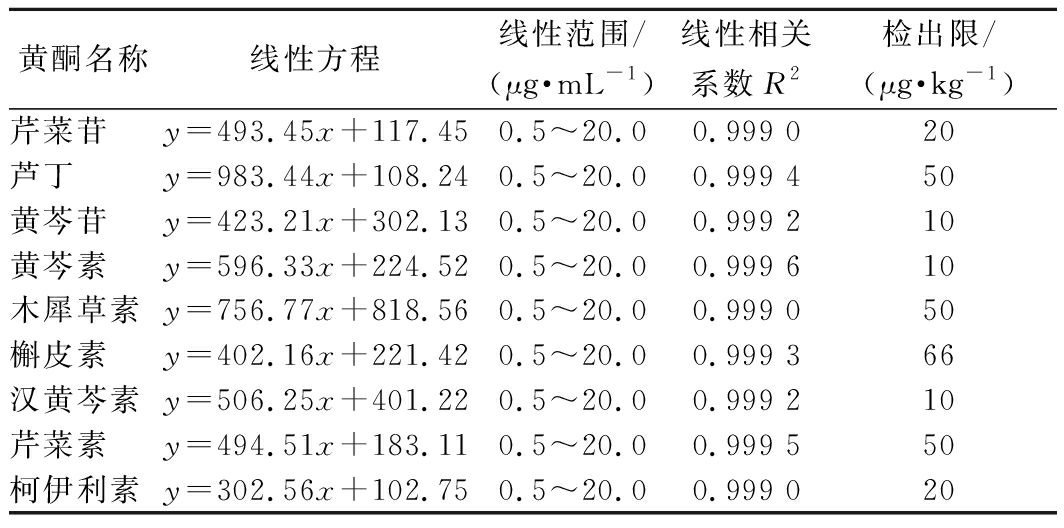
黄酮名称线性方程线性范围/(μg·mL-1)线性相关系数R2检出限/(μg·kg-1)芹菜苷y=493.45x+117.450.5~20.00.999 020芦丁y=983.44x+108.240.5~20.00.999 450黄芩苷y=423.21x+302.130.5~20.00.999 210黄芩素y=596.33x+224.520.5~20.00.999 610木犀草素y=756.77x+818.560.5~20.00.999 050槲皮素y=402.16x+221.420.5~20.00.999 366汉黄芩素y=506.25x+401.220.5~20.00.999 210芹菜素y=494.51x+183.110.5~20.00.999 550柯伊利素y=302.56x+102.750.5~20.00.999 020
由表4可知,9种黄酮在0.5~20.0 μg/mL的线性范围内线性关系良好,线性相关系数R2均>0.999 0。S/N=3时,检出限为10~66 μg/kg。
2.6 精密度、稳定性和加标回收率
取同一质量浓度的9种黄酮标准品混合溶液重复进样6次,记录峰面积,计算精密度相对标准偏差(relative standard deviation,RSD)。9种黄酮精密度RSD均<2%,仪器精密度较好。
取1.3.3条件下制备的同一黄酮样品溶液,LC-MS/MS检测,共进样6次,每次间隔4 h,计算峰面积RSD。9种黄酮的RSD为1.4%~4.0%,表明芹菜籽黄酮样品溶液在24 h内稳定性较强。
将9种黄酮混合标准溶液以低、中、高3个水平分别加入到1.0 g芹菜籽样品中,每个水平平行测定3次,计算平均回收率和RSD。结果见表5。
表5 九种黄酮加标回收率实验数据(n=3)
Table 5 The experimental data of the recovery rate of nine flavonoids (n=3)
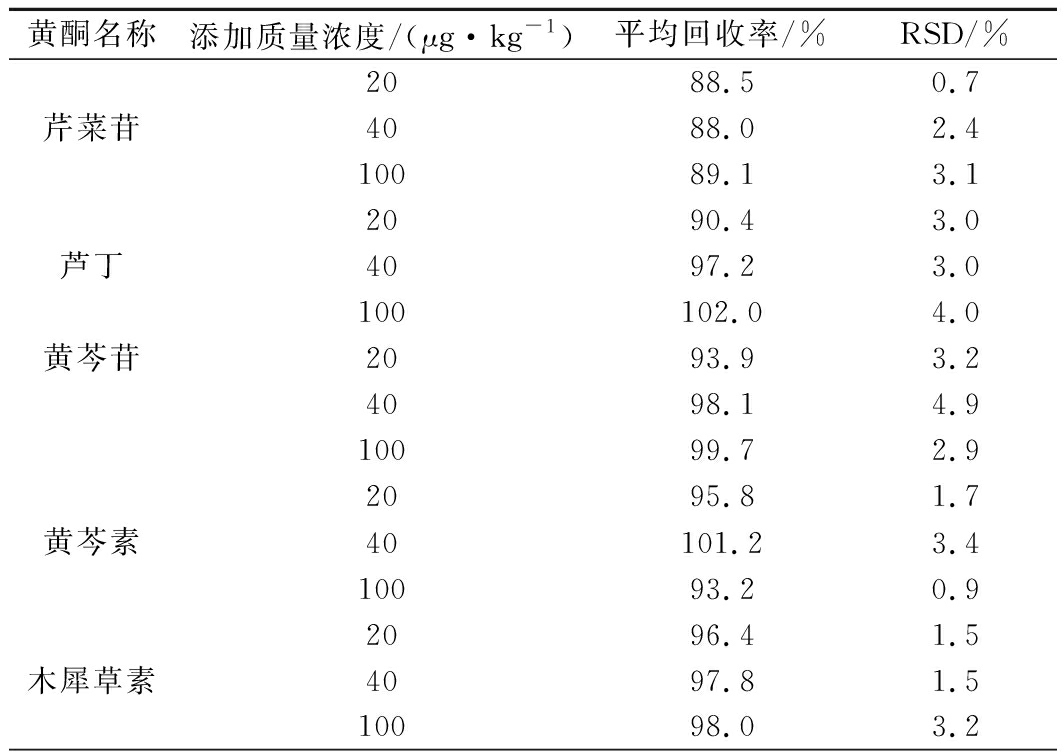
黄酮名称添加质量浓度/(μg·kg-1)平均回收率/%RSD/%2088.50.7芹菜苷4088.02.410089.13.12090.43.0芦丁4097.23.0100102.04.0黄芩苷2093.93.24098.14.910099.72.92095.81.7黄芩素40101.23.410093.20.92096.41.5木犀草素4097.81.510098.03.2
续表5
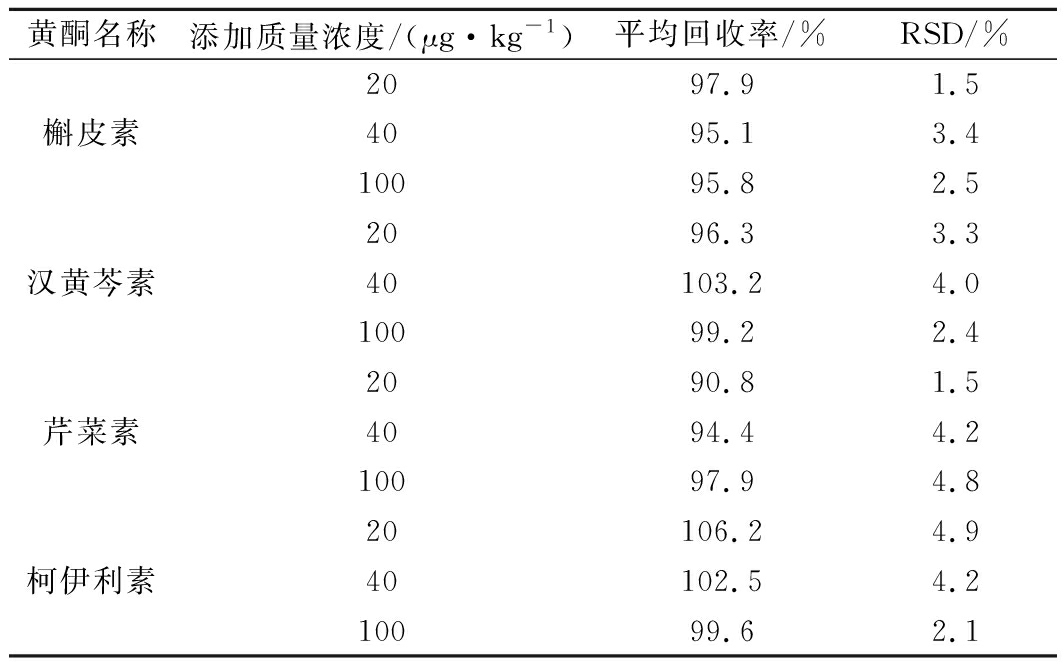
黄酮名称添加质量浓度/(μg·kg-1)平均回收率/%RSD/%2097.91.5槲皮素4095.13.410095.82.52096.33.3汉黄芩素40103.24.010099.22.42090.81.5芹菜素4094.44.210097.94.820106.24.9柯伊利素40102.54.210099.62.1
由表5可知,9种黄酮的加标回收率为88.0%~106.2%,RSD为0.7%~4.9%,满足方法学要求。
2.7 样品测定
按1.3.5和1.3.6中液相色谱、质谱条件对天津实芹籽样品进行检测,得到总离子流图和MRM图,见图5。

a-总离子流图;b-9种黄酮MRM图
图5 天津实芹籽样品色谱图
Fig.5 Chromatogram of Tianjin celery seed sample
利用试验建立的液相色谱串联质谱法对天津市售的实芹籽、冬芹籽、西芹籽3种芹菜籽中9种黄酮的含量进行测定,结果见表6。实芹籽、冬芹籽、西芹籽3种芹菜籽中9种黄酮含量差异较小,可能是由于来自同一产地天津,气温、海拔等生长环境条件相同。其中实芹籽中均含有9种黄酮,与文献[28-29]报道较为一致。冬芹籽中芹菜苷和黄芩苷未检出,西芹籽中柯伊利素未检出,这种差异可能是品种不同造成的。
表6 不同芹菜籽样品中9种黄酮含量 单位:mg/g
Table 6 Contents of nine flavonoids in different celery seed samples
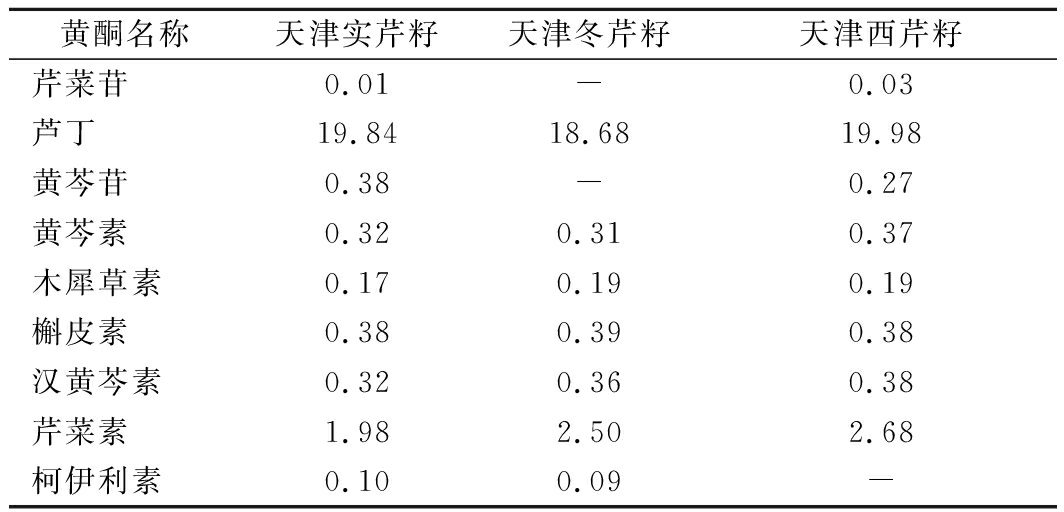
黄酮名称天津实芹籽天津冬芹籽天津西芹籽芹菜苷0.01-0.03芦丁19.8418.6819.98黄芩苷0.38-0.27黄芩素0.320.310.37木犀草素0.170.190.19槲皮素0.380.390.38汉黄芩素0.320.360.38芹菜素1.982.502.68柯伊利素0.100.09-
注:“-”表示未检出
3 结论
本文成功建立了一种同时测定芹菜籽样品中芹菜苷、芦丁、黄芩苷、黄芩素、木犀草素、槲皮素、汉黄芩素、芹菜素、柯伊利素9种黄酮含量的液相色谱串联质谱法,对芹菜籽中黄酮的提取、纯化、液相色谱以及质谱等条件进行了优化。该方法操作简便,纯化效果好,灵敏度、精密度高,重复性好,各项参数均能达到日常检测的技术要求,能够满足测定芹菜籽中9种黄酮含量的需要。
[1] 国家中医药管理局《中华本草》编委会.中华本草·维吾尔药卷[M].上海:上海科学技术出版社,2005.
Editorial Board of “Chinese Materia Medica” of the State Administration of Traditional Chinese Medicine.Chinese Materia Medica·Uyghur Medicine Volume [M].Shanghai:Shanghai Science and Technology Press,2005.
[2] 吕金良, 牟新利,王武宝,等.维药芹菜籽化学成分研究[J].时珍国医国药,2006,17(1):6-7.
LYU J L,MOU X L,WANG W B,et al.Studies on the chemical constituents of seeds of Apium graveolens L.[J].Lishizhen Medicine and Materia Medica Research,2006,17(1):6-7.
[3] LU Z G,LI W,WANG P J.Chemical composition and ability of scavenging DPPH radical of essential oil and residue from the celery seed[J].Advanced Materials Research,2011,1 154:18-21.
[4] 曾琼瑶,龚瑞莹,杨海玲,等.GC/MS结合保留指数分析湖南芹菜籽挥发油成分[J].中药新药与临床药理,2016,27(5):677-680.
ZENG Q Y,GONG R Y,YANG H L,et al.Analysis of essential oil from Hunan celery seeds by GC/MS combined with retention index[J].Traditional Chinese Drug Research & Clinical Pharmacology,2016,27(5):677-680.
[5] DESTAILLATS F,ANGERS P.Base-catalyzed derivatization methodology for FA analysis application to milk fat and celery seed lipid TAG[J].Lipids,2002,37(5):527-532.
[6] TASHAKORI-SABZEVAR F,RAZAVI B M,IMENSHAHIDI M,et al.Evaluation of mechanism for antihypertensive and vasorelaxant effects of hexanic and hydroalcoholic extracts of celery seed in normotensive and hypertensive rats[J].Revista Brasileira De Farmacognosia,2016,26(5):619-626.
[7] KIM M A,HAN C H,LEE J C,et al.Antioxidant properties and oxidative stability of celery seeds ethanol extract using in vitro assays and oil-in-water emulsion[J].Korean Journal of Food Science & Technology,2017,49(5):480-485.
[8] GAO A M,ZHANG X Y,HU J N,et al.Apigenin sensitizes hepatocellular carcinoma cells to doxorubic through regulating miR-520b/ATG7axis[J].Chemico-Biological Interactions,2018,280:45-50.
[9] SI Y H,GUO S D,FANG Y Q,et al.Celery seed extract blocks peroxide injury in macrophages via Notch1/NF-κB pathway[J].The American Journal of Chinese Medicine,2015,43(3):443-455.
[10] 王克勤. 芹菜黄酮类物质的分离纯化与药理功能研究[D].长沙:湖南农业大学,2009.
WANG K Q.Studies on separation,purification and pharmacological functions of flavonoids from celery (Apium.graveolens L.)[D].Changsha:Hunan Agricultural University,2009.
[11] 姜笑寒, 孟青,刘莉兰,等.芹菜籽中黄酮成分的提取纯化及LC-MS检测[J].中国卫生产业,2013,10(22):8-9.
JIANG X H,MENG Q,LIU L L,et al.The extraction and purification and composition of celery seed medium yellow ketone of LC-MS detection[J].China Health Industry,2013,10(22):8-9.
[12] 吕金良, 热比古丽·斯拉木,阿吉艾克拜尔·艾萨,等.芹菜籽黄酮类化学成分研究[J].中成药,2007,29(3):406-408.
LV J L,RABIGUL I,HAJI AKBER A,et al.Flavonoids from celery seed[J].Chinese Traditional Patent Medicine,2007,29(3):406-408.
[13] MOMIN R A,NAIR M G.Antioxidant,cyclooxygenase and topoisomerase inhibitory compounds from Apium graveolens Linn.seeds[J].Phytomedicine,2002,9(4):312-318.
[14] 赵珺, 王丽,李磊,等.芹菜素对自由基致DNA损伤的保护作用及机制[J].食品科学,2011,32(13):1-4.
ZHAO J,WANG L,LI L,et al.Protective effect and mechanisms of apigenin against free radical-induced DNA damage[J].Food Science,2011,32(13):1-4.
[15] JAKOVLJEVIC V,RASKOVIC A,POPOVIC M,et al.The effect of celery and parsley juices on pharmacodynamic activity of drugs involving cytochrome P450 in their metabolism[J].European Journal of Drug Metabolism and Pharmacokinetics,2002,27(3):153-156.
[16] 严建刚, 张名位,杨公明,等.芹菜提取物的降血脂与抗氧化作用的研究[J].中国食品学报,2005,5(3):1-4.
YAN J G,ZHANG M W,YANG G M,et al.Study on the hypolipidemic effect and antioxidative activity of celery extracts[J].Journal of Chinese Institute of Food Science and Technology,2005,5(3):1-4.
[17] 陈春. 沙棘黄酮检测方法概述[J].山西林业科技,2018,47(3):14-17.
CHEN C.Detection methods of flavonoids in Hippophae rhamnoides Linn[J].Shanxi Forestry Science and Technology,2018,47(3):14-17.
[18] 宿书芳, 薛霞,公丕学,等.超高效液相色谱-串联质谱法检测蜂蜜中的内源性酚酸和黄酮类物质[J].现代食品科技,2018,34(8):260-266.
SU S F,XUE X,GONG P X,et al.Determination of endogenous phenolic acids and flavonoids in honey by UPLC/MS/MS[J].Modern Food Science and Technology,2018,34(8):260-266.
[19] 王君玲,贾淑梅.薄层色谱法及其在药物、色素分离等方面的应用[J].锦州师范学院学报(自然科学版),2003,24(1):14-16.
WANG J L,JIA S M.Thin-layer chromatography and its application on the separation of medichine and natural pigment[J].Journal of Jinzhou Teachers College (Natural Sciences,Edition),2003,24(1):14-16.
[20] 侯建波, 谢文,钱艳,等.固相萃取-液相色谱-串联质谱法同时测定蜂蜜中16种黄酮类化合物和阿魏酸[J].色谱,2020,38(5):529-537.
HOU J B,XIE W,QIAN Y,et al.Simultaneous determination of 16 flavonoids and ferulic acid in honey by solid phase extraction and high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2020,38(5):529-537.
[21] 林志燕, 杨荣富,唐跃年.8种黄酮类成分的LC-MS/MS分析[J].中国药师,2014,17(8):1 292-1 297.
LIN Z Y,YANG R F,TANG Y N.LC-MS/MS analysis of eight kinds of flavonoids[J].China Pharmacist,2014,17(8):1 292-1 297.
[22] 吴婕, 吴学慧,徐高.大孔树脂纯化甜茶叶总黄酮及其纯化前后的抗氧化性[J].江苏农业科学,2019,47(16):190-193.
WU J,WU X H,XU G.Purification of total flavonoids from sweet tea by macroporous resin and its antioxidant activity before and after purification[J].Jiangsu Agricultural Sciences,2019,47(16):190-193.
[23] 冯靖, 彭效明,李翠清,等.大孔树脂纯化银杏叶中总黄酮的工艺研究[J].应用化工,2019,48(10):2 339-2 343;2 349.
FENG J,PENG X M,LI C Q,et al.Purification of total flavonoids from Ginkgo leaves by macroporous resin[J].Applied Chemical Industry,2019,48(10):2 339-2 343;2 349.
[24] 王文君,孙志勇,向灿辉,等.芹菜籽中总黄酮提取工艺条件的研究[J].井冈山大学学报(自然科学版),2010,31(3):61-64.
WANG W J,SUN Z Y,XIANG C H,et al.Research on the extraction conditions of total flavonoids from celery seed[J].Journal of Jinggangshan University (Natural Science),2010,31(3):61-64.
[25] 徐斌, 马洪波,张岚,等.芹菜籽中黄酮的提取工艺[J].食品研究与开发,2015,36(9):60-64.
XU B,MA H B,ZHANG L,et al.The extraction process of flavonoids in celery seed[J].Food Research and Development,2015,36(9):60-64.
[26] 林薇薇, 程明,莫丽红,等.大孔树脂纯化芹菜籽黄酮的工艺[J].海南热带海洋学院学报,2019,26(5):104-110.
LIN W W,CHENG M,MO L H,et al.Purification of flavonoids from celery seeds by macroporous resin[J].Journal of Hainan Tropical Ocean University,2019,26(5):104-110.
[27] 师仁丽, 翟龙飞,于文龙,等.利用DAD-HPLC和LC-MS法检测金丝小枣中黄酮类化合物[J].食品科学,2016,37(16):123-127.
SHI R L,ZHAI L F,YU W L,et al.Determination of flavonoid in Ziziphus jujuba mill.cv.jinsixiaozao fruits by DAD-HPLC and LC-MS[J].Food Science,2016,37(16):123-127.
[28] 尹进朝, 李进,高永良.HPLC测定芹菜籽提取物中木犀草素含量[J].中国现代应用药学,2011,28(6):556-558.
YIN J C,LI J,GAO Y L.Determination of luteolin in celery seed extract by HPLC[J].Chinese Journal of Modern Applied Pharmacy,2011,28(6):556-558.
[29] 黄进丽, 魏鲜娥,苏昭仑,等.高效液相色谱法同时测定芹菜籽提取物中芹菜苷和3-甲氧基芹菜苷的含量[J].食品安全质量检测学报,2020,11(1):253-257.
HUANG J L,WEI X E,SU Z L,et al.Simultaneously determination of apigenin and 3-methoxy apigenin in celery seed extract by high performance liquid chromatography[J].Journal of Food Safety and Quality Testing,2020,11(1):253-257.