红茶是典型的全发酵茶,茶汤醇厚、色泽红艳、香气馥郁,受到消费者广泛喜爱[1]。红茶中的茶黄素(theaflavins,TFs)是影响红茶品质的关键成分,而且在医药、保健、食品、美容等领域有着广泛的应用前景[2]。在红茶发酵的过程中,主要通过细胞的多酚氧化酶(polyphenol oxidase,PPO)将儿茶素酶促氧化生成TFs[3],但TFs生成量极低且随季节变化波动较大,因此较难直接从红茶中规模化获取。大量研究表明,酶促合成法是工业化生产TFs的一条重要途径,其既能提高产物产量,又能解决季节性限制的问题[4]。酶促合成法是指利用外源(植物源和微生物源)PPO将儿茶素类物质氧化合成TFs[5]。近年,研究多利用PPO粗酶液酶促合成TFs,但粗酶液纯度较低,存在大量杂质和干扰成分会影响TFs的生成[6]。
课题组前期试验发现,多种植物的PPO粗酶液均能酶促合成TFs,但合成能力存在差异。经过初步筛选,试验选择使用分布广泛、价格适宜、PPO含量较高、酶促合成能力较强的马铃薯作为试验材料,分离纯化得到马铃薯PPO纯酶,并分析其酶学性质和酶促合成TFs能力,期望为工业化制备TFs提供指导。
1 材料与方法
1.1 试验试剂
马铃薯,新鲜市售;茶黄素(theaflavin,TF)、茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF-3-G)、茶黄素-3’-没食子酸酯(theaflavin-3’-gallate,TF-3’-G)、茶黄素-3,3′-双没食子酸酯(theaflavine-3,3′-digallate,TFDG),成都德思特生物技术有限公司;SDS-PAGE凝胶快速配制试剂盒,Solarbio科技有限公司;DEAE-Sepharose Fast Flow、茶多酚,上海源叶生物科技有限公司,经本实验室检测其主要成分见表1。
表1 茶多酚的主要成分含量 单位:mg/L
Table 1 Main components of tea polyphenols
表儿茶素没食子酸酯表没食子儿茶素没食子酸酯表没食子儿茶素儿茶素总含量0.175 5±0.001 40.537 6±0.007 10.241 2±0.017 30.085 9±0.001 81.040 3±0.021 2
1.2 仪器与设备
HD-4L电脑核酸蛋白检测仪,上海沪西分析仪器厂有限公司;垂直板电泳槽、电泳仪,美国Bio-Rad生命医学产品(上海)有限公司;Agilent 1260高效液相色谱仪、EC-C18色谱柱(4.6 mm×150 mm,2.7 μm),美国Agilent科技有限公司。
2 试验方法
2.1 PPO的分离纯化
2.1.1 粗酶液浸提
参考许雷[7]的方法并稍作修改。将25 g马铃薯和50 mL预冷的磷酸缓冲液匀浆后隔夜浸提12 h,并将浸提液于4 ℃、9 000 r/min条件下离心30 min,收集上清液,即得粗酶液。
2.1.2 硫酸铵沉淀和透析
参照滕杰[8]的方法并稍作修改。向粗酶液中缓慢加入等体积的硫酸铵饱和溶液,搅拌均匀后静置6 h。将混合液置于4 ℃、9 000 r/min条件下离心30 min,取不同饱和度的硫酸铵沉淀复溶后再离心10 min。通过比较上清液的比活力,选出硫酸铵沉淀的最适饱和度,取比活力最高的目标酶液透析18 h备用。
2.1.3 阴离子交换层析
参照滕杰[8]的方法并稍作修改。将透析后的酶液于DEAE-Sepharose Fast Flow阴离子交换层析柱上样,待样品被离子交换剂吸附后,依次用0.1、0.2、0.3、0.4、0.5 mol/L的NaCl缓冲液进行洗脱,每管收集5 mL,流速设定为0.5 mL/min,每个梯度洗脱6个柱体积,利用核酸蛋白检测仪观察280 nm波长处的紫外吸光值,同时收集并比较各蛋白洗脱峰的比活力,最后收集目标酶液透析、浓缩、冷冻干燥备用。
2.1.4 SDS-PAGE凝胶电泳
根据凝胶试剂盒使用说明对目标酶液进行SDS-PAGE垂直板电泳纯度鉴定,浓缩胶和分离胶的质量分数分别为5%和12%,上样量为15 μL,样品在浓缩胶和分离胶中迁移时的电压分别为100和120 V。经考马斯亮蓝快速染色液染色并摇床脱色后,判断目标酶液是否为单一蛋白条带,并计算其相对分子质量。
2.2 PPO的酶学性质分析
2.1.2 最适pH分析
将酶液和不同pH(3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)的缓冲液等体积混合组成反应体系,30 ℃水浴锅内保温30 min,测其酶活力,并以最高酶活力为100%,计算其余相对酶活力,由此确定最适pH。
2.2.2 最适温度分析
在最适pH下,将酶反应体系分别放置在20、30、40、50、60、70、80、90 ℃水浴锅内保温30 min,测其酶活力,并以最高酶活力为100%计算其余相对酶活力,由此确定最适温度。
2.2.3 金属离子对酶活性影响
在最适pH和温度下,向已除去内源金属离子的酶液中等体积加入含有以下种类、浓度金属离子的缓冲液,即0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08 mol/L的Na+(NaCl)、K+(KCl)、Ca2+(CaCl2)、Al3+(AlCl3)、Mg2+(MgCl2)、Zn2+(ZnCl2)、Mn2+(MnCl2)、Cu2+(CuCl2)、Fe2+(FeCl2)、Fe3+(FeCl3)。分别测定其酶活力,以未添加金属离子的酶活力为100%,计算其余相对酶活力,由此比较各金属离子对PPO酶活性影响。
2.3 PPO酶促合成TFs
参照黄莹捷等[4]的方法并稍作修改。将90 μL PPO粗酶液、纯酶液分别与840 μL 5 mg/mL的儿茶素反应液组成反应体系,置于30 ℃的摇床内剧烈反应1.5 h。待酶促合成结束后,立即用微波高火终止反应,离心收集上清液并过0.45 μm微孔滤膜备用。
2.4 PPO比活力测定
参考李远华[9]的方法并稍作修改。将1.5 mL磷酸缓冲液和0.5 mL酶液混合均匀,30 ℃水浴保温5 min,加入1.0 mL邻苯二酚迅速反应,记录每分钟420 nm波长处吸光值的变化情况。酶活力定义:每分钟吸光值变化0.001为1个酶活单位(U)。
利用考马斯亮蓝染色法[10]测定PPO酶液的蛋白质含量。
1 min内,1 mg蛋白质吸光值变化0.001定义为1个比活力单位,其常用酶活力和蛋白质含量的比值表示[11]。
2.5 TFs含量的测定
参考潘海波[12]的超高效液相色谱法并稍作修改。色谱条件:流动相A为0.1%的甲酸溶液,流动相B为乙腈,流速0.4 mL/min,柱温35 ℃,检测波长280 nm,进样量15 μL。梯度洗脱程序:0~30 min,流动相A 90%→60%,流动相B 10%→40%;30~40 min,流动相A 60%→90%,流动相B 40%→10%。
2.6 TFs的转化率
PPO酶促合成TFs的能力可以用TFs的转化率[4]表示,根据公式(1)计算TFs的转化率:
TFs转化率![]()
(1)
3 结果与讨论
3.1 PPO分离纯化结果分析
3.1.1 硫酸铵沉淀结果分析
根据蛋白质分子颗粒大小和亲水程度的不同,通过增大硫酸铵盐溶液浓度,可使高浓度的盐离子与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,最终使得目标蛋白析出[13]。当加入饱和度为20%的硫酸铵溶液时,蛋白质和酶活力均较低,开始有少量目标蛋白析出。当硫酸铵溶液饱和度增大至60%时,蛋白质和酶活力也随之增大,有部分目标蛋白和大量杂蛋白析出。当加入饱和度70%~90%的硫酸铵溶液时,蛋白质含量减小,酶活力增至最高,开始有大量目标蛋白析出。故本试验采用最适宜的80%饱和度硫酸铵溶液回收酶活力高、杂蛋白少的目标蛋白,具体结果见图1。
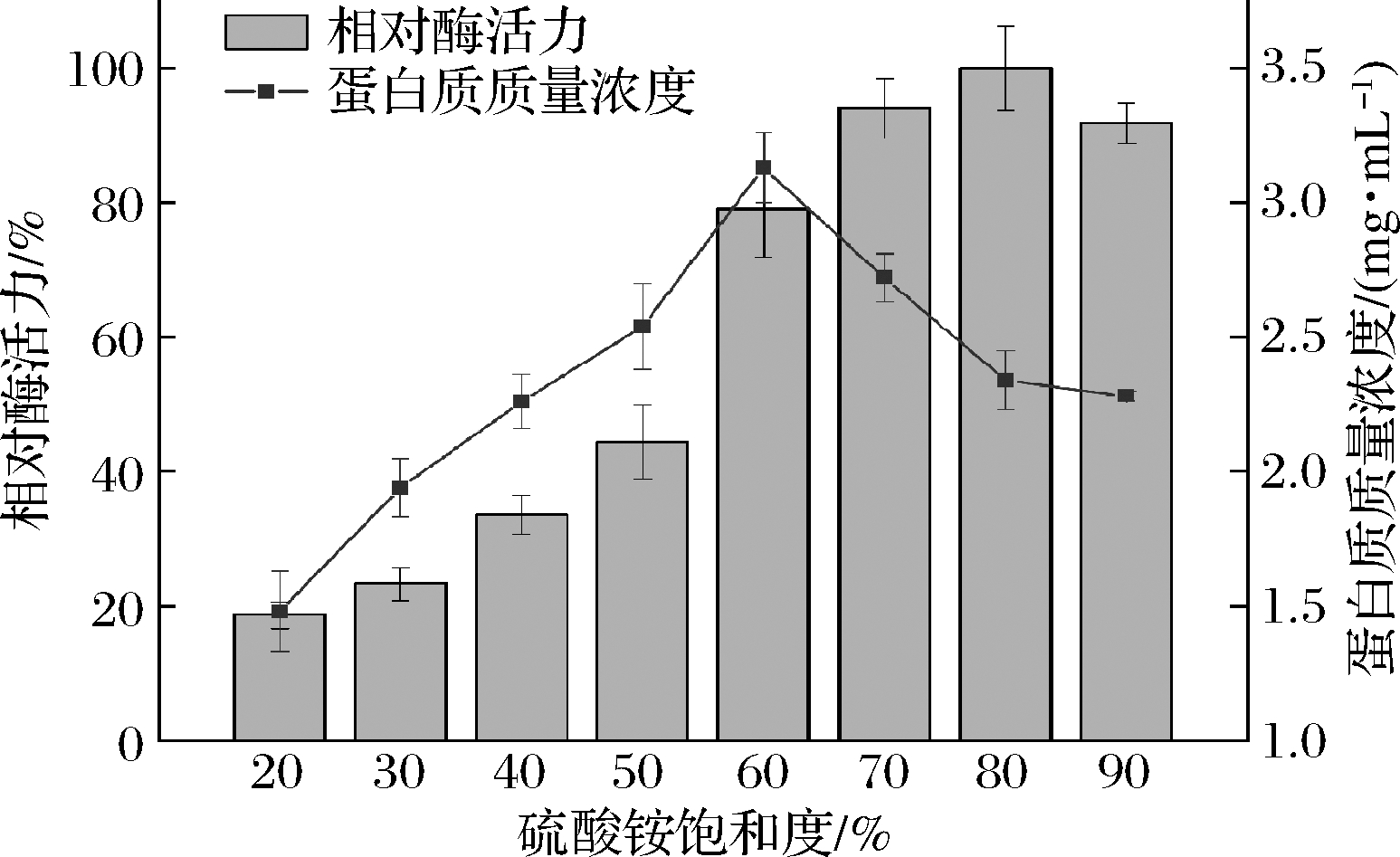
图1 饱和硫酸铵沉淀目标蛋白
Fig.1 Target protein precipitated by saturated ammonium sulfate solution
3.1.2 阴离子交换层析结果分析
利用不同浓度的NaCl缓冲液对透析后的目标酶液进行梯度洗脱,一共得到5个洗脱峰,根据洗脱管的先后依次编号Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ。其中,Ⅰ号峰具有较高的酶活力、蛋白质含量和吸光度值,其可能是未被吸附的穿透峰[14]。Ⅱ号峰的酶活力和蛋白质含量偏低,可能是洗脱液浓度偏低,未能洗脱出大量目标蛋白。Ⅲ、Ⅳ号峰的酶活力>20 U,故能洗脱出少量目标蛋白。而Ⅴ号洗脱峰具有最高比活力和酶活力,可能含有大量目标蛋白,具体结果见图2。
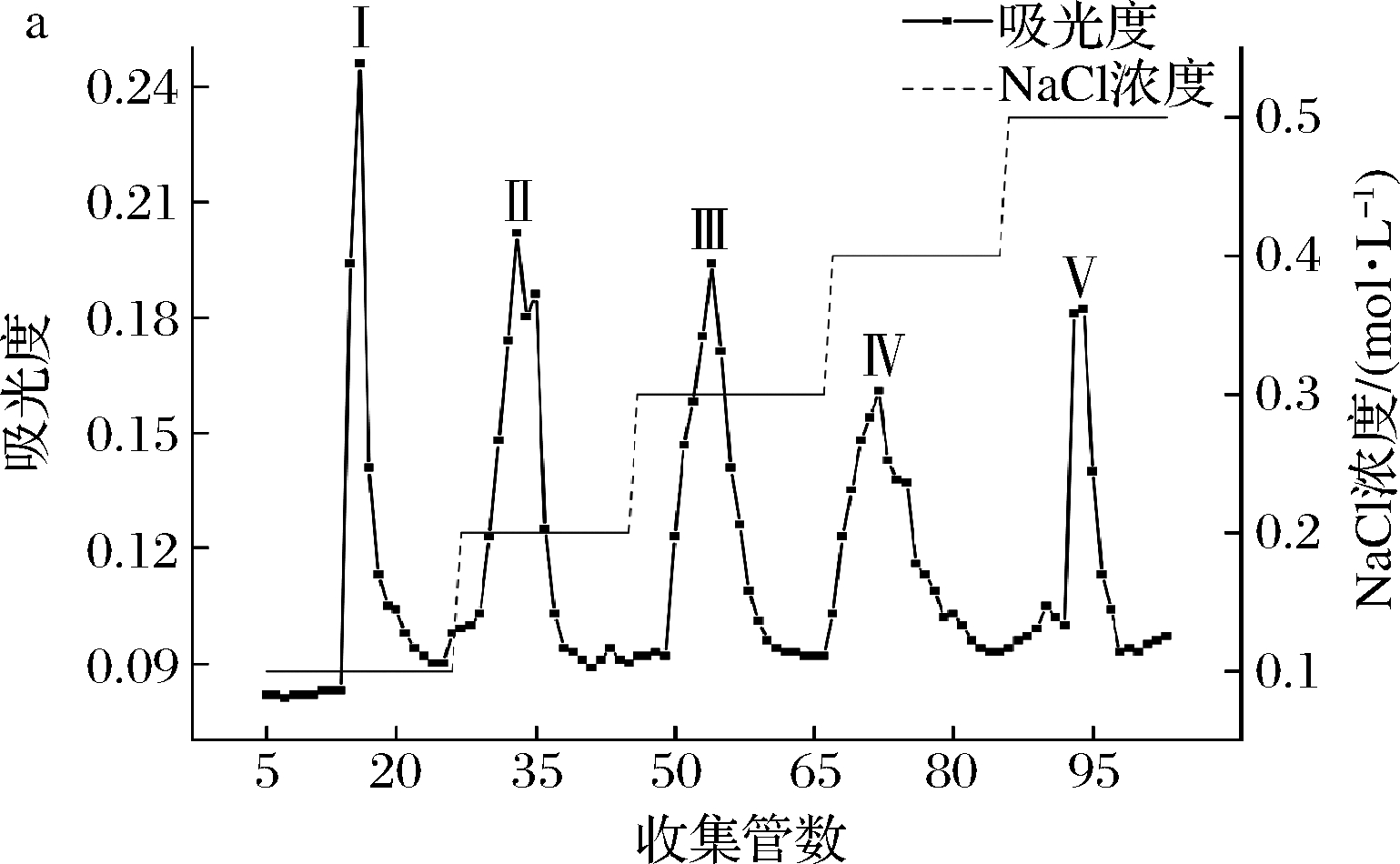

a-阴离子交换层析洗脱曲线;b-各洗脱峰的比活力、酶活力、蛋白质含量
图2 阴离子交换层析结果
Fig.2 Results of anion exchange chromatography
马铃薯PPO经过分离纯化处理后,其比活力不断增大,蛋白质含量和酶活力不断下降,说明在纯化过程中目标蛋白得以浓缩纯化但酶活力存在自然损耗。最终,PPO纯酶的比活力为21.79 U/mg、回收率为17.15%、纯化倍数为14.43,具体结果见表2。
表2 分离纯化的结果
Table 2 Result of separation and purification
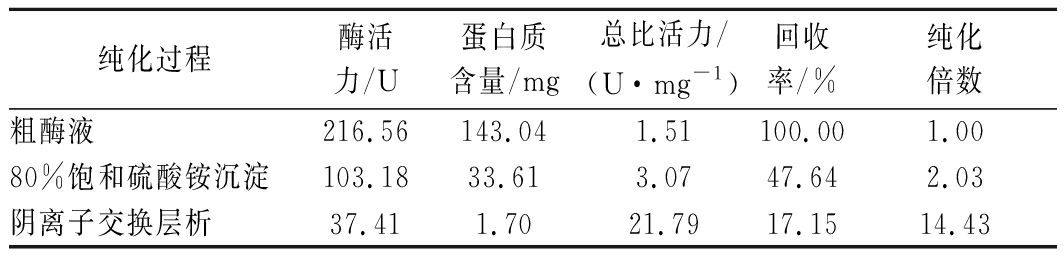
纯化过程酶活力/U蛋白质含量/mg总比活力/(U·mg-1)回收率/%纯化倍数粗酶液216.56143.041.51100.001.0080%饱和硫酸铵沉淀103.1833.613.0747.642.03阴离子交换层析37.411.7021.7917.1514.43
3.1.3 目标蛋白电泳纯度鉴定
收集Ⅴ号峰的目标蛋白进行电泳纯度鉴定。结果显示(图3),目标蛋白呈现单一电泳条带,表明本实验获得的目标蛋白达到电泳纯度,根据标准蛋白的相对迁移率,测得其分子质量约为42 kDa。贺立红等[15]研究指出,不同植物PPO的分子质量存在差异,但其大多分子质量为40 k~70 kDa,与本实验研究结果基本一致。

图3 PPO的SDS-PAGE
Fig.3 SDS-PAGE of PPO
3.2 PPO酶学性质分析
3.2.1 最适pH分析
PPO最适pH为6.0,在弱酸性条件下(pH 6.0~7.0),PPO能保持90%以上的相对酶活力;在酸性或碱性条件下(pH<4.0或pH>10.0),PPO相对酶活力将降至30%以下,具体结果见图4。研究结果与李俊等[16]研究结果一致,马铃薯PPO在弱酸性条件下稳定性较好,但在酸性、碱性环境中酶活力较低,这是因为反应体系的酸碱度将影响酶蛋白的活性中心,并改变其解离状态。
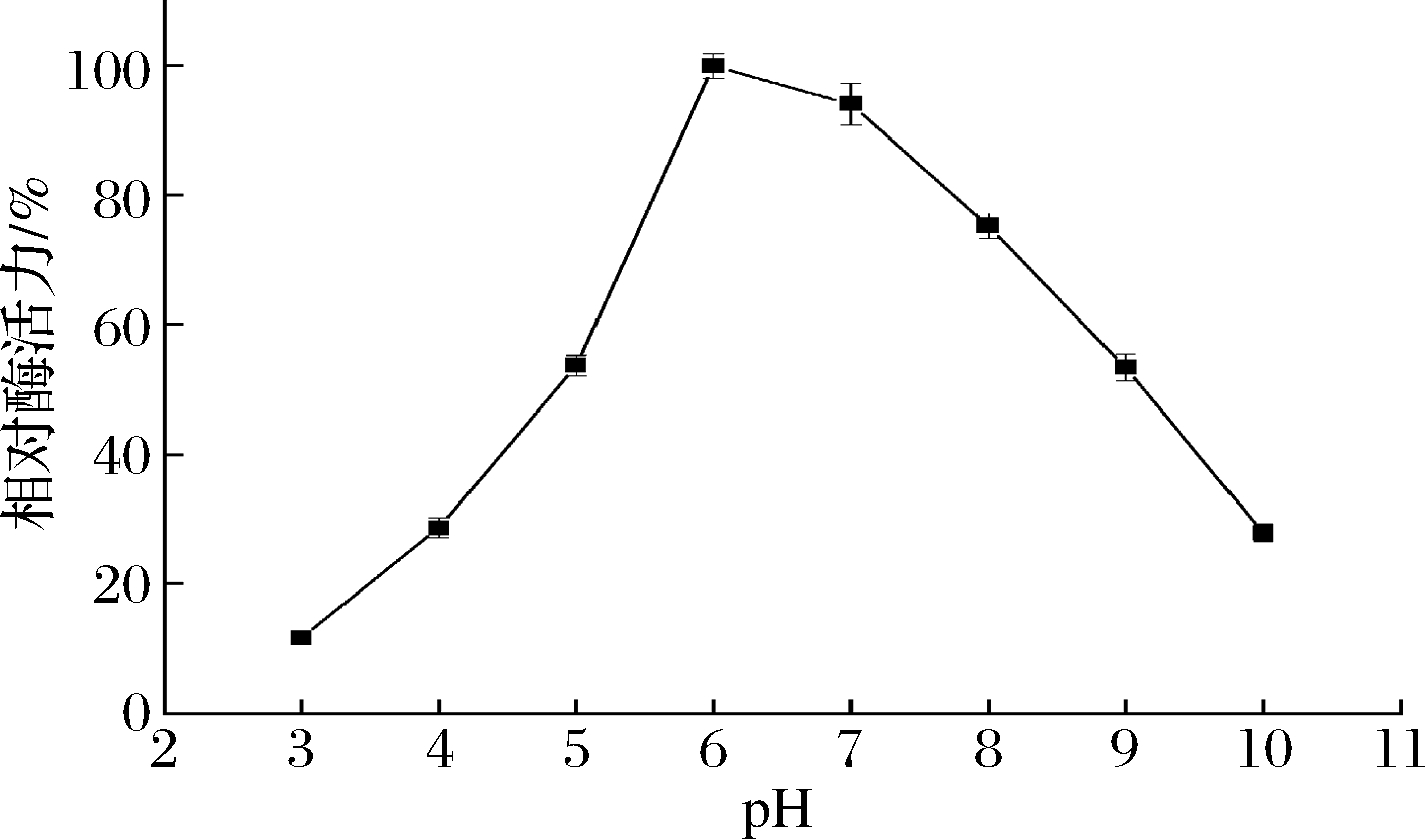
图4 PPO的最适pH
Fig.4 Optimum pH of PPO
3.2.2 最适温度分析
张帅等[17]研究表明,温度对PPO酶活力有较大影响,具体可分为2个阶段:前一阶段,随温度升高,酶促反应速率升高;后一阶段,温度进一步升高,酶发生不可逆热变性,酶促反应速率下降。本研究中观察到类似现象,反应体系从低温升至30 ℃时,PPO酶活力随之升高;温度继续升高时,其酶活力不断下降,温度升至90 ℃时,相对酶活力仅剩20%。因此本实验中,PPO最适温度为30 ℃(图5)。
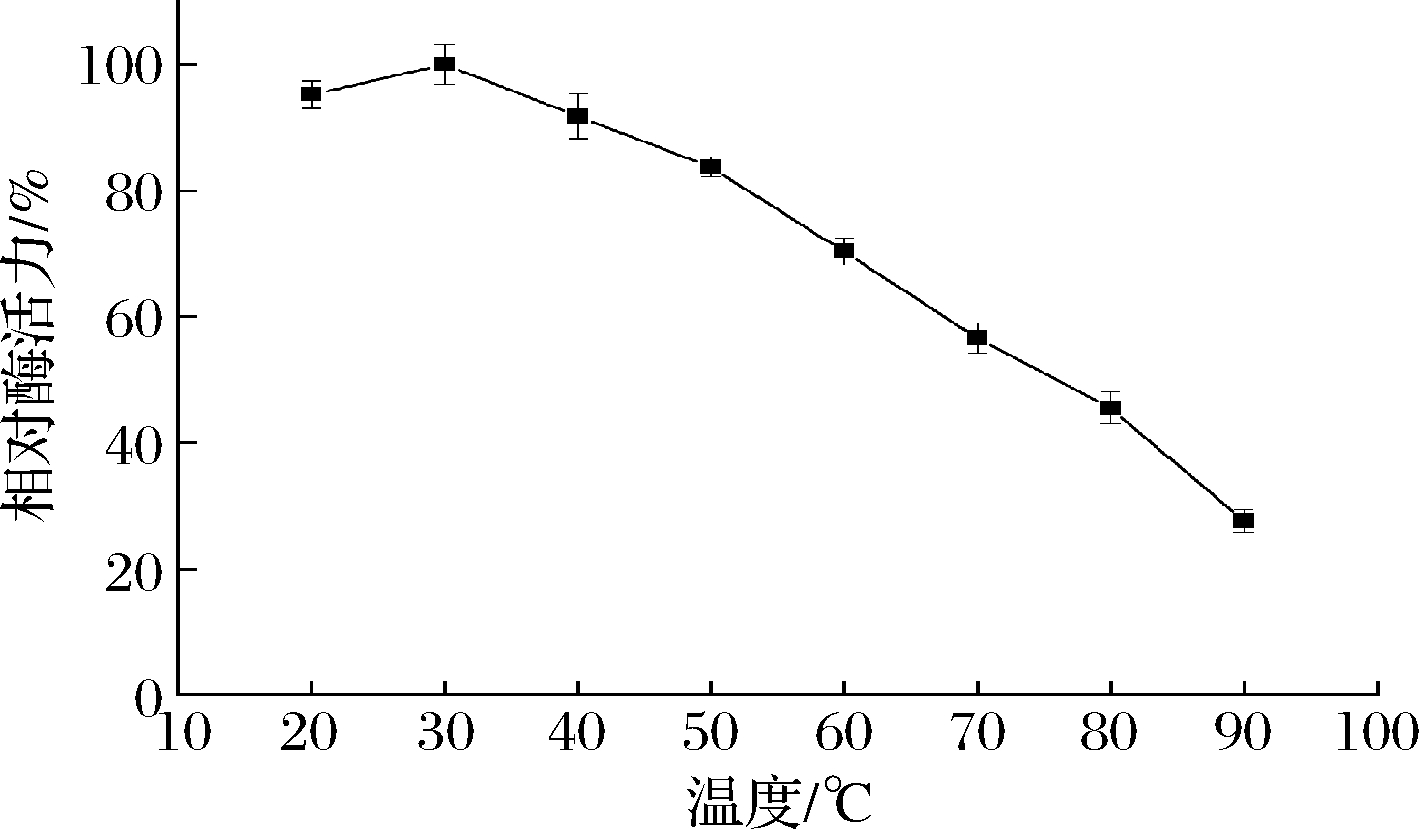
图5 PPO的最适温度
Fig.5 Optimum temperature of PPO
3.2.3 金属离子对酶活性影响的分析
如图6所示,Al3+、Mg2+和Zn2+对PPO酶活力有激活作用。在0.01 mol/L的低浓度下,Zn2+可使PPO相对酶活力提高至130%;Al3+和Mg2+的浓度分别升至0.08和0.04 mol/L时,才能将相对酶活力提高至120%。Na+、K+和Ca2+对酶活力没有显著影响,而Cu2+和Mn2+对酶活力有着轻微抑制作用。

图6 金属离子对PPO活力的影响
Fig.6 Effect of metal ion on PPO activity
在试验过程中,向反应体系中添加Fe2+和Fe3+分别出现淡蓝色和墨绿色的絮状物,无法测定其酶活力,推测其原因可能是pH>4时,铁盐和酚类反应生成有色物质。试验结果和黄浩[18]所得结果基本一致,故利用PPO酶促合成TFs时可适量添加金属离子Al3+、Mg2+和Zn2+,以辅助提高PPO酶活力。
3.3 PPO酶促合成TFs
利用酶活力相近的PPO粗酶和纯酶(酶活力分别为34.5和37.4 U、比活力分别为1.51和21.79 U/mg)分别酶促合成TFs,TFs的生成量分别是(0.096 1±0.000 5)和(0.237 8±0.013 2)g/L,TFs的转化率分别为(9.24±0.05)%和(22.86±1.27)%。同时,马铃薯PPO酶促合成TFs单体存在偏好性,TFDG和TF是最主要的TFs合成单体(图7)。

图7 酶对茶黄素类物质生成量的影响
Fig.7 Effects of enzymes on theaflavins production
注:TFs含量为TF、TF-3-G、TF-3’-G、TFDG的总和
由此可以看出,当酶活力相近时,其酶促合成TFs的能力与其比活力呈正相关。试验结果与陈盛虎[19]和许雷等[20]所得结果一致,比活力高、纯化效果好的PPO酶促合成TFs的效果更好。罗玲[21]和王佛生等[6]也曾利用马铃薯PPO粗酶液酶促合成TFs,分别得到以TF和TF-3-G为主的TFs合成单体,与本试验结果存在差异。其原因可能是各试验所选择的底物儿茶素含量存在差异,正如DAVIES等[22]提出的,各类儿茶素单体通过复杂多样的苯骈环化作用形成不同的茶黄素类物质。
4 结论
本研究以马铃薯为供试材料,通过磷酸缓冲液浸提、 80%硫酸铵沉淀、透析和阴离子交换层析分离纯化得到电泳纯的马铃薯PPO,其比活力为21.79 U/mg,回收率为17.15%,纯化倍数为14.43倍,分子质量约为42 kDa。其相关的酶学性质如下:最适pH 6.0,最适温度30 ℃,在20~30 ℃和pH 5.0~6.0时,能够保持较好的热稳定性和酸碱稳定性。同时,金属离子Na+、K+和Ca2+对酶活力无较大影响,Al3+、Mg2+和Zn2+对酶活力有激活作用,Cu2+和Mn2+对酶活力存在抑制作用。马铃薯PPO粗酶和纯酶均可酶促合成TFs,其最大生成量分别为(0.096 1±0.000 5)和(0.237 8±0.013 2) g/L,TFs转化率分别为(9.24±0.05)%和(22.86±1.27)%。在酶活力相近时,纯化后的、比活力高的PPO酶促合成TFs的效果更好。故在利用马铃薯PPO工业化制备TFs时,可参考采用比活力较高的PPO,并将其置于pH 6.0、30 ℃、适当添加Al3+、Mg2+和Zn2+等金属离子的反应体系中,以获得更多的目标产物TFs。
[1] SHEVCHUK A,JAYASINGHE L,KUHNERT N.Differentiation of black tea infusions according to origin,processing and botanical varieties using multivariate statistical analysis of LC-MS data[J].Food Research International,2018,109:387-402.
[2] TU Y Y,TANG A B,WATANABE N.The theaflavin monomers inhibit the cancer cells growth in vitro[J].Acta Biochimica et Biophysica Sinica,2004,36(7):508-512.
[3] 薛金金, 尹鹏,张建勇,等.植物源多酚氧化酶氧化儿茶素形成茶黄素和聚酯型儿茶素的研究[J].食品工业科技,2019,40(20):76-81.
XUE J J,YIN P,ZHANG J Y,et al.Screening of plant-derived polyphenol oxidase for the formation of theaflavins and theasinensins from the oxidation of catechins[J].Science and Technology of Food Industry,2019,40(20):76-81.
[4] 黄莹捷,伍梦瑶,姚燕妮,等.不同反应条件对勐库大叶种多酚氧化酶合成茶黄素的影响[J].食品科学,2017,38(22):54-59.
HUANG Y J,WU M Y,YAO Y N,et al.Effects of different conditions on theaflavins synthesis by polyphenol oxidase of Camellia sinensis var.assamica cv.Mengku[J].Food Science,2017,38(22):54-59.
[5] 吴光亮, 刘新涛,胡冰,等.茶黄素双没食子酸酯的酶法合成条件优化与纯化[J].食品科学,2018,39(14):296-301.
WU G L,LIU X T,HU B,et al.Optimization of enzymatic synthesis and purification of theaflavin-3,3’-O-digallate[J].Food Science,2018,39(14):296-301.
[6] 王佛生, 武永福.酯型茶黄素酶促氧化制备条件研究[J].陇东学院学报,2017,28(1):43-47.
WANG F S,WU Y F.Study on optimum condition of the formation of ester type theaflavins by enzymatic oxidation[J].Journal of Longdong University,2017,28(1):43-47.
[7] 许雷. 茶树多酚氧化酶的提取、分离纯化及其部分酶性质研究[D].武汉:华中农业大学,2014.
XU L.Extraction,isolation,purification and partial characteristics of polyphenol oxidase from Camellia sinensis[D].Wuhan:Huazhong Agricultural University,2014.
[8] 滕杰. 茶叶多酚氧化酶同工酶分离鉴定及其酶促合成茶黄素研究[D].长沙:湖南农业大学,2015.
TENG J.Isolation and identification of polyphenol oxidase isozymes from Camellia sinensis and its the enzymatic synthesis of theaflavins[D].Changsha:Hunan Agricultural University,2015.
[9] 李远华. 茶学综合实验[M].北京:中国轻工业出版社,2018.
LI Y H.Comprehensive experiment of tea science[M].Beijing:China Light Industry Press,2018.
[10] 李玉花. 蛋白质分析实验技术指南[M].北京:高等教育出版社,2011.
LI Y H.Technical guide for protein analysis experiment[M].Beijing:Higher Education Press,2011.
[11] R.R.伯吉斯, M.P.多伊彻.蛋白质纯化指南[M].北京:科学出版社,2013.
BURGESS R R,DEUTCHER M P.The guide to protein purification[M].Beijing:Science Press,2013.
[12] 潘海波. 茶黄素的UPLC分析及其对人卵巢癌细胞抑制作用和机制的研究[D].杭州:浙江大学,2018.
PAN H B.Analysis of theafalvins and the inhibitory effects and mechanisms of theaflavins on human ovarian carcinoma cells[D].Hangzhou:Zhejiang University,2018.
[13] 马帅, 杨绍青,刘翊昊,等.枯草芽孢杆菌壳聚糖酶在毕赤酵母中的高效表达及其酶解特性[J].食品科学,2019,40(14):99-106.
MA S,YANG S Q,LIU Y H,et al.High-level expression of Bacillus subtilis chitosanase in Pichia pastoris and its hydrolytic properties[J].Food Science,2019,40(14):99-106.
[14] 廖海君,李蕊伽,陶敏,等.云南莴笋尖酪氨酸酶分离纯化及酶学性质[J].食品科学,2017,38(8):30-36.
LIAO H J,LI R J,TAO M,et al.Isolation,purification and partial characterization of tyrosinase from Yunnan-grown lettuce tip[J].Food Science,2017,38(8):30-36.
[15] 贺立红, 宾金华.高等植物中的多酚氧化酶[J].植物生理学通讯,2001,37(4):340-345.
HE L H,BIN J H.Polyphenol oxidase in higher plants[J].The Plant Physiology Communications,2001,37(4):340-345.
[16] 李俊, 卢扬,刘永翔,等.不同品种马铃薯多酚氧化酶酶学特性对比[J].食品科技,2020,45(6):218-223.
LI J,LU Y,LIU Y X,et al.Comparison of enzymatic characteristics of polyphenol oxidase in different varieties of potato[J].Food Science and Technology,2020,45(6):218-223.
[17] 张帅, 曹庸,梁晓莹,等.黑曲霉N5-5单宁酶的纯化及酶学性质测定[J].食品科学,2017,38(6):142-146.
ZHANG S,CAO Y,LIANG X Y,et al.Purification and enzymatic properties of tannase from Aspergillus niger N5-5[J].Food Science,2017,38(6):142-146.
[18] 黄浩. 马铃薯多酚氧化酶性质及抑制剂作用机理的研究[D].厦门:厦门大学,2006.
HUANG H.Study on properties of potato polyphenol oxidase and mechanism of inhibitor[D].Xiamen:Xiamen University,2006.
[19] 陈盛虎. 龙井43号茶树多酚氧化酶同工酶的分离纯化与PPO III-2、PPO V-3性质研究[D].武汉:华中农业大学,2016.
CHEN S H.Isolation and purification of polyphenol oxidase isoenzyme from Camellia sinensis var longjing 43,and enzymatic properties of PPO III-2 AND PPO V-3[D].Wuhan:Huazhong Agricultural University,2016.
[20] 许雷, 张书芹,陈盛虎,等.茶树多酚氧化酶同工酶的分离纯化[J].华中农业大学学报,2015,34(6):114-118.
XU L,ZHANG S Q,CHEN S H,et al.Isolation and purification of polyphenol oxidase isoenzyme from Camellia sinensis[J].Journal of Huazhong Agricultural University,2015,34(6):114-118.
[21] 罗玲. 天然果蔬多酚氧化酶氧化茶多酚的研究[D].无锡:江南大学,2014.
LUO L.Research on oxidation of tea polyphenols by PPO of natural fruits and vegetables[D].Wuxi:Jiangnan University,2014.
[22] DAVIES A P,GOODSALL C,CAI Y,et al.Black tea dimeric and oligomeric pigments-structures and formation[M].New York:Kluwer Academic Plenum Publishers,1999.