透明质酸由D-葡萄糖醛酸(aldehydo-D-glucuronic acid,GlcUA)和N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc)的双糖重复序列组成,β-1,3和β-1,4糖苷键交替连接[1]。透明质酸在自然界分布广泛,主要存在于人体脐带、皮肤等位置,主要用于保持体内水分,保护关节滑顺[2];动物体内主要存在于眼玻璃体和各组织细胞中;在某些链球菌属细胞荚膜中大量存在,保护细胞免受氧气的侵害,这也是目前大量获得透明质酸的主要途径。传统工艺中,透明质酸是从鸡冠、人脐带、牛眼玻璃体中提取或者化学合成得到[3],但提取率低,工艺复杂,成本高,目前透明质酸的生产主要通过微生物发酵。透明质酸的生物学功能和特异性应用取决于其分子质量,高分子透明质酸(分子质量范围1.8 M~2.2 MDa)结构稳定,常用于生物医学领域[4-7];中分子透明质酸(分子质量范围1.0 M~1.8 MDa)可保持关节润滑,长久保湿,在骨关节炎治疗中有显著疗效[8];小分子透明质酸(分子质量范围400 k~1.0 MDa)能渗入真皮,扩张毛细血管,主要用于化妆品领域[9]。目前,透明质酸产量不论在发酵水平还是分子水平都已达到瓶颈,仅仅提升产量不利于透明质酸的推广应用,因此为扩大透明质酸的应用范围以及制备更好的生物医学、保健产品,对于调控透明质酸分子质量大小的研究非常重要,这也是近年来学者们的研究重点。
本文分别在发酵水平和分子层面上对近几年国内外调控透明质酸分子质量的研究进行总结,同时对分子生物技术、代谢工程在生产特定分子质量透明质酸方面的优势进行展望,旨在对未来提高透明质酸分子质量与开发特定分子质量透明质酸的研究方法提供参考。
1 发酵水平调控透明质酸分子质量
随着发酵技术、设备的进步成熟,发酵工程在生产多糖类物质中的地位越来越高。透明质酸发酵中主要通过控制以下几方面来调控透明质酸分子质量。
1.1 通过pH调控透明质酸分子质量
研究表明,链球菌在37 ℃,pH为7.0下透明质酸产量最高,在30 ℃,pH为8.0时则产生分子质量较高的透明质酸[10-11]。李志敏[12]在发酵前10 h采用弱碱性和低温条件来提高透明质酸分子质量,之后将pH和温度调为7.0和37 ℃,将发酵过程分阶段调控,透明质酸产量与分子质量分别达到4.55 g/L和2.2 MDa。汪伟等[13]采用2种pH调控模式(分段调控和周期调控),分段调控即在前6 h将发酵液pH控制为7.0,之后调为8.0直至发酵结束;周期调控即在发酵前6 h将pH控制为7.0,在6~7 h控制为8.0,8~9 h控制为7.0,如此循环直至发酵结束。其中分段调控pH下透明质酸分子质量比对照组提高了10.6%,且透明质酸分子质量的分布发生改变,在高分子质量范围内的透明质酸含量显著增加。其分子质量的改变可能是因为酸碱环境的胁迫作用导致细胞的产能途径和葡萄糖流量分布发生变化,有利于透明质酸链长的延伸;pH调控透明质酸分子质量的机制还不清晰,对其进行深入探究将对未来在发酵水平上精准化调控透明质酸分子质量奠定基础。
1.2 通过溶氧调控透明质酸分子质量
链球菌是一种兼性厌氧菌,荚膜中含有透明质酸用来防止氧气对细胞的毒害。但是透明质酸作为一种黏多糖,分泌在发酵液中会显著降低发酵液溶氧水平,同时还会阻止细胞与营养物质的接触,阻碍细胞生长。WANG等[14]在重组谷氨酸棒状杆菌发酵体系中加入重组水蛭透明质酸酶发现,透明质酸酶的加入有利于透明质酸的脱落,提高了溶氧水平,同时增加了细胞与营养物质的接触空间,成功将透明质酸产量提升至74.1 g/L,并且通过控制添加水蛭透明质酸酶的浓度来有效控制透明质酸分子质量。刘龙[15]在发酵8和12 h时加入透明质酸酶和过氧化氢来降解透明质酸,其分子质量降至20 kDa左右,产量提高20%,且发酵液黏度显著降低,溶氧水平明显提升。在发酵液中加入上述2种物质,通过控制其浓度能够通过发酵法生产特定范围分子质量的透明质酸,这是首次提出利用发酵法获得较低分子质量透明质酸的报道。
1.3 通过培养基组成与比例调控透明质酸分子质量
组成链球菌的生长培养基一般包括葡萄糖、蔗糖、酵母粉、蛋白胨和其他营养物质。JAGANNATH等[16]研究表明,培养基组分中氮源浓度过高或者通过流加氨水方式补加氮源均不利于Streptococcus zooepidemicus合成高分子质量的透明质酸,而低浓度的复合氮源可以防止菌体快速生长,减小与透明质酸合成的竞争,提高透明质酸产量和分子质量。DON等[17]通过建立非结构数学模型预测了链球菌耐受葡萄糖的最高质量浓度为40 g/L。李志敏[12]发现,发酵过程中葡萄糖供给水平和方式对透明质酸分子质量大小有重要作用。吴祥坤等[18]采用分批培养的方式进行发酵,当初始葡萄糖质量浓度为80 g/L时透明质酸产量为5.94 g/L,分子质量达到1.68×106 Da;采用补料发酵模式时,葡萄糖总质量浓度为80 g/L,用初始葡萄糖质量浓度为40 g/L,在发酵6 h时一次性将剩余的40 g/L葡萄糖补加到发酵罐中的方式,透明质酸产量提高28.5%,平均分子质量为1.56×106 Da。
前体UDP-GlcUA和UDP-GlcNAc中均含有尿嘧啶核苷二磷酸(uridine diphosphate,UDP),UDP参与了透明质酸的合成,在发酵液中加入少量尿嘧啶既能保证细胞正常代谢又能提高合成透明质酸的2种前体浓度,进而提高透明质酸产量与分子质量[19]。ARMSTRONG等[20]以谷氨酰胺为氮源在培养基中去除几种常见氨基酸的合成途径,发现细胞生长速度与对照组相比下降60%,透明质酸产量降低50%左右,同时确定11种氨基酸是细胞生长必须的,通过外源添加氨基酸等可以提高透明质酸产量与分子质量。
1.4 通过细胞膜通透性调控透明质酸分子质量
研究表明[21],透明质酸的合成只需要透明质酸合成酶(hyaluronic acid synthase,HAS)的参与,HAS的催化功能主要依赖其特殊的跨膜结构,最新研究发现透明质酸合成酶结构中存在7个典型的跨膜结构域,如图1。这7个结构域围绕构成一个跨膜蛋白孔隙。PUMMILL等[22]通过定点突变技术研究脊椎动物HAS的各种突变体,不仅发现了多种单一突变体导致透明质酸分子质量变大或变小,而且还发现了一种特定的氨基酸,可以通过突变产生分子质量大小不一的透明质酸。他们推测氨基酸的突变导致酶结构发生变化,而这些变化就与蛋白孔隙有关。WEIGEL等[23]认为透明质酸的跨膜运输分泌可能是由HAS孔隙与细胞膜上的ABC转运系统共同完成的;MEDINA等[24]将纯化的SeHAS添加到预载荧光染料的脂质体中模拟体外跨膜运输,证明HAS内存在一个蛋白孔隙且通过自身将透明质酸转移到细胞外。
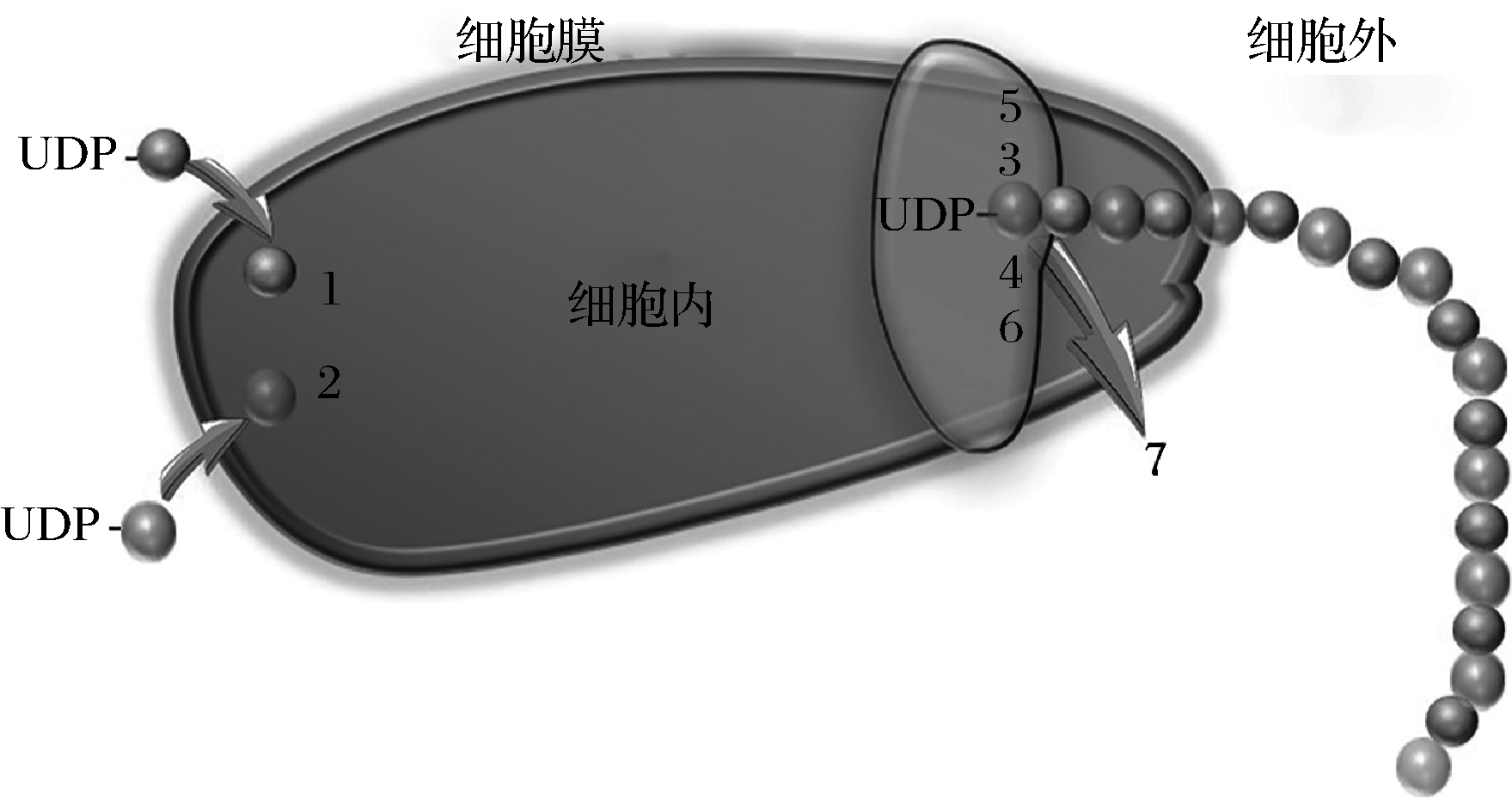
UDP- ![]() :UDP-GlcNAc;UDP-
:UDP-GlcNAc;UDP-  :UDP-GlcUA;透明质酸合成酶的7个结构域:1:UDP-GlcNAc结合部位;2:UDP-GlcUA结合部位;3:透明质酸-GlcUA-UDP供给部位;4:透明质酸-GlcNAc-UDP供给部位;5:UDP-GIcUA糖基转移酶位点;6:UDP-GlcNAc糖基转移酶位点;7:透明质酸跨膜位点
:UDP-GlcUA;透明质酸合成酶的7个结构域:1:UDP-GlcNAc结合部位;2:UDP-GlcUA结合部位;3:透明质酸-GlcUA-UDP供给部位;4:透明质酸-GlcNAc-UDP供给部位;5:UDP-GIcUA糖基转移酶位点;6:UDP-GlcNAc糖基转移酶位点;7:透明质酸跨膜位点
图1 透明质酸在细胞膜上的合成与分泌
Fig.1 Synthesis and secretion of hyaluronic acid on cell membrane
透明质酸的跨膜机制并不清晰,对机制的研究集中在细胞膜微环境对HAS活性的影响以及HAS在跨膜过程中细胞基质的改变,研究其机制对未来控制透明质酸分子质量有重大意义。
温琦等[25]在发酵液中加入表面活性剂来探究对透明质酸发酵的影响,发酵12 h加入20 mg/mL的十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB),透明质酸产量提高20%,CTAB的加入改变了细胞外基质,有利于透明质酸荚膜的脱落,但CTAB的毒性使得透明质酸分子质量略有下降。李志敏[12]在发酵8 h添加磷脂酰胆碱,使透明质酸产量与分子质量分别达到5.61 g/L和2.54 MDa,基本实现了高产量与高分子质量的统一。
随着发酵技术的逐渐发展,发酵工程在透明质酸发酵中的优势越来越大,主要体现在操作简单,便于控制,易于实现等方面。而且在发酵水平上对透明质酸分子质量进行调控的手段较多,比如氮源种类、其他生长因子以及与其他学科的交叉应用等。但在发酵水平上对透明质酸分子质量控制精确度较差,只能得到分子质量较低的透明质酸,对于高分子质量以及特定分子质量透明质酸的生产还不成熟,并且控制透明质酸分子质量不论是成本还是原材料上消耗比较大,是一个亟待解决的问题[26-27]。尽管发酵法生产透明质酸的培养基与培养条件已经基本确定,但是不同条件以及不同营养成分对透明质酸产量以及分子质量影响的具体机制并不清晰,因此在分子、代谢水平上对透明质酸合成相关基因和代谢途径进行调控能够分析其机制且对透明质酸分子质量实现精准化调控。
2 分子水平调控透明质酸分子质量
近年来,随着大量关于微生物多糖生物合成代谢途径和相关基因的深入了解,对优良菌株进行基因改造成为一条降低成本、增加菌株安全性、提高透明质酸产量和控制分子质量的切实可行途径。合成透明质酸的2个前体UDP-GlcUA和UDP-GlcNAc在HAS的作用下合成透明质酸,其在兽疫链球菌中的合成途径如图2所示。其中的基因包括编码HAS的hasA、UDP-葡萄糖脱氢酶(UGDH)编码基因hasB/ugd、葡萄糖-1-磷酸尿苷转移酶的编码基因hasC/galU、N-乙酰葡糖胺-1-磷酸尿苷转移酶的编码基因hasD/glmU以及编码磷酸葡萄糖异构酶的hasE/pgi[28],如图3所示。
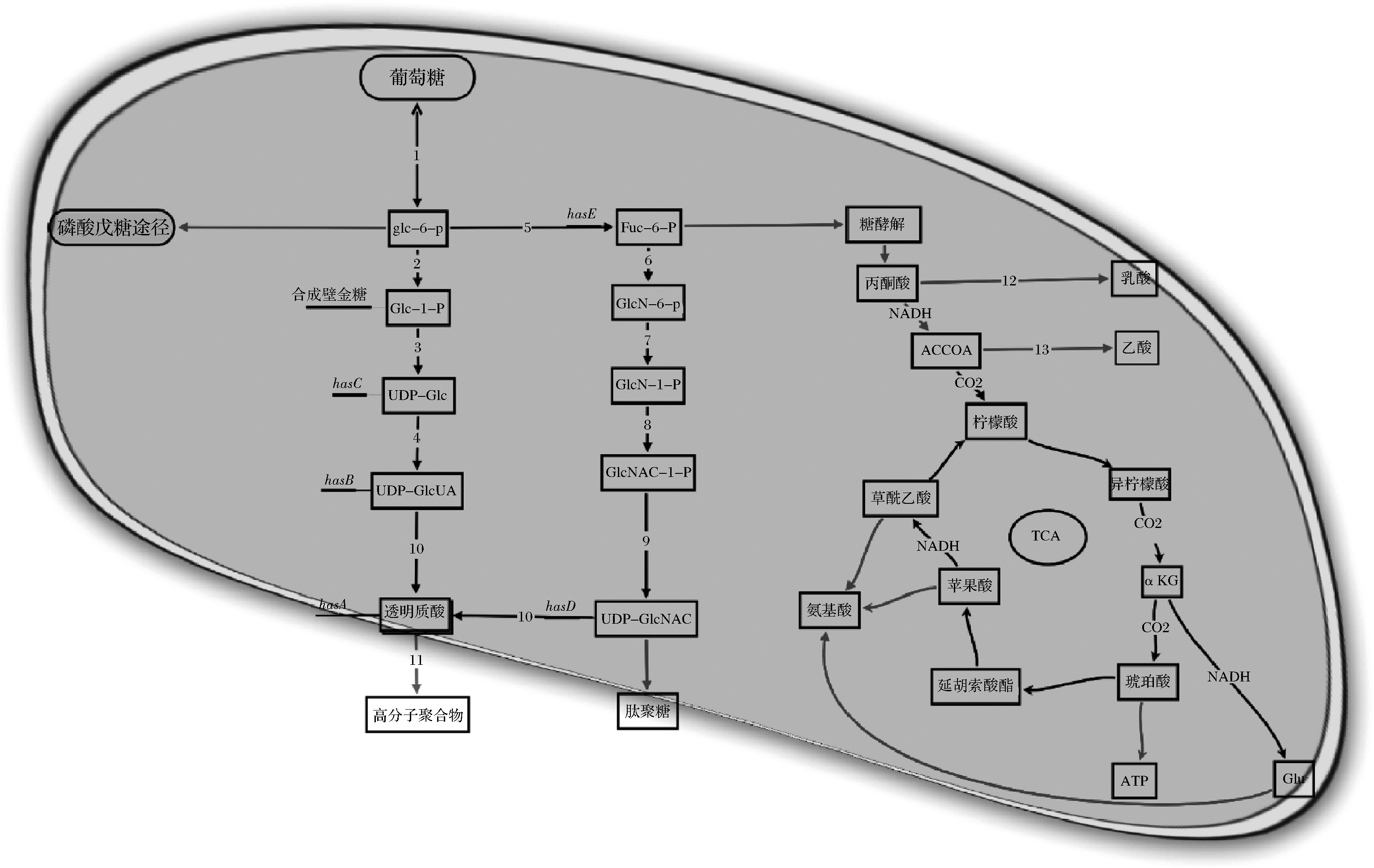
1-己糖激酶;2-葡萄糖磷酸变位酶;3-UDP-葡萄糖焦磷酸化酶;4-UDP-葡萄糖脱氢酶;5-磷酸葡糖异构酶;6-氨基转移酶;7-变位酶;
8-乙酰转移酶;9-焦磷酸化酶;10-透明质酸合成酶;11-透明质酸酶;12-乳酸脱氢酶;13-乙酸激酶
图2 兽疫链球菌透明质酸代谢合成途径
Fig.2 Hyaluronic acid anabolic pathway in S.epizooides
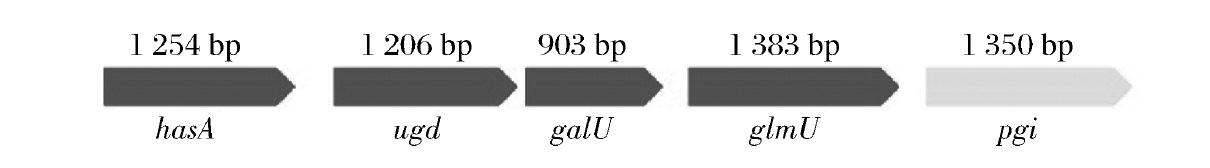
图3 兽疫链球菌透明质酸合成基因簇
Fig.3 The hyaluronic acid synthesis gene cluster of S.epizoides
2.1 调控透明质酸合成前体浓度
2种前体的竞争会刺激HAS的合成,对其聚合速率影响较大,因此可能存在两底物之间的最佳比例使透明质酸分子质量达到最大。HMAR等[29]发现当2种前体的浓度比例接近1时,产生较高分子质量的透明质酸;当该比例远大于或远小于1时,产生较低分子质量的透明质酸。由于链球菌是条件致病菌,目前在分子水平上调控透明质酸分子质量的方法大多通过异源表达透明质酸来降低致病风险,目前研究较多的宿主细胞有枯草芽孢杆菌[30]、乳酸乳球菌[31]、大肠杆菌[32]、谷氨酸棒状杆菌[33]等。PRASAD等[31]将兽疫链球菌中合成透明质酸的基因导入乳酸乳球菌中时,发现将szhasA、szhasB、szhasC同时导入乳酸乳球菌中,透明质酸产量比只导入szhasA、szhasB的重组菌株提高了119%。可见2种前体的浓度与比例是提高透明质酸产量的关键。CHEN等[34]通过对不同透明质酸合成基因的过表达发现前体UDP-GlcNAc的浓度是透明质酸分子质量大小的关键限制因子,并指出UDP-GlcUA与UDP-GlcNAc的竞争关系一方面是对HAS上结合位点的亲和力不同,UDP-GlcNAc亲和力较差;另一方面是对UDP的竞争。进一步将与透明质酸合成的相关基因过表达,发现过表达编码磷酸葡萄糖异构酶的基因hasE显著提高透明质酸分子质量,因为磷酸葡萄糖异构酶浓度的提高使更多的葡萄糖6-磷酸流向果糖6-磷酸,产生更多的UDP-GlcNAc。由此提出3种策略增加UDP-GlcNAc:1)降低磷酸果糖激酶活性;2)其他酶基因在UDP-GlcNAc通路(如GlmS或GlmM)的过表达;3)在发酵液中加入葡萄糖胺。JIA等[35]通过构建2个人工操纵子分别将多杀性巴斯德菌hasA基因置于可诱导木糖启动子控制下和将透明质酸合成前体基因置于可诱导启动子IPTG下,通过诱导启动子表达控制基因表达水平,控制透明质酸分子质量。然后通过两阶段诱导策略成功构建出高产高分子质量的菌株,产量达6.8 g/L,分子质量为4.5 MDa,分子质量可控范围为8 k~5.4 MDa。通过对宿主的UDP-GlcNAc/UDP-GlcUA值进行定位,或者通过精细化表达、动态监控等手段来调控两种前体糖的最佳配比将是一种更精确生产特定分子质量透明质酸的方法。
2.2 透明质酸合成途径的代谢调控
葡萄糖-1-磷酸、UDP-GlcUA和UDP-GlcNAC同时用于合成透明质酸和细菌细胞壁,即细胞自身生长与透明质酸合成存在竞争关系。乳酸的大量积累又同时影响细胞生长和透明质酸合成,具体机制见图4[36]。通过抑制或完全去除这些途径使更多的ATP和葡萄糖中间产物流向透明质酸合成途径进而提高透明质酸产量与分子质量。JIN等[33]在构建的枯草芽孢杆菌重组菌中,分别用TTG或GTG替换pfkA(编码果糖-6-磷酸激酶)的起始密码子ATG抑制pfkA的表达,使更多的果糖-6-磷酸用来合成前体UDP-GlcNAc,然后通过共表达前体基因,摇瓶水平下,重组枯草芽孢杆菌E168G(GTG)和E168T(TTG)与E168A(ATG)相比,透明质酸产量分别增加13%和18%分子质量范围在1.4 M~1.83 MDa。CHENG等[37]通过敲除zwf(Glc-6-磷酸脱氢酶基因)消除磷酸戊糖途径同时弱化FBA(Fuc-1-6二磷酸醛缩酶)的表达减弱糖酵解途径,又通过单交叉同源重组法敲除重组菌株(Corynebacterium glutamicum)中ldh基因(编码乳酸脱氢酶LDH催化丙酮酸转化为乳酸),在C.glutamicum中经过分批补料发酵模式使透明质酸产量增加到28.7 g/L,分子质量为0.21 MDa。
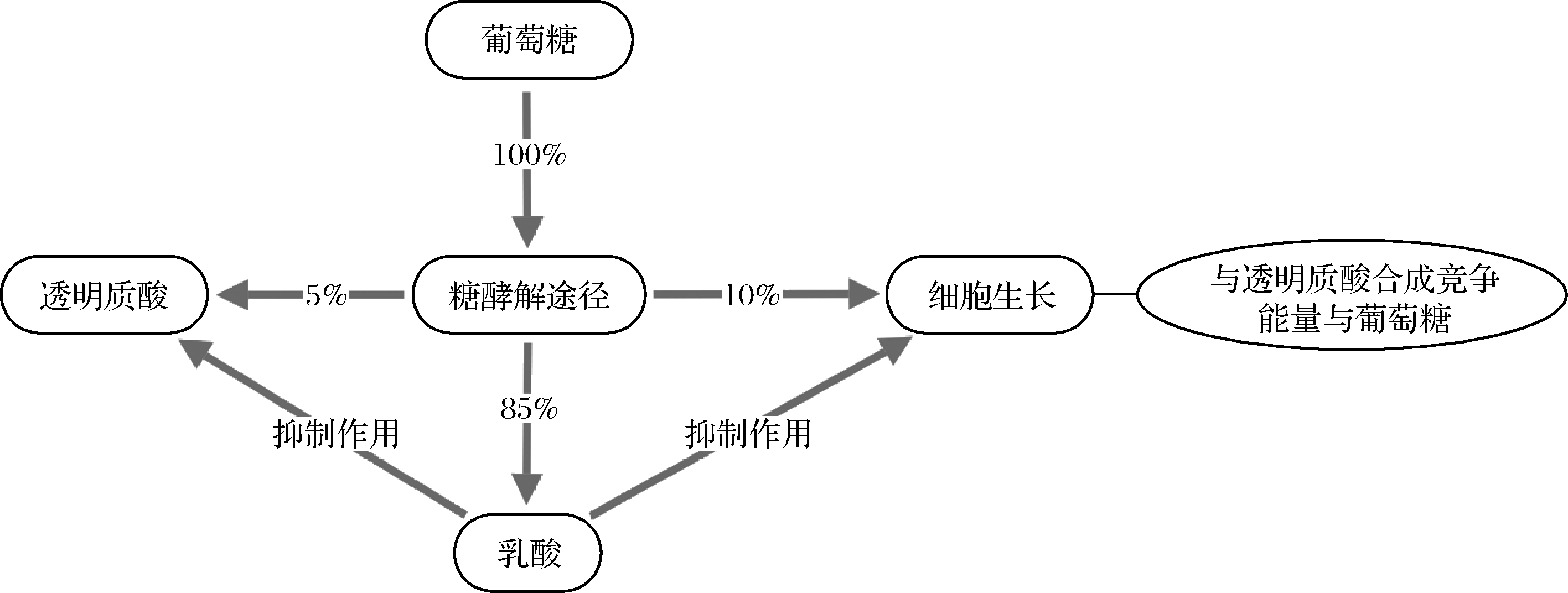
图4 细胞内葡萄糖消耗的分布
Fig.4 Glucose consumption distribution in cells
透明质酸的合成过程中伴随着能量的代谢,需要消耗大量NAD+和ATP,NAD+的生成主要依靠丙酮转化成乳酸,但是乳酸的合成导致发酵液pH降低阻碍细胞生长,且1 mol葡萄糖转化成乳酸时只产生2 mol ATP,而产乙酸时则产4 mol ATP。因此利用近几年发展的前沿技术工具[38-39]精确地调节关键代谢物质或者基因工程开发出其他代谢途径或改变细胞能量代谢途径使更多的ATP流向透明质酸合成通路是提高透明质酸产量与分子质量的可行途径。张晋宇[40]克隆 Wautersia eutropha的PHB(聚羟基丁酸)合成基因phbCAB导入兽疫链球菌,在phbCAB蛋白催化作用下NADH向NAD+转化为细胞提供一个全新的NAD+补给途径,在发酵罐水平下乳酸产量从64 g/L降低到41 g/L,透明质酸产量提高了1 g/L左右。
2.3 调控HAS和透明质酸酶
HAS作为将2种前体糖连接起来的关键物质对透明质酸分子质量和产量起到重要作用,透明质酸分子质量也可以说是HAS的内在参数。KUMARI等[41]通过在体外实验发现,HAS中保守半胱氨酸的突变或者其他氨基酸的突变导致透明质酸分子质量下降,但对透明质酸合成速率以及产量影响较小。而在脊椎动物HAS中氨基酸的突变和突变形成的氨基酸则会控制透明质酸分子质量大小。WANG[14]将不同物种中的HAS合成基因hasA在枯草芽孢杆菌中单独过表达发现不同物种的HAS合成透明质酸的能力不同,对其蛋白结构的研究发现HAS的第1个跨膜螺旋在透明质酸调控中发挥重要作用。透明质酸酶作为一种内源性N-乙酰己糖氨基酶通过消除透明质酸单体之间的β-1-4键来降解透明质酸使透明质酸分子质量变小[22,42]。JIN等[43]通过扩增cDNA末端聚合酶链式反应(RACE-PCR)鉴定了第1个水蛭透明质酸酶基因,在毕赤酵母中通过高密度培养等方法水蛭透明质酸酶产量达到8.42×105 U/mL,这种酶的应用将促进特定分子质量透明质酸的大规模生产。JIN等[43]将兽疫链球菌HAS和枯草芽孢杆菌中透明质酸合成前体基因在枯草芽孢杆菌工程菌上表达,再将来自水蛭透明质酸酶编码基因LHyal整合到枯草芽孢杆菌染色体上,对LHyal N端修饰以高效表达,分别采用不同强度的核糖体结合位点序列来调控透明质酸酶的表达量,得到范围为2.20×103~1.42×106 Da的特定分子质量透明质酸,且在3 L发酵罐中透明质酸产量从5.96 g/L提高至19.38 g/L。VALCARCEL等[44]模拟透明质酸酶、软骨素酶ABC和磷酸降解透明质酸的动力学模型,通过凝胶渗透色谱监测透明质酸分子质量,该模型正确的将数据再现,并得到了特定分子质量大小的透明质酸。已有学者通过提取天然植物中的物质来抑制透明质酸酶活性如赤草苏皂苷、儿萘素、水杨酸盐、类黄酮[45]等;将这些天然植物提取物加入到发酵体系中来抑制细菌自身的透明质酸酶活性,结合分子手段同时提高透明质酸产量将是一种新的同时提高透明质酸产量与分子质量的思路。
基因工程、代谢工程等技术具有对透明质酸分子质量精细化调控、降低安全风险以及提高效益等优势在生产开发特定分子质量大小透明质酸中应用越来越多;但分子技术手段的难度较大,操作较为复杂,使其在未来透明质酸的研究中还需深入研究。
3 展望
近年来,随着发酵、分子以及其他科学技术技术的进步,国内外对透明质酸分子质量的调控研究越来越深入。高分子质量以及特定分子质量的透明质酸在生物医药、食品保健等领域具有巨大的发展潜力和市场需求。
透明质酸分子质量的调控是未来透明质酸研究的热点,发酵水平上通过改变细胞自身产能途径和细胞膜的通透性来控制透明质酸分子质量;分子水平上依靠基因技术以及代谢工程技术来提高流向透明质酸合成通路的各种前体物质的通量或者抑制与其竞争的通路更加精细化的调控透明质酸分子质量。大量研究表明,在发酵水平和分子水平上对透明质酸分子质量调控效果显著,但是细胞水平上对透明质酸链长延伸的研究还不成熟,如透明质酸在延伸到细胞外时细胞膜对其影响的具体机制还不清晰;细胞外基质中是否存在一种未知的调控因子控制透明质酸链长以及HAS在转移过程中的活性是否受到一些未知的因素影响还需要深入研究,为进一步调控透明质酸分子质量奠定基础。
透明质酸的合成较为复杂,与其合成竞争的代谢途径较多且受到多层次和多水平调控,因此采用最新分子技术手段如CRISPER/Cas9结合蛋白质组学、转录组学、代谢组学等来提高、弱化和协同透明质酸合成途径中间代谢物质将是提高透明质酸产量与开发特定分子质量的有效手段;通过在研究较为成熟的基因工程模式菌株中来异源表达透明质酸将会更加简单、安全、高效的调控透明质酸分子质量。同时,利用多组学技术解析透明质酸在应用中发挥作用的分子机制来生产特定分子质量透明质酸对未来透明质酸在各个领域的应用具有深远影响。
[1] KOGAN G,SOLTÉS L,STERN R,et al.Hyaluronic acid:A natural biopolymer with a broad range of biomedical and industrial applications[J].Biotechnol Lett,2007,29(1):17-25.
[2] POGREL M A,LOW M A,STERN R.Hyaluronan (hyaluronic acid) and its regulation in human saliva by hyaluronidase and its inhibitors[J].Journal of Oral Science,2003,45(2):85-91.
[3] 张天民,凌沛学,沈渤江,等.透明质酸的研制及应用研究[J].中国药学杂志,1987(9):56-59.
ZHANG T M,LING P X,SHEN B J,et al.Development and application of hyaluronic acid[J].Chinese Journal of Pharmaceuticals,1987(9):56-59.
[4] GARANTZIOTIS S,SAVANI R C.Hyaluronan biology:A complex balancing act of structure,function,location and context[J].Matrix Biology:Journal of the International Society for Matrix Biology,2019,78-79:1-10.
[5] ATHAMNEH T,AMIN A,BENKE E,et al.Alginate and hybrid alginate-hyaluronic acid aerogel microspheres as potential carrier for pulmonary drug delivery[J].The Journal of Supercritical Fluids,2019,150:49-55.
[6] KANDEL L,AGAR G,ELKAYAM O,et al.A novel approach for knee osteoarthritis using high molecular weight hyaluronic acid conjugated to plasma fibrinogen-interim findings of a double-blind clinical study[J].Heliyon,2020,6(7):e 04 475.
[7] TOLBA Y M,OMAR S S,NAGUI D A,et al.Effect of high molecular weight hyaluronic acid in treatment of osteoarthritic temporomandibular joints of rats[J].Archives of Oral Biology,2020,110:104 618.
[8] MOCHIZUKI T,IKARI K,YANO K,et al.Comparison of patient-reported outcomes of treatment with low-and intermediate molecular weight hyaluronic acid in Japanese patients with symptomatic knee osteoarthritis:A prospective,randomized,single-blind trial[J].Asia-Pacific Journal of Sports Medicine,Arthroscopy,Rehabilitation and Technology,2020,21:22-26.
[9] 白云,许国明,范明明,等.透明质酸和硅胶假体在美容整形隆鼻术中应用效果对比观察[J].智慧健康,2019,5(18):145-146.
BAI Y, XU G M, FAN M M,et al.Comparative observation of application effects of hyaluronic acid and silicone prosthesis in cosmetic rhinoplasty[J].Smart Health,2019,5(18):145-146.
[10] JOHNS M R,GOH L T,OEGGERLI A.Effect of pH,agitation and aeration on hyaluronic acid production by Streptococcus zooepidemicus[J].Biotechnology Letters,1994,16(5):507-512.
[11] KIM J H,YOO S J,OH D K,et al.Selection of a Streptococcus equi mutant and optimization of culture conditions for the production of high molecular weight hyaluronic acid[J].Enzyme and Microbial Technology,1996,19(6):440-445.
[12] 李志敏.高分子量透明质酸发酵工艺的研究[D].石家庄:河北科技大学,2015.
LI Z M.Study on fermentation process of high-molecular-weight hyaluronic acid[D].Shijiazhuang:Hebei University of Science and Technology,2015.
[13] 汪伟,蔡海波,谭文松.pH调控方式和温度对透明质酸发酵过程的影响[J].现代食品科技,2019,35(8):207-213.
WANG W,CAI H B,TAN W S.Effects of pH control modes on hyaluronic acid fermentation process[J].Modern Food Science and Technology,2019,35(8):207-213.
[14] WANG Y,HU L,HUANG H,et al.Eliminating the capsule-like layer to promote glucose uptake for hyaluronan production by engineered Corynebacterium glutamicum[J].Nature Communications,2020,11(1):3 120.
[15] 刘龙.兽疫链球菌发酵生产透明质酸过程控制与优化[D].无锡:江南大学,2009.
LIU L.Control and optimization of production process of hyaluronic acid from Streptococcus epizoides fermentation[D].Wuxi:Jiang Nan University,2009.
[16] JAGANNATH S,RAMACHANDRAN K B.Influence of competing metabolic processes on the molecular weight of hyaluronic acid synthesized by Streptococcus zooepidemicus[J].Biochemical Engineering Journal,2010,48(2):148-158.
[17] MAT DON M,SHOPARWE N.Kinetics of hyaluronic acid production by Streptococcus zooepidemicus considering the effect of glucose[J].Biochemical Engineering Journal,2010,49(1):95-103.
[18] 吴祥坤,王腾飞,李丕武.葡萄糖浓度及补料方式对透明质酸发酵的影响[J].食品工业科技,2016,37(13):198-201;270.
WU X K,WANG T F,LI P W.Effect of glucose concentration and feeding methods on hyaluronic acid fermentation[J].Science and Technology of Food Industry,2016,37(13):198-201;270.
[19] LIU L,LIU Y,LI J,et al.Microbial production of hyaluronic acid:current state,challenges,and perspectives[J].Microbial Cell Factories,2011,10(99):2-9.
[20] ARMSTRONG D C,COONEY M J,JOHNS M R.Growth and amino acid requirements of hyaluronic-acid-producing Streptococcus zooepidemicus[J].Applied Microbiology and Biotechnology,1997,47(3):309-312.
[21] TLAPAK-SIMMONS V L,BARON C A,WEIGEL P H.Characterization of the purified hyaluronan synthase from Streptococcus equisimilis[J].Biochemistry,2004,43(28):9 234-9 242.
[22] PUMMILL P E,DEANGELIS P L.Alteration of polysaccharide size distribution of a vertebrate hyaluronan synthase by mutation[J].Journal of Biological Chemistry,2003,278(22):19 808-19 814.
[23] WEIGEL P H,DEANGELIS P L.Hyaluronan synthases:A decade-plus of novel glycosyltransferases[J].The Journal of Biological Chemistry,2007,282(51):36 777-36 781.
[24] MEDINA A P,LIN J,WEIGEL P H.Hyaluronan synthase mediates dye translocation across liposomal membranes[J].BMC Biochemistry,2012,13(1):2-5.
[25] 温琦,刘登如,陈坚,等.添加表面活性剂促进兽疫链球菌高产透明质酸[J].化工进展,2006,25(9):1 089-1 094.
WEN Q,LIU D R,CHEN J.et al.Enhancement of hyaluronic acid production by Streptococcus zooepidemicus H24 through supplement of CTAB[J].Chemical Industry and Engineering Progress,2006,25(9):1 089-1 094
[26] AMADO I R,V ZQUEZ J A,PASTRANA L,et al.Microbial production of hyaluronic acid from agro-industrial by-products:Molasses and corn steep liquor[J].Biochemical Engineering Journal,2017,117:181-187.
ZQUEZ J A,PASTRANA L,et al.Microbial production of hyaluronic acid from agro-industrial by-products:Molasses and corn steep liquor[J].Biochemical Engineering Journal,2017,117:181-187.
[27] AMADO I R,V ZQUEZ J A,PASTRANA L,et al.Cheese whey:A cost-effective alternative for hyaluronic acid production by Streptococcus zooepidemicus[J].Food Chemistry,2016,198:54-61.
ZQUEZ J A,PASTRANA L,et al.Cheese whey:A cost-effective alternative for hyaluronic acid production by Streptococcus zooepidemicus[J].Food Chemistry,2016,198:54-61.
[28] BLANK L M,HUGENHOLTZ P,NIELSEN L K.Evolution of the hyaluronic acid synthesis (has) operon in Streptococcus zooepidemicus and other pathogenic Streptococcius[J].Journal of Molecular Evolution,2008,67(1):13.
[29] HMAR R,PRASAD S,JAYARAMAN G,et al.Chromosomal integration of hyaluronic acid synthesis (has) genes enhances the molecular weight of hyaluronan produced in Lactococcus lactis[J].Biotechnology Journal,2014,9(12):1 554-1 564.
[30] CHIEN L J,LEE C K.Enhanced hyaluronic acid production in Bacillus subtilis by coexpressing bacterial hemoglobin[J].Biotechnology Progress,2007,23(5):1 017-1 022.
[31] PRASAD S,RAMACHANDRAN K,JAYARAMAN G.Transcription analysis of hyaluronan biosynthesis genes in Streptococcus zooepidemicus and metabolically engineered Lactococcus lactis[J].Applied Microbiology and Biotechnology,2012,94(6):1 593-1 607.
[32] YU H,STEPHANOPOULOS G.Metabolic engineering of Escherichia coli for biosynthesis of hyaluronic acid[J].Metabolic Engineering,2008,10(1):24-32.
[33] JIN P,KANG Z,YUAN P,et al.Production of specific-molecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168[J].Metabolic Engineering,2016,35:21-30.
[34] CHEN W,MARCELLIN E,HUNG J,et al.Hyaluronan molecular weight is controlled by UDP-N-acetylglucosamine concentration in Streptococcus zooepidemicus[J].Journal of Biological Chemistry,2009,284(27):1 800 7-1 801 4.
[35] JIA Y,ZHU J,CHEN X,et al.Metabolic engineering of Bacillus subtilis for the efficient biosynthesis of uniform hyaluronic acid with controlled molecular weights[J].Bioresource Technology,2013,132(132):427-431.
[36] 吴祥坤.产中等分子量透明质酸菌株的选育及发酵过程优化[D].济南:齐鲁工业大学,2016.
WU X K.Screening of moderate molecular weight hyaluronic acid producing strain and optimization of fermentation process[D].Jinan:Qilu University of Technology,2016.
[37] CHENG F,GONG Q,YU H,et al.High-titer biosynthesis of hyaluronic acid by recombinant Corynebacterium glutamicum[J].Biotechnology Journal,2015,11(4):574-584.
[38] XU P,LI L Y,ZHANG F M,et al.Improving fatty acids production by engineering dynamic pathway regulation and metabolic control[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(31):27-31.
[39] MCNERNEY M P,WATSTEIN D M,STYCZYNSKI M P.Precision metabolic engineering:The design of responsive,selective,and controllable metabolic systems[J].Metabolic Engineering,2015,31:123-131.
[40] 张晋宇.表达phbCAB基因对兽疫链球菌中乳酸及透明质酸产量的影响[D].北京:清华大学,2005.
ZHANG J Y.Effect of expressing PHB synthesis gens phbCAB gene on production of latate and hyaluronic acid by Streptococcus zooepidemicus[D].Beijing:Tsinghua University,2005.
[41] KUMARI K,TLAPAK-SIMMONS V,BAGGENSTOSS B,et al.The Streptococcal hyaluronan synthases are inhibited by sulfhydryl-modifying reagents,but conserved cysteine residues are not essential for enzyme function[J].The Journal of Biological Chemistry,2002,277(16):13 943-13 951.
[42] BINER O,TRACHSEL C,MOSER A,et al.Isolation,N-glycosylations and function of a hyaluronidase-like enzyme from the venom of the spider Cupiennius salei[J].PloS One,2015,10(1):e 0143 963.
[43] JIN P,KANG Z,ZHANG N,et al.High-yield novel leech hyaluronidase to expedite the preparation of specific hyaluronan oligomers[J].Scientific Reports,2014,4(1):4 471.
[44] VALCARCEL J,GARC A M R,VARELA U R,et al.Hyaluronic acid of tailored molecular weight by enzymatic and acid depolymerization[J].International Journal of Biological Macromolecules,2020,145:788-794.
A M R,VARELA U R,et al.Hyaluronic acid of tailored molecular weight by enzymatic and acid depolymerization[J].International Journal of Biological Macromolecules,2020,145:788-794.
[45] FOX J.A brief review of the scientific history of several lesser-known snake venom proteins:L-amino acid oxidases,hyaluronidases and phosphodiesterases[J].Toxicon:Official Journal of the International Society on Toxinology,2012,62(1):75-82.