柑橘是全世界种植面积最广且最为重要的水果品种之一,素有“水果之王”的美誉[1]。据资料显示,2018年中国柑橘产量为4 138.1万t[2]。因受消费习惯和柑橘品种分布及产量的影响,我国各柑橘加工产品所占比例存在较大差异。近年来以柑橘罐头进出口量占果蔬罐头比重较高,而尽管我国柑橘汁消费比例较低,但其进口量却呈现出上升的趋势,2018年,达到了约为9.7×104 t[3]的历史新高。继果汁和橘瓣罐头之后,柑橘果酒凭借着其独特的风味和营养保健功能逐步引起了消费者的青睐,对柑橘加工产品风味物质特别是增香技术的研究及优化成为企业和研究人员的关注热点。
β-葡萄糖苷酶(EC3.2.1.21)又称β-D葡萄糖苷水解酶,在增香领域具有潜在优势,于1837年首次在苦杏仁汁中发现[4],随后陆续在自然界多种生物体及一些尚未定义的物种中均有发现。所有的生物体内几乎都存在着β-葡萄糖苷酶,但其在不同的生物体中结构与组成不同[5]。它在微生物领域中作为一种重要的纤维素酶类,可应用于纤维素材料的生物降解和生物转化过程当中。此外,β-葡萄糖苷酶还在生物体的糖代谢途径中发挥着至关重要的作用,可以水解结合于末端、非还原性的β-D葡萄糖苷键并释放出β-D葡萄糖与相应的配基[6]。近年来,针对β-葡萄糖苷酶可以切断糖苷键合态香气物质中配基与糖基之间的糖苷键并释放出香气的特性被逐渐应用到食品的增香领域中。糖苷结合风味物质的研究起源于1969年FRANCIS等[7]对玫瑰花瓣中糖苷形式单萜醇进行的检测与研究。1993年进一步研究发现,大多数C13去甲基类异戊二烯挥发性化合物几乎都源于糖苷前体物衍生,糖苷结合风味物质的研究引起了科研人员的关注[8]。此后,人们对糖苷类芳香化合物的研究迅速增多,包括葡萄、茶、柑橘等。其中对于柑橘而言,β-葡萄糖苷酶不仅能够增加柑橘汁中香气物质的种类和含量[9],同时还可以和α-L-鼠李糖苷酶组成柚苷酶用于水解柑橘类果实当中重要的苦味物质柚皮苷,已有研究优化了柚苷酶对柑橘类果汁的最佳脱苦工艺且脱苦效果理想[10]。但对于β-葡萄糖苷酶的活性而言,柑橘加工过程中所处环境的pH,乙醇、葡萄糖、温度等都极大的限制了β-葡萄糖苷酶的活性进而影响了其增香效果。
为了提高β-葡萄糖苷酶在柑橘加工所处复杂环境下的活性及稳定性,更好地满足消费者对柑橘加工产品品质的要求,本文从β-葡萄糖苷酶的酶活性测定及增香和脱苦原理出发,进而综述了其在柑橘加工所处复杂环境中活性稳定化技术方面的研究现状,并展望了不同技术的应用前景。
1 β-葡萄糖苷酶的酶活力测定方法
酶活力测定方法与β-葡萄糖苷酶在柑橘加工过程中活性稳定化技术的研究紧密相联。选取一种适合的酶活测定方法不仅可以在酶活性稳定化技术研究中快速、准确地测定出相应酶活力,并且具有着较好的重现性。
目前,β-葡萄糖苷酶测定方法主要有以水杨苷为底物的分光光度法、以4-甲基伞形酮-β-D-葡萄糖苷(3-methylumbelliferyl-β-D-glucopyranoside,4-MUG)为底物的荧光法[11]及以对硝基苯-β-D-葡萄糖苷(4′-nitrophenyl-β-D-glucopyranoside,pNPG)为底物的比色法[12]。其中,分光光度法由于其适合检测酶解底物产生极微量的葡萄糖,故酶解底物过程中伴有的其他物质将容易影响其测定结果,检测灵敏度较差[13]。相比于实验过程中操作繁琐以4-MUG为底物的荧光法而言,以pNPG为底物的比色法因其在实验中具有简易的操作方式,较好的重现性及其快速,准确的测定结果而更为常用,但其两者酶解产物均可能受到一些与它们具有相同吸收波长物质的干扰,如具有蓝色背景的生物样品容易与4-MUG荧光法酶解产物的蓝色荧光发生重叠现象,pNPG比色法酶解后生成的黄色对硝基苯酚与柑橘汁及柑橘酒颜色相近,从而可能会影响400 nm左右对硝基苯酚的吸光度[14-15]。因此,当进行柑橘中β-葡萄糖苷酶酶活力测定过程中存在生色团干扰时,还可以通过测定其释放出的葡萄糖及释放出的酚类物质含量来计算其酶活力[16]。近期,WANG等[17]基于点击化学反应原理建立了一种以2-O-β-D-葡萄糖基-L-抗坏血酸为底物的β-葡萄糖苷酶酶活力测定方法,其因检测波长短于以pNPG为底物的比色法和以4-MUG为底物的荧光法而能有效避免部分体系在高于400 nm范围内的干扰,此为不同实际检测体系中β-葡萄糖苷酶活性的测定提供了新的选择方案。表1是不同来源β-葡萄糖苷酶的一些基本性质。
表1 不同来源β-葡萄糖苷酶的基本性质
Table 1 The basic properties of β-glucosidase from different sources
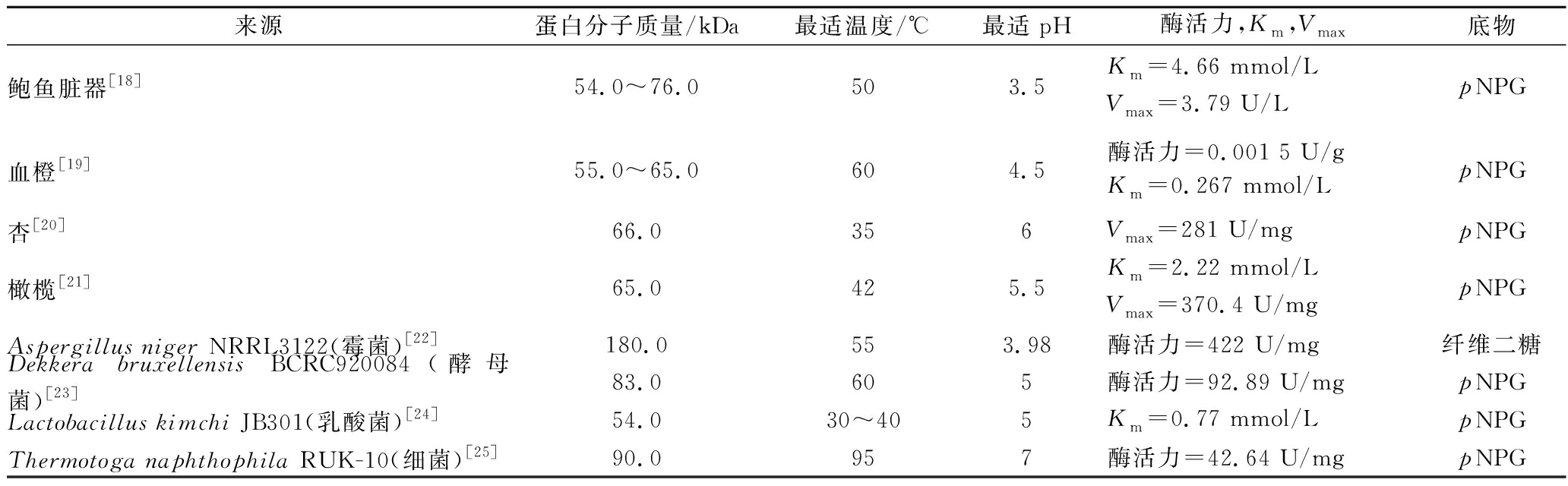
来源蛋白分子质量/kDa最适温度/℃最适pH酶活力,Km,Vmax底物鲍鱼脏器[18]54.0~76.0503.5Km=4.66 mmol/LVmax=3.79 U/LpNPG血橙[19]55.0~65.0604.5酶活力=0.001 5 U/gKm=0.267 mmol/LpNPG杏[20]66.0356Vmax=281 U/mgpNPG橄榄[21]65.0425.5Km=2.22 mmol/LVmax=370.4 U/mgpNPGAspergillus niger NRRL3122(霉菌)[22]180.0553.98酶活力=422 U/mg纤维二糖Dekkera bruxellensis BCRC920084(酵母菌)[23]83.0605酶活力=92.89 U/mgpNPGLactobacillus kimchi JB301(乳酸菌)[24]54.030~405Km=0.77 mmol/LpNPGThermotoga naphthophila RUK-10(细菌)[25]90.0957酶活力=42.64 U/mgpNPG
2 β-葡萄糖苷酶的增香及脱苦原理
香气影响着柑橘加工产品的品质,在柑橘加工过程中产品的脱苦和增香相辅相成,是加工技术的重要环节。β-葡萄糖苷酶酶解前后,红橙果汁中酸类、醇类、醛类在种类和含量上均有所上升,并基于果汁原有风味的基础上增添了安息香醛、3-蒈烯等风味物质,进而在感官评定表中显示果汁样品分值提升,表明β-葡萄糖苷酶在果汁的口感及风味方面具有良好的增香效果[9]。
柑橘的香气物质由可被人们感知到的游离态香气物质和只有经过酸解或酶解释放后才可以被人们感知到的以糖苷形式存在,且不具有挥发性的糖苷键合态香气物质所组成。其中较为重要的键合态香气物质是以萜烯类物质、C13降异戊二烯类物质及苯的衍生物为配基的糖苷键合态物质,β-葡萄糖苷酶能够水解糖苷键合态香气物质中配基与糖基之间的糖苷键,从而达到增香的目的,若水解过程中糖苷与双糖连接,则需要α-L-鼠李糖苷酶、α-阿拉伯糖苷酶或β-木糖苷酶等外切酶对其外糖切割以后,再由β-葡萄糖苷酶切割释放糖苷配体,水解过程如图1所示。
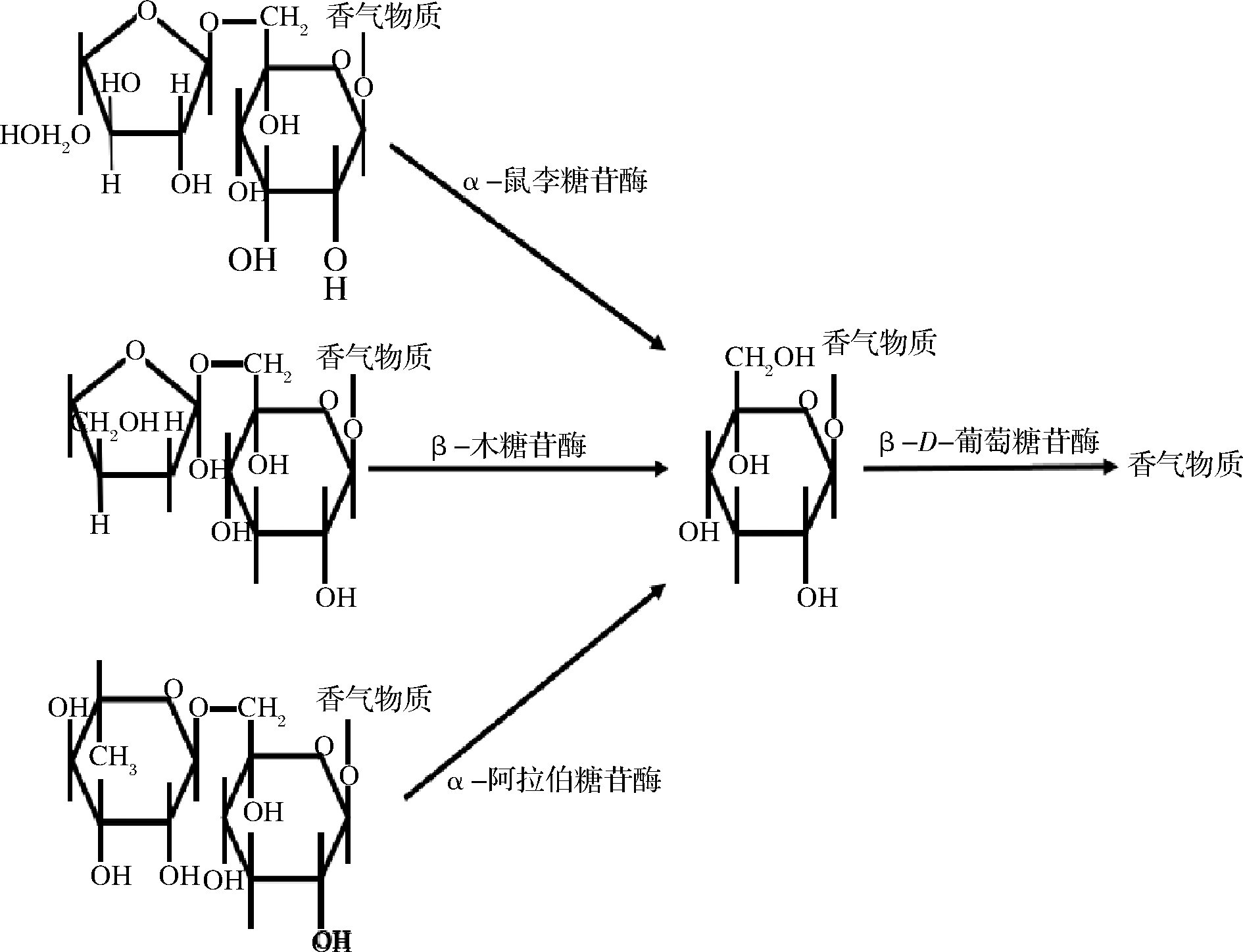
图1 糖苷键合态香气物质的水解过程
Fig.1 Hydrolysis of glycoside bound aroma compounds
此外,柑橘的脱苦同样也是柑橘增香过程中的关键,“后苦”现象是在柑橘果实经过放置或加工过程中产生的,严重影响产品的口感和风味,并掩盖了产品本身及其在加工过程中所产生的香味。柑橘中的苦味物质主要分为两大类,黄烷酮糖苷类化合物和三萜类化合物,柚皮苷和柠檬苦素分别为两者的代表性物质,且相比于柚皮苷而言,柠檬苦素苦味阈值很低,苦味约为柚皮苷苦味的20倍[26-27]。但柠檬苦素主要分布于果实的种子中[28],可以通过去除种子的方式使柠檬苦素类似物对柑橘苦味的影响程度大为降低。因此对于柚汁及一般带皮榨汁的柑橘类果实而言,柚皮苷为苦味的主要来源,利用柚苷酶酶解柚皮苷可脱苦,1938年首次在芹菜种子中分离得到柚苷酶[29],由α-L-鼠李糖苷酶和β-D-葡萄糖苷酶组成。柚皮苷首先被α-L-鼠李糖苷酶水解为樱桃苷和鼠李糖,其次在β-D-葡萄糖苷酶的作用下樱桃苷生成无苦味的柚皮素和葡萄糖,水解过程如图2所示。
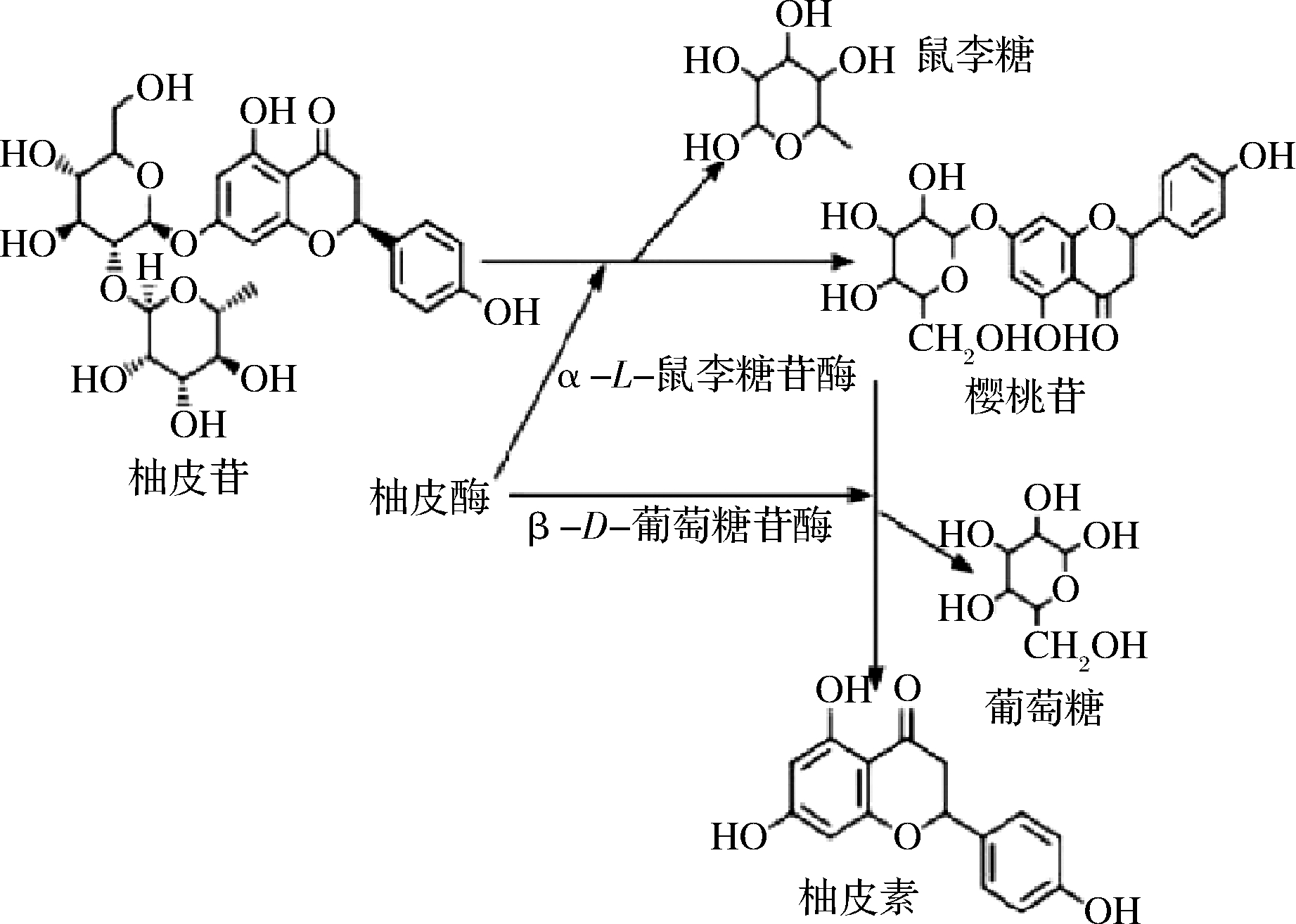
图2 柚皮苷在柚苷酶作用下水解过程
Fig.2 Hydrolysis of naringin under the action of naringinase
3 β-葡萄糖苷酶提高柑橘加工产品香气的应用
β-葡萄糖苷酶酶制剂的纯度、产量、活性及稳定性对柑橘加工产品的香气至关重要,直接影响着柑橘在加工过程中糖苷键合态香气物质水解效率的高低及脱苦效果。柑橘在加工过程中β-葡萄糖苷酶的活性、稳定性容易受到加工条件的影响导致增香效率的降低。目前,已有相关研究人员综述了葡萄酒发酵过程中如何提升β-葡萄糖苷酶的活性及稳定性[30],但在柑橘加工所处复杂环境中β-葡萄糖苷酶活性稳定化技术研究较少,故可选用微生物产酶的方式、酶的固定化技术、酿酒酵母表面展示技术及酶的半理性设计技术来提高β-葡萄糖苷酶在柑橘加工所处复杂环境中的活性及稳定性,进而提升其在柑橘加工过程中的增香效率。
3.1 微生物产酶
目前,由于微生物来源的β-葡萄糖苷酶酶活性、稳定性普遍高于植物的,故为采用微生物来源的β-葡萄糖苷酶[31-32]。近年来,针对柑橘在酿酒过程中缺乏专用的酵母菌株造成柑橘果酒风味不佳,研究人员在柑橘专用酵母菌株筛选方面的研究日益增多,其中菌株的酿酒特性、挥发性物质浓度、气味活性值、感官评价得分均作为柑橘酒发酵候选品种筛选的关键指标[33]。
在柑橘果酒发酵过程中,相比于有些可以产生丰富β-葡萄糖苷酶的非酿酒酵母而言[34],由于酿酒酵母普遍不具备合成β-葡萄糖苷酶的能力而导致柑橘果酒经商业酿酒酵母菌株发酵后风味不佳[35]。非酿酒酵母菌菌株与酿酒酵母菌菌株联合发酵产生的挥发性香气物质,特别是高级醇和酯类物质含量高,有利于改善柑橘酒的感官品质[36]。对此,HU等[37]为筛选适合柑橘酒发酵的非酿酒酵母菌菌株,采用理化方法和固相微萃取-气相色谱-质谱联用技术对10株非酿酒酵母菌菌株的酿酒特性和挥发性组分进行了研究,并选择了挥发性物质浓度、气味活性值、感官评价得分均较高的Hanseniaspora uvarum、Hanseniaspora opuntiae、Hanseniaspora occidentalis、Pichia kudriavzevii 及 Torulaspora delbrueckii作为柑橘酒发酵的候选品种。而对葡萄酒中微生物来源的β-葡萄糖苷酶增香效果研究时发现,微生物来源的β-葡萄糖苷酶在葡萄酒生产当中具有较高的稳定性,且经过β-葡萄糖苷酶处理的葡萄酒中萜烯浓度高于未经处理的葡萄酒,萜烯酚作为葡萄酒中赋予新鲜果香的主要单萜类物质之一[38],其含量比未经处理的对照组显著增加了约27倍[39]。但柑橘酒方面还鲜有文献能够像对葡萄酒中微生物来源的β-葡萄糖苷酶增香效果进行研究,原因可能在于柑橘酒脱苦工艺的不完善导致脱苦效果不理想且柑橘汁糖分较低,不利于自然发酵等,因此需深入分析并评估其在柑桔产品中的增香效果。
3.2 β-葡萄糖苷酶的固定化
β-葡萄糖苷酶的固定化是指将酶限制于一定区域内仍可保留其催化活性并可重复回收使用的一项技术,其中β-葡萄糖苷酶不仅作为一种高效的糖苷水解催化剂,而且作为柚苷酶的重要组成部分,在柑橘果汁的脱苦方面也发挥了至关重要的作用。因此,良好载体的筛选既可以拓宽固定化后β-葡萄糖苷酶pH值和活化温度范围,并且可使固定化后的柚苷酶在酸性pH和低温条件下的活性最适,从而使其在保持橙汁营养和感官特性的前提下适用于柑橘汁等酸性环境,这对于更好地提升柑橘加工产品的香气及柚子汁脱苦效果的改善具有潜在的应用价值[40-41]。近期,β-葡萄糖苷酶稳定性随着新型固定化材料Eupergit C的发现得到了很大的提升,且可以耐受酒精度为18%、pH<3.0及葡萄糖质量浓度为100 g/L的溶液[42],相对于葡萄酒所处发酵环境相似的柑橘酒而言,新型材料Eupergit C的发现基本克服了β-葡萄糖苷酶在柑橘加工产品中应用的壁垒。此外,将柚苷酶固定在经过戊二醛活化的壳聚糖微球上对柚子汁进行脱苦时,柚子汁的脱苦效果和感官品质均得到了较大改善[45]。
3.3 酿酒酵母表面展示技术
固定化技术为保持酶的稳定性提供了一条有前景的途径,但固定材料的高成本和复杂的纯化过程阻碍了其大规模的工业应用。细胞表面展示技术可以避免繁琐的纯化和固定化过程,使表达的多肽以融合蛋白的形式展现在核糖体、病毒或细胞表面进而筛选、进化具有优良特性的基因编码肽分子。
酿酒酵母表面展示系统的步骤是将酿酒酵母细胞壁蛋白与目标蛋白融合,然后由胞壁蛋白通过共价键或非共价键形式连接在细胞壁上。ZHANG等[43]为评估细胞表面展示技术在葡萄酒增香领域中的应用潜力,利用不同的启动子(GPD和SED1)和糖基磷脂酰肌醇(GPI)锚定区(Sag1、SED1和Cwp2)在酿酒酵母的细胞表面构建了β-葡萄糖苷酶显示系统,并对典型酿酒条件下显示的β-葡萄糖苷酶的稳定性及其在发酵结束时作为全细胞生物催化剂水解糖苷的能力做了研究,研究结果表明与商业酶相比,显示的β-葡萄糖苷酶不仅在pH 3.0和葡萄糖质量浓度低于25 g/L时均可表现出较高活性,而且具有更好的释放游离萜醇的能力。因此,相比于传统固定化技术而言,其优势是可以在其表面形成与细胞内环境相类似的保护层,当把β-葡萄糖苷酶展示在酿酒细胞表面时,不仅降低了葡萄糖对GH3家族β-葡萄糖苷酶活性的抑制作用,并且增加了酶的稳定性[44-45]。由于柑橘酒所处的发酵环境与葡萄酒所处发酵环境相似,因此表面展示系统对于提升柑橘加工产品香气方面提供了新的可行性解决方案。
3.4 β-葡萄糖苷酶的半理性设计
半理性设计是继理性设计之后出现的一种酶的定向进化方法,与酶的固定化、酿酒酵母展示技术相比而言,其优势是不需要高成本的固定材料和繁琐的纯化过程,同时避免了因柑橘加工过程中产生的酒精会抑制酵母生长而对β-葡萄糖苷酶固定效果造成的影响[46]。其作用原理是对β-葡萄糖苷酶基因进行定点突变以获得可以在柑橘加工所处复杂环境条件下保持较高活性及稳定性的酶[47]。近年来,基于提高β-葡萄糖苷酶葡萄糖耐受性、乙醇耐受性及低温耐受性开展了相关研究以期为半理性设计提供理论基础。
3.4.1 葡萄糖耐受性
鉴于葡萄糖由于其反馈抑制作用会限制β-葡萄糖苷酶的实际应用效果,基于在葡萄糖与β-葡萄糖苷酶互作机理,对β-葡萄糖苷酶进行定向改造非常重要。GIUSEPPE等[48]为探讨GH1家族葡萄糖耐受性显著高于GH3家族的问题,通过分析比较2个家族β-葡萄糖苷酶晶体结构的差异得出活性位点的可及性和葡萄糖耐受性之间存在着明显的相关性,GH3家族的β-葡萄糖苷酶葡萄糖耐受性相比于GH1家族较低的原因在于其袋口宽大且催化通道较浅有助于葡萄糖分子更多地进入到酶活性位点。此与KONAR等[49]、SUSHANT等[50]的研究结果相似,表明了活性位点袋口的宽窄与催化通道的长短可能直接影响着葡萄糖进入β-葡萄糖苷酶活性位点的难易程度,且当葡萄糖、疏水性残基积聚在活性位点袋口处时将会阻碍葡萄糖分子与活性位点结合,从而使得β-葡萄糖苷酶对葡萄糖的耐受性升高。因此,β-葡萄糖苷酶的葡萄糖耐受性取决于葡萄糖进入β-葡萄糖苷酶活性位点的难易程度,可通过阻碍葡萄糖分子与活性位点结合来提高β-葡萄糖苷酶对葡萄糖的耐受性进而在很大程度上保留酶活力。
3.4.2 乙醇耐受性
乙醇作为一种有机溶剂,β-葡萄糖苷酶的活性会随着柑橘酒发酵过程中乙醇含量的升高而降低。研究发现,溶液里大部分酒类酒球菌菌株中β-葡萄糖苷酶活性在酒精体积分数达到4%时已经受到强烈抑制[51],而导致酶活性损失的潜在因素之一为β-葡萄糖苷酶的构象随着有机溶剂浓度的升高而发生了变化[52]。对此,提高β-葡萄糖苷酶乙醇耐受性可以通过对β-葡萄糖苷酶中稳定性较差的氨基酸进行定点突变,加强氨基酸之间的疏水力和氢键来提高蛋白质结构当中的非共价相互作用力以使得β-葡萄糖苷酶对乙醇的耐受性增强[47]。此外,KARNAOURI等[53]研究用甲醇当有机溶剂时,β-葡萄糖苷酶能够有效合成甲基-葡萄糖苷键,并且酶本身在体积分数50%的乙醇中具有较高的稳定性,这表明了β-葡萄糖苷酶对乙醇的耐受性可能与其存在着更强的亲核试剂发生的转糖基化活性及转糖苷能力有关。
3.4.3 低温耐受性
柑橘酒的发酵温度通常低于30 ℃,而β-葡萄糖苷酶活性的最适宜温度通常高于45 ℃,这对适合于低温发酵的柑橘酒而言是一个极具挑战性的问题,如何通过提高β-葡萄糖苷酶的低温耐受性改善柑橘酒的风味至关重要。研究人员尝试从嗜冷和耐冷细菌中分离出属于GH3[54]和GH1家族的几种冷适应β-葡萄糖苷酶,并通过对比嗜冷菌中的β-葡萄糖苷酶BglU与嗜温及嗜热菌中β-葡萄糖苷酶BglB和GlyTn的晶体结构及编码序列,将BglU结构中特有的L3环缩短,其在低温下的催化活性将会降低;若将299位置上的His突变为Tyr,酶的最适温度将会提高[55]。相反地,将BglB的Tyr301突变为His,酶的最适温度将会降低[56]。SUN等[57]从海洋细菌中克隆了一个可以编码冷适应β-葡萄糖苷酶的新基因(Bgl)并置于大肠杆菌中表达,且经Ni2+层析纯化,纯化后的β-葡萄糖苷酶最适温度为25~45 ℃,这可能是因为其特殊的基因编码序列决定了其特有的结构,而这种结构致使其拥有了较好的低温耐受性,但对于纯化后该β-葡萄糖苷酶的晶体结构还有待进一步研究。
4 展望
香气和苦味物质作为柑橘汁品种的重要指标,使得β-葡萄糖苷酶在提升柑橘汁香气和脱苦方面备受关注。然而,柑橘酒的研究难以像葡萄酒一样进入产业化而是一直停留在试验阶段,其原因不仅在于缺乏专属酵母,导致柑橘酒风味不佳及脱苦效果不理想,而且柑橘汁糖分较低不利于自然发酵。通过对β-葡萄糖苷酶的纵深研究可能会对柑橘加工产品品质的提升带来新的契机。因此,未来应继续着重于通过提高β-葡萄糖苷酶在复杂环境中活性及稳定性,进而提高柑橘加工产品香气释放和降低苦味来加深研究,这有助于为改善柑橘加工产品品质,并进一步推进增香技术的工业化应用提供科学依据。
[1] XU Q,CHEN L L,RUAN X A,et al.The draft genome of sweet orange (Citrus sinensis)[J].Nature Genetics,2013,45(1):59-66.
[2] 国家统计局.中国统计年鉴-主要农产品产量[M].中国统计出版社,北京数通电子出版社,2019.
National Bureau of statistics.China Statistical Yearbook-output of major agricultural products [M].China Statistics Press:Beijing Shutong Electronic Publishing House,2019.
[3] 张放.2018年中国主要柑桔加工品进出口统计简析[J].中国果业信息,2019,36(12):18-31.
ZHANG F.Statistical analysis of China’s main citrus processed products import and export in 2018[J].China Fruit News,2019,36(12):18-31.
[4] RODRIGUES P D O,SANTOS B V D,COSTA L,et al.Xylanase and β-glucosidase production by Aspergillus fumigatus using commercial and lignocellulosic substrates submitted to chemical pre-treatments[J].Industrial Crops and Products,2017,95(1):453-459.
[5] ALBERTO G P,WINAI S,PAU L K.The effects of high hydrostatic pressure on β-glucosidase,peroxidase and polyphenoloxidase in red raspberry (Rubus idaells) and strawberry (Fragaria×ananassa)[J].Food Chemistry,2004,88(1):7-10.
[6] 周林芳,江波,张涛,等.糖苷水解酶第3家族β-葡萄糖苷酶的研究进展[J].食品工业科技,2017,38(14):340-345.
ZHOU L F,JIANG B,ZHANG T,et al.Research progress of β-glucosidases of glycoside hydrolase family 3[J].Science and Technology of Food Industry,2017,38(14):340-345.
[7] FRANCIS M J O,ALLCOCK C.Geraniol β-d-glucoside;occurrence and synthesis in rose flowers[J].Phytochemistry,1969,8(8):1 339-1 347.
[8] WINTERHALTER P,SCHREIER P.Biotechnology:Challenge for the Flavour Industry.In:Acree TE,Treanishi R(eds)Flavour science.ACS,Washington,1993:225
[9] 高倩. β-葡萄糖苷酶的提取纯化及其改善廉江红橙果汁风味的研究[D].湛江:广东海洋大学,2017.
GAO Q.Extraction and purification of β-glucosidase and its improvement on the flavor of red-orange juice abstract[D].Zhanjiang:Guangdong Ocean University,2017.
[10] 盛金凤,何雪梅,孙健,等.柚皮苷酶脱苦工艺优化及对金桔汁品质的影响[J].食品工业,2019,40(7):126-131.
SHENG J F,HE X M,SUN J,et al,Optimization of naringinase debittering and effect on nutritional quality of kumquat juice[J].The Food Industry,2019,40(7):126-131.
[11] STROPPIANO M,CALEVO M G,CORSOLINI F,et al.Validity of b-d-glucosidase activity measured in dried blood samples for detection of potential Gaucher disease patients[J].Clinical Biochemistry Ottawa Then New York Pergamon Press Elsevier Science,2014,47(13-14):1 293-1 296.
[12] CHAN A K N,NG A K L,NG K K Y,et al.Cloning and characterization of two novel β-glucosidase genes encoding isoenzymes of the cellobiase complex from Cellulomonas biazotea[J].Gene,2018,642:367-375.
[13] 陈守文,陈九武,赵山.利用黑曲霉β-葡萄糖苷酶改善葡萄酒的风味[J].中国酿造,1999,18(3):17-19.
CHEN S W,CHEN J W,ZHAO S.Improving wine flavor by Aspergillus niger β-glucosidase[J].China Brewing,1999,18(3):17-19.
[14] ROBINSON D.The fluorimetric determination of β-glucosidase:Its occurrence in the tissues of animals,including insects[J].The Biochemical Journal,1956,63(1):39-44.
[15] SERDIUK I,RESZKA M,MYSZKA H,et al.Flavonol-based fluorescent indicator for determination of β-glucosidase activity[J].RSC Advances,2016,6(48):42 532-42 536.
[16] CAMERON R G,MANTHEY J A,BAKER R A,et al.Purification and characterization of a beta-glucosidase from Citrus sinensis var.valencia fruit tissue[J].Journal of Agricultural & Food Chemistry,2001,49(9):4 457-4 462.
[17] WANG L W,MA J M,CHENG X,et al.Determination of β-glucosidase activity based on enzyme-triggered click chemistry[J].Chinese Journal of Organic Chemistry,2018,38(10):2775.
[18] 罗小娟,杨娟,陈锦权,等.鲍鱼脏器β-葡萄糖苷酶提取工艺的优化[J].安徽农学通报,2016,22(18):16-19;48.
LUO X J,YANG J,CHEN J Q,et al.Purification of β-glucosidase from abalone viscera and its enzymological character[J].Anhui Agricultural Science Bulletin,2016,22(18):16-19;48.
[19] BARBAGALLO R N,PALMERI R,FABIANO S,et al.Characteristic of β-glucosidase from Sicilian blood oranges in relation to anthocyanin degradation[J].Enzyme & Microbial Technology,2007,41(5):570-575.
[20] BHALLA T C,ASIF M,SMITA K.Purification and characterization of cyanogenic β-glucosidase from wild apricot (Prunus armeniaca L.)[J].Process Biochemistry,2017,58:320-325.
[21] HATIBE ERTURK KARA,SINAN S,TURAN Y.Purification of beta-glucosidase from olive (Olea europaea L.) fruit tissue with specifically designed hydrophobic interaction chromatography and characterization of the purified enzyme[J].Journal of Chromatography.B,Analytical Technologies in the Biomedical and Life Sciences,2011,879(19):1 507-1 512.
[22] ABDELLA A,EL-BAZ A F,IBRAHIM I A,et al.Biotransformation of soy flour isoflavones by Aspergillus niger NRRL 3122 β-glucosidase enzyme[J].Natural Product Research,2017,32(2):1-10.
[23] KUO H P,WANG R,HUANG C Y,et al.Characterization of an extracellular β-glucosidase from Dekkera bruxellensis for resveratrol production[J].Journal of Food & Drug Analysis,2018,26(1):163-171.
[24] KO J A,PARK J Y,KWON H J,et al.Purification and functional characterization of the first stilbene glucoside-specific β-glucosidase isolated from Lactobacillus kimchi[J].Enzyme and Microbial Technology,2014,67(12):59-66.
[25] FANSI K,JINGWEN Y,ZHEN Z,et al.Gene cloning and molecular characterization of a β-glucosidase from Thermotoga naphthophila RUK-10:An effective tool for synthesis of galacto-oligosaccharide and alkyl galactopyranosides[J].Chemical Research in Chinese University,2015,31(5):774-780.
[26] 王松林,彭荣,崔榕,等.类柠檬苦素生物转化与脱苦研究进展[J].食品科学,2015,36(9):279-283.
WANG S L,PENG R,CUI R,et al.Biotransformation and debittering of limonoids:An overview[J].Food Science,2015,36(9):278-283.
[27] 晏敏,周宇,贺肖寒,等.柑橘籽中柠檬苦素及类似物的生物活性研究进展[J].食品与发酵工业,2018,44(2):290-296.
YAN M,ZHOU Y,HE X H,et al.Research progress on the bioactivity of limonin and its analogues in Citrus[J].Food and Fermentation Industries,2018,44(2):290-296.
[28] MCINTOSH C A,MANSELL R L.Distribution of limonin during the growth and development of leaves and branches of Citrus paradisi[J].Journal of Agricultural & Food Chemistry,1983,31(2):319-325.
[29] 姚辉.产柚苷酶菌株的选育及柚子汁酶法脱苦工艺的研究[D].福州:福建农林大学,2009.
YAO H.Screening and mutation breeding of the naringinase producing strain and the study of the debittering technology by naringinase[D].Fuzhou:Fujian Agriculture and Forestry University,2009.
[30] 张阳,江璐,郭志君,等.利用β-葡萄糖苷酶提高葡萄酒香气的研究进展[J].现代食品科技,2020,36(4):316-324.
ZHANG Y,JIANG L,GUO Z J,et al.Improving wine aroma by using beta-glucosidase:A review[J].Modern Food Science and Technology,2020,36(4):316-324.
[31] AGRAWAL R,VERMA A K,SATLEWAL A.Application of nanoparticle-immobilized thermostable β-glucosidase for improving the sugarcane juice properties[J].Innovative Food Science & Emerging Technologies,2016,33(2):472-482.
[32] ÜNAL MÜ, ENER A.Biochemical properties of β-glucosidase from Turkish Hac
ENER A.Biochemical properties of β-glucosidase from Turkish Hac halilo
halilo lu apricot (Prunus armenica L.) as affected by harvest year[J].LWT-Food Science and Technology,2017,79(6):190-196.
lu apricot (Prunus armenica L.) as affected by harvest year[J].LWT-Food Science and Technology,2017,79(6):190-196.
[33] LIU R,ZHANG Q H,CHEN F S,et al.Analysis of culturable yeast diversity in spontaneously fermented orange wine,orange peel and orangery soil of a Ponkan plantation in China[J].Annals of Microbiology,2015,65(4):2 387-2 391.
[34] BELDA I,RUIZ J,ALASTRUEY-IZQUIERDO A,et al.Unraveling the enzymatic basis of wine “Flavorome”:A phylo-functional study of wine related yeast species[J].Frontiers in Microbiology,2016,7(1):12.
[35] SABEL A,MARTENS S,PETRI A,et al.Wickerhamomyces anomalus AS1:A new strain with potential to improve wine aroma[J].Annals of Microbiology,2014,64(2):483-491.
[36] HU L,LIU R,WANG X,ZHANG X.The sensory quality improvement of citrus wine through Co-Fermentations with selected non-saccharomyces yeast strains and Saccharomyces cerevisiae[J].Microorganisms,2020,8(3):323.
[37] HU L L,WANG J,JI X A,et al.Selection of non-Saccharomyces yeasts for orange wine fermentation based on their enological traits and volatile compounds formation[J].Journal of Food Science and Technology,2018,55(10):4 001-4 012.
[38] MARIA A V,JUAN U I,ANA B P.Enhancement of aroma in white wines using a β-glucosidase preparation from Debaryomyces pseudopolymorphus (A-77)[J].Food Biotechnology,2007,21(2):181-194.
[39] BAFFI M A,TOBAL T,LAGO J H G,et al.Wine aroma improvement using a β-glucosidase preparation from Aureobasidium pullulans[J].Applied Biochemistry & Biotechnology,2013,169(2):493-501.
[40] ZHOU Y,PAN S,WU T,et al.Optimal immobilization of β-glucosidase into chitosan beads using response surface methodology[J].Electronic Journal of Biotechnology,2013,16(6):6.
[41] BODAKOWSKA-BOCZNIEWICZ J,GARNCAREK Z.Immobilization of naringinase from Penicillium decumbens on chitosan microspheres for debittering grapefruit juice[J].Molecules,2019,24(23):4 234.
[42] PAULA GONZ LEZ-POMBO,FARI?A L,CARRAU F,et al.A novel extracellular β-glucosidase from Issatchenkia terricola:Lsolation,immobilization and application for aroma enhancement of white Muscat wine[J].Process Biochemistry,2011,46(1):385-389.
LEZ-POMBO,FARI?A L,CARRAU F,et al.A novel extracellular β-glucosidase from Issatchenkia terricola:Lsolation,immobilization and application for aroma enhancement of white Muscat wine[J].Process Biochemistry,2011,46(1):385-389.
[43] ZHANG Y,MIN Z,QIN Y,et al.Efficient display of Aspergillus niger β-glucosidase on Saccharomyces cerevisiae cell wall for aroma enhancement in wine[J].Journal of Agricultural and Food Chemistry,2019,67(18):5 169-5 176.
[44] KAYA M,ITO J,KOTAKA A,,et al.Isoflavone aglycones production from isoflavone glycosides by display of β-glucosidase from Aspergillus oryzae on yeast cell surface[J].Applied Microbiology and Biotechnology,2008,79(1):51-60.
[45] SAUER M,STEIGER M,MATTANOVICH D,et al.Bioprocessing of Renewable Resources to Commodity Bioproducts[M].Bisaria VS,2014.
[46] 王佳堃,孙中远,刘建新.酵母细胞表面展示技术[J].动物营养学报,2011,23(11):1 847-1 853.
WANG J K,SUN Z Y,LIU J X.Recent advances in yeast cell-surface display technology[J].Chinese Journal of Animal Nutrition,2011,23(11):1 847-1 853.
[47] FANG W,YANG Y,ZHANG X,et al.Improve ethanol tolerance of β-glucosidase Bgl1A by semi-rational engineering for the hydrolysis of soybean isoflavone glycosides[J].Journal of Biotechnology,2016,227:64-71.
[48] GIUSEPPE P O D,SOUZA T D A C B,SOUZA F H M,et al.Structural basis for glucose tolerance in GH1 β-glucosidases[J].Acta Crystallographica Section D,Biological Crystallography,2014,70(Pt 6):1 631-1 639.
[49] KONAR S,SINHA SK,DATTA S,et al.Probing the effect of glucose on the activity and stability of β-glucosidase:An all-atom molecular dynamics simulation investigation[J].ACS omega,2019,4(6):11 189-11 196.
[50] SINHA SK,DAS S,KONAR S,et al.Elucidating the regulation of glucose tolerance in a β-glucosidase from Halothermothrix orenii by active site pocket engineering and computational analysis[J].International Journal of Biological Macromolecules,2020,156:621-632.
[51] 杨芮,吕珍,文彦,等.酒类酒球菌中β-葡萄糖苷酶性质研究[J].食品科学,2013,34(23):206-211.
YANG R,LYU Z,WEN Y,et al.β-glycosidase activity of Oenococcus oeni[J].Food Science,2013,34(23):206-211.
[52] DOUKYU N,OGINO H.Organic solvent-tolerant enzymes[J].Biochemical Engineering Journal,2010,48(3):270-282.
[53] KARNAOURI A,TOPAKAS E,PASCHOS T,et al.Cloning,expression and characterization of an ethanol tolerant GH3 β-glucosidase from Myceliophthora thermophila[J].Peerj,2013,1(1):e46.
[54] MAO X X,HONG Y Z,SHAO Z Z,et al.A novel cold-active and alkali-stable β-glucosidase gene isolated from the marine bacterium martelella mediterranea[J].Applied Biochemistry and Biotechnology,2010,162(8):2 136-2 148.
[55] MIAO L L,HOU Y J,FAN H X,et al.Molecular structural basis for the cold-adaptedness of the psychrophilic β-glucosidase BglU in Micrococcus antarcticus[J].Applied & Environmental Microbiology,2016,82(7):2 021-2 030.
[56] SOUZA V P,CEC LIA M,IKEGAMI,et al.Protein thermal denaturation is modulated by central residues in the protein structure network[J].The FEBS Journal,2016,283(6):1 124-1 138.
LIA M,IKEGAMI,et al.Protein thermal denaturation is modulated by central residues in the protein structure network[J].The FEBS Journal,2016,283(6):1 124-1 138.
[57] SUN J J,WANG W,YAO Y,et al.Overexpression and characterization of a novel cold-adapted and salt-tolerant GH1 β-glucosidase from the marine bacterium Alteromonas sp.L82[J].Journal of Microbiology,2018,56(9):656-664.