大曲作为白酒发酵生产的动力,有丰富的微生物群落,其中枯草芽孢杆菌(Bacillus subtilis)作为大曲主要功能菌之一,能在白酒酿造过程中增加吡嗪类物质含量[1],并降低酒体中高级醇含量[2];能产生蛋白酶与淀粉酶,有利于风味物质的生成[3];还能抑制链霉菌生长,进而减少土臭素以控制白酒的土臭味[4],因而对白酒的风味和品质有重要影响。
近年来,对枯草芽孢杆菌的研究主要在产酶、产香的功能性[5],包括对枯草芽孢杆菌产淀粉酶、蛋白酶等多种酶的产酶条件进行优化[6-7]。此外,通过枯草芽孢杆菌与不同酵母菌种在小麦基质上共发酵,发现乙醇和氨基酸的合成代谢存在差异[8];通过在高粱基质上发酵,发现不同的发酵阶段有不同的特征风味[9];通过对枯草芽孢杆菌所产酱香的研究,发现其不仅与多种香味物质相关,蛋白酶也起重要作用[10-11]。目前,对枯草芽孢杆菌的研究大多在纯菌或熟料基质条件下进行[9,12],在混菌生料发酵体系中进行发酵时枯草芽孢杆菌的影响却鲜有报道。
本研究将浓香型大曲中分离的枯草芽孢杆菌接种到小麦基质中,并进行不同培养条件下的生料发酵,了解枯草芽孢杆菌在不同培养条件下的扰动作用,以此为枯草芽孢杆菌应用于大曲强化提供数据支持。
1 材料与方法
1.1 材料与试剂
原料:浓香型大曲中分离鉴定的1株枯草芽孢杆菌 Bacillus subtilis A1;软质小麦。
试剂:乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,Na2EDTA)、Na2HPO4、NaH2PO4、蜗牛酶、溶菌酶、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),生工生物工程(上海)股份有限公司;Tris-平衡酚(pH>7.8)、牛肉膏蛋白胨培养基(生化试剂),上海博威生物医药有限公司;三氯甲烷(分析纯)、无水乙醇(分析纯),成都市科隆化学品有限公司;异戊醇(分析纯),天津市致远化学试剂有限公司;异丙醇(分析纯),天津市津东天正精细化学试剂厂。
1.2 仪器与设备
QL-861漩涡振荡器,江苏海门市麒麟医用仪器厂;LYNX6000高速冷冻离心机,美国Bio-rad公司;POWERPAC电泳仪、ChemiDocXRS+凝胶成像分析系统,美国Bio-rad公司;Illumina MiSeq 高通量测序平台,美国Illumina公司。
1.3 试验方法
1.3.1 枯草芽孢杆菌对混菌固态发酵体系的扰动实验
种子液的制备:将枯草芽孢杆菌接种至斜面,37 ℃培养2 d后用去离子水洗脱,稀释至OD600=1的菌悬液待用。
小麦固态发酵培养基的制备:称取1 000 g小麦(水分质量分数约为10%)于干净容器中,加入50 mL 80 ℃水,润料4 h;粉碎至小麦烂心不烂皮,且细粉率约为20%。分别称取粉碎后的小麦240 g于4个白瓷盘中,对照组加水量为发酵体系的20%(即60 mL);实验组中种子液的添加量为发酵体系的10%(即30 mL),再加水30 mL,调整发酵体系中的水分含量约为40%。混合均匀后以8层纱布封口。
实验所取的温度/湿度条件是根据浓香型大曲在生产过程中各阶段的发酵条件及枯草芽孢杆菌的耐热性所设定的。实验的枯草芽孢杆菌所生长的原始环境为浓香型大曲,大曲的最初发酵温度/湿度约为 25 ℃/95%,再结合大曲生产过程中各阶段的发酵条件选取5个发酵条件,即发酵温度/湿度为25 ℃/95%、35 ℃/85%、43 ℃/70%、50 ℃/60%和58 ℃/40%,分别进行5组生料发酵,分别记为YA、YB、YC、YD和YE。每个条件下设 2 个空白组、2 个实验组,生料发酵48 h。
1.3.2 总DNA提取和测序
DNA的提取采用改良的CTAB法,借助酶,反复冻融,用酚∶氯仿∶异戊醇(25∶24∶1,体积比)抽提等操作提取大曲中微生物的总DNA[14-15]。真菌用引物SSU0817F(5′-TTAGCATGGAATAATRRAATAGGA-3′)和1196R(5′-TCTGGACCTGGTGAGTTTCC-3′)对V5-V7区进行扩增。细菌用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增16S rRNA V4区。基因库测序由深圳微生太科技有限公司提供,采用Illumina MiSeq平台对测序样本进行双端测序。
1.3.3 数据分析
与NCBI的GenBank进行BLAST比对,确定细菌、真菌序列的分类信息,获得门和属水平下的种类及相对丰度[16]。α多样性用Chaol和Shannon指数来计算,以评价样品微生物群落的生物多样性和丰富度[17]。相关性网络分析采用SPSS 20.0计算所选OTU之间的Spearman相关系数(ρ),选择|ρ|>0.6的相关微生物利用Cytoscape 3.5.1构建相关网络。以高质量序列为基础,利用PICRUSt预测微生物功能[18]。
2 结果与分析
2.1 枯草芽孢杆菌对混菌发酵体系微生物菌群α多样性的影响
α多样性反映了单个样品内部物种的多样性[19],以Chao1和Shannon来描述各组微生物群落的α多样性[20]。Chao1 指数反映样品中群落的丰富度,即简单指群落中物种的数量,而不考虑群落中每个物种的丰度情况,Shannon 指数反映群落的多样性,受样品群落中物种丰富度和物种均匀度的影响[21]。整体来看,枯草芽孢杆菌扰动后,细菌群落在温度/湿度为50 ℃/60%和58 ℃/40%时丰富度增加,58 ℃/40%时多样性增加。真菌群落的丰富度和多样性略有降低。将得到的α多样性指数结合分组信息,使用Wilcox Test去精确比较了各个组间的显著差异,如图1所示。枯草芽孢杆菌扰动前后在不同发酵条件下,细菌和真菌群落的α多样性没有显著差异,表明枯草芽孢杆菌生物扰动造成的真菌和细菌群落丰富度和多样性的变化不显著。
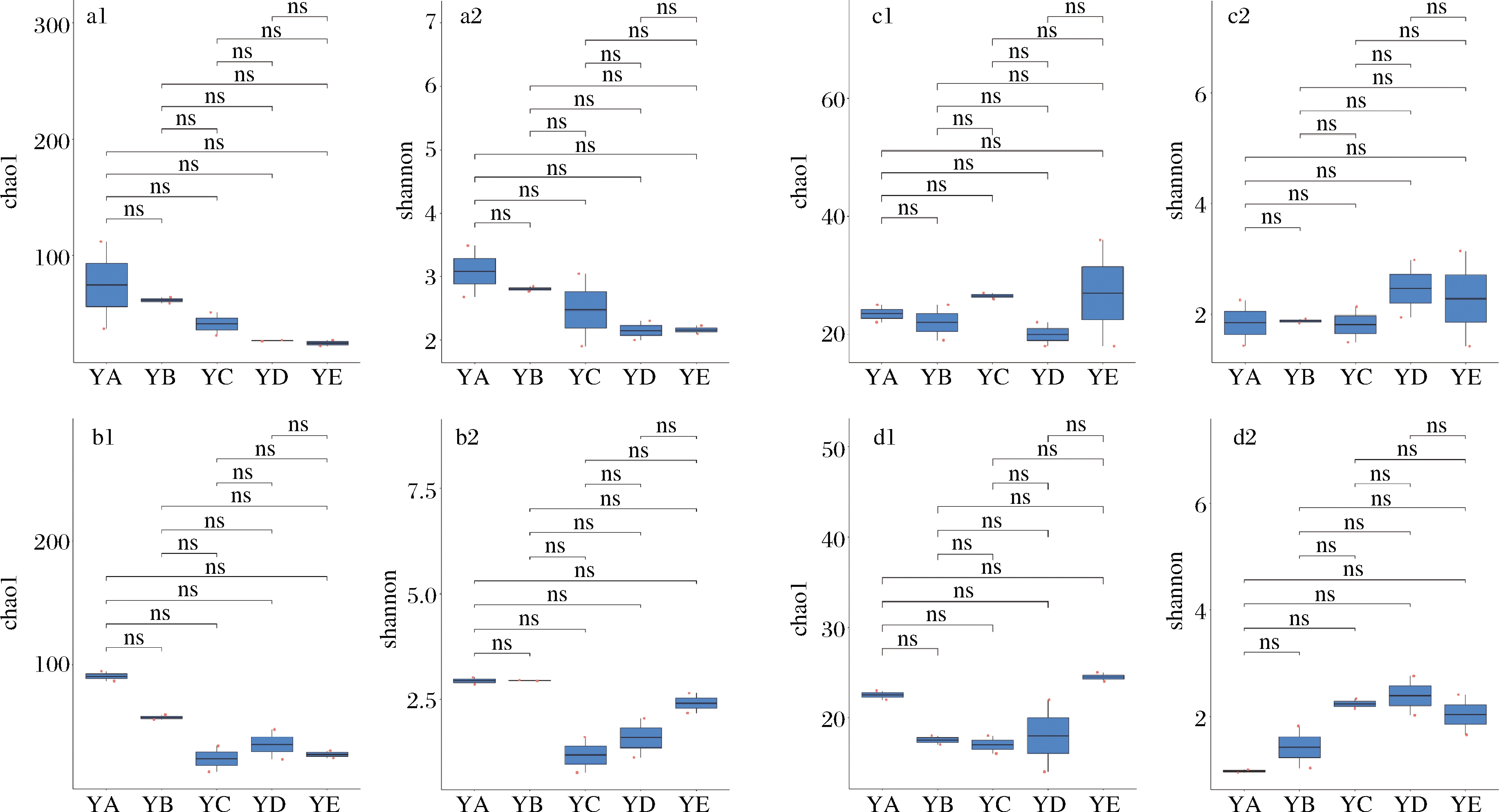
a-自然发酵时各培养条件下细菌的α多样性;b-枯草芽孢杆菌扰动后各培养条件下细菌的α多样性;
c-自然发酵时各培养条件下真菌的α多样性;d-枯草芽孢杆菌扰动后各培养条件下真菌的α多样性
图1 枯草芽孢杆菌扰动对α多样性的影响
Fig.1 Effects of B.subtilis disturbance on α diversity
注:α多样性主要以Chao1(如a1、b1、c1、d1所示)和Shannon(如a2、b2、c2、d2所示)指数来表征
2.2 枯草芽孢杆菌对混菌发酵体系微生物菌群结构的影响
枯草芽孢杆菌对微生物属级群落组成及相对丰度的生物扰动效应如图2所示。不同培养条件下样品中的细菌和真菌群落对枯草芽孢杆菌扰动反应不同。其中优势菌属(相对丰度组成以50%以上为优势属[22])变化主要如下。

a-各培养条件下细菌的物种组成;b-各培养条件下真菌的物种组成
图2 枯草芽孢杆菌扰动前后属水平的物种组成
Fig.2 Species composition of genus level before and after B.subtilis disturbance
注:a1和b1是自然发酵的,a2和b2是枯草芽孢杆菌扰动后的
枯草芽孢杆菌扰动后总体表现为:在温度/湿度为25 ℃/95%培养下相对丰度增加的有未知曲霉属(unspecified-Aspergillus)、横梗霉属(Lichtheimia)和肠杆菌属(Enterobacter),依次增加36.6%、1.3%和44.8%;在温度/湿度为35 ℃/85%培养下相对丰度增加的有(unspecified-Aspergillus)、毕赤酵母属(Pichia)、未知酵母菌属(unspecified-Saccharomycetales)、Lichtheimia和芽孢杆菌属(Bacillus),依次增加4.9%、71.1%、0.2%、19.8%和35.5%;在温度/湿度为43 ℃/70%培养下有所增加的有Pichia、unspecified-Saccharomycetales和Bacillus,依次增加23.6%、30.3%和35.5%;在温度/湿度为50 ℃/60%培养下相对丰度增加的有unspecified-Aspergillus、unspecified-Saccharo-mycetales和Enterobacter,依次增加12.8%、10.9%和5.0%;在温度/湿度为58 ℃/40%培养下相对丰度增加的有unspecified-Saccharomycetales、Lichtheimia和Enterobacter,依次增加20.8%、4.7%和0.2%。在枯草芽孢杆菌扰动后才成为优势菌属的有:在温度/湿度为25 ℃/95%培养下的Enterobacter,在温度/湿度为43 ℃/70%培养下的Bacillus和在温度/湿度为58 ℃/40%培养下的unspecified-Saccharomycetales。
2.3 枯草芽孢杆菌对混菌发酵体系微生物菌种间相互作用的影响
微生物相互作用被认为是支撑微生物结构的重要因素[23],也可能是决定目前属相对丰度变化的主要因素[22],利用样品中的所有微生物OTU进行网络分析。如图3所示,自然发酵时,细菌中有37个属鉴定了193对相关性,其中170对正相关。真菌中有20个属鉴定出22对相关性,其中17对正相关。枯草芽孢杆菌扰动后,物种间相互作用发生了改变。细菌有35个属鉴定出186对相关性,其中有152对正相关。真菌中有16个属鉴定出11对相关性,包括8对正相关。具体表现为:自然发酵时,与Bacillus呈负相关的细菌属有Enterobacter、葡萄球菌属(Staphylococcus)、不动杆菌属(Acinetobacter)、梭菌属(Clostridium)、泛菌属(Pantoea)、坂崎肠杆菌属(Cronobacter)、片球菌属(Pediococcus)、克雷伯氏菌(Klebsiella)、欧文氏菌属(Erwinia)、特拉布斯氏菌属(Trabulsiella)、魏斯氏菌属(Weissella)和乳球菌属(Lactococcus),共计12个;与之呈正相关的是芽孢杆菌属(Brevibacillus)。枯草芽孢杆菌扰动后,与Bacillus呈负相关的细菌属多了5个,依次是拉恩氏菌属(Rahnella)、糖杆菌属(Saccharibacillus)、明串珠菌属(Leuconostoc)、鞘氨醇单胞菌属(Sphingobacterium)和产吲哚金黄杆菌属(Chryseobacterium);比之少了Cronobacter。自然发酵时Pichia仅与Clavispora_Candida_clade呈正相关,枯草芽孢杆菌扰动使其多了与Aspergillus,假丝酵母(Candida_Lodderomyces_clade)的正相关,及与根霉(Rhizopus),镰刀菌(Fusarium)的负相关。

a1-自然发酵时细菌的相互作用;a2-枯草芽孢杆菌扰动后细菌的相互作用;b1-自然发酵时真菌的相互作用;b2-枯草芽孢杆菌扰动后真菌的相互作用
图3 枯草芽孢杆菌扰动前后属分类水平物种相互作用网络图
Fig.3 The network diagram of species interaction of genera before and after B.subtilis disturbance
2.4 枯草芽孢杆菌对微生物菌群功能的影响
基于KEGG数据库,采用PICRUSt预测微生物功能[18]。同时,对不同培养条件下的样品的KEGG通路组成进行了分析,结果如图4所示。
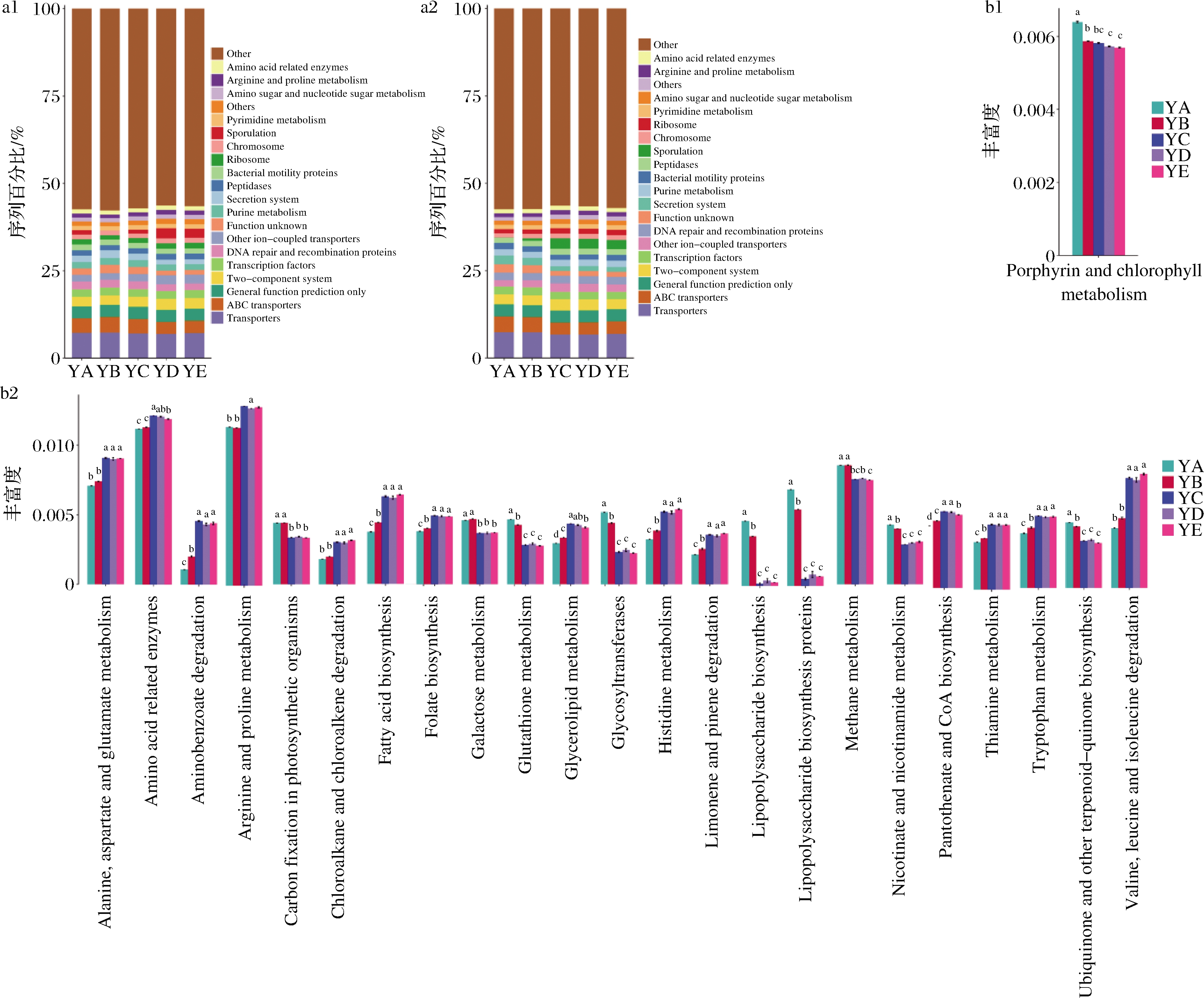
a1-自然发酵时的代谢功能组成;a2-枯草芽孢杆菌扰动后的代谢功能组成;
b1-自然发酵时不同培养条件下差异显著的代谢功能;b2-枯草芽孢杆菌扰动后不同培养条件下差异显著的代谢功能
图4 枯草芽孢杆菌扰动在不同培养条件下的代谢功能及代谢通路差异
Fig.4 The metabolic function and metabolic pathway of B.subtilis disturbance under different culture conditions
不同培养条件下,微生物菌群的代谢功能存在差异,尤其是在枯草芽孢杆菌扰动后,其差异代谢功能增多。自然发酵时,温度/湿度为35 ℃/85%培养下微生物群落中分泌系统(secretion system)和未知功能(function unknown)高度表达。枯草芽孢杆菌扰动后,分泌系统(secretion system)和未知功能(function unknown)在温度/湿度为25 ℃/95%和35 ℃/85%下高度表达,其他离子-耦合转运体(other ion-coupled transporters),两个-组件系统(two-component system)在25 ℃/95%和35 ℃/85%以及43 ℃/70%中表达更高。
将KEGG功能注释和分组信息相结合,利用ANOVA+Duncan和Dunn test分析了微生物群落预测功能在组间是否有显著性差异。如图4-b1所示,自然发酵下,仅有卟啉和叶绿素代谢(porphyrin and chlorophyll metabolism)通路在不同培养条件下存在显著差异。枯草芽孢杆菌扰动后,有更多代谢通路在不同培养条件下的样品中存在差异,在温度/湿度为43 ℃/70%和50 ℃/60%以及58 ℃/40%的培养条件下,丰度较高的代谢通路主要有氨基酸相关酶(amino acid related enzymes)、精氨酸和脯氨酸代谢(arginine and proline metabolism)、孢子形成(sporulation)、转录机制(transcription machinery)。在该培养条件下,丰度更低的代谢通路主要有分泌系统(secretion system)、核糖体合成(ribosome biogenesis)、未知功能(function unknown)、ABC转运蛋白(ABC transporters)。
在代谢通路显著差异图可知,在较高温度下,脂多糖生物合成(lipopolysaccharide biosynthesis)和脂多糖生物合成蛋白(lipopolysaccharide biosynthesis proteins)表达减少,会影响革兰氏阴性细菌的细胞膜[24];孢子代表芽孢杆菌属细胞内休眠,以响应环境胁迫,这是杆菌孢子逃避损伤的策略[25-26],因此在温度较高时,芽孢杆菌属丰度增加,孢子形成(sporulation)功能高度表达;较高的温度能诱导精氨酸代谢,导致多胺和脯氨酸的积累[27],而脯氨酸可以作为渗透调节物质来维持细胞的形状、代谢功能,稳定蛋白的结构、酶的活性,保持膜的通透性[28]。
3 结论与讨论
本研究在发酵温度/湿度为25 ℃/95%、35 ℃/85%、43 ℃/70%、50 ℃/60%和58 ℃/40%的条件下,基于混菌固态发酵体系,研究了浓香型大曲中分离获得的枯草芽孢杆菌的生长代谢特性。通过分析枯草芽孢杆菌扰动前后微生物群落多样性、微生物群落结构、微生物间的相互作用及PI CRUST预测的代谢功能和通路的差异,解析了枯草芽孢杆菌菌株对多菌共酵体系的扰动作用。结果表明,接种枯草芽孢杆菌会显著的影响固态混菌发酵体系,使得各微生物菌属的相对丰度改变,但仅在枯草芽孢杆菌扰动后才成为优势菌属的有:在温度/湿度为25 ℃/95%培养下的肠杆菌属(Enterobacter),在温度/湿度为43 ℃/70%培养下的芽孢杆菌属(Bacillus)和在温度/湿度为58 ℃/40%培养下的未知酵属(Unspecified-Saccharomycetales)。枯草芽孢杆菌扰动后,在6种优势菌属中除横梗霉属(Lichtheimia)外的优势菌属互作增多。枯草芽孢杆菌扰动后,微生物群落的分泌系统和未知功能在温度/湿度为25 ℃/95%和35 ℃/85%下高度表达,其他离子一耦合转运体,两个一组件系统在25 ℃/95%和35 ℃/85%以及43 ℃/70%中表达更高。这些数据表明枯草芽孢杆菌在固态混菌发酵体系中起到了至关重要的作用,也为深入研究枯草芽孢杆菌在浓香型大曲中的应用提供了重要的数据。
[1] 范文来,徐岩.白酒功能因子与品质安全问题[J].酿酒科技,2012,2(3):7-12.
FAN W L,XU Y.Review of functional factors and quality safety factors of Baijiu(Chinese liquor)[J].Liquor-Making Science & Technology,2012,2(3):7-12.
[2] 施小明,徐岩,崔凤元,等.枯草芽孢杆菌在白酒生产中的应用[J].酿酒科技,2012(2):49-53.
SHI X M,XU Y,CUI F Y,et al.Study on the application of B.subtilis in the production of liquor[J].Liquor-Making Science & Technology,2012(2):49-53.
[3] BEAUMONT M.Flavouring composition prepared by fermentation with Bacillus spp.[J].International Journal of Food Microbiology,2002,75(3):189-196.
[4] ZHI Y,WU Q,DU H,et al.Biocontrol of geosmin-producing Streptomyces spp.by two Bacillus strains from Chinese liquor[J].International Journal of Food Microbiology,2016,231:1-9.
[5] 袁庆云.酱香型白酒发酵过程中微生物的功能研究[J].酿酒,2016,43(4):15-20.
YUAN Q Y.Research microbial functions in the fermentation process of Maotai-flavor liquor[J].Liquor Making,2016,43(4):15-20.
[6] 高永生,朱丽云,朱贵州,等.枯草芽孢杆菌产酶规律及酶学性质研究[J].安徽农业科学,2011,39(19):11 964-11 965;11 968.
GAO Y S,ZHU L Y,ZHU G Z,et al.Study on the production rule and enzymatic property of amylase produced by Bacillus subtilis[J].Journal of Anhui Agricultural Science,2011,39(19):11 964-11 965;11 968.
[7] 王晓阁.枯草芽孢杆菌研究进展与展望[J].中山大学研究生学刊(自然科学·医学版),2012,33(3):17-26.
WANG X G.Research progress and prospect of Bacillus subtilis[J].Journal of the Graduates SunYat-Sen University(Natural Science Medicine),2012,33(3):17-26.
[8] 黄实宽,陈雄,姚娟,等.小麦基质下枯草芽孢杆菌与酵母共发酵代谢特征[J].中国酿造,2020,39(5):157-161.
HUANG S K,CHEN X,YAO J,et al.Metabolic characteristics of Bacillus subtilis and yeast co-fermentation in wheat flour[J].China Brewing,2020,39(5):157-161.
[9] 王西,沈毅,张亚东,等.产香枯草芽孢杆菌在酱香型白酒生产中的应用[J].酿酒科技,2018(7):70-75.
WANG X,SHEN Y,ZHANG Y D,et al.Application of aroma-producing B.subtilis in the production of Jiangxiang Baijiu[J].Liquor-Making Science & Technology,2018(7):70-75.
[10] 邵元龙,谢和.两株枯草芽孢杆菌蛋白酶的提取及产酱香研究[J].郑州轻工业学院学报,2005,20(3):51-53.
SHAO Y L,XIE H.Study on protease purifying and soysauce-like aroms producing of two strains of Bacillus subtilis[J].Journal of Zhengzhou Institute of Light Industry,2005,20(3):51-53.
[11] 林群,董胜,付秋香,等.产香风味枯草芽孢杆菌(Bacillus subtilis)分离及发酵代谢产物分析[J].酿酒科技,2013(11):30-32.
LIN Q,DONG S,FU Q X,et al.Isolation of aroma-producing Bacillus subtilis and analysis of its fermentation metabolites[J].Liquor-Making Science & Technology,2013(11):30-32.
[12] 刘文龙,刘胜利,王兴吉,等.枯草芽孢杆菌产中性蛋白酶发酵条件的优化[J].化学与生物工程,2019,36(1):47-52.
LIU W L,LIU S L,WANG X J,et al.Optimization in fermentation conditions of Bacillus subtilis production neutral protease[J].Chemistry & Bioengineering,2019,36(1):47-52.
[13] ROZALI S N M,MILANI E A,DEED R C,et al.Bacteria,mould and yeast spore inactivation studies by scanning electron microscope observations[J].International Journal of Food Microbiology,2017,263:17-25.
[14] WILLIAMSON R C,TOYE A M.Glycophorin A:Band 3 aid[J].Blood Cells,Molecules,and Diseases,2008,41(1):35-43.
[15] 夏玙,罗惠波,周平,等.不同处理方式的大曲真菌群落差异分析[J].食品科学,2018,39(22):166-172.
XIA Y,LUO H B,ZHOU P,et al.Comparison of fungal communities in Daqu with different treatments[J].Food Science,2018,39(22):166-172.
[16] 王艳云,郭笃发.应用高通量测序技术研究柽柳、獐茅土壤真菌多样性[J].生物技术通报,2016,32(7):48-53.
WANG Y Y,GUO D F.The application of 454 high-throughput sequencing technology into anlaysing the diversity of soil fungi in the field planting Tamarix chinensis and Angiospermae[J].Biotechnology Bulletin,2016,32(7):48-53.
[17] WANG Y,SHENG H F,HE Y,et al.Comparison of the levels of bacterial diversity in freshwater,intertidal wetland,and marine sediments by using millions of Illumina tags[J].Applied & Environmental Microbiology,2012,78(23):8264-8271.
[18] LANGILLE M G I,ZANEVELD J,CAPORASO J G,et al.Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J].Nature Biotechnology,2013,31(9):814-821.
[19] 宁亚丽,吴跃,何嫱,等.基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性[J].食品科学,2019,40(16):107-114.
NING Y L,WU Y,HE Q,et al.Analysis of microbial community diversity in Chinese Korean traditional rice wine and its starter culture using high-throughput sequencing[J].Food Science,2019,40(16):107-114.
[20] HE G,DONG Y,HUANG J,et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT,2019,111:1-8.
[21] 吴燕燕,钱茜茜,李来好,等.基于Illumina MiSeq技术分析腌干鱼加工过程中微生物群落多样性[J].食品科学,2017,38(12):1-8.
WU Y Y,QIAN X X,LI L H,et al.Microbial community diversity in dried-salted fish during processing revealed by Illumina MiSeq sequencing[J].Food Science,2017,38(12):1-8.
[22] WANG P,WU Q,JIANG X J,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].International Journal of Food Microbiology,2017,250:59-67.
[23] SMID E J,LACROIX C.Microbe-microbe interactions in mixed culture food fermentations[J].Current Opinion in Biotechnology,2013,24(2):148-154.
[24] 李秋颍,王敏,吴斌琰,等.植物识别脂多糖的分子机制研究进展[J].植物生理学报,2019,55(4):387-392.
LI Q Y,WANG M,WU B Y,et al.Lipopolysacchaaride perception and signaling inplant immunity[J].Plant Physiology Journal,2019,55(4):387-392
[25] ERRINGTON J.Bacillus subtilis sporulation:Regulation of gene expression and control of morphogenesis[J].Microbiological Reviews,1993,57(1):1-33.
[26] POPHAM D L,HELIN J,COSTELLO C E,et al.Muramic lactam in peptidoglycan of Bacillus subtilis spores is required for spore outgrowth but not for spore dehydration or heat resistance[J].Proceedings of the National Academy of Sciences,1996,93(26):15 405-15 410.
[27] BOKHARY S U F,WANG L,ZHENG Y,et al.Pre-storage hot water treatment enhances chilling tolerance of zucchini(Cucurbita pepo L.) squash by regulating arginine metabolism[J].Postharvest Biology and Technology,2020,166:111 229
[28] 王丽媛,丁国华,黎莉.脯氨酸代谢的研究进展[J].哈尔滨师范大学自然科学学报,2010,26(2):84-90.
WANG L Y,DING G H,LI L.Progress in synthesis and metabolism of proline[J].Natural Science Journal of Harbin Normal University,2010,26(2):84-89.