扣囊复膜酵母(Saccharomycopsis fibuligera)又称拟内孢霉,属于子囊菌门(Ascmycota)酵母亚门(Saccharomycotina)下酵母纲(Saccharomycetes)酵母目(Saccharomycetales)酵母科(Saccharomycetaceae)复膜酵母属(Saccharomycopsis),常被发现于具有淀粉质的底物中,由于该酵母为多极芽接和菌丝体形成繁殖而被认为是一种食源性的双态性真菌[1]。在汾酒大曲[2]、红曲[3]、浓香型白酒大曲[4]、小曲酒曲药[5]、酱香型大曲[6]以及发酵前期的酒醅[7-8]等各种酒曲中均有扣囊复膜酵母的存在。周森等[8-9]采用传统分离方法结合高通量测序对11份清香大曲微生物进行系统研究,在真菌组成中,扣囊复膜酵母是11份大曲样品的主要真菌,其数量远高于丝状真菌和其他酵母菌,占大曲样品的51.48%~98.32%;马凯等[10]在汾酒大曲堆中随机从上、中、下取 3 份大曲样品,分离出81 株真菌并进行了基于 ITS 基因序列的分子生物学鉴定,结果表明在汾酒大曲中分布的酵母菌中,扣囊复膜酵母是优势酵母菌种。然而,扣囊复膜酵母在混菌发酵体系中的作用却鲜有报道。
浓香型大曲生产具有自然接种混菌固态发酵的特点,其微生物来自于粮食原料及环境,而浓香型大曲主要原料是小麦[11]。微生物的生长代谢受温度、湿度、pH值等环境条件影响,还与大曲微生物之间的相互作用有关[12]。浓香型大曲发酵过程中发现存在扣囊复膜酵母[13]。本研究将从浓香型大曲中分离获得的扣囊复膜酵母接种于小麦培养基中,空白组为对照,以浓香型大曲制曲过程中重要环境参数温度、湿度变化为依据,设置发酵条件进行生料发酵。通过研究不同发酵条件下多菌共酵体系中扣囊复膜酵母对微生物多样性、发酵醅理化参数及重要酶活力、挥发性风味物质等代谢产物的影响,分析扣囊复膜酵母对微生物菌群的扰动作用,为扣囊复膜酵母的强化应用及挥发性风味代谢物的解析提供基础数据。
1 材料与方法
1.1 材料与试剂
小麦,市售的软质小麦;扣囊复膜酵母菌株,分离自浓香型大曲;Na2EDTA、Na2HPO4、NaH2PO4、蜗牛酶、溶菌酶、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),生工生物工程(上海)股份有限公司;异丙醇,天津市津东天正精细化学试剂厂;三氯甲烷,成都市科隆化学品有限公司;Tris-平衡酚(pH>7.8)、酵母浸出粉胨葡萄糖琼脂培养基(yeast extract peptone dextrose medium,YPD)(生化试剂),上海博威生物医药有限公司。
1.2 仪器与设备
萃取头(50/30 μm DVB/CAR on PDMS),上海安谱实验科技股份有限公司;Agligent 7890A—5975B型气相色谱-质谱联用仪,美国安捷伦公司。
1.3 实验方法
1.3.1 固态发酵培养基的制作
所有固态培养基使用同一批小麦,用80 ℃水润粮4 h,润粮时翻拌均匀,使小麦充分吸收水分;然后进行粉碎加水搅拌,小麦粉碎要烂皮不烂心,粗细比4∶1,分别将小麦粉分装在陶瓷托盘中,补充水分使加水量为总质量的30%,最后用8层纱布封住陶瓷托盘。
1.3.2 扣囊复膜酵母菌菌株对微生物菌群的扰动实验
分别设定发酵温度/湿度为25 ℃/95%、28 ℃/90%、35 ℃/85%、38 ℃/80%、43 ℃/75%,每个条件下设2个空白组和2个实验组。实验组加入从浓香型大曲中分离到的扣囊复膜酵母菌。实验所取温度和湿度是根据浓香型大曲在曲房中生产过程及扣囊复膜酵母菌的最高耐受条件设定。所分离的扣囊复膜酵母菌所生长的原始环境为大曲,浓香型大曲的最初发酵温度/湿度分别为25 ℃/95%,所以开始发酵培养条件为25 ℃/95%,而在分离实验时,大曲培养条件为43 ℃/75%时没有分离到这个菌,表明此条件下扣囊复膜酵母在大曲中已经没有或极少,所以结合大曲生长环境选取5个发酵条件。作图分析时对应上述发酵条件将空白组标记为KJa0、KJB0、KJc0、KJd0、KJe0,实验组标记为KJa1、KJB1、KJc1、KJd1、KJe1。
1.3.3 固态发酵物中微生物总DNA的提取
采用文献报道的方法提取固态发酵物中微生物总基因组DNA[14]。16S扩增子测序使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3~V4可变区进行PCR扩增。ITS扩增子测序使用ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GC-TGCGTTCTTCATCGATGC-3′)对ITS区进行扩增。
1.3.4 理化及酶活检测
水分、pH、酸度、液化力、糖化力、发酵力、酒化力的测定参照QB/T 4257—2011《酿酒大曲通用分析方法》,还原糖含量的测定参考GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》。
1.3.5 挥发性物质的测定
采用GC-MS对样品进行测定。挥发性化合物的测定在20 mL顶空瓶中加入2 g大曲样品、饱和食盐水。加入20 μL 0.022 64 mg/mL乙酸正戊酯为内标。平衡温度和萃取温度为60 ℃,平衡10 min,萃取50 min,解析3.5 min。仪器条件:色谱条件:DB-WAX毛细管色谱柱(60 m×0.25 mm,0.25 μm);载气:氦气(He);流量:1 mL/min,不分流,进样口温度250 ℃;柱温:起始温度40 ℃保持1 min,以5 ℃/min升温至180 ℃保持5 min,再以8 ℃/min升温至230 ℃保持10 min,运行时间50.25 min。质谱条件:接口温度250 ℃,离子源温度230 ℃,电离方式为电子电离源,电子能量70 eV,四级杆温度150 ℃,传输线温度290 ℃,扫描质量范围20~550 amu。
1.3.6 生物信息学与统计分析
生物信息分析流程使用QIIME2推荐的DADA2方法来去噪去嵌合,为了方便理解,仍以OTU代表这个扩增特征的代表序列。进化树的绘制由R语言ggtree包完成。选取关注的OTU代表序列进行系统进化分析(每个属选取一个丰度最高的OTU作为代表,之后再选取丰度最高的前50个属)绘制进化关系树图,同时结合OTU在各个分组的绝对丰度进行热图可视化展示。RDA的分析主要依赖R语言VEGAN包,以及用ggplot2进行可视化。
2 结果与分析
2.1 扣囊复膜酵母菌对多菌共酵体系微生物群落多样性的影响
2.1.1 样本微生物群落测序深度评价
如图1所示,通过观察物种的Shannon稀释曲线都趋于饱和,这表明测序数据足以评估微生物生态系统的微生物群落。
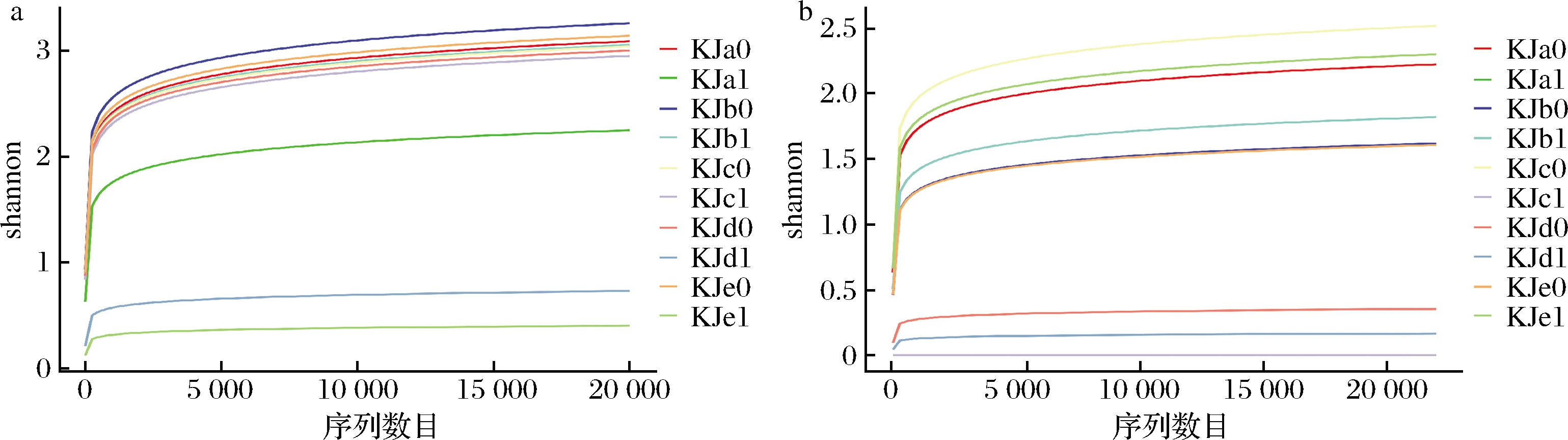
a-细菌;b-真菌
图1 样品稀释曲线
Fig.1 Rarefaction curves of OTUs for all samples
2.1.2 不同发酵条件下扣囊复膜酵母菌对微生物菌群多样性的影响
采用高通量测序技术对小麦固态多菌种固态发酵体系进行研究,得到空白组和实验组中微生物群落情况,并分别计算Shannon、Faith’s Phylogenetic Di-versity及Chao1指数来评估微生物群落的丰富度和多样性,如表1所示。空白组的Chao1、Faith’s Phylogenetic Diversity指数数据明显低于实验组且Shannon指数数值大部分高于实验组,结合分析发现接种扣囊复膜酵母菌后,小麦多菌种发酵体系中物种丰富度明显降低且均匀度变低。表明实验组接种扣囊复膜酵母菌后对小麦多菌种发酵体系中的微生物发生了明显的扰动。
表1 Alpha多样性指数
Table 1 Alpha diversity index
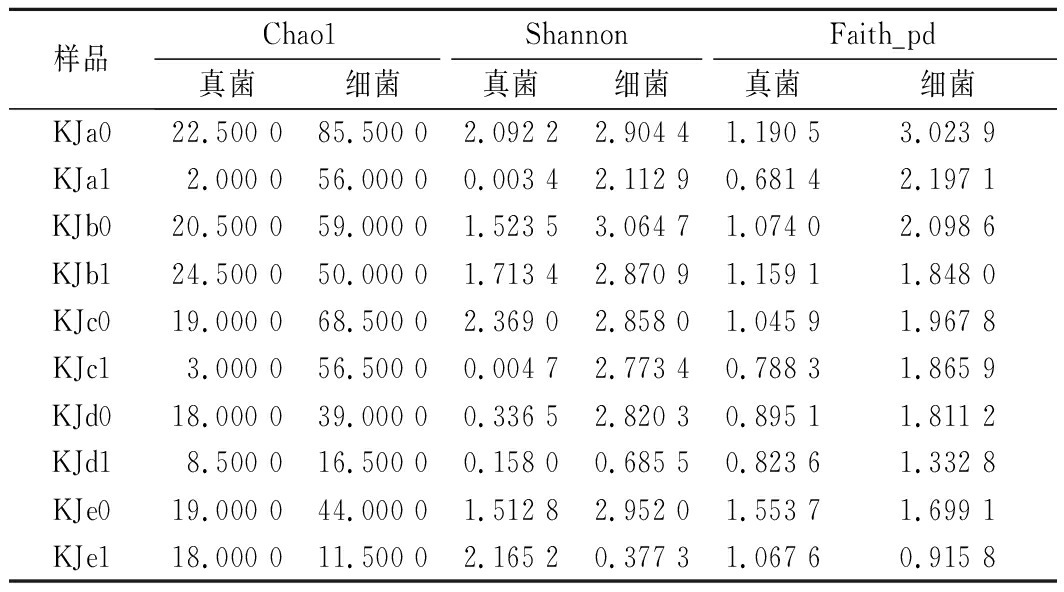
样品Chao1ShannonFaith_pd真菌细菌真菌细菌真菌细菌KJa022.500 085.500 02.092 22.904 41.190 53.023 9KJa12.000 056.000 00.003 42.112 90.681 42.197 1KJb020.500 059.000 01.523 53.064 71.074 02.098 6KJb124.500 050.000 01.713 42.870 91.159 11.848 0KJc019.000 068.500 02.369 02.858 01.045 91.967 8KJc13.000 056.500 00.004 72.773 40.788 31.865 9KJd018.000 039.000 00.336 52.820 30.895 11.811 2KJd18.500 016.500 00.158 00.685 50.823 61.332 8KJe019.000 044.000 01.512 82.952 01.553 71.699 1KJe118.000 011.500 02.165 20.377 31.067 60.915 8
2.2 扣囊复膜酵母菌对多菌共酵体系微生物群落组成的影响
如图2所示,空白组与实验组菌种中优势微生物组成大致相同,丰度前20的菌种都占微生物总量的98%左右。但相对丰度占比情况发生了明显变化,实验组与空白组相比毕赤酵母属(Pichia)、横梗霉属(Lichtheimia)、肠杆菌属(Enterobacter)、片球菌属(Pediococcus)、魏斯氏菌(Weissella)相对丰度占比明显降低,分别减低了9%、18%、17%、8%、1%,复膜酵母属(Saccharomycopsis)、芽孢杆菌属(Bacillus)相对丰度占比明显增多,分别增多了45%、44%。值得注意的是,实验组中复膜酵母属也并非在所有发酵条件下都增加,只有在25 ℃/95%、35 ℃/85%、43 ℃/75%这3个发酵条件下所在的复膜酵母属有明显增加,而在28 ℃/90%、38 ℃/80% 的发酵条件下的复膜酵母属有明显降低的情况。且在28 ℃/90%发酵条件下,多菌种共发酵体系中未分类的曲霉菌属(Unspecified_Aspergillaceae)有增加了48.24%,与毕赤酵母属共占比88.40%;在38 ℃/80%发酵条件下,多菌种共发酵体系中毕赤酵母属独占99%。

a-真菌;b-细菌;c-PCA
图2 属水平的物种相对丰度
Fig.2 Relative abundances of microbial community at genus level
将其微生物丰度变化情况进行主成分分析(principal component analysis,PCA),如图2-c所示,可以观察到实验组和空白组微生物组成有明显变化,解释度PCA1+PCA2达到81.29%。
2.3 扣囊复膜酵母对固态混菌培养基微生物菌群相互作用的影响
对小麦多菌种共发酵体系中微生物群落进行分析,空白组和实验组有明显的差异。为了进一步探讨接种扣囊复膜酵母是否影响物种间的相互作用,构建空白组和实验组微生物群落的相关网络。分别选取其中相对丰度前10的细菌和真菌,如图3所示。在实验组中芽孢杆菌属(Bacillus)与其他微生物产生了显著负相关性,而在空白组中芽孢杆菌属并没有此特性。在空白组中毕赤酵母属(Pichia)与未分类曲霉菌属(Unspecified_Aspergillaceae)、未分类格孢腔菌属(Unspecified_Pleosporales)、根霉属(Rhizopus)呈现显著负相关性,而实验组中与复膜酵母属(Saccharomycopsis)呈现显著负相关性。而假丝酵母属(Candida_Lodderomyces_clade)与片球菌属(Pediococcus)在空白组中呈显著负相关性在实验组中则呈现显著正相关性,且与魏斯氏菌属(Weissella)产生新的显著正相关性。结果表明,空白组和实验组多菌种共发酵体系中微生物群落的整体网络结构发生了明显的变化。表明扣囊复膜酵母对固态混菌培养基微生物菌群发生了扰动作用,改变了多菌种共发酵体系中微生物群落的整体网络结构。

a-空白组固态发酵体系的微生物相关性;b-实验组固态发酵体系的微生物相关性
图3 固态混菌培养体系中微生物的相关性网络
Fig.3 Co-occurrence networks of microbial communities in mixed solid fermentation system
注:关联表示统计上显著(P<0.05)
2.4 不同发酵条件下扣囊复膜酵母菌对微生物菌群生长代谢的影响
2.4.1 不同发酵条件下扣囊复膜酵母菌多菌共酵体系理化指标的影响
不同发酵条件下小麦多菌种共发酵体系的理化指标如图4所示,可以看出空白组和实验组的理化指标变化趋势大致是相同的,说明接种扣囊复膜酵母菌后依然遵守设定的环境对发酵体系的约束。但接种扣囊复膜酵母菌后测定的理化在各发酵条件下变化情况是不同的。分析小麦多菌种共发酵体系中的理化变化情况可知,实验组与空白组水分变化情况大致相同,都是随温度升高湿度减低而降低。pH变化情况除38 ℃/80%发酵条件下实验组明显高于空白组。酸度变化情况是在28 ℃/90%、35 ℃/85%、43 ℃/75%发酵条件下实验组比空白组明显降低。结合上述对微生物群落的分析,产酸相关的菌属片球菌属(Pediococcus)、魏斯氏菌(Weissella)、乳球菌属(Lactococcus)等实验组明显低于空白组。实验组pH和酸度的变化应是扣囊复膜酵母的接种导致产酸微生物减少的结果。

图4 不同发酵条件下混菌体系中水分、pH和酸度的变化
Fig.4 The changes of water,pH and acidity in mixed solid fermentation system under different fermentation conditions
2.4.2 不同发酵条件下扣囊复膜酵母菌对微生物菌群产酶能力的影响
不同发酵条件下小麦多菌种共发酵体系的酶活力如图5所示,实验组与空白组对比,还原糖和糖化力变化情况基本一致。在35 ℃/85%、43 ℃/75%发酵条件下有所降低,在25 ℃/95%、28 ℃/90%、38 ℃/80%这3个发酵条件下皆有所升高;液化力在所有发酵条件下都高于空白组。发酵力在25 ℃/95%、28 ℃/90%、35 ℃/85%这3个发酵条件下实验组高于空白组。而酒化力影响情况并不明显。但液化力在所有发酵条件下实验组都优于空白组。已有的研究表明扣囊复膜酵母有较强的产淀粉水解酶的能力[15],接种后对固态混菌培养基中的酶活力在低温(38 ℃之前)发酵条件有一定影响。但对实验组和空白组整体分析影响并不显著。

图5 不同发酵条件下混菌体系中还原糖含量、糖化力、液化力、发酵力、酒化力的变化
Fig.5 The changes of reducing sugar content,saccharifying power,liquefying power,fermenting power and liquor-producing power in mixed solid fermentation system under different fermentation conditions
2.4.3 扣囊复膜酵母对微生物菌群合成挥发性代谢物的影响
将测定的挥发性化合物与各发酵条件相关性分析并使用正交最小二乘法分析其主成分分析及差异代谢物,如图6所示。通过GC-MS检测获得的不同发酵条件下微生物菌群的挥发性代谢物可知,醇类是含量最多的挥发性代谢物,其余依次是酯类、吡嗪类、酸类、醛类化合物。通过分析实验结果可知,在25 ℃/95%发酵条件下实验组与酯类有明显正相关,35 ℃/85%发酵条件下实验组与吡嗪类化合物呈现明显正相关。且通过分析挥发性代谢物物组成,35 ℃/85%、42 ℃/75%这2个发酵条件下,实验组的吡嗪类化合物明显增多,分别是空白组的5.7和2.3倍。相对应的发酵条件下微生物群落的变化中芽孢杆菌属(Bacillus)丰度有明显增多,而芽孢杆菌属(Bacillus)与吡嗪类化合物的合成有紧密关系[16-18]。结合正交最小二乘法分析其主成分分析及差异代谢物,空白组和实验组的主成分分析有明显的差异,结合S-plot图分析其显著差异的风味物。显著风味物分别是(2R,3R)-(-)-2,3-丁二醇、异戊醇、正己醇、棕榈酸乙酯、乙酸乙酯、亚油酸乙酯、油酸乙酯、9-十六碳烯酸乙酯、肉乙酯、2,5-二甲基吡嗪、2,3-二甲基吡嗪。实验组相比空白组,2,5-二甲基吡嗪、2,3-二甲基吡嗪、异戊醇、正己醇为显著增加,(2R,3R)-(-)-2,3-丁二醇、棕榈酸乙酯、乙酸乙酯、亚油酸乙酯、油酸乙酯、9-十六碳烯酸乙酯、肉乙酯显著减少。由结果分析可知,扣囊复膜酵母的扰动导致固态混菌培养体系中挥发性代谢物发生了显著变化。

a-主要挥发性代谢物的含量;b-挥发性代谢物与发酵条件的相关性热图;c-OPLS-DA得分图;d-S-plot图
图6 挥发性代谢物变化
Fig.6 Changes of volatile metabolites
注:b、d图共用图例
3 结论
在发酵温度/湿度为25 ℃/95%、28 ℃/90%、35 ℃/85%、38 ℃/80%、43 ℃/75%条件下,基于混菌固态发酵体系,研究了浓香型大曲中分离获得的扣囊复膜酵母菌的生长代谢特性。通过分析试验组和对照组微生物多样性、发酵过程理化参数及重要酶活力、挥发性风味物质等代谢产物的差异,解析了扣囊复膜酵母菌菌株对多菌共酵体系的扰动作用。结果表明,接种扣囊复膜酵母菌会显著的影响固态混菌培养基,对毕赤酵母属(Pichia)、横梗霉属(Lichtheimia)、肠杆菌属(Enterobacter)、片球菌属(Pediococcus)、魏斯氏菌(Weissella)有显著的抑制作用,对芽孢杆菌属(Bacillus)有显著增强作用,且会通过抑制产酸微生物进而影响发酵体系的pH、酸度。25 ℃/95%、35 ℃/85%发酵条件下会增强固态混菌体系中淀粉的水解能力,且接种扣囊复膜酵母菌后挥发性代谢物中2,5-二甲基吡嗪、2,3-二甲基吡嗪、异戊醇、正己醇为显著增加,(2R,3R)-(-)-2,3-丁二醇、棕榈酸乙酯、乙酸乙酯、亚油酸乙酯、油酸乙酯、9-十六碳烯酸乙酯、肉乙酯显著减少。在35 ℃/85%、42 ℃/75%发酵条件下,接种扣囊复膜酵母菌后吡嗪类化合物的含量是不接种的5.7和2.3倍。结果表明扣囊复膜酵母在固态混菌发酵体系中起到了至关重要的作用,也为深入研究扣囊复膜酵母在浓香型大曲中的作用提供了重要的数据。
[1] CHI Z M,CHI Z,LIU G L,et al.Saccharomycopsis fibuligera and its applications in biotechnology[J].Biotechnology Advances,2009,27(4):423-431.
[2] ZHENG X W,YAN Z,NOUT M J R,et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu,a Chinese industrial fermentation starter[J].International Journal of Food Microbiology,2014,182-183:57-62.
[3] LYU X C,CHEN Z C,JIA R B,et al.Microbial community structure and dynamics during the traditional brewing of Fuzhou Hong Qu glutinous rice wine as determined by culture-dependent and culture-independent techniques[J].Food Control,2015,57:216-224.
[4] DU H,WANG X S,ZHANG Y H,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology,2019,297:32-40.
[5] SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Research International,2020,137.DOI:10.1016/j.foodres.2020.109425.
[6] WANG X D,QIU S Y,LI P,et al.Analysis of microbial community structure in traditional and automated Moutai-flavor Daqu[J].Journal of the American Society of Brewing Chemists,2019,77(2):140-146.
[7] JUNG M J,NAM Y D,ROH S W,et al.Unexpected convergence of fungal and bacterial communities during fermentation of traditional Korean alcoholic beverages inoculated with various natural starters[J].Food Microbiology,2012,30(1):112-123.
[8] 周森, 韩培杰,胡佳音,等.牛栏山二锅头酿造过程中的真菌多样性分析[J].食品工业科技,2018,19(1):127-130;136.
ZHOU S,HAN P J,HU J Y,et al.Analysis of fungal diversity in Niulanshan Erguotou brewing process[J].Science and Technology of Food Industry,2018,39(1):127-130;136.
[9] 周森,胡佳音,崔洋,等.应用高通量测序技术解析清香型大曲微生物多样性[J].中国食品学报,2019,19(6):244-250.
ZHOU S,HU J Y,CUI Y,et al.Microbial diversity analysis of flight-flavor Daqu using high-throughput sequencing[J].Journal of Chinese Institute of Food Science and Technology,2019,19(6):244-250.
[10] 马凯,崔哲男,郑晓卫,等.汾酒大曲可培养真菌多样性的初步分析[J].中国酿造,2011,30(8):19-21.
MA K,CUI Z N,ZHENG X W,et al.Diversity of culturable fungi in Fen-Daqu[J].China Brewing,2011,30(8):19-21.
[11] ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu-a traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing,2012,117(1):82-90.
[12] HE G,HUANG J,WU C,et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Research International,2019,129:108 851.
[13] WANG H Y,GAO Y B,FAN Q W,et al.Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCR-DGGE[J].Letters in Applied Microbiology,2011,53(2):134-140.
[14] YANG J G,DOU X,MA Y Y,et al.Diversity and dynamic succession of microorganisms during Daqu preparation for Luzhou-flavour liquor using second-generation sequencing technology[J].Journal of the Institute of Brewing,2018,124(4):498-507.
[15] JULIA M N,LEONTION G,SANTIAGO A,et al.Structural and functional analysis of hybrid enzymes generated by domain shuffling between Saccharomyces cerevisiae (var.diastaticus) Sta1 glucoamylase and Saccharomycopsis fibuligera Bgl1 β-glucosidase[J].Applied Microbiology and Biotechnology,2011,89(1):121-130.
[16] 黄晓宁, 刘晶晶,韩北忠,等.基于酶学特性筛选大曲来源芽孢杆菌用于强化酿酒[J/OL].食品科学:2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1708.234.html.
HUANG X N,LIU J J,HAN B Z,et al.Screening of bacillus from Daqu based on enzymatic characteristics for enhanced brewing [J/OL].Food Science:2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1708.234.html.
[17] HE G,HUANG J,ZHOU R,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Frontiers in Microbiology,2019,10.DOI:10.3389/fmicb.2019.00056.
[18] 张丽杰, 张怀志,徐岩.枯草芽孢杆菌Nr.5和底物添加促进酱油中吡嗪类物质合成[J].食品与发酵工业,2020,46(21):1-8.
ZHANG L J,ZHANG H Z,XU Y.Pyrazines synthesis in soy sauce promoted by Bacillus subtilis Nr.5 and substrate addition[J].Food and Fermentation Industry,2020,46 (21):1-8.