人体口腔环境是由多种属微生物形成的复杂的微生态系统[1],口腔中细菌的种类超过700种,微生物通过共生、竞争和拮抗等相互作用影响着口腔的微生态平衡,与宿主口腔健康和疾病有着紧密联系[2]。当有外来微生物进入口腔环境或者口腔环境中固有的某些微生物过量生长,逐渐成为优势菌群时,会打破口腔的微生态平衡,导致口腔疾病发生[1]。人类常见的口腔感染性疾病包括牙周病、龋齿和口臭等,对人体健康造成危害。目前,普遍认为牙周疾病主要由牙龈卟啉单胞菌、福赛斯坦纳菌、具核梭杆菌、齿垢密螺旋体和中间普氏菌等革兰氏阴性厌氧菌联合致病[3]。龋病主要是以变异链球菌和产酸菌的过度生长引起的牙体硬组织感染性疾病[4]。口腔念珠菌病是念珠菌属感染引起的口腔黏膜疾病,其中白色念珠菌是最主要的病原菌[5]。
目前,国内外主要采用口服抗生素的化学疗法来治疗细菌感染性疾病。但长期服用抗生素会破坏口腔生态系统平衡,同时也加剧了细菌耐药性[6]。而益生菌疗法则为口腔疾病提供了新的诊治方式[7]。当前国外在口腔医学领域应用益生菌疗法方面已有一些研究和尝试,而国内在这方面开展工作较少[8]。
益生菌是指“当摄入适当剂量时对宿主有益的活体微生物制剂”[9]。在口腔中研究和应用最多的是乳酸杆菌,但其作用尚不明确[10]。在防治牙周病方面,KOLL-KLAIS等[11]研究指出,口腔环境中定植的一些乳酸杆菌能够抑制致病菌牙龈卟啉单胞菌和中间普雷沃菌的生长。在防治龋齿方面,NASE等[12]研究发现,鼠李糖乳杆菌能够抑制龋齿致病菌变异链球菌的生长,减少口腔环境中变异链球菌数量,降低龋病发生率。HATAKKA等[13]研究报道益生菌在防治口臭和中老年人口腔念珠菌病等口腔疾病中有显著疗效。综上所述,益生菌疗法可以通过不同的机制抑制致病菌的生长,同时还能维持正常的口腔微生态菌群,保障口腔健康[14]。本研究筛选具有抑制口腔致病菌的乳酸菌,并研究其抑菌特性,旨在为国内口腔益生菌的研究和开发提供研究思路和经验。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及培养基
乳酸菌:筛选自四川大凉山农家泡菜;所用培养基为MRS液体培养基、MRS固体培养基、MRS+CaCO3筛选培养基、M17液体培养基、M17固体培养基、M17+CaCO3筛选培养基。
表1 指示菌及培养基
Table 1 Indicator bacteria and culture medium
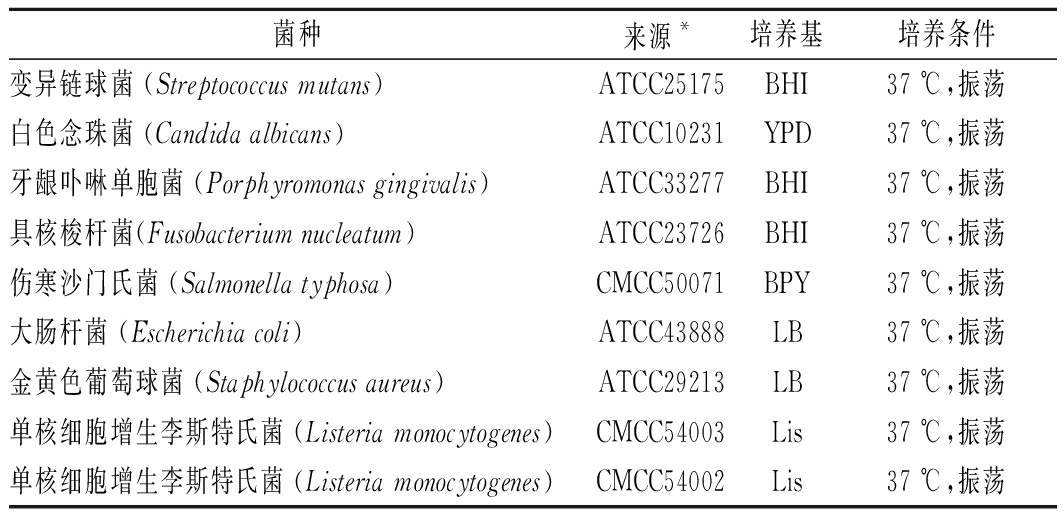
菌种来源*培养基培养条件变异链球菌 (Streptococcus mutans)ATCC25175BHI37 ℃,振荡白色念珠菌 (Candida albicans)ATCC10231YPD37 ℃,振荡牙龈卟啉单胞菌 (Porphyromonas gingivalis)ATCC33277BHI37 ℃,振荡具核梭杆菌(Fusobacterium nucleatum)ATCC23726BHI37 ℃,振荡伤寒沙门氏菌 (Salmonella typhosa)CMCC50071BPY37 ℃,振荡大肠杆菌 (Escherichia coli)ATCC43888LB37 ℃,振荡金黄色葡萄球菌 (Staphylococcus aureus)ATCC29213LB37 ℃,振荡单核细胞增生李斯特氏菌 (Listeria monocytogenes)CMCC54003Lis37 ℃,振荡单核细胞增生李斯特氏菌 (Listeria monocytogenes)CMCC54002Lis37 ℃,振荡
注:*ATCC,美国典型菌种保藏中心(American Type Culture Collection);CMCC,中国医学细菌菌种保藏管理中心(National Center for Medical Culture Collection)
1.1.2 主要试剂
MRS培养基制备参见文献[15]。细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司;Nisin,浙江新银象生物工程有限公司;0.22 μm无菌过滤器,德国 Merck Millipore公司;牛津杯(内径6.5 mm,外径8.0 mm),北京先驱威锋技术开发公司。
1.1.3 主要仪器
DL-CJ-1 N 超净工作台,北京东连哈尔滨仪器制造有限公司;PHS-3B 便携式酸度计,上海雷磁仪器厂;游标卡尺,杭州易宏制造有限公司;BIOFUGE STRATOS 台式冷冻离心机,美国 Thermo Scientific;PTC-200 型PCR仪、Bio-RAD 凝胶成像系统,美国 Bio-Rad公司。
1.2 实验方法
1.2.1 乳酸菌的分离
采用涂布平板法[16]:称取5 g 泡菜样品放入无菌均质袋中,加入45 mL 无菌生理盐水拍打混匀后,梯度稀释,分别吸取稀释倍数为 10-3、10-4、10-5、10-6的样品 100 μL,涂布于含2.5% CaCO3的 MRS 和M17平板上,37 ℃培养 24 h。挑取长势良好,溶钙圈明显的菌落,通过平板划线分离法反复分离纯化,编号,于-80 ℃甘油保藏[17]。
1.2.2 抑制口腔致病菌乳酸菌的筛选
将分离所得乳酸菌用MRS液体培养基活化后,按1×109 CFU/mL接种于MRS液体培养基中,37 ℃、180 r/min培养24 h。于4 ℃、10 000×g离心10 min后,弃菌体沉淀,用0.22 μm无菌过滤器过滤得无细胞发酵上清液。以变异链球菌、白色念珠菌、具核梭杆菌、牙龈卟啉单胞菌为指示菌,且指示菌的接种浓度均为107 CFU/mL、体积均为100 μL,采用牛津杯法[18]筛选出对各指示菌有明显抑菌圈的菌株。并用MRS液体培养基做阴性对照,质量浓度为6.25 mg/mL的Nisin、2 mg/mL山梨酸钾和纳他霉素做阳性对照。每个试验重复3次,采用十字交叉法测量抑菌圈直径。
1.2.3 16S rRNA鉴定[19]
根据细菌基因组DNA提取试剂盒说明操作提取未知菌株基因组DNA,以基因组 DNA为模版进行 16S rRNA 基因的 PCR 扩增。扩增引物使用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)。PCR反应体系见表2。PCR 反应条件:95 ℃预变性 5 min;95 ℃变性30 s,55 ℃退火 30 s,72 ℃延伸 30 s,34 次循环;最后 72 ℃延伸 5 min。
表2 PCR反应体系
Table 2 PCR reaction system
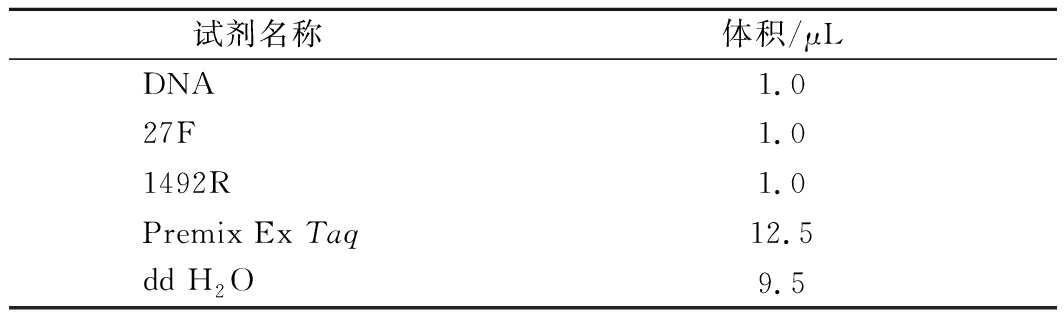
试剂名称体积/μLDNA1.027F1.01492R1.0Premix Ex Taq12.5dd H2O9.5
将提取的基因组和 PCR 扩增产物用琼脂糖凝胶电泳分析检测后,将 PCR 产物进行DNA测序(上海生工生物工程有限公司)。测序序列结果在 NCBI 数据库中用 Blast 软件搜索近似序列,将所测得的序列和从 Gen Bank 中获得的相关种属的16S rRNA 基因序列,运用 Mega 7.0 软件构建系统发育树。
1.2.4 乳酸菌SD26不同生长时间上清液pH及抑菌活力的测定
将浓度为1×109 CFU/mL的 SD26以2%的体积分数接种于200 mL MRS液体培养基中,37 ℃培养24 h。每隔 4 h 取培养液 20 mL,测定其OD600。于4 ℃、10 000×g离心10 min后测定上清液的pH及其对白色念珠菌的抑菌活力。设3个重复,取平均值。
1.2.5 乳酸菌SD26上清液对白色念珠菌生长过程的影响
将浓度为1×109 CFU/mL的SD26 以2%的体积分数接种于200 mL MRS液体培养基中,37 ℃培养12 h后于4 ℃、10 000×g离心10 min后得上清液,测定上清液的pH值,并将上清液分装试管编号。用pH计将上清液的pH调为6.0,然后测定不同pH的SD26发酵上清液对白色念珠菌生长的影响。
将浓度为1×107 CFU/mL的白色念珠菌以2%的体积分数接种于10 mL YPD液体培养基中,编号。再分别添加不同pH的10 mL SD26发酵上清液,37 ℃培养24 h,每4 h取出一定量培养液,测定其OD600。设3个重复,绘制白色念珠菌的生长曲线。以不添加SD26上清液的白色念珠菌的生长曲线作为阴性对照。
1.2.6 抑菌物质的确定
为了确定乳酸菌SD26发酵上清液中的抑菌物质,进行以下3种试验[20-21]:
酸碱作用:测量发酵上清液的pH,用1 mol/L NaOH溶液或 1 mol/L HCl溶液将发酵上清液的pH调为3.0、4.0、5.0、6.0、7.0后,分别吸取发酵上清液和原发酵上清液,以白色念珠菌为指示菌,用牛津杯法进行抑菌试验。
酸对照:用乙酸、L-乳酸、D-乳酸将空白的MRS培养基调节到与SD26发酵上清液相同的pH值,以MRS液体培养基作为空白对照,以白色念珠菌为指示菌,用牛津杯法进行抑菌试验。
盐析:取100 mL SD26发酵上清液,向其中加入硫酸铵至饱和度为75%,待硫酸铵盐完全溶解,将样品置于4 ℃中搅拌过夜后10 000×g 离心30 min,分别收集上清液和沉淀。测量上清液的pH,并用1 mol/L NaOH溶液调pH值为6.0和7.0,用pH 为 7.0的无菌水将沉淀复溶至 10 mL,取上清液和沉淀复溶液,以白色念珠菌为指示菌做抑菌试验。
1.2.7 对食源性常见致病菌抑菌谱的测定
取SD26发酵上清液,以伤寒沙门氏菌CMCC50071、大肠杆菌ATCC43888、金黄色葡萄球菌ATCC29213、单核细胞增生李斯特氏菌CMCC54003和单核细胞增生李斯特氏菌CMCC54002为指示菌,且指示菌的接种浓度均为107 CFU/mL、体积为100 μL。用牛津杯法[18]做抑菌实验。每个菌设3个重复,取平均值。
1.2.8 统计学分析
采用SPSS 18.0软件进行数据统计处理,数值均用平均值±标准差来表示,采用Duncan多重比较检验,以P>0.05表示差异不著性,P<0.05表示差异显著。采用Origin 8软件进行数据分析作图。
2 结果与讨论
2.1 泡菜中乳酸菌的筛选和对口腔致病菌的抑制
从泡菜样品中筛选分离出9株乳酸菌,编号为 SD23—SD31。9株菌株表现出对不同口腔致病菌的不同抑制作用,由表3可知,SD26对口腔致病菌的抑制作用强于其余菌株。尤其是SD26对白色念珠菌的抑制作用明显强于其余菌株及对照组Nisin、山梨酸钾和纳他霉素,且SD26对白色念珠菌的抑菌圈直径最大,为26.63 mm。故选择SD26菌株作为目标菌株做进一步的试验研究。
表3 不同菌株对各指示菌的抑制活性
Table 3 Inhibitory activity of lactic acid bacteria against different indicators
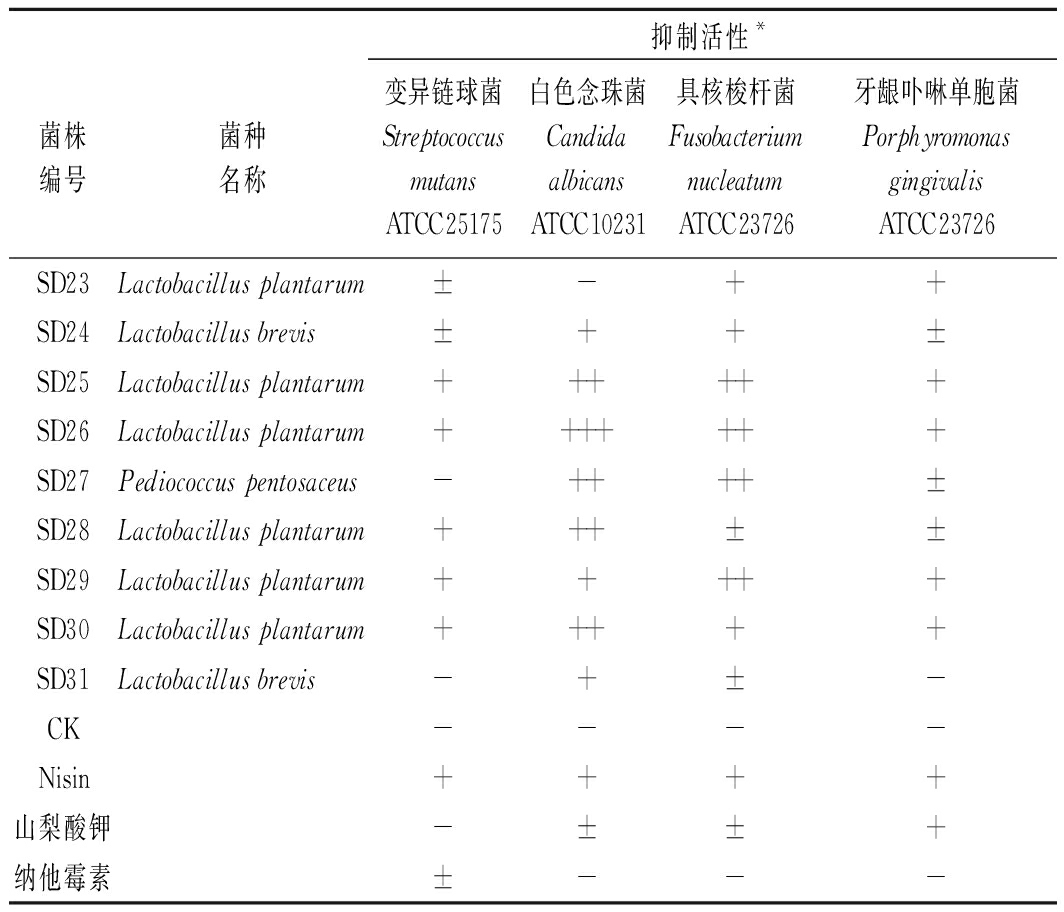
抑制活性*菌株编号菌种名称变异链球菌Streptococcus mutans ATCC25175白色念珠菌Candida albicansATCC10231具核梭杆菌Fusobacterium nucleatumATCC23726牙龈卟啉单胞菌Porphyromonas gingivalisATCC23726SD23Lactobacillus plantarum±-++SD24Lactobacillus brevis ±++±SD25Lactobacillus plantarum++++++SD26Lactobacillus plantarum+++++++SD27Pediococcus pentosaceus-++++±SD28Lactobacillus plantarum+++±±SD29Lactobacillus plantarum+++++SD30Lactobacillus plantarum+++++SD31Lactobacillus brevis -+±-CK----Nisin++++山梨酸钾-±±+纳他霉素±---
注:*抑菌活性用抑菌圈的直径(mm)表示,+++,>20 mm;++,15~20 mm;+,10~15 mm;±,<10 mm;-,无抑制作用;CK:MRS液体培养基。
2.2 乳酸菌SD26的16S r RNA序列分析
图1为 SD26 的基因组和 16S rRNA 扩增片段。16S rRNA 测序结果经BLAST 分析和多重比对后,构建系统发育树(见图2)。由同源性比较可知菌株SD26与植物乳杆菌(L.plantarum)16S rRNA基因序列相似性为 98%,当16S rRNA 序列同源性≥98%时可以认为是同种[22],由此可知菌株SD26为植物乳杆菌。

M1-Marker DL15000 ;M2-DL2000;
1-菌株SD26 基因组;2-16S rRNA 扩增产物
图1 菌株SD26基因组与16S rRNA扩增产物琼脂糖凝胶电泳
Fig.1 Agarose gel electrophoresis of SD26 genome and 16S rRNA amplification product of strain

图2 基于16S rRNA 序列的菌株SD26系统发育树
Fig.2 Phylogenetic tree of strain SD26 based on 16S rRNA sequence
2.3 乳酸菌 SD26 的生长动力曲线
由图3可知,培养4 h时,SD26开始进入对数生长期,此时其发酵上清液的pH值在5.0左右,已对白色念珠菌有较高的抑制活性,其抑菌圈直径为19.25 mm。随着培养时间的增加,SD26发酵上清液的pH值不断降低,而对白色念珠菌的抑菌圈直径不断增大。当培养到20 h时,SD26进入稳定期后期,发酵上清液的pH值趋于稳定且最小为3.81,此时对白色念珠菌的抑菌圈直径达到最大,为26.63 mm。

图3 乳酸菌SD26的生长曲线及不同培养时间下pH和抑菌圈直径
Fig.3 Growth curve of lactic acid bacteria SD26 and the pH value and the diameter of bacteriostatic zone at different culture time
注:字母不同表示两组之间有显著差异 (P<0.05)
2.4 乳酸菌SD26不同pH值的上清液对白色念珠菌生长的影响
由图4可知,SD26不同pH值的发酵上清液对白色念珠菌的生长有不同的影响,其中将白色念珠菌的生长曲线作为空白对照。当SD26发酵上清液的pH值为3.81时,白色念珠菌24 h都处于较低的OD600且几乎恒定在零水平。而当SD26发酵上清液的pH值为6.0时,白色念珠菌的生长曲线趋势几乎与空白对照组相吻合。由此可推测SD26上清液的低酸性环境对白色念珠菌的生长起抑制作用。
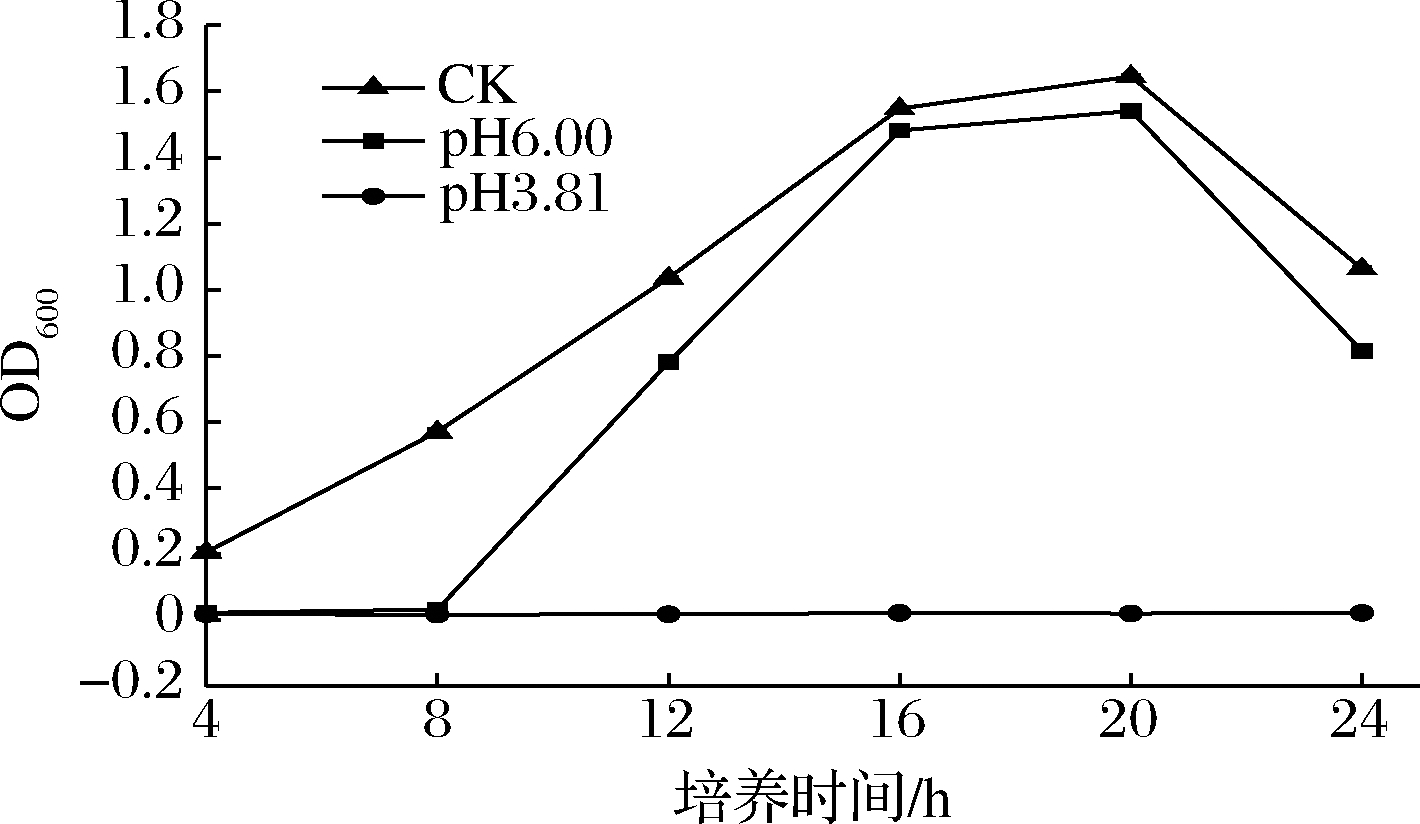
图4 乳酸菌SD26发酵上清液对白色念珠菌生长过程的影响
Fig.4 Effect of lactic acid bacteria SD26 fermentation supernatant on the growth of C.albicans
2.5 乳酸菌SD26抑菌物质的确定
由表4可知,随着SD26发酵上清液pH值的升高,对白色念珠菌的抑菌圈在变小;当pH值大于5.0时,对白色念珠菌无抑菌作用。而SD26发酵上清液的不同pH值对白色念珠菌的抑菌圈直径存在显著性差异(P<0.05),由此可推测,对白色念珠菌的抑制作用依赖于SD26发酵上清液的pH值,且低酸性环境对白色念珠菌有强抑制作用。
表4 乳酸菌SD26不同pH值的发酵上清液对白色念珠菌的抑制活性
Table 4 Inhibitory activity of lactic acid bacteria SD26 fermentation supernatant under different pH values on C.albicans
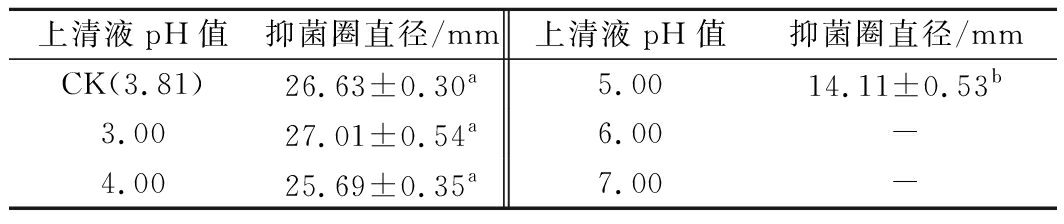
上清液pH值抑菌圈直径/mm上清液pH值抑菌圈直径/mmCK(3.81)26.63±0.30a5.0014.11±0.53b3.0027.01±0.54a6.00-4.0025.69±0.35a7.00-
注:CK,原发酵上清液;同列肩标有字母相同表示和CK差异不显著 (P>0.05),不同表示差异显著 (P<0.05);-,无抑制作用
由图5可知,在与SD26发酵上清液pH值相同时,乙酸、D-乳酸均对白色念珠菌有明显的抑制作用,而L-乳酸对白色念珠菌无抑制作用。且D-乳酸的抑菌圈直径为20.01 mm,与SD26发酵上清液的抑菌圈直径26.63 mm有着显著差异(P<0.05),而乙酸的抑菌圈直径为27.01 mm,与SD26发酵上清液的抑菌圈直径没有显著差异(P>0.05)。用75%硫酸铵盐析后酸性上清液有明显抑菌圈,而中性沉淀复溶液无抑菌圈,表明SD26发酵上清液中对白色念珠菌起抑菌作用的物质非蛋白质类化合物,而是该乳酸菌代谢分泌的有机酸。
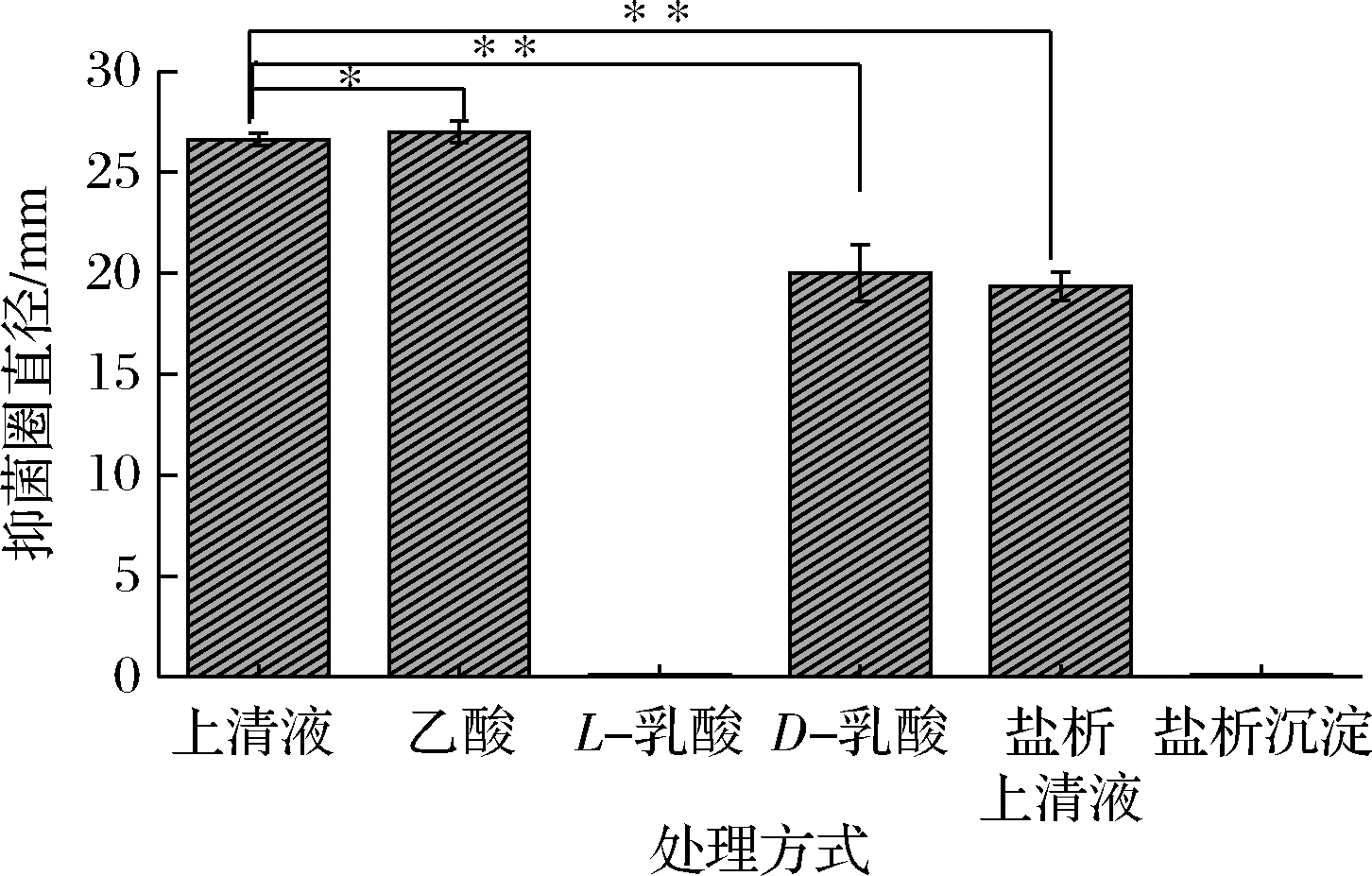
图5 乳酸菌 SD26发酵上清液(或培养基)的不同处理对白色念珠菌的抑制活性
Fig.5 Inhibitory activity of lactic acid bacteria SD26 fermentation supernatant (or medium)on C.albicans
注:*表示两组之间没有显著差异 (P>0.05);**表示两组之间有显著差异 (P<0.05)
2.6 食源性常见致病菌的抑菌谱
由表5可知,SD26对食源性常见致病菌革兰氏阳性菌和革兰氏阴性菌均有不同程度的抑制作用。其中,对革兰氏阳性菌单核细胞增生李斯特氏菌(CMCC54002)的抑菌作用最强,抑菌圈直径超过20 mm。由此可知,SD26对食源性常见致病菌的抑菌作用较好,有良好的应用潜力。
表5 乳酸菌SD26对食源性致病菌的抑菌谱
Table 5 Antimicrobial spectrum of lactic acid bacteria SD26 against foodborne pathogens
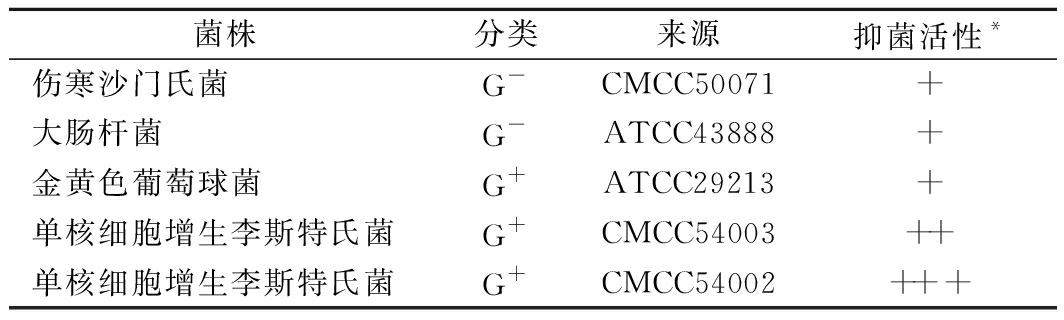
菌株分类来源抑菌活性*伤寒沙门氏菌G-CMCC50071+大肠杆菌G-ATCC43888+金黄色葡萄球菌G+ATCC29213+单核细胞增生李斯特氏菌G+CMCC54003++单核细胞增生李斯特氏菌G+CMCC54002+++
注:*抑菌活性用抑菌圈的直径(mm)表示,+++,>20 mm;++,15~20 mm;+,10~15 mm;±,<10 mm;-,无抑制作用
3 讨论
乳酸杆菌菌种具有多样性,对不同口腔致病菌的作用存在差异[23]。MARSH[24]研究报道,健康人群口腔中乳酸杆菌的检出率,尤其是植物乳杆菌和发酵乳杆菌的检出率显著高于有口腔疾病的患者。将乳酸杆菌同口腔致病菌共培养后,因所处环境pH值的降低,口腔致病菌被显著抑制,得出益生菌可以通过产生有机酸来降低环境pH值,从而实现抑菌的作用[25]。这一结论与本研究的植物乳杆菌SD26发酵上清液在低pH时能抑制白色念珠菌生长在几乎恒定的零水平相吻合。
乳酸菌能够产生具有抑菌活性的有机酸等代谢产物,抑菌机理通常认为是在酸性pH条件下,以未解离的形式作用于目标细胞膜,破坏细胞膜电化学质子梯度从而导致细胞死亡[26]。有关研究表明[27],酸的抗菌活性与pH的降低以及它们的离解能力有关,这取决于相应酸的pKa值和周围环境的pH。酸以未离解的形式可溶于脂质,并且它们通过被动和载体介导的转运机制都容易进入微生物细胞。一旦进入细胞,酸就会在碱性环境中释放质子H+,导致细胞内H减少。这会影响微生物的代谢,抑制重要的微生物酶的作用,并迫使细菌细胞利用能量输出过量的质子H+,最终导致细胞能量耗竭而死亡。同时,质子H+可以使细菌对酸敏感的蛋白质和DNA变性。有机酸的抑菌活性具有pH依赖性,未解离有机酸的抑菌活性高于解离的有机酸。这一结论与本研究的SD26发酵上清液对白色念珠菌的抑菌圈直径受pH显著影响相吻合。
另外,用75%硫酸铵盐析SD26发酵上清液后,盐析上清液pH为4.01,且有明显的抑菌圈,而将盐析上清液pH调为6.0及以上时,抑菌圈消失,且中性沉淀复溶液无抑菌圈,表明抑菌活性成分非蛋白质类化合物,而是该乳酸菌代谢分泌的有机酸。同时,DONG等[28]研究发现,植物乳杆菌可产生抗真菌的代谢产物有机酸,例如乙酸、丙酸和乳酸等。这一结论与本研究对白色念珠菌起抑菌作用的主要成分为SD26生长代谢分泌的有机酸相吻合。综上所述,从泡菜中筛选出的菌株SD26经鉴定为植物乳杆菌,该乳酸菌对口腔致病菌白色念珠菌的抑菌物质为其代谢分泌的有机酸。后期将对菌株SD26二代进行全基因组测序,明确其是否为新菌株,并探究其对白色念珠菌的抑菌物质和机理,为将益生菌应用到口腔领域提供基础。
[1] KILIAN M,CHAPPLE IL C,HANNIG M,et al.The oral microbiome-an update for oral healthcare professionals[J].British Dental Journal,2016,221(10):657-666.
[2] SAMPAIO-MAIA B,CALDAS I M,PEREIRA M L,et al.Chapter four-the oral microbiome in health and its implication in oral and systemic diseases[J].Advances in Applied Microbiology,2016,97:171-210.
[3] 施文元, 周学东.人体口腔微生物群的相互作用[J].华西口腔医学杂志,2010,28(1):1-4.
SHI W Y,ZHOU X D.Interaction of human oral microbiota[J].West China Journal of Stomatology,2010,28(1):1-4.
[4] ABELES S R,ROBLES-SIKISAKA R,LY M,et al.Human oral viruses are personal,persistent and gender-consistent[J].The Isme Journal,2014,8(9):1 753-1 767.
[5] JORGENSEN M R,KRAGELUND C,JENSEN P O,et al.Probiotic Lactobacillus reuterihas antifungal effects on oral Candida species in vitro[J].Journal of Oral Microbiology,2017,9(1):274-282.
[6] 董雨馨, 张君超,张红星,等.1株产细菌素植物乳杆菌的筛选及其细菌素抑菌性质研究[J].食品与发酵工业,2016,42(7):74-79.
DONG Y X,ZHANG J C,ZHANG H X,et al.Screening of bacteriocin-producing Lactobacillus plantarum and study on antimicrobial characteristics of bacteriocin[J].Food and Fermentation Industries,2016,42(7):74-79.
[7] OUWEHAND A C.A review of dose-responses of probiotics in human studies[J].Beneficial microbes,2017,8(2):143-151.
[8] BERNARD B,GIUSEPPE P,GIOVANNI S,et al.Probiotics and oral health[J].Current Pharmaceutical Design,2012,18(34):5 522-5 531.
[9] AGGETT P J,CARLO A,IRENE A,et al.Nondigestible carbohydrates in the diets of infants and young children:A commentary by the espghan committee on nutrition[J].Journal of Pediatric Gastroenterology and Nutrition,2003,36(3):329-337.
[10] PHAM L,VAN S,ROLING W,et al.Effects of probiotic Lactobacillus salivarius W24 on the compositional stability of oral microbial communities[J].Archives of Oral Biology,2009,54(2):132-137.
[11] KOLL-KLAIS P,MANDAR R,LEIBUR E,et al.Oral lactobacilli in chronic periodontitis and periodontal health:Species composition and antimicrobial activity[J].Oral Microbiology and Immunology,2005,20(6):354-361.
[12] NASE L,HATAKKA K,SAVILAHTI E,et al.Effect of long-term consumption of a probiotic bacterium,Lactobacillus rhamnosus GG,in milk on dental caries and caries risk in children[J].Caries Research,2001,35(6):412-420.
[13] HATAKKA K,AHOLA A J,YLI-KNUUTTILA H,et al.Probiotics reduce the prevalence of oral Candida in the elderly—a randomized controlled trial[J].Journal of Dental Research,2007,86(2):125-130.
[14] GHOLIZADEH P,ESLAMI H,YOUSE M,et al.Role of oral microbiome on oral cancers,a review[J].Biomedicine & Pharmacotherapy,2016,84:552-558.
[15] D’AIMMO M R,MODESTO M,BIAVATI B.Antibiotic resistance of lactic acid bacteria and Bifidobacterium spp.isolated from dairy and pharmaceutical products[J].International Journal of Food Microbiology,2007,115(1):35-42.
[16] 刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2011.
LIU H.Modern food microbiology experimental technology[M].Beijing:China Light Industry Press,2011.
[17] 李清, 王英,刘小莉,等.一株广谱抑菌活性乳酸菌的筛选及特性研究[J].微生物学通报,2015,42(2):332-339.
LI Q,WANG Y,LIU X L,et al.Screening and characterization of a broad-spectrum antibacterial active Lactobacillus[J].Microbiology China,2015,42(2):332-339.
[18] WASFI R,ABD El-RAHMAN O A,ZAFER M M,et al.Probiotic Lactobacillus sp.inhibit growth,biofilm formation and gene expression of caries-inducing Streptococcus mutans[J].Journal of Cellular and Molecular Medicine,2018,22(3):1 972-1 983.
[19] 李转羽, 郝艳芳,张红星,等.1株产乳酸菌素植物乳杆菌的鉴定及功能研究[J].中国食品学报,2015,15(2):207-213.
LI Z Y,HAO Y F,ZHANG H X,et al.Identification and function studying of a Lactobacillus plantarum producing lactobacillin[J].Journal of Chinese Institute of Food Science and Technology,2015,15(2):207-213.
[20] JANCZAREK M,BACHANEK T,MAZUR E,et al.The role of probiotics in prevention of oral diseases[J].Postepy Higieny I Medycyny Doswiadczalnej,2016,70:850-857.
[21] 张英春, 韩雪,单毓娟,等.益生菌抑制致病菌作用的机制研究进展[J].微生物学通报,2012,39(9):1 306-1 313.
ZHANG Y C,HAN X,DAN Y J,et al.Recent advances in mechanism on probiotic bacteria inhibition of pathogens[J].Microbiology China,2012,39(9):1 306-1 313.
[22] STACKEBRAND E,GOEBEL B M.Taxonomic note:A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J].International Journal of Systematic Bacteriology,1994,44(4):846-849.
[23] SAMOT J,LEBRETON J,BADET C.Adherence capacities of oral lactobacilli for potential probiotic purposes[J].Anaerobe,2011,17(2):69-72.
[24] MARSH P D.Microbiologic aspects of dental plaque and dental caries[J].Dental Clinics of North America,1999,43(4):599-614.
[25] 郭夏蕾, 张健,杨贞耐.抑制口腔变异链球菌的乳酸菌筛选及其抑菌机理[J].食品科学,2016,37(19):117-122.
GUO X L,ZHANG J,YANG Z N.Screening of lactic acid bacteria for inhibiting oral Streptococcus mutans and preliminary study of antibacterial mechanism[J].Food Science,2016,37(19):117-122.
[26] BRUL S,COOTE P.Preservative agents in foods:Mode of action and microbial resistance mechanisms[J].International Journal of Food Microbiology,1999,50(1-2):1-17.
[27] HALM M,HORNBAEK T,ARNEBORG N,HALM M,et al.Lactic acid tolerance determined by measurement of intracellular pH of singles cells of Candida krusei and Saccharomyces cerevisiae isolated from fermented maize dough[J].International Journal of Food Microbiology,2003,94(1):97-103.
[28] DONG A R,HO T T,LO R,et al.A genetic diversity study of antifungal Lactobacillus plantarum isolates[J].Food Control,2017,72:83-89.