植物乳杆菌是一类嗜温、革兰氏阳性、兼性厌氧、兼性异型发酵的乳酸菌,在植物、土壤、人类或动物的排泄物及发酵食品(发酵蔬菜、发酵肉制品、发酵鱼制品、干酪)等中均存在,且该菌是人体肠道的原籍菌[1]。植物乳杆菌已被报道可耐酸耐胆盐并在肠道中定殖[2],具有改善肠道菌群紊乱[3]、显著降低空肠弯曲菌毒力基因的转录并抑制其在肠道的感染[4]、缓解高糖高脂饮食导致的代谢综合征[5]等健康功能。
尽管植物乳杆菌已被报道具有多种益生功能,但在发酵乳中的应用并不常见,因为大多数菌株在牛乳中生长不良、难以凝乳。研究表明,植物乳杆菌蛋白水解系统存在缺陷,虽存在胞内肽酶及肽转运系统,但缺乏胞壁蛋白酶(cell-envelope proteinase,CEP)[6]。这意味着植物乳杆菌不能将牛乳中酪蛋白降解为肽,且天然牛乳中的肽含量太低,无法满足植物乳杆菌的生长要求[7]。协同发酵是解决这一问题的有效途径,利用发酵过程中的微生物间互利共生和偏利共生关系,以达到更好的发酵效果,已被用于酸奶和奶酪生产[8]。植物乳杆菌也已被报道在干酪中与其他乳酸菌协同发酵[9-10],但对于发酵乳中植物乳杆菌与其他乳酸菌的协同发酵却知之甚少。
前期研究已证明了植物乳杆菌(Lactobacillus plantarum) CCFM8661具有减轻重金属铅毒害的健康功能[11],且在酸豆乳中也有较好的应用[12],另外发现在发酵乳中添加麦芽、燕麦提取物是刺激植物乳杆菌生长的一种方法[13]。本研究通过将蛋白水解菌株与植物乳杆菌协同发酵,并对产酸能力、活菌数、抗氧化能力、发酵乳色泽、持水力、黏度、感官评价进行测定,对进一步促进植物乳杆菌在发酵乳中的应用具有重要意义。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
脱脂奶粉(0.8%脂肪、33.4%蛋白质、54.1%乳糖、7.9%矿物质和3.8%水分,质量分数)、浓缩乳清蛋白WPC80,新西兰恒天然公司;低酯果胶,美国CP Kelco公司;白砂糖,上海上棠食品;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) ,ABTS),BBI生命科学有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl ,DPPH),上海沃凯;环丙沙星,北京索宝来公司;其余试剂为分析纯,国药试剂平台。
1.1.2 实验仪器
MS 3振荡器、C-MAG HS 7恒温电热板磁力搅拌器,德国IKA公司;YXQ-LS-70A高压釜、BSP-150生化培养箱、BAC-1300ⅡA2生物安全柜,苏州安泰;Sorvall LYNX 4000离心机(A24-8×50转子),Thermo Science公司(美国);DW-86L388 J超低温冰箱、DW-25L262医用低温保藏箱、BCD-268STCV冰箱,海尔公司;VE-60LH-AI超纯水机,深圳宏森公司;ST3100数字pH计,奥豪斯仪器(常州);BHS-4数显恒温水浴锅,江阴市保利科研器械;C0000622水系0.22 μm针筒式滤膜、C0000623 水系0.45 μm针筒式滤膜Alllabware Scientific公司(中国);UV-1800分光光度计,翱艺仪器;Brookfield DV2T LV黏度仪,Brookfield公司(美国);CR-400色差计,Konica Minolta 公司(日本)。
1.2 实验方法
1.2.1 复原乳的配制
脱脂乳粉100 g/L,溶解后搅拌均匀,4 ℃静置过夜。添加辅料的复原乳:脱脂乳粉100 g/L,蔗糖70 g/L,低酯果胶1.5 g/L,天然乳清2 g/L[13]。将配制好的复原乳在108 ℃灭菌15 min备用。
1.2.2 活化菌种与接种
前期实验已筛选出具有蛋白水解能力的菌株,如表1所示,所有菌种都保藏于江南大学食品学院生物技术中心。
表1 实验所用菌种
Table 1 Strains used in this study
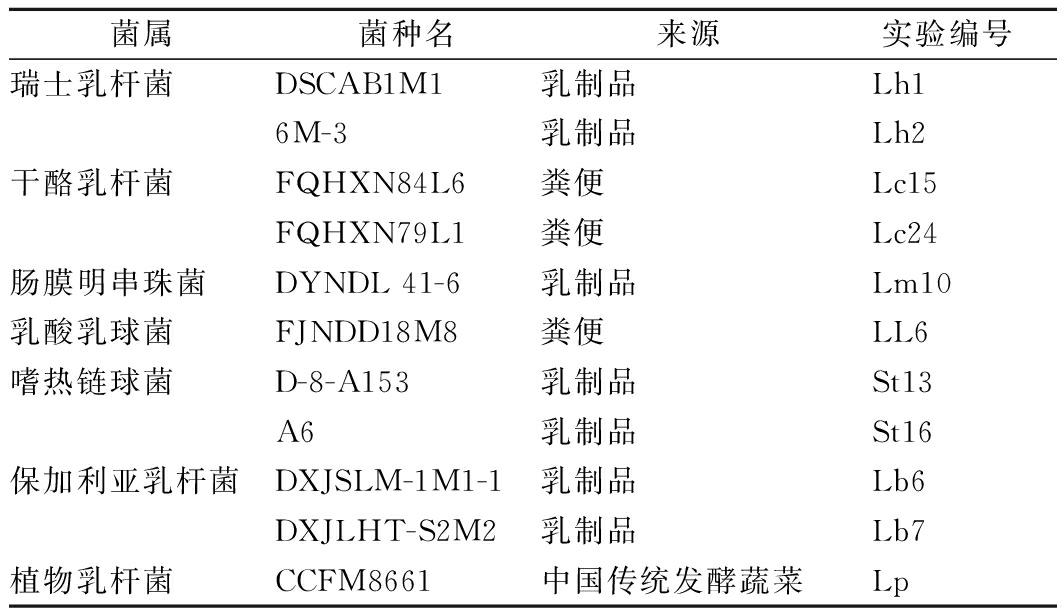
菌属菌种名来源实验编号瑞士乳杆菌DSCAB1M1乳制品Lh16M-3乳制品Lh2干酪乳杆菌FQHXN84L6粪便Lc15FQHXN79L1粪便Lc24肠膜明串珠菌DYNDL 41-6乳制品Lm10乳酸乳球菌FJNDD18M8粪便LL6嗜热链球菌D-8-A153乳制品St13A6乳制品St16保加利亚乳杆菌DXJSLM-1M1-1乳制品Lb6DXJLHT-S2M2乳制品Lb7植物乳杆菌CCFM8661中国传统发酵蔬菜Lp
瑞士乳杆菌、干酪乳杆菌、植物乳杆菌(MRS培养基,37 ℃),肠膜明串珠菌(MRS培养基,30 ℃),乳酸乳球菌(M17+10 g/L乳糖培养基,30 ℃),嗜热链球菌(M17+10 g/L乳糖培养基,42 ℃),保加利亚乳杆菌(MRS培养基,42 ℃)分别活化。传代3次后,将最后一代菌液稀释到合适浓度,在600 nm处测定其吸光度值,根据吸光度值与活菌数的对应关系,用磷酸盐缓冲液对菌液进行调整,使最终活菌数达到1×109 CFU/mL。将菌液接种于灭菌复原乳中,单一发酵接种量是植物乳杆菌1.0×107 CFU/mL,协同发酵接种量是植物乳杆菌、蛋白水解菌株分别为1.0×107 CFU/mL。接种完毕后,轻轻摇动玻璃瓶以分散发酵剂,水浴加热至 35 ℃,于37 ℃静置培养。
1.2.3 产酸能力及活菌数测定
用pH计测量不同时间点的发酵乳的pH值。在12、24、36、48 h分别取发酵乳样品,使用植物乳杆菌选择培养基(LPSM)计数[14],在37 ℃培养48 h,3次平行。已通过验证试验表明,本实验所用瑞士乳杆菌、干酪乳杆菌、肠膜明串珠菌、乳酸乳球菌、嗜热链球菌、保加利亚乳杆菌在LPSM中均不能生长,而植物乳杆菌在LPSM中正常生长。
1.2.4 ABTS阳离子自由基清除能力测定
通过ABTS溶液与酸奶样品反应评估样品抗氧化能力[15]。酸奶样品处理:离心(4 ℃,5 000×g,20 min),后用0.44 μm滤膜过滤。用体积分数为96%乙醇溶液将ABTS溶液稀释到A734 nm=0.700±0.020(A0)。将150 μL样品与3 mL ABTS溶液混合摇匀,黑暗中反应30 min后,在734 nm处测吸光度Ai,通过添加150 μL去离子水代替样品来制备试剂空白,测得吸光度为A0,每个样品平行测定 3次。ABTS阳离子自由基清除能力按公式(1)计算:
ABTS阳离子自由基抑制率![]()
(1)
式中:A0为未添加样品的吸光度值;Ai添加不同样品反应后的吸光度值。
1.2.5 DPPH自由基清除能力测定
酸奶样品处理:离心(4 ℃,5 000×g,20 min)后用0.44 μm滤膜过滤。对处理好的样品测定DPPH自由基清除能力[16],每个样品平行测定 3 次。DPPH自由基清除能力按公式(2)计算:
DPPH自由基抑制率![]()
(2)
式中:A0,未添加样品的吸光度值;Ai,为添加不同样品反应后的吸光度值。
1.2.6 发酵乳持水力测定
取 20 g接种后的发酵乳,在离心管中 37 ℃ 恒温培养至发酵终点,将样品在4 ℃下 500×g 离心 15 min,去除乳清后称重。每个样品平行测定 3 次,按照公式(3)计算持水力:
发酵乳持水力![]()
(3)
式中:m1,离心后样品的质量,g;m2,离心前样品的质量,g。
1.2.7 发酵乳黏度测定
在发酵乳pH值为4.3时终止发酵,用黏度仪测定黏度,温度20 ℃,转子63#,转速2 r/min,每10 s读数1次。
1.2.8 发酵乳色泽测定
用色差计测定发酵乳的L*值、a*值和b*值(L*值代表亮度值;a*值代表红绿值;b*值代表黄蓝值)。每次测定前先用白板矫正。每个样品平行测定 3次。
1.2.9 感官评定
对发酵乳的口感、气味、风味、酸甜度进行感官评定,按照9分刺激法进行评价(1=极端讨厌,9=极端喜欢)[17]。
1.2.10 数据处理及分析方法
所有数据均表示为平均值±标准误差。使用IBM SPSS 23对获得的数据进行统计分析。采用方差分析(ANOVA)的邓肯多重检验比较数据平均值的差异显著性,显著性水平为P<0.05。
2 结果与分析
2.1 产酸能力与活菌数
如图1-a所示,不同发酵剂产酸能力存在差别。在24 h,Lc15/Lp、Lc24/Lp、LL6/Lp、Lh1/Lp、Lh2/Lp都能使发酵乳pH降到4.5以下,其中Lh1/Lp产酸能力最强,达到4.04±0.07。在36 h,Lm10/Lp、Lb6/Lp可使发酵乳pH值降到4.5以下。而St13/Lp、St16/Lp、Lb7/Lp都要在48 h才能使pH降到4.5以下,这是由于发酵温度为37 ℃,不是嗜热链球菌、保加利亚乳杆菌最适生长的温度,故其产酸缓慢。另外,单一的植物乳杆菌产酸缓慢,在48 h的pH始终在5.5以上,这表明其生长不良。

a-不同菌种的产酸水平;
b-协同发酵乳中的植物乳杆菌活菌数
图1 协同发酵中的产酸水平和植物乳杆菌活菌数
Fig.1 Acidification of different starters and viable counts of L.plantarum in different co-fermented milk
注:不同字母表示不同组间的显著性差异(P<0.05)(下同)
根据图1-b,在协同发酵过程中,植物乳杆菌活菌数显著增长。在12 h,协同发酵乳中植物乳杆菌活菌数优势并不明显,这是由于蛋白水解菌株需要将牛乳中本身的多肽利用完全,才能产生蛋白水解作用[18]。而在24 h,可以看到植物乳杆菌活菌数快速增长,最高达到(8.72±0.05)lg CFU/g,这是由于蛋白水解菌株水解蛋白质产生多肽,被植物乳杆菌利用,从而生长受到促进。其中植物乳杆菌活菌数最高的是Lc15/Lp、Lc24/Lp、Lh1/Lp、Lh2/Lp发酵乳,其次是LL6/Lp发酵乳。在36 h,各组仍保持较高的活菌数。在48 h,Lb6/Lp、Lb7/Lp、St13/Lp、St16/Lp发酵乳中植物乳杆菌活菌数都达到顶峰。而对于单一的植物乳杆菌发酵乳,活菌数最高仅有(8.08±0.01)lg CFU/g,且随着发酵进行,活菌数逐渐下降,这是植物乳杆菌不能水解蛋白质,且牛乳中本身的多肽物质不能满足其生长需求。总的来说,协同发酵明显促进了植物乳杆菌在发酵乳中的生长,活菌数显著高于单一的植物乳杆菌发酵乳。
2.2 ABTS阳离子自由基清除能力
发酵乳的抗氧化能力通过测定ABTS阳离子自由基清除能力,用普通发酵乳(嗜热链球菌+保加利亚乳杆菌)作为对照组(下同)。由图2可知,普通发酵乳发酵过程中ABTS阳离子自由基清除能力变化较小,最高为(62.9±0.39)%。而协同发酵乳ABTS阳离子自由基清除能力各组间差异较大。Lc15/Lp、Lc24/Lp、Lh1/Lp、Lh2/Lp协同发酵乳始终保持较高的ABTS阳离子自由基清除能力,均高于对照组(P<0.05),最高达到(78.57±1.9)%。LL6/Lp、Lb6/Lp协同发酵乳的ABTS阳离子自由基清除能力随时间变化,在36 h达到最高,明显高于对照组,而在48 h略有下降。St13/Lp、St16/Lp、Lb7/Lp协同发酵乳的ABTS阳离子自由基清除能力变化较小,略高于对照组。总的来说,协同发酵乳的ABTS阳离子自由基清除能力高于普通发酵乳,其中Lc15/Lp、Lc24/Lp、Lh1/Lp、Lh2/Lp协同发酵乳最为突出。

图2 协同发酵乳的ABTS阳离子自由基清除能力
Fig.2 ABTS cation radical scavenging ability of different co-fermented milk
2.3 DPPH自由基清除能力
DPPH自由基清除能力也用来表示发酵乳的抗氧化能力。如图3所示,普通发酵乳的DPPH自由基清除能力同样在发酵时间内变化较小,最高在(48.62±0.38)%。协同发酵乳不同组别间差距较大,且随着发酵时间进行发生较大变化。Lc15/Lp、Lc24/Lp、Lh2/Lp协同发酵乳在36 h增长到较高水平,Lc24/Lp协同发酵乳达到(81.99±0.56)%,且在48 h仍维持较高的清除能力。Lh1/Lp协同发酵乳DPPH自由基清除能力在24 h已达到(75.67±0.80)%,明显高于对照组,且在36 h仍保持增长。其余组别DPPH自由基清除能力都随着发酵时间增长,在48 h达到最高值。LL6/Lp、St16/Lp协同发酵乳在48 h也展现了较高的清除能力,高于对照组(P<0.05)。总的来说,协同发酵乳清除DPPH自由基能力明显高于普通发酵乳,且受发酵时间影响明显,基本上与清除ABTS阳离子自由基能力一致。
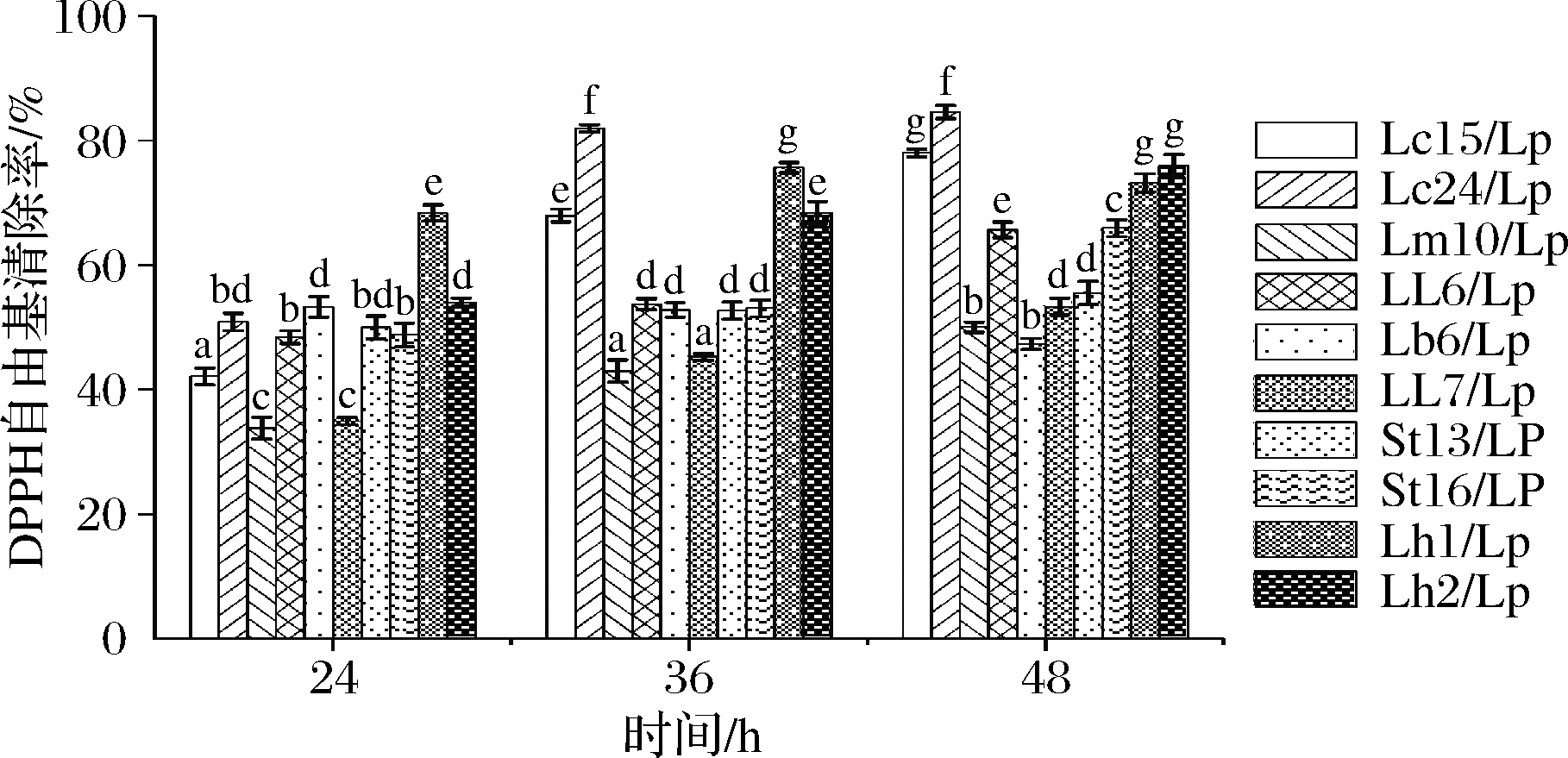
图3 协同发酵乳DPPH自由基清除能力
Fig.3 DPPH free radical scavenging ability of different co-fermented milk
2.4 发酵乳色泽
总体来看,不同发酵剂生产的发酵乳主要在L*、b*有差别,而a*几乎无差别。因此在亮度-黄蓝值图中显示各组发酵乳位置(图4)。L*最直观地显示发酵乳的明亮程度,与对照组相比,大多数协同发酵乳亮度值增加,LL6/Lp、Lc15/Lp、Lc24/Lp、St13/Lp、St16/Lp发酵乳亮度值最高,达到84.02±0.13。Lc15/Lp、Lc24/Lp、LL6/Lp发酵乳提高了b*,最高达到-0.69±0.08,使发酵乳呈现令人愉悦的明亮淡黄色。
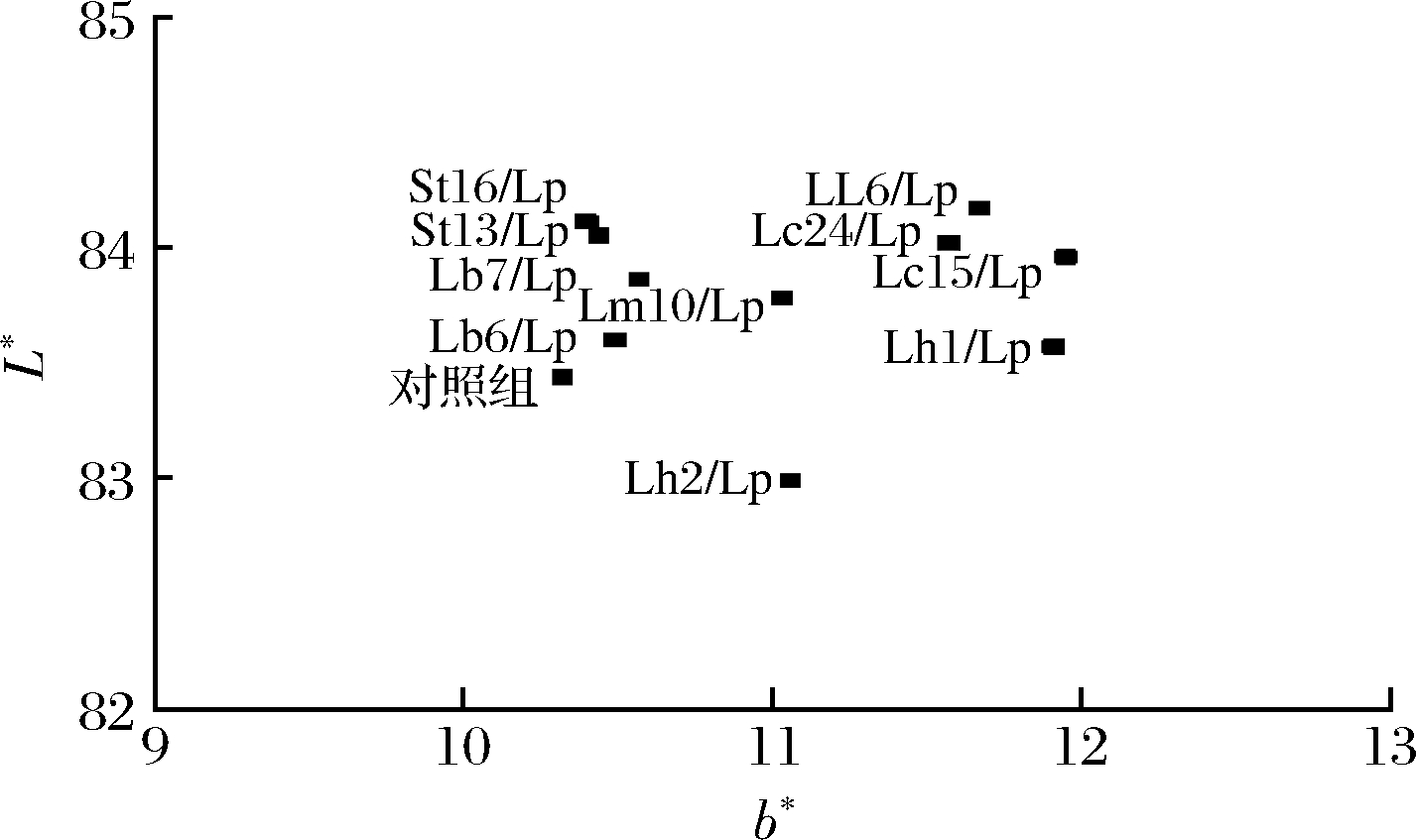
图4 不同菌种生产发酵乳的亮度-黄蓝值位置图
Fig.4 Position of fermented milk by different starters on a lightness-yellow ness diagram
2.5 持水力
酸性条件下,酪蛋白分子形成三维空间胶体结构,可容纳更多的水分。持水力受总固形物、蛋白含量、种类的影响,对发酵乳的口感影响巨大。根据前期试验,发酵乳在pH值4.2~4.3时,发酵乳的感官品质最好,所以选择pH值4.2~4.3作为发酵终点。添加2 g/L乳清蛋白,1.5 g/L低脂果胶作为稳定剂。如图5所示,各组持水力达到较高水平(90%左右),这是由于浓缩乳清蛋白、果胶帮助形成凝胶,使三维空间结构更加稳固[19]。各组持水力趋向于一致,与对照组区别较小,表明在添加稳定剂的情况下,协同发酵方法对发酵乳的持水力影响较小,与普通发酵乳差别不大,可满足感官品质要求。
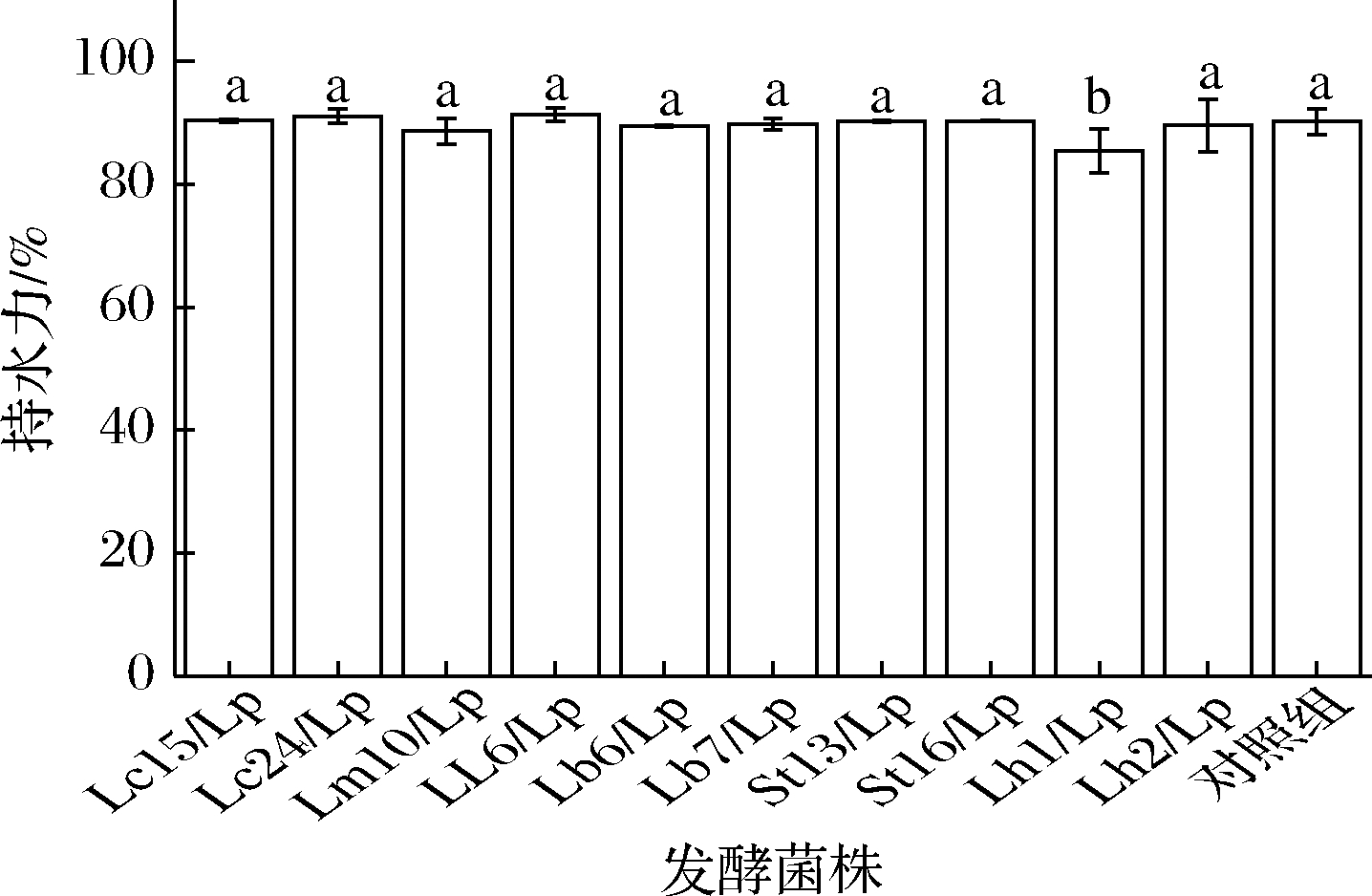
图5 不同菌种生产发酵乳的持水力
Fig.5 Water retention of different co-fermented milk
2.6 黏度
选择pH值4.2~4.3作为发酵终点。添加2 g/L 乳清蛋白,1.5 g/L低脂果胶作为稳定剂。如图6所示,总体上各组黏度都高于对照组。Lc15/Lp发酵乳黏度最高,其次是LL6/Lp、Lh2/Lp、Lm10/Lp,而其他发酵乳黏度与对照组差别不大。这表明在添加稳定剂的情况下,协同发酵生产的植物乳杆菌发酵乳能达到普通发酵乳的黏度,部分组别黏度可以更高,完全满足感官品质要求。
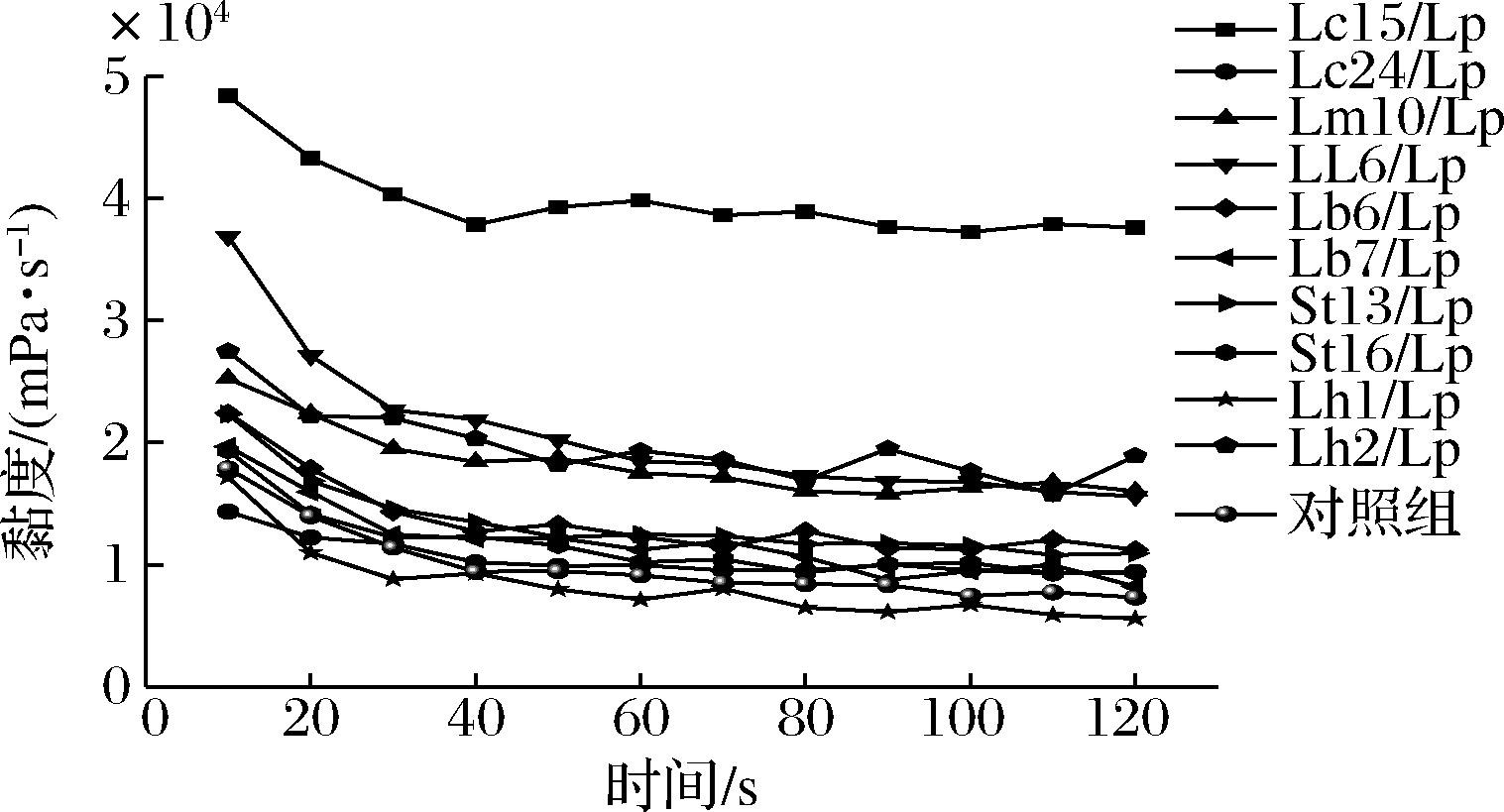
图6 不同发酵乳黏度
Fig.6 Viscosity of different co-fermented milk
2.7 发酵乳感官品质
如表2所示,Lc15/Lp、Lc24/Lp、Lh1/Lp、Lh2/Lp发酵乳的口感、酸甜度都较优良,考虑到其出色的抗氧化能力及较高的植物乳杆菌活菌数,可通过在后续工艺中添加香精香料进一步调节其风味,满足应用需求。而LL6/Lp发酵乳感官评价较为优良,总体评分为8.6±0.1,具有良好的口感、风味、酸甜度。Lb6/Lp、St16/Lp、Lb7/Lp发酵乳也具有较好的感官评价。
表2 协同发酵乳感官品质评价
Table 2 Sensory evaluation of co-fermented milk

感官品质Lc15/LpLc24/LpLm10/LpLL6/LpSt13/LpSt16/LpLb6/LpLb7/LpLh1/LpLh2/Lp对照组口感8.1±0.1a8.3±0.1a7.5±0.1b8.0±0.1a8.3±0.1a8.2±0.1a8.4±0.1a8.3±0.1a8.2±0.1a8.1±0.1a8.3±0.1a气味7.2±0.1a7.0±0.1a6.5±0.1d8.5±0.1b7.2±0.2a7.1±0.1a8.2±0.1c8.4±0.1b7.2±0.1a7.3±0.1a8.4±0.2b风味7.0±0.2a8.1±0.1b7.2±0.2d8.4±0.1c8.3±0.1bc8.0±0.2b8.3±0.1b8.0±0.1b8.1±0.2b7.0±0.2a8.5±0.1b酸甜度8.5±0.1a8.3±0.2a8.0±0.1a9.0±0.1b8.0±0.1a8.3±0.1a9.1±0.1b8.1±0.2a8.5±0.1a8.2±0.1a8.0±0.1b总体接受度7.2±0.2a8.2±0.1b7.1±0.1a8.6±0.1c7.0±0.2a8.5±0.1c8.9±0.1c8.5±0.1c8.3±0.2b7.3±0.2a8.7±0.1c
3 结论
本实验通过将前期筛选得到的具有一定蛋白水解能力的乳酸菌菌株与植物乳杆菌协同发酵,并对产酸能力、植物乳杆菌活菌数、抗氧化能力、发酵乳色泽、持水力、黏度、感官评价进行测定。整体来看,协同发酵方法生产的植物乳杆菌发酵乳品质优良,发酵乳中植物乳杆菌活菌数显著增高。其中Lc15/Lp 发酵乳中植物乳杆菌活菌数达到(8.72±0.05)lg CFU/g,Lc24/Lp发酵乳植物乳杆菌活菌数达到(8.60±0.08) lg CFU/g。Lc24/Lp发酵乳还具有ABTS阳离子自由基清除能力和DPPH自由基清除能力分别为(78.57±1.9)%、(81.99±0.56%),其感官品质良好的特点,Lc15/Lp、Lh1/Lp、Lh2/Lp发酵乳也具有类似的性质。LL6/Lp发酵乳抗氧化能力中等,但感官品质优良。此研究解决了植物乳杆菌在发酵乳中生长不良、难以凝乳的问题,有利于植物乳杆菌在发酵乳产业中的广泛应用。
[1] SIEZEN R J,TZENEVA V A,CASTIONI A,et al.Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches[J].Environmental Microbiology,2010,12(3):758-773.
[2] GEORGIEVA R,ILIEV I,HAERTLÉ T,et al.Technological properties of candidate probiotic Lactobacillus plantarum strains[J].International Dairy Journal,2009,19(11):696-702.
[3] 朱广素, 王刚,王园园,等.三株植物乳杆菌对代谢综合征大鼠肠道菌群的影响[J].食品与发酵工业,2018,44(9):53-60.
ZHU G S,WANG G,WANG Y Y,et al.Effects of three Lactobacillus plantarum strains on gut microbiota in metabolic syndrome rats[J]..Food and Fermentation Industries,2018,44(9):53-60.
[4] 金星, 贺禹丰,周永华,等.具有高细胞黏附性及高生物膜形成能力的植物乳杆菌有效抑制小鼠体内空肠弯曲杆菌毒力因子的转录活性[J].食品与发酵工业,2020,46(14):12-18.
JIN X,HE Y F,ZHOU Y H,et al.Lactobacillus plantarum with high cell adhesion and biofilm formation ability effectively inhibits the transcriptional activities of Campylobacter jejuni virulence genes in mice[J].Food and Fermentation Industries,2020,46(14):12-18.
[5] 朱广素, 王刚,王园园,等.植物乳杆菌通过调节肠道短链脂肪酸水平缓解代谢综合征[J].食品科学,2019,40(13):102-109.
ZHU G S,WANG G,WANG Y Y,et al.Lactobacillus plantarum alleviates metabolic syndrome by modulating intestinal short-chain fatty acid levels[J].Food Science,2019,40(13):102-109.
[6] KLEEREBEZEM M,BOEKHORST J,VAN KRANENBURG R,et al.Complete genome sequence of Lactobacillus plantarum WCFS1[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(4):1 990-1 995.
[7] HÉBERT E M,RAYA R R,DE GIORI G S.Modulation of the cell-surface proteinase activity of thermophilic lactobacilli by the peptide supply[J].Current Microbiology,2002,45:385-389.
[8] ARYANA K J,OLSON D W.A 100-Year Review:Yogurt and other cultured dairy products[J].Journal of Dairy Science,2017,100(12):9 987-10 013.
[9] OH N S,JOUNG J Y,LEE J Y,et al.Characterization of the microbial diversity and chemical composition of Gouda cheese made by potential probiotic strains as an adjunct starter culture[J].Journal of Agricultural and Food Chemistry,2016,64(39):7 357-7 366.
[10] AYDEMIR O,HARTH H,WECKX S,et al.Microbial communities involved in Ka ar cheese ripening[J].Food Microbiology,2015,46:587-595.
ar cheese ripening[J].Food Microbiology,2015,46:587-595.
[11] TIAN F W,ZHAI Q X,ZHAO J X,et al.Lactobacillus plantarum CCFM8661 alleviates lead toxicity in mice[J].Biological Trace Element Research,2012:264-271.
[12] 田丰伟, 翟齐啸,孙媛媛,等.缓解铅毒性植物乳杆菌 CCFM8661 的微生物学性质及其应用的研究[J].食品安全质量检测学报,2014,5(4):1 010-1 015.
TIAN F,ZHAI Q X,SUN Y Y,et al.A preliminary study of microbiological properties and applications of Lactobacillus plantarum CCFM8661[J].Journal of Food Safety and Quality,2014,5(4):1 010-1 015.
[13] HANG F,JIANG Y Z,YAN L W,et al.Preliminary study for the stimulation effect of plant-based meals on pure culture Lactobacillus plantarum growth and acidification in milk fermentation[J].Journal of Dairy Science,2020,103(5):4 078-4 087.
[14] BUJALANCE C,JIMÉNEZ-VALERA M,MORENO E et al.A selective differential medium for Lactobacillus plantarum[J].Journal of Microbiological Methods,2006,66(3):572-575.
[15] PERNA A,INTAGLIETTA I,SIMONETTI A,et al.Donkey milk for manufacture of novel functional fermented beverages[J].Journal of Food Science,2015,80(6):S1 352-S1 359.
[16] ZHANG Y W,ZHANG H,WANG L,et al.Influence of the degree of hydrolysis (DH) on antioxidant properties and radical-scavenging activities of peanut peptides prepared from fermented peanut meal[J].European Food Research and Technology,2011,232(6):941-950.
[17] DIMITRELLOU D,SALAMOURA C,KONTOGIANNI A,et al.Effect of milk type on the microbiological,physicochemical and sensory characteristics of probiotic fermented milk[J].Microorganisms,2019,7(9).DOI:10.3390/microorganisms7090274.
[18] HÉBERT E M,RAYA R R,DE GIORI G S.Modulation of the cell-surface proteinase activity of Thermophilic lactobacilli by the peptide supply[J].Current Microbiology,2002,45(6):385-389.
[19] WANG W,BAO Y B,HENDRICKS G M,et al.Consistency,microstructure and probiotic survivability of goats’ milk yoghurt using polymerized whey protein as a co-thickening agent[J].International Dairy Journal,2012,24(2):113-119.