乳液是由2种或2种以上互不相溶的液相组成的多相分散体系,其中内相以液滴的形式分散于外相。由于存在的油/水界面面积大,体系吉布斯自由能高,本质上属于热力学不稳定体系[1]。因此,传统乳液往往需添加乳化剂(如表面活性剂或聚合物),以降低体系界面张力,提高乳液稳定性[2]。20世纪初,RAMSDEN[3]首次发现胶体尺寸的固体颗粒可以用于稳定乳液。随后,PICKERING[4]对其进行了更为系统的研究,为表彰其突出贡献,由固体颗粒代替乳化剂而制备的乳液被命名为 Pickering 乳液。近年来,Pickering乳液因其具有高抗聚结性、环境友好性、成本较低等优点,在食品、农业、医药等领域受到了研究人员的广泛关注[5]。
目前,各种无机纳米粒子已被广泛应用于Pickering乳液。但无机纳米粒子存在有毒、不易降解、生物相容性低等缺陷,限制了其在食品领域的应用[6]。因此,寻求环境友好型、天然来源、可再生和可生物降解的固体颗粒用于稳定 Pickering 乳液已成为目前研究的热点[7-8],如淀粉纳米颗粒[9]、甲壳素纳米晶[10]、大豆分离蛋白[11]、玉米醇溶蛋白[12]和纤维素纳米晶体[13]等。其中,通过硫酸水解纤维素制备的纤维素纳米晶体(cellulose nanocrystals,CNC)因其独特的棒状形态在诸多纳米纤维素材料中备受关注[14]。棒状CNC呈现出的高比表面积和高长径比,赋予其高吸附能力及强亲和力,CNC表面还存在着丰富的羟基,是极佳的纳米粒子生长还原剂和成核位点[15-16]。利用CNC作为有机或无机纳米材料的生长模板开发新型纳米功能材料已成为当下CNC研究与应用的一大热点。以CNC为生物基模板合成的磁性纤维素纳米晶体(magnetic cellulose nanocrystal,MCNC),具有特殊的磁响应性能[17]。本文用超声共沉淀法制备MCNC,对其形貌进行表征,探究了MCNC与不同水溶性聚合物间的相互作用及其协同稳定Pickering乳液的效果。通过比较不同乳液的基本性质、界面特性和流变特性,并结合冷冻扫描电子显微镜成像,揭示了MCNC与不同水溶性聚合物间的相互作用及其在乳液中的稳定机制。
1 材料与方法
1.1 材料与试剂
纤维素纳米晶,湖州闪思新材料科技有限公司;亚麻籽油,河北爱度生物科技股份有限公司;甲基纤维素(methylcellulose, MC)、羟丙基甲基纤维素(hydroxypropyl methylcellulose, HPMC),北京酷来搏科技有限公司;FeCl2·4H2O、FeCl3·6H2O、NH3·H2O(25%~28%)、无水乙醇(≥95%),均为分析纯,国药集团化学试剂北京有限公司;聚乙烯亚胺,北京索莱宝科技有限公司;实验用水均为超纯水。
1.2 仪器与设备
SCIENTZ-950E超声波细胞破碎机,中国宁波新芝生物科技有限公司;T18高速匀浆机,德国IKA公司;FB-110Q纳米级高压均质机,中国上海励图机械;LS13 320 激光粒度仪,美国Beckman公司;OCA25视频接触角测量仪,德国Dataphysics公司;DHR2旋转流变仪,美国TA仪器;QSENCE-E4石英晶体微天平,瑞典Biolin公司;SU8010冷冻扫描电镜,日本HITACHI公司。
1.3 实验方法
1.3.1 磁性纤维素纳米晶体的制备
参考LOW等[18]的方法,通过超声-共沉淀法制备MCNC。称取一定质量的CNC分散于超纯水中,冰浴超声900 W/5 min制得均匀稳定的0.4%(以湿重计) CNC分散液,取100 mL分散液依次分别加入FeCl2·4H2O 0.18 g和FeCl3·6H2O 0.37 g,保持Fe2+/Fe3+摩尔比为1∶1.5;然后将混合反应液45 ℃水浴、800 r/min机械搅拌10 min,同时滴加NH3·H2O调节反应液pH值至10;在80 W功率下超声处理5 min,促进晶核形成与生长。结束后用无水乙醇、超纯水冲洗4次以去除杂质,用磁铁分离产物MCNC,真空冷冻干燥后隔氧避光保存,待用。在无CNC基质的情况下,以相同条件合成Fe3O4作为对照。
1.3.2 乳液的制备
经前期预实验优化参数,选择质量分数0.2% MCNC及0.3% MC、0.3% HPMC单独或者等体积混合分散液做水相,以亚麻籽油作为油相,V(油)∶V(水)=30∶70,在12 000 r/min高速剪切2 min,再在50 MPa下高压均质3 min制备Pickering乳液,分别标记为MCNC-PE,MCNC/MC-PE,MCNC/HPMC-PE。
1.3.3 乳液的粒径分布
使用LS13 320激光粒度仪测定乳液的粒径分布。选择Induce PIDS模式,模型为Fraunhofer.rf 780 d。滴加样品后,偏振光散射强度差保持在40%~50%,测定乳液的粒径分布。
1.3.4 乳化体系油-水界面张力的测定
使用OCA25视频接触角测量仪,参考NI等[19]的方法采用悬滴法(pendant drop)测定油-水界面张力。在5.0 cm×5.0 cm×5.0 cm矩形样品池中倒入亚麻籽油作油相,0.51 mm针头浸入油液面以下,定量挤出5 μL乳化剂小液滴,用视频接触角测量仪拍照记录20 min内的液滴形态变化,并由液滴形状依据LaPlace-Young公式计算界面张力。
1.3.5 流变特性分析
参考LI等[20]的方法使用DHR-2流变仪表征不同乳液体系的流变特性。选用直径为40 mm锥度为2°的不锈钢椎板夹具,测试模式为Flow Ramp模式,测定温度25 ℃,平衡时间30 s,间距1 050 μm,剪切速率1~100 s-1,测定时间60 s,测定黏度/剪切应力-剪切速率曲线。
1.3.6 石英晶体微天平分析
根据JAAFAR等[21]方法略作修改,采用石英晶体微天平重量法(quartz crystal microbalance with dissipation,QCM-D)探究MC、HPMC对MCNC的吸附作用。
MCNC-SiO2传感器:SiO2晶片用乙醇清洗、纯水冲洗、氮气吹干;再将洁净的SiO2晶片置于旋涂仪,涂布1滴1 g/L 聚乙烯亚胺溶液;滴加1滴质量分数0.2% MCNC分散液于旋转的SiO2晶片上,维持转速4 000 r/30 s;涂布完成的SiO2晶片于80 ℃/15 min下热固定,防止MCNC脱吸附。
QCM-D测定流程:记录传感器接触吸附介质时的频移Δf和耗散系数D(第3、5、7、9、11倍频)。平衡基线:先分别以空气、超纯水在100 μL/min流速下平稳基线,至各倍频无明显差异;将1 g/L MC或HPMC水溶液以100 μL/min流速注入,直至再次平稳;再以超纯水在100 μL/min流速下注入直至平稳。
1.3.7 冷冻扫描电镜分析
参考DELOID等[22]的方法,通过冷冻扫描电镜(cryo-sanning electron microscope,cryo-SEM)揭示乳液液滴的微观结构。选用针头直径0.45 mm的1 mL注射器,挤1滴乳液于样品托上,注意排除气泡;样品于130 K(-143.5 ℃)的过冷液氮中速冻;结束后转移到真空环境的冷台上横向切割,冷冻升华连续相,使乳液微球充分暴露;升华后样品横截面溅射镀铂金,cryo-SEM进行超微结构观察。
1.3.8 统计分析方法
采用SPSS 20进行数据分析,Origin 8.0 软件作图。
2 结果与分析
2.1 MCNC表征
采用超声-共沉淀法,在80 W/5 min超声处理下,以CNC为反应模板制备磁性纳米复合物MCNC;并在无CNC基质的情况下,以相同制备条件合成的磁性纳米粒子Fe3O4作为对照。
如图1所示,通过透射电镜(transmission electron microscopy,TEM)进行表征,超声-共沉淀法合成的Fe3O4呈球形结构,尺寸分布较均匀,直径为7~10 nm,但由于高表面能和磁偶极子相互作用[17],颗粒之间严重聚集形成非常不规则的团块,影响了其分散性。CNC呈现典型的棒状结构且具有较大的长径比,这一独特结构有利于其为Fe3O4粒子提供充足的结合位点。利用超声-共沉淀法成功制备了表面吸附Fe3O4的纳米复合物MCNC,Fe3O4纳米粒子均匀稳定的分散于MCNC表面。MCNC上吸附的Fe3O4粒子尺寸分布较为均匀,直径约8 nm,与纯Fe3O4尺寸相接近。此外,MCNC分散液在进行TEM观察前已进行过超声处理,然而大部分Fe3O4依然被吸附于CNC表面,说明CNC与Fe3O4间存在较强相互作用,使Fe3O4不易脱落。

图1 TEM图像
Fig.1 TEM images
2.2 不同乳化体系的油-水界面张力
乳化剂的界面张力与乳液的形成和稳定密切相关,高效的乳化剂必须能够降低油-水界面张力[23]。为评估所制备的磁改性MCNC及其与水溶性聚合物在亚麻籽油-水界面的乳化性能,通过悬滴法测定了20 min内不同乳化体系的界面张力-时间曲线(图2)。MCNC分散液在测定开始时界面张力迅速下降,表明MCNC可以快速吸附到油-水界面上[23]。相比于单独的MCNC分散液,MCNC与聚合物的复合乳化体系表面活性提高,复合体系的混合溶液在20 min时,界面张力即降至7.31 mN/m,介于MCNC和聚合物之间,这意味着MCNC与聚合物的复合乳化体系能够更快吸附在油-水界面并降低界面张力。已有研究表明,乳化剂先在油-水界面吸附,继而在油滴周围经过构象重排形成黏弹性薄膜的能力,因此乳化剂的界面吸附能力是影响乳液形成的重要因素[24]。因此,从这一方面来说,MCNC和水溶性聚合物具有协同稳定乳液的潜力。
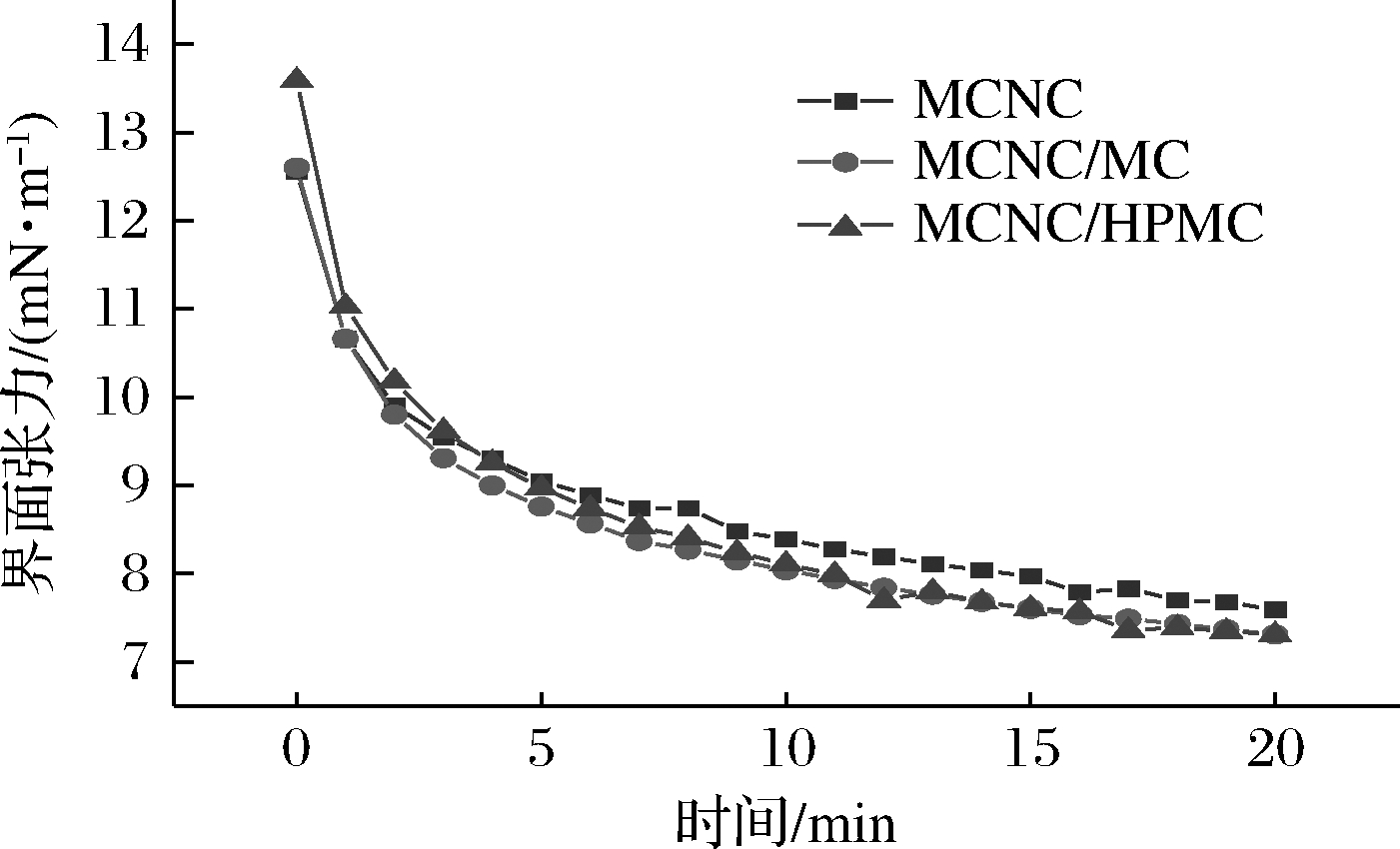
图2 不同乳化体系的油/水界面张力-时间曲线
Fig.2 Oil/water interfacial tension-time curves of different dispersion
2.3 MCNC/衍生物之间的相互作用分析
MCNC和非离子型纤维素MC或HPMC之间的协同作用不等同于2种乳化剂成分的简单混合,需要两者之间相互作用(吸附行为),才能发挥更佳的整体效应。因而,采用QCM-D法评定2种水溶性聚合物MC、HPMC和MCNC之间的物理吸附效果,测定MCNC-SiO2传感器在特定程序下的频率变化Δf以反映聚合物于MCNC表面的吸附情况。图3-a显示了在3倍频(15 MHz)下的频移-时间曲线,发现加入MC溶液,Δf3曲线即出现急剧下降,这种负频移是由于耦合质量的增加导致的,表明MC聚合物大分子在MCNC上发生吸附[25],饱和值达-100 Hz;而HPMC则未发生该反应。MC、HPMC质量吸附导致ΔD值增大的情况与Δf曲线变化类似,而当冲洗时则发生轻微的Δf上升和ΔD下降,这是由于部分聚合物发生了解吸附。
运用QTools软件以苏伯雷方程(Sauerbrey formula)对Δf3数据进行拟合,如公式(1)所示可以获得MCNC-SiO2传感器表面吸附的聚合物质量随时间变化曲线(图3-c)。
(1)
式中:CQCM,质量灵敏度常数,(17.7 ng·cm2/Hz,f=5 MHz);n,倍频数,(1,3,…)。
吸附质量-时间曲线可给出吸附过程整体动力学图像。由图3可知,加入MC溶液,在MCNC上的吸附质量显著升高,饱和值达到1 756 ng/cm2,即使再经水冲洗也只是略有下降,这表明非离子聚合物MC与MCNC之间通过氢键结合牢固。而HPMC吸附质量则相对极低,饱和值仅104 ng/cm2,表明HPMC在MCNC上的吸附相对微弱。

a-频移-时间曲线;b-耗散系数-时间曲线;c-吸附质量-时间曲线
图3 QCM-D测定MC、HPMC在MCNC表面的吸附特征
Fig.3 Adsorption characteristics of MC,HPMC on MCNCs-coated sensors determined by QCM-D
2.4 不同乳液体系的表征
如图4所示,单独由MCNC稳定的MCNC-PE,粒径呈多峰分布,液滴大小不均匀。MCNC/MC协同稳定的乳液比MCNC单独稳定的乳液粒径更大。但MCNC/MC-PE呈单峰分布,粒径变化更加均匀连续,而不像MCNC-PE呈多峰分布。根据胶体排空相互作用理论(大小不等颗粒组成的多相体系,小颗粒和大颗粒之间的排空作用力会导致大颗粒聚集倾向)[26],这意味着均匀的粒径分布可能会提高乳液体系稳定性。而MCNC/HPMC-PE粒径分布则呈双峰分布,不利于乳液的长期稳定性。单独由MCNC稳定的乳液经长期贮存后没有分层(图5),但会因液滴的聚结而发生了少部分油析;而MCNC/MC和MCNC/HPMC混合体系协同稳定的乳液可以避免液滴破乳油析,MCNC/MC稳定的乳液短期内稳定性良好,但长期贮存后,两者均发生了明显分层。
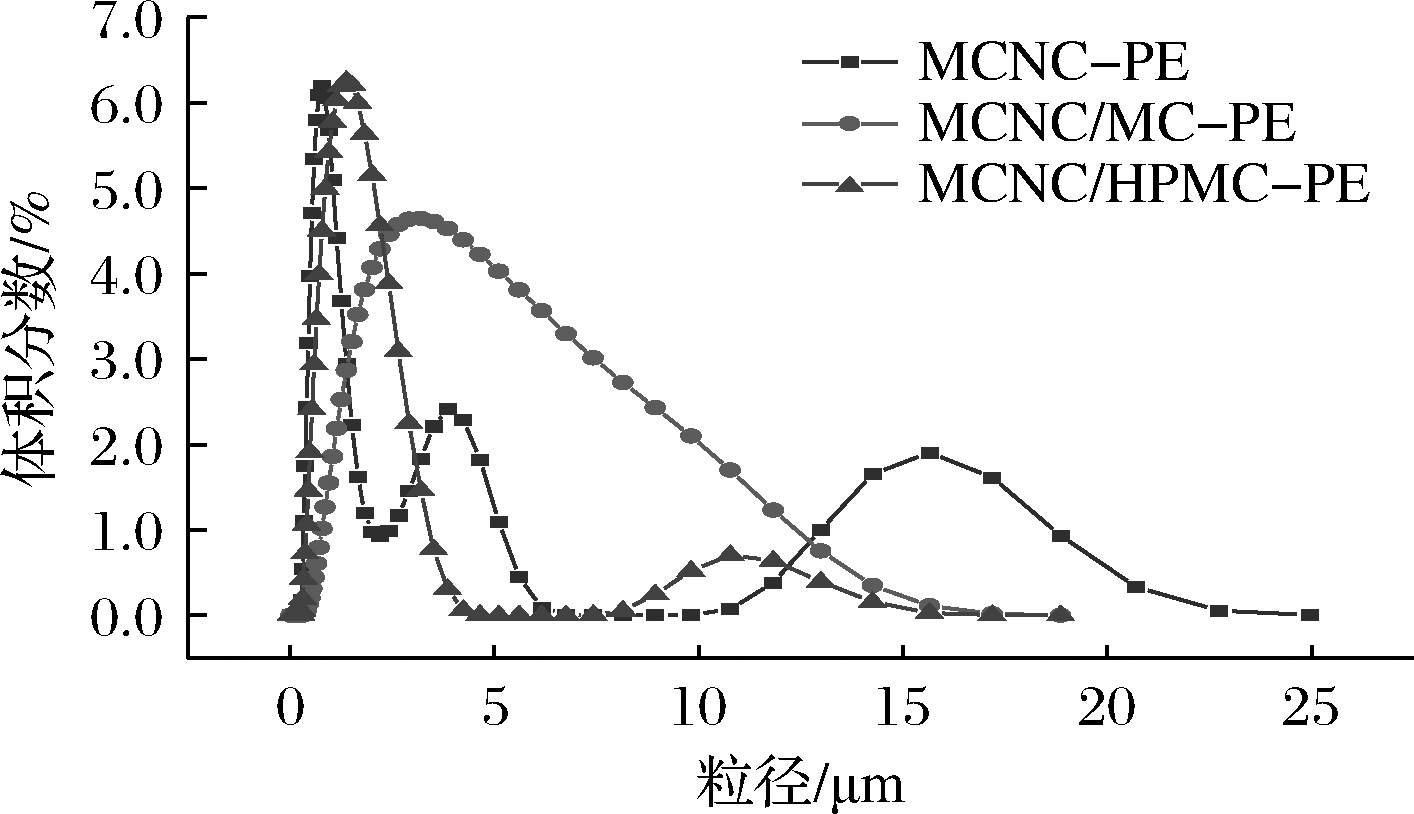
图4 不同乳液体系的粒径分布
Fig.4 Particle size distribution of different Pickering emulsions

a-f-分别为第0,3,7,14,21,28天;
从左到右依次为:MCNC-PE、MCNC/MC-PE、MCNC/HPMC-PE
图5 不同乳液在贮藏期内的外观变化
Fig.5 Appearance changes of different emulsions during storage
2.5 不同乳液体系的流变特性
MCNC及水溶性聚合物MC、HPMC单独或协同制备乳液MCNC-PE、MCNC/MC-PE、MCNC/HPMC-PE的流体力学曲线如图6所示。由结果可知,3种乳液体系表观黏度大小依次为ηMCNC/MC-PE>ηMCNC/HPMC-PE>ηMCNC-PE,且均表现出剪切稀化特性,这与MCNC、MCNC/MC、MCNC/HPMC乳化体系的流变特性相一致。此外,利用Herschel-Bulkley方程进行剪切应力-剪切速率曲线拟合,相关系数R2>0.99,模型拟合参数值详见表1。
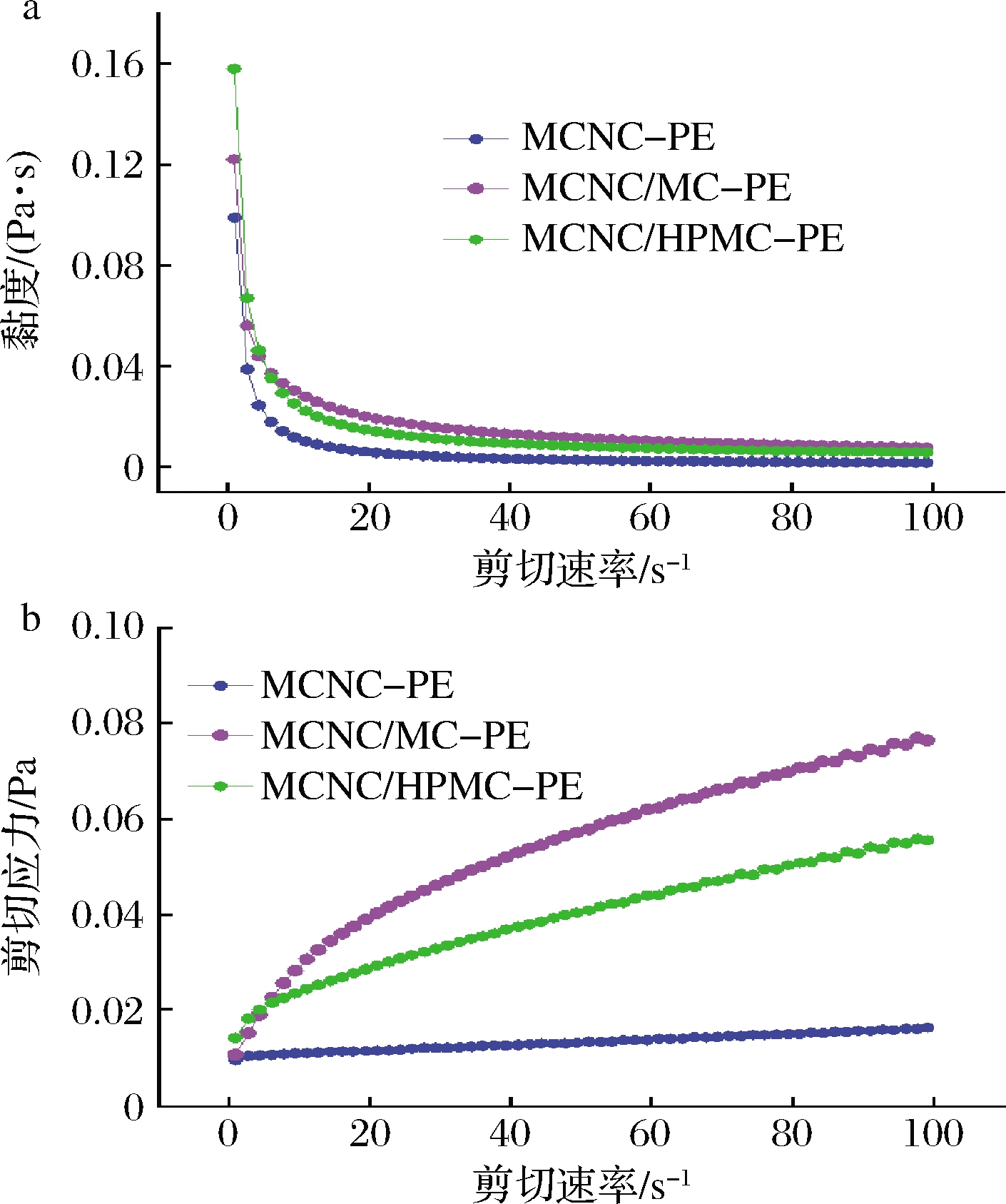
a-黏度-剪切速率曲线;b-剪切应力-剪切速率曲线
图6 不同乳液体系的流变特性
Fig.6 Rheological characteristics of different Pickering emulsions
表1 不同乳液体系的Herschel-Bulkley模型拟合参数值
Table 1 Parameters of Herschel-Bulkley model of different Pickering emulsions
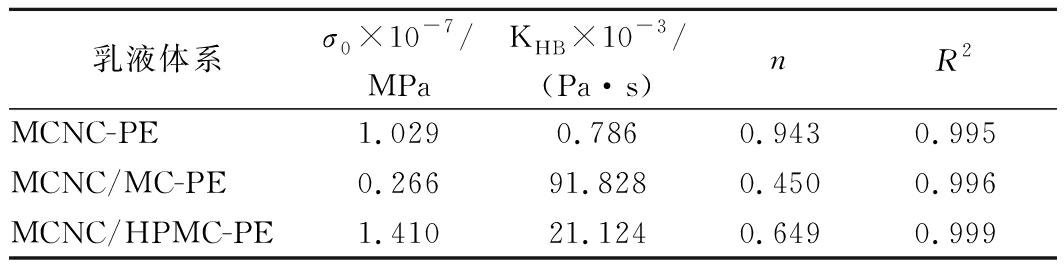
乳液体系σ0×10-7/MPaKHB×10-3/(Pa·s)nR2MCNC-PE1.0290.7860.9430.995MCNC/MC-PE0.26691.8280.4500.996MCNC/HPMC-PE1.41021.1240.6490.999
乳液体系黏度的增大,可以减缓密度较小的乳化液滴上浮或密度较大的固体颗粒沉淀的速度,降低乳化层和水相分层程度,改善乳液贮存过程中的物理稳定性。在研究不同质量浓度对MCNC及水溶性聚合物稳定Pickering乳液稳定性的影响时,发现随着水溶性聚合物MC或HPMC浓度增大,乳、水两相分层程度降低,乳化层保留率更大。但是,乳液体系黏度不是影响其物理稳定性的唯一因素,由于乳化剂不同性质造成液滴之间相互作用的差异也会影响其在长期存储过程中的稳定性[27]。
2.6 MCNC/Polymer协同稳定乳液的机理
Cryo-SEM技术能够实时、准确地反映乳液的真实微观形貌,是目前表征纳米颗粒(<200 nm)的最先进技术之一,可以为乳液稳定机制提供直观的认知依据[28]。MCNC、MCNC/MC、MCNC/HPMC 3种乳化体系制备Pickering乳液的cryo-SEM图像如图7所示。单独由MCNC稳定的乳液上可观察到在液滴表面吸附、堆积的棒状纳米纤维(图7-a),进一步证明了MCNC通过在油-水界面形成致密堆积层以稳定乳液。在乳液的液滴间也可发现MCNC形成“鸟巢”状连接,这种空间阻隔可避免或减缓液滴之间的聚结[29];此外,当一个液滴同时受到来自另外2个相邻液滴上MCNC纤维网络的牵拉时,会发生变形[30],这使得MCNC-PE许多液滴并非呈规则的圆形,且乳液在贮存过程中也将会处于这种动态稳定的状态[31]。

a-MCNC-PE;b-MCNC/MC-PE;c-MCNC/HPMC-PE
图7 Pickering乳液的cryo-SEM图像
Fig.7 Cryo-SEM images of Pickering emulsions
由图7-b可知,由MCNC、MC协同稳定的乳液MCNC/MC-PE液滴间呈现“神经元”状连接,从微米级尺寸判断其应为MC纤维素分子。另外,在单独的液滴表面可以发现细小棒状颗粒堆积形成的褶皱,这是MCNC纳米纤维素吸附于油-水界面喷涂铂金后的印迹。这表明MCNC/MC-PE具有双重稳定机理:一方面,通过MCNC和MC分子共同吸附于油滴表面形成界面膜稳定乳液(固体颗粒界面膜理论)[32];另一方面,在MCNC/MC强吸附作用下,MC纤维素分子搭接于2个相邻液滴间,形成“神经元”状网络结构,增大了连续相的黏度,进一步避免液滴发生碰撞聚结,提高乳液稳定性(三维黏弹粒子网络机理)[33]。此外,液滴间相互桥连的方式使得乳化层形成致密的空间结构,并因密度低于连续相而逐渐上浮,进而在长期存储过程中发生分层、乳析。
从图7-c可以看出,乳液MCNC/HPMC-PE液滴间布满一层层的纤维网络,且在单独液滴表面可以观察到长约十几微米的凸起条纹,应为界面吸附的HPMC纤维素分子,但却难以在液滴表面找到棒状纳米颗粒MCNC。这主要是由于MCNC、HPMC之间的吸附作用较弱,且HPMC的油-水界面张力显著低于MCNC,具有更强的表面活性,因此MCNC、HPMC在油-水界面的吸附可能是竞争性的[34]。因此HPMC会优先吸附于界面,而MCNC只有少数得以吸附,其余MCNC只能游离分散于连续相,导致在cryo-SEM观察下很难找到MCNC的痕迹。
综上所述,MCNC/MC协同稳定Pickering乳液极大改善了其长期稳定性。通过cryo-SEM对乳液微观结构的研究,揭示了其稳定机制符合固体颗粒界面膜理论(机械阻隔理论)和三维黏弹粒子网络机理。
3 结论
本文探究了磁性纤维素纳米晶体与水溶性聚合物间相互作用,并分析了乳化体系及乳液体系的流变特性。石英晶体微天平结果显示仅MCNC/MC之间存在较强的吸附作用,而MCNC/HPMC则无明显吸附。推测MCNC/MC可发挥协同乳化效果,而MCNC/HPMC可能为竞争性吸附。MC的加入可以降低界面张力,提高乳液体系黏度,具有促进乳液稳定的趋势。利用冷冻扫描电镜技术,发现MCNC或MCNC/MC稳定乳液的机理符合固体颗粒界面膜理论和三维黏弹粒子网络机理。
[1] MCCLEMENTS D J,GUMUS C E.Natural emulsifiers-biosurfactants,phospholipids,biopolymers,and colloidal particles:Molecular and physicochemical basis of functional performance[J].Advances in Colloid and Interface Science,2016,234:3-26.
[2] BAI L,HUAN S Q,XIANG W C,et al.Pickering emulsions by combining cellulose nanofibrils and nanocrystals:phase behavior and depletion stabilization[J].Green Chemistry,2018,20(7):1 571-1 582.
[3] RAMSDEN W.Separation of solids in the surface-layers of solutions and ‘Suspensions’(Observations on surface-membranes,bubbles,emulsions,and mechanical coagulation).Preliminary account[J].Proceedings of the Royal Society of London,1903,72(479):156-164.
[4] PICKERING S U.Emulsions[J].Journal of the Chemical Society,1907,91:2 001-2 021.
[5] LINKE C,DRUSCH S.Pickering emulsions in foods-opportunities and limitations[J].Critical Reviews in Food Science and Nutrition,2018,58(12):1 971-1 985.
[6] TAVERNIER I,WIJAYA W,VANDER MEEREN P,et al.Food-grade particles for emulsion stabilization[J].Trends in Food Science and Technology,2016,50(50):159-174.
[7] SARKAR A,DICKINSON E.Sustainable food-grade Pickering emulsions stabilized by plant-based particles[J].Current Opinion in Colloid & Interface Science,2020.https://doi.org/10.1080/10408398.2020.1832440.
[8] MA T,HU X N,LU S Y,et al.Nanocellulose:A promising green treasure from food wastes to available food materials[J].Critical Reviews in Food Science and Nutrition,2020,on line.
[9] YANG T,ZHENG J,ZHENG B S,et al.High internal phase emulsions stabilized by starch nanocrystals[J].Food Hydrocolloids,2018,82:230-238.
[10] ZHOU H L,TAN Y B,LYU S S,et al.Nanochitin-stabilized Pickering emulsions:Influence of nanochitin on lipid digestibility and vitamin bioaccessibility[J].Food Hydrocolloids,2020,106:105 878.
[11] TANG C H,Emulsifying properties of soy proteins:A critical review with emphasis on the role of conformational flexibility[J].Critical Reviews in Food Science and Nutrition,2017,57(12):2 636-2 679.
[12] DAI L,YANG S F,WEI Y,et al.Development of stable high internal phase emulsions by Pickering stabilization:Utilization of zein-propylene glycol alginate-rhamnolipid complex particles as colloidal emulsifiers[J].Food Chemistry,2019,275:246-254.
[13] DU LE H,LOVEDAY S M,SINGH H,et al.Pickering emulsions stabilised by hydrophobically modified cellulose nanocrystals:Responsiveness to pH and ionic strength[J].Food Hydrocolloids,2020,99:105 344.
[14] SARKAR A,ZHANG S N,HOLMES M,et al.Colloidal aspects of digestion of Pickering emulsions:Experiments and theoretical models of lipid digestion kinetics[J].Advances in Colloid and Interface Science,2019,263:195-211.
[15] CAO L M,CHENG Z Z,YAN M W,et al.Anisotropic rubber nanocomposites via magnetic-induced alignment of Fe3O4/cellulose nanocrystals hybrids obtained by templated assembly[J].Chemical Engineering Journal,2019,363:203-212.
[16] DHAR P,KUMAR A,KATIYAR V.Magnetic cellulose nanocrystal based anisotropic polylactic acid nanocomposite films:Influence on electrical,magnetic,thermal,and mechanical properties[J].ACS Applied Materials & Interfaces,2016,8(28):18 393-18 409.
[17] LOW L E,TEY B T,ONG B H,et al.Dispersion stability,magnetivity and wettability of cellulose nanocrystal(CNC)-dispersed superparamagnetic Fe3O4 nanoparticles:impact of CNC concentration[J].RSC Advances,2016,6(114):113 132-113 138.
[18] LOW L E,TEY B T,ONG B H,et al.A facile and rapid sonochemical synthesis of monodispersed Fe3O4@cellulose nanocrystal nanocomposites without inert gas protection[J].Asia-Pacific Journal of Chemical Engineering,2018,13(4):UNSP e2209.
[19] NI Y,FAN L P,SUN Y.Interfacial properties of cellulose nanoparticles with different lengths from ginkgo seed shells[J].Food Hydrocolloids,2020,109:106 121.
[20] LI W W,WANG Y S,ZHAO H B,et al.Improvement of emulsifying properties of soy protein through selective hydrolysis:Interfacial shear rheology of adsorption layer[J].Food Hydrocolloids,2016,60:453-460.
[21] JAAFAR Z,MAZEAU K,BOISSIERE A,et al.Meaning of xylan acetylation on xylan-cellulose interactions:A quartz crystal microbalance with dissipation(QCM-D) and molecular dynamic study[J].Carbohydrate Polymers,2019,226:115 315.
[22] DELOID G,SOHAL I S,LORENTE L R,et al.Reducing intestinal digestion and absorption of fat using a nature-derived biopolymer:Interference of triglyceride hydrolysis by nanocellulose[J].ACS Nano,2018,12(7):6 469-6 479.
[23] CHEN X Q,ZHANG Y T,HAN Y,et al.Emulsifying properties of polysaccharide conjugates prepared from chin-brick tea[J].Journal of Agricultural and Food Chemistry,2019,67(36):10 165-10 173.
[24] URUAKPA F O,ARNTFIELD S D.Emulsifying characteristics of commercial canola protein-hydrocolloid systems[J].Food Research International,2005,38(6):659-672.
[25] SETIOWATI A D,DE NEVE L,A’YUN Q,et al.Quartz crystal microbalance with dissipation(QCM-D) as a tool to study the interaction between whey protein isolate and low methoxyl pectin[J].Food Hydrocolloids,2021,110:106 180.
[26] 马红孺.胶体排空相互作用理论与计算[J].物理学报,2016,65(18):19-32.
MA H R.Theory and calculations of colloidal depletion interaction[J].Acta Physica Sinica,2016,65(18):19-32.
[27] DICKINSON E.Hydrocolloids acting as emulsifying agents-How do they doit[J].Food Hydrocolloids,2018,78:2-14.
[28] XIAO J,WANG X A,PEREZ GONZALEZ A J,et al.Kafirin nanoparticles-stabilized Pickering emulsions:Microstructure and rheological behavior[J].Food Hydrocolloids,2016,54:30-39.
[29] HU Z,PATTEN T,PELTON R,et al.Synergistic stabilization of emulsions and emulsion gels with water-soluble polymers and cellulose nanocrystals[J].ACS Sustainable Chemistry & Engineering,2015,3(5):1 023-1 031.
[30] 焦博.花生蛋白—多糖Pickering乳液的制备及稳定机理研究[D].北京:中国农业科学院,2018.
JIAO B.Preparation and stabilizing mechanism of peanut protein-polysaccharide composite particles stabilized pickering emulsions[D].Beijing:Chinese Academy of Agricultural Sciences,2018.
[31] CHEVALIER Y,BOLZINGER M A.Emulsions stabilized with solid nanoparticles:Pickering emulsions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2013,439:23-34.
[32] MIAO C W,ATIFI S,HAMAD W Y.Properties and stabilization mechanism of oil-in-water Pickering emulsions stabilized by cellulose filaments[J].Carbohydrate Polymers,2020,248:116 775.
[33] SILVA C E P,TAM K C,BERNARDES J S,et al.Double stabilization mechanism of O/W Pickering emulsions using cationic nanofibrillated cellulose[J].Journal of Colloid and Interface Science,2020,574:207-216.
[34] ![]() L,KASPARKOVA V,BORDES R.Role of protein-cellulose nanocrystal interactions in the stabilization of emulsion[J].Journal of Colloid and Interface Science,2019,557:196-206.
L,KASPARKOVA V,BORDES R.Role of protein-cellulose nanocrystal interactions in the stabilization of emulsion[J].Journal of Colloid and Interface Science,2019,557:196-206.