苦荞麦,又名鞑靼荞麦,是我国为数不多的药食同源作物,富含蛋白质、脂肪、维生素和矿物质。相比甜荞麦,苦荞麦含有更加丰富的黄酮类物质,例如芦丁、槲皮素、山奈酚等,其中芦丁和槲皮素含量占苦荞麦总黄酮含量的70%~90%。研究表明,苦荞黄酮具有降血糖、降血脂、降血压、抗氧化等多种生理功效[1]。此外苦荞麦还是不含麸质的作物,因其卓越的保健和营养功效引起了广泛的关注。目前已有多种苦荞麦功能食品,例如:苦荞麦面条、苦荞茶、苦荞麦饼干、苦荞麦面包等[2]。
目前苦荞的利用主要以苦荞粉为主。但苦荞粉不含麸质无法形成面筋网络,因此必须同小麦粉混合才能形成合格的面团来生产馒头、面包、面条等食物[3]。苦荞粉在工业生产中被分级为麸皮粉、荞芯粉和荞麦全粉。荞麦麸皮粉因富含黄酮类物质而被广泛应用在荞麦保健食品的生产上,相反荞麦芯粉因缺乏黄酮类物质而被视作副产物,造成资源的浪费[4]。与大多数天然淀粉及谷物粉一样,天然荞麦粉的理化性质较差,导致加工性能较差,比如:吸水性差,水溶性差,且成糊之后易脱水、老化,无法满足工业需求,因此利用率很低[2,5]。对荞麦粉进行改性修饰有利于提高荞麦粉的利用率。其中,物理改性因安全、经济、易操作而受青睐。已有多种物理改性手段用于对荞麦粉的改性,例如:挤压法、湿热法、高压蒸气、烘烤等,这些改性手段均能够对荞麦淀粉或荞麦粉的理化性质进行修饰和改善[2,5-6]。
过热蒸气是一种温度高于饱和点或沸点的蒸气,具有传热效率高、低氧化的特点,被广泛应用在原料的干燥、酶的钝化、净化等方面[7]。HU等[8]研究表明,过热蒸气对马铃薯淀粉的理化及消化性质有显著影响。LIU等[9]采用过热蒸气对不同来源的淀粉进行改性,能够显著改变淀粉的溶胀和流变特点。但是关于过热蒸气改性对苦荞粉的理化性质及营养性质的影响鲜有报道。本研究以苦荞麦全粉(苦全)和苦荞麦芯粉(苦芯)为原料,采用不同温度的过热蒸气进行改性处理,研究过热蒸气处理对苦荞粉的糊化性质、热力学性质、体外消化能力以及对荞麦的多酚含量及抗氧化性质的影响,以期为其应用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
实验所用苦荞全粉(苦全)和苦荞芯粉(苦芯)由云南中金特色食品有限公司提供,其中苦荞全粉是过40目(425 μm)后的级分,苦荞芯粉为60目(250 μm)后的级分。
1.2 试验方法
1.2.1 过热蒸气处理苦荞粉的样品制备
称取12 g苦荞全粉和苦荞芯粉置于过热蒸气发生装置样品室内,分别在110、130、150 ℃条件下处理10 min,冷却至室温后装至自封袋中,室温存放于干燥器中,用于后续实验。过热蒸气处理之后的样品分别标记为:苦全110,苦全130,苦全150,苦芯110,苦芯130,苦芯150。
1.2.2 苦荞粉糊化性质测定
使用RVA-TEC快速黏度分析仪,测定样品的糊化性质[10]。准确称取3.0 g样品加至铝桶中,然后加入25 mL蒸馏水,在运行程序之前,用塑料桨将样品手动混合均匀,避免出现结团。开始运行,程序参数如下:搅拌速度960 r/min,保持10 s,之后保持160 r/min。50 ℃保持1 min,以12 ℃/min速率匀速升温至95 ℃,保温2 min 30 s,然后再以相同速率降温至50 ℃,保温2 min。样品的糊化特性曲线、糊化温度、峰值黏度、最终黏度、崩减值、回生值均由软件自行记录。
1.2.3 苦荞粉热力学性质测定
称取3 mg样品置于铝盘中,用微量调节注射器加入10.5 μL蒸馏水[m(样品)∶m(水)=1∶3.5]。密封样品盘,并在室温下放置24 h以平衡样品。以空盘作为参比。扫描温度和升温速率为30~120 ℃,10 ℃/min。每个样品平行测试3次。
1.2.4 体外消化能力测定
采用ENGLYST等[11]方法,略加修改。根据苦荞粉淀粉含量确保所称取的样品所含淀粉含量均为200 mg并将其置于锥形瓶中,加入15 mL醋酸钠溶液(0.2 mol/L,CaCl2 1 mmol/L,pH 5.2)。将上述溶液置于37 ℃下平衡5 min,向其中加入6颗玻璃球(直径5 mm),再加入5 mL的混合酶(α-淀粉酶和糖化酶,酶活力分别为:120和80 U/mL)。样品进行37 ℃温水浴,转速为150 r/min。分别在20、120 min吸取500 μL水解液,立即加入4 mL的无水乙醇灭酶。离心后取上清液用葡萄糖氧化酶法测定其中的葡萄糖含量。每个样品平行进行3次。快速消化淀粉(ready digestible starch,RDS)、缓慢消化淀粉(slowly digestible starch,SDS) 、抗性淀粉(resistant starch,RS)含量计算见公式(1)、(2)和(3):
(1)
(2)
(3)
式中:mFG,样品中葡萄糖质量,mg;mG20,淀粉酶水解20 min时产生的葡萄糖质量,mg;mG120,淀粉酶水解120 min时产生的葡萄糖质量,mg; mTS,总淀粉质量,mg。
1.2.5 扫描电镜(SEM)
将样品用双面胶固定在载物台上,喷金处理之后置于SEM下进行观察。仪器参数设置为:20 kV,放大2 000倍,观察样品微观形态。
1.2.6 游离多酚、可溶性共轭多酚和结合多酚的提取及含量测定
参考GONG等[12]的方法,并有一定程度的修改,具体如下:
1.2.6.1 游离多酚的提取
准确称取2 g样品置于50 mL离心管中,加入30 mL 80%预冷的丙酮,冰水浴超声10 min。然后在4 ℃下,2 500×g离心10 min。用圆底烧瓶收集上清液,残渣再用丙酮重复提取2次。合并所有上清液,在45 ℃下旋转蒸发至无溶剂残留。加适量蒸馏水后用超声波辅助溶解,转移至容量瓶中定容至10 mL,获得可溶性多酚,避光-20 ℃保存。将可溶性多酚提取液用浓盐酸调至pH 2,然后加入20 mL己烷,涡旋2 min,4 ℃下,2 500×g下离心10 min,除去上层液体。往下层混合物中加入20 mL乙酸乙酯,涡旋2 min,于4 ℃下2 500×g离心10 min,用圆底烧瓶(烧瓶外部包裹铝箔,内部充氮气)收集乙酸乙酯提取物,再重复提取4次。合并乙酸乙酯提取液,在45 ℃下旋转蒸发至无溶剂残留。加适量的甲醇后超声辅助溶解,定容至5 mL,于-40 ℃下储存备用。每个样品平行提取3次。
1.2.6.2 可溶性共轭多酚的提取
将1.2.6.1中用乙酸乙酯提取之后的剩余部分用10 mL 2 mol/L NaOH溶液室温下避光消化1 h(充氮气)。用浓盐酸调至pH 2,然后加入20 mL己烷,涡旋2 min,接着于4 ℃下2 500×g离心10 min,除去上层脂肪后,加入20 mL乙酸乙酯,涡旋2 min后,于4 ℃下2 500×g离心10 min,用圆底烧瓶收集乙酸乙酯提取物,再重复提取4次。合并乙酸乙酯提取液,在45 ℃下旋转蒸发至无溶剂残留。加适量的甲醇后用超声波辅助溶解,定容至5 mL,于-40 ℃下储存备用。每个样品平行提取3次。
1.2.6.3 结合多酚的提取
准确称取0.5 g样品至50 mL离心管中,加入10 mL 80%预冷丙酮,超声10 min后离心(4 ℃下2 500×g离心10 min),重复3次(弃上清液)。将提取完可溶性多酚后的残渣用氮气吹干残留的丙酮。然后加10 mL 2 mol/L的NaOH溶液于该残渣中,并用氮气充满离心管,旋紧盖子后在室温下平板振摇消化1 h。然后加入浓盐酸调节pH至2,加入20 mL己烷,涡旋2 min后,于4 ℃下,2 500×g离心10 min,除去上层脂肪。往下层混合物加入20 mL乙酸乙酯,涡旋2 min后,再次于4 ℃下2 500×g离心10 min,用圆底烧瓶收集乙酸乙酯提取物,再重复提取4次。合并提取液在45 ℃下旋转蒸发至无溶剂残留。加适量甲醇后超声辅助溶解,转移到容量瓶中并定容至5 mL,于-40 ℃下储存备用。
1.2.6.4 多酚含量的测定
采用福林酚比色法。取1 mL提取物在12 000×g下离心10 min,取上清液用于后续测定。加100 μL多酚提取液或不同稀释梯度的没食子酸溶液(0.00、0.02、0.04、0.06、0.08、0.10、0.15 mg/mL)于比色管中,加入400 μL去离子水和100 μL福林酚试剂,置于室温下反应6 min。然后按序加入1 mL 7%的Na2CO3溶液和0.8 mL去离子水。涡旋混匀后于室温下避光放置90 min。待反应结束后取200 μL反应液于96孔板中,并在760 nm处测定吸光度。多酚含量以每100 g样品干重相当于没食子酸(GAE)的质量表示(mg GAE/100 g DW)。其中,总酚含量等于游离多酚、可溶性共轭多酚和结合多酚含量的总和。
1.2.7 抗氧化能力测定
1.2.7.1 ABTS阳离子自由基清除力
提取物的ABTS阳离子自由基清除力采用RE等[13]的方法。具体如下:准确称取192 mg 2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2, 2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)与33 mg过硫酸钾,用去离子水定容至50 mL,室温下避光反应12 h,完成ABTS阳离子自由基母液的配制,然后用蒸馏水稀释,使A734 nm为(0.7±0.02)。在10 mL离心管中加入100 μL经过适当稀释的酚类提取物,然后加入4 900 μL现配的ABTS阳离子自由基溶液。混匀后于30 ℃下孵浴10 min,然后立刻在734 nm,30 ℃下测定其吸光度。利用水溶性维生素E(TE)标准曲线计算提取物的ABTS阳离子自由基清除能力,TE的浓度范围在0~1 200 μmol/L。ABTS阳离子自由基清除能力用每克样品干重相当于TE当量表示,单位为μmol/(g·L)。
1.2.7.2 FRAP抗氧化能力
铁还原/抗氧化能力(ferric reducing/antioxidant power,FRAP)采用BENZIE等[14]报道的方法。FRAP试剂的配制:37 ℃下混合2.5 mL 10 mmol/L 2,4,6-三吡啶基三嗪溶液(用40 mmol/L HCl溶液制备)、2.5 mL 12.024 mmol/L FeCl3溶液和25 mL 300 mmol/L醋酸缓冲液(pH 3.6)。将2.4 mL FRAP试剂与0.1 mL样品提取液或硫酸亚铁标准液(0~1.0 mmol/L)混合,在37 ℃下孵育10 min,593 nm下测定吸光度。结果以每100 g样品干重相当于硫酸亚铁的量表示,单位为mmol/(100 g·L)。
1.2.8 数据统计分析
图和表中数据均为平均值±标准差,采用SPSS 16.0进行单因素方差分析,采用Ducan进行多因素比较,作图采用Origin 2018软件。
2 结果与分析
2.1 过热蒸气处理对苦荞粉糊化性质影响
糊化特性是淀粉基材料的重要性质。不同温度的过热蒸气处理对苦荞粉(苦芯、苦全)的糊化性质影响如表1所示。很明显,除110 ℃处理下苦全和苦芯的峰值黏度和谷值黏度有所下降外,130、150 ℃过热蒸气处理后苦全和苦芯粉的峰值黏度和谷值黏度均显著增加(P<0.05),并且与处理温度呈正相关。过热蒸气处理之后,苦全和苦芯的崩解值和糊化温度均明显提升(P<0.05),但随着处理温度的提高,其提高幅度呈现出下降的趋势。与之相反,终值黏度和回生值在过热蒸气处理之后均显著低于对照组(P<0.05),且温度越高下降程度越小。
表1 过热蒸气处理对苦荞粉的糊化性质影响
Table 1 Effect of SS treatment on the pasting properties of tartary buckwheat flours
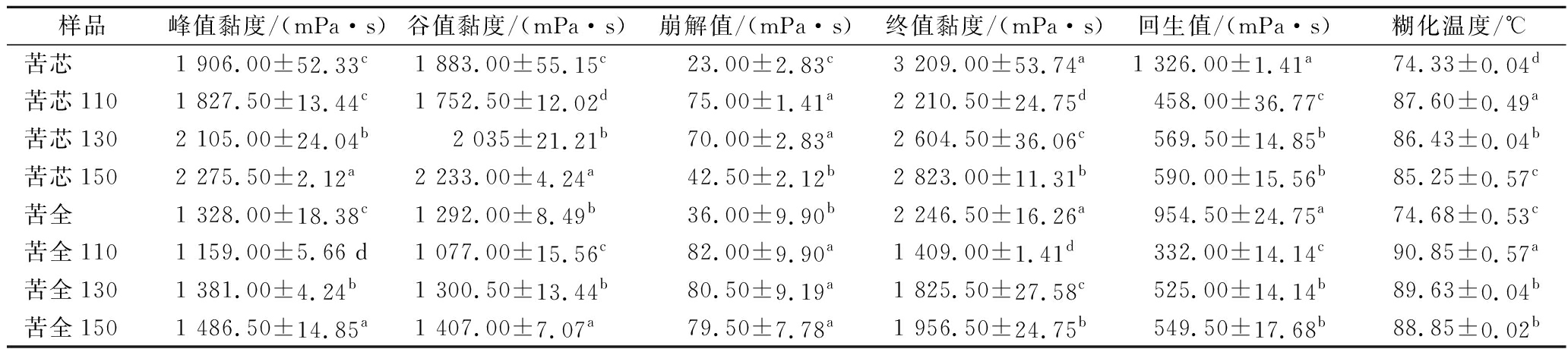
样品峰值黏度/(mPa·s)谷值黏度/(mPa·s)崩解值/(mPa·s)终值黏度/(mPa·s)回生值/(mPa·s)糊化温度/℃苦芯1 906.00±52.33c1 883.00±55.15c23.00±2.83c3 209.00±53.74a1 326.00±1.41a74.33±0.04d苦芯1101 827.50±13.44c1 752.50±12.02d75.00±1.41a2 210.50±24.75d458.00±36.77c87.60±0.49a苦芯1302 105.00±24.04b2 035±21.21b70.00±2.83a2 604.50±36.06c569.50±14.85b86.43±0.04b苦芯1502 275.50±2.12a2 233.00±4.24a42.50±2.12b2 823.00±11.31b590.00±15.56b85.25±0.57c苦全1 328.00±18.38c1 292.00±8.49b36.00±9.90b2 246.50±16.26a954.50±24.75a74.68±0.53c苦全1101 159.00±5.66 d1 077.00±15.56c82.00±9.90a1 409.00±1.41d332.00±14.14c90.85±0.57a苦全1301 381.00±4.24b1 300.50±13.44b80.50±9.19a1 825.50±27.58c525.00±14.14b89.63±0.04b苦全1501 486.50±14.85a1 407.00±7.07a79.50±7.78a1 956.50±24.75b549.50±17.68b88.85±0.02b
注:同一列中具有相同字母的平均值之间不具有显著性(P>0.05),下同
糊化温度是淀粉糊化过程中黏度开始增加时对应的温度。苦全和苦芯粉糊化温度的提高表明过热蒸气处理之后苦荞粉更不易糊化。崩解值是峰值黏度和终值黏度的差值,是由于膨胀的淀粉颗粒的破裂所致,可反映热淀粉糊的热稳定性和抗剪切性能。本研究中苦荞粉崩解值的增加表明苦荞粉抗剪切能力的下降。回生值可以用来衡量老化特性,回生值的显著降低表明,过热蒸气处理后苦荞粉冷糊稳定性提高且不易发生短期回生。HU等[8]发现采用过热蒸气处理后马铃薯淀粉的峰值黏度显著降低,而崩解值、终值黏度和回生值均明显降低,这一发现与本研究结果是相反的。这可能是由于反应条件的不同造成的,如处理时间、样本的含水量、处理温度以及淀粉的来源。作者推测后续可以通过控制过热蒸气处理条件来生产具有特定糊化性质的苦荞粉。另外,本研究也发现,150 ℃处理下的苦荞粉具有较高的峰值黏度,较低的回生值,但与对照组接近的终值黏度,而这一黏度性质被认为是面条生产的良好特点。
2.2 过热蒸气处理对苦荞粉热力学性质的影响
过热蒸气处理对苦荞粉的热力学性质影响如表2所示。可以看出经过热蒸气处理之后,苦荞粉的起始糊化温度(Tp)和终止温度(Tc)均显著提高(P<0.05),这表明经过热蒸气处理后苦荞粉更不易糊化,这一结果与RVA测定结果一致。苦荞粉的糊化焓值(ΔH)在过热蒸气处理之后也得到了显著的增加(P<0.05),并且随着处理温度的提高而增加,焓变越高表明淀粉糊化需要吸收的能量越多,淀粉热稳定性越强。
表2 过热蒸气处理对苦荞粉热力学性质的影响
Table 2 Effect of SS treatment on the thermal properties of tartary buckwheat flours
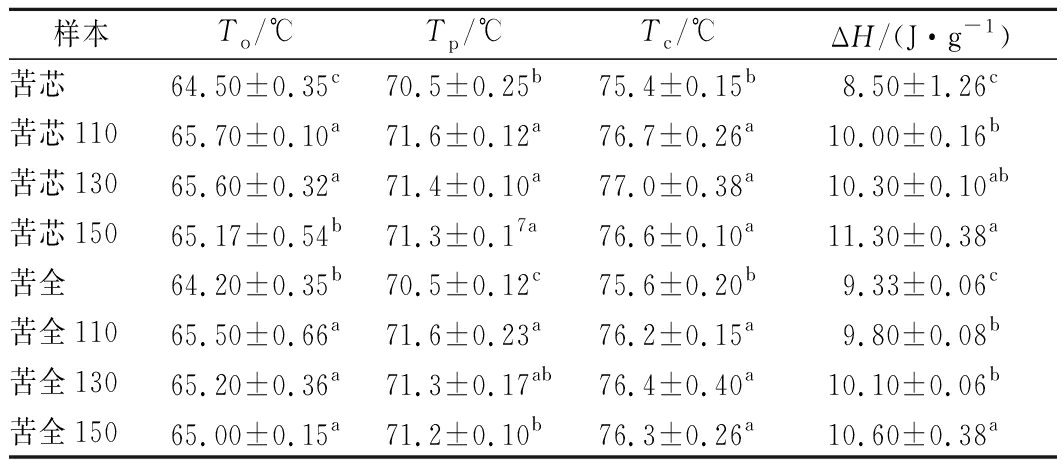
样本To/℃Tp/℃Tc/℃ΔH/(J·g-1)苦芯64.50±0.35c70.5±0.25b75.4±0.15b8.50±1.26c苦芯11065.70±0.10a71.6±0.12a76.7±0.26a10.00±0.16b苦芯13065.60±0.32a71.4±0.10a77.0±0.38a10.30±0.10ab苦芯15065.17±0.54b71.3±0.17a76.6±0.10a11.30±0.38a苦全64.20±0.35b70.5±0.12c75.6±0.20b9.33±0.06c苦全11065.50±0.66a71.6±0.23a76.2±0.15a9.80±0.08b苦全13065.20±0.36a71.3±0.17ab76.4±0.40a10.10±0.06b苦全15065.00±0.15a71.2±0.10b76.3±0.26a10.60±0.38a
注:To,起始糊化温度;Tp,峰值温度;Tc,终止温度;ΔH,糊化焓值
在淀粉糊化过程中,支链淀粉的外链(双螺旋堆积成簇状)会发生熔融和解卷。较高的糊化温度可能与淀粉颗粒中结晶度的增加有关。本研究中过热蒸气处理后苦荞粉的转变温度的提高表明在淀粉颗粒中可能形成了更加完善的微晶结构。这可能是由于高温下多酚与淀粉颗粒的结合度增加,抑制了淀粉的糊化,从而提高了淀粉的糊化温度。ΔH表示破坏淀粉颗粒中双螺旋结构所需要的热量[2,15]。过热蒸气处理之后的苦荞粉增加的ΔH表明过热蒸气处理可能会增加苦荞粉中双螺旋结构的比例。这可能是因为过热蒸气的处理下淀粉链的活动性增强发生重排,从而形成更有序的结构。LIU等[16]的研究中发现了同样的现象。
2.3 过热蒸气处理对苦荞粉体外消化影响
过热蒸气处理对苦荞粉体外消化能力影响结果如表3所示。经过热蒸气处理之后,苦荞粉(苦全,苦芯)中的RDS和SDS含量显著降低(P<0.05),但各个处理温度之间无显著性差异(P>0.05)。相反,过热蒸气处理苦荞粉中RS显著增加(P<0.05),但并非温度依赖性,且不同温度处理的各组之间无显著性差异(P>0.05)。HU等[8]发现采用100~120 ℃过热蒸气处理马铃薯淀粉1 h后,其RS含量显著增加,而SDS含量显著降低,这与本研究的发现相一致,可能原因是较长时间的过热蒸气处理会降解支链淀粉的侧链,降解下的侧链会在过热蒸气环境下运动、取向结合在一起形成刚性结构,形成抗性淀粉。但该研究中DSC结果ΔH的变化同本研究结果相反。过热蒸气处理苦荞粉中RDS含量的降低,可能是因为过热蒸气处理之后会导致蛋白的变性,包裹于淀粉颗粒表面,从而降低其RDS含量[17]。另一方面过热蒸气处理可能会促进多酚和淀粉之间的相互作用形成复合物,从而降低苦荞粉的消化速率,GUO等[18]采用静水压形成淀粉-茶多酚复合物会显著降低淀粉的体外消化速率,但关于过热蒸气是否能够促进淀粉和多酚的复合物的形成还需在以后的实验中进行论证。淀粉对酶的敏感性受多种因素的影响,包括淀粉的来源、直链支链淀粉的比例、淀粉颗粒大小,尤其是结晶结构等[19]。据报道SDS主要是由不完美晶粒构成,而RS对应结晶度更高的淀粉[20]。本研究中过热蒸气处理苦荞粉中RS含量显著升高,而SDS含量显著降低,可能是因为短时间的过热蒸气处理下,淀粉颗粒内部分子链运动能力增加,分子链之间的相互作用增强,进行重新取向,促进颗粒的结晶度的增加。因而造成RS的增加和SDS含量的降低,这也和DSC的结果相一致。ΔH反映熔解淀粉中的双螺旋结构所需要的热量[2,15]。本研究中ΔH的增加,表明短时间的过热蒸气处理会增加苦荞粉中双螺旋结构的含量。可能促进淀粉颗粒的晶型由不完美趋于完美。总体来说,过热蒸气处理对苦荞粉的消化影响是一个复杂的过程,一方面过热蒸气会影响淀粉的结构,会促使淀粉链内和链间重排,另一方面过热处理还会影响非淀粉物质的变化,如蛋白变性,以及淀粉与非淀粉物质之间的相互作用,例如直链淀粉-脂肪,淀粉-多酚复合物的形成等,此外过热蒸气处理还与处理条件例如温度、含水量,以及淀粉的来源有关[8,17]。RS因其潜在的健康功效和功能特性而备受关注。RS对人体的消化道、肠道微生物、血胆固醇和血糖控制均具有积极的作用[21]。本研究中过热蒸气处理后苦荞粉中的RS含量的增加,表明过热蒸气能够增加苦荞粉的抗消化能力,增加其健康功效,过热蒸气改性苦荞粉可能应用于健康保健食品方面。
表3 过热蒸气处理对苦荞粉体外消化的影响
Table 3 Effect of SS treatment on the in vitro digestion ability of tartary buckwheat flours
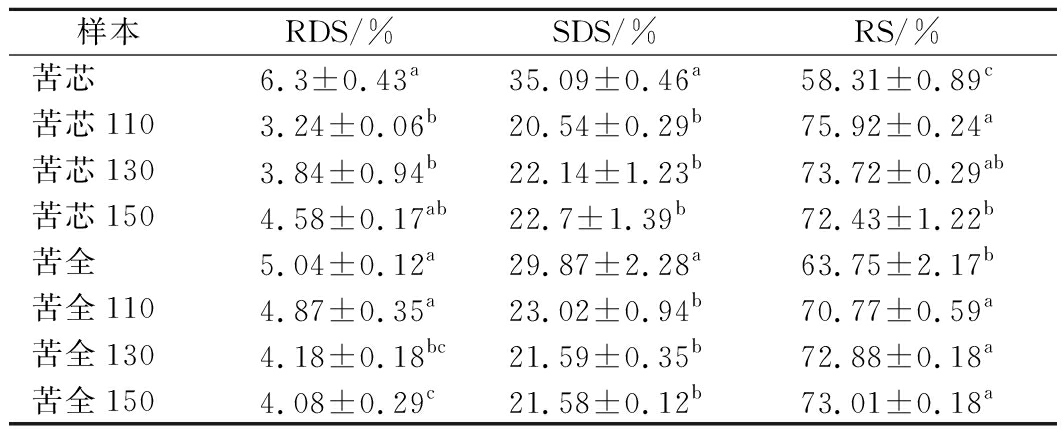
样本RDS/%SDS/%RS/%苦芯6.3±0.43a35.09±0.46a58.31±0.89c苦芯1103.24±0.06b20.54±0.29b75.92±0.24a苦芯1303.84±0.94b22.14±1.23b73.72±0.29ab苦芯1504.58±0.17ab22.7±1.39b72.43±1.22b苦全5.04±0.12a29.87±2.28a63.75±2.17b苦全1104.87±0.35a23.02±0.94b70.77±0.59a苦全1304.18±0.18bc21.59±0.35b72.88±0.18a苦全1504.08±0.29c21.58±0.12b73.01±0.18a
注:RDS,快速消化淀粉;SDS,慢性消化淀粉;RS,抗性消化淀粉
2.4 过热蒸气处理对苦荞粉微观结构的影响
过热蒸气处理对苦荞粉微观结构的影响如图1所示,苦荞粉中淀粉颗粒外部包裹着附加物,据报道淀粉颗粒外部的包裹物主要为蛋白质[22],包裹的蛋白质在一定程度上会阻碍淀粉与淀粉消化酶的接触,从而形成天然的屏障。由图可知,过热蒸气对苦荞粉的微观结构影响并不大,这可能是处理时间较短所致。HU等[8]采用过热蒸气对土豆淀粉处理2 h后发现淀粉颗粒表面出现部分褶皱。苦全粉和苦芯粉之间的微观样貌并无显著区别,这可能是因为处理时间短对颗粒的样貌影响较小所致,作者认为苦全粉和苦芯粉是依靠筛分进行区分,两者的差异主要是在相应物质的含量方面,因此微观样貌区别可能不是很大。

a-苦芯; b-苦芯110; c-苦芯130; d-苦芯150;e-苦全110; f-苦全130; g-苦全150
图1 过热蒸气处理后苦荞粉的微观样貌(SEM)
Fig.1 Microscopic structure of tartary buckwheat flours after SS treatment(SEM)
2.5 过热蒸气处理对苦荞粉多酚含量及抗氧化能力影响
不同温度过热蒸气处理对苦荞粉的多酚含量以及抗氧化能力分别见图2、图3和图4。从图2-d中可以看出,苦全粉中的多酚含量要显著高于苦芯粉中的多酚含量,前者大约是后者含量的4.2倍多。图2-a~图2-c表明,苦荞粉的多酚主要以游离酚的形式存在,约占总酚含量的92%。经过热蒸气处理后,苦荞粉中的游离酚和总酚含量显著降低(P<0.05),而可溶性共轭酚和结合酚的含量却明显提高(P<0.05)。基本上,抗氧化能力的变化与多酚含量的变化一致。
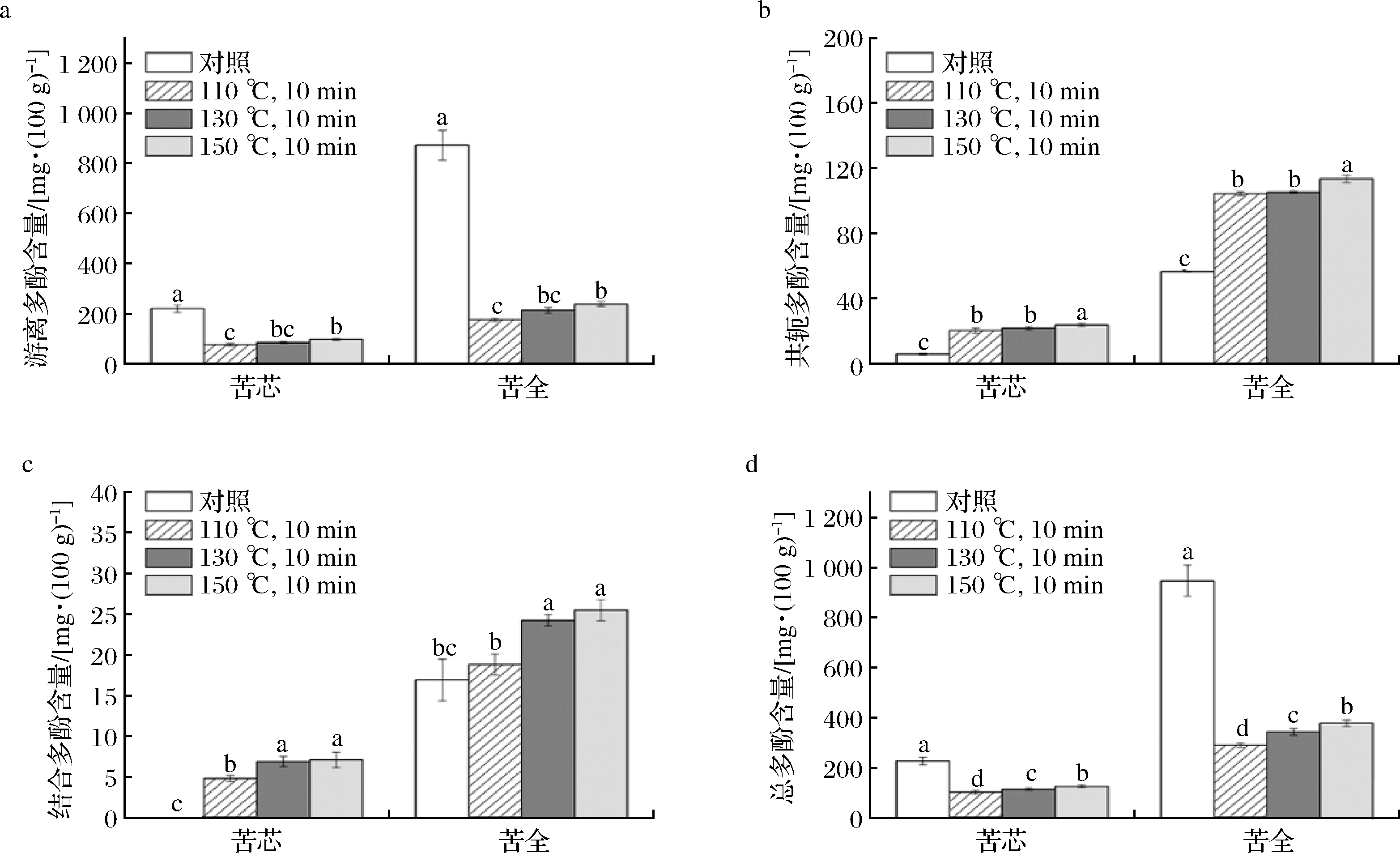
图2 过热蒸气处理对苦荞粉多酚含量影响
Fig.2 Effect of SS treatment on the phenolics content of Tartary buckwheat flours
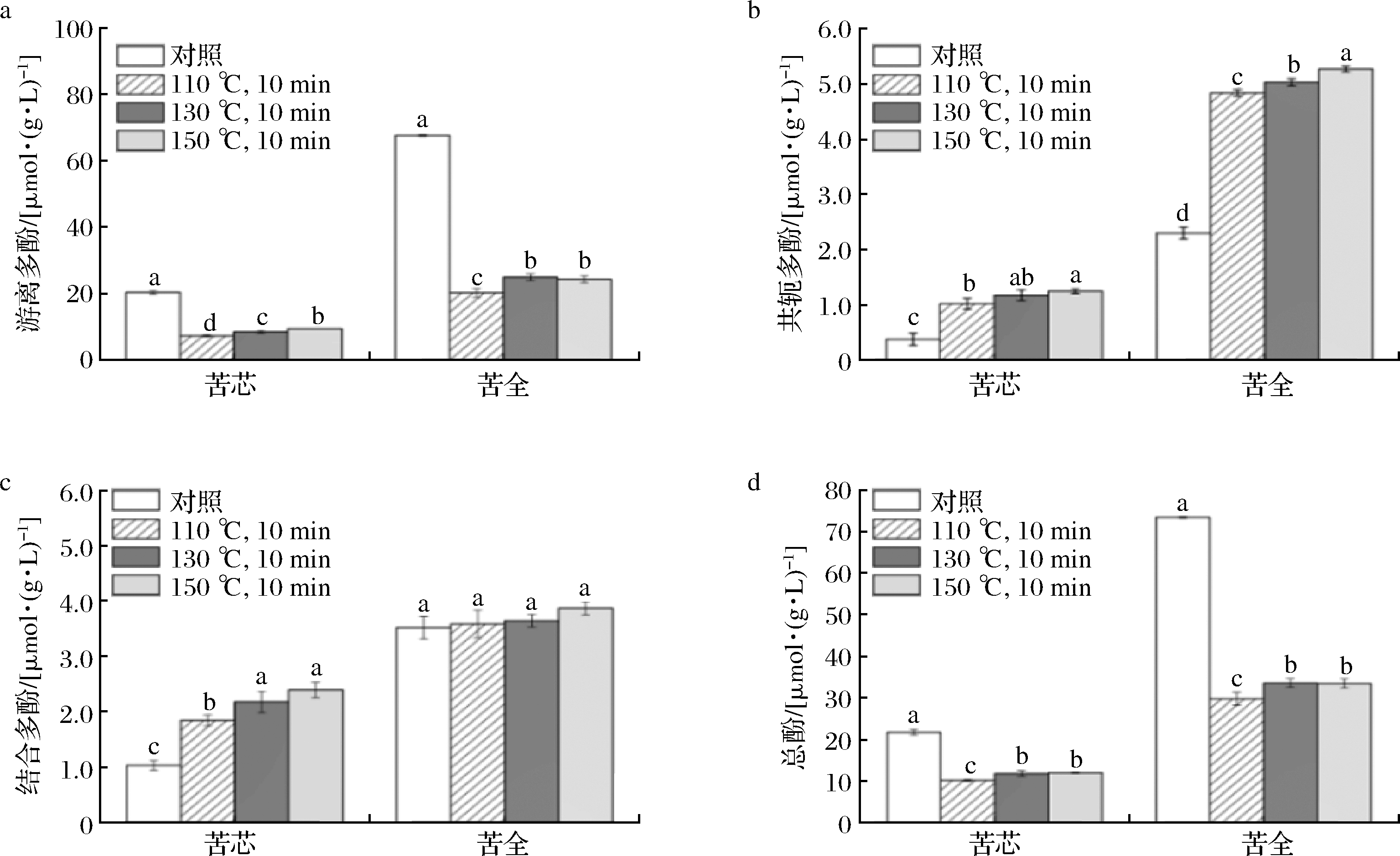
图3 过热蒸气处理对苦荞粉ABTS阳离子自由基清除能力影响
Fig.3 Effect of SS treatment on the ABTS cation radical scavenging ability of tartary buckwheat flours

图4 过热蒸气处理对苦荞粉FRAP能力影响
Fig.4 Effect of SS treatment on the FRAP antioxidant ability of tartary buckwheat flours
膳食中的多酚根据其与食品基质的结合情况可以分为可溶性游离多酚,可溶性共轭多酚和不溶性结合多酚3类,总酚含量等于3者含量之和。其中,游离多酚以游离形式存在于植物细胞液泡中,而可溶性共轭多酚指的是与糖和其他低分子组分如脂肪酸以共价键或酯化结合的多酚,结合多酚指的是通过化学共价键,氢键及疏水相互作用与植物食品基质中的细胞壁的不溶性高分子底物相连的多酚[23]。据报道,谷物中的多酚大多以不溶性的结合多酚形式存在。据报道玉米、小麦和水稻中分别有约85%、75%和62%的酚类物质以结合多酚形式存在。因此在大部分的谷物中结合多酚是其抗氧化活性的主要贡献部分[24]。与大多数的谷物多酚组成相反,苦荞麦中的多酚主要以游离多酚的形式存在,这与GUO等[25]和WU等[1]的研究结果相一致。由于荞麦中的酚类物质主要集中在胚和糊粉层,因此苦全粉的酚类物质含量显著高于苦芯粉中的含量。过热蒸气处理之后苦荞粉中的游离多酚含量显著降低,且110 ℃时对多酚的破坏作用最强,130、150 ℃处理组之间无统计学差异。游离多酚含量的降低主要是在高温条件多酚的不稳定分解和氧化造成的[26],在苦荞粉中由于92%的多酚是游离多酚,且游离多酚的含量远远高于结合多酚和可溶性共轭多酚的含量,因此经过热蒸气处理后苦荞粉中的总酚含量亦显著降低。ZIELINSKI等[27]采用挤压机处理苦荞籽发现160 ℃挤压处理的破坏作用要强于200 ℃挤压处理的作用。这与本研究中110 ℃对多酚的破坏作用强于130、150 ℃的破坏作用结果类似。这可能是因为3个处理条件下苦荞粉所处环境的不同造成,比如氧气含量、传热速率等,但有待进一步研究。ZHANG等[28]的发现焙烤、高压蒸气和微波加热等不同的热处理之后,荞麦中的总酚含量和抗氧化都显著下降。JAMBREC等[29]发现高压蒸气处理能够降低甜荞麦粉中游离酚的含量但增加结合酚的含量,这一发现与本文的结果相一致。WU等[7]采用发现短时间的过热蒸气处理能够增加大米中游离酚含量但是对结合多酚没显著影响。由此可以看出过热蒸气对多酚的影响与时间和处理温度紧密相关。本文中的结果作者推测可能是过热蒸气能够削弱结合多酚与细胞壁组分(如纤维素、半纤维素、木质素)之间的醚键或酯键从而增加结合多酚含量的提取率,同时由于较长时间的热处理苦荞多酚发生降解因而游离多酚含量明显降低,另一方面过热蒸气处理可能会促进游离多酚与糖,脂肪酸等小分子之间的酯化或共价结合,因而增加可溶性共轭多酚的含量。GONG等[12]的研究表明,热处理之后糙米中的可溶性共轭多酚含量降低,推测可能是因为热加工导致可溶性共轭多酚与大分子之间的结合造成其含量的降低。PARRA等[30]发现热加工会显著增加游离酚酸和共轭酚酸的含量,但降低结合酚酸含量。热处理对酚类物质的影响取决于加工方法、全谷物的种类和品种[12]。据报道,不溶性酚类在预防结肠癌等肠道疾病中起着重要作用,因为它能在胃和肠道消化中存活并到达结肠。相反,游离酚和可溶性共轭酚类物质主要在上消化道中发挥生理作用[24]。从某种意义上说,酚类物质的合理分布更有利于人体健康。很明显过热蒸气处理能明显改变苦荞粉中酚类物质的分布。
3 结论
本研究采用过热蒸气对苦荞粉进行改性,结果表明过热蒸气对苦荞粉的理化和营养性质有显著影响。过热蒸气能够显著增加苦荞粉的峰值黏度和谷值黏度;显著降低苦荞粉的回生值,这表明过热蒸气处理后降低了苦荞粉的短期老化,这一性质被视作面条生产的良好品质。DSC和体外消化试验结果表明,过热蒸气可以显著提高苦荞粉的热稳定性,可能会通过促进苦荞粉淀粉内部分子发生重排和促使多酚或脂质与淀粉形成复合物从而显著降低苦荞粉中RDS和SDS的含量,提高RS的含量,提高苦荞粉的健康营养价值。另一方面过热蒸气处理能够改变苦荞粉的酚类组成,可以降低苦荞粉中的游离酚含量,增加可溶性共轭酚和结合酚的含量,但过热蒸气处理显著降低了苦荞粉中总酚的含量,且110 ℃下的破坏作用更强,为探究多酚的具体变化,后续实验可以采用液质联用等技术对具体组分进行测定。总之过热蒸气能够明显改变苦荞粉的理化性质,可以作为一种新型高效的物理改性手段,改性后苦荞粉拥有较高的RS含量,这为苦荞粉在功能食品的应用提供可能。在下一步的实验中拟采用苦荞淀粉作为原料进行改性研究,以探究过热蒸气改性苦荞粉的内在机理。
[1] WU X,FU G,LI R,et al.Effect of thermal processing for rutin preservation on the properties of phenolics & starch in Tartary buckwheat achenes[J].International Journal of Biological Macromolecules,2020,164:1 275-1 283.
[2] XIAO Y,LIU H,WEI T,et al.Differences in physicochemical properties and in vitro digestibility between tartary buckwheat flour and starch modified by heat-moisture treatment[J].LWT,2017,86:285-292.
[3] LIU H,LYU M M,PENG Q,et al.Physicochemical and textural properties of tartary buckwheat starch after heat-moisture treatment at different moisture levels[J].Starch-Stärke,2015,67(3-4):276-284.
[4] GAO J,KREFT I,CHAO G,et al.Tartary buckwheat(Fagopyrum tataricum Gaertn.) starch,a side product in functional food production,as a potential source of retrograded starch[J].Food Chemistry,2016,190:552-558.
[5] CHENG W,GAO L,WU D,et al.Effect of improved extrusion cooking technology on structure,physiochemical and nutritional characteristics of physically modified buckwheat flour:Its potential use as food ingredients[J].LWT,2020,133:109 872.
[6] SUN X,LI W,HU Y,et al.Comparison of pre-gelatinization methods on physicochemical,functional,and structural properties of tartary buckwheat flour and noodle quality[J].Journal of Cereal Science,2018,80:63-71.
[7] WU J Y,MCCLEMENTS D J,CHEN J,et al.Improvement in nutritional attributes of rice using superheated steam processing[J].Journal of Functional Foods,2016,24:338-350.
[8] HU X T,GUO B Z,LIU C M,et al.Modification of potato starch by using superheated steam[J].Carbohydrate Polymer,2018,198:375-384.
[9] LIU C,YAN X,XU X,et al.Changes in granular swelling and rheological properties of food crop starches modified by superheated steam[J].Starch-Stärke,2019,71(3-4):1 800 132.
[10] LI W H,CAO F,FAN J,et al.Physically modified common buckwheat starch and their physicochemical and structural properties[J].Food Hydrocolloids,2014,40:237-244.
[11] ENGLYST H N,KINGMAN S M,CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition,1992,46 (Suppl 2):S33-S50.
[12] GONG E S,LUO S J,LI T,et al.Phytochemical profiles and antioxidant activity of processed brown rice products[J].Food Chemistry,2017,232:67-78.
[13] RE R,PELLEGRINI N,PROTEGGENTE A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine,1999,26(9-10):1 231-1 237.
[14] BENZIE I F,STRAIN J J.The ferric reducing ability of plasma(FRAP) as a measure of “antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[15] LI W,CAO F,FAN J,et al.Physically modified common buckwheat starch and their physicochemical and structural properties[J].Food Hydrocolloids,2014,40:237-244.
[16] LIU H,WANG L J,SHEN M R,et al.Changes in physicochemical properties and in vitro digestibility of tartary buckwheat and sorghum starches induced by annealing[J].Starch-Stärke,2016,68(7-8):709-718.
[17] MA Y,XU D,SANG S,et al.Effect of superheated steam treatment on the structural and digestible properties of wheat flour[J].Food Hydrocolloids,2020,112:106 362.
[18] GUO Z B,ZHAO B B,CHEN J,et al.Insight into the characterization and digestion of lotus seed starch-tea polyphenol complexes prepared under high hydrostatic pressure[J].Food Chemistry,2019,297:124 992.
[19] ZAVAREZE E D R,GUERRA DIAS A R.Impact of heat-moisture treatment and annealing in starches A review[J].Carbohydrate Polymers,2011,83(2):317-328.
[20] XIE Y Y,HU X P,JIN Z Y,et al.Effect of temperature-cycled retrogradation on in vitro digestibility and structural characteristics of waxy potato starch[J].International Journal of Biological Macromolecules,2014,67:79-84.
[21] FUENTES-ZARAGOZA E,RIQUELME-NAVARRETE M J,S NCHEZ-ZAPATA E,et al.Resistant starch as functional ingredient:A review[J].Food Research International,2010,43(4):931-942.
NCHEZ-ZAPATA E,et al.Resistant starch as functional ingredient:A review[J].Food Research International,2010,43(4):931-942.
[22] YANG J,GU Z B,ZHU L,et al.Buckwheat digestibility affected by the chemical and structural features of its main components[J].Food Hydrocolloids,2019,96:596-603.
[23] ZHANG B,ZHANG Y,LI H,et al.A review on insoluble-bound phenolics in plant-based food matrix and their contribution to human health with future perspectives[J].Trends in Food Science & Technology,2020,105:347-362.
[24] ACOSTA-ESTRADA B A,GUTIÉRREZ-URIBE J A,SERNA-SALD VAR S O.Bound phenolics in foods,a review[J].Food Chemistry,2014,152:46-55.
VAR S O.Bound phenolics in foods,a review[J].Food Chemistry,2014,152:46-55.
[25] GUO X D,WU C S,MA Y J,et al.Comparison of milling fractions of tartary buckwheat for their phenolics and antioxidant properties[J].Food Research International,2012,49(1):53-59.
[26] ZZAMAN W,BHAT R,YANG T A.Effect of superheated steam roasting on the phenolic antioxidant properties of cocoa beans[J].Journal of Food Processing and Preservation,2014,38(4):1 932-1 938.
[27] ZIELINSKI H,MICHALSKA A,PISKULA M K,et al.Antioxidants in thermally treated buckwheat groats[J].Molecular Nutrition & Food Research,2006,50(9):824-832.
[28] ZHANG M,CHEN H X,LI J L,et al.Antioxidant properties of tartary buckwheat extracts as affected by different thermal processing methods[J].LWT-Food Science and Technology,2010,43(1):181-185.
[29] JAMBREC ![]() M,MI
M,MI AN A,et al.Effect of autoclaving and cooking on phenolic compounds in buckwheat-enriched whole wheat tagliatelle[J].Journal of Cereal Science,2015,66:1-9.
AN A,et al.Effect of autoclaving and cooking on phenolic compounds in buckwheat-enriched whole wheat tagliatelle[J].Journal of Cereal Science,2015,66:1-9.
[30] PARRA C D L,SERNA SALDIVAR S O,LIU R H.Effect of processing on the phytochemical profiles and antioxidant activity of corn for production of masa,tortillas,and tortilla chips[J].Journal of Agricultural and Food Chemistry,2007,55(10):4 177-4 183.