澳洲坚果(Macadamia ternifolia F.Muell),又称夏威夷果、澳洲核桃等,是一种亚热带坚果,产于澳大利亚昆士兰州和新南威尔士州等,属山龙眼科[1]。脱脂或低脂澳洲坚果油粕粉作为澳洲坚果油生产的副产品,可作为食品和饮料中营养丰富的配料[2],其含有丰富的蛋白质、多糖和糖肽[3]。研究糖链对澳洲坚果多肽各种功能性质的影响对开发澳洲坚果油粕粉产品有一定的指导作用。
糖基化反应是一种生物体内很普遍的翻译后修饰的过程,常常影响蛋白质的结构和生物活性[4]。DEN STEEN等[5]使用核磁共振评估了糖基化的糖肽片段,18 kDa的蛋白质被高度糖基化,核心O-糖链与肽相互作用,被约束为特定构象,使肽主链更加稳定;王岸娜等[6]发现除去猕猴桃糖蛋白O-糖链会破坏蛋白质二级结构中β-折叠,从而降低糖蛋白的抗氧化性;此外糖链还可以保护半胱氨酸免受氧自由基的攻击[7]。就蛋白质的二级、三级、四级结构而言,糖链的释放必将会导致肽链的重新折叠从而影响肽链的结构,在某些情况下这些结构影响其功能。例如葡糖淀粉酶用α-甘露糖酶处理后酶活性降低[8],说明葡糖淀粉酶的O-糖链在淀粉水解中起重要作用。因此研究多糖对蛋白结构和性质的影响对于改造和利用丰富的蛋白资源很有必要。本文用β-消除法释放澳洲坚果糖肽中的O-糖链,通过圆二色谱仪观察去糖基化前后澳洲坚果糖肽中肽链二级结构变化;差示扫描量热法(differential scanning calorimetry,DSC)分析去糖基化对其热稳定性的影响;扫描电子显微镜观察微观结构变化,测定去糖基化前后澳洲坚果糖肽体外抗氧化活性的变化。研究了糖基化对澳洲坚果糖肽的结构和性质的影响。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
澳洲坚果油粕,广西省岑溪市寿香乡有机农产品开发有限公司;DEAE-52 纤维素,美国GE 公司;Sephadex G-100 凝胶,上海源叶生物科技有限公司;DPPH、浓硫酸、盐酸、NaCl,均为分析纯,天津市津东天正精细化学试剂厂;无水乙醇、三氯乙酸、双氧水、苯酚,均为分析纯,广州化学试剂厂;SDS-PAGE超低分子质量标准品,广州硕谱生物科技公司。
1.1.2 仪器与设备
SCIENTZ-10 N冷冻干燥机,宁波新芝生物科技股份有限公司;UV-9600紫外-可见分光光度计,北京瑞利分析仪器公司;LC-20A高效液相色谱仪、TM3030Plus型扫描电子显微镜,日本岛津公司;DSC-1差示扫描量热仪,梅特勒-托利多公司;圆二色光谱仪,英国应用光物理公司。
1.2 实验方法
1.2.1 澳洲坚果糖肽的提取纯化
分离:取冷榨脱脂澳洲坚果油粕粉250 g,加入2 L蒸馏水,60 ℃水浴加热2 h。冷却离心(3 500 r/min,20 min)保留上清液,减压浓缩;向浓缩液中加入无水乙醇至乙醇体积分数为10%,离心(3 500 r/min,20 min)除去蛋白质等沉淀物,收集上清液继续加无水乙醇至乙醇体积分数为60%,离心(3 500 r/min,20 min)收集沉淀物。重新溶解并减压浓缩,冷冻干燥得澳洲坚果糖肽粗提物。
纯化:取澳洲坚果糖肽粗提物250 mg,溶于10 mL蒸馏水。充分溶解后上样到DEAE-52纤维层析柱中,分别用0、0.1、0.2 mol/L的NaCl溶液洗脱,收集洗脱液每管10 mL。测每管溶液在波长280 nm处的吸光度,苯酚-硫酸法测量每管溶液在波长490 nm处的吸光度。以管数序号为横坐标、吸光度值为纵坐标绘制洗脱曲线。收集既有糖又有蛋白的样品峰,浓缩后用8 kDa透析袋透析。取适量上述溶液上样到Sephadex G-100葡聚糖凝胶层析柱中,蒸馏水缓慢洗脱,收集洗脱液每管5 mL,同样的方法在波长280和490 nm处测每管洗脱液吸光度,收集糖肽样品峰,透析冻干,得率为3.5%。
1.2.2 糖肽的纯度和分子质量鉴定
通过高效液相色谱凝胶过滤色谱法测定澳洲坚果糖肽(macadamia glycopeptiole,MGP)的纯度[9],采用PolySep-GFC-P4000柱(7.8 mm×300 mm),以蒸馏水为流动相,进样量10 μL,流速0.5 mL/min,检测器为蒸发光散射器(evaporative light-scattering detector,ELSD)。
用超低分子质量标准品来测定糖肽的分子质量,该标品由3种多肽和2种低分子质量蛋白组成,分子质量分别为20 100、14 400、7 823、5 856、3 313 Da。采用Tricine-甘油SDS-PAGE测定分子质量,根据文献[10]制备凝胶液和电泳液。
根据表1制备分离胶,聚合后制备夹层胶,最后制备浓缩胶。3种胶长度比为4∶1.5∶1。电压:30 V 1 h,100 V至结束。电泳之后将胶在固定液中固定10~20 min,再进行染色,一般染色20~30 min即可脱色。
表1 电泳胶配制表
Table 1 Preparation of electrophoresis gel
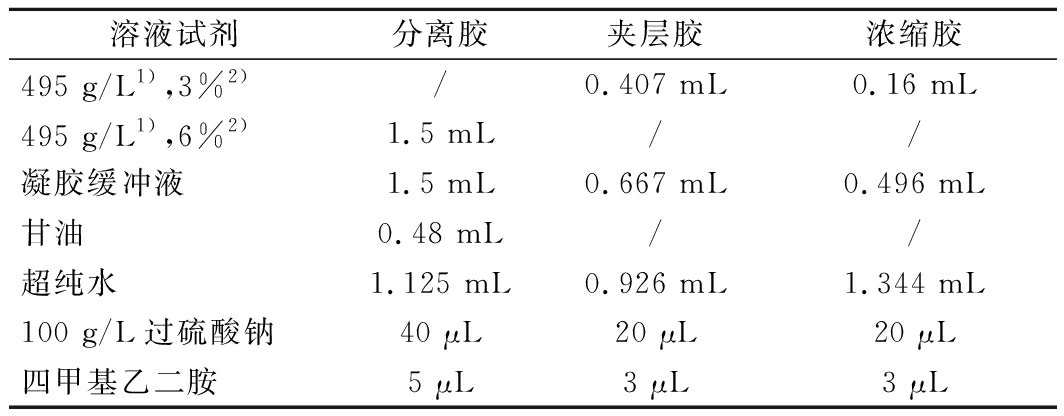
溶液试剂分离胶夹层胶浓缩胶495 g/L1),3%2)/0.407 mL0.16 mL495 g/L1),6%2)1.5 mL//凝胶缓冲液1.5 mL0.667 mL0.496 mL甘油0.48 mL//超纯水1.125 mL0.926 mL1.344 mL100 g/L过硫酸钠40 μL20 μL20 μL四甲基乙二胺5 μL3 μL3 μL
注:1)丙烯酰胺和双丙烯酰胺的总质量浓度;2)交联度质量分数
1.2.3 糖苷键组成
β-消除法[11]除去糖链:500 mg糖肽与5 mL 0.3 mol/L NaOH溶液和5 mL 1 mol/L硼氢化钠溶液混合,35 ℃反应24 h,2 kDa透析袋透析24 h。浓缩冻干得到澳洲坚果糖肽的肽链(macadamia glycopeptide peptide,MGPP)。比较反应前后样品在波长240 nm处的紫外吸收是否有变化,以此确定糖肽中是否存在O-糖肽键。
1.2.4 圆二色谱分析
将MGP和MGPP溶于水配成0.1 mg/mL的溶液,用10 mm 光径样品池扫描(波长260~190 nm),扫描速度100 nm/min,响应时间1 s。
1.2.5 DSC分析
使用DSC测定MGP和MGPP在水溶液中的变性温度。称取MGP和MGPP配成0.5 mg/mL水溶液,分别取50 μL于铝盒中。氮气流速设定20 mL/min,在25~200 ℃ 扫描,升温速率为25 ℃/min ,得到曲线。
1.2.6 扫描电子显微镜分析
导电胶粘于样品台,取微量冻干样品MGP和MGPP均匀地粘在导电胶上,吹去浮沫,喷金后在扫描电子显微镜下观察样品的微观结构。
1.2.7 体外抗氧化能力测定
(1)DPPH自由基清除率的测定[12]
用95%(体积分数)乙醇溶液配制0.2 mmol/L DPPH溶液,取2 mL置于试管中,加入2 mL不同质量分数的MGP和MGPP样品溶液,旋涡混匀,室温下反应30 min,在517 nm波长处测其吸光度。DPPH自由基清除率根据公式(1)计算:
DPPH清除率![]()
(1)
式中:A1,待测样品的吸光度;A2,95%乙醇溶液代替DPPH溶液的吸光度;A0,95%乙醇溶液代替样品的吸光度。
(2)·OH清除率的测定[13]
取样品2 mL,加入2 mL 6 mmol/L的FeSO4、2 mL 6 mmol/L的H2O2,旋涡混匀反应10 min后加入2 mL 6 mmol/L的水杨酸混匀,室温静置30 min,510 nm波长处测吸光度。·OH清除率根据公式(2)计算:
·OH清除率![]()
(2)
式中:A1,待测样品的吸光度;A2,双蒸水代替H2O2测得的吸光度;A0,水代替样品测得的吸光度。
(3)还原力的测定[13]
2 mL样品中加入2 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和2 mL 10 g/L的铁氰化钾溶液,混匀后于50 ℃水浴中反应20 min,室温放置冷却后加入2 mL 100 g/L的三氯乙酸溶液,混匀后取出2 mL,与2 mL蒸馏水以及0.4 mL 1 g/L的FeCl3溶液混匀,静置10 min,在700 nm波长处测定其吸光度,还原力与吸光度成正比。
1.3 数据处理
3次重复试验的结果以(平均值±标准差)表示,使用Excel 2019数据处理,实验数据运用SPSS 26.0进行统计分析,Origin 2019 软件绘图。
2 结果与分析
2.1 分离纯化分析结果
由图1-a可知,经DEAE-52洗脱后出现3个吸收峰,其中0.1 mol/L NaCl溶液的洗脱部分(峰2)既有蛋白又有糖的吸收,即该浓度洗脱部分应为糖肽,而且含量最多。收集该洗脱部分,透析冻干后经过Sephadex G-100凝胶柱洗脱,得到2个既有蛋白又有糖吸收的峰(图1-b);收集主峰(图1-b中的4峰)透析冻干,得纯澳洲坚果糖肽,命名为MGP。

a-DEAE-52纤维素洗脱图;b-Sephadex G-100凝胶柱洗脱图
图1 MGP分离纯化图
Fig.1 MGP separation and purification diagram
2.2 纯度和分子质量
MGP经HPLC的纯度鉴定结果如图2-a所示,HPLC图谱呈现窄的单一对称峰,可认为MGP是均一糖肽,保留时间为9.741 min。Tricine-甘油 SDS-PAGE电泳结果如图2-b所示,因为糖肽中的糖链有许多为不对称形结构,糖单元具有不均一性,这种非均一性源于寡糖链接位点的非均一性和连接于同一位点上寡糖的非均一性[14]。导致含糖蛋白质的电泳行为与一般蛋白质有所不同,多糖复合物解离程度较微弱,电荷密度低,糖肽的电泳带呈带状分布[15];MGP的电泳图亦见到此现象。小分子肽在电泳过程中本身就会出现弥散现象,使电泳带比一般的蛋白电泳带宽,与本文中MGPP和标准蛋白电泳行为相符合。溴酚蓝为指示剂,其迁移率为1.0,以蛋白和多肽的相对迁移率对分子质量对数做标准曲线为y=-2.185 5x+5.030 7(R2=0.995 9)。根据MGP和MGPP的相对迁移率求得MGP的分子质量约为12 kDa,MGPP的分子质量约为9 kDa。
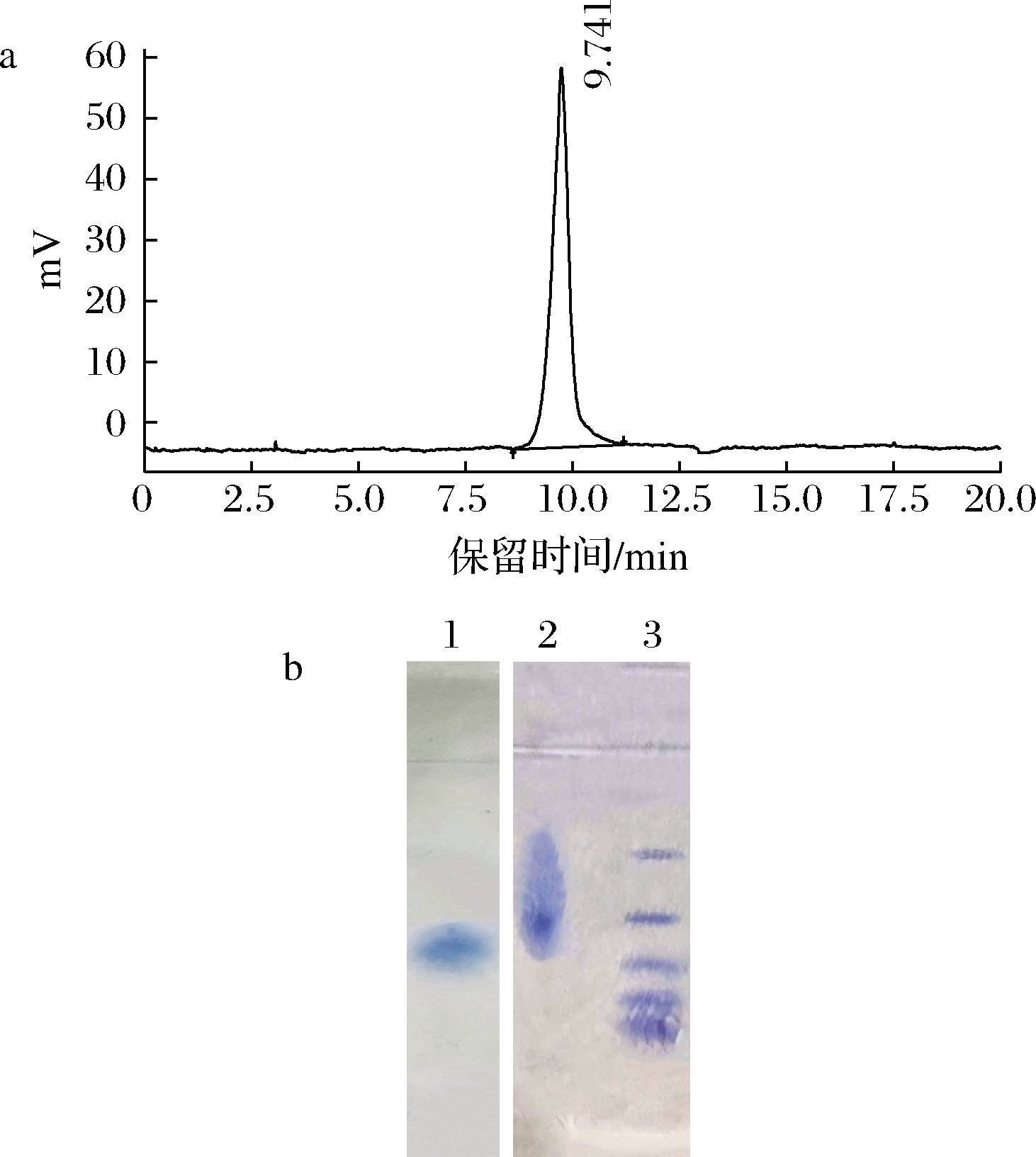
a-MGP的高效液相色谱图;b-Tricine-甘油SDS-PAGE电泳图
1-MGPP;2-MGP;3-标准分子质量
图2 纯度和分子质量鉴定图
Fig.2 Identification diagram of purity and molecular mass
2.3 糖苷键类型
MGP经β-消除后,240 nm波长处吸光度明显增加(图3),当蛋白质中的丝氨酸或苏氨酸与多糖结合形成O-糖肽键时,稀碱处理(即发生β-消除反应)会发生解离,丝氨酸或苏氨酸残基会形成α-氨基丙烯酸或α-氨基丁烯酸,在240 nm波长处有特征吸收[16]。据此可以推断:MGP中糖和肽链是通过O-糖肽键连接的。
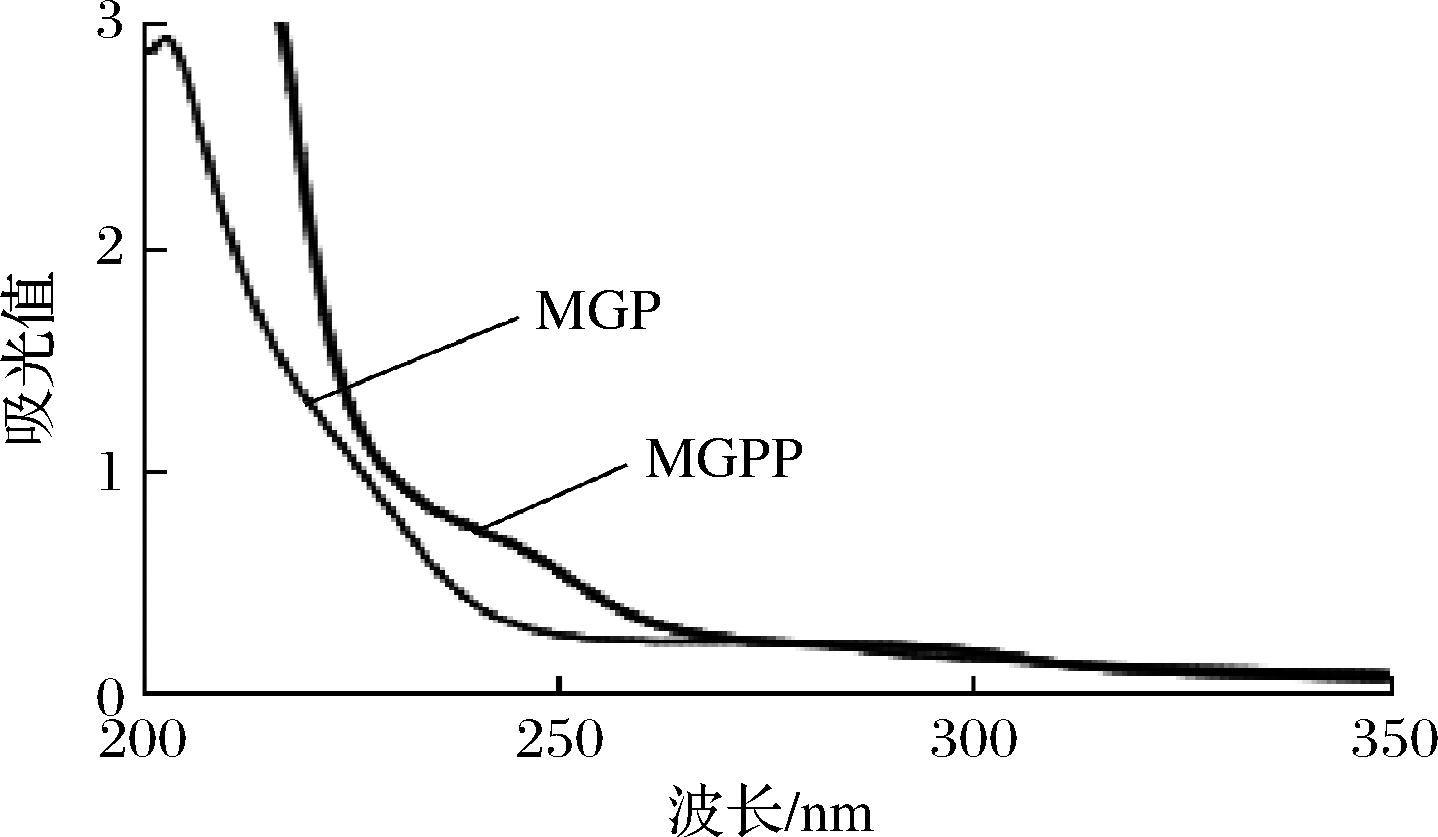
图3 β-消除反应前后紫外扫描光谱图
Fig.3 UV scan spectrum before and after β-elimination reaction
2.4 圆二色谱分析结果
蛋白质的二级结构主要通过非共价力维持,当分子内环境发生变化时,蛋白分子将重新排列,达到最低能量以维持相对稳定[17]。根据凝胶电泳测得的分子质量对MGP(12 kDa)和MGPP(9 kDa)的圆二色谱图数据进行分析,得到2种多肽二级结构相对含量如表2所示。MGP经β-消除后所获得的MGPP,其二级结构α-螺旋含量降低9.3%;β-折叠含量降低21%;β-转角、无规则卷曲含量分别增加1.6%、28.7%。这表明糖基化会使MGP肽链二级结构更加稳定有序,这是因为高水平的α-螺旋、β-折叠含量高有助于肽链形成更紧密的蛋白结构或分布,改善蛋白的稳定性[18]。
表2 β-消除前后二级结构各组分相对含量 单位:%
Table 2 Relative content of each component of the secondary structure before and after β-elimination
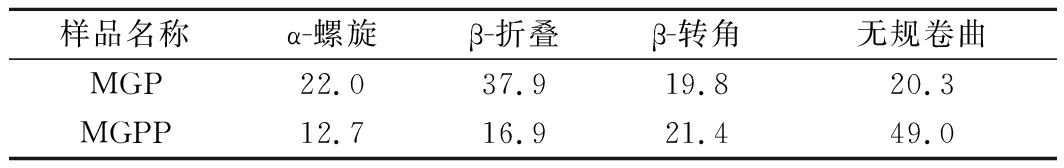
样品名称α-螺旋β-折叠β-转角无规卷曲MGP22.037.919.820.3MGPP12.716.921.449.0
2.5 DSC分析结果
蛋白质只有在水中才能呈现出特定的三维立体结构来支撑蛋白质的各种功能性质[19],因此蛋白质的热变性温度即蛋白质在水溶液中的变性温度。MGP溶液和MGPP溶液的DSC曲线如图4所示,曲线的最大吸收峰值所对应的温度和峰面积即它们的热变性温度(Td)和焓变值(ΔH)[19]。MGP的热变性温度Td=148 ℃,焓变值ΔH=0.207 kJ/g;MGPP的Td=136 ℃,ΔH=0.138 kJ/g。Td反映热稳定性,ΔH反映变性所需要的热量,ΔH越大表明有序结构越多,蛋白的聚集程度越大[20]。上述结果表明MGP的热稳定性(Td)和有序聚集程度(ΔH)都大于MGPP,即糖基化有助于肽链形成有序结构,提高肽链热稳定性。
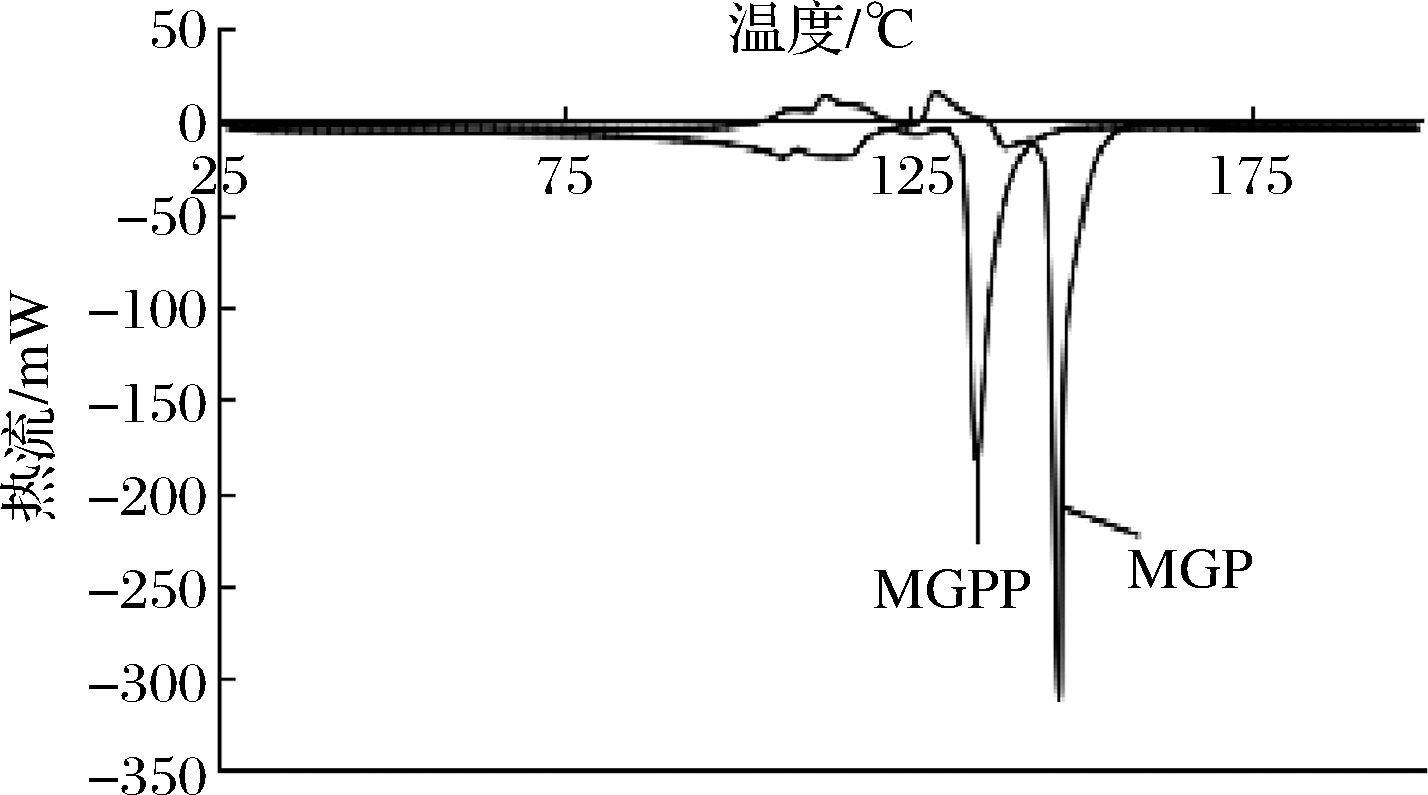
图4 MGP和MGPP的DSC谱图
Fig.4 DSC spectra of MGP and MGPP
2.6 扫描电子显微镜分析结果
图5为澳洲坚果糖肽MGP和肽链MGPP在扫描电镜下放大200和2 000倍的表面形貌图。在200倍和2000倍扫描电镜上观察到MGP有很多疏松多孔的网络结构,网络结构周围光滑平整(图5-a,图5-b),说明分子间有相互作用力,能形成紧密而稳定的结构。与MGP相比,MGPP中紧密有序的网络结构消失(图5-c、图5-d),出现一些杂乱无序的结构。MGP在冷冻干燥后仍能保持有序结构可能是由于糖链能够自身形成糖网络[21],可以加固蛋白网络结构,使其在冷冻环境下更加稳定。

a-MGP×200;b-MGP×2000;c-MGPP×200;d-MGPP×2 000
图5 MGP β-消除反应前后的扫描电镜图
Fig.5 SEM images before and after MGP β-elimination reaction
2.7 抗氧化分析结果
如图6所示,随着MGP质量浓度的提高,其DPPH、·OH清除能力和还原能力逐步提高,并有明显量效关系,并在质量分数2%时分别达到最大,为60.3%、98.7%、1.45。与MGP相比,MGPP的DPPH清除率显著降低,最大清除率由60.3%降到20.3%(图6-a),除去糖链后,糖肽空间结构被破坏,疏水基团相互结合,使更多的亲水氨基酸暴露,而DPPH是一种油溶性的自由基[12],肽链极性增加使它们更难捕获油溶性的DPPH,导致DPPH的清除能力下降;·OH最大清除率由98.7%降到37.6%(图6-b),由圆二色谱结果可知,消除糖链后多肽的β-折叠减少而无规则卷曲增加,研究发现β-折叠中的阶梯状结构[6]能够将大部分氢键包裹在结构内,弱化了·OH对本身结构的影响,使之有更强的·OH清除能力,与本实验得到的结果相符合;最大还原能力由1.4降到0.5(图6-c),还原能力反映抗氧化剂供电子能力的强弱,有研究表明酸性或碱性氨基酸残基对还原能力的影响很大[22],主要是由于这些氨基酸的氨基和羧基参与了金属离子反应,使肽链供电子能力变差,阻碍了抗氧化反应[23]。去糖基化导致肽链中的酸性或碱性氨基酸暴露出来,使MGPP的还原能力下降。除了通过影响肽链分子空间结构,抗氧化活性的降低还可能与糖肽中糖链本身即具有抗氧化及清除自由基的能力有关。综上所述,MGP具有较好的抗氧化活性,其结构上的O-糖基化有助于提高和稳定澳洲坚果糖肽的抗氧化活性。
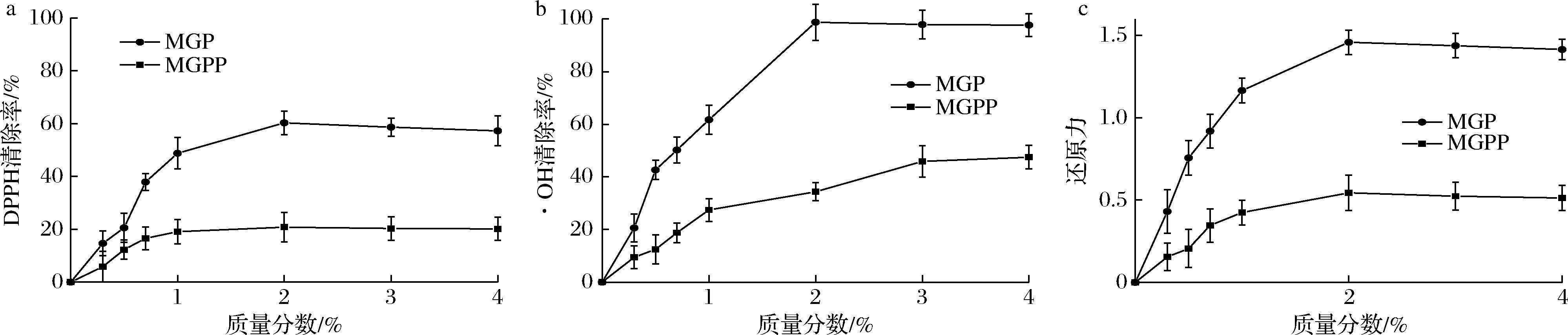
a-DPPH自由基清除率;b-·OH的清除率;c-总还原力
图6 MGP和MGPP的体外抗氧化作用
Fig.6 Antioxidant effects of MGP and MGPP in vitro
3 结论
本文从澳洲坚果油粕中分离纯化得到分子质量约为12 kDa的澳洲坚果糖肽MGP,MGP经β-消除后得到分子质量约为9 kDa的肽链MGPP。研究结果表明:糖肽MGP为O-型糖苷键,其肽链的二级结构中较MGPP有更多的α-螺旋、β-折叠等有序结构,有更高的热稳定性、抗氧化能力和更有序的显微结构。因此,澳洲坚果糖肽的糖基化有助于维持澳洲坚果糖肽的空间结构,使MGP的结构和性能更加稳定,这对更好地发挥其多肽的生物功能、更好地利用丰富的动植物蛋白资源有重要意义。
[1] CARVALHO L C,MORAIS C L M,LIMA K M G,et al.Using intact nuts and near infrared spectroscopy to classify Macadamia cultivars[J].Food Analytical Methods,2018,11(7):1 857-1 866.
[2] ACHEAMPONG-BOATENG O,MIKASI M S,BENYI K,et al.Growth performance and carcass characteristics of feedlot cattle fed different levels of Macadamia oil cake[J].Trop Anim Health Prod,2008,40(3):175-179.
[3] JITNGARMKUSOL S,HONGSUWANKUL J,TANANUWONG K.Chemical compositions,functional properties,and microstructure of defatted Macadamia flours[J].Food Chemistry,2008,110(1):23-30.
[4] 陈垚,赵敏,李文华.低氧环境下蛋白质糖基化参与免疫反应机制的研究进展[J].中国组织工程研究,2019,23(35):5 703-5 709.
CHEN Y,ZHAO M,LI W H.Research progress of mechanism of protein glycosylation in the immune reaction under hypoxia[J].Chinese Journal of Tissue Engineering Research,2019,23(35):5 703-5 709.
[5] DEN STEEN P V,RUDD P M,DWEK R A,et al.Concepts and principles of O-linked glycosylation[J].Crit Rev Biochem Mol Biol,1997,33(3):151-208.
[6] 王岸娜, 苏子豪,吴立根,等.O-糖链对猕猴桃糖蛋白抗氧化能力及构象的影响[J].河南工业大学学报(自然科学版),2016,37(2):79-85.
WANG A N,SU Z H,WU L G,et al.The impact of O-glycan on the antioxidant activity and secondary structure of glycoprotein extracted from kiwi fruit[J].Journal of Henan University of Technology (Natural Science Edition),2016,37(2):79-85.
[7] VASUDEVAN D,HALTIWANGER R S.Novel roles for O-linked glycans in protein folding[J].Glycoconjugate Journal,2014,31(6-7):417-426.
[8] WALLIS G L F,SWIFT R J,HEMMING F W,et al.Glucoamylase overexpression and secretion in Aspergillus niger:Analysis of glycosylation[J].Biochimica et Biophysica Acta(BBA)-General Subjects,1999,1472(3):576-586.
[9] 张翔, 李星星,黄雪松.澳洲坚果糖蛋白的分离纯化及其体外抗氧化能力[J].食品与发酵工业,2019,45(5):145-150.
ZHANG X,LI X X,HUANG X S.Purification of glycoprotein from Macadamia and its antioxidant activity in vitro[J].Food and Fermentation Industries,2019,45(5):145-150.
[10] SCHAGGER H,VON JAGOW G.Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J].Analytical Biochemistry,1987,166(2):368-379.
[11] JENSEN P H,KARLSSON N G,KOLARICH D,et al.Structural analysis of N-and O-glycans released from glycoproteins[J].Nature Protocols,2012,7(7):1 299-1 310.
[12] 陈丽花, 朱楚楚,李冉冉.体外消化对金瓜籽抗氧化肽抗氧化活性的影响[J].食品科学,2019,40(3):78-86.
CHEN L H,ZHU C C,LI R R.Effect of in vitro digestion on antioxidant activity of antioxidant peptides from marrow seeds (Cucurbita pepo L.var.medullosa alef.)[J].Food Science,2019,40(3):78-86.
[13] 陈树俊, 石玥,李乐,等.藜麦芽发酵浓浆模拟体外消化及抗氧化活性研究[J].营养学报,2018,40(1):71-78.
CHEN S J,SHI Y,LI L,et al.Studies on simulated in vitro digestion and antioxidant activity of fermented quinoa malt paste[J].Acta Nutri Sin,2018,40(1):71-78.
[14] 童坦君, 刘德勇.燕窝糖肽的分离与鉴定[J].科学通报,1985,30(12):949.
TONG T J,LIU D Y.Isolation and identification of bird’s nest glycopeptide[J].Chinese Science Bulletin,1985,30(12):949.
[15] 李文哲, 张彦龙.糖基化修饰与糖复合物功能[M].北京:科学出版社,2013.
LI W ZH,ZHANG Y L.Glycosylation modification and function of sugar complex[M].Beijing:Science Press,2013.
[16] SCORZA M,LIGUORI R,ELCE A,et al.Biological role of mannose binding lectin:from newborns to centenarians[J].Clinica Chimica Acta,2015(451):78-81.
[17] 刘丽莉, 代晓凝,杨晓盼,等.喷雾冷冻干燥对鸡蛋清蛋白结构和特性的影响[J].食品与机械,2020,36(1):30-35;41.
LIU L L,DAI X N,YANG X P,et al.Effect of spray freeze drying on the structure and properties of egg white protein[J].Food and Machinery,2020,36(1):30-35;41.
[18] 薛海燕,操歌,贺宝元,等.超声处理对牛乳酪蛋白结构及抗原性的影响[J].食品科学,2019,40(23):123-129.
XUE H Y,CAO G,HE B Y,et al.Effect of ultrasonic treatment on the structure and antigenicity of bovine caseins[J].Food Science,2019,40(23):123-129.
[19] 刘睿,潘思轶,谢笔钧,等.高粱原花青素对α-淀粉酶和蛋白酶活力影响的DSC研究[J].食品与发酵工业,2006,32(7):64-66.
LIU R,PAN S Y,XIE B J.Effects of procyanidins from Sorghum episperm on activity of α-amylase and protease by DSC[J].Food and Fermentation Industries,2006,32(7):64-66.
[20] 王飞镝, 周智鹏,崔英德,等.DSC研究大豆蛋白凝胶中水的状态[J].功能材料,2006,37(6):933-935.
WANG F D,ZHOU ZH P,CUI Y D,et al.Study on the state of water in soy protein gel by DSC[J].Journal of Functional Materials,2006,37(6):933-935.
[21] 伍燕, 朱家豪,汪伟,等.暗褐网柄牛肝菌多糖AHP分离纯化和结构研究[J].食品与发酵工业,2020,46(8):92-96.
WU Y,ZHU J H,WANG W,et al.Isolation,purification and structural elucidation of AHP polysaccharide from Phlebopus portentosus[J].Food and Fermentation Industries,2020,46(8):92-96.
[22] 张冠亚, 黄晓君,聂少平,等.体外模拟3种消化液对铁皮石斛多糖的消化作用[J].食品科学,2014,35(23):279-283.
ZHANG G Y,HUANG X J,NIE S P,et al.Effects of three digestive juices on the in vitro digestion of Dendrobium officinale polysaccharide[J].Food Science,2014,35(23):279-283.
[23] DAVALOS A,MIGUEL M,BARTOLOME B,et al.Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J].Journal of Food Protection,2004,67(9):1 939-1 944.