紫檀芪(pterostilbene,PTS)是一种芪类化合物,主要存在于蓝莓、葡萄等水果中[1]。研究表明,其是白藜芦醇的甲基化衍生物,具有抗氧化、延缓衰老、降血脂等生物活性[2]。然而紫檀芪在水中的溶解性极差,导致其生物利用率低,在光照条件下容易转变成顺式结构而失去活性[3],因而限制了其在医药、食品及保健品中的应用。
以纳米输送系统改善疏水性分子的溶解性和稳定性越来越受欢迎,尤其是利用蛋白质作为载体。蛋白质来源广、成本低,而且具有多个疏水区域可以与活性物质结合,可用于稳定胶体颗粒或者纳米分散体[4]。TAPAL等[5]制备了大豆蛋白-姜黄素复合物,姜黄素的溶解性以及生物利用率显著提高。LIU等[6]利用乳清蛋白保护白藜芦醇不被降解,提高了白藜芦醇的稳定性。
亚麻籽蛋白具有较高的营养价值,其溶解性和乳化性良好,而且其热稳定性优于大豆蛋白、乳清蛋白等[7],可以作为活性物质的载体。但是其在等电点附近以及高盐条件下不稳定,容易聚集。先前的研究表明,蛋白质与多糖(如:海藻酸钠、大豆多糖等)可以通过静电相互作用结合,从而有效抑制聚集体的产生,提高体系的稳定性[8]。
本文利用可溶性大豆多糖制备负载紫檀芪的亚麻籽蛋白-大豆多糖核壳型纳米复合物,研究颗粒之间的相互作用以及复合物的稳定性,以期开发出用于医药及保健品领域的紫檀芪纳米输送体系。
1 材料与方法
1.1 材料与设备
亚麻籽饼粉,宁夏君星坊食品科技有限公司;可溶性大豆多糖(soluble soybean polysaccharide,SSPS),河南万邦实业有限公司;紫檀芪(纯度≥98%),北京百灵威科技有限公司;其他试剂购于国药集团化学试剂公司,均为分析纯。
GL-23M冷冻离心机,长沙翔之离心机有限公司;LGJ-10E冷冻干燥机,宁波森茨生物科技有限公司;Nano-ZS粒度电位仪,英国马尔文公司;傅里叶红外光谱仪,美国Nicolet公司;F-7000荧光光谱仪,日本国立公司;高效液相色谱仪,美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 亚麻籽蛋白的提取
亚麻籽蛋白(flaxseed protein isolate,FPI)的提取方法主要参考YANG等[9]的方法:取100 g亚麻籽饼粉,比例1∶5(g∶mL)的比例加入石油醚,除去残留的亚麻籽油。将除油后的亚麻籽饼粉按比例1∶20(g∶mL)的比例加入去离子水,调整溶液pH值为9.5,搅拌2 h。然后将溶液在4 ℃,4 000×g的条件下离心20 min,重复上述步骤3次后合并上清液。调整上清液的pH值为4.0,离心收集沉淀,将沉淀溶于水并调整其pH值为7.0。最后将复溶后的溶液冷冻干燥得到亚麻籽蛋白粉末,并用凯氏定氮法测其蛋白含量。
1.2.2 纳米复合物的制备
取一定量的亚麻籽蛋白粉末溶于去离子水,配成20 mg/mL的原始蛋白溶液。将5 mg/mL的紫檀芪乙醇溶液按照体积比1∶10逐滴加入亚麻籽蛋白溶液中,避光搅拌3 h。最后将其离心除去游离的紫檀芪得到亚麻籽蛋白-紫檀芪复合物溶液(flaxseed protein isolate-pterostilbene nanocomplex,FPN)。
将新鲜制备的FPN复合物溶液与10 mg/mL的SSPS溶液等体积混合,用1 mol/L HCl调整溶液pH值为2.0~5.0,得到亚麻籽蛋白-紫檀芪-大豆多糖复合物溶液(flaxseed protein isolate-pterostilbene-soluble soybean polysaccharide nanocomplex,FPSN),研究pH对复合物的影响。将新鲜制备的FPN复合物溶液与不同质量浓度(5~25 mg/mL)的SSPS溶液等体积混合,用1 mol/L HCl调整溶液pH值为3.5,得到FPSN,研究SSPS浓度对复合物的影响[8]。
1.2.3 纳米复合物的表征
将新鲜制备的复合物溶液用去离子水稀释到0.1% 以避免多重散射,利用马尔文激光粒度仪测定样品的平均粒径、电位和多分散性指数(polydispersion index,PDI)。测试条件设置为:固定角度173°,蛋白颗粒折射率1.763,氦氖激光器为633 nm[10]。
1.2.4 包埋率的测定
根据LIU等[11]的方法测定复合物中结合的紫檀芪含量。取1 mL样品加入乙酸乙酯,漩涡振荡2 min,静置分层后收集上层液体,重复萃取3次后合并有机相。样品经过0.22 μm微孔滤膜过滤后,用Waters高效液相色谱(UV检测器)测定样品中紫檀芪的含量。色谱柱为C18柱,检测波长为305 nm,流动相为55%(体积分数)乙腈,流速为1 mL/min,柱温为30 ℃,进样量为20 μL。根据标准曲线计算紫檀芪含量(Y=168.55 X-11.795, R2=0.998 8)。包埋率按公式(1)计算:
包埋率![]()
(1)
1.2.5 荧光光谱分析
将样品适当稀释,加入不同浓度梯度的紫檀芪乙醇溶液(0~50 μg/mL),用F-7000型荧光光谱仪(日本日立公司)测定样品的荧光光谱。固定激发波长280 nm,光谱测定范围300~450 nm,扫描速度为1 200 nm/min,狭缝宽度5 nm[4]。
1.2.6 傅里叶红外光谱分析
将10 mg冷冻干燥后的样品与1.0 g的溴化钾混合均匀后压片,以溴化钾为空白背景进行扫描。波长范围400~4 000 cm-1,分辨率4 cm-1,扫描次数32次,最后结果用Peakfit 4.12 软件进行分析处理[12]。
1.2.7 纳米复合物的稳定性分析
调节复合物溶液pH值为2.0~8.0,以粒径和电位分析样品在不同pH条件下的稳定性。类似地,在紫檀芪纳米复合物溶液中加入NaCl,使其盐离子浓度为0~500 mmol/L,通过电位来分析样品在不同盐离子条件下的稳定性。
1.2.8 数据分析
所有实验进行3次。采用SPSS软件进行方差分析,并用Duncan多重比较进行显著性分析(P<0.05)。
2 结果与分析
2.1 纳米复合物制备参数的研究
2.1.1 pH对复合物包埋效果的影响
亚麻籽蛋白的等电点为4~5[13],pH<4时,亚麻籽蛋白带正电,大豆多糖带负电,二者可以通过静电相互作用形成核壳结构的纳米颗粒[8]。如图1所示,pH=2时,纳米颗粒的包埋率最小,仅为70.12%,其Zeta 电位大约为-19.3 mV,此时颗粒间的静电排斥作用弱,容易聚集沉淀,导致离心后上清液中的紫檀芪含量变少,因而其包埋率最小。pH=3.5时,包埋率达到95.06%,在该条件下,亚麻籽蛋白与大豆多糖带相反电荷,有助于二者之间的相互作用,此时整个体系分散均匀,因此选择pH=3.5来制备纳米复合物。
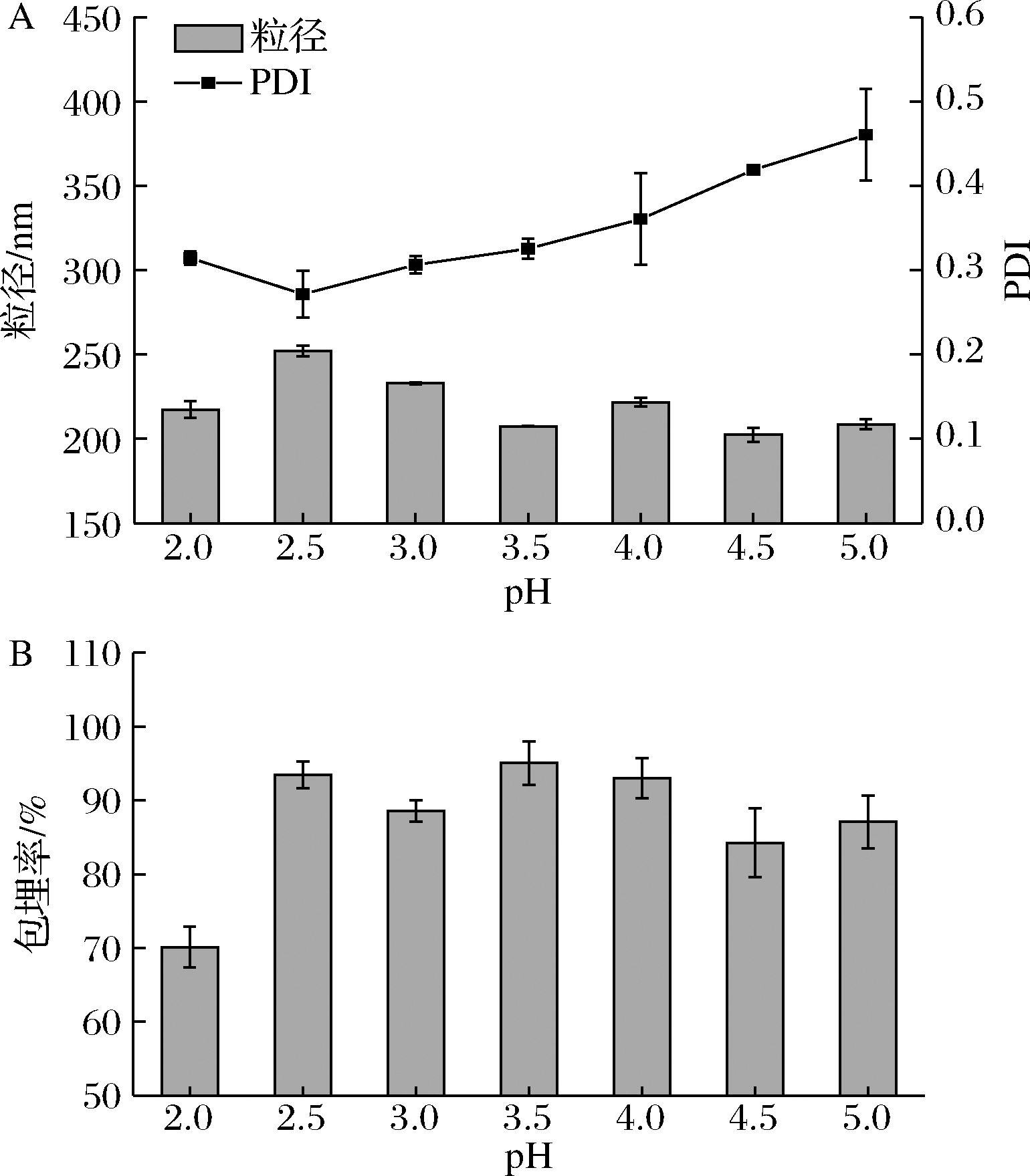
A-粒径与PDI;B-包埋率
图1 pH对FPSN粒径、PDI和包埋率的影响
Fig.1 Effect of pH on the particle diameter, PDI and encapsulation efficiency of FPSN
2.1.2 多糖质量浓度对复合物包埋效果的影响
如图2所示,未添加大豆多糖时,复合物带正电荷。随着大豆多糖的加入,复合物表面吸附的大豆多糖逐渐增加,纳米颗粒平均粒径逐渐增大,复合物表面的净电荷增加,使得颗粒之间的静电斥力变大。质量浓度达到10 mg/mL后,电位趋于稳定,且其电位值与大豆多糖在pH=3.5时的电位值相似,表明大豆多糖缠绕在了亚麻籽蛋白的表面,其静电斥力阻止了颗粒间的聚集。大豆多糖质量浓度过高会使颗粒粒径变大,体系分散不均匀,因此选择10 mg/mL作为最佳浓度,此时复合物表面的大豆多糖也达到饱和,分散液也比较稳定。
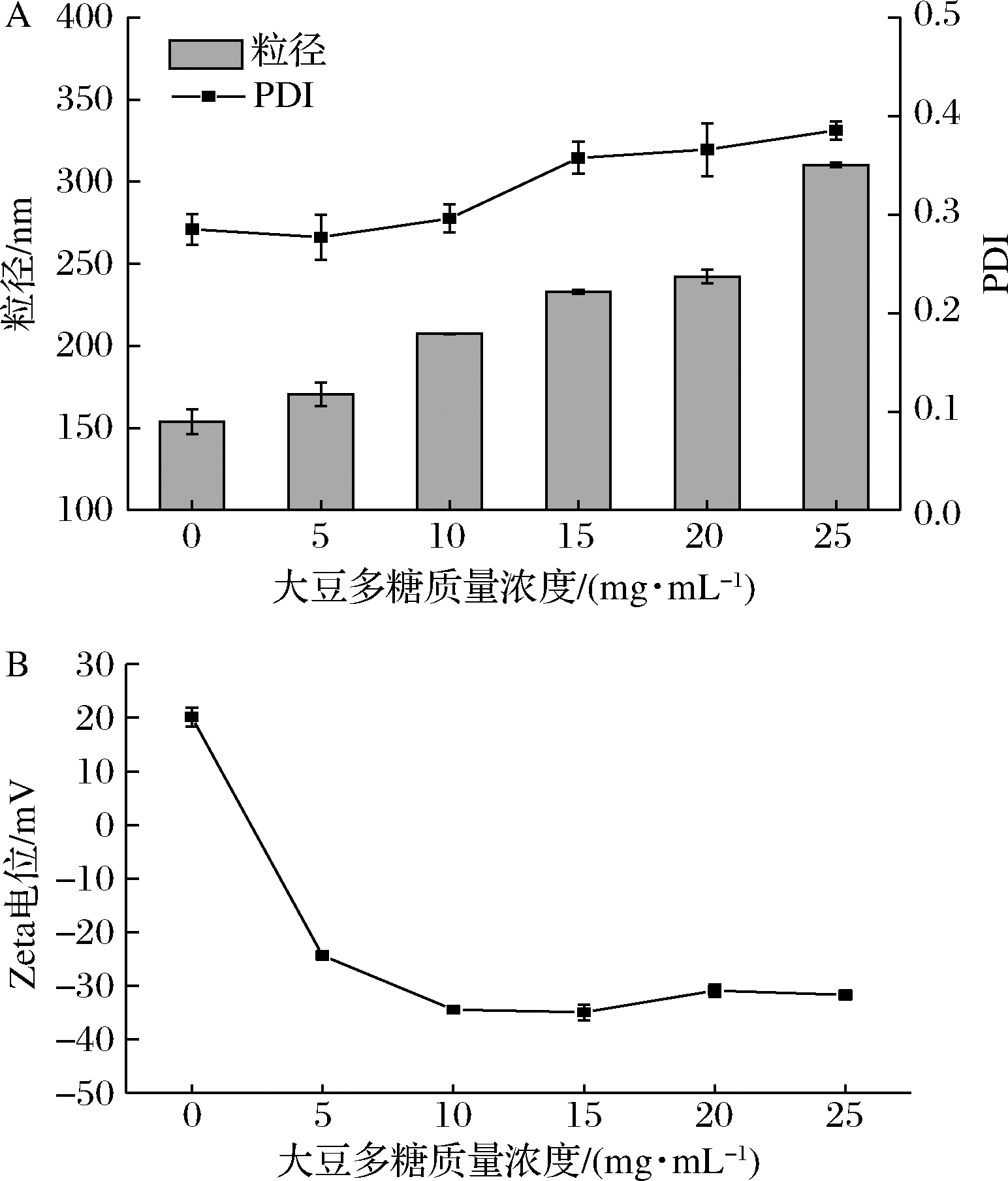
A-粒径和PDI;B-Zeta电位
图2 大豆多糖质量浓度对FPSN电位、粒径和PDI的影响
Fig.2 Effect of SSPS concentration on the zeta potential, particle diameter and PDI of FPSN
2.2 颗粒间的相互作用分析
2.2.1 荧光光谱分析
蛋白质分子中的酪氨酸、色氨酸等氨基酸残基具有荧光,可在280 nm波长处被激发,而且这些氨基酸残基对微环境的变化很敏感,因此可以利用荧光光谱法来研究疏水性生物活性分子与蛋白质之间的相互作用[14]。如图3所示,在280 nm的激发波长下,亚麻籽蛋白在350 nm处出现了峰值。随着紫檀芪浓度的增加,亚麻籽蛋白的荧光强度逐渐变小,说明紫檀芪的加入使得亚麻籽蛋白发生了荧光猝灭。还可以看到亚麻籽蛋白的最大荧光发射波长发生了红移现象(350~357 nm),表明色氨酸进入了一个更加亲水的微环境,同时也可以得出紫檀芪与亚麻籽蛋白之间存在疏水相互作用的结论。CHEN等[15]通过将大豆蛋白与百里酚结合来改善百里酚的稳定性,百里酚对大豆蛋白有荧光猝灭效应,二者之间存在疏水相互作用。
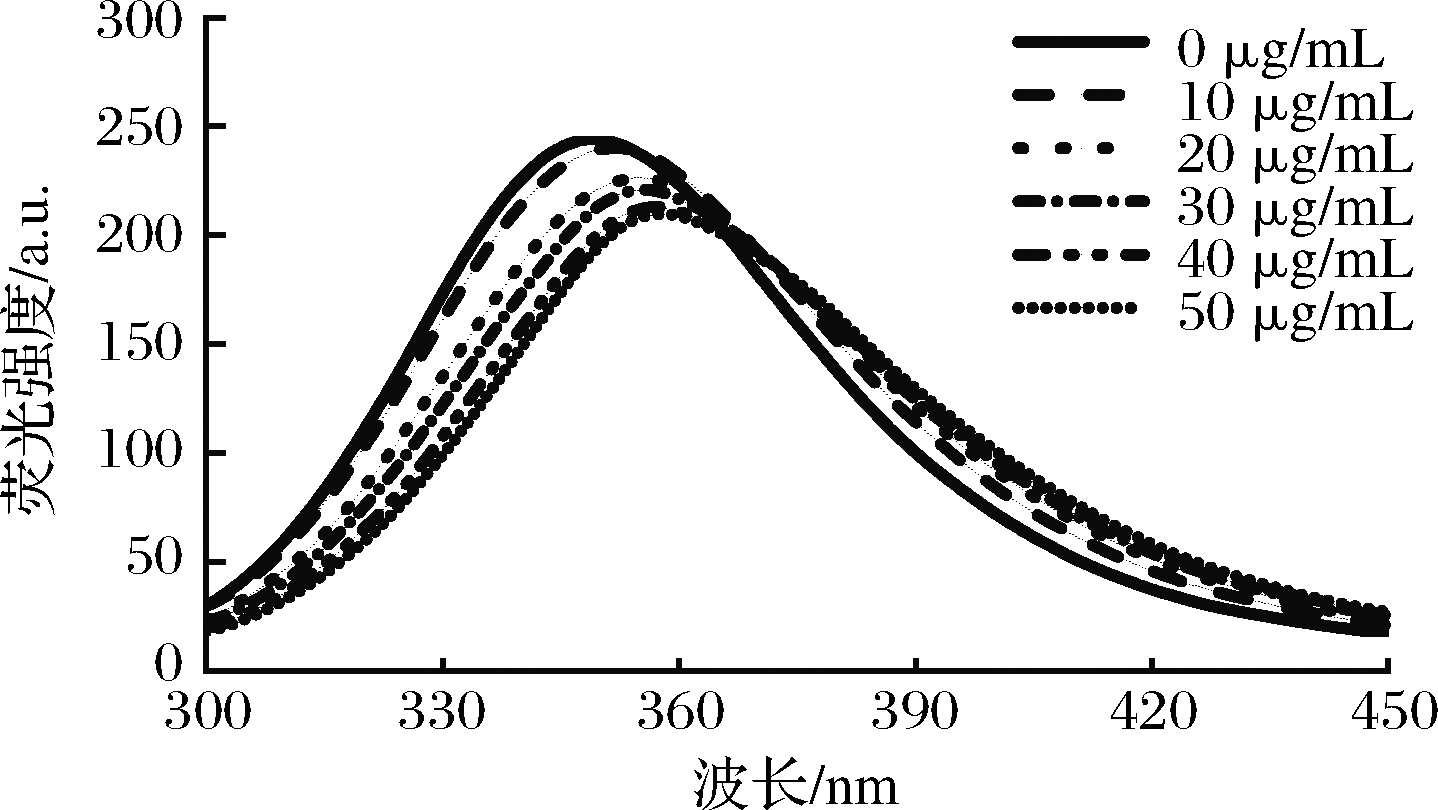
图3 紫檀芪对亚麻籽蛋白内源荧光猝灭情况
Fig.3 Typical profiles for the quenching of intrinsic fluorescence of FPI, by increasing concentrations of PTS
2.2.2 傅里叶红外光谱分析
图4是亚麻籽蛋白、大豆多糖、紫檀芪、FPN、FPSN的傅里叶红外光谱。亚麻籽蛋白在3 292 cm-1处有1个吸收峰,属于—OH伸缩振动峰;在1 660 cm-1和1 539 cm-1有吸收峰,分别属于C![]() O和N—H振动吸收峰,与YANG等[9]的报道结果一致。与亚麻籽蛋白的羟基吸收峰相比,FPN和FPSN的羟基伸缩振动峰发生了蓝移,说明颗粒之间存在氢键相互作用。此外,大豆多糖与亚麻籽蛋白结合后,波数由3 307 cm-1移动到3 418 cm-1,而且移动范围比较大,说明大豆多糖与蛋白之间的氢键相互作用较强。LIU等[6]也观察到了类似的现象,表明α乳清蛋白与白藜芦醇之间存在分子间氢键作用力。酰胺Ⅰ带位于1 600~1 700 cm-1,主要涉及C
O和N—H振动吸收峰,与YANG等[9]的报道结果一致。与亚麻籽蛋白的羟基吸收峰相比,FPN和FPSN的羟基伸缩振动峰发生了蓝移,说明颗粒之间存在氢键相互作用。此外,大豆多糖与亚麻籽蛋白结合后,波数由3 307 cm-1移动到3 418 cm-1,而且移动范围比较大,说明大豆多糖与蛋白之间的氢键相互作用较强。LIU等[6]也观察到了类似的现象,表明α乳清蛋白与白藜芦醇之间存在分子间氢键作用力。酰胺Ⅰ带位于1 600~1 700 cm-1,主要涉及C![]() O振动,酰胺Ⅱ带在1 500~1 600 cm-1范围内,主要是N—H弯曲振动和C—N伸缩振动。FPN和FPSN酰胺Ⅰ带对应的吸收峰偏移到了1 657、1 660 cm-1,酰胺Ⅱ带对应的吸收峰偏移到了1 543、1 542 cm-1。根据参考文献中有关蛋白质与多糖及其他物质复合后酰胺带变化推测可知,这2个吸收峰的迁移与亚麻籽蛋白、大豆多糖之间的静电作用相关[16-17]。另外,FPN、FPSN的指纹区内`紫檀芪对应的特征峰吸收数量减少,强度减弱,而且大豆多糖对应的羧基特征峰(1 622 cm-1)在FPSN的光谱中没有检测到,说明蛋白-多糖复合物的形成。傅里叶红外光谱结果说明亚麻籽蛋白、大豆多糖、紫檀芪在形成复合物时存在相互作用,主要为静电相互作用和氢键作用力。
O振动,酰胺Ⅱ带在1 500~1 600 cm-1范围内,主要是N—H弯曲振动和C—N伸缩振动。FPN和FPSN酰胺Ⅰ带对应的吸收峰偏移到了1 657、1 660 cm-1,酰胺Ⅱ带对应的吸收峰偏移到了1 543、1 542 cm-1。根据参考文献中有关蛋白质与多糖及其他物质复合后酰胺带变化推测可知,这2个吸收峰的迁移与亚麻籽蛋白、大豆多糖之间的静电作用相关[16-17]。另外,FPN、FPSN的指纹区内`紫檀芪对应的特征峰吸收数量减少,强度减弱,而且大豆多糖对应的羧基特征峰(1 622 cm-1)在FPSN的光谱中没有检测到,说明蛋白-多糖复合物的形成。傅里叶红外光谱结果说明亚麻籽蛋白、大豆多糖、紫檀芪在形成复合物时存在相互作用,主要为静电相互作用和氢键作用力。

A-PTS;B-SSPS、FPI、FPN、FPSN
图4 PTS、FPI、SSPS、FPN、FPSN的红外光光谱图
Fig.4 FTIR spectra of PTS, FPI, SSPS, FPN and FPSN
2.3 稳定性分析
2.3.1 pH稳定性
Zeta电位是表征胶体稳定性的重要指标之一。其绝对值越大,表明颗粒间的斥力越大,整个体系越稳定。相反,其绝对值越小,体系越不稳定,容易聚集沉淀[18]。纳米颗粒表面的Zeta电位随pH的变化如图5所示,由于大豆多糖的存在,FPSN的带电量高于FPN。在中性条件下,由FPN和FPSN均带负电,随着pH的降低,复合物的|Zeta|逐渐变小。FPN在pH=4~5时净电荷为0,随着pH的进一步降低,Zeta 电位变为正,且其值逐渐变大。
由图5可知, pH=4、5时,FPN的平均粒径明显高于其他pH条件下的粒径。这是因为在等电点附近,FPI所带净电荷几乎为0,颗粒间的斥力较小,体系不稳定,导致其粒径比较大。pH=2时,FPSN复合物体系稳定性较差,相互作用较弱,容易聚集。随着pH的增大,FPSN的平均粒径保持在250 nm左右,其溶解度提高,没有沉淀产生,说明大豆多糖的加入有效提高了复合物的稳定性。大豆多糖之所以能够改善蛋白在酸性条件下的稳定性,是因为大豆多糖有复杂的多糖链,可以缠绕在蛋白表面,通过空间位阻效应以及静电排斥力阻止蛋白的聚集。

A-Zeta电位;B-平均粒径
图5 pH对FPN和FPSN纳米复合物的影响
Fig.5 Effect of pH value on FPN and FPSN nanocomplex
2.3.2 盐离子稳定性
蛋白基纳米颗粒对盐离子的稳定性较差,因此有必要研究盐离子对所制备复合物稳定性的影响。由图6可知,2种复合物电位随着盐离子浓度的变化趋势是相似的,随着盐浓度的增大,颗粒表面的净电荷减少,其电位值变小,原因可能是盐离子屏蔽了蛋白表面的电荷,从而削弱了亚麻籽蛋白与大豆多糖之间的相互作用,导致颗粒的聚集。尽管盐离子降低了FPSN的表面电荷,但其带电量仍然高于FPN。FPSN表面的大豆多糖为纳米粒子提供了空间位阻,可以使纳米粒子在高离子强度下保持稳定[19]。LI等[20]制备了大豆蛋白-二十八烷醇纳米复合物,发现该复合物的 Zeta电位也随着盐离子浓度的增加而降低。
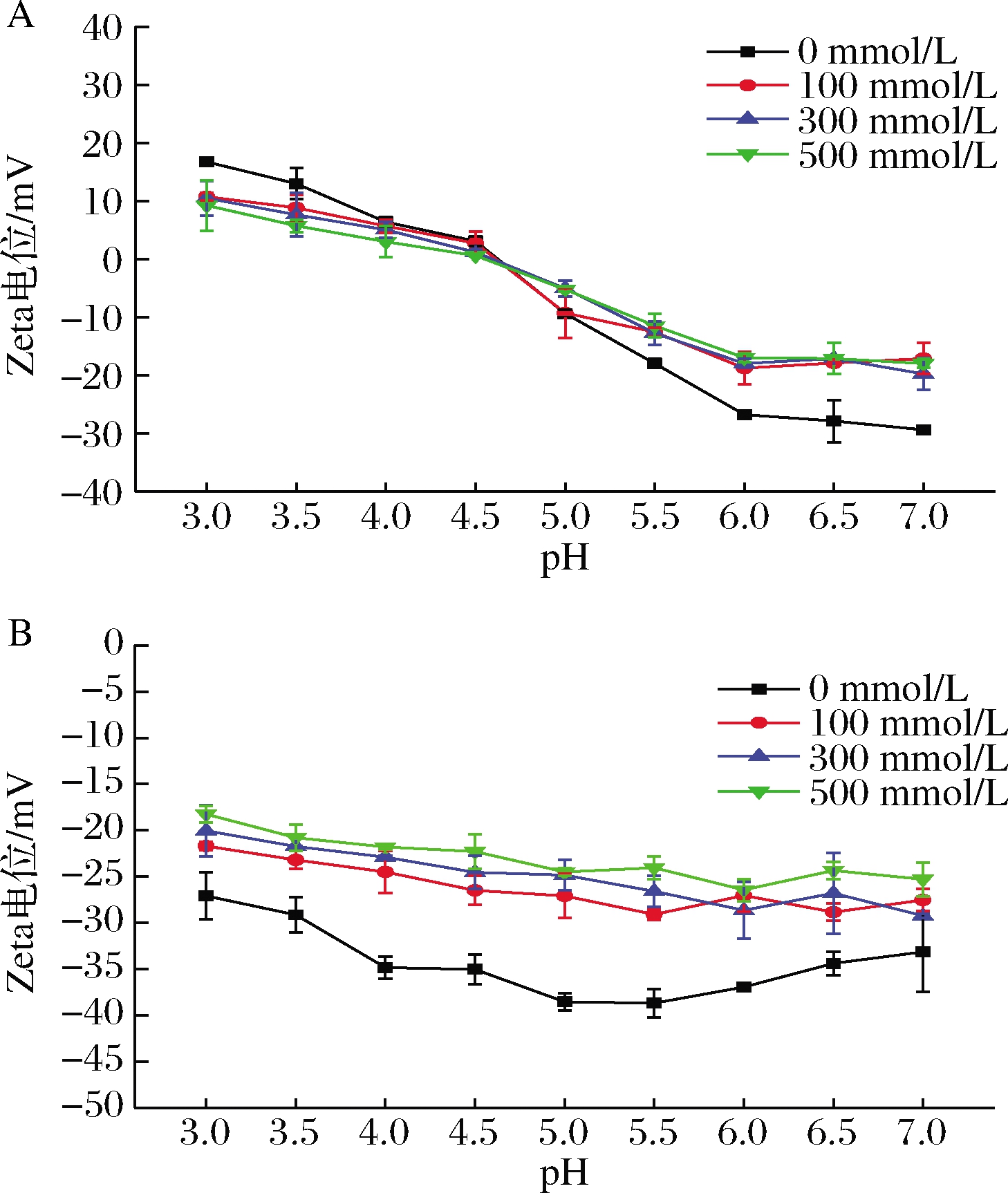
A-FPN;B-FPSN
图6 盐离子浓度对FPN和FPSN纳米复合物Zeta电位的影响
Fig.6 Effect of ion concentration on zeta potential of FPN and FPSN nanocomplex
3 结论
本研究制备了亚麻籽蛋白-紫檀芪-大豆多糖纳米复合物来改善紫檀芪的水溶性及稳定性。溶液pH值为3.5且大豆多糖质量浓度为10 mg/mL时,包埋率达到95.06%,此时整个体系分散比较均匀。通过荧光光谱和傅里叶红外光谱发现,亚麻籽蛋白、大豆多糖、紫檀芪在形成复合物时存在相互作用,主要为疏水相互作用、静电相互作用和氢键作用力。加入大豆多糖后,纳米复合物在酸性条件和高盐条件下的稳定性得到明显改善。本研究制备的亚麻籽蛋白-紫檀芪-大豆多糖纳米复合物具有应用于医药、功能性食品的潜力。
[1] PENG R M, LIN G R, TING Y, et al.Oral delivery system enhanced the bioavailability of stilbenes:Resveratrol and pterostilbene[J].Biofactors, 2018, 44(1):5-15.
[2] MA Z, ZHANG X, XU L, et al.Pterostilbene:Mechanisms of its action as oncostatic agent in cell models and in vivo studies[J].Pharmacological Research 2019, 145:104 265.
[3] LIU Q, CHEN J, QIN Y, et al.Encapsulation of pterostilbene in nanoemulsions:Influence of lipid composition on physical stability, in vitro digestion, bioaccessibility, and Caco-2 cell monolayer permeability[J].Food Function, 2019, 10(10):6 604-6 614.
[4] CHAO W J, OU S, LIN W F, et al.Food protein-based phytosterol nanoparticles:Fabrication and characterization[J].Food Function, 2016, 7(9):3 973-3 980.
[5] TAPAL A, TIKU P K.Complexation of curcumin with soy protein isolate and its implications on solubility and stability of curcumin[J].Food Chemistry, 2012, 130(4):960-965.
[6] LIU Y, FAN Y, GAO L, et al.Enhanced pH and thermal stability, solubility and antioxidant activity of resveratrol by nanocomplexation with α-lactalbumin[J].Food Function, 2018, 9(9):4 781-4 790.
[7] OOMAH B D, DER T J, GODFREY D V.Thermal characteristics of flaxseed (Linum usitatissimum L.) proteins[J].Food Chemistry, 2006, 98(4):733-741.
[8] CHEN F, OU S, TANG C.Core-shell soy protein-soy polysaccharide complex(Nano)particles as carriers for improved stability and sustained release of curcumin[J].Journal of Agricultural and Food Chemistry, 2016, 64(24):5 053-5 059.
[9] YANG L, OHM J B, CHEN B C, et al.Physicochemical properties and aroma profiles of flaxseed proteins extracted from whole flaxseed and flaxseed meal[J].Food Hydrocolloids, 2020, 104:105 731.
[10] LI B, DU W, JIN J, et al.Preservation of (-)-epigallocatechin-3-gallate antioxidant properties loaded in heat treated β-lactoglobulin nanoparticles[J].Journal of Agricultural and Food Chemistry, 2012, 60(13):3 477-3 484.
[11] LIU Q, CHEN J, QIN Y, et al.Zein/fucoidan-based composite nanoparticles for the encapsulation of pterostilbene:Preparation, characterization, physicochemical stability, and formation mechanism[J].International Journal of Biological Macromolecules, 2020, 158:461-470.
[12] CHEN S, ZHANG Y, QING J, et al.Core-shell nanoparticles for co-encapsulation of coenzyme Q10 and piperine:Surface engineering of hydrogel shell around protein core[J].Food Hydrocolloids, 2020, 103:105 651.
[13] TIRGAR M, SILCOCK P, CARNE A, et al.Effect of extraction method on functional properties of flaxseed protein concentrates[J].Food Chemistry, 2017, 215:417-424.
[14] ZHU J, SUN X, WANG S, et al.Formation of nanocomplexes comprising whey proteins and fucoxanthin:Characterization, spectroscopic analysis, and molecular docking[J].Food Hydrocolloids, 2017, 63:391-403.
[15] CHEN F, KONG N, WANG L, et al.Nanocomplexation between thymol and soy protein isolate and its improvements on stability and antibacterial properties of thymol[J].Food Chemistry, 2021, 334:127 594.
[16] LUO Y, ZHANG B, WHENT M, et al.Preparation and characterization of zein/chitosan complex for encapsulation of alpha-tocopherol, and its in vitro controlled release study[J].Colloids Surf B Biointerfaces, 2011, 85(2):145-152.
[17] YUAN Y, LI H, LIU C, et al.Fabrication and characterization of lutein-loaded nanoparticles based on zein and sophorolipid:Enhancement of water solubility, stability, and bioaccessibility[J].Journal of Agricultural and Food Chemistry, 2019, 67(43):11 977-11 985.
[18] KOVACEVIC A B, MUELLER R H, SAVIC S D, et al.Solid lipid nanoparticles(SLN) stabilized with polyhydroxy surfactants:Preparation, characterization and physical stability investigation[J].Colloids Surfaces A Physicochemical Engineering Aspects, 2014, 444:15-25.
[19] HUANG X, HUANG X, GONG Y, et al.Enhancement of curcumin water dispersibility and antioxidant activity using core-shell protein-polysaccharide nanoparticles[J].Food Research International, 2016, 87:1-9.
[20] LI D, LI X, WU G, et al.The characterization and stability of the soy protein isolate/1-octacosanol nanocomplex[J].Food Chemistry, 2019, 297:124 766.