海藻酸钠是从褐藻等海藻中提取的,由β-D-甘露糖醛酸和α-L-古洛糖醛酸单体组成的天然多糖,其降解产物海藻酸钠寡糖具有多种功能,在医疗保健领域,海藻酸钠寡糖具有免疫调节[1-2]、促进细胞生长[3-4]、保护神经细胞并促进β-淀粉样蛋白降解[5]、缓解药物毒性[6]、改善骨骼退化[7]等作用;在农业领域,可提高植物抗病性[8-9]、采后保鲜[10]、促进动植物生长[11-12]等,是一种应用前景非常广泛的寡糖。目前海藻酸钠的降解方法主要有辐照法[13-14]和微生物酶解法[15-20],辐照法需要Co60等辐照源,不便于推广。酶解法条件温和、环保压力小且可获得不同结构和特性的寡糖,是近年来的研究热点。酶解法需要将海藻酸钠溶于水中配制为均相溶液,多糖溶液黏度与浓度一般呈指数关系,黏度随浓度提高而迅速增加;受限于黏度的增加,为满足搅拌、泵送等工艺操作而难以进一步提高体系中的多糖浓度,导致体系降解效率较低,在酶解法研究报道中海藻酸钠浓度均未超过1.0%(质量分数),实际应用中海藻酸钠具体浓度尚未见报道。降解后体系中大量水的去除一般使用蒸发或膜处理,存在能耗较高、耗时较长、膜元件通量衰减等问题。使用不能溶解多糖的液体作为介质,即非均相降解,可改善或解决水相中降解不足的问题。在非均相体系中,多糖粉末以固体微粒的形式分散在液体介质中,在整个降解过程中体系为固/液两相状态(图1),由于多糖糖链没有伸展,因此多糖浓度的提高对体系黏度影响较小,在设备搅拌能力范围内可尽量提高多糖浓度以提高生产效率;降解完毕后通过简单的固液分离操作即可得到降解产物,无需除去水,可简化工艺、减少能耗。在非均相体系液体介质的选择上,前期研究发现若干低共熔溶剂(deep eutectic solvents,DES)[21-23]可满足要求。低共熔溶剂是一类新型溶剂体系,使用胆碱、甘油、尿素、有机酸、糖类等天然成分配制的天然DES[24-25]具有绿色来源、成本低廉、可生物降解、环境友好等优点。天然DES的多糖非均相降解具有绿色环保、成本低廉、操作简便等优势,是一种具有良好工业化前景的多糖降解方法。因此,本文对海藻酸钠在该体系中的降解进行了初步研究,以期为其后续研究提供参考。
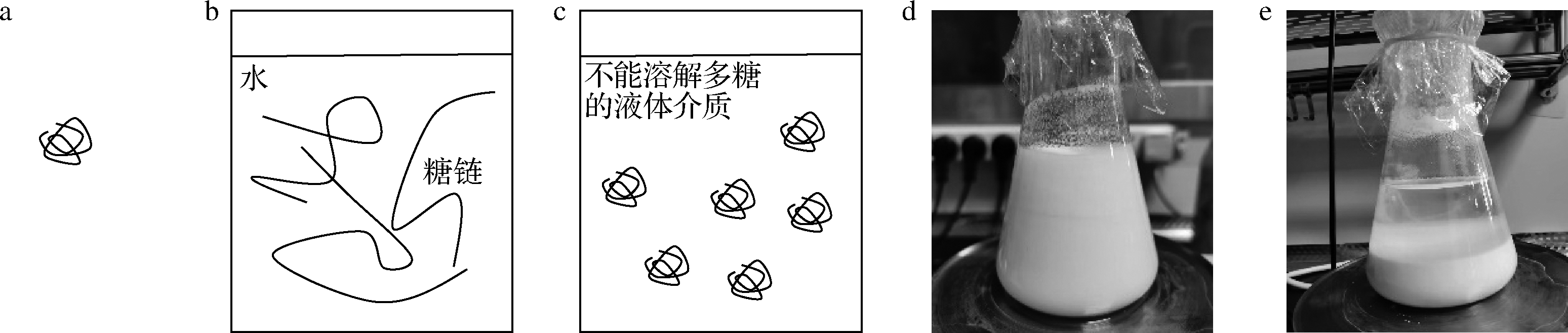
a-多糖(固体微粒);b-水相体系多糖糖链伸展使体系黏度较高;c-非均相体系糖链未伸展,体系黏度相对较低; d-搅拌中的非均相体系;e-停止搅拌的非均相体系上部为液体介质,下部白色沉淀为多糖粉末
图1 非均相体系示意图
Fig.1 Schematic diagram of heterogeneous system
1 材料与方法
1.1 材料与设备
1.2.1 主要材料
海藻酸钠食品添加剂级,外观为白色粉末,青岛明月海藻集团;PRD-6DES液体,由胆碱/尿素/糖醇组成、催化剂PRD-62C、二元羧酸类催化剂,菏泽高新区优科生物科技有限公司;无水乙醇、硝酸钠等试剂均为分析纯或色谱级;水溶液配制均使用双蒸水。
1.2.1 主要设备
85-2单数显恒温磁力搅拌器,金坛市城东新瑞仪器厂;NDJ-5S数显黏度计(配0~4号转子),上海邦西仪器科技有限公司;Nicolet iN10傅立叶变换显微红外光谱仪,美国Thermo公司。
1.2 实验方法
1.2.1 海藻酸钠降解处理
50 g海藻酸钠粉末与DES液体200 mL混合后加入特定比例的降解催化剂,室温下100 r/min搅拌30 min待催化剂溶解后,转移到特定温度恒温水浴中继续搅拌一定时间进行降解处理。降解结束后使用定性滤纸在布氏漏斗上真空抽滤,滤饼在200 mL 75%(体积分数)乙醇中打浆洗涤1次后再次抽滤,滤饼在60 ℃下热风干燥16 h,得到降解产物,用于后续检测。
1.2.2 黏度测定
海藻酸钠及其降解产物配制为3%(质量分数)水溶液,25 ℃下使用数显黏度计测量黏度,每个样品测5次取平均值。
1.2.3 分子质量测定
使用凝胶色谱-示差-多角度激光光散射(GPC-RI-MALS)分析方法,流动相为0.1 mol/L NaNO3,检测器为Optilab T-rEX和DAWN HELEOS Ⅱ(Wyatt technology,美国)串联使用,流速0.4 mL/min,柱温45 ℃,分析柱为Ohpak SB-805 HQ(300 mm×8 mm), SB-804 HQ(300 mm×8 mm), SB-803 HQ(300 mm×8 mm)串联使用。5 mg样品加1 mL 流动相,45 ℃下振荡溶解后14 000 r/min离心10 min,取100 μL上清液进行上样检测。
1.2.4 红外光谱检测
待测样品进行溴化钾压片后使用Nicolet iN10 傅立叶变换显微红外光谱仪检测,样品和背景扫描次数32,分辨率4 cm-1,扫描范围4 000~400 cm-1。
1.2.4 表面扫描电镜观察
由上海微谱化工技术服务有限公司进行,样品粉末黏附在导电胶表面后放入场发射扫描电镜,加速电压3.00 kV,观察成像。
2 结果与分析
2.1 降解工艺优化
多糖的分子质量可通过凝胶过滤等方法获得相对准确的测量结果,但成本和时间耗费较多,黏度法操作简便但测量误差较大,仅能作为分子质量的近似表示。在本研究中将黏度法和凝胶过滤法结合使用以简便试验过程。
2.1.1 单因素考察
为初步判断各因素对海藻酸钠降解的影响,对降解温度(40~70 ℃)、催化剂用量(0.03~0.06 g催化剂/g海藻酸钠)、降解时间(1~4 h)在固定另外2个因素(时间2 h、温度50 ℃、催化剂用量0.04 g/g海藻酸钠)下分别进行单因素试验并测量降解产物黏度。随各因素数值增加,海藻酸钠降解产物黏度均呈下降趋势(图2),未处理海藻酸钠3%溶液黏度为7 520 mPa·s,降解后黏度最低已降至70~90 mPa·s,从图中斜率分析认为仍存在继续优化的空间。
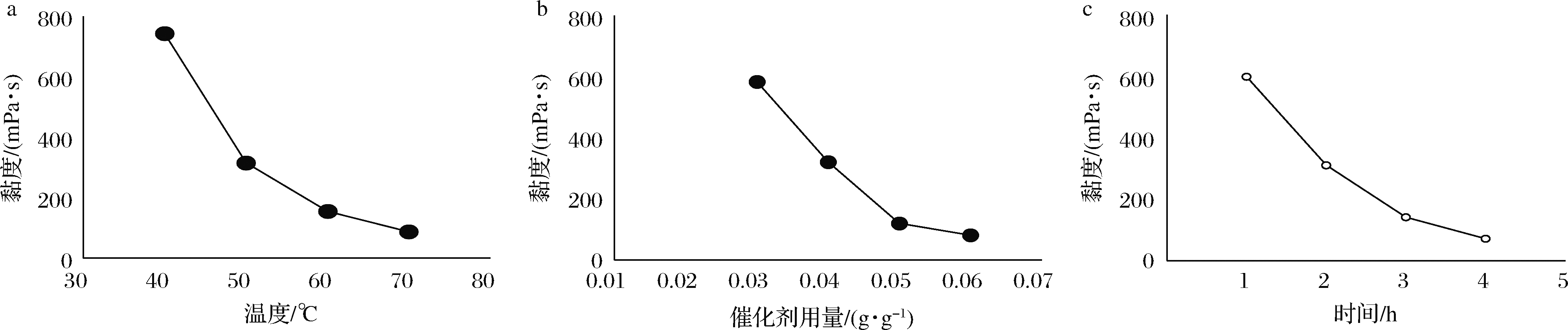
a-温度对黏度的影响;b-催化剂用量对黏度的影响;c-降解时间对黏度的影响
图2 温度、催化剂用量、时间对降解产物黏度的影响
Fig.2 Effects of temperature, catalyst dosage and time on the viscosity of degradation products
2.1.2 降解参数的Box-Behnken 优化
采用Box-Behnken 法进行试验设计并测量降解产物黏度,结果见表1。为避免模型中黏度出现负值,对黏度结果开方变换后进行拟合,黏度(Y)与各因素编码值的拟合方程如公式(1)所示:Sqrt(Y)=2.731 7-0.460 67A-1.775 0B-1.266 9C+0.660 3AB+0.058 54AC+0.684 1BC+0.072 32A2+1.436 6B2+0.418 0C2
表1 Box-Behnken法试验设计及黏度测定结果
Table 1 The Box-Behnken design experimental and response values for the viscosity
编号因素和编码Y(黏度)/(mPa·s)A(时间)/hB(温度)/℃C(催化剂用量)/[g·(10g)-1海藻酸钠]实测值理论值13(-1)70(+1)0.75(0)6.155.1324(0)70(+1)1(+1)3.584.9733(-1)60(0)1.0(+1)6.165.5643(-1)50(-1)0.75(0)54.6050.9355(+1)70(+1)0.75(0)5.827.1064(0)50(-1)0.5(-1)74.8069.0974(0)60(0)0.75(0)7.527.4684(0)60(0)0.75(0)7.837.4695(+1)50(-1)0.75(0)21.9123.96103(-1)60(0)0.5(-1)19.5325.08114(0)60(0)0.75(0)7.137.46125(+1)60(0)1.0(+1)4.592.41134(0)50(-1)1.0(+1)16.2819.45144(0)60(0)0.75(0)7.347.46154(0)60(0)0.75(0)7.417.46165(+1)60(0)0.5(-1)14.8015.76174(0)70(+1)0.5(-1)14.2111.52
(1)
式中:A代表时间,h;B代表温度,℃;C代表催化剂用量,g/g。
方差分析见表2,拟合方程F-value为28.308 8,P-value为0.000 1表明拟合极显著,Lack of Fit值为199.6 95 6,P-value<0.000 1表明拟合误差几乎全部来自试验数据而环境噪声影响可忽略不计。从模型可知,影响黏度下降的因素重要程度依次为降解温度、催化剂用量和降解时间,且降解温度与催化剂用量、降解温度与降解时间存在显著交互作用,降解时间与催化剂用量间交互作用不显著,因素间两两作用的等高线图见图3。公式(1)给出的理论最优值为时间5 h、温度61.53 ℃,催化剂用量1.0 g/10g海藻酸钠,预测黏度为2.31 mPa·s,在该条件下所得海藻酸钠降解产物的3.0%溶液实测黏度为3.54 mPa·s。
表2 方差分析结果
Table 2 The ANOVA for response surface quadratic model obtained from experimental results
来源平方和自由度均方F值P值模型53.217 783 4995.913 087 05428.308 838 280.000 1时间1.697 352 78311.697 352 7838.126 057 5040.024 7温度25.203 046 02125.203 046 02120.659 301 5<0.000 1催化剂用量12.839 314 06112.839 314 0661.468 072 770.000 1AB1.743 611 50611.743 611 5068.347 520 6250.023 3AC0.013 705 68710.013 705 6870.065 615 8240.805 2BC1.871 868 01311.871 868 0138.961 547 220.020 1A20.022 021 40110.022 021 4010.105 427 210.754 9B28.689 748 45418.689 748 45441.602 073 740.000 4C20.735 810 93110.735 810 9313.522 686 6180.102 6残差1.462 144 40170.208 877 772失拟项1.452 446 66430.484 148 888199.695 612 5<0.000 1纯误差0.009 697 73740.002 424 434总值54.679 927 8916R2=0.973 3,R2adj=0.938 9
2.2 分子质量测定与验证
选择不同黏度的海藻酸钠降解产物,使用凝胶色谱-示差-多角度激光光散射分析方法测定分子质量,结果见表3,部分样品的示差检测谱图见图4。降解前数均分子质量为198.6 kDa,通过控制降解条件可获得数均分子质量15.4 kDa~112.4 kDa的降解产物。反映分子质量分布宽度的多分散指数随分子质量降低而升高,表明随降解程度加大,分子质量分散性也随之增加。黏度的开方数值与数均分子质量、重均分子质量、峰值分子质量均有良好相关性,在线性、指数、二次多项式模型中的R2分别为0.965 5~0.986 2、0.939 1~0.945 7、0.988 1~0.998 1,提示在取值范围内可根据黏度对分子质量进行估计。将降解参数-黏度模型与分子质量-黏度模型联立,从数均分子质量理论值出发推算黏度和降解参数,在模型的数均分子量范围(15.4 kDa~60.8 kDa)内对数均分子质量理论值为30 kDa、50 kDa的降解参数进行验证(表4),实测值与理论值仅相差2 kDa,确认了模型的有效性,表明可通过控制降解条件获得特定分子质量的海藻酸钠降解产物。另外根据单因素试验结果,对数均分子质量理论值为80 kDa、100 kDa的降解参数进行验证(表4),数均分子质量理论值和实测值相差约6 kDa,但黏度值的理论值和实测值相差较大,可进一步优化以提高该分子质量范围内的预测精度。
表4 黏度-分子质量-降解参数的验证
Table 4 Verification of viscosity-molecular weight-degradation parameters
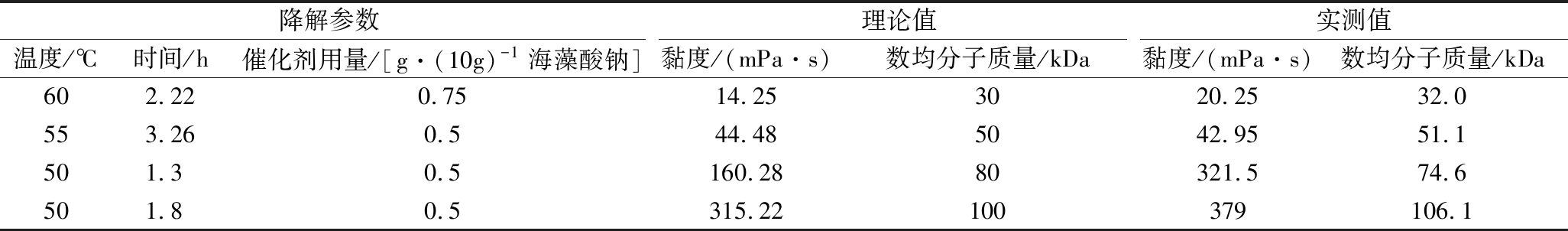
降解参数理论值实测值温度/℃时间/h催化剂用量/[g·(10g)-1海藻酸钠]黏度/(mPa·s)数均分子质量/kDa黏度/(mPa·s)数均分子质量/kDa602.220.7514.253020.2532.0553.260.544.485042.9551.1501.30.5160.2880321.574.6501.80.5315.22100379106.1
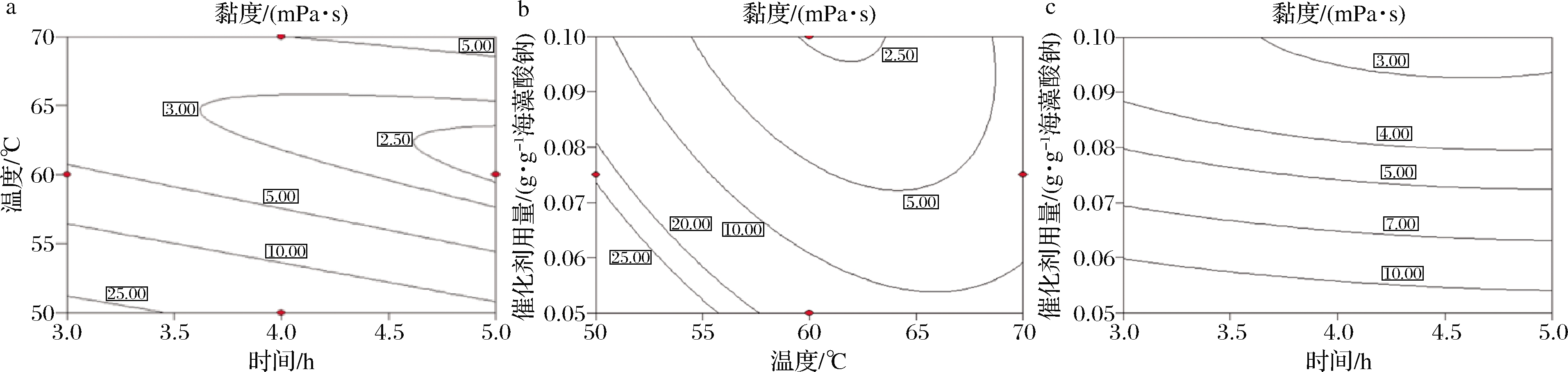
a-时间、温度对黏度的影响;b-温度、催化剂用量对黏度的影响;c-时间、催化剂用量用黏度的影响
图3 降解参数对黏度影响的等高线图
Fig.3 Contour plot showing the effect of variables (temperature, time, catalyst dosage) and their mutual effects on the viscosity of degradation products
表3 不同黏度降解产品的分子质量测定结果
Table 3 Molecular weight determination results of degradation products with different viscosity
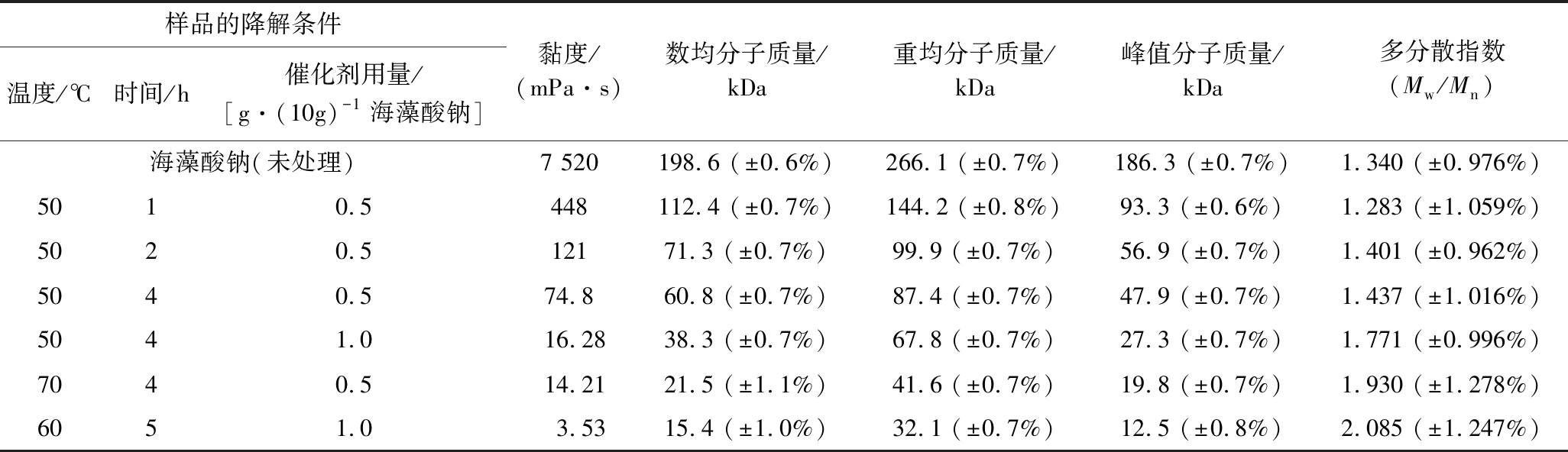
样品的降解条件温度/℃时间/h催化剂用量/[g·(10g)-1海藻酸钠]黏度/(mPa·s)数均分子质量/kDa重均分子质量/kDa峰值分子质量/kDa多分散指数(Mw/Mn)海藻酸钠(未处理)7 520198.6 (±0.6%)266.1 (±0.7%)186.3 (±0.7%)1.340 (±0.976%)5010.5448112.4 (±0.7%)144.2 (±0.8%)93.3 (±0.6%)1.283 (±1.059%)5020.512171.3 (±0.7%)99.9 (±0.7%)56.9 (±0.7%)1.401 (±0.962%)5040.574.860.8 (±0.7%)87.4 (±0.7%)47.9 (±0.7%)1.437 (±1.016%)5041.016.2838.3 (±0.7%)67.8 (±0.7%)27.3 (±0.7%)1.771 (±0.996%)7040.514.2121.5 (±1.1%)41.6 (±0.7%)19.8 (±0.7%)1.930 (±1.278%)6051.03.5315.4 (±1.0%)32.1 (±0.7%)12.5 (±0.8%)2.085 (±1.247%)
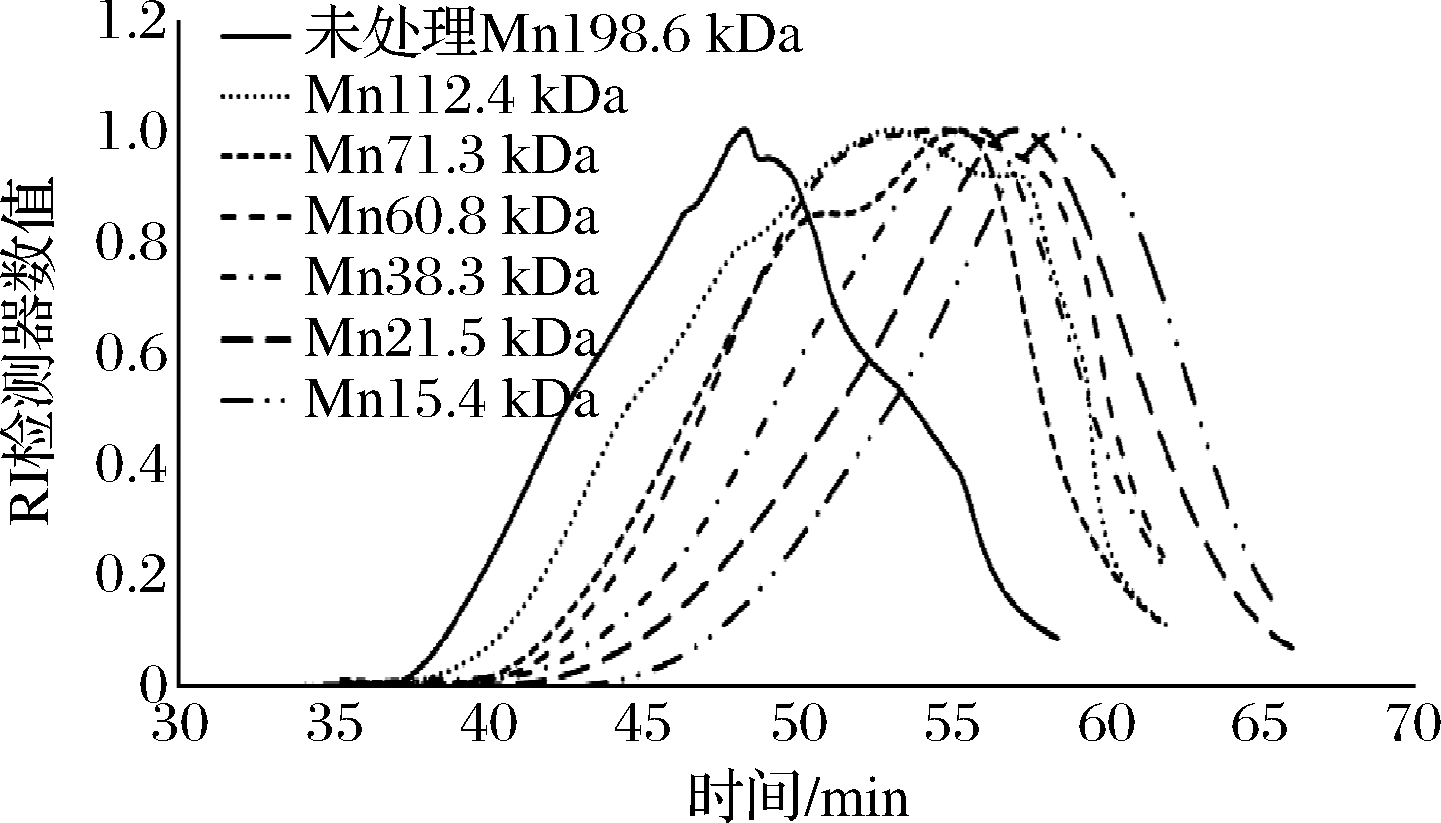
图4 不同分子质量样品的示差图谱
Fig.4 Refractive index of samples with different molecular weights
2.3 理化性质检测
对未处理海藻酸钠和不同降解程度样品进行红外光谱扫描,整体峰形、1 095、1 037 cm-1的C—O伸缩峰、3 440 cm-1的羟基吸收峰、1 619、1 420 cm-1的羧基峰等特征峰位置均无明显改变,表明降解处理对海藻酸钠糖链结构特征无影响(图5)。表面扫描电镜显示,降解处理后海藻酸钠颗粒仍保持原有颗粒形态,但表面形貌改变,粗糙程度加大,出现孔洞等腐蚀样外观,且随降解程度加大而更加明显(图6)。
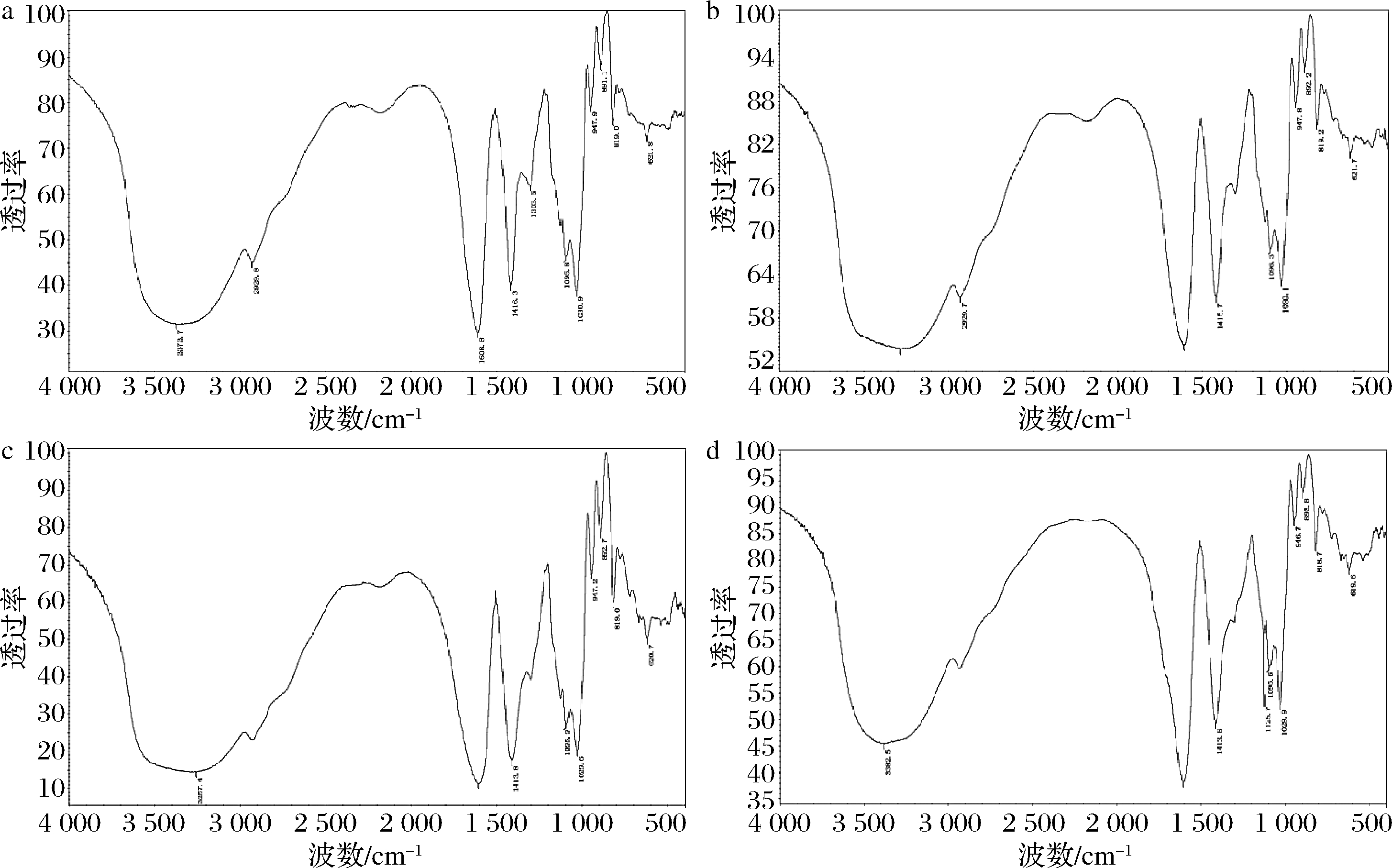
a-未处理海藻酸钠,数均分子质量198.6 kDa;b-数均分子质量71.3 kDa的海藻酸钠降解产物;c-数均分子质量38.3 kDa的 海藻酸钠降解产物;d-数均分子质量15.4 kDa的海藻酸钠降解产物
图5 海藻酸钠及降解产物样品的红外光谱扫描结果
Fig.5 FT-IR spectra of sodium alginate and degradation products

a-未处理海藻酸钠,数均分子质量198.6 kDa;b-数均分子质量 112.4 kDa的海藻酸钠降解产物;c-数均分子质量15.4 kDa的 海藻酸钠降解产物;d-未处理海藻酸钠,数均分子质量198.6 kDa; e-数均分子质量112.4 kDa的海藻酸钠降解产物;f-数均分子质量 15.4 kDa的海藻酸钠降解产物
图6 海藻酸钠及其降解产物的扫描电镜图像
Fig.6 The SEM photograph of sodium alginate and degradation products 注:a~c,标尺50μm;d~f,标尺2 μm
3 讨论和结论
目前海藻酸钠降解的主要研究方向是酶解法,微生物产生的降解酶多样性较高,降解产物在糖链长度、单糖序列、末端组成上各有差异,酶解法降解程度高,可获得从单糖至10糖的寡糖,且环境友好符合产业发展方向,在海藻酸钠功能性寡糖的生产上极具前景[15-20]。研究报道中酶解均在水相中进行,海藻酸钠溶液浓度均不超过1%(质量分数),效率并不理想,且降解后水的去除需要大量能耗和成本,限制了工业化放大应用。因此开发多糖无法溶解的非均相降解方法可提高效率、降低成本、有利于工业化应用。本研究中,固相的多糖微粒在DES液体中分散而不溶解,可避免提高浓度导致黏度迅速增加的问题,在使用小型磁力搅拌器和转子的情况下,体系中多糖与溶剂的比例可达到1∶3~1∶4(g∶mL),多糖浓度可达20%~25%(质量分数),在工业生产中使用搅拌效果更好的设备还可进一步提高多糖浓度,极大提高了生产效率;降解过程中多糖及其降解产物始终为固体粉末状态,降解结束后可通过简便的固液分离操作得到降解产物,能耗可显著降低;该方法在多糖深加工领域有良好应用前景。本研究得到的海藻酸钠降解产物因分子质量降低,其水溶液黏度也明显下降,数均分子质量15.4 kDa降解产物的15%(质量分数)水溶液黏度约为630 mPa·s,可考虑与酶解法联用以提高酶解法效率。
基于海藻酸钠的水凝胶等新材料在药物缓释、再生医学、仿生学等方向被广泛研究[26-27],但不同分子质量对材料性质影响的研究相对较少,可能与目前缺乏不同分子质量的海藻酸钠商品有关。WILLIAMS等[28]研究了不同比例的高、低分子质量海藻酸钠组合制备可注射水凝胶并观察1-磷酸鞘氨醇的缓释及血管再生效果,高分子质量海藻酸钠比例与药物释放速度呈反比且导致更明显的内皮细胞迁移和血管组织发育。使用不同分子质量和甘露糖醛酸/古洛糖醛酸比例的海藻酸钠制作益生菌微胶囊,20 kDa~60 kDa的低分子质量和甘露糖醛酸/古洛糖醛酸为30∶70时可形成更致密的组织结构,渗透性更低,对益生菌细胞有更好的保护效果[29]。对120 kDa中分子质量和180 kDa高分子质量海藻酸钠在不同凝胶中进行比较,认为中分子质量海藻酸钠形成的气凝胶具有更好稳定性[30]。在本研究中,基于降解条件、黏度和分子质量之间的模型联立,可通过控制温度、催化剂用量和时间获得具有特定分子质量的降解产物,这种在较宽分子质量范围(15 kDa~110 kDa)内相对精确控制海藻酸钠分子质量的降解方法此前未见报道。具有更加宽泛分子质量的海藻酸钠可使材料性能更加丰富,有利于深化海藻酸钠在各领域的研究应用。
本研究所得降解产物的Mn最小值为15.4 kDa,理论上由约75~80个单糖单元构成,在降解程度上明显低于酶解法报道。降解程度的差异在于水相中多糖溶解使糖链伸展以充分暴露切割位点,在非均相体系中多糖颗粒未溶解,糖链无法充分伸展以暴露切割位点。电镜图像表明,降解一般发生在颗粒表面并随孔洞的形成继续深入。降解前多糖粉末粒径分布或对降解效果有较大影响,需进一步研究。
[1] WAN J, ZHANG J, CHEN D W, et al.Alginate oligosaccharide alleviates enterotoxigenic Escherichia coli-induced intestinal mucosal disruption in weaned pigs[J].Food & Function, 2018, 9(12):6 401-6 413.
[2] TRAN V C, CHO S Y, KWON J, et al.Alginate oligosaccharide (AOS) improves immuno-metabolic systems by inhibiting STOML2 overexpression in high-fat-diet-induced obese zebrafish[J].Food & Function, 2019, 10(8):4 636-4 648.
[3] KAWADA A, HIURA N, SHIRAIW M, et al.Stimulation of human keratinocyte growth by alginate oligosaccharides, a possible co-factor for epidermal growth factor in cell culture[J].Febs Letters, 1997, 408(1):43-46.
[4] KAWADA A, HIURA N, TAJIMA S, et al.Alginate oligosaccharides stimulate VEGF-mediated growth and migration of human endothelial cells[J].Archives of Dermatological Research, 1999, 291(10):542-547.
[5] ZHOU R, SHI X Y, BI D C, et al.Alginate-derived oligosaccharide inhibits neuroinflammation and promotes microglial phagocytosis of β-amyloid[J].Marine Drugs, 2015, 13(9):5 828-5 846.
[6] GUO J J, MA L L, SHI H T, et al.Alginate oligosaccharide prevents acute doxorubicin cardiotoxicity by suppressing oxidative stress and endoplasmic reticulum-mediated apoptosis[J].Marine Drugs, 2016, 14(12):1-13.
[7] QU Y, WANG Z M, ZHOU H H, et al.Oligosaccharide nanomedicine of alginate sodium improves therapeutic results of posterior lumbar interbody fusion with cages for degenerative lumbar disease in osteoporosis patients by downregulating serum miR-155[J].International Journal of Nanomedicine, 2017, 12:8 459-8 469.
[8] VERA J, CASTRO J, GONZALEZ A, et al.Seaweed polysaccharides and derived oligosaccharides stimulate defense responses and protection against pathogens in plants[J].Marine Drugs, 2011, 9(12):2 514-2 525.
[9] ZHANG C G, HOWLADER P, LIU T M, et al.Alginate oligosaccharide (AOS) induced resistance to Pst DC3000 via salicylic acid-mediated signaling pathway in Arabidopsis thaliana[J].Carbohydrate Polymers, 2019, 225(1):1-12.
[10] SANTOSH K B, HOWLDER P, JIA X C, et al.Alginate oligosaccharide postharvest treatment preserve fruit quality and increase storage life via Abscisic acid signaling in strawberry[J].Food Chemistry, 2019, 283(15):665-674.
[11] WAN J, ZHANG J, CHEN D W, et al.Alginate oligosaccharide-induced intestinal morphology,barrier function and epithelium apoptosis modifications have beneficial effects on the growth performance of weaned pigs[J].Journal of Animal Science and Biotechnology, 2018, 9:1-12.
[12] TAKESHI Y, TORU N, YOSHIKO Y, et al.Growth-promoting effect of alginate oligosaccharides on a unicellular marine microalga, Nannochloropsis oculata[J].Bioscience Biotechnology and Biochemistry, 2009, 73(2):450-453.
[13] NAOTSUGU NAGASAWA A, HIROSHI MITOMO A, FUMIO YOSHII B, et al.Radiation-induced degradation of sodium alginate[J].Polymer Degradation & Stability, 2000, 69(3):279-285.
[14] LEE D W, CHOI W S, BYUN M W, et al.Effect of γ-irradiation on degradation of alginate[J].Jounrnal of Agriculture and Food Chemistry, 2003, 51(16):4 819-4 823.
[15] ZHU B W, YIN H.Alginate lyase:Review of major sources and classification, properties, structure-function analysis and applications[J].Bioengineered Bugs, 2015, 6(3):125-131.
[16] HAN W J, GU J Y, CHENG Y Y, et al.Novel alginate lyase (Aly5) from a polysaccharide-degrading marine bacterium, Flammeovirga sp.strain MY04:Effects of module truncation on biochemical characteristics, alginate degradation patterns, and oligosaccharide-yielding properties[J].Applied and Environmental Microbiology, 2016, 82(1):364-374.
[17] ZHU B W, CHEN M J, YIN H, et al.Enzymatic hydrolysis of alginate to produce oligosaccharides by a new purified endo-type alginate lyase[J].Marine Drugs, 2016, 14(6):108-118.
[18] PENG C E, WANG Q B, LU D R, et al.A novel bifunctional endolytic alginate lyase with variable alginate-degrading modes and versatile monosaccharide-producing properties[J].Frontiers in Microbiology, 2018, 9:1-14.
[19] ZHU B W, NING L M, JIANG Y C, et al.Biochemical characterization and degradation pattern of a novel endo-type bifunctional alginate lyase AlyA from marine bacterium Isoptericola halotolerans[J].Marine Drugs, 2018, 16(8):258:1-13.
[20] ITOH T, NAKAGAWA E, YODA M, et al.Structural and biochemical characterization of a novel alginatelyase from paenibacillus sp.str.FPU-7[J].Scientific Reports, 2019, 9:1-14.
[21] TOMÉ LIN, BAI O V, SILVA W D, et al.Deep eutectic solvents for the production and application of new materials[J].Applied Materials Today, 2018, 10:30-50.
O V, SILVA W D, et al.Deep eutectic solvents for the production and application of new materials[J].Applied Materials Today, 2018, 10:30-50.
[22] RODA A, MATIAS A A, PAIVA A, et al.Polymer science and engineering using deep eutectic solvents[J].Polymers, 2019, 11(5):1-22.
[23] MAGDALENA Z, KATARZYNA W, TADEUSZ S.Deep eutectic solvents for polysaccharides processing:A review[J].Carbohydrate Polymers, 2018, 200:361-380.
[24] DAI Y T, VAN SPRONSEN J, WITKAMP G J, et al.Natural deep eutectic solvents as new potential media for green technology[J].Analytica Chimica Acta, 2013, 766:61-68.
[25] LIU Y, FRIESEN J B, MCALPINE J B, et al.Natural deep eutectic solvents:Properties, applications, and perspectives[J].Journal of Natural Products, 2018, 81(3):679-690.
[26] RASTOGI P, KANDASUBRAMANIAN B.Review of alginate-based hydrogel bioprinting for application in tissue engineering[J].Biofabrication, 2019, 11(4):1-10.
[27] ABASALIZADEH F, MOGHADDAM SV, ALIZADEH E, et al.Alginate-based hydrogels as drug delivery vehicles in cancer treatment and their applications in wound dressing and 3D bioprinting[J].Journal of Biological Engineering,2020, 8:1-11.
[28] WILLIAMS P A, CAMPBELL K T, SILVA E A.Alginate hydrogels of varied molecular weight distribution enable sustained release of sphingosine-1-phosphate and promote angiogenesis[J].Journal of Biomedical Materials Research Part A, 2018, 106(1):138-146.
[29] RAMOS P E, SILVA P, ALARIO M M, et al.Effect of alginate molecular weight and M/G ratio in beads properties foreseeing the protection of probiotics[J].Food Hydrocolloids, 2018, 77:8-16.
[30] ROSAL A, RODR
A, RODR GUEZ-DORADO, CLARA, et al.Design of aerogels, cryogels and xerogels of alginate:Effect of molecular weight, gelation conditions and drying method on particles′ micromeritics[J].Molecules, 2019, 24(6):1-13.
GUEZ-DORADO, CLARA, et al.Design of aerogels, cryogels and xerogels of alginate:Effect of molecular weight, gelation conditions and drying method on particles′ micromeritics[J].Molecules, 2019, 24(6):1-13.