阿胶是采用马科动物驴的皮经煎煮、浓缩而制成的固体胶,也称驴皮胶[1]。阿胶与人参、鹿茸一起被称为“中药三宝”。阿胶现今在临床上主要用于治疗劳嗽咯血、妊娠胎漏、心烦不眠等症。此外,阿胶还具有安胎、增加体内钙摄入量、抗休克、抑制肿瘤、美容养颜等作用[2-10]。在驴皮资源短缺、原材料供应不足的今天,出现了应用马皮、牛皮、猪皮等皮类冒充驴皮熬胶的现象。《中国药典》[1]明确规定,阿胶只能采用驴皮熬制,由驴皮熬制的阿胶才具有补血滋阴润燥的功效。伪品胶类的存在严重影响了我国阿胶市场的阿胶质量,也阻碍我国阿胶产业的健康发展及阿胶复方制剂的推广。因此,对阿胶的真伪鉴别具有重要意义。
目前针对阿胶真伪鉴别的技术众多,包括传统鉴别、理化鉴别、色谱分析及分子生物学鉴别等。传统鉴别法依据外观、颜色、表面刀切纹路、气味等进行鉴别,主观因素影响较大,无法鉴别深加工阿胶产品;理化鉴别法主要针对阿胶中无机元素及硫酸皮肤素等进行检测,受加工工艺以及辅料添加的影响,使阿胶的分子组成、质量分布和光谱性质等存在差异,缺乏有效的阿胶质量控制方法,无法保证结果准确性;色谱分析法主要检测阿胶中胶原蛋白及其水解产物如明胶、多肽、多种氨基酸等,但阿胶的化学成分复杂,无准确标准,甚至有些鉴别特征并不明显,使鉴别存在一定困难。随着分子生物学和物种遗传学的发展,分子生物学技术、分子纳米技术和DNA分子遗传学技术[11-15]已经广泛应用于中药材领域的研究,应用分子生物学方法鉴别阿胶中驴源性成分具有种属特异性强、灵敏性高等特点,是目前人们研究的热点技术。荧光定量PCR是通过荧光染料或荧光标记的特异性探针,对PCR产物进行标记跟踪,实时在线监控反应过程的方法。具有特异性强、灵敏度高、准确性高、检测范围宽和操作简单等特点,目前在临床疾病诊断、食品安全、科学研究等[16-17]方面已有广泛应用。
由于阿胶加工工艺的复杂导致DNA严重降解和断裂,致使其动物源性基因组DNA提取非常困难,因此本研究应用DNA纯化柱法[18]提取阿胶中高质量的DNA。综合考虑阿胶DNA的降解情况、阿胶中驴源性特异性靶基因片段的大小以及检测成本等方面,建立阿胶SYBR Green I荧光定量PCR(polymerase chain reaction)方法鉴定阿胶真伪,通过灵敏性试验确定检测下限,应用重组质粒pGMT-Equ66 bp制备标准曲线,对22批阿胶样品中驴源性成分进行定量分析,为实现阿胶的快速标准化基源鉴定提供实验室依据。
1 材料与方法
1.1 实验样品
阿胶标准品(中国食品药品检定研究院,批号:121274-201703);22批阿胶样品分别由4家公司提供:吉林双药药业股份有限公司(1~10号)、山东东阿百年堂阿胶生物制品股份有限公司(11~14号)、北京同仁堂科技发展股份有限公司制药厂(15~18号)和河北东汝阿胶有限公司(19~22号),并经吉林省吉测检测技术有限公司,应用《中国药典》方法进行质谱检测,确定为正品;阿胶伪品(马皮胶、牛皮胶、羊皮胶和猪皮胶),由吉林双药药业有限公司为本研究单独生产提供。
1.2 实验试剂
2×Taq PCR Master Mix、50 bp DNA Ladder,北京天根生化科技有限公司;2×RealStar Green Power Mixture(SYBR),北京康润诚业生物科技有限公司;P1 275 μL(P2、0.5 mol/L EDTA、20 mg/mL蛋白酶K和10 mg/mL RNA酶);P2 250 μL(1 mol/L Tris-HCl、0.5 mol/L EDTA、NaCl、10%(质量分数) SDS和20 mg/mL 蛋白酶K);P3 800 μL(5 mol/L醋酸钾、1 mol/L Tris-HCl、0.5 mol/L EDTA、无水乙醇和ddH2O),实验室配制;其他试剂均为国产分析纯。
1.3 仪器与设备
HC-150T2高速多功能粉碎机,永康市绿可食品机械有限公司;DS-11超微量紫外可见分光光度计,美国Denovix公司;TCR0024 PikoReal实时定量PCR仪、Thermo Fisher高速离心机,赛默飞世尔科技(中国)有限公司;TC1000-G PCR仪,美国赛洛捷克(Scilogex)公司。
1.4 阿胶标准品及样品DNA提取
取阿胶样品0.20 g,置1.5 mL EP管中,加入P1 275 μL、P2 250 μL,混匀,56 ℃水浴1 h;充分混匀后,70 ℃水浴10 min;加入异丙醇500 μL,轻轻颠倒混匀,500 r/min,5 s;将以上溶液加到DNA纯化柱中,10 000 r/min,3 min,弃废液;加入P3 700 μL,10 000 r/min,1 min,弃废液(重复1次);10 000 r/min,2 min,将DNA纯化柱转移入1.5 mL EP管中,加入ddH2O 50 μL,室温放置10 min,10 000 r/min×2 min(重复1次),即得DNA溶液,于-20 ℃保存。
1.5 DNA浓度及A260/A280检测
用超微量紫外分光光度计测定基因组DNA的浓度及A260/A280,每个样品测量3次,取平均值。
1.6 PCR引物设计
GenBank下载驴种属基因序列(GenBank:X97337.1),应用DNAMAN设计引物,Equus asinus-66 bp:上游5′-GCCCTTATCCTTTCCATCTTA-3′,下游5′-GCTTCGTTGTTTTGACATG-3′,并在NCBI在线进行Primer-BLAST分析引物特异性,由生工生物工程(上海)股份有限公司合成。
1.7 引物特异性试验
应用Equus asinus-66 bp对阿胶标准品、马皮胶、牛皮胶、羊皮胶和猪皮胶进行PCR反应,验证引物特异性。PCR反应体系:2×Taq PCR Master Mix 10 μL,引物F、R(10 ng/μL)各0.5 μL,DNA 0.5 μL,ddH2O 8.5 μL;PCR反应参数:94 ℃预变性5 min;94 ℃ 变性30 s,60 ℃退火30 s,72 ℃延伸30 s(30个循环);72 ℃延伸10 min,4 ℃保存。
1.8 构建标准阳性对照品
目的片段凝胶回收,测量浓度后,pGM-T载体16 ℃连接过夜,命名为pGMT-Equ66 bp;转化大肠杆菌后接种平板,37 ℃过夜培养;经蓝白筛选转入LB液体培养基37 ℃空气浴振荡过夜培养;质粒小提、测定DNA浓度、PCR扩增反应、电泳[7]。挑选质量浓度大于100 ng/μL且与预期目的条带位置一致的样本,送往生工生物(上海)股份有限公司测序。
1.9 荧光定量PCR扩增反应
最适荧光定量PCR反应体系及反应条件见表1。
表1 最适荧光定量PCR反应体系及反应条件
Table 1 Optimum fluorescence quantitative PCR reaction system and reaction conditions

PCR反应体系PCR反应条件成分体积/μL步骤温度/℃RealStar Mixture1095上游引物(F)0.4预变性5 min下游引物(R)0.4变性15 s95DNA模板0.440个循环退火30 s60无菌ddH2O8.8延伸30 s72
1.10 荧光定量PCR灵敏性试验
以1.8中构建的重组质粒pGMT-Equ66 bp作为标准,测量其质量浓度为100 ng/μL,依次进行10倍等级稀释(1×102~1×10-8 ng/μL),荧光定量PCR检测,根据CT值的大小判断荧光定量PCR检测标准质粒pGMT-Equ66 bp的灵敏性,根据灵敏性确定检测下限。
1.11 制备标准曲线
阿胶标准品以1.8中构建的100 ng/μL重组质粒pGMT-Equ66 bp作为标准,计算其样品拷贝数为2.96×1010copies/μL。将pGMT-Equ66 bp标准质粒从2.96×1010copies/μL依次进行10倍等级稀释(2.96×1010 ~2.96×103copies/μL),进行荧光定量PCR,每个浓度设置3个重复对照。以CT值作为纵坐标,以标准品拷贝数对数值为横坐标绘制标准曲线。
1.12 阿胶样品定量检测
采用阿胶荧光定量PCR检测方法,对22批阿胶样品进行检测,并依据标准曲线确定其驴源性成分含量。
2 结果与分析
2.1 阿胶基因组DNA浓度及A260/A280检测结果
应用DNA纯化柱法提取22批阿胶样品基因组DNA,质量浓度为(82.17±0.09)~(172.81±1.81) ng/μL,A260/A280为(1.561±0.07)~(1.821±0.04),其中阿胶样品2号、3号、11号~14号、18号~22号(生产批号:20170701、20170801、20192401、20192402、20192403、20192404、20191701、20191702、20191703和20191704)相较其他阿胶样品浓度较低、A260/A280较小(表2)。
表2 阿胶样品基因组DNA浓度及A260/A280检测结果
Table 2 The results of DNA concentration and A260/A280 detection colla corii asini samples
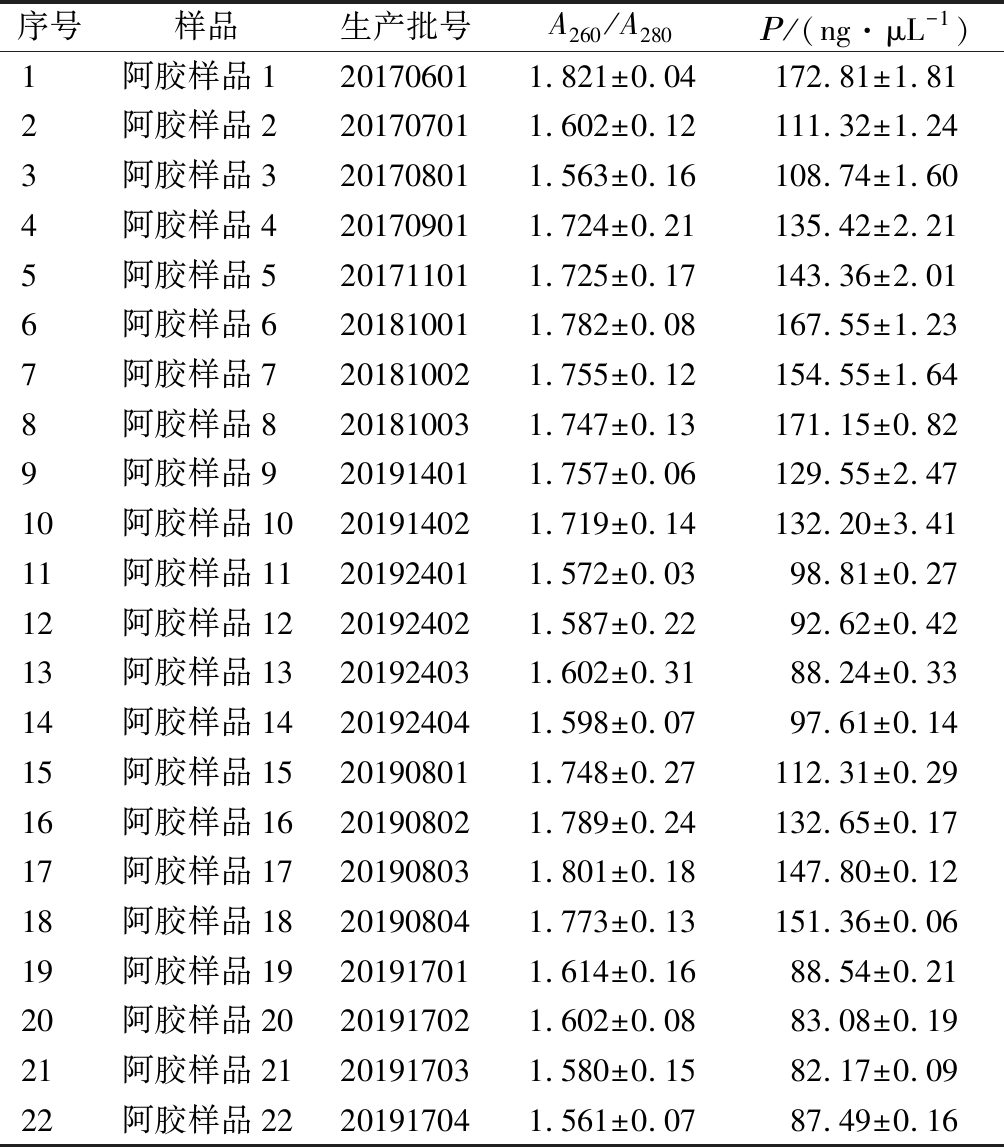
序号样品生产批号A260 /A280Ρ/(ng·μL-1)1阿胶样品1201706011.821±0.04172.81±1.812阿胶样品2201707011.602±0.12111.32±1.243阿胶样品3201708011.563±0.16108.74±1.604阿胶样品4201709011.724±0.21135.42±2.215阿胶样品5201711011.725±0.17143.36±2.016阿胶样品6201810011.782±0.08167.55±1.237阿胶样品7201810021.755±0.12154.55±1.648阿胶样品8201810031.747±0.13171.15±0.829阿胶样品9201914011.757±0.06129.55±2.4710阿胶样品10201914021.719±0.14132.20±3.4111阿胶样品11201924011.572±0.0398.81±0.2712阿胶样品12201924021.587±0.2292.62±0.4213阿胶样品13201924031.602±0.3188.24±0.3314阿胶样品14201924041.598±0.0797.61±0.1415阿胶样品15201908011.748±0.27112.31±0.2916阿胶样品16201908021.789±0.24132.65±0.1717阿胶样品17201908031.801±0.18147.80±0.1218阿胶样品18201908041.773±0.13151.36±0.0619阿胶样品19201917011.614±0.1688.54±0.2120阿胶样品20201917021.602±0.0883.08±0.1921阿胶样品21201917031.580±0.1582.17±0.0922阿胶样品22201917041.561±0.0787.49±0.16
2.2 引物特异性试验结果
应用PCR对阿胶标准品及伪品进行检测,结果表明只有阿胶标准品能扩增出特异性条带,其他伪品均未出现条带(图1)。
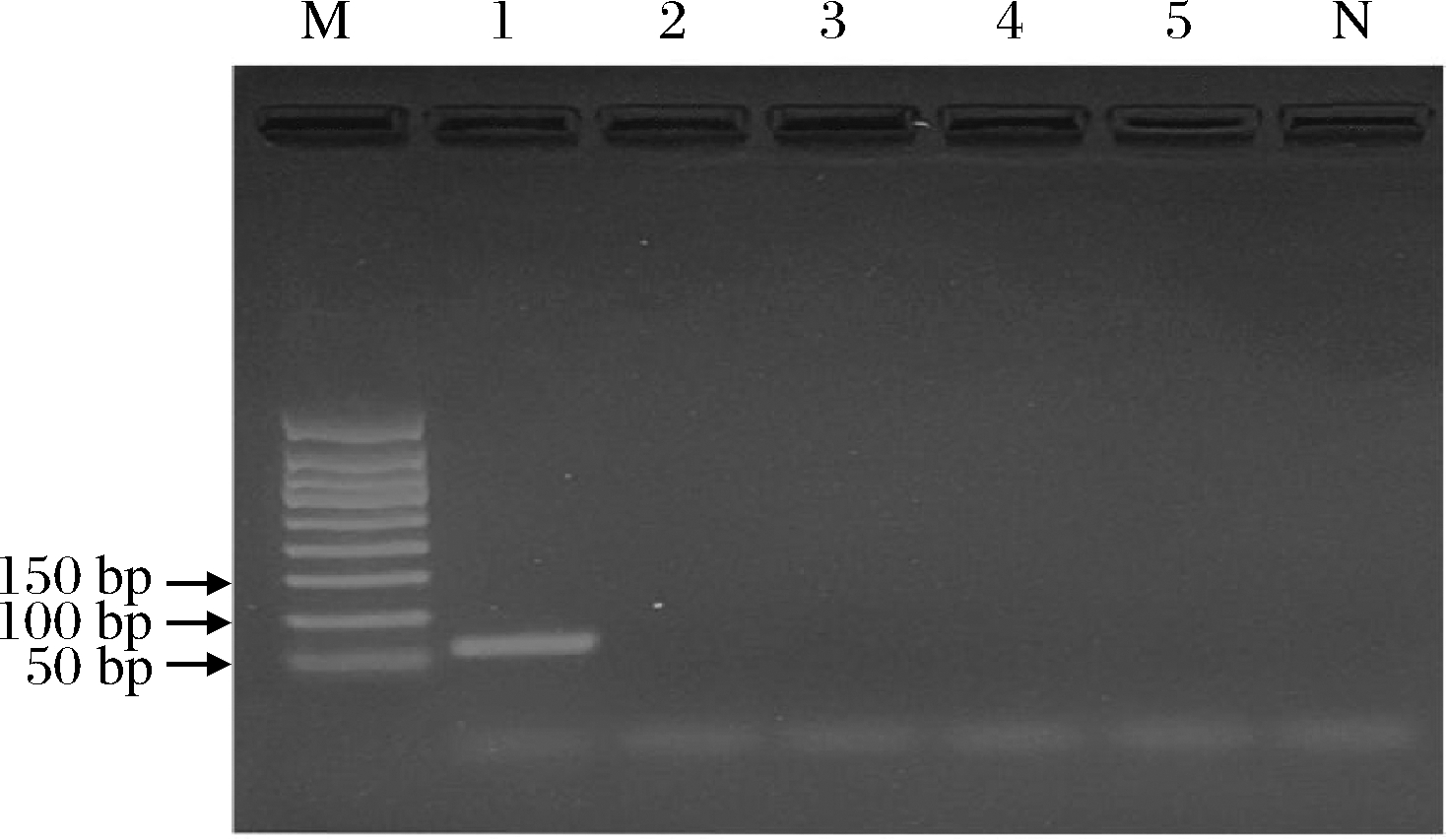
M-50 bp DNA Ladder;1-阿胶标准品;2-马皮胶;3-牛皮胶; 4-羊皮胶;5-猪皮胶;N-空白对照
图1 阿胶普通PCR检测特异性结果
Fig.1 The result of colla corii asini general PCR detection specificity test
2.3 构建标准阳性对照品结果
重组质粒经PCR、电泳后在66 bp处出现特异性条带(图2),与预期目的条带位置一致。测序结果经比对分析后与GenBank中已登记的驴物种相似性为100%(图3),说明克隆重组质粒pGMT-Equ66 bp可作为鉴定阿胶驴源性DNA的标准阳性对照品。
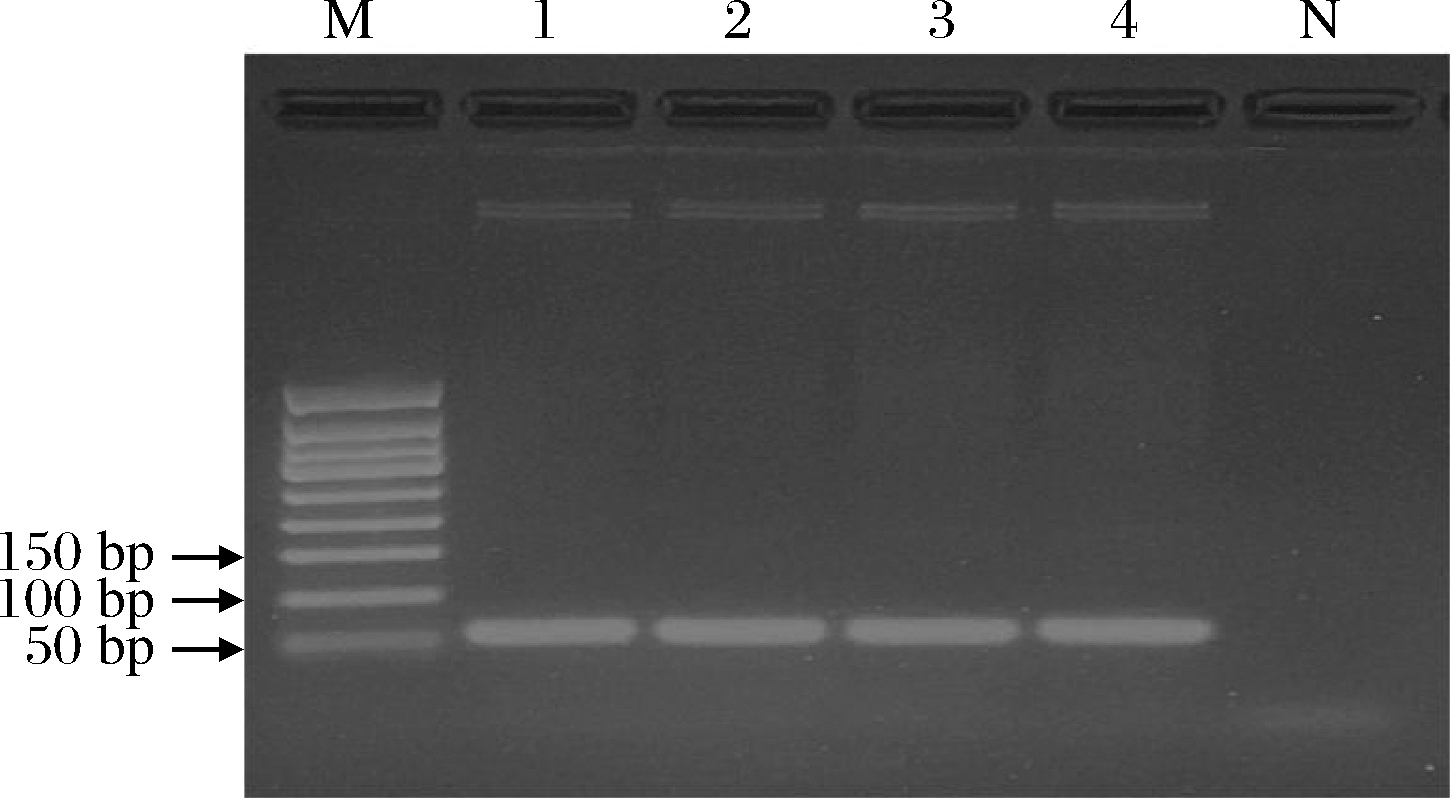
M-50 bp DNA Ladder;1~4-pGMT-Equ66 bp;N-空白对照
图2 重组质粒PCR电泳结果
Fig.2 The results of recombinant plasmid PCR electrophoresis
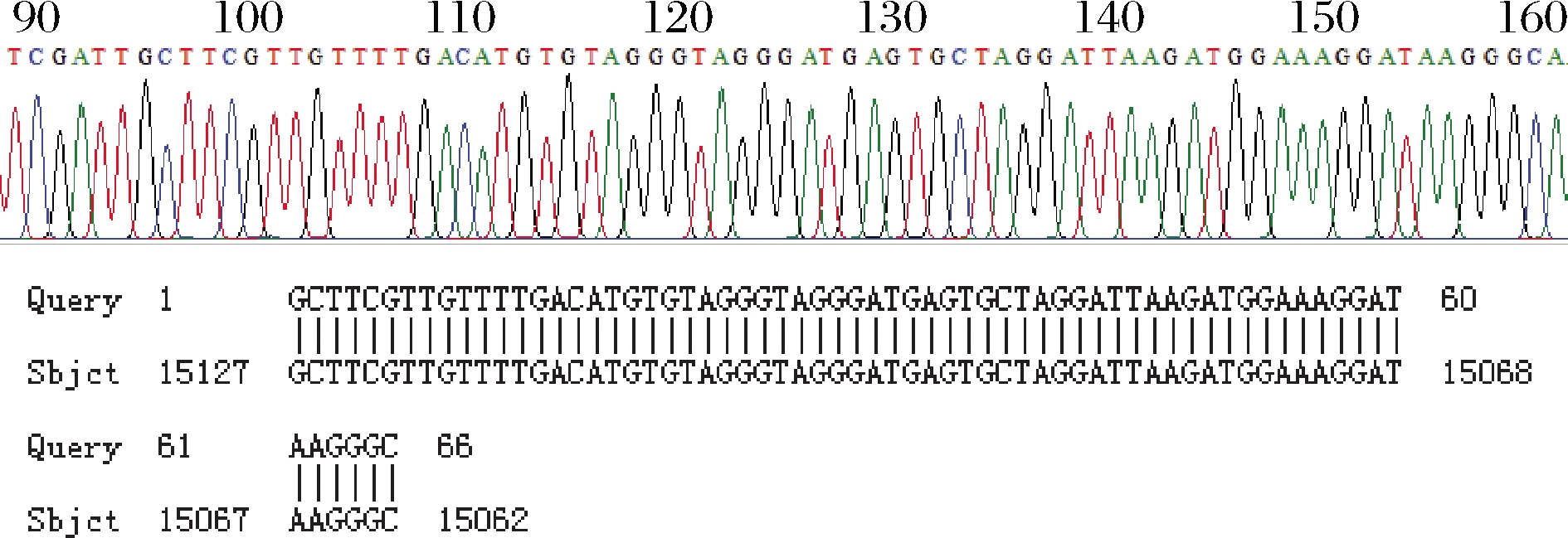
图3 目的基因序列测序结果和比对结果
Fig.3 The results of target gene sequence sequencing and alignment test
2.4 荧光定量PCR特异性试验结果
对阿胶标准品及其伪品进行检测,结果表明只有阿胶标准品成功扩增,伪品均未出现扩增,熔解曲线在76.1 ℃处出现单一峰,特异性好,无引物二聚体(图4、图5)。
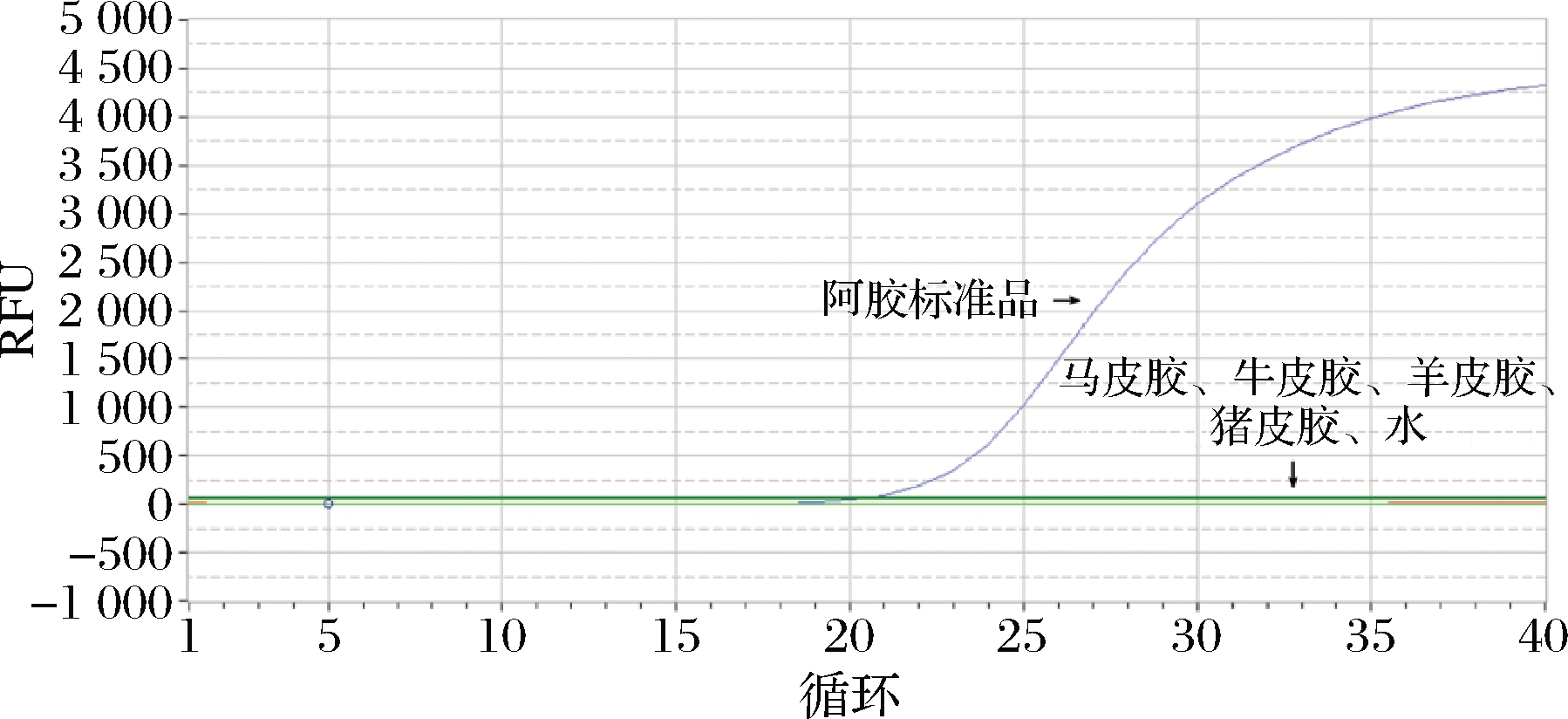
图4 阿胶荧光定量PCR检测特异性结果
Fig.4 The results of colla corii asini fluorescence quantitative PCR detection specificity test
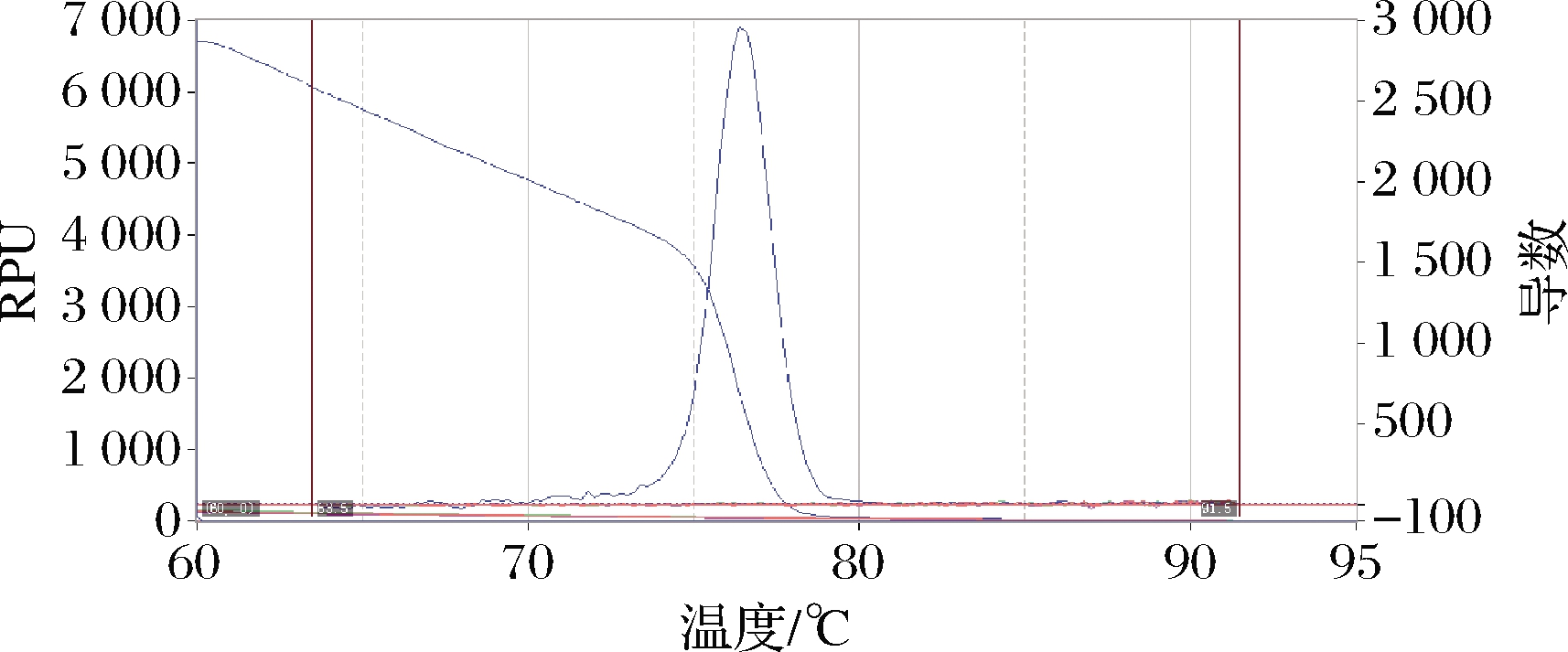
图5 阿胶荧光定量PCR检测特异性熔解曲线结果
Fig.5 The results of colla corii asini fluorescence quantitative PCR detection specificity melting curve test
2.5 荧光定量PCR灵敏性试验结果
灵敏性结果表明,模板质量浓度高于1×10-7ng/μL时扩增曲线有明显基线期、指数增长期和平台期,故认为检测下限为1×10-7 ng/μL,此时CT值为32。由此确定当待检阿胶样品CT值小于32时,认为是阿胶正品(图6)。
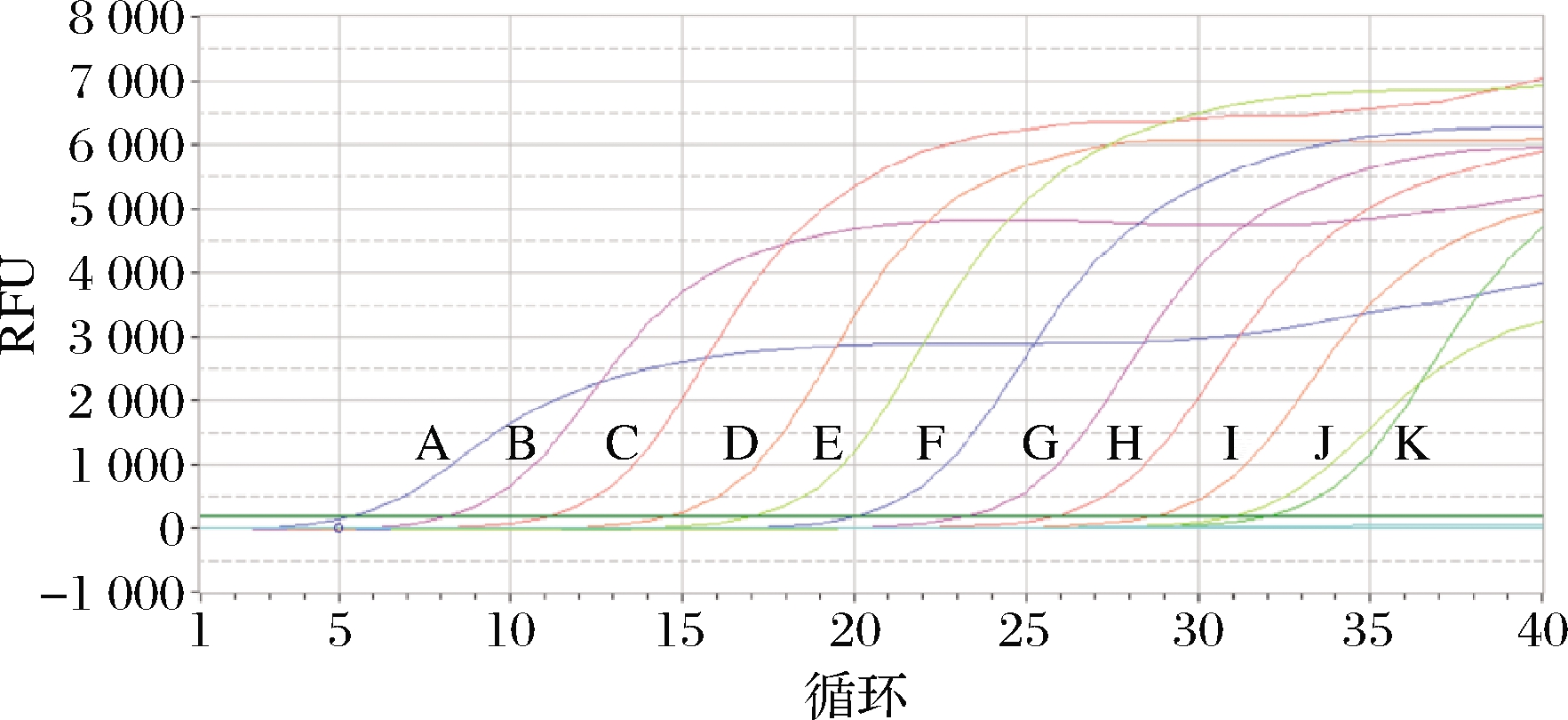
A-100 ng/μL;B-10 ng/μL;C-1 ng/μL;D-1×10-1 ng/μL; E-1×10-2 ng/μL;F-1×10-3 ng/μL;G-1×10-4 ng/μL; H-1×10-5 ng/μL;I-1×10-6 ng/μL;J-1×10-7 ng/μL; K-1×10-8 ng/μL
图6 阿胶荧光定量PCR灵敏性检测结果
Fig.6 The results of colla corii asini fluorescence quantitative PCR detection sensitivity test
2.6 标准曲线制备结果
选取CT值为13~30的5个梯度(2.96×104~2.96×108copies/μL)的重组标准质粒pGMT-Equ66 bp进行荧光定量PCR,结果表明,均呈“S”型扩增(图7)。熔解曲线呈单一峰,特异性好(图8)。以CT值作为纵坐标,以标准品拷贝数对数值作为横坐标建立标准曲线(图9),标准曲线方程为y=-3.13x+37.362,相关系数R2 = 0.990 8,可信度高。
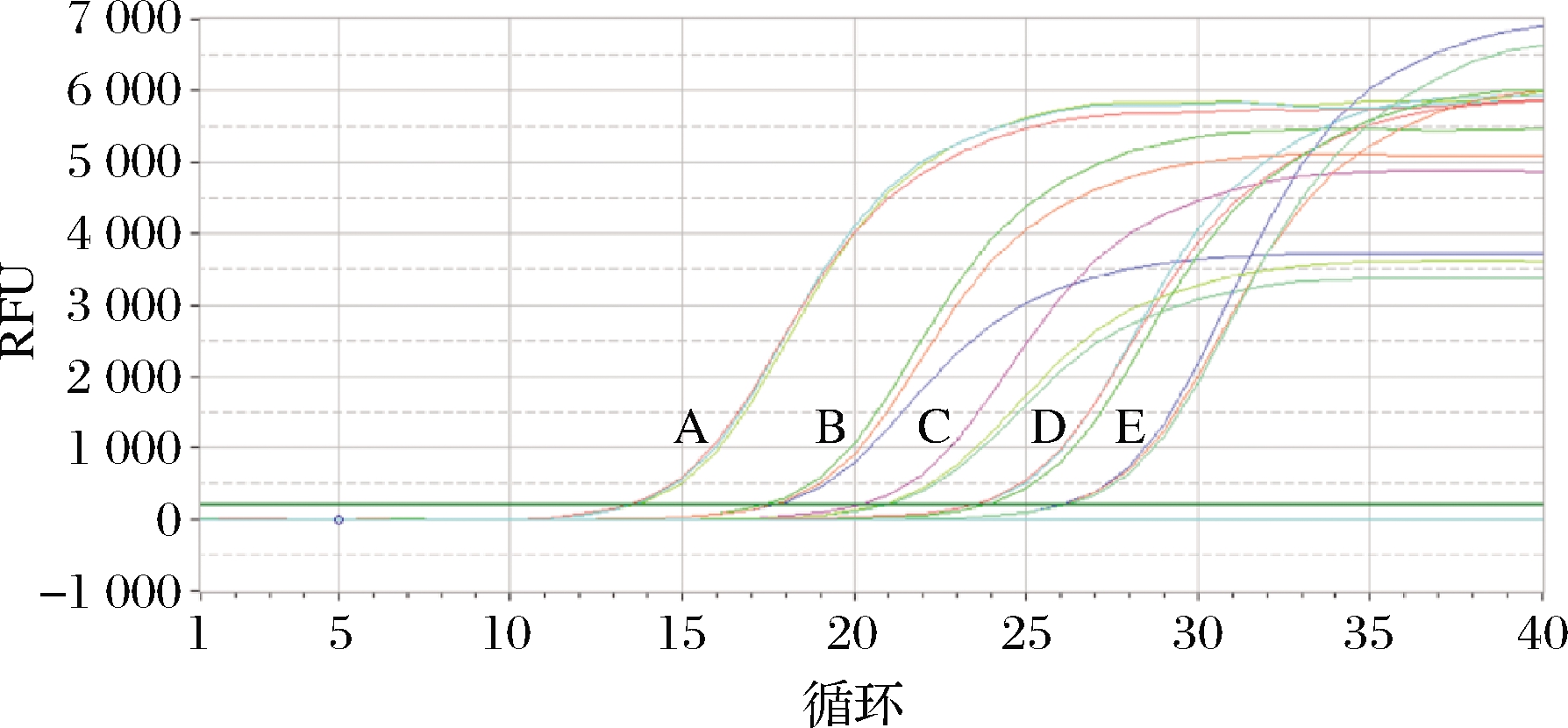
A-2.96×108 copies/μL;B-2.96×107 copies/μL; C-2.96×106 copies/μL;D-2.96×105 copies/μL; E-2.96×104 copies/μL
图7 阿胶不同浓度标准质粒扩增曲线结果
Fig.7 The results of amplification curves of standard plasmids with different concentrations of colla corii asini
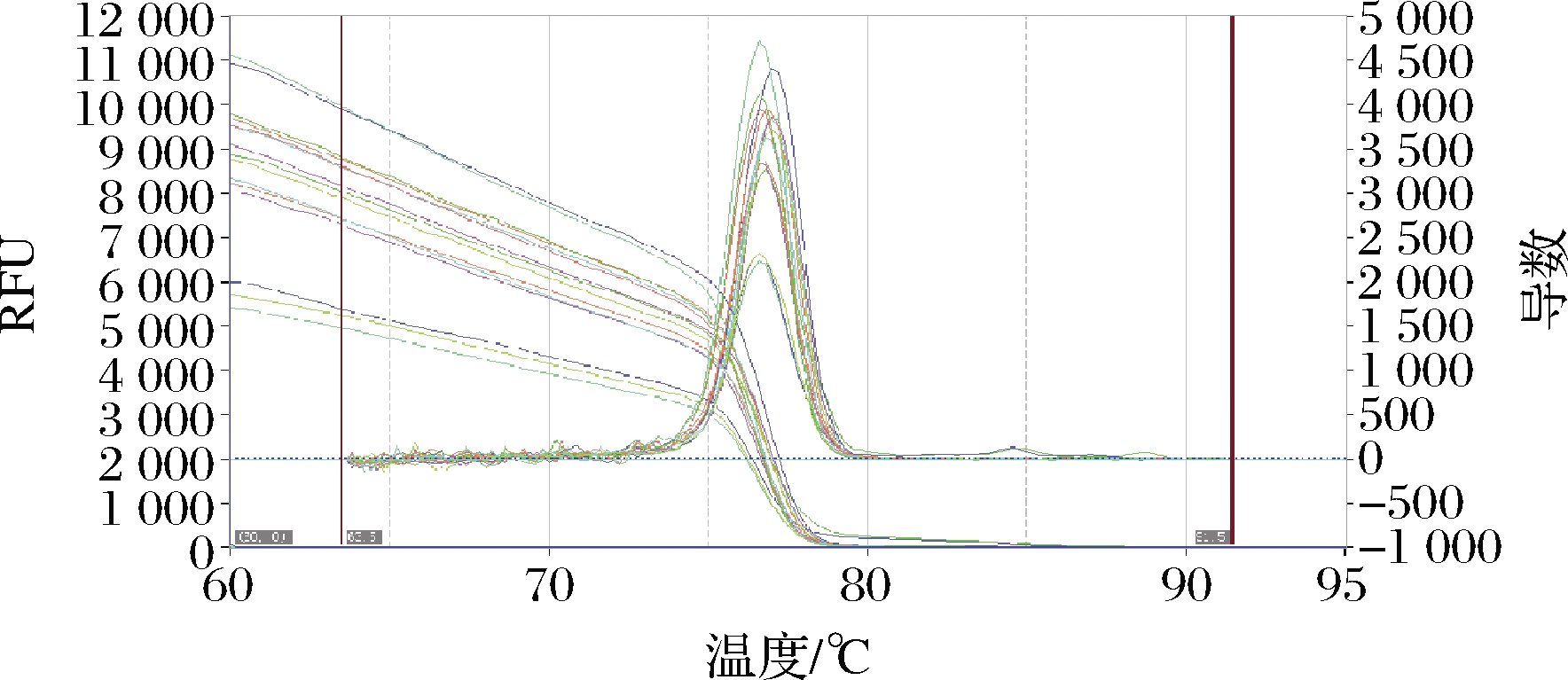
图8 阿胶不同浓度标准质粒熔解曲线结果
Fig.8 The results of melting curve of standard plasmids with different concentrations of colla corii asini
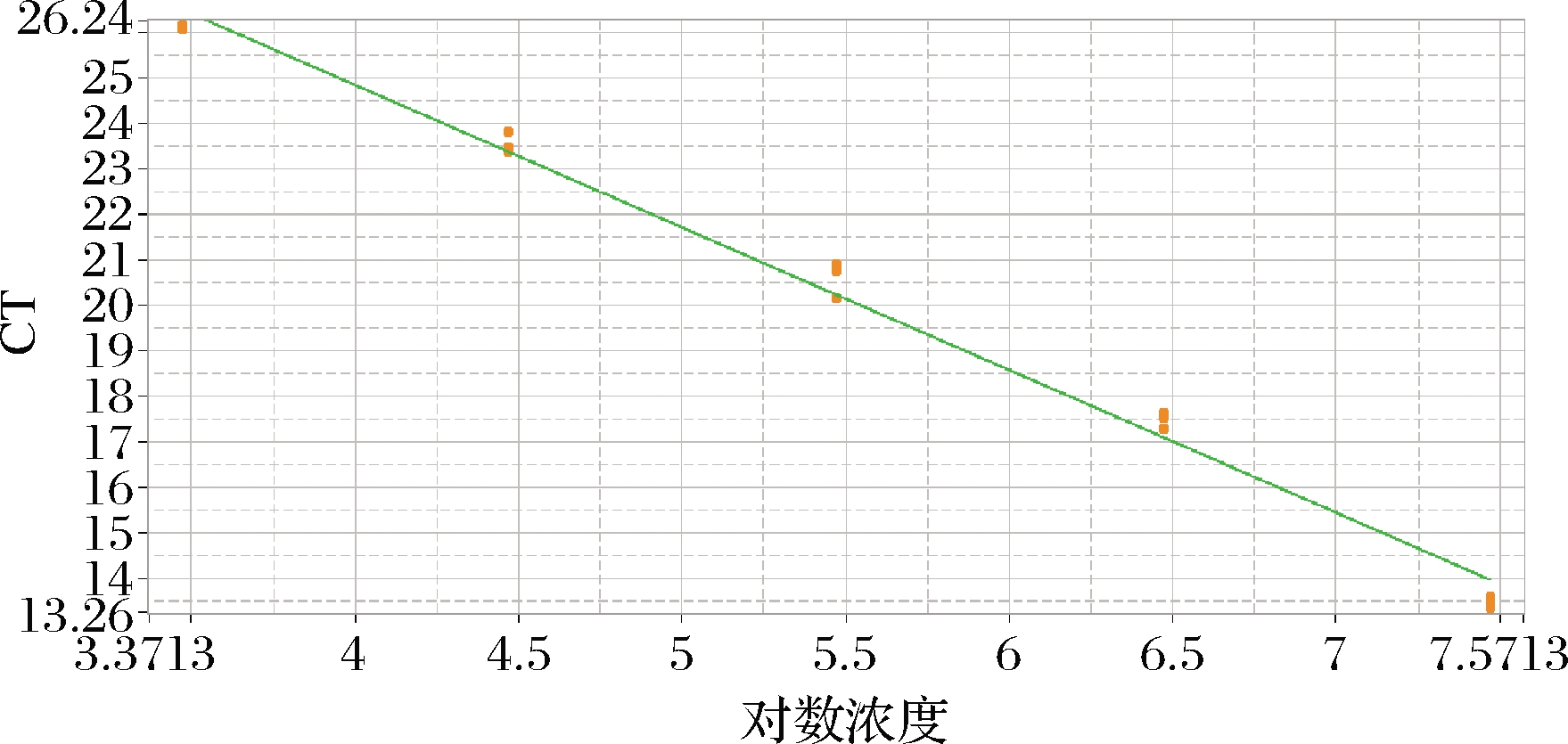
图9 阿胶荧光定量PCR标准曲线
Fig.9 Colla corii asini fluorescence quantitative PCR standard curve
2.7 阿胶样品荧光定量检测结果
将22批阿胶样品进行定量检测,结果表明,22批阿胶样品的CT值为19.83~28.85,均小于32,大于检测下限,为正品,与《中国药典》方法质谱检测结果一致;其中,阿胶1号、4号~10号、15号~18号样品的CT值为19.83~23.16,拷贝数为104.54~105.60 copies/μL;阿胶2号、3号、11号~14号、19号~22号样品的CT值为27.72~28.85,拷贝数为102.72~103.08 copies/μL(表3)。
表3 阿胶样品荧光定量检测结果
Table 3 The results of fluorescence quantitative test results of colla corii asini samples
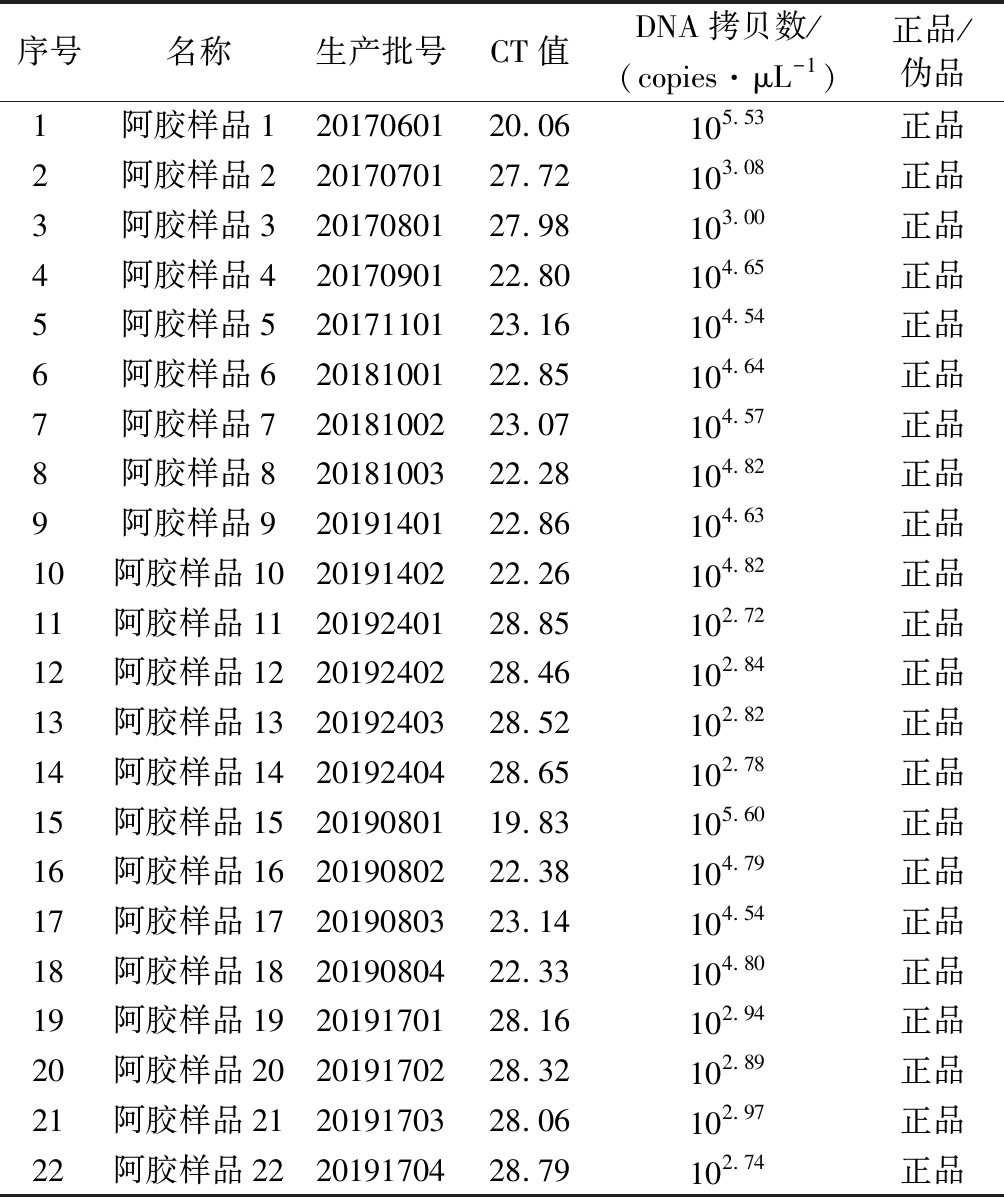
序号名称生产批号CT值DNA拷贝数/(copies·μL-1)正品/伪品1阿胶样品12017060120.06105.53正品2阿胶样品22017070127.72103.08正品3阿胶样品32017080127.98103.00正品4阿胶样品42017090122.80104.65正品5阿胶样品52017110123.16104.54正品6阿胶样品62018100122.85104.64正品7阿胶样品72018100223.07104.57正品8阿胶样品82018100322.28104.82正品9阿胶样品92019140122.86104.63正品10阿胶样品102019140222.26104.82正品11阿胶样品112019240128.85102.72正品12阿胶样品122019240228.46102.84正品13阿胶样品132019240328.52102.82正品14阿胶样品142019240428.65102.78正品15阿胶样品152019080119.83105.60正品16阿胶样品162019080222.38104.79正品17阿胶样品172019080323.14104.54正品18阿胶样品182019080422.33104.80正品19阿胶样品192019170128.16102.94正品20阿胶样品202019170228.32102.89正品21阿胶样品212019170328.06102.97正品22阿胶样品222019170428.79102.74正品
3 讨论
阿胶是滋补养血的中药,水解后产生多种氨基酸,如L-羟脯氨酸、甘氨酸、丙氨酸和L-脯氨酸等,具有安胎、抑瘤、美容养颜等作用。阿胶可用黄酒或开水烊化直接食用,可加入蛤粉或蒲黄文火拌炒制成阿胶珠服用,也可作为重要原材料配伍相关中药材治疗相关疾病。阿胶市场需求量的上升,致使驴皮——阿胶的唯一原材料也供不应求。巨大的经济利润致使一些不法商贩违背良知,应用马皮、牛皮等熬制阿胶。真假阿胶虽然外观相似,但功效显著不同,阿胶伪品不仅没有保健价值,而且可损害消费者身心健康[19]。阿胶伪品的存在严重扰乱了阿胶市场的平衡,严重损害并阻碍了阿胶产业的健康发展。因此,亟待建立一种高效、简便、快速的方法鉴别阿胶真伪。
本研究所采用的阿胶标准品(批号:121274-201703)购自中国食品药品检定研究院;22批阿胶样品,经吉林省吉测检测技术有限公司,采用《中国药典》方法质谱检测,检测结果均为正品;阿胶伪品(马皮胶、牛皮胶、羊皮胶、猪皮胶)由吉林双药药业有限公司为本研究单独生产提供。阿胶因长时间高温熬煮,其DNA高度降解、断裂。因此,从阿胶中提取DNA较为困难。本团队改进了酚/氯仿法提取DNA的方法,建立了阿胶驴源性DNA提取方法——DNA纯化柱法。DNA纯化柱法提取的DNA质量浓度为(82.17±0.09)~(172.81±1.81) ng/μL,A260/A280为(1.561±0.07)~(1.821±0.04),说明DNA纯化柱法提取的DNA能满足后续PCR实验要求。DNA纯化柱法可在90 min内从深加工的阿胶中提取高质量的动物源性基因组DNA,步骤简便、用时短、经济适用且无毒害作用,可满足PCR等鉴定实验的要求,为阿胶分子生物学鉴定提供高质量待检DNA。
在GenBnak中选取驴种属CytB基因序列,应用DNAMAN设计驴源性特异性引物。对阿胶标准品及其伪品应用Equus asinus-66 bp进行特异性试验,最适退火温度为60 ℃时,只有阿胶标准品在66 bp处出现单一、特异性条带,其他伪品均不出现条带。本研究应用分子克隆技术构建重组质粒pGMT-Equ66 bp,经测序比对分析后,与GenBank中已登记的驴(GenBank:X97337.1)物种同源性为100%,与其他物种无匹配,可作为阿胶驴源性DNA标准阳性对照品。构建的质粒易于保存,稳定性好,利于阿胶分子生物学检测技术在基层广泛推广。
荧光定量PCR 是通过荧光染料或荧光标记的特异性探针,对 PCR 产物进行标记跟踪, 实时在线监控反应过程的方法。具有特异性强、灵敏度高、准确性高、检测范围宽和操作简单等特点。综合考虑阿胶 DNA 的降解情况、阿胶中驴源性特异性靶基因片段的大小以及检测成本等方面,选择荧光染料(SYBR Green I)法对阿胶真伪做进一步鉴别。荧光定量PCR特异性检测结果表明,只有阿胶标准品成功扩增,伪品均未出现扩增,且熔解曲线在76.1 ℃呈单一峰,未出现非特异性扩增,说明特异性好。荧光定量PCR灵敏性检测结果表明,模板质量浓度高于1×10-7 ng/μL时扩增曲线有明显基线期、指数增长期和平台期,因此认为检测下限为1×10-7 ng/μL,此时CT值为32。由此确定当待检阿胶样品CT值小于32时,认为是阿胶正品。
应用构建的重组标准质粒pGMT-Equ66 bp,测量其浓度并计算其初始拷贝数为2.96×1010 copies/μL,依次10倍等级稀释进行荧光定量PCR。选取CT值为13~30的5个梯度(2.96×104~2.96×108 copies/μL)的pGMT-Equ66 bp,以CT值为纵坐标,浓度对数为横坐标建立标准曲线,阿胶荧光定量PCR标准曲线为y=-3.13x+37.362,相关系数R2=0.990 8,可信度高。
应用所建立的阿胶SYBR Green I荧光定量PCR方法对22批阿胶样品进行定量分析,22批阿胶样品的CT值为19.83~28.85,均小于32,经荧光定量PCR鉴定为正品,其检测结果与《中国药典》方法质谱检测结果一致,说明荧光定量PCR灵敏性更高、特异性强。与《中国药典》中对阿胶特征分子离子峰及4种氨基酸含量进行检测的方法相比,《中国药典》方法检测时间长、检测的氨基酸无种属特异性;本研究所建立的阿胶SYBR Green I荧光定量PCR检测方法,对阿胶中驴源性DNA进行检测,追踪溯源从阿胶原材料驴皮的基因水平鉴定真伪,检测的种属特异性更强、灵敏度更高,所需时间更短;并且本研究已应用所建立的阿胶SYBR Green I荧光定量PCR检测体系对阿胶标准品做出标准曲线,根据检测数据差异,可获悉所检测样本中是否存在其他动物源性胶类掺假情况。
综上所述,本研究建立的阿胶SYBR Green I荧光定量PCR检测体系可快速检测阿胶样品真伪,与《中国药典》方法检测结果一致,且特异性强、灵敏性高,从分子生物学角度解决了阿胶样品真伪鉴定问题。
[1] 国家药典委员会.中国药典[M].北京:中国医药科技出版社2015:189.
Chnese Plamacopoeia Comrission.Chinese Pharmacopoein[M].Beijing: China Medical:Science-Press,2015:189
[2] 邓一聪. 中药阿胶的临床应用及其药理分析[J].中国处方药, 2018, 16(5):18-19.
DENG Y C.Clinical application and pharmacological analysis of Ejiao[J].Journal of China Prescription Drug, 2018, 16(5):18-19.
[3] 曾庆华, 丁士伦.阿胶补血膏的药效学研究[J].食品与药品, 2007,9(1):34-35.
ZENG Q H, DING S L.Pharmacodynamics study of Ejiao hematinic ointment[J].Food and Drug, 2007,9(1):34-35.
[4] 李敏, 梁大连, 邵珠德, 等.阿胶肽-铁螯合物对缺铁性贫血小鼠的初步药效学研究[J].时珍国医国药, 2019, 30(4):852-854.
LI M, LIANG D L, SHAO Z D, et al.The effect of ferrous-chelating Ejiao hydrolysate on iron-deficiency anemia in mice[J].Lishizhen Medicine and Materia Medica Research, 2019, 30(4):852-854.
[5] LIU M X, TAN H N, ZHANG X K, et al.Hematopoietic effects and mechanisms of Fufang Ejiao Jiang on radiotherapy and chemotherapy-induced myelosuppressed mice[J].Journal of Ethnopharmacol, 2014,152 (3):575-584.
[6] 张路, 朱海芳, 陈慧慧, 等.复方阿胶浆对小鼠抗疲劳能力的影响[J].中国实验方剂学杂志, 2013, 19(19):254-257.
ZHANG L, ZHU H F, CHEN H H, et al.Anti-fatigue effect of Fufang Ejiao Jiang on mice[J].Chinese Journal of Experimental Traditional Medical Formulae, 2013, 19(19):254-257.
[7] 戚金凤, 项国.复方阿胶浆在肿瘤患者化疗中的应用分析[J].中国卫生标准管理, 2019, 10(2):96-97.
QI J F, XIANG G.Application analysis of compound E-gelatin syrup in chemotherapy process for tumor patients[J].China Health Standard Management, 2019, 10(2):96-97.
[8] 刘元涛, 张惠惠, 王升光, 等.阿胶仿生酶解前后提高免疫力作用对比研究[J].时珍国医国药, 2016, 27(9):2 158-2 160.
LIU Y T, ZHANG H H, WANG S G, et al.Comparative study on improving immunity of Ejiao biomimetic enzymatic hydrolysis[J].Lishizhen Medicine and Materia Medica Research, 2016, 27(9):2 158-2 160.
[9] 张飘飘, 凌亚豪, 阎晓丹, 等.阿胶对人工细颗粒物所致大鼠呼吸系统损伤的保护作用[J].癌变·畸变·突变, 2017, 29(5):346-351.
ZHANG P P, LING Y H, YAN X D, et al.Protective effect of donkey-hide gelatin on rat′s respiratory system injury caused by artificial fine particles[J].Carcinogenesis,Teratogenesis & Mutagenesis, 2017, 29(5):346-351.
[10] WANG D L, LIU M X, CAO J C, et al.Effect of Ejiao (Ejiao) on D-galactose induced aging mice[J].Biological & Pharmceutical Bulletin, 2012, 35(12):2 128-2 132.
[11] 张慧, 孙海新, 许娜, 等.阿胶的半巢式-多重PCR鉴别方法研究[J].食品研究与开发, 2016, 37(17):103-106.
ZHANG H, SUN H X, XU N, et al.Study on semi-nested multiplex PCR identification method of gelatin[J].Food Research and Development, 2016, 37(17):103-106.
[12] 陈志宣, 龚国利.常见阿胶伪品的荧光PCR分子检测[J].陕西科技大学学报(自然科学版), 2015, 33(3):135-139.
CHEN Z X, LONG G L.PCR fluorescence detection of common adulterants Ejiao[J].Journal of Shaanxi University of Science & Technology, 2015, 33(3):135-139.
[13] PANDEY R, TEIG-SUSSHOLZ O, SCHUSTER S, et al.Integrated electrochemical chip-on-plant functional sensor for monitoring gene expression under stress[J].Biosens Bioelectron, 2018, 117:493-500.
[14] PARISOT N, PETRETAILLADE E, DUGAT-BONY E, et al.Probe design strategies for oligonucleotide microarrays[J].Methods Mol Biol, 2016, 1 368:67-82.
[15] LYU P, ZHOU X, YOU J, et al.Extraction of trace amount of severely degraded DNA[J].Zeischrift Fur Naturforschung Section C-A Journal of Biosciences, 2009, 64(7-8):581-589.
[16] 戴陈伟, 童琳, 武昌俊, 等.实时荧光定量PCR技术快速检测志贺氏菌[J].食品安全质量检测学报, 2019, 10(23):8 037-8 041.
DAI C W,TONG L,WU C J, et al.Rapid detection of Shigella by real-time fluorescence quantitative PCR[J].Journal of Food Safety & Quality, 2019, 10(23):8 037-8 041.
[17] 海小, 刘国强, 罗建兴, 等.TaqMan实时荧光PCR检测水牛源性成分[J].食品工业, 2019, 40(11):331-337.
HAI X, LIU G Q, LUO J X, et al.Detection of buffalo orgin by Taqman real-time PCR[J].The Food Industry, 2019, 40(11):331-337.
[18] 陈思秀, 张馨方, 刘玟妍, 等.阿胶中动物源性DNA提取方法的改进及驴源性成分鉴定[J].中国药学杂志, 2019, 54(22):1 840-1 845.
CHEN S X, ZHANG X F, LIU W Y, et al.Improvment of extraction method of animaldrived DNA from colla corii asini identification of donkey-derived components[J].Chinese Pharmaceutical Journal, 2019, 54(22):1 840-1 845.
[19] 李时珍. 本草纲目[M].昆明:云南人民出版社, 2011.
LI S Z.Compendium of Materia Medica[M].Kunming:Yunnan People′s Publishing House, 2011.