含有益生菌的发酵乳具有诸多生理特性[1-2],是最常见且具有较高商业价值的益生菌产品。在保质期结束前益生菌的数量和胃肠道生存能力,是决定益生菌产品能否发挥益生作用的前提条件,也是评价其品质的重要准则。近20年来,许多学者对益生菌发酵乳菌株的筛选、配方的优化、发酵工艺的提升、贮藏期间生存能力的评价等方面进行了深入研究[3-7],取得了良好成果。相比之下,发酵乳中益生菌在胃肠道内的存活特性研究较为薄弱,某些益生菌菌株的胃肠道存活能力缺乏科学证据的支持[7-9]。因此,在进行昂贵的体内测试之前,通过模拟人类胃肠道条件的体外实验来证明它们的存活特性是必不可少的。
与传统的静态消化模型(如恒温水浴摇床和磁力搅拌器等)相比,动态模型在模拟消化道的蠕动收缩运动、形态解剖结构和动态消化条件(如pH值的动态变化、消化液的连续分泌、食糜胃排空)等方面具有显著优势[10-11],被广泛用于益生菌的胃肠道存活特性研究[3, 12-14]。例如,VENEMA等[15]利用TNO胃肠道模型(TNO intestinal model 1,TIM-1)研究了Lactobacillus gasseri PA 16/8、Bifidobacterium longum SP 07/3、Bifidobacterium bifidum MF 20/5这3种菌株在胃和小肠内的存活率。
酪蛋白和乳清蛋白是牛乳中2种主要蛋白,它们结构和理化性质不同,比例约为4∶1。与乳清蛋白相比,酪蛋白更容易在胃酸环境下沉淀形成比较致密和坚硬的酪蛋白胶束和凝结物,致使胃排空延迟,蛋白质消化和氨基酸吸收缓慢[9, 16-17]。因此,降低酪蛋白与乳清蛋白的比例被证实可以提高牛乳蛋白在胃内的消化率[16],但是否会影响发酵乳中益生菌胃肠道存活特性,目前未见相关研究公开发表。本研究以不同酪蛋白与乳清蛋白配比制备的益生菌发酵乳及菌粉固体饮料样品为研究对象,旨在阐明酪蛋白和乳清蛋白配比、食物基质影响益生菌胃肠道存活特性的作用机制,为儿童益生菌发酵乳的配方优化和发酵工艺提升提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 益生菌发酵乳、酸奶及菌粉固体饮料
不同酪蛋白/乳清蛋白配比的益生菌发酵乳,菌粉和原味QQ星酸奶均由内蒙古伊利实业集团股份有限公司提供。所有样品中菌株种类和比例相同,初始总乳酸菌(包括保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌)数≥1×1010 CFU/g,乳双歧杆菌数≥1×109 CFU/g。发酵乳的配方组成如表1所示,各配方中宏量营养素含量保持一致,菌种添加量均为0.1%,仅酪蛋白和乳清蛋白比例不同。
表1 不同酪蛋白/乳清蛋白配比的益生菌发酵乳配方
Table 1 Fermented milk formula with different ratios of casein to whey protein
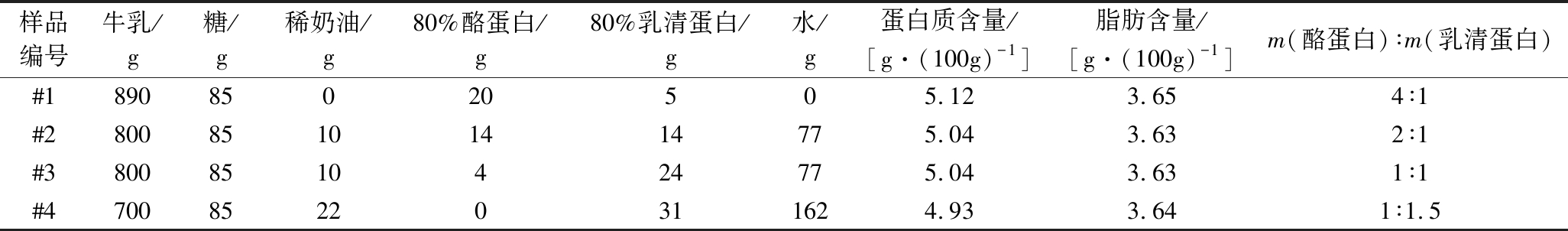
样品编号牛乳/g糖/g稀奶油/g80%酪蛋白/g80%乳清蛋白/g水/g蛋白质含量/[g·(100g)-1]脂肪含量/[g·(100g)-1]m(酪蛋白)∶m(乳清蛋白)#189085020505.123.654∶1#280085101414775.043.632∶1#38008510424775.043.631∶1#470085220311624.933.641∶1.5
市售原味QQ星酸奶(#5)蛋白质含量约2.8 g/100g,m(酪蛋白)∶m(乳清蛋白)=4∶1。菌粉固体饮料(#6)由0.25 g菌粉(与发酵乳样品为同一批次发酵剂)分散于125 mL无菌水中制备而成。
1.1.2 实验试剂与药品
MRS agar培养基、半胱氨酸盐酸盐溶液、莫匹罗星锂盐溶液,青岛海博生物技术有限公司;Oxoid厌氧产气袋,Thermo(中国)公司;P7125胃蛋白酶、P7545胰酶、48305胆汁盐,Sigma-Aldrich(上海)贸易有限公司;75%乙醇、NaCl、NaHCO3、KCl、KH2PO4、MgCl2、(NH4)2CO3、CaCl2、NaOH、HCl,国药集团化学试剂有限公司。
1.1.3 仪器与设备
DHSI-IV动态仿生人胃肠消化系统,晓东宜健(苏州)仪器设备有限公司;SPX-50B生化培养箱,上海坤天实验仪器有限公司;ZY-100F高压蒸汽灭菌锅,浙江新丰医疗器械有限公司;MS1602TS电子分析天平,梅特勒-托利多国际贸易(上海)有限公司;DHG-9070A鼓风干燥箱,上海精宏实验设备有限公司;Milli-Q Advantage A10超纯水机,Millipore(美国)公司。
1.2 实验方法
1.2.1 培养基的制备
取66.2 g MRS agar培养基于1 000 mL超纯水中,加热煮沸至完全溶解,121 ℃高压灭菌20 min,取出后置于恒温水浴锅中48 ℃保温待用。
1.2.2 生理盐水的制备
称取8.5 g NaCl,溶于1 000 mL超纯水中,充分溶解后,配制成质量浓度为8.5 g/L的NaCl溶液。121 ℃高压灭菌20 min,冷却后待用。
1.2.3 模拟消化液的制备
消化液模拟液主要由电解质储备液、酶、CaCl2和去离子水组成,配制方法参考相关文献[18]。
模拟胃液(以100 mL为例):取80 mL胃电解质储备液,分别加入50 μL CaCl2溶液和18.5 mL去离子水,用6 mol/L HCl溶液调节pH值至1.5,按照胃蛋白酶终浓度为800 U/mL的比例加入胃蛋白酶,充分溶解后用0.22 μm的无菌过滤膜过滤除菌。
模拟肠液(以100 mL为例):取80 mL肠电解质储备液,分别加入 200 μL CaCl2溶液和19 mL去离子水,用6 mol/L HCl溶液调节pH值至6.5,按照胰蛋白酶和胆汁盐终浓度分别为200 U/mL、20 mmol/L的比例加入胰酶和胆盐,充分溶解后用0.22 μm的无菌过滤膜过滤除菌。
1.2.4 动态体外胃肠消化
动态人胃肠体外消化设备(the dynamic human stomach-intestine IV,DHSI-IV)主要包括模拟食管、胃、十二指肠、小肠和大肠过滤装置5部分(图1)。DHSI-IV模拟食物胃肠道消化和胃排空的原理及细节已由WANG等[19]详细描述。该设备已被证实可以有效模拟米饭和牛肉在胃消化过程中的pH、粒径分布、胃排空速率的变化[19]。实验前,开启加热开关,将设备及模拟消化液温度预热至37 ℃。按照文献[20-22]报道的儿童(3~14周岁)胃肠道生理条件,设置消化液分泌速率、胃蠕动频率、幽门开口大小、小肠蠕动频率等实验运行参数。具体参数如表2所示。1 min内将120 mL样品从食管进样漏斗注入,随即开启设备进行连续胃肠消化。当消化60和120 min时,分别从图1所示的胃和小肠取样口处取4 mL消化食糜,测其pH、固含量及活菌浓度。
表2 儿童胃肠道模拟的运行参数
Table 2 Operating parameters for simulation of gastrointestinal tract in children

消化环境运行参数胃进样体积120 mL进样时间1 min空腹胃液体积12 mL胃液分泌速率0~10 min:0.4 mL/min;10~20 min:0.5 mL/min;20~30 min:0.6 mL/min;30~40 min:0.8 mL/min;40~50 min:0.7 mL/min;50~60 min:0.6 mL/min;60~120 min:0.3 mL/min0.33 mol/L HCl分泌速率0~25 min:0.5 mL/min胃蠕动频率3 次/min幽门开口大小0~0.5 mm幽门开口频率1 次/2min小肠肠液分泌速率0~120 min:1 mL/min1 mol/L NaHCO3分泌速率0~50 min:0.5 mL/min;50~120 min:0十二指肠蠕动频率12 次/min小肠蠕动频率6 次/min
1.2.5 pH检测
在线pH计实时监测胃内pH的变化。另一台pH计测定分别于胃和小肠消化60 和120 min后的食糜pH值。
1.2.6 消化食糜的表观形态结构分析
取4 mL分批消化60和120 min的胃及小肠消化食糜于培养皿中,用相机拍摄其形态结构。

A-食管模型;B-胃模型;C-十二指肠模型;D-小肠模型; E-大肠过滤模型
图1 第四代动态体外仿生人胃肠消化系统(DHSI-IV)装置图
Fig.1 Installation diagram of the dynamic in vitro human stomach-intestine system, DHSI-IV 注:图中黑色箭头表示食糜流动方向;蓝色箭头表示幽门开口位置
1.2.7 消化食糜固含量的检测
从连续消化实验期间取出的4 mL消化食糜中,均匀取1 mL样品准确称重后放入105 ℃烘箱中干燥24 h,测其固含量[14]。
1.2.8 活菌浓度及存活率的检测
将连续消化0、60、120 min的胃和小肠食糜(4 mL)漩涡混匀后,取100 μL于无菌生理盐水中进行梯度稀释。取10-3、10-4、10-5这3个梯度的稀释样液各100 μL于无菌培养皿中,每个梯度做4~6个平行,其中2~3个平板注入48 ℃保温的MRS培养基,用于总乳酸菌(含嗜热链球菌、保加利亚乳杆菌及嗜酸乳杆菌)的计数;另外2~3个平板注入经半胱氨酸盐酸盐和莫匹罗星锂盐改良过的MRS培养基,用于乳双歧杆菌的计数。37 ℃厌氧培养48 h后,将消化0、60、120 min的样品分别进行平板菌落计数,菌落数分别以N0、N60、N120 CFU/mL表示。具体平板计数方法参考乳酸菌检测国家标准方法。考虑到不同样品的初始(0 min)菌落数可能有差异,将消化过程中的活菌浓度与消化前进行对比,从而得到胃肠消化60和120 min的存活率(N/N0)。60 min时胃和肠存活率分别由公式(1)、公式(2)进行计算;120 min时胃和肠存活率分别由公式(3)、公式(4)进行计算:
(1)
(2)
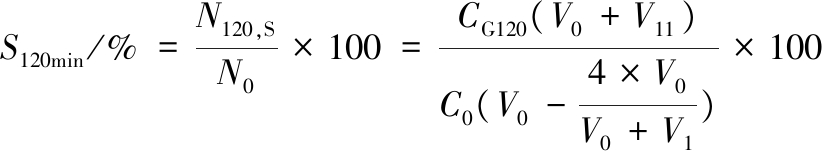
(3)
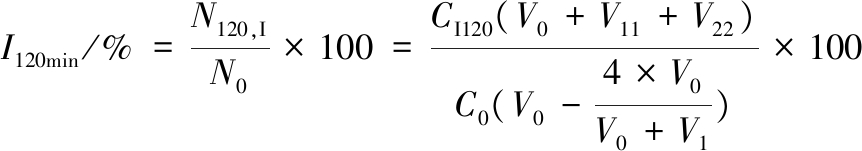
(4)
式中:C0,样品初始平板活菌浓度,CFU/mL;CG60,消化60 min从胃内取出的样品平板活菌浓度,CFU/mL;V0,样品体积(按120 mL计),mL;V1,60 min内进入胃内的模拟胃液体积(含HCl溶液),mL;CI60,消化60 min从肠末端取出的样品平板活菌浓度,CFU/mL;V2,60 min 内进入肠内的模拟肠液体积(含NaHCO3溶液),mL;CG120,消化120 min从胃内取出的样品平板测到的活菌浓度,CFU/mL;V11,120 min内进入胃内的模拟胃液体积(含HCl溶液),mL;CI120,消化120 min从肠末端取出的样品平板活菌浓度,CFU/mL;V22,120 min内进入肠内的模拟肠液体积(含NaHCO3溶液),mL;4为60 min时从胃内取出的样品体积,mL。
1.2.9 数据分析
模拟胃肠道消化实验至少重复2次,各指标均为3组平行,结果表示为平均值![]() 标准差(SD)。采用Excel对数据进行单因素方差分析,显著性水平设定为0.05,绘图采用Origin 9.0完成。不同小写字母表示P<0.05。
标准差(SD)。采用Excel对数据进行单因素方差分析,显著性水平设定为0.05,绘图采用Origin 9.0完成。不同小写字母表示P<0.05。
2 结果与分析
2.1 消化产物的表观结构
发酵乳样品在分批消化60和120 min后,从胃内剩余和肠内收集的食糜,混匀后取样拍摄图片如图2所示。发酵乳样品#1、#3、#4在胃内消化60 min后都出现了较明显的蛋白凝聚现象,随着消化时间延长至120 min,胃内蛋白凝聚程度更高,出现较为明显的块状凝聚物。这是由于在胃酸和胃蛋白酶作用下,发酵乳中酪蛋白胶束发生变性、絮凝造成的[23]。本研究观察到的蛋白凝聚现象与许多文献[17, 24-26]结果报道一致。酪蛋白被报道在胃酸环境下容易形成结构致密的凝聚物,进而延缓酪蛋白水解及氨基酸吸收。相比之下,乳清蛋白虽然在胃酸环境下也会絮凝、结块,但形成的凝聚物结构比较松散,对乳清蛋白水解和氨基酸吸收速率没有显著影响[17]。MULET-CABERO等[27]研究表明,随着酪蛋白与乳清蛋白的质量比从4∶1调整至1∶4,样品在胃消化过程中聚集程度逐渐降低,凝聚物体积逐渐减小,而全是乳清蛋白的样品只是在胃消化初期产生少量凝聚物,随着消化时间延长蛋白凝聚现象消失。在本消化实验中,由于受到胃窦和幽门的强烈挤压作用,致使胃内形成的蛋白聚集物比较分散、体积较小,不同酪蛋白/乳清蛋白比例发酵乳样品的聚集态结构没有明显差异。相同消化条件下,样品 #1在胃内形成的凝聚物相比于 #3和 #4更多、颗粒更小,#2在胃内仅形成少量凝聚物,这可能与该比例下酪蛋白和乳清蛋白之间相互作用较弱有关。样品#5(QQ星原味酸奶)在整个胃消化过程中未产生凝聚,可能是因为原味QQ星样品#5成熟的发酵工艺或者添加的稳定剂导致其结构在消化过程中更稳定。小肠消化阶段,在肠液的稀释和胰酶的酶解作用下,胃内形成的蛋白聚集物逐渐消失。
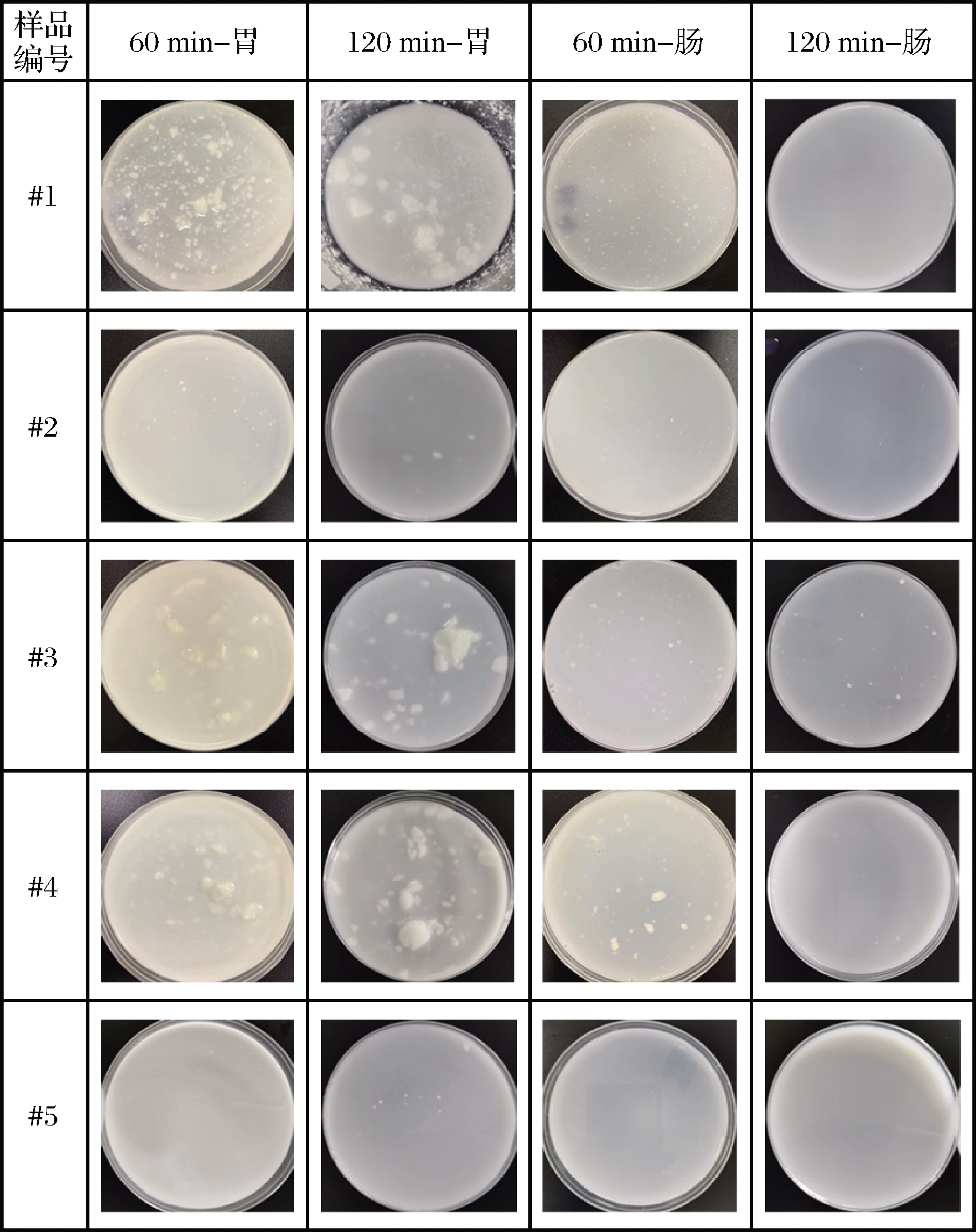
图2 不同发酵乳样品在模拟动态胃肠道消化过程中的 表观形态结构
Fig.2 Apparent morphological structure of different fermented milk samples during simulated dynamic gastrointestinal digestion
2.2 消化食糜固含量的变化
模拟动态胃肠道消化过程中,从胃和小肠末端取出的食糜的固含量变化见表3。从表3可以看出,发酵乳样品(#1~#5)的胃内食糜的固含量逐渐降低,进入肠消化后,食糜固含量进一步降低,这主要是因为模拟胃液和肠液的持续稀释作用。与发酵乳样品不同,菌粉饮料样品#6的固含量随消化时间略微增加,这是因为消化液中的胃蛋白酶、胰酶和胆汁盐增加了菌粉固体饮料的固含量。
2.3 消化过程中pH的变化
动态模拟胃肠道消化过程中,胃和肠食糜pH的变化如表3所示。在加入样品之前,空腹模拟胃液pH为1.6左右,“进食”发酵乳样品后(t=0 min),胃内pH立即升高至4.2~4.5,其中样品 #1和 #5的pH略高于#2、#3、#4,但样品之间无显著差异(P>0.05)。随着模拟胃液和HCl溶液的分泌,胃内食糜的pH逐渐降低。消化60 min时,发酵乳食糜pH降低至2.1~3.5;消化120 min时,pH降低至1.9~3.3。发酵乳样品胃内食糜pH的总体变化趋势与YE等[25]报道的结果一致。相同消化时间下,样品#1和#5的胃pH显著高于#2、#3、#4,且乳清蛋白含量越高的样品,其胃pH普遍更低。该结果说明酪蛋白的缓冲能力高于乳清蛋白,这可能是由于酪蛋白与乳清蛋白空间结构和聚集态结构的差异导致[17, 25]。与发酵乳样品相比,菌粉饮料样品#6在胃消化期间的pH快速下降。消化60 min时,其胃pH已从初始(t=0 min)的5.8降低至1.4左右,显著低于发酵乳样品。这是因为菌粉饮料样品#6分散于水中,其缓冲能力较弱的缘故。
表3 动态模拟胃肠道消化过程中胃和肠食糜固含量及pH的变化
Table 3 Changes in the solid content and pH of the gastric and intestinal digesta during simulated dynamic gastrointestinal digestion
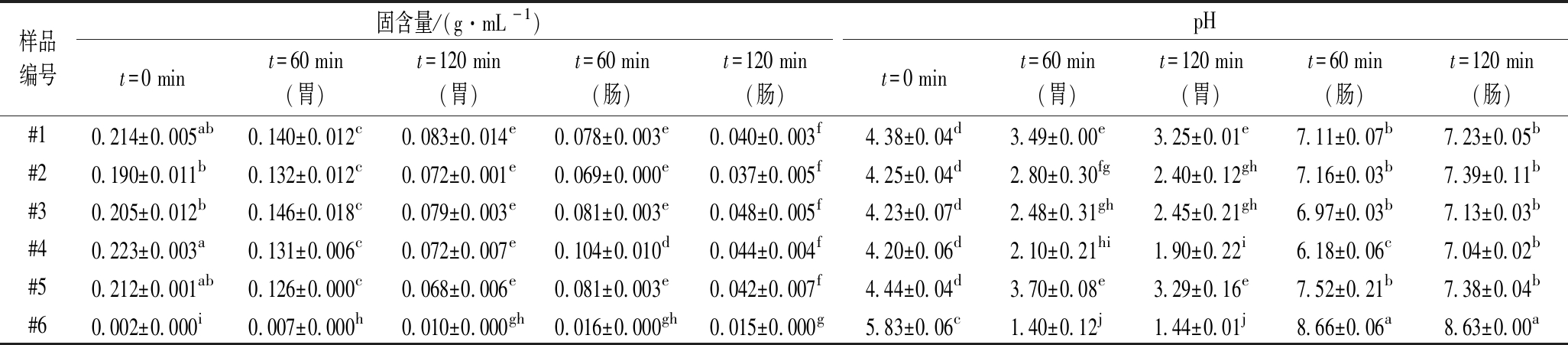
样品编号固含量/(g·mL -1)pHt=0 mint=60 min(胃)t=120 min(胃)t=60 min(肠)t=120 min(肠)t=0 mint=60 min(胃)t=120 min(胃)t=60 min(肠)t=120 min(肠)#10.214±0.005ab0.140±0.012c0.083±0.014e0.078±0.003e0.040±0.003f4.38±0.04d3.49±0.00e3.25±0.01e7.11±0.07b7.23±0.05b#20.190±0.011b0.132±0.012c0.072±0.001e0.069±0.000e0.037±0.005f4.25±0.04d2.80±0.30fg2.40±0.12gh7.16±0.03b7.39±0.11b#30.205±0.012b0.146±0.018c0.079±0.003e0.081±0.003e0.048±0.005f4.23±0.07d2.48±0.31gh2.45±0.21gh6.97±0.03b7.13±0.03b#40.223±0.003a0.131±0.006c0.072±0.007e0.104±0.010d0.044±0.004f4.20±0.06d2.10±0.21hi1.90±0.22i6.18±0.06c7.04±0.02b#50.212±0.001ab0.126±0.000c0.068±0.006e0.081±0.003e0.042±0.007f4.44±0.04d3.70±0.08e3.29±0.16e7.52±0.21b7.38±0.04b#60.002±0.000i0.007±0.000h0.010±0.000gh0.016±0.000gh0.015±0.000g5.83±0.06c1.40±0.12j1.44±0.01j8.66±0.06a8.63±0.00a
注:固含量或pH数据中不同小写字母表示差异显著(P<0.05)(下同)
进入小肠消化阶段后,在模拟肠液和NaHCO3溶液的中和作用下,除样品#4外,其他发酵乳样品在60 min 时的pH已回升至7左右,并保持稳定。样品#4在60 min时的肠pH在6.2左右,这可能是有部分模拟胃液和酸性食糜混入的缘故。
2.4 消化过程中活菌浓度及存活率的变化
总乳酸菌(包含保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌)和乳双歧杆菌在模拟动态消化过程中的活菌浓度分别如图3-a、图3-b所示。由图3-a可知,样品中总乳酸菌初始(t=0 min)活菌浓度略有差异,其中样品#5对数浓度为9.08 lg CFU/mL,显著高于其他样品(8.06~8.43 lg CFU/mL)(P<0.05)。随着消化时间的延长,总乳酸菌活菌浓度逐渐降低,菌粉饮料#6的活菌浓度显著低于发酵乳样品(P<0.05)。消化60 min时,所有发酵乳样品中总乳酸菌在胃内浓度的降低都不超过1个数量级,其中#1、#5的活菌浓度降低最少,菌粉样品#6则降低了约3个数量级。消化120 min 时,样品#1的活菌浓度仅降低0.5个数量级,而 #2和 #5降低约1个数量级,#3和 #4活菌浓度的降低约2个数量级,而菌粉样品 #6降低了约3.5个数量级。考虑到样品之间的初始活菌浓度有差异,为进一步定量比较不同样品中益生菌的存活率,表4给出了总乳酸菌和乳双歧杆菌的存活率数据。从表4可看出,不同样品中总乳酸菌在胃内的存活率与其活菌浓度结果总体一致。发酵乳中样品 #1总乳酸菌在消化60 min时的胃内存活率仍高达97%,其次是 #5(73%),#2、 #3、#4的存活率最低,分别为45%、23%、14%。消化120 min时,样品 #1中总乳酸菌存活率(45%)仍显著高于其他样品(P<0.05),随着酪蛋白与乳清蛋白比例的增加,总乳酸菌存活率逐渐上升。与发酵乳样品相比,菌粉样品 #6中总乳酸菌的胃内存活率非常低(约0.1%)。
从菌的空间分布来看,进入肠消化阶段后,所有样品中总乳酸菌存活率持续降低。如表4所示,消化60 min时,样品 #1和 #5中总乳酸菌的肠内存活率分别为29%和46%,显著高于#2、#3、#4(分别约为6%、3%、3%),而菌粉#6溶液中只有低于0.01%的活总乳酸菌能通过小肠。消化至120 min时,样品 #1和 #5中仍有约10%的活总乳酸菌通过小肠,而 #2、#3、#4中分别剩约4%、3%、0.4%的活菌通过小肠,菌粉样品#6 中总乳酸菌的肠内存活率则不到0.001%。
从图3-b可看出,样品中乳双歧杆菌的初始活菌浓度也略有差异,其中菌粉样品 #6中初始乳双歧杆菌对数浓度最高(8.28 lg CFU/mL),其次是发酵乳样品 #3和 #4(约7.9 lg CFU/mL)。模拟动态胃肠道消化过程中,乳双歧杆菌的活菌浓度和存活率的变化与总乳酸菌近似,随消化时间的延长而降低;但是乳双歧杆菌在胃和肠内的存活率均高于总乳酸菌(表4),这与文献报道的结果一致,说明乳双歧杆菌更能抵抗胃肠道不利环境的刺激[28]。根据表4结果,样品 #1中乳双歧杆菌的胃内存活率显著高于其他样品(P<0.05),其次是 #4,而 #2、#3、#5中乳双歧杆菌存活率差异较小。该结果表明酪蛋白与乳清蛋白的比例对发酵乳中乳双歧杆菌存活能力可能没有显著影响。此外,菌粉样品 #6中乳双歧杆菌存活率显著低于发酵乳,消化120 min时,仅有0.000 6%的活乳双歧杆菌能通过小肠。
表4 总乳酸菌和乳双歧杆菌在模拟动态胃肠道消化 过程中存活率的变化
Table 4 Changes in the viability of total lactobacillus and bifidobacterium lactis during simulated dynamic gastrointestinal digestion
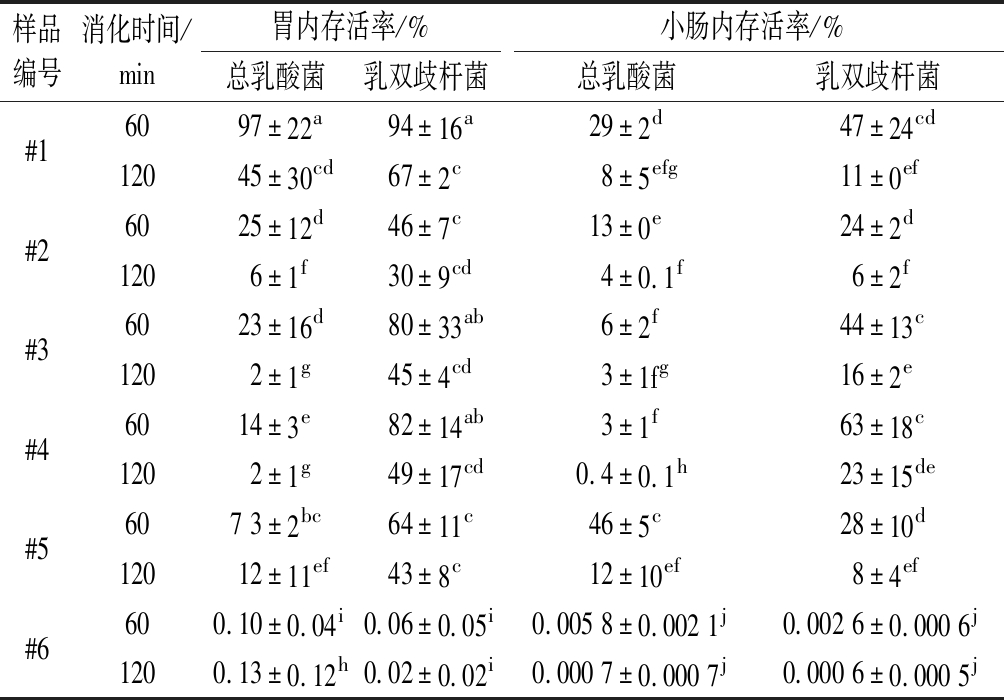
样品编号消化时间/min胃内存活率/%小肠内存活率/%总乳酸菌乳双歧杆菌总乳酸菌乳双歧杆菌#16097±22a94±16a29±2d 47±24cd12045±30cd67±2c8±5efg11±0ef#26025±12d46±7c13±0e24±2d1206±1f30±9cd4± 0.1f6±2f#36023±16d80±33ab6±2f44±13c1202±1g45±4cd3±1fg16±2e#46014±3e82±14ab3±1f63±18c1202±1g49±17cd0.4±0.1h23±15de#5607 3± 2bc64±11c46±5c28±10d12012±11ef43±8c12±10ef8±4ef#6600.10±0.04i0.06±0.05i0.005 8±0.002 1j0.002 6±0.000 6j1200.13±0.12h0.02±0.02i0.000 7±0.000 7j0.000 6±0.000 5j
基于以上对总乳酸菌和乳双歧杆菌胃肠道存活特性的分析,我们可看出,与菌粉饮料相比,发酵乳对总乳酸菌有明显的保护作用,从而显著提高益生菌存活率;发酵乳中酪蛋白与乳清蛋白的比例影响总乳酸菌在胃内的活菌浓度,该比值越大则越有利于总乳酸菌的存活,但是对乳双歧杆菌的存活特性没有显著影响,这可能与菌株种类有关。酪蛋白胶束较强的pH缓冲能力以及胃酸环境下形成的小而坚硬的凝聚物,可能通过对益生菌形成包埋,一定程度防止了胃酸、胆汁盐和消化酶对菌的损伤[6, 9, 16],进而提高益生菌在高酪蛋白含量的发酵乳样品#1中的胃肠道存活率。这与WANG等[29]报道的变性蛋白在热对流干燥情况下形成的较厚壳结构对菌有保护作用类似。
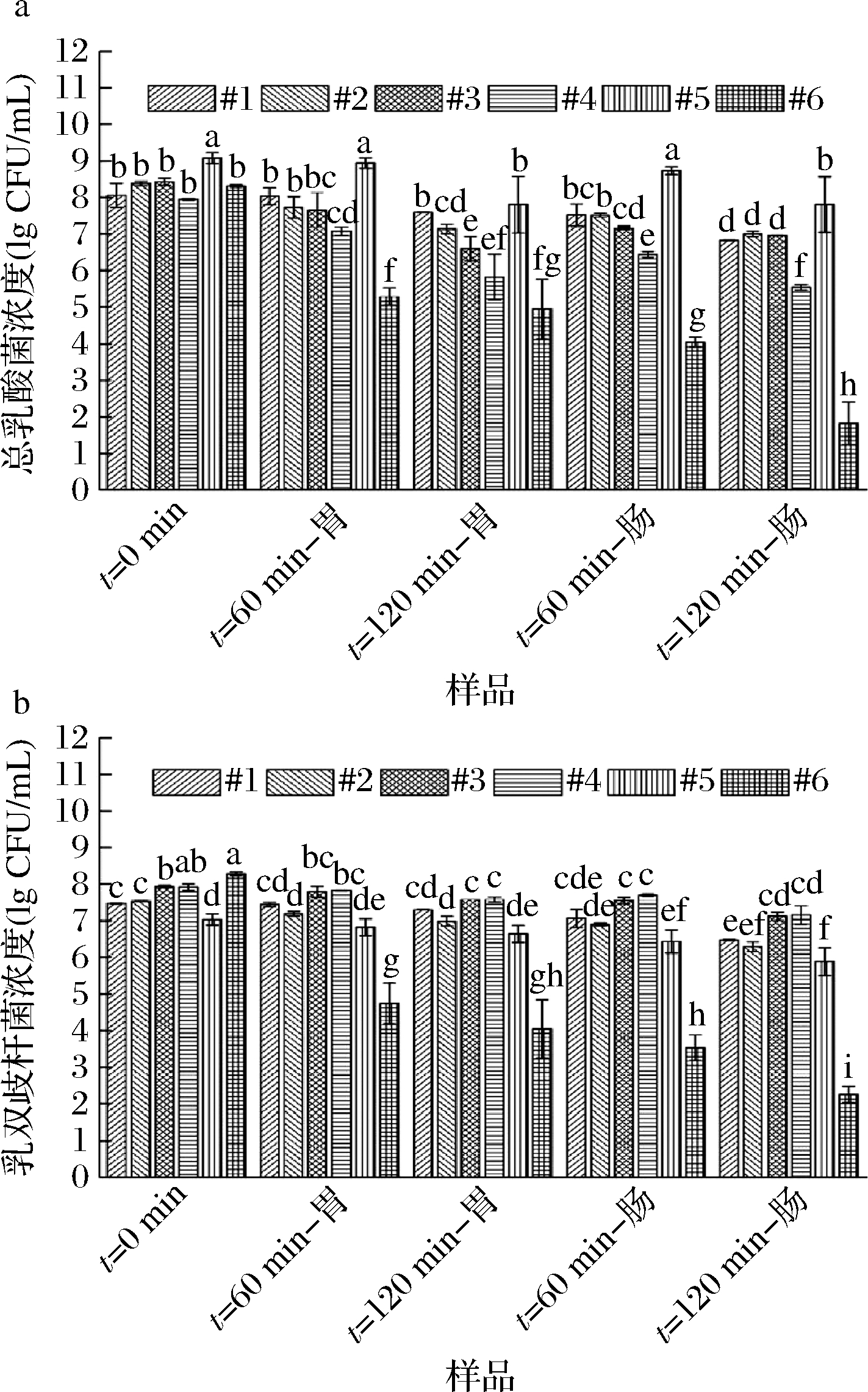
a-总乳酸菌;b-乳双歧杆菌
图3 模拟动态胃肠道消化过程中活菌浓度的变化
Fig.3 Changes in viable concentrations of probiotic during simulated dynamic gastrointestinal digestion 注:不同小写字母表示差异显著(P<0.05)
3 结论
本研究考察了含有不同酪蛋白与乳清蛋白比例的发酵乳样品及菌粉固体饮料,在仿生儿童胃肠道模型内动态消化期间的胃或肠pH值、固形物含量、表观形态结构、菌活浓度及存活率。研究结果显示,所有发酵乳样品中,总乳酸菌和乳双歧杆菌的胃肠道活菌浓度/存活率均显著高于菌粉饮料,证实食物基质的存在对益生菌有保护作用。随着酪蛋白与乳清蛋白比例的增加,发酵乳中总乳酸菌的胃肠道存活率显著提高,而乳双歧杆菌的存活率变化较小。本研究中酪蛋白和乳清蛋白质量比为4∶1的发酵乳具有更强的pH缓冲能力,在胃酸环境下更容易形成结构致密的凝聚物,通过对益生菌进行包埋,一定程度上降低了胃肠道环境对菌的损伤,从而提高其胃肠道存活率。
[1] 李楠, 刘振民.益生菌与功能发酵乳开发研究进展[J].乳业科学与技术, 2020, 43(3):31-38.
LI N, LIU Z M.Probiotics and development of functional yogurt:A review of recent progress[J].Journal of Dairy Science and Technology, 2020, 43(3):31-38.
[2] VIJAYA KUMAR B, VIJAYENDRA S V N, REDDY O V S.Trends in dairy and non-dairy probiotic products-A review[J].Journal of Food Science and Technology, 2015, 52(10):6 112-6 124.
[3] ABD EL-SALAM M H, EL-SHIBINY S.Preparation and properties of milk proteins-based encapsulated probiotics:A review[J].Dairy Science & Technology, 2015, 95(4):393-412.
[4] IRAVANI S, KORBEKANDI H, MIRMOHAMMADI S V.Technology and potential applications of probiotic encapsulation in fermented milk products[J].Journal of Food Science and Technology, 2015, 52(8):4 679-4 696.
[5] TRIPATHI M K, GIRI S K.Probiotic functional foods:Survival of probiotics during processing and storage[J].Journal of Functional Foods, 2014, 9:225-241.
[6] YAO M, WU J, LI B, et al.Microencapsulation of Lactobacillus salivarious Li01 for enhanced storage viability and targeted delivery to gut microbiota[J].Food Hydrocolloids, 2017, 72:228-236.
[7] YAO M, XIE J, DU H, et al.Progress in microencapsulation of probiotics:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2):857-874.
[8] MILLETTE M, NGUYEN A, AMINE K M, et al.Gastrointestinal survival of bacteria in commercial probiotic products[J].International Journal of Probiotics and Prebiotics, 2013, 8:149-156.
[9] BURGAIN J, GAIANI C, CAILLIEZ-GRIMAL C, et al.Encapsulation of Lactobacillus rhamnosus GG in microparticles:Influence of casein to whey protein ratio on bacterial survival during digestion[J].Innovative Food Science & Emerging Technologies, 2013, 19:233-242.
[10] WU P, CHEN X D.On designing biomimic in vitro human and animal digestion track models:Ideas, current and future devices[J].Current Opinion in Food Science, 2020, 35:10-19.
[11] 伍鹏, 王晶晶, 董志忠, 等.体外仿生消化系统的研究进展——从静态到动态[J].生物产业技术, 2019, 6:26-41.
WU P, WANG J J, DONG Z Z, et al.Advance in biomimetic in vitro digestion systems-from static to dynamic[J].Biotechnology & Business, 2019, 6:26-41.
[12] AFZAAL M, KHAN A U, SAEED F, et al.Survival and stability of free and encapsulated probiotic bacteria under simulated gastrointestinal conditions and in ice cream[J].Food Science & Nutrition, 2020, 8(3):1 649-1 656.
[13] MARCIAL-COBA M S, CIEPLAK T, ![]() T B, et al.Viability of microencapsulated Akkermansia muciniphila and Lactobacillus plantarum during freeze-drying, storage and in vitro simulated upper gastrointestinal tract passage[J].Food & Function, 2018, 9(11):5 868-5 879.
T B, et al.Viability of microencapsulated Akkermansia muciniphila and Lactobacillus plantarum during freeze-drying, storage and in vitro simulated upper gastrointestinal tract passage[J].Food & Function, 2018, 9(11):5 868-5 879.
[14] KEMSAWASD V, CHAIKHAM P, RATTANASENA P.Survival of immobilized probiotics in chocolate during storage and with an in vitro gastrointestinal model[J].Food Bioscience, 2016, 16:37-43.
[15] VENEMA K, VERHOEVEN J, VERBRUGGEN S, et al.Probiotic survival during a multi-layered tablet development as tested in a dynamic, computer-controlled in vitro model of the stomach and small intestine (TIM-1)[J].Letters in Applied Microbiology, 2019, 69(5):325-332.
[16] MULET-CABERO A-I, TORCELLO-G MEZ A, SAHA S, et al.Impact of caseins and whey proteins ratio and lipid content on in vitro digestion and ex vivo absorption[J].Food Chemistry, 2020, 319:126 514.
MEZ A, SAHA S, et al.Impact of caseins and whey proteins ratio and lipid content on in vitro digestion and ex vivo absorption[J].Food Chemistry, 2020, 319:126 514.
[17] YE A, CUI J, DALGLEISH D, et al.Formation of a structured clot during the gastric digestion of milk:Impact on the rate of protein hydrolysis[J].Food Hydrocolloids, 2016, 52:478-486.
[18] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food & Function, 2014, 5(6):1 113-1 124.
[19] WANG J, WU P, LIU M, et al.An advanced near real dynamic in vitro human stomach system to study gastric digestion and emptying of beef stew and cooked rice[J].Food & Function, 2019, 10(5):2 914-2 925.
[20] HAVENAAR R, ANNEVELD B, HANFF L M, et al.In vitro gastrointestinal model (TIM) with predictive power, even for infants and children?[J].International Journal of Pharmaceutics, 2013, 457(1):327-332.
[21] BOURLIEU C, MÉNARD O, BOUZERZOUR K, et al.Specificity of infant digestive conditions:Some clues for developing relevant in vitro models[J].Critical Reviews in Food Science and Nutrition, 2014, 54(11):1 427-1 457.
[22] HODGKINSON A J, WALLACE O A M, BOGGS I, et al.Gastric digestion of cow and goat milk:Impact of infant and young child in vitro digestion conditions[J].Food Chemistry, 2018, 245:275-281.
[23] LEITER A, RAU S, WINGER S, et al.Influence of heating temperature, pressure and pH on recrystallization inhibition activity of antifreeze protein type Ⅲ[J].Journal of Food Engineering, 2016, 187:53-61.
[24] VASBINDER A J, DE KRUIF C G.Casein-whey protein interactions in heated milk:The influence of pH[J].International Dairy Journal, 2003, 13(8):669-677.
[25] YE A, CUI J, DALGLEISH D, et al.The formation and breakdown of structured clots from whole milk during gastric digestion[J].Food & Function, 2016, 7(10):4 259-4 266.
[26] YE A, LIU W, CUI J, et al.Coagulation behaviour of milk under gastric digestion:Effect of pasteurization and ultra-high temperature treatment[J].Food Chemistry, 2019, 286:216-225.
[27] MULET-CABERO A I, TORCELLO-G MEZ A, SAHA S, et al.Impact of caseins and whey proteins ratio and lipid content on in vitro digestion and ex vivo absorption[J].Food Chemistry, 2020, 319:126 514.
MEZ A, SAHA S, et al.Impact of caseins and whey proteins ratio and lipid content on in vitro digestion and ex vivo absorption[J].Food Chemistry, 2020, 319:126 514.
[28] ZIARNO M, ZAR![]() ,BA D.Effects of milk components and food additives on survival of three bifidobacteria strains in fermented milk under simulated gastrointestinal tract conditions[J].Microbial Ecology in Health and Disease, 2015, 27:27 812.
,BA D.Effects of milk components and food additives on survival of three bifidobacteria strains in fermented milk under simulated gastrointestinal tract conditions[J].Microbial Ecology in Health and Disease, 2015, 27:27 812.
[29] WANG J, HUANG S, FU N, et al.Thermal aggregation of calcium-fortified skim milk enhances probiotic protection during convective droplet drying[J].Journal of Agricultural and Food Chemistry, 2016, 64(30):6 003-6 010.