阿魏酸(ferulic acid,FA)广泛存在于植物细胞壁,与多糖、木质素间以醚键或酯键形成网状结构[1],以增强细胞机械强度与完整性,同时降低生物分解率[2]。FA是公认安全的抗氧化剂,在欧洲国家已被列入食品添加剂。此外,研究表明,FA具有紫外吸收、抗菌消炎、防癌降脂等生物活性,在医药、化妆、造纸等领域有广泛应用前景[3]。目前,生产阿魏酸方法有植物提取法、化学合成法和生物酶法。植物提取法通过酸碱水解的方式破坏植物内其他高价值化学成分,同时副产物增多,产物分离困难,因此能耗大,污染环境。化学合成法通过有机反应合成FA,但反应时间长,环境污染严重。相比而言,生物酶法则具有反应条件温和,专一性高,产物得率高,对环境友好等优点[4],这些优点使生物酶法成为生产FA的研究热点。
阿魏酸酯酶(feruloyl esterase,FAE,E.C.3.1.1.73),属于羧酸酯酶亚类,可催化水解阿魏酸与多糖、纤维素、木质素间的酯键或醚键,生成阿魏酸[5]。此外,在三元有机溶剂体系中,阿魏酸酯酶还可通过酯交换反应生产阿魏酰寡糖或羟基肉桂酸酯等衍生物[6]。FAE广泛分布于植物和微生物中,目前产FAE微生物主要有曲霉属[7]、青霉属[8]等丝状真菌,放线菌[9]、乳酸菌[10]、芽孢杆菌[11]等细菌。不同来源FAE其酶学性质、序列同源性、空间结构有较大差异,目前对黑曲霉来源的FAE研究较深入。尽管真菌产阿魏酸酯酶能力强,但真菌来源的FAE分离困难,发酵酶活力低,耐热性差等缺点导致其难以规模化生产[12],因此发掘更多细菌来源、酶活力高的阿魏酸酯酶成为亟需解决的问题并获得国内外学者广泛关注。
本研究从土壤中分离鉴定得到1株产阿魏酸酯酶的菌株SK52.001;确定了最佳碳源及浓度,最佳氮源和培养基初始pH值;明确FAE是诱导性酶,为更多细菌来源的阿魏酸酯酶提供了理论依据和技术支持。
1 材料与方法
1.1 试验材料
1.1.1 材料
土壤:在江苏无锡贡湖湾湿地和长广溪湿地随机挑选10个地点采集土壤下5~10 cm深腐殖质土壤。
小麦麸皮:江苏无锡欧尚超市。
1.1.2 仪器与设备
Agilent 1200型高效液相色谱仪,美国Agilent公司;Waters ACQUITY UPLC液相色谱串联四极杆飞行时间质谱仪,美国沃特世公司。
1.1.3 培养基
分离培养基(g/L):马铃薯200,蔗糖20,琼脂15~20;pH值自然,121 ℃灭菌20 min。
种子培养基(g/L):马铃薯200,蔗糖20;pH值自然,121 ℃灭菌20 min。
筛选固体培养基(g/L):NaNO3 2,K2HPO4·3H2O 1,KCl 0.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,琼脂15~20;pH值自然,115 ℃灭菌30 min。0.22 μm滤膜过滤100 mg/L阿魏酸乙酯的N,N-二甲基甲酰胺溶液,添加10%(体积分数)阿魏酸乙酯溶液至灭菌培养基中,摇匀至培养基呈均匀的乳白色溶液后倒平板。
基础发酵产酶培养基[13](g/L):麦麸20,NaNO3 2,K2HPO4·3H2O 1,KCl 0.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01;pH值自然,115 ℃灭菌30 min。
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10;pH值自然,121 ℃灭菌20 min。
1.2 菌株筛选
1.2.1 菌株分离
称取土样1.0 g加入到10 mL含玻璃珠的无菌水,于30 ℃,200 r/min振荡30 min,静置2 min后取上清液梯度稀释,并将稀释悬浮液取100 μL涂布于分离培养基,倒置于30 ℃培养箱培养至单菌落长出。
1.2.2 菌株筛选
将分离培养基的单菌落挑至筛选培养基,利用以阿魏酸乙酯为唯一碳源的筛选平板筛选。于30 ℃ 培养箱倒置24 h,观察菌落周围是否有透明圈出现。若有透明圈,则说明该菌株具有阿魏酸酯酶活性。
将有阿魏酸酯酶活性的菌落划线纯化,将纯培养物接种至种子培养基,30 ℃,200 r/min培养18 h,按5%接种量接种至基础发酵产酶培养基培养7 d,定时取发酵液检测其是否存在阿魏酸酯酶活性。
1.3 阿魏酸酯酶活力测定
1.3.1 测定方法
粗酶液制备:1 mL发酵液室温下以10 000 r/min离心10 min,发酵上清液即为粗酶液。
酶反应:1 mL酶反应体系中含250 μL粗酶液和750 μL浓度为0.003 mol/L 阿魏酸甲酯(溶解在0.050 mol/L Tris-HCl缓冲溶液,pH值8.0)。酶反应体系在50 ℃水浴锅反应15 min后立即煮沸灭酶10 min ,终止酶反应,12 000 r/min离心2 min,取上清液制样。以加入等量蒸馏水代替粗酶液为空白对照,其他操作相同。
酶活力单位定义:一定温度下,1 min水解阿魏酸甲酯生成1 μmol阿魏酸所需要的酶量为1个酶活力单位(1 U)。
1.3.2 高效液相色谱检测条件
色谱条件参照文献[14]的方法,并加以改进。Agilent 1200型高效液相色谱仪;色谱柱为ZORBAX Eclipse Plus C18(Agilent,4.6 mm×150 mm,3.5 μm);紫外检测器;流动相A:1%乙酸溶液,流动相B:甲醇;流速1 mL/min;柱温30 ℃;检测波长320 nm,梯度洗脱程序如表1所示。
表1 梯度洗脱程序
Table 1 Gradient elution program
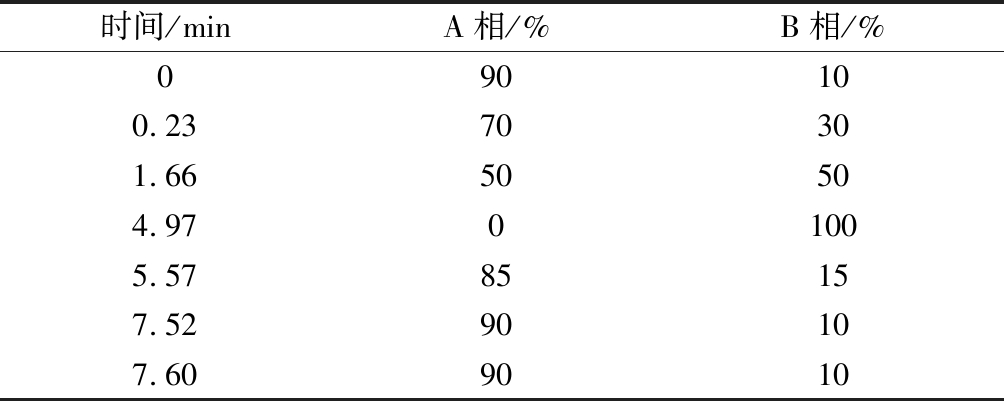
时间/minA相/%B相/%090100.2370301.6650504.9701005.5785157.5290107.609010
1.4 酶反应产物LC-MS鉴定
色谱条件:Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×150 mm,1.7 μm);Waters ACQUITY PDA检测器;流动相A:0.1% 甲酸,流动相B:乙腈;梯度洗脱分离条件:0~40 min,100%~70% A;40~45 min,70%~20% A;45~50 min,20%~0% A;50~55 min,0%~100% A;流速0.3 mL/min;柱温45 ℃。
质谱条件:锥孔电压30 V;毛细管电压3.5 V;ESI阴离子电离喷雾源;脱溶剂汽温度400 ℃;脱溶剂汽流量700 L/h;离子源温度100 ℃;锥孔汽流量50 L/h;质量扫描范围20~2 000 m/z。
1.5 目标菌株鉴定
1.5.1 菌株形态鉴定
目标菌株纯培养物划线于LB平板,观察菌落形态和颜色;并进行革兰氏染色及菌株个体形态观察。1.5.2 生理生化特征
参照《伯杰氏系统细菌学手册》[15]及《常见细菌系统鉴定手册》[16]进行目标菌株生理生化特征检测。
1.5.3 分子生物学鉴定
菌株16S rRNA 基因测序由天一辉远生物科技有限公司完成。将16S rRNA序列在NCBI(National center for Biotechnology Information)数据库进行比对分析,并采用MEGA 7.0软件绘制系统发育树。
1.6 发酵产酶条件优化
发酵条件采用以下方式:挑取单菌落至50 mL LB培养基于30 ℃,200 r/min 培养18 h后,按5%接种量接种至发酵产酶培养基,30 ℃,200 r/min培养26 h,250 mL锥形瓶装液量为25 mL,测定发酵结束的菌体生长量及发酵上清液酶活力,每次优化的结果均用于之后的实验中。
1.6.1 碳源种类及浓度
去淀粉小麦麸皮[17]:麸皮浸没于质量分数为0.3%的醋酸钾溶液中,95 ℃水浴1 h,其间不断搅拌,去离子水反复冲洗至淀粉完全去除,105 ℃烘干至恒重。
以10 g/L葡萄糖、果糖、蔗糖、乳糖、D-木糖、木聚糖、可溶性淀粉、小麦麸皮(wheat bran,WB)、去淀粉小麦麸皮(destarched wheat bran,DSWB)作为唯一碳源确定最佳碳源。改变最佳碳源浓度,分别为5、10、15、20、25、30、35、40、45、50 g/L,确定最佳碳源浓度。
1.6.2 复合碳源
额外添加5 g/L葡萄糖、果糖、蔗糖、乳糖、D-木糖和木聚糖为复合碳源,以45 g/L WB为对照[18]。
1.6.3 氮源种类
以5 g/L胰蛋白胨、大豆蛋白胨、鱼粉蛋白胨、酵母提取物、硫酸铵、尿素、硝酸钠为唯一氮源,以不加入氮源为对照。
1.6.4 初始pH值
分别调节发酵产酶培养基初始pH值为4.0、5.0、6.0、7.0、8.0、9.0,确定菌株生长的最适初始pH值。
1.7 发酵产酶曲线测定
将种子液分别接种至诱导性碳源(45 g/L麸皮),非诱导性碳源(45 g/L葡萄糖),以非诱导性碳(45 g/L葡萄糖)预培养至对数中期后添加45 g/L麸皮的发酵产酶培养基中,于30 ℃,200 r/min摇床培养,每隔一定时间取样测定OD600值和发酵酶活力。
2 结果与分析
2.1 菌株筛选结果
土样经分离和筛选后,共获得105株菌,其中8株产阿魏酸酯酶,发酵酶活力见表2。3号菌株的阿魏酸酯酶活力最高,达195 U/L,因此命名3号菌株为SK52.001,作为后续研究菌株。
表2 菌株产酶活力测定 单位:U/L
Table 2 FAE activities of FAE-producing strains
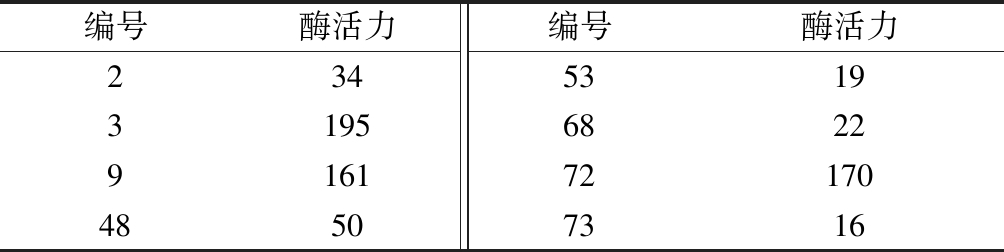
编号酶活力编号酶活力23453193195682291617217048507316
2.2 酶反应产物LC-MS结果
由图1-a全离子色谱图可知,目标产物阿魏酸在3.64 min出单峰。在负离子模式一级质谱图中,相同保留时间的是[M-H]-分子离子峰,因此由质谱图1-b中相对丰度最高的碎片m/z=193可知,目标产物的相对分子质量为194,与阿魏酸单体的相对分子质量一致。
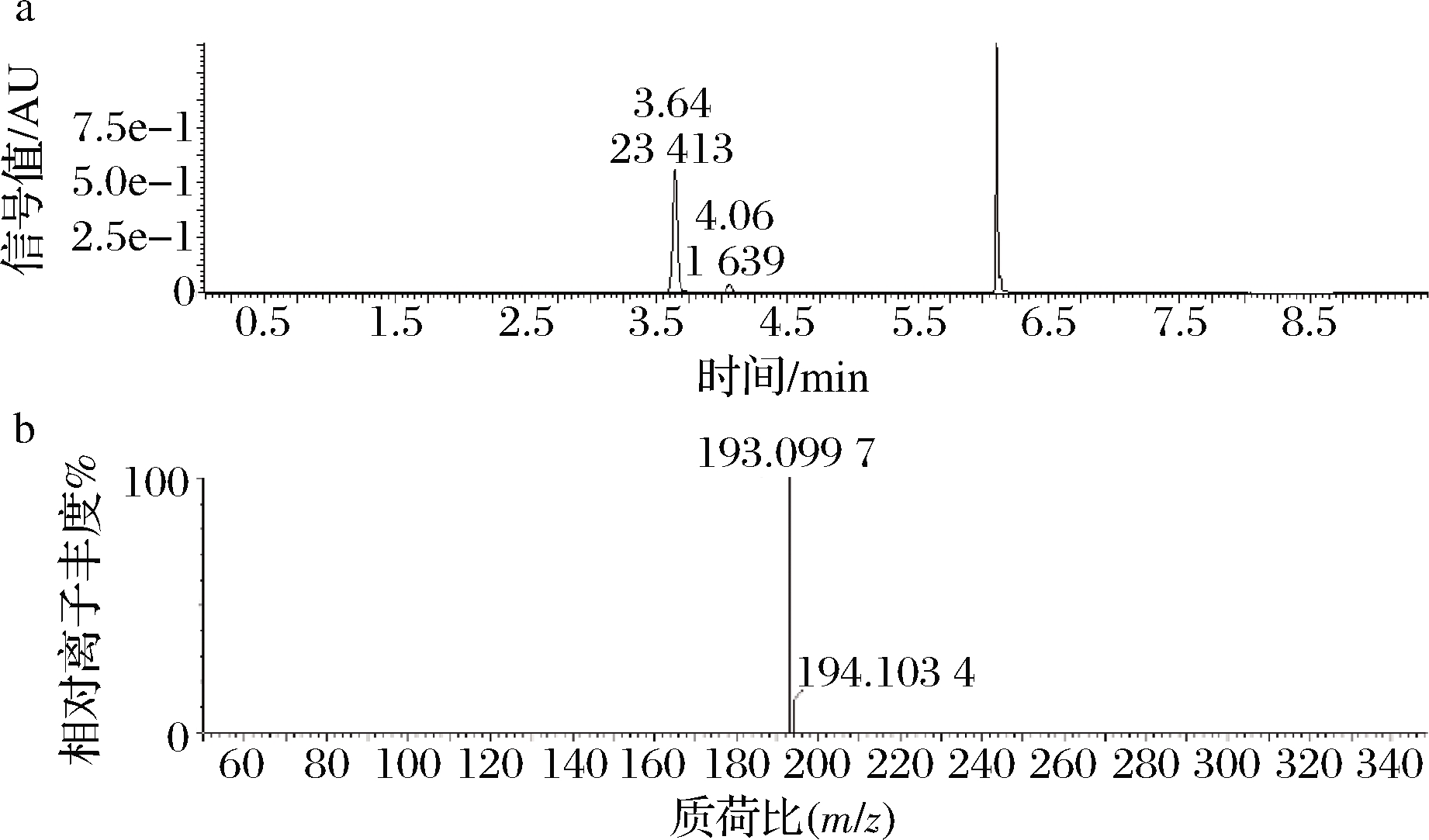
a-色谱图;b-质谱图
图1 酶反应产物LC-MS图谱
Fig.1 Result of SK52.001 product by LC-MS
2.3 菌种鉴定
2.3.1 形态学鉴定
该菌株在LB固体平板上的菌落为圆形,较薄,中间呈浅黄色,边缘微白,表面黏稠湿润,边缘凹凸不整齐(图2)。细胞呈短杆状,两端钝圆,具有典型的芽孢杆菌的形态特征,属于革兰氏阳性菌。

a-菌落形态;b-细胞形态(400×)
图2 菌落与菌体形态
Fig.2 Morphology of colony and cell
2.3.2 生理生化特征
菌株SK52.001生理生化鉴定结果如表3所示。
表3 生理生化特征
Table 3 Physiological and biochemical characteristics
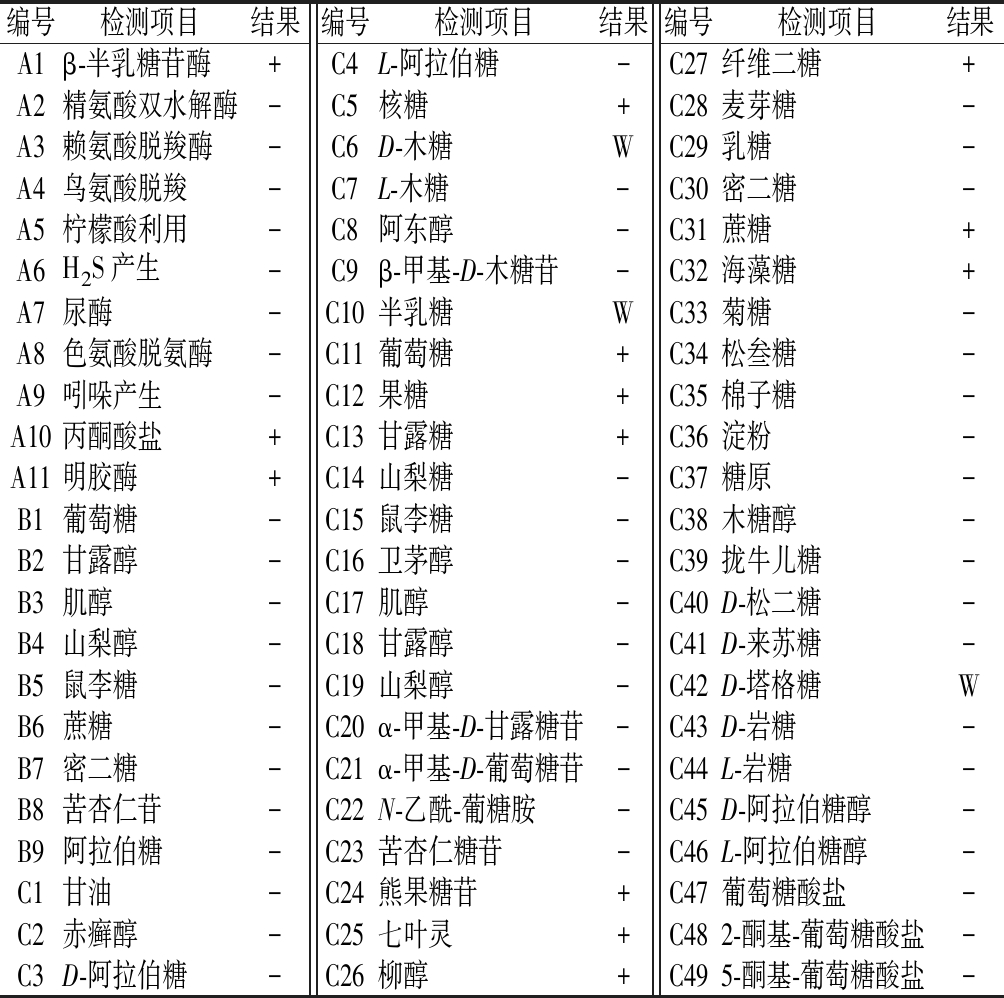
编号检测项目结果编号检测项目结果编号检测项目结果A1β-半乳糖苷酶+C4L-阿拉伯糖-C27纤维二糖+A2精氨酸双水解酶-C5核糖+C28麦芽糖-A3赖氨酸脱羧酶-C6D-木糖WC29乳糖-A4鸟氨酸脱羧-C7L-木糖-C30密二糖-A5柠檬酸利用-C8阿东醇-C31蔗糖+A6H2S产生-C9β-甲基-D-木糖苷-C32海藻糖+A7尿酶-C10半乳糖WC33菊糖-A8色氨酸脱氨酶-C11葡萄糖+C34松叁糖-A9吲哚产生-C12果糖+C35棉子糖-A10丙酮酸盐+C13甘露糖+C36淀粉-A11明胶酶+C14山梨糖-C37糖原-B1葡萄糖-C15鼠李糖-C38木糖醇-B2甘露醇-C16卫茅醇-C39拢牛儿糖-B3肌醇-C17肌醇-C40D-松二糖-B4山梨醇-C18甘露醇-C41D-来苏糖-B5鼠李糖-C19山梨醇-C42D-塔格糖WB6蔗糖-C20α-甲基-D-甘露糖苷-C43D-岩糖-B7密二糖-C21α-甲基-D-葡萄糖苷-C44L-岩糖-B8苦杏仁苷-C22N-乙酰-葡糖胺-C45D-阿拉伯糖醇-B9阿拉伯糖-C23苦杏仁糖苷-C46L-阿拉伯糖醇-C1甘油-C24熊果糖苷+C47葡萄糖酸盐-C2赤癣醇-C25七叶灵+C482-酮基-葡萄糖酸盐-C3D-阿拉伯糖-C26柳醇+C495-酮基-葡萄糖酸盐-
注:+,阳性反应;-,阴性反应;W,弱阳性反应。A为酶活力检测项目,B为碳源氧化检测项目,C为利用碳源产酸检测项目
2.3.3 分子生物学鉴定
测序结果显示,SK52.001的16S rRNA基因序列含1 404个碱基,经NCBI在线数据库比对后发现,其与多种芽孢杆菌属菌株同源性达100%,结合该菌株生理生化试验与形态学特征,最终确定SK52.001为短小芽孢杆菌。为进一步确定目标菌株与已知芽孢杆菌属菌株间亲缘关系,采用MEGA 7软件构建系统进化树,采用Neighbor-Joining分析法[19],通过1 000次步长检验得到系统发育树,如图3所示。
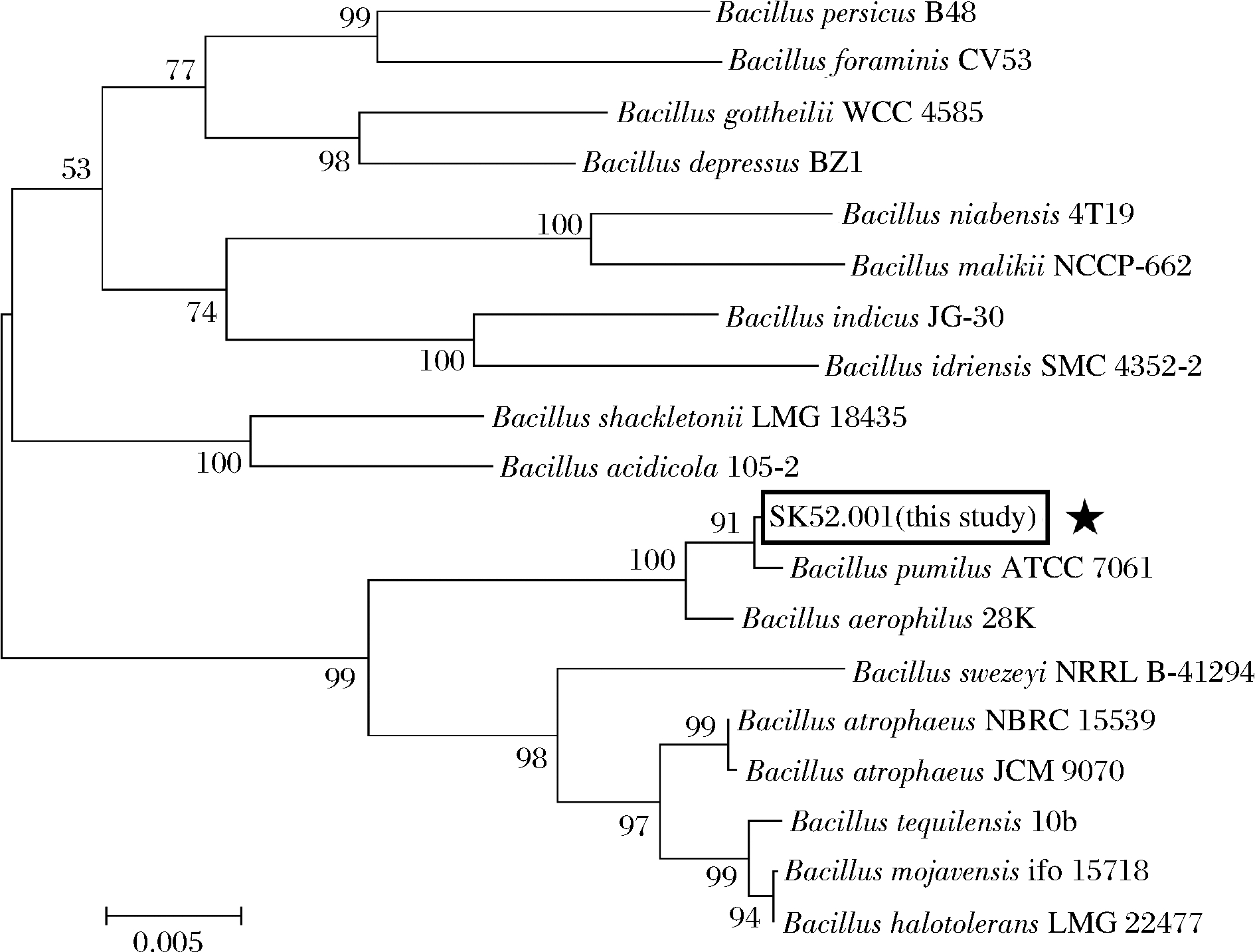
图3 利用Neighbor-Joining法构建菌株SK52.001的系统发育树
Fig.3 Phylogenetic tree of strain SK52.001 constructed by method of Neighbor-Joining 注:★为本研究菌株
2.4 发酵培养基优化
2.4.1 碳源种类与浓度
当发酵产酶培养基中碳源种类不同时,菌体生长量及阿魏酸酯酶活力存在显著差异,见图4-a。以葡萄糖等简单糖为碳源时,FAE发酵酶活力低,这与SHIN等[20]研究结果基本一致。以麸皮和DSWB为碳源时,菌体生长量较高,一方面可能是麸皮中含多种蛋白质及营养物质如尼克酸、硫胺酸等,可以满足菌体生长需求[21],另一方面FAE为诱导酶[22],麸皮与DSWB含有阿魏酸酯键可诱导生产大量FAE提高酶活力。其中,以麸皮为碳源时FAE酶活力最高,可能是由于DSWB中水溶性物质营养成分流失。
以麸皮为碳源时,探究了不同浓度对FAE酶活力的影响(图4-b)。当麸皮质量浓度低于45 g/L时,FAE酶活力随着麸皮浓度的增加而提高,当麸皮质量浓度在45 g/L时,FAE酶活力最高,随后酶活力呈现下降趋势。可能是因为过高的麸皮浓度使培养基中水分含量和空气通量减少[23],菌体的FAE合成能力下降;同时,麸皮不断被分解利用使培养基中球形颗粒增多,浊度增加,因此在600 nm处的光密度增加。
2.4.2 复合碳源
本实验还探究了当麸皮质量浓度为45 g/L时,添加其他糖共发酵对酶活力影响(图4-c)。研究表明,简单糖的存在一定程度上抑制FAE的生产,这与之前研究相同[18],该现象可能是菌体生长产酶过程中,简单糖与麸皮作为碳源相互竞争,过多碳源抑制微生物生长,进而减少FAE表达分泌。因此,选择质量浓度为45 g/L麸皮为唯一碳源时,FAE酶活力最高。
2.4.3 氮源种类
氮源是菌体生长和细胞代谢的重要营养物质,SK52.001利用不同氮源生长产酶情况不同(图4-d)。麸皮作为天然化合物包括淀粉、蛋白质、纤维素等营养物质,也可作为氮源,因此选用不额外添加氮源的培养基作为对照组。结果显示,有机氮源酶活力普遍高于无机氮源,可能是由于有机氮源中的小分子肽更易于菌体吸收利用,而无机氮源转化率低,降低菌体生长代谢速率,造成产酶量减少[24]。麸皮作为氮源,其结构复杂,氮源提供不足,菌体利用率低使生长受抑制,产酶量少。当发酵培养基含5 g/L胰蛋白胨时,FAE酶活力最高,大豆蛋白胨次之。然而,与早期报道[25]结果不同,有机氮源如酵母提取物蛋白胨不支持阿魏酸酯酶的生产,主要是由于产酶菌株对氮源的利用率不同。
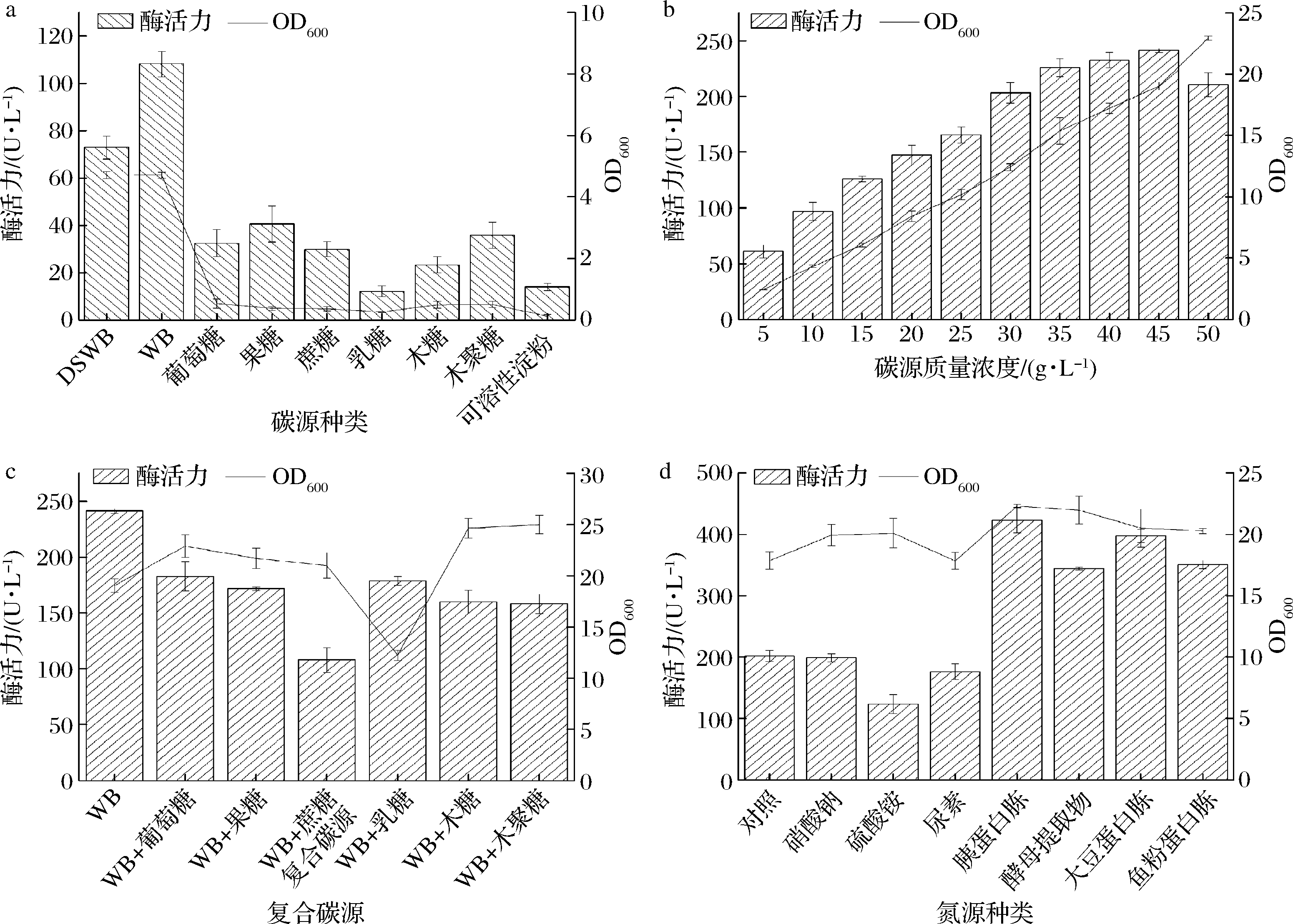
a-碳源种类;b-麸皮浓度;c-复合碳源;d-氮源种类
图4 产酶培养基成分优化
Fig.4 Optimization in the medium for the FAE production
2.4.4 初始 pH值
培养基pH值直接影响菌体代谢及产酶,过酸过碱的生长环境都抑制菌体生长代谢。由图5可知,在pH值为6.0时FAE酶活力达421 U/L。曹艳等[26]研究显示,溜曲霉FD-8(Aspergillus tamarii,FD-8)发酵产酶培养基最适pH值为6.0,在该pH值下,菌体生长量最多,可合成更多的FAE,进而提高FAE酶活力。
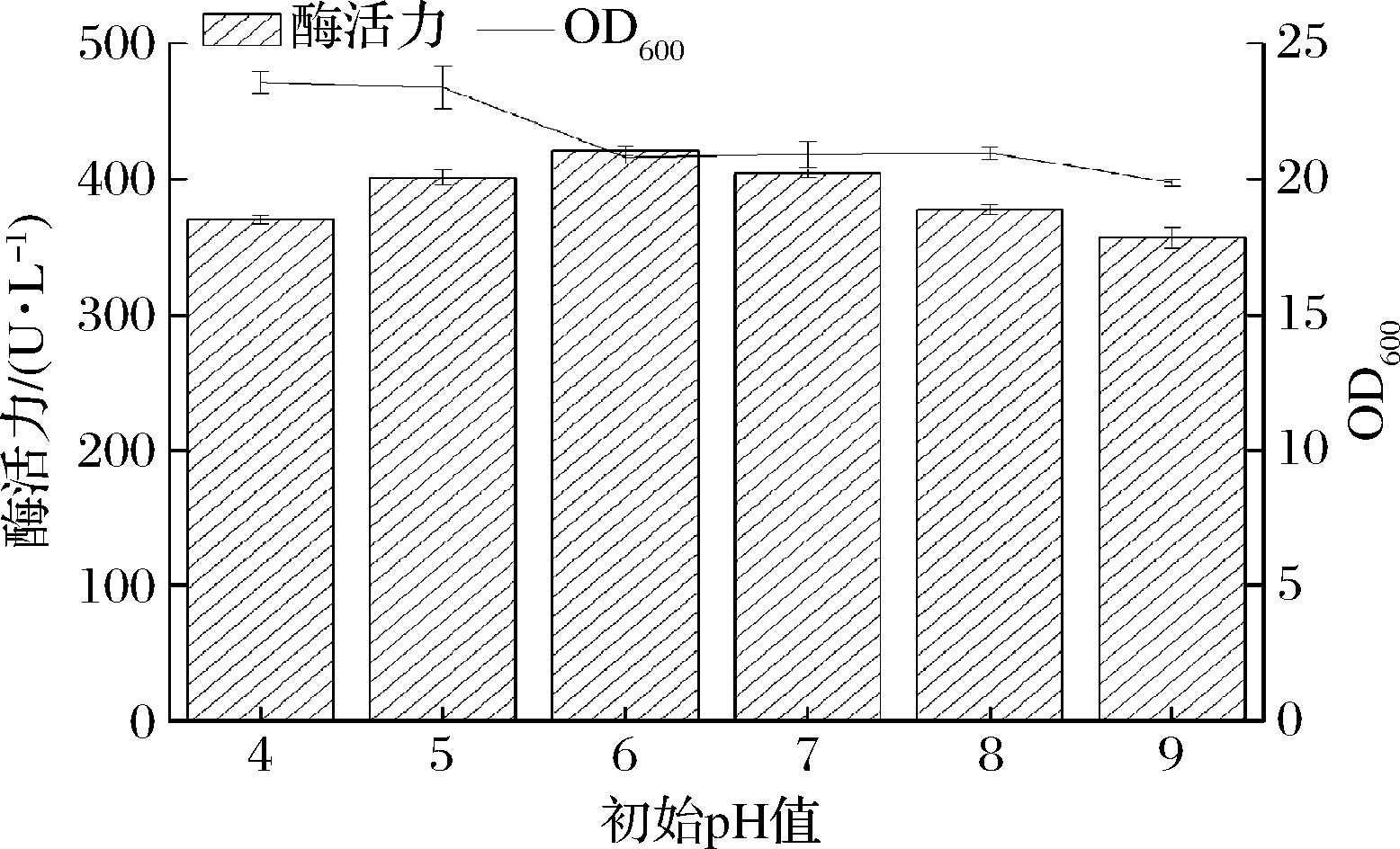
图5 初始pH值优化
Fig.5 Optimization of initial pH values
2.5 发酵产酶曲线
分别考察以葡萄糖为碳源,以麸皮为碳源,以葡萄糖为碳源培养至对数中期加麸皮诱导产酶在不同发酵时间的OD600和发酵酶活力(如图6所示)。当以葡萄糖为碳源时,菌株生长16 h进入稳定期,而FAE酶活力极低,且几乎无变化,说明葡萄糖仅供菌株维持基本生长代谢。当以麸皮为碳源时,菌株培养24 h进入稳定期,随后随OD600缓慢增加酶活力也不断升高,培养至32 h时FEA酶活力最高。当以葡萄糖为碳源预培养8 h后添加麸皮诱导产酶44 h时,FAE酶活力显著提高至808 U/L,说明麸皮的添加可诱导菌株生产FAE,前期葡萄糖提供菌株生长所需碳源,之后补加麸皮,一方面提供产酶诱导物,另一方面进一步补充供微生物生长的营养物质,所以菌体量与产酶量均高于仅用麸皮或葡萄糖为碳源的产量。以上结果表明,该菌株所产FAE是诱导型表达,只有当培养基中存在诱导物时,FAE才能大量表达。
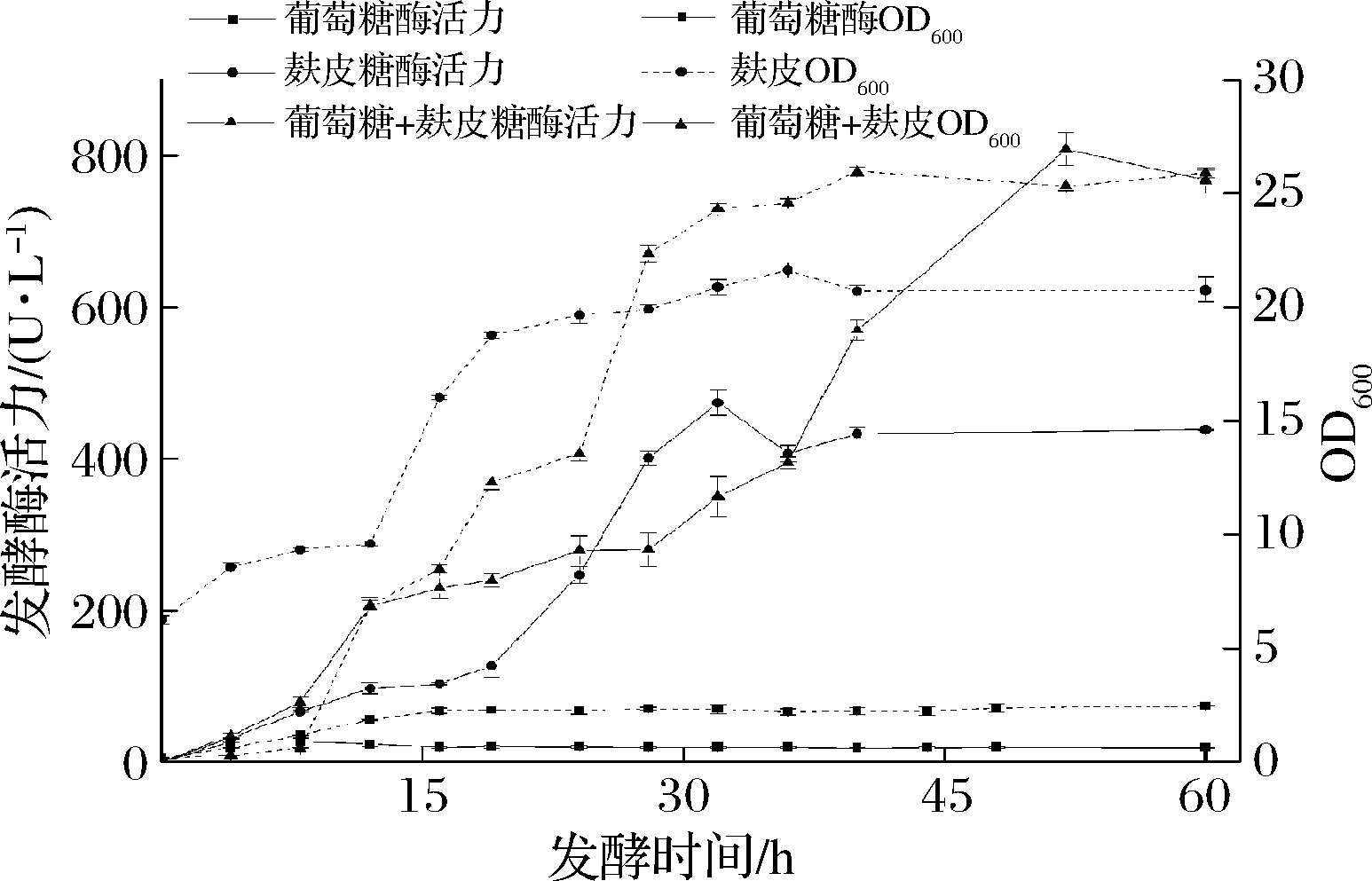
图6 发酵产酶曲线
Fig.6 Curve of enzyme production
近年来国内外报道生产阿魏酸酯酶的不同菌株发酵产酶条件和酶活力见表4。本研究中短小芽孢杆菌来源的阿魏酸酯酶在国内外报道较少,且发酵酶活力可达808 U/L,在工业中有巨大的潜在应用价值。
表4 阿魏酸酯酶发酵酶活力
Table 4 Enzyme activity of FAE
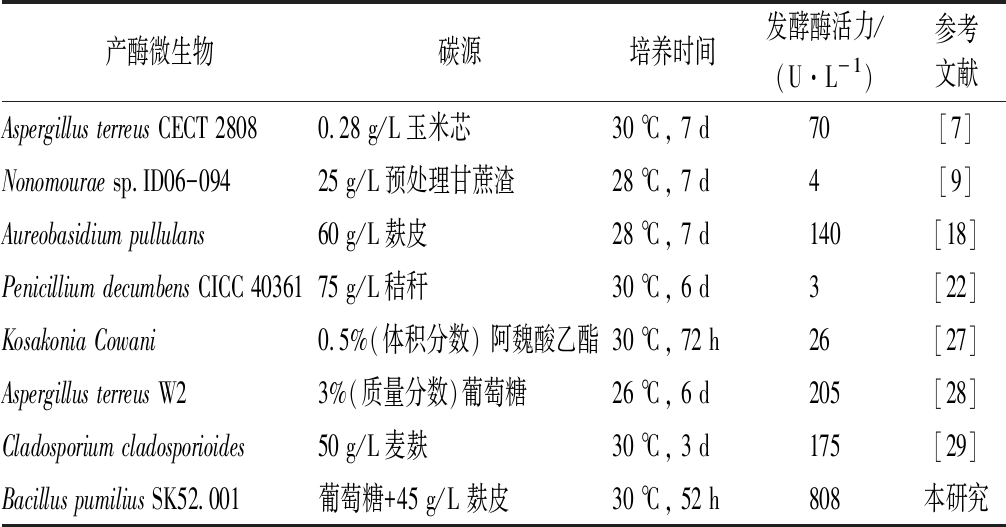
产酶微生物碳源培养时间发酵酶活力/(U·L-1)参考文献Aspergillus terreus CECT 28080.28 g/L玉米芯30 ℃, 7 d70[7]Nonomourae sp.ID06-09425 g/L预处理甘蔗渣28 ℃, 7 d4[9]Aureobasidium pullulans60 g/L麸皮28 ℃, 7 d140[18]Penicillium decumbens CICC 4036175 g/L秸秆30 ℃, 6 d3[22]Kosakonia Cowani0.5%(体积分数) 阿魏酸乙酯30 ℃, 72 h26[27]Aspergillus terreus W23%(质量分数)葡萄糖26 ℃, 6 d205[28]Cladosporium cladosporioides50 g/L麦麸30 ℃, 3 d175[29]Bacillus pumilius SK52.001葡萄糖+45 g/L 麸皮30 ℃, 52 h808本研究
3 结论
本实验从江苏无锡贡湖湾湿地和长广溪湿地土壤中分离出1株产阿魏酸酯酶的菌株,通过对此菌株进行形态学特征观察、生理生化试验及分子生物学鉴定,构建系统发育树后确定该菌株为短小芽孢杆菌 Bacillus pumilus SK52.001。其酶反应产物经过LC-MS后可确定该酶为阿魏酸酯酶,利用该菌株在30 ℃,200 r/min条件下,当接种量为5%时,在45 g/L麸皮,5 g/L胰蛋白胨,培养基初始pH值为6.0时,发酵培养26 h,发酵液中的阿魏酸酯酶活力达到421 U/L,比原始酶活力(195 U/L)提高115%。当菌株在以45 g/L葡萄糖为碳源的发酵产酶培养基中预培养8 h,加入45 g/L麸皮诱导产酶44 h时,发酵液中阿魏酸酯酶活力最高,达到808 U/L。研究结果表明,筛选得到的菌株B.pumilus SK52.001是一种具有工业化生产能力的阿魏酸酯酶生产菌。
[1] LAN J S, ZENG R F, JIANG X Y, et al.Design, synthesis and evaluation of novel ferulic acid derivatives as multi-target-directed ligands for the treatment of Alzheimer′s disease[J].Bioorganic Chemistry, 2020, 94:103 413.
[2] DILOKPIMOL A A, MAKELA M R, MANSOURI S B, et al.Expanding the feruloyl esterase gene family of Aspergillus niger by characterization of a feruloyl esterase, FaeC[J].New Biotechnology, 2017, 37(PtB):200-209.
[3] FAN G S, ZHU Y T, FU Z L, et al.Optimization of fermentation conditions for the producti on of recombinant feruloyl esterase from Burkholderia pyrrocinia B1213[J].3 Biotech, 2020, 10(5):216.
[4] MAURA F A, ANTON H, GIULIO Z, et al.Advances in combined enzymatic extraction of ferulic acid from wheat bran[J].New Biotechnology, 2020, 56:38-45.
[5] XU Z S, WANG T, ZHANG S S.Extracellular secretion of feruloyl esterase derived from Lactobacillus crispatus in Escherichia coli and its application for ferulic acid production[J].Bioresource Technology, 2019, 288:121 526.
[6] JUAN T C, SALWA K.Immobilized feruloyl esterase from Humicola insolens catalyzes the synthesis of feruloylated oligosaccharides[J].Process Biochemistry, 2019, 79:81-90.
[7] PE R G N, MOREIRA C D, TORRADO A A, et al.Feruloyl esterase production by Aspergillus terreus CECT 2808 and subsequent application to enzymatic hydrolysis[J].Enzyme and Microbial Technology, 2016, 91:52-58.
[8] CHADHA B S, MONGA A, OBEROI H S.α-L-arabinofuranosidase from an efficient hemicellulolytic fungus Penicillium janthinellum capable of hydrolyzing wheat and rye arabinoxylan to arabinose[J].Journal of Microbiology Biotechnology and Food Sciences, 2017, 6(5):1 132-1 139.
[9] RAHMANI N, KAHAR P, LISDIYANTI P, et al.Xylanase and feruloyl esterase from actinomycetes cultures could enhance sugarcane bagasse hydrolysis in the production of fermentable sugars[J].Bioscience, Biotechnology and Biochemistry, 2018, 82(5):904-915.
[10] SU R N, NI K K, WANG T W, et al.Effects of ferulic acid esterase-producing Lactobacillus fermentum and cellulase additives on the fermentation quality and microbial community of alfalfa silage[J].PeerJ, 2019, 7:e7 712.
[11] WANG X A, BAI Y B, CAI Y A, et al.Biochemical characteristics of three feruloyl esterases with a broad substrate spectrum from Bacillus amyloliquefaciens H47[J].Process Biochemistry, 2017, 53:109-115.
[12] WU D H, CAI G L, LI X M, et al.Cloning and expression of ferulic acid esterase gene and its effect on wort filterability[J].Biotechnology Letters, 2018, 40(4):711-717.
[13] 陈锦, 胡茂丰, 吴章华, 等.高产阿魏酸酯酶菌株的筛选及其产酶条件优化[J].食品工业科技, 2015, (8):218-239.
CHEN J, HU M F, WU Z H, et al.Selection of high-yield ferulic acid esterase strain and optimization of enzyme production condition[J].Science and Technology of Food Industry, 2015,(8):218-239.
[14] NIETER A, KELLE S, LINKE D, et al.Feruloyl esterases from Schizophyllum commune to treat food industry side-streams[J].Bioresource Technology, 2016, 220:38-46.
[15] 布坎南 R E, 吉本斯 N E.伯杰细菌鉴定手册[M].第8版.北京:科学出版社, 1984.
BUCHANAN R E, GIBBONS N E.Bergey′s Manual of Determinative Bacteriology[M].8th ed.Beijing:Science Press, 1984.
[16] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
DONG X Z, CAI M Y.Manual for Identifying Common Bacterium[M].Beijing:Science Press, 2001.
[17] KASMAEI K M, SUNDH J.Identification of novel putative bacterial feruloyl esterases from anaerobic ecosystems by use of whole-genome shotgun metagenomics and genome binning[J].Frontiers in Microbiology, 2019, 10:2 673.
[18] YU X H, GU Z X.Direct production of feruloyl oligosaccharides and hemicellulase inducement and distribution in a newly isolated Aureobasidium pullulans strain[J].World Journal of Microbiology and Biotechnology, 2014, 30(2):747-755.
[19] ATTESON K.The performance of neighbor-joining methods of phylogenetic reconstruction[J].Algorithmica, 1999, 25(2-3):251-278.
[20] SHIN H D, CHEN R R.Production and characterization of a type B feruloyl esterase from Fusarium proliferatum NRRL 26517[J].Enzyme and Microbial Technology, 2006, 38(3):478-485.
[21] 孙思佳,翟磊,白秀彬,等.一株高产淀粉酶扣囊复膜孢酵母的产酶条件优化及酶学性质研究[J].食品与发酵工业,2019, 45(21):31-37.
SUN S J, ZHAI L, BAI X B, et al.Optimization of enzyme production conditions and enzymatic properties of a high amylase-production Saccharomucopsis fibuligera[J].Food and Fermentation Industries, 2019, 45(21):31-37.
[22] HOU R R, HU J J, WANG Y Z, et al.Simultaneous production of cellulase and ferulic acid esterase by Penicillium decumbens with rice straw as the sole carbon source[J].Journal of Bioscience and Bioengineering, 2019, 129(3):276-283.
[23] 邓轶韬, 李夏兰, 陈宗香,等.阿魏酸酯酶产生菌的筛选及产酶条件的优化[J].华侨大学学报(自然版), 2011(3):300-303.
DENG Y T, LI X L, CHEN Z X, et al.Screening of feruloyl esterases producing strain and optimization of the enzyme production[J].Journal of Huaqiao University (Natural Science), 2011, (3):300-303.
[24] 郑义, 张健, 曹永强,等.产β-D-半乳糖苷酶马克斯克鲁维酵母的分离鉴定及产酶特性研究[J].食品科学, 2020, 41(2):158-165.
ZHENG Y, ZHANG J, CAO Y Q, et al.Isolation, identification and enzymatic characteristics of Kluyveromyces marxianus producing β-D-galactosidase[J].Food Science, 2020, 41(2):158-165.
[25] KUMAR C G, KAMLE A, MONGOLLA P, et al.Parametric optimization of feruloyl esterase production from Aspergillus terreus strain GA2 isolated from tropical agro-ecosystems cultivating sweet sorghum[J].Journal of Microbiology and Biotechnology, 2011, 21(9):947-953.
[26] 曹艳, 夏其乐, 陈剑兵,等.1株阿魏酸酯酶产生菌的筛选鉴定及发酵条件优化[J].微生物学杂志, 2019, 39(5):8-15.
CAO Y, XIA Q L, CHEN J B, et al.Screening and identification of a ferulic acid esterase producing strain and the optimization of fermentation conditions[J].Journal of Microbiology, 2019, 39(5):8-15.
[27] 李丽, 章宇丹, 刘军, 等.浓香型白酒酿造过程中一株产阿魏酸酯酶菌株的筛选和鉴定[J].食品工业科技, 2021,42(5):126-131;137.
LI L, ZHANG Y D, LIU J, et al.Screening, identification and biological characteristics of ferulic acid esterase strain in Luzhou-flavor liquor brewing process[J].Science and Technology of Food Industry, 2021,42(5):126-131;137.
[28] 李松, 徐朝旭, 林陈莹,等.产阿魏酸酯酶丝状真菌筛选及发酵条件优化[J].食品与发酵工业, 2020,46(23):74-80.
LI S, XU C X, LIN C Y, et al.Screening of filamentous fungi with feruloyl esterase producing ability and optimization of fermentation conditions[J].Food and Fermentation Industry, 2020,46(23):74-80.
[29] 李翠翠, 毛健, 刘双平, 等.产阿魏酸酯酶的枝状枝孢霉筛选、发酵特性及在黄酒中应用研究[J].食品与生物技术学报, 2018, 37(8):793-801.
LI C C, MAO J, LIU S P, et al.Isolation, fermentation characteristics and application in Chinese rice wine of a Cladosporium cladosporioides strain producing feruloyl esterases[J].Food Science and Biotechnology, 2018, 37(8):793-801.