柠檬(Citrus limon L.Burm.F.)属芸香科柑橘属常绿小乔木,在全球热带及亚热带地区均有广泛种植;柠檬果实色泽鲜艳、质地饱满、酸味浓郁,且富含各种维生素及矿物质元素以及柠檬苦素、类黄酮、酚酸等抗氧化物质,故近年来逐渐受到市场推崇[1]。考虑到柠檬果实中鲜食比例小,进行合适的精深加工是柠檬果类资源高效开发的重要手段[2]。近年来,我国柠檬年加工总量从2010的15万 t上升至2018年的近40万 t,展现出良好发展势头[3]。但柠檬果实加工过程中也同时易形成大量籽粒碎片,填埋或焚烧虽是常规的处置方法,但也造成巨大的资源浪费和环境污染。有研究发现,柠檬籽粒出油率接近20%,且初榨柠檬籽油中不饱和脂肪酸含量比例接近70%,具有一定的保健功效,因此对柠檬籽进行油脂的提取兼具经济和环境效益[4-5]。
冷榨制油法是一种将未经烘焙或蒸炒的油制原料在较低温度下直接经榨油机通过高压压缩的方式直接得到的分子结构未发生明显变化的油脂产品的工艺方法,属于低温高压制油法[6]。相较于传统的热榨法和溶剂提取法,冷榨制油法可有效减少压榨过程中油脂品质的损失,维持油脂固有特性,并可简化后续精炼工艺。同时,冷榨法属于物理压榨制油法,加工过程中无化学添加,可保证较高的食品安全性[7]。另一方面,由于柠檬籽含有大量苦素类(如柠檬苦素、诺米林和柚皮苷等)物质,在柠檬籽压榨过程中会大量溶入油脂中并产生极强的苦涩味,因此在对柠檬籽油进行精炼之前需增加脱苦步骤,以保证柠檬籽油的口感达到食用油标准[8-9]。而这其中,考虑到类柠檬苦素(如柠檬苦素和诺米林)物质由于其苦味阈值极低,水溶液或果汁产品中的苦味阈值(3 mg/L)仅为柚皮苷的1/20左右,因此,尽可能去除柠檬苦素类物质是柠檬籽油脱苦工艺的首要前提[10]。传统的食品脱苦操作包括酶解法、吸附法、碱炼法、遮掩法和稀释法等;这其中,遮掩法和稀释法多为果汁脱苦使用,碱炼法易造成酚类含量或苦素类含量较高的油脂色泽黯淡,酶解法和吸附法从原理上分析更适合于柠檬籽油的脱苦操作[11-12]。因此,本研究即以冷榨柠檬籽油为原料,分析酶法-吸附联合脱苦工艺对柠檬籽油品质改良的效果并对相关工艺进行优化,最后将成品柠檬籽油与市售常见食用油进行综合品质参数的比较,以期为开发柠檬籽油产品奠定基础。
1 材料与方法
1.1 材料与试剂
柠檬籽粒,由重庆汇达柠檬科技集团有限公司加工厂提供,以柠檬果实深加工后的破碎籽粒居多,粒径(4.83±0.68) mm,含水量(58.59±3.73)%;柠檬苦素标准品(≥95 %)、诺米林标准品(≥95 %),美国Sigma公司;37种脂肪酸混合标准品,上海康朗生物科技有限公司;α-L-鼠李糖苷苷酶(食品级),上海伊卡生物技术有限公司;β-D-葡萄糖苷酶(食品级),北京华越洋生物科技有限公司;木瓜蛋白酶、纤维素酶、果胶酶和淀粉酶(均为食品级),山东隆科特酶制剂有限公司;活性白土,济南清海化工有限公司;活性炭、硅酸镁和硅胶粉,河南嵩山科技有限公司。
1.2 仪器与设备
JC101电热鼓风干燥箱,南通嘉程仪器有限公司;SYZX 12双螺杆榨油机,安陆市天星粮油机械设备有限公司;TDL-5-A冷冻离心机,上海安亭科学仪器厂;Agilent 1100高效液相色谱仪、Agilent 6890气相色谱仪,美国安捷伦公司;DK-98-ⅡA电热恒温水浴锅,天津市泰斯特仪器有限公司;FA2004 N电子天平,上海菁海仪器有限公司;752紫外可见分光光度计,上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 实验流程图
柠檬籽冷榨制油及分析工艺流程如下:
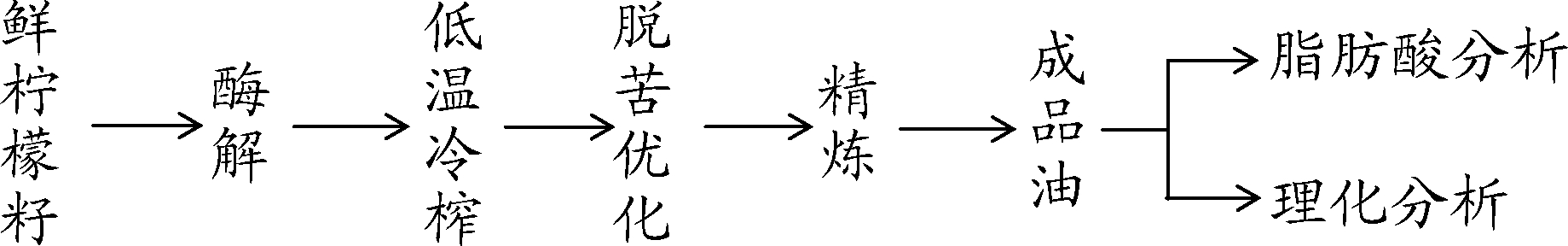
1.3.2 预处理及冷榨制油
分选后的鲜柠檬籽在加工前烘干至水分含量约20%(质量分数),随后用撞击式粉碎机将其粉碎成柠檬籽果仁和果壳,调节柠檬籽果仁和果壳质量比至1∶7~1∶9。随后参考课题组前期方法[13]对柠檬籽粒进行复合酶解,复合酶质量比为果胶酶∶纤维素酶∶淀粉酶=2∶1∶1,添加量1.5%(质量分数),酶解参数为:温度45 ℃、pH 5、时间4 h。将酶解后的籽粒过滤并烘干至水分含量<8%,备用。
1.3.3 冷榨制油
参考课题组前期方法[14]进行冷榨制油,将烘干后的固体物料送入双螺杆榨油机进行三级低温榨油,第一级压榨时膛压为10 MPa、时间30 min、温度35~40 ℃;所述第二级压榨时膛压40 MPa、时间15 min、温度40~45 ℃;所述第三级压榨时膛压为60 MPa、时间30 min、温度40~45 ℃。合并各级毛油备用。
1.3.4 脱苦工艺
工艺流程如下:
冷榨毛油→5 000 r/min离心→复合酶解脱苦→复合吸附剂脱苦→5 000 r/min离心→精炼→成品油
工艺流程中复合脱苦酶为α-L-鼠李糖苷酶、β-D-葡萄糖苷酶和木瓜蛋白酶;复合脱苦吸附剂为碱性白土、活性炭颗粒、硅酸镁、硅胶粉。碱性白土吸附剂制备工艺为:将活性白土和1 mmol/L NaOH溶液按3∶1(质量比)混匀,调节pH值至7.5~7.7,80 ℃烘干后用80~100目筛网过滤。
1.3.5 主要因素筛选
在前期预实验(单因素实验)的基础上,选取对柠檬籽中苦素类物质降解影响显著的α-L-鼠李糖苷酶、β-D-葡萄糖苷酶和木瓜蛋白酶的添加量,复合酶解温度和时间,碱性白土、活性炭颗粒、硅酸镁、和硅胶粉使用量以及吸附时间等10个因素进行2水平Plaktett-Burman设计(表1),以脱苦率为响应值筛选主要影响因素。
表1 Plaktett-Burman试验设计因素及水平表
Table 1 Independent factors and the levels used in Placket-Burman design
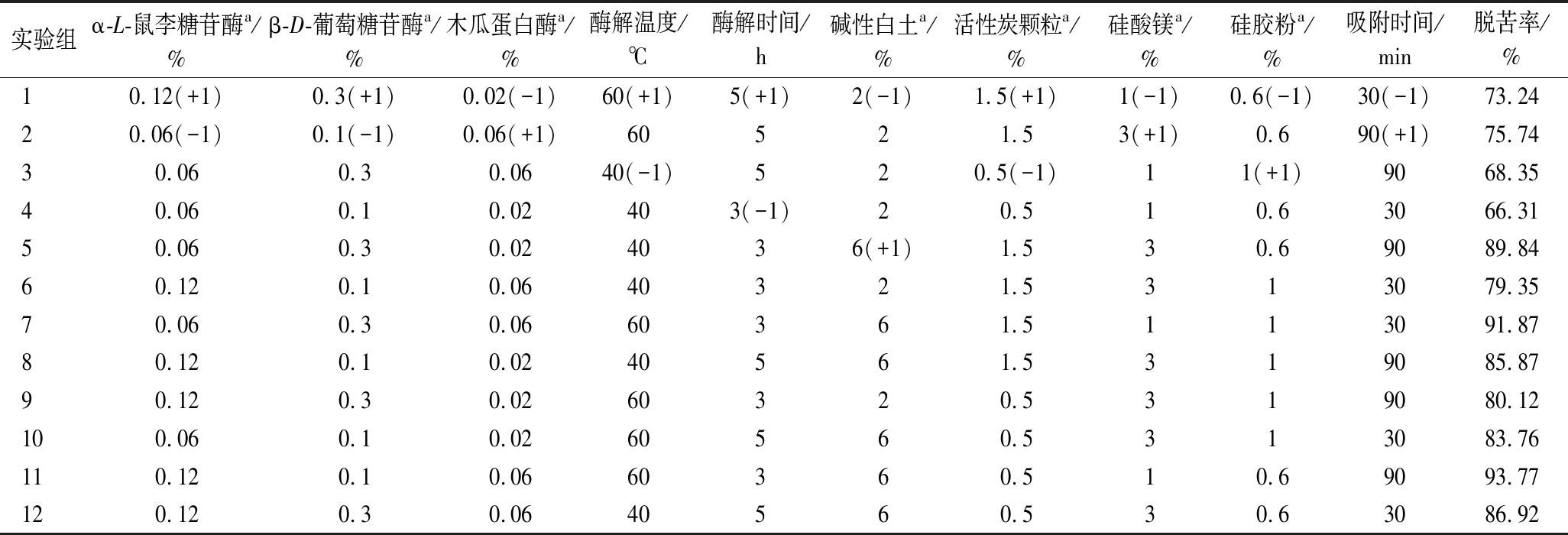
实验组α-L-鼠李糖苷酶a/%β-D-葡萄糖苷酶a/%木瓜蛋白酶a/%酶解温度/℃酶解时间/h碱性白土a/%活性炭颗粒a/%硅酸镁a/%硅胶粉a/%吸附时间/min脱苦率/%10.12(+1)0.3(+1)0.02(-1) 60(+1) 5(+1)2(-1)1.5(+1) 1(-1)0.6(-1)30(-1)73.2420.06(-1)0.1(-1)0.06(+1)60521.53(+1)0.690(+1)75.7430.060.30.0640(-1)520.5(-1)11(+1)9068.3540.060.10.02403(-1)20.510.63066.3150.060.30.024036(+1)1.530.69089.8460.120.10.0640321.5313079.3570.060.30.0660361.5113091.8780.120.10.0240561.5319085.8790.120.30.0260320.5319080.12100.060.10.0260560.5313083.76110.120.10.0660360.510.69093.77120.120.30.0640560.530.63086.92
注:a表示样品均为质量分数
1.3.6 响应面设计
通过上述二水平Plaktett-Burman试验,得出α-L-鼠李糖苷酶、酶解温度、酶解时间和碱性白土用量(按影响效应为序)为影响柠檬籽油脱苦率的主要影响因素。以此为基础,应用Design Expert软件中的 Box-Behnken 设计功能来对α-L-鼠李糖苷酶、酶解温度、酶解时间和碱性白土使用量4个工艺参数进行优化。以α-L-鼠李糖苷酶添加量、酶解温度、酶解时间和碱性白土添加量为自变量,分别以X1、X2、X3和X4表示,+1、0、-1分别表示因素的3个水平,最后得出29组实验组合的提取条件(表2)。
表2 响应面优化实验设计及结果
Table 2 Designs and results of optimizing tests by response surface method (RSD)
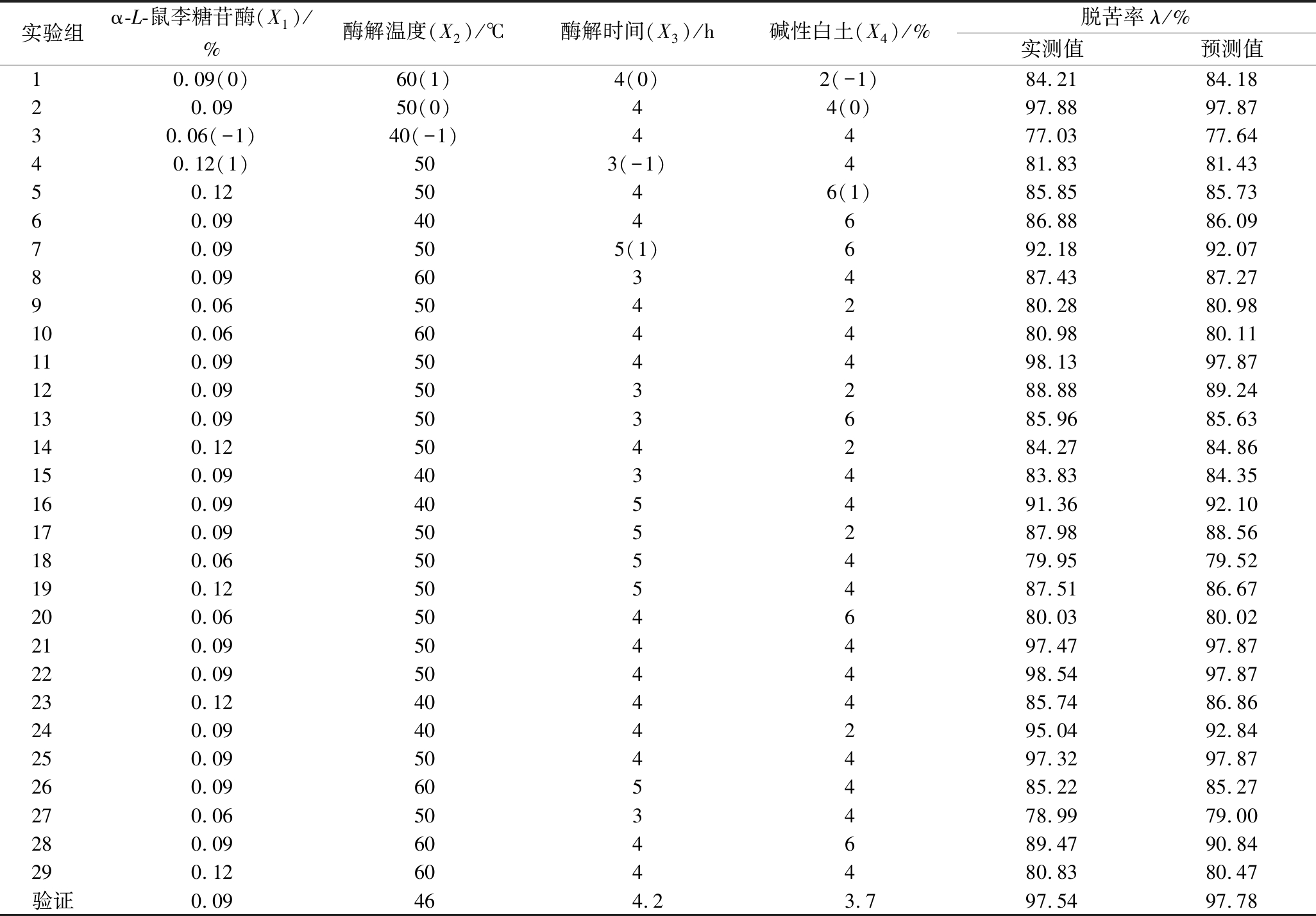
实验组α-L-鼠李糖苷酶(X1)/%酶解温度(X2)/℃酶解时间(X3)/h碱性白土(X4)/%脱苦率λ/%实测值预测值10.09(0)60(1)4(0)2(-1)84.2184.1820.0950(0)44(0)97.8897.8730.06(-1)40(-1)4477.0377.6440.12(1)503(-1)481.8381.4350.125046(1)85.8585.7360.09404686.8886.0970.09505(1)692.1892.0780.09603487.4387.2790.06504280.2880.98100.06604480.9880.11110.09504498.1397.87120.09503288.8889.24130.09503685.9685.63140.12504284.2784.86150.09403483.8384.35160.09405491.3692.10170.09505287.9888.56180.06505479.9579.52190.12505487.5186.67200.06504680.0380.02210.09504497.4797.87220.09504498.5497.87230.12404485.7486.86240.09404295.0492.84250.09504497.3297.87260.09605485.2285.27270.06503478.9979.00280.09604689.4790.84290.12604480.8380.47验证0.0946 4.2 3.797.5497.78
1.3.7 柠檬苦素和诺米林含量及脱苦率的测定
柠檬籽油样品中类苦素物质(柠檬苦素和诺米林)的提取和测定参考FAN等[15]的方法进行,略有改动。取5 mL样品用重蒸水定容至100 mL,经超声振荡(300 W)处理10 min后在30 ℃下静置1 h,吸取上层水相5 mL至50 mL容量瓶中,用甲醇定容,用0.45 μm有机微孔滤膜过滤后备用。使用Agilent 1100系列高效液相色谱仪进行类苦素类物质的测定,其装备reverse Nova-Pak C18分析色谱柱(250 mm×4.6 mm, 10 μm)。流动相A液为20%(体积分数)四氢呋喃,B液为乙腈,体积比为4∶1,速率0.4 mL/min,柱温35 ℃,进样体积10 μL,在215 nm波长下检测样品中柠檬苦素和诺米林含量,外标法以峰面积定量,结果以mg/L表示。同时,根据柠檬苦素和诺米林含量计算脱苦率[16],如公式(1)所示:
脱苦率![]()
(1)
式中:λ,基于柠檬苦素和诺米林含量的总脱苦率;A0,脱苦前油脂中柠檬苦素含量,mg/L;A1,脱苦后柠檬苦素含量,mg/L;B0,脱苦前油脂中诺米林含量,mg/L;B1,脱苦后油脂中诺米林含量,mg/L。
1.3.8 脱苦柠檬籽油脂肪酸组成分析
取脱苦柠檬籽油和市售某品牌花生油、菜籽油和大豆油为研究对象,参照纪佳璐等[17]的气相色谱法分析柠檬籽油脂肪酸组成成分,略有改动。气相色谱条件如下,选用SGE BPX-70 色谱柱(30 m×250 μm×0.25 μm);载气为氮气,流量为1.0 mL/min;氢气流量为30.0 mL/mi,空气流量为400 mL/min;进样口、柱温和检测器温度分别为210、180和300 ℃。以37种脂肪酸甲酯混标为内标标准品,进样混标浓度为1 000 mL/min,通过内标法分析成品柠檬籽油中脂肪酸组成。
1.3.9 脱苦柠檬籽油生育酚(VE)含量的测定
取1 mL柠檬籽油样品,依次加入0.2 mL 2 mmol/L FeCl3溶液和0.2 mL 9.7 mmol/L的邻菲罗啉溶液,显色30 s后加入0.2 mL 15.7 mmol/L的H3PO4溶液,最后用无水乙醇定容至5 mL,509 nm比色测定生育酚含量[18]。
1.3.10 脱苦柠檬籽油理化指标分析
参考曾小坪等[19]方法使用浊度计测定油脂透明度,结果以NTU值表示;分别参照GB 5009.229—2016《食品中酸价的测定》、GB 5532—2008《动植物油脂碘值的测定》、GB 5534—2008《动植物油脂皂化值的测定》和GB 5009.227—2016《食品中过氧化值的测定》测定油脂中酸价、碘值、皂化值和过氧化值;参考GB 5009.36—2016《食品中氰化物的测定》方法在638 nm处比色测定油脂中氰化物含量;采用正乙烷辅助抽滤的直接干燥法测定油脂中不溶性杂质比例[20]。
1.4 数据分析
以上各指标均重复测定3次,整个实验重复2次,结果以平均值±标准误差表示。脱苦因素筛选和工艺优化分别使用Design Expert 10.0.7软件中的Plaktett-Burman和Box-Behnken设计模块进行验证或数据拟合;使用RGui4.0.3软件R语言进行多种脂肪酸的主成分分析,采用Duncan氏多重比较法进行显著性检验。
2 结果与分析
2.1 因素筛选实验结果
以柠檬籽油脱苦率为响应值,对Plaktett-Burman试验数据(表1)进行分析可知,影响柠檬籽油脱苦率的前4个因素包括:α-L-鼠李糖苷酶添加量、酶解温度、酶解时间和碱性白土用量(P<0.05)(表3)。以此为基础,对α-L-鼠李糖苷酶添加量、酶解时间、酶解温度和碱性白土用量等4个主要因素作进一步优化分析。由于其余6个因素与脱苦率也存在相关性,依据Plaktett-Burman试验结果,选取0.1%β-D-葡萄糖苷酶添加量、0.02%木瓜蛋白酶添加量、0.5%活性炭颗粒用量、1%硅酸镁用量、0.6% 硅胶粉用量和30 min 吸附剂处理时间为固定参数。
表3 Plaktett-Burman 2水平试验方差分析
Table 3 Variance analysis of Plaktett-Burman two-level experiment
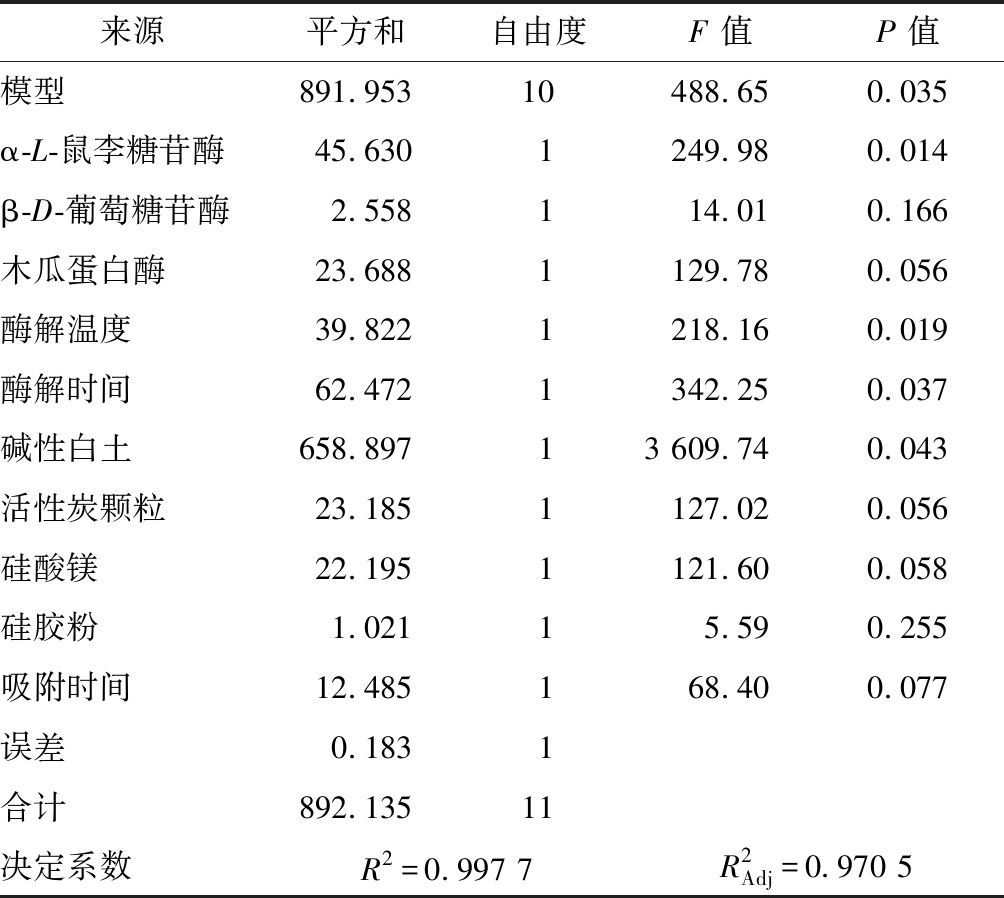
来源平方和自由度F 值P 值模型891.95310488.650.035α-L-鼠李糖苷酶45.6301249.980.014β-D-葡萄糖苷酶2.558114.010.166木瓜蛋白酶23.6881129.780.056酶解温度39.8221218.160.019酶解时间62.4721342.250.037碱性白土658.89713 609.740.043活性炭颗粒23.1851127.020.056硅酸镁22.1951121.600.058硅胶粉1.02115.590.255吸附时间12.485168.400.077误差0.1831合计892.13511决定系数R2=0.997 7R2Adj=0.970 5
2.2 柠檬籽油脱苦工艺模型的建立
按表2设计来优化柠檬籽油脱苦工艺参数。使用Design Expert 10.0.7软件,以柠檬籽油脱苦率为响应值(Y),自变量为α-L-鼠李糖苷酶添加量(X1)、酶解温度(X2)、酶解时间(X3)和碱性白土用量(X4),根据表2中各因素水平和脱苦率实测数据进行多元拟合,可解出柠檬籽油脱苦率对α-L-鼠李糖苷酶添加量、酶解温度、酶解时间和碱性白土用量各实际水平值的四元二次回归方程,即:
Y=-262.18 +2 480.22X1 +6.37X2 +47.44X3-4.89X4-7.38X1X2 +39.33X1X3 +7.63X1X4-0.24X2X3 +0.16X2X4 +0.89X3X4-12 ![]()
使用以上方程可预测柠檬籽油在各不同脱苦工艺组合下的脱苦效率,其预测值结果见表2。对此脱苦率为响应值的拟合模型做方差分析,结果见表4。首先,此多元方程极显著(P<0.01),失拟项不显著(P= 0.059 6),模型与实际脱苦率呈明显正相关(R2=0.987 7、Adj.R2=0.975 4),这些数据说明此模型拟合程度高。显著性数据可反映X1、X2和X3变化对柠檬籽油脱苦率影响显著(P<0.05),其中X1> X3> X2>X4,即α-L-鼠李糖苷酶添加量>酶解时间>酶解温度>碱性白土用量;二次项中,X12<0.000 1、X22<0.000 1、X32≤0.000 1、X42≤0.000 1;交互项中,X12=0.000 6,X13=0.034 1,X14=0.037 8、X23=0.000 3、X24<0.000 1、X34=0.003 3,说明酶解参数以及酶量和碱性白土用量之间存在显著交互作用。
表4 响应面回归模型的方差分析
Table 4 Variance analysis of response surface regression model
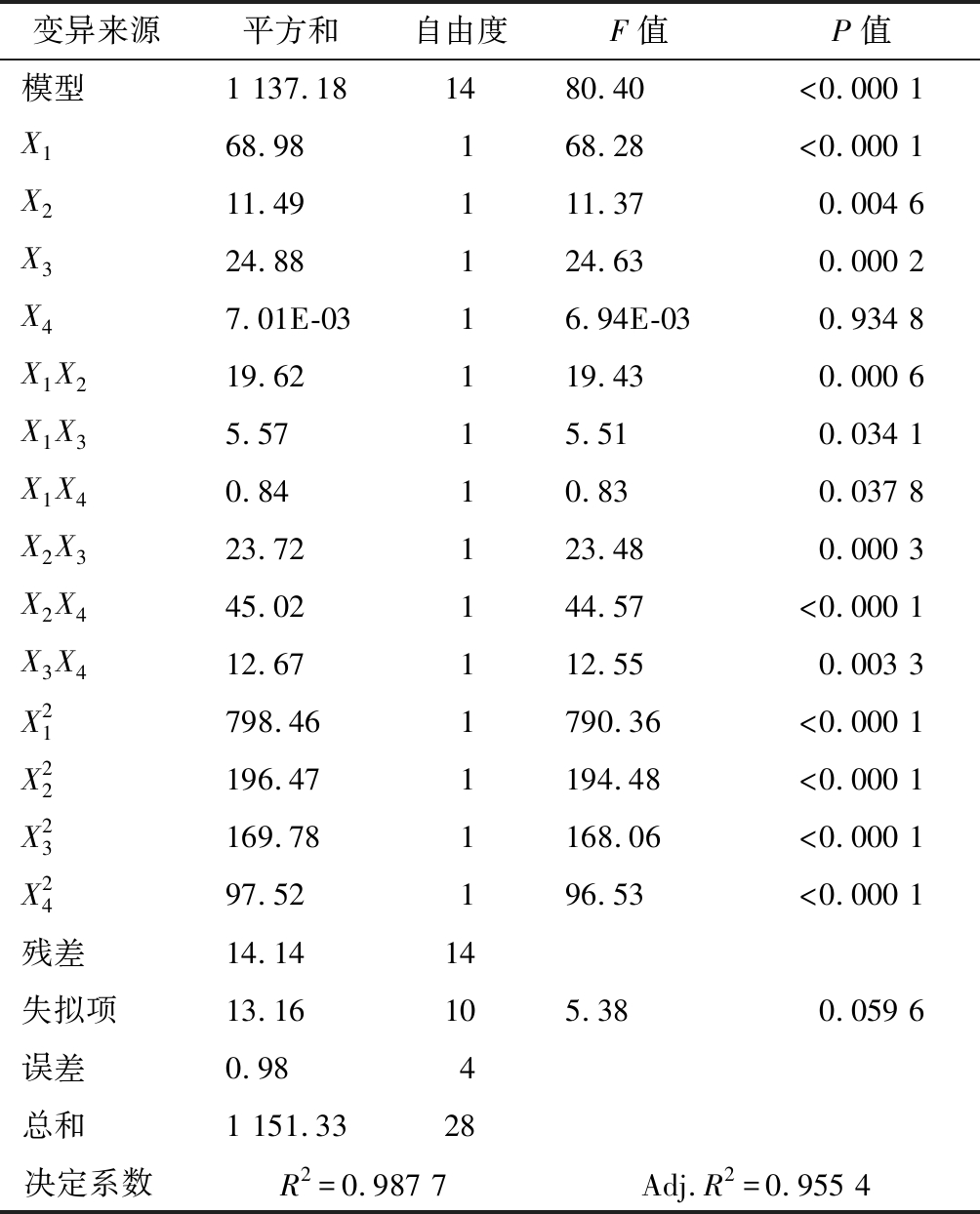
变异来源平方和自由度F值P值模型1 137.181480.40<0.000 1X168.98168.28<0.000 1X211.49111.370.004 6X324.88124.630.000 2X47.01E-0316.94E-030.934 8X1X219.62119.430.000 6X1X35.5715.510.034 1X1X40.8410.830.037 8X2X323.72123.480.000 3X2X445.02144.57<0.000 1X3X412.67112.550.003 3X21798.461790.36<0.000 1X22196.471194.48<0.000 1X23169.781168.06<0.000 1X2497.52196.53<0.000 1残差14.1414失拟项13.16105.380.059 6误差0.984总和1 151.3328决定系数 R2=0.987 7Adj.R2=0.955 4
结合表1和表4数据可知,以柠檬籽油脱苦率为响应值的多元二次方程整体和各主要因素均具有较高的显著性,失拟项不显著,决定系数高,说明方程拟合程度好,可直接用于柠檬籽油复合脱苦工艺的评价和优化。
2.3 模型分析
通过Design Expert 10.0.7软件完成以柠檬籽油脱苦率为响应值的4因素3水平响应曲面和等高线图,结果见图1。等高线图可用于评价各因素间交互作用的强弱,曲面图可确定各因素的最佳水平范围[21-22]。α-L-鼠李糖苷酶不仅能水解苦素类物质,而且对残留的呈苦味的柚皮苷亦具有较强水解能力[23];碱性白土则可通过氢键和范德华力吸附柠檬籽油中的苦味物质[24]。在本研究中,考虑到酶解和吸附脱苦工艺上的特点以及因素之间交互作用的显著性,本部分主要分析α-L-鼠李糖苷酶添加量(X1)、酶解温度(X2)和酶解时间(X3)3因素之间以及α-L-鼠李糖苷酶添加量(X1)和碱性白土用量(X4)之间的交互作用。
由图1-a可知,随着α-L-鼠李糖苷酶和酶解温度的增加,柠檬籽油的脱苦率呈先上升再降低的趋势,当α-L-鼠李糖苷酶用量为0.08%~0.10%、酶解温度为45~55 ℃时,响应值处于峰值。α-L-鼠李糖苷酶和酶解温度的曲面图形态平缓,等高线图呈微椭圆形,暗示此2因素的水平交互作用显著(P=0.000 6)。
由图1-b可知,当其他条件不变时,不断增加α-L-鼠李糖苷酶添加量和碱性白土用量,脱苦率先快速升高后缓慢降低,α-L-鼠李糖苷酶用量为0.08%~0.10%,碱性白土用量在4%左右时,脱苦率较高。等高线呈现微椭圆形,表明二者交互作用明显,具有显著性(P=0.034 1)。
随着α-L-鼠李糖苷酶用量和酶解时间逐渐增加,总脱苦率(响应值)先缓慢增加再缓慢下降,酶解时间在3~5 h时,脱苦率有明显峰值;等高线图呈椭圆形,交互作用显著(P=0.037 8,图1-c)。如图1-d所示,该响应曲面相对比较平缓,说明酶解温度和时间的交互作用显著(P=0.000 3),说明在不改变α-L-鼠李糖苷酶添加量的基础上,酶解温度和酶解时间对总脱苦率的影响相对较小。
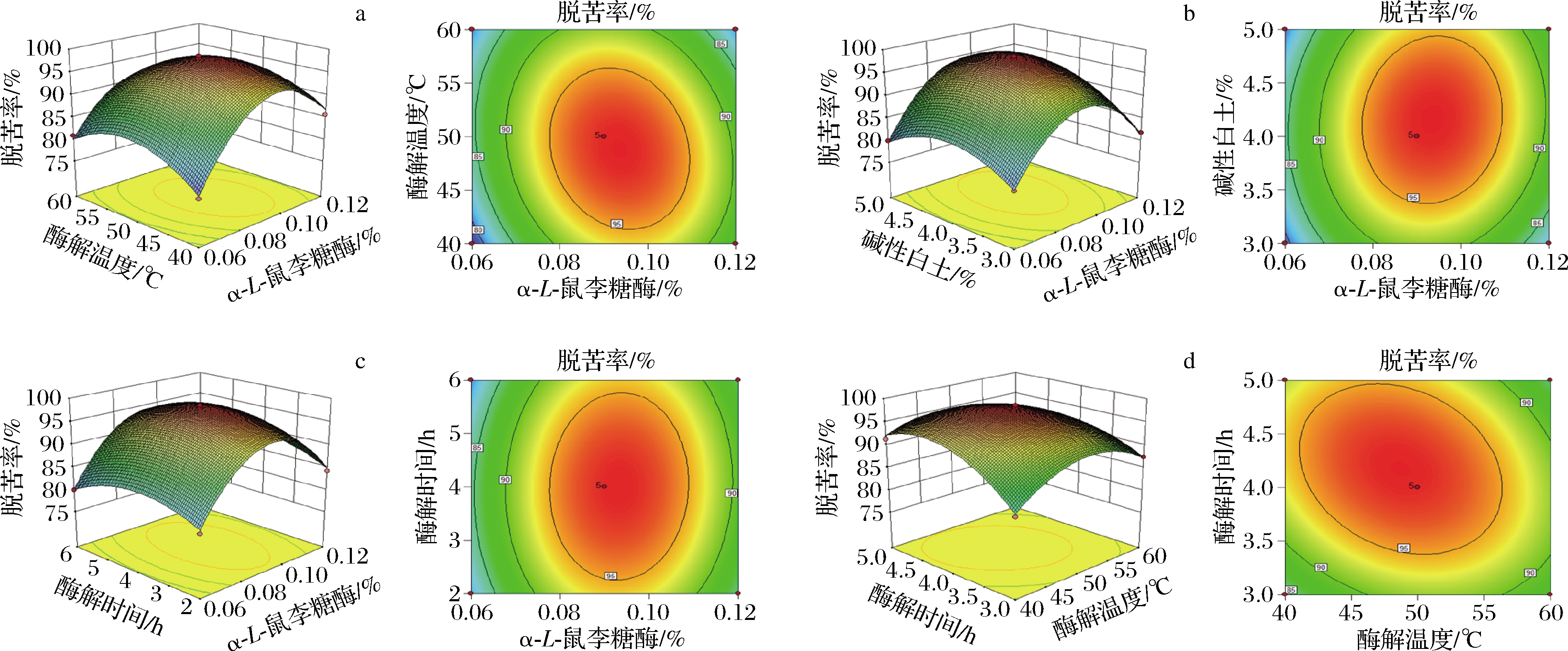
a-α-L-鼠李糖酶与酶解温度的交互关系;b-α-L-鼠李糖酶与碱性白土的交互关系; c-α-L-鼠李糖酶与酶解时间的交互关系;d-酶解温度与酶解时间的交互关系
图1 试验交互因素影响柠檬籽油脱苦率提取量的曲面图和等高线图
Fig.1 Surface and contour plots of experimental interaction factors affecting debittering efficiency of lemon seed oil
2.4 最优参数的确定和验证
以获得柠檬籽油脱苦率最高值为目的,应用Design Expert 10.0.7软件对影响柠檬籽油脱苦率较显著的α-L-鼠李糖苷酶添加量、酶解温度、酶解时间和碱性白土用量等因素各实际水平值的四元二次回归方程进行求解。此外,根据二水平Plaktett-Burman试验,其余因素的最优水平为:添加β-D-葡萄糖苷酶0.1%、木瓜蛋白酶0.02%,活性炭颗粒0.5%,硅酸镁1%,硅胶粉0.6%,吸附时间30 min。结果显示,当α-L-鼠李糖苷酶添加量0.092%、酶解温度46.080 ℃、酶解时间4.137 h、碱性白土用量4.083%,脱苦率有最大值(97.63±2.31)%。为了适用于实际生产,将参数校正至α-L-鼠李糖苷酶添加量0.09%、酶解温度 46 ℃、酶解时间为4.1 h、碱性白土用量为4.1%。根据上述因素水平重复3次验证试验,结果显示柠檬籽油脱苦率为(98.86±1.96)%,较预测值相对误差为+1.23%,无显著差异(P>0.05),说明预测模型具有较高精准性。
2.5 经不同脱苦处理的柠檬籽油理化指标分析
由表5可知,采用冷榨工艺制备的初榨原油澄清度低且类柠檬苦素类物质含量较高,表明冷榨柠檬籽油中存在较多杂质和呈苦物质从而影响油脂品质。各脱苦处理均可显著(P<0.05)降低柠檬籽油不溶性杂质、柠檬苦素和诺米林含量,提高澄清度和生育酚含量,消除氰化物残留,表明碱性白土吸附或复合酶解的脱苦工艺可有效改善柠檬籽油耐贮性和安全性,提高油脂功能性。其中,酶解-吸附复合脱苦法较单一的酶解或吸附脱苦法更为显著(P<0.05)地降低了柠檬籽油中柠檬苦素和诺米林含量,减少了呈苦物质在油脂中的富集。酸价、过氧化值、碘值和皂化值是油脂主要品质指标;在榨油过程中,由于温度、脂肪酶和氧气的影响,会导致少量甘油三酯被分解成脂肪酸并发生氧化作用,使油脂中游离羧基含量(酸价)和过氧化物含量(过氧化值)上升,口感下降;碘价表示了油脂不饱和程度,而皂化值反映了油脂脂肪酸碳链的长度[25]。酶解-吸附复合脱苦法较单一处理更为显著(P<0.05)地降低了冷榨柠檬籽油的酸价和过氧化物值,改善了油脂综合品质,成品符合GB 2716—2018《食品安全国家标准植物油》中对酸值限量的强制要求;复合脱苦法也明显提升了冷榨柠檬籽油碘价,表明该法维持了油脂不饱和程度;各脱苦工艺对皂化值无显著影响,说明脱苦工艺未对油脂产生明显裂解作用。因此,经酶解-吸附复合脱苦法处理的柠檬籽油中各项品质指标均较单一处理有显著提升,说明酶解-吸附复合脱苦油具有较高的综合品质。参考压榨花生油质量等级指标的设定值[26],本研究涉及的冷榨制备的脱苦柠檬籽油已达到二级压榨油质量标准,同时未检出氰苷类物质,可以作为食用油使用。
表5 经不同脱苦处理的柠檬籽油理化指标分析
Table 5 Assessment for physicochemical properties of lemon seed oil following different debittering processes
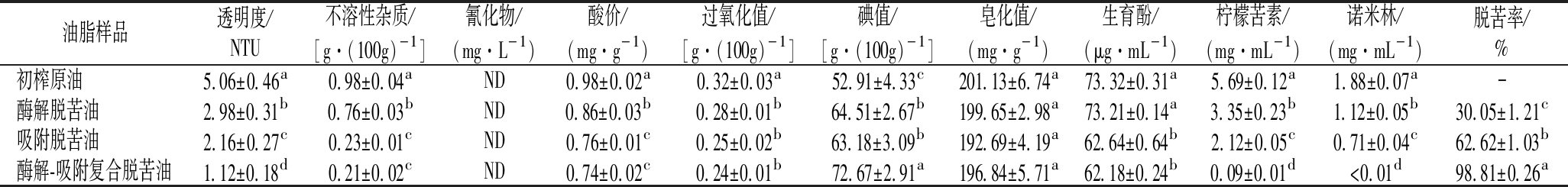
油脂样品透明度/NTU不溶性杂质/[g·(100g)-1]氰化物/(mg·L-1)酸价/(mg·g-1)过氧化值/[g·(100g)-1]碘值/[g·(100g)-1]皂化值/(mg·g-1)生育酚/(μg·mL-1)柠檬苦素/(mg·mL-1)诺米林/(mg·mL-1)脱苦率/%初榨原油5.06±0.46a0.98±0.04aND0.98±0.02a0.32±0.03a52.91±4.33c201.13±6.74a73.32±0.31a5.69±0.12a1.88±0.07a-酶解脱苦油2.98±0.31b0.76±0.03bND0.86±0.03b0.28±0.01b64.51±2.67b199.65±2.98a73.21±0.14a3.35±0.23b1.12±0.05b30.05±1.21c吸附脱苦油2.16±0.27c0.23±0.01cND0.76±0.01c0.25±0.02b63.18±3.09b192.69±4.19a62.64±0.64b2.12±0.05c0.71±0.04c62.62±1.03b酶解-吸附复合脱苦油1.12±0.18d0.21±0.02cND0.74±0.02c0.24±0.01b72.67±2.91a196.84±5.71a62.18±0.24b0.09±0.01d<0.01d98.81±0.26a
注:不同小写字母表示同列数据差异显著(P<0.05),ND表示未检出,-表示无数据(下同)
2.6 脱苦柠檬籽油脂肪酸组成分析
由表6可知,脱苦柠檬籽油中含量前5位的脂肪酸成分为顺,顺-9,12-十八碳二烯酸甲酯[亚油酸(38.50±0.06)%]、顺-9-十八碳一烯酸甲酯[油酸(36.24±0.05)%]、顺,顺,顺-9,12,15-十八碳三烯酸甲酯[α-亚麻酸(10.72±0.05)%]、十六碳酸甲酯[棕榈酸(8.25±0.02)%]和十八碳酸甲酯[硬脂酸(3.64±0.02)%]。同时,脱苦柠檬籽油中不饱和脂肪酸含量占比达到(87.37±0.13)%,与油菜籽、花生、玉米等油料作物油脂中不饱和脂肪酸比例相较无显著差异(P>0.05);但柠檬籽油脂中人体必需脂肪酸(∑EFA)α-亚麻酸和亚油酸总量显著高于(P<0.05)菜籽油或花生油中相关物质含量,表明脱苦工艺未对柠檬籽油脂肪酸含量和不饱和度产生显著不良影响,脱苦柠檬籽油仍具有较强功能性。
表6 柠檬籽油与市售常见食用植物油肪酸组成比较 单位:mg/L
Table 6 Comparison of fatty acid composition between lemon seed oil and common retailed edible vegetable oils
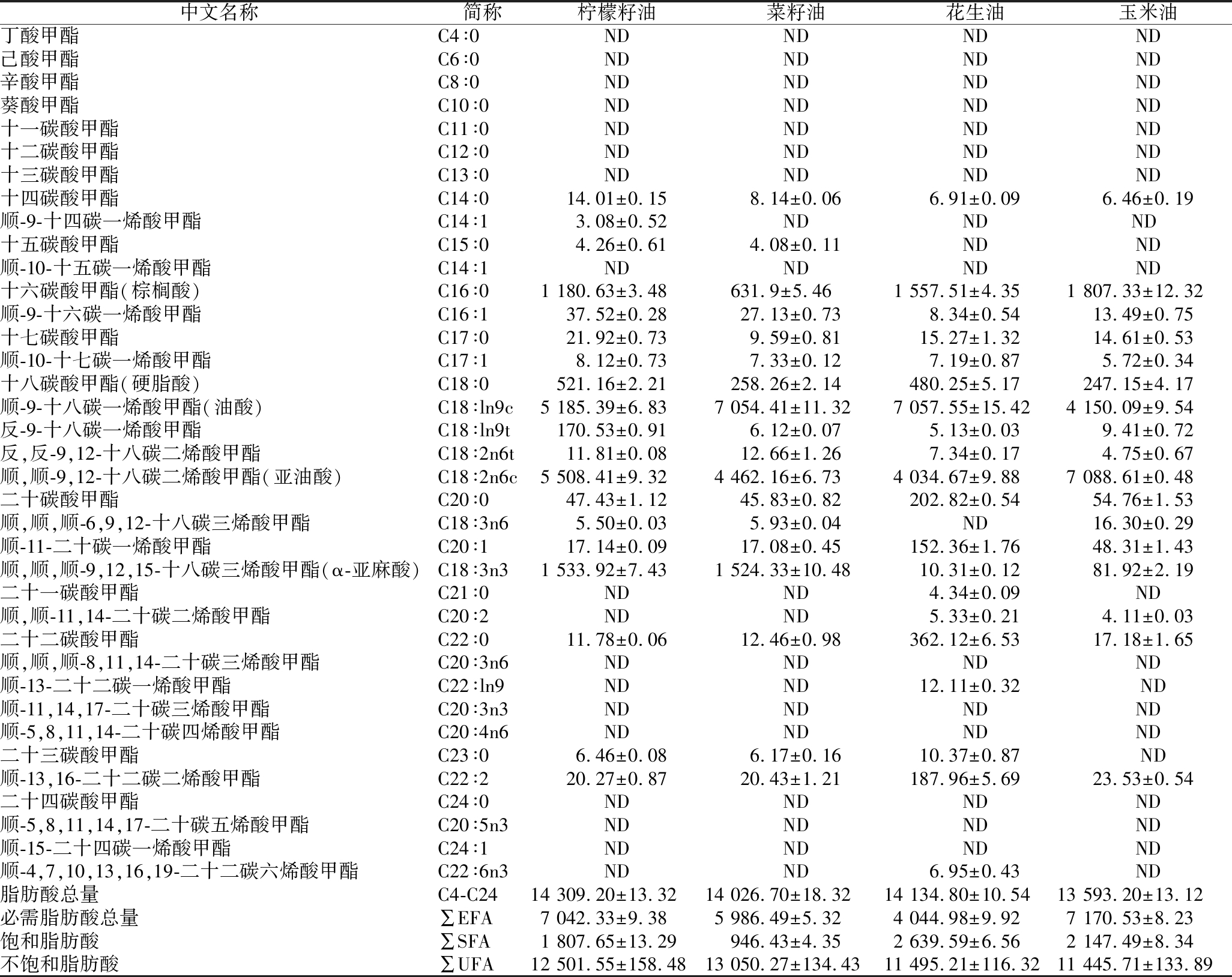
中文名称简称柠檬籽油菜籽油花生油玉米油丁酸甲酯C4∶0NDNDNDND己酸甲酯C6∶0NDNDNDND辛酸甲酯C8∶0NDNDNDND葵酸甲酯C10∶0NDNDNDND十一碳酸甲酯C11∶0NDNDNDND十二碳酸甲酯C12∶0NDNDNDND十三碳酸甲酯C13∶0NDNDNDND十四碳酸甲酯C14∶014.01±0.158.14±0.066.91±0.096.46±0.19顺-9-十四碳一烯酸甲酯C14∶13.08±0.52NDNDND 十五碳酸甲酯C15∶04.26±0.614.08±0.11NDND顺-10-十五碳一烯酸甲酯C14∶1NDNDNDND十六碳酸甲酯(棕榈酸)C16∶01 180.63±3.48631.9±5.461 557.51±4.351 807.33±12.32顺-9-十六碳一烯酸甲酯C16∶137.52±0.2827.13±0.738.34±0.5413.49±0.75十七碳酸甲酯C17∶021.92±0.739.59±0.8115.27±1.3214.61±0.53顺-10-十七碳一烯酸甲酯C17∶18.12±0.737.33±0.127.19±0.875.72±0.34十八碳酸甲酯(硬脂酸)C18∶0521.16±2.21258.26±2.14480.25±5.17247.15±4.17顺-9-十八碳一烯酸甲酯(油酸)C18∶ln9c5 185.39±6.837 054.41±11.327 057.55±15.424 150.09±9.54反-9-十八碳一烯酸甲酯C18∶ln9t170.53±0.916.12±0.075.13±0.039.41±0.72反,反-9,12-十八碳二烯酸甲酯C18∶2n6t11.81±0.0812.66±1.267.34±0.174.75±0.67顺,顺-9,12-十八碳二烯酸甲酯(亚油酸)C18∶2n6c5 508.41±9.324 462.16±6.734 034.67±9.887 088.61±0.48二十碳酸甲酯C20∶047.43±1.1245.83±0.82202.82±0.5454.76±1.53顺,顺,顺-6,9,12-十八碳三烯酸甲酯C18∶3n65.50±0.035.93±0.04ND16.30±0.29顺-11-二十碳一烯酸甲酯C20∶117.14±0.0917.08±0.45152.36±1.7648.31±1.43顺,顺,顺-9,12,15-十八碳三烯酸甲酯(α-亚麻酸)C18∶3n31 533.92±7.431 524.33±10.4810.31±0.1281.92±2.19二十一碳酸甲酯C21∶0NDND4.34±0.09ND顺,顺-11,14-二十碳二烯酸甲酯C20∶2NDND5.33±0.214.11±0.03二十二碳酸甲酯C22∶011.78±0.0612.46±0.98362.12±6.5317.18±1.65顺,顺,顺-8,11,14-二十碳三烯酸甲酯C20∶3n6NDNDNDND顺-13-二十二碳一烯酸甲酯C22∶ln9NDND12.11±0.32 ND顺-11,14,17-二十碳三烯酸甲酯C20∶3n3NDNDNDND顺-5,8,11,14-二十碳四烯酸甲酯C20∶4n6NDNDNDND二十三碳酸甲酯C23∶06.46±0.086.17±0.1610.37±0.87 ND顺-13,16-二十二碳二烯酸甲酯C22∶220.27±0.8720.43±1.21187.96±5.6923.53±0.54二十四碳酸甲酯C24∶0NDNDNDND顺-5,8,11,14,17-二十碳五烯酸甲酯C20∶5n3NDNDNDND顺-15-二十四碳一烯酸甲酯C24∶1NDNDNDND顺-4,7,10,13,16,19-二十二碳六烯酸甲酯C22∶6n3NDND6.95±0.43ND脂肪酸总量C4-C2414 309.20±13.3214 026.70±18.3214 134.80±10.5413 593.20±13.12必需脂肪酸总量∑EFA7 042.33±9.385 986.49±5.324 044.98±9.927 170.53±8.23饱和脂肪酸∑SFA1 807.65±13.29946.43±4.352 639.59±6.562 147.49±8.34不饱和脂肪酸∑UFA12 501.55±158.4813 050.27±134.4311 495.21±116.3211 445.71±133.89
利用RGui语言对脱苦柠檬籽油和其他3种常见食用油脂肪酸原始数据进行主成分分析,得到特征值、主成分方差贡献率和累计贡献率,以及分析得到不同品种植物油得分图,如图2所示。花生油与PC1高度正相关,柠檬籽油与PC1呈现负相关,且PC1的方差贡献率为51.996%,表明PC1对4种植物油脂肪酸的综合评价影响最大。玉米油在PC2中较高,PC2的方差贡献率为30.649%,则PC2综合评价影响也较高。图中不同品种植物油距离越近,则表示品种中植物油组成的相似度越高[27];根据脱苦柠檬籽油、菜籽油、花生油和玉米油中脂肪酸的组成指标进行分析,表明脱苦柠檬籽油与其他植物油之间的脂肪酸组成特征较为类似,其中脱苦柠檬籽油和菜籽油距离最近,说明4种脂肪酸的组成差异最小。
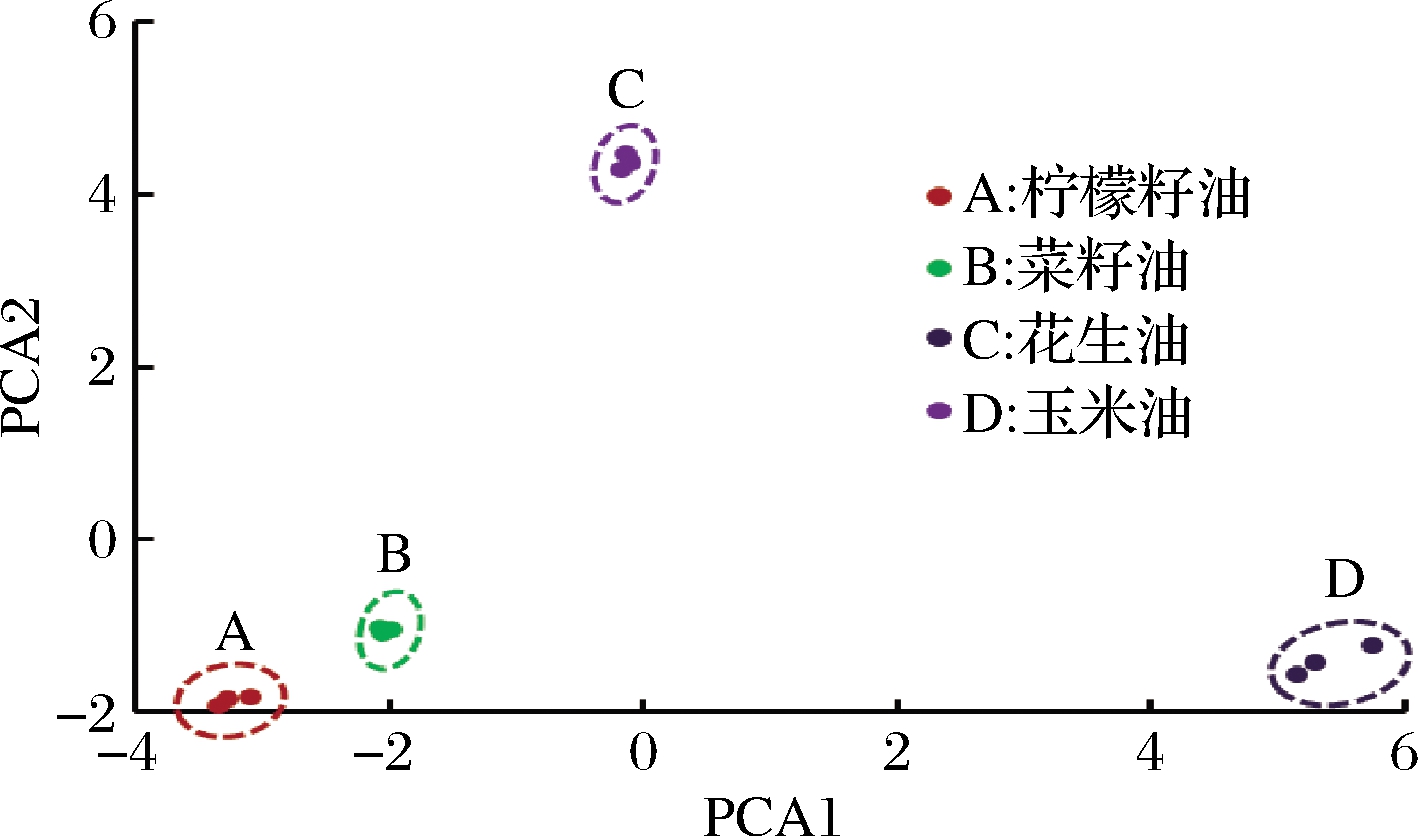
PC1-51.996%;PC2-30.649%
图2 不同品种植物油得分图
Fig.2 Score map of different varieties of vegetable oil
图3可直观反映脱苦柠檬籽油与其他常见植物油脂肪酸的相关系数的差异,其中主要反映在C14∶0与C14∶1呈强正相关(R2=0.95~1.00),C15∶0与C18∶2n6t 呈强负相关;棕榈酸(C16∶0)与C17∶0呈现强正相关,硬脂酸(C18∶0)与其他成分均无显著相关性;油酸(C18∶ln9c)与其他成分呈现弱正相关性,但与C16∶0,C17∶0呈现强负相关性;亚油酸(C18∶2n6c)与C17∶1 呈现强负相关性;α-亚麻酸(C18∶3n3)与C15∶0、C16∶1和C18∶2n6t均呈现强正相关性。这些数据表明,当脱苦柠檬籽油不饱和脂肪酸含量发生变化时,油脂各主要脂肪酸含量均会发生明显变化,说明柠檬籽油较易发生氧化且进程极快。因此,抑制柠檬籽油的氧化是延长该油脂贮存和零售周期的首要考虑因素。
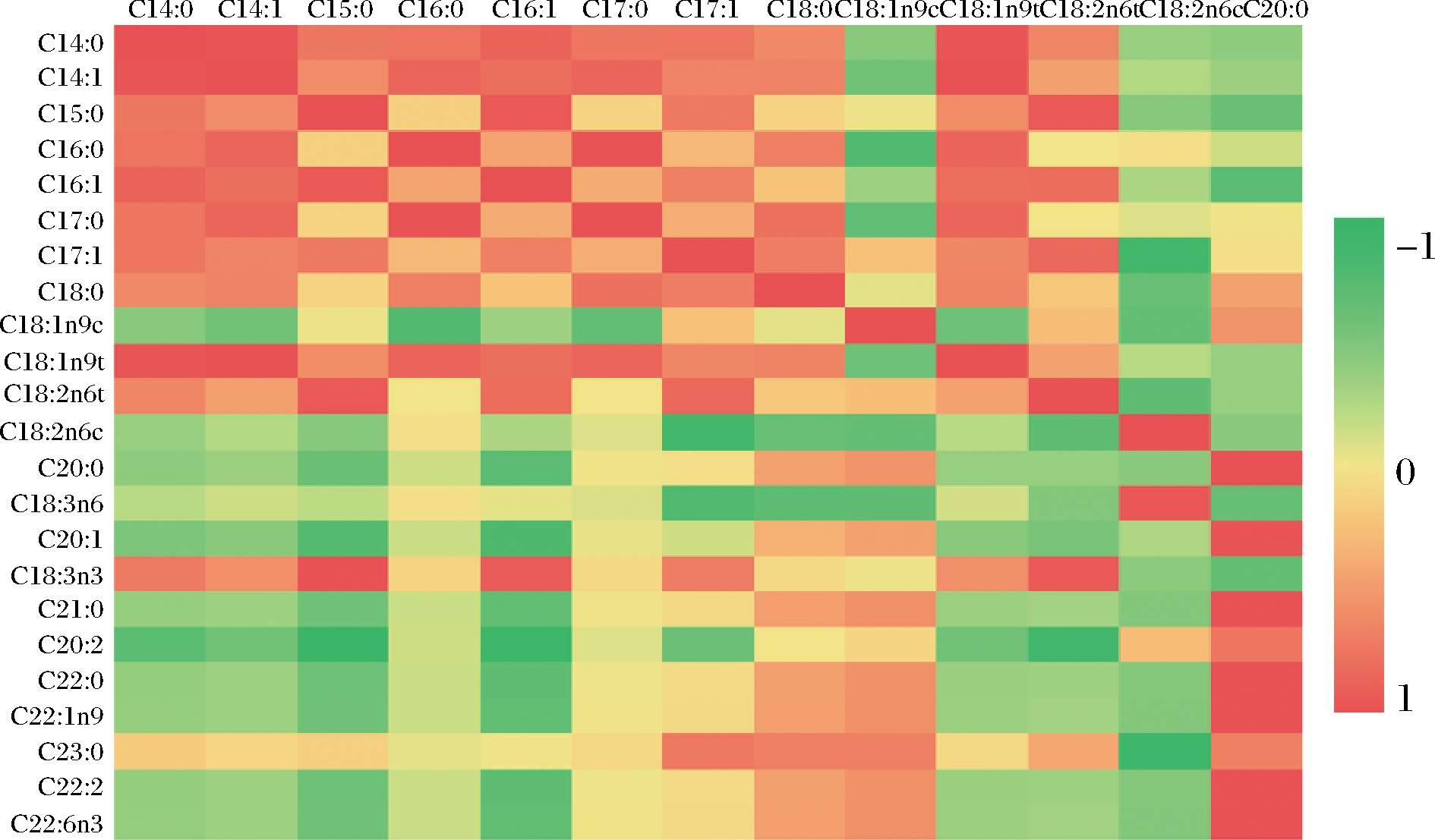
图3 柠檬籽油与其他常见植物油脂肪酸的相关系数的 丰度热图
Fig.3 Heatmap of correlation coefficients matrix of fatty acids in lemon seed oil or common retailed edible vegetable oils
3 结论
冷榨制油法可最大程度保留植物油脂风味和营养价值,但也容易带入脂溶性杂质而影响油脂品质。本研究中,冷榨后的柠檬籽油经酶解-吸附复合脱苦后,油脂澄清度及各项品质指标均有明显改善,且苦素类物质含量也显著下降,产品达到二级食品油标准。
2水平Plaktett-Burman试验筛选出影响柠檬籽油酶解-吸附复合脱苦法效率的主要因素有α-L-鼠李糖苷酶添加量、碱性白土用量、酶解时间和酶解温度。响应面分析得出该复合脱苦法最优参数为:α-L-鼠李糖苷酶添加量0.092%(质量分数)、酶解温度46.080 ℃、酶解时间为4.137 h、碱性白土添加量4.083%(质量分数),在该参数下,柠檬籽油脱苦率可达(97.63±2.31)%。
脱苦柠檬籽油中不饱和脂肪酸含量占比达到(87.37±0.13)%,且∑EFA占比高于市售菜籽油或花生油,同时富含生育酚,体现了较高的功能性。此外,脱苦柠檬籽油与其他植物油之间的脂肪酸组成特征较为类似,但脱苦柠檬籽油中不饱和脂肪酸与其余脂肪酸的相关度高,说明不饱和脂肪酸含量的变化易引起油脂脂肪酸组成的改变,从而可能影响油脂品质的稳定性,这暗示柠檬籽油产品一旦发生过氧化反应,其品质劣变速率较其他油脂快。因此,需采取附加措施(如充氮包装、添加抗氧化剂等)加强对柠檬籽油产品的保鲜,防止油脂在贮运和零售环节出现不良过氧化反应。
[1] DUBEY A K, SHARMA R M.Effect of rootstocks on tree growth, yield, quality and leaf mineral composition of lemon (Citrus limon (L.) Burm.)[J].Scientia Horticulturae, 2016, 200:131-136.
[2] GUNESER B A, YILMAZ E.Bioactives, aromatics and sensory properties of cold-pressed and hexane-extracted lemon (Citrus limon L.) seed oils[J].Journal of the American Oil Chemists′ Society, 2017, 94(5):723-731.
[3] 张放. 全球柠檬来檬生产与鲜果贸易现状[J].中国果业信息, 2019, 36(8):24-30.
ZHANG F.Global lemon production and fresh fruit trade[J].China Fruit News, 2019, 36(8):24-30.
[4] EMIN Y, BUKET A G.Cold pressed versus solvent extracted lemon (Citrus limon L.) seed oils:Yield and properties[J].Journal of Food Science and Technology, 2017, 54(7):1 891-1 900.
[5] RAO J, MCCLEMENTS D J.Impact of lemon oil composition on formation and stability of model food and beverage emulsions[J].Food Chemistry, 2012, 134(2):749-757.
[6] YU L L, ZHOU K K, PARRY J.Antioxidant properties of cold-pressed black caraway, carrot, cranberry, and hemp seed oils[J].Food Chemistry, 2005, 91(4):723-729.
[7] GRAJZER M, SZMALCEL K, KUZMINSKI L, et al.Characteristics and antioxidant potential of cold-pressed oils-possible strategies to improve oil stability[J].Foods, 2020, 9(11):1 630-1 640.
[8] TUNDIS R, LOIZZO M R, MENICHINI F.An overview on chemical aspects and potential health benefits of limonoids and their derivatives[J].Critical Reviews in Food Science and Nutrition, 2014, 54(2):225-250.
[9] MANNERS G D.Citrus limonoids:Analysis, bioactivity, and biomedical prospects[J].Journal of Agricultural and Food Chemistry, 2007, 55(21):8 285-8 294.
[10] 王松林, 彭荣, 崔榕, 等.类柠檬苦素生物转化与脱苦研究进展[J].食品科学, 2015, 36(9):279-283.
WANG S L, PENG R, CUI R.Biotransformation and debittering of limonoids:An overview[J].Food Science, 2015, 36(9):279-283.
[11] PURI M, MARWAHA S S, KOTHARI R M, et al.Biochemical basis of bitterness in citrus fruit juices and biotech approaches for debittering[J].Critical reviews in biotechnology, 1996, 16(2):145-155.
[12] ZHANG J, YANG Z, LIANG Y, et al.Effects of postharvest time, heat treatment, pH and filtration on the limonin content in Newhall navel orange (Citrus sinensis Osbeck cv.Newhall) juice[J].Molecules, 2018, 23(10):2 691-2 700.
[13] 汪开拓, 王文重, 朱克迪, 等.柑橘皮渣超声波辅助酶解工艺的建立及其优化[J].食品科技, 2016, 41(10):177-183.
WANG K T, WANG W C, ZHU K D, et al.Establishment and optimization of the process in ultrasonic-assisted enzymatic hydrolysis of citrus pomace[J].Food Science and Technology, 2016, 41(10):177-183.
[14] 汪开拓, 代领军, 张帮奎, 等.一种冷榨制备脱苦柠檬籽油的加工工艺:中国, CN107794114A[P].2018-03-13.
WANG K T, DAI L J, ZHANG B K.et al.A processing technology for preparing debittered lemon seed oil by cold pressing:China, CN107794114A[P].2018-03-13.
[15] FAN J P, YUAN T T, YU J X, et al.Determination and thermodynamic analysis of the solubility of limonin in eight organic solvents and ethyl acetate+2-propanol binary solvents from 283.2 to 323.2 K[J].Journal of Chemical and Engineering Date, 2018, 63(3):642-650.
[16] 刘伟, 单杨, 李高阳, 等.酸橙汁苦味去除工艺优化[J].中国食品学报, 2015, 15(12):134-142.
LIU W, SHAN Y, LI G Y, et al.Optimization of the debittering technology of sour orange juice by enzyme[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(12):134-142.
[17] 纪佳璐, 吴莹, 徐斐然, 等.马泡瓜籽油理化特性、组成分析及氧化稳定性[J].食品科学, 2020, 41(21):15-21.
JI J L, WU Y, XU F R, et al.Physicochemical characteristics and oxidative stability of Cucumis bisexualis seed oil[J].Food Science, 2020, 41(21):15-21.
[18] THURNHAM D I, DAVIES J A, CRUMP B J, et al.The use of different lipids to express serum tocopherol:Lipid ratios for the measurement of vitamin E status[J].Annals of Clinical Biochemistry, 1986, 23(5):514-520.
[19] 曾小坪, 祝婷婷, 苏沛, 等.使用便携式浊度计测定油脂透明度的方法研究[J].中国油脂, 2018, 48(12):149-151.
ZENG X P, ZHU T T, SU P, et al.Determination of oil transparency using portable turbidimeter[J].China Oils and Fats, 2018, 48(12):149-151.
[20] 邱晓东, 陶宁萍.奇亚籽油的品质评价及其在魔芋糕中对小鼠血糖调节作用的影响[J].食品与发酵工业, 2019, 45(18):87-92.
QIU X D, TAO N P.Quality evaluation of chia seed oil and its effects on blood glucose regulation of mice in konjac cake[J].Food and Fermentation Industries, 2019, 45(18):87-92.
[21] FAR B E, KHOSROUSHAHI A Y, DILMAGHANI A.In silico study of alkaline serine protease and production optimization in Bacillus sp.khoz1 closed bacillus safensis isolated from honey[J].International Journal of Peptide Research and Therapeutics, 2020, 26(4):2 241-2 251.
[22] DU K Z, LI J, WANG L H, et al.Biosurfactant trehalose lipid-enhanced ultrasound-assisted micellar extraction and determination of the main antioxidant compounds from functional plant tea[J].Journal of Separation Science, 2019, 43(4):799-807.
[23] LI L, GONG J, WANG S, et al.Heterologous expression and characterization of a new clade of aspergillus α-L-rhamnosidase suitable for citrus juice processing[J].Journal of Agricultural and Food Chemistry, 2019, 67(10):2 926-2 935.
[24] IDOWU A T, BENJAKUL S.Bitterness of fish protein hydrolysate and its debittering prospects[J].Journal of Food Biochemistry, 2019, 43(9):e12 978.
[25] 李奕, 宋嘉欣, 李昊辰, 等.油莎豆油的脱胶和脱酸工艺[J].食品与发酵工业, 2020, 46(17):158-165.
LI Y, SONG J X, LI H C, et al.Study on degumming and deacidification technology of tiger nut (Cyperus esculentus L.) oil[J].Food and Fermentation Industries, 2020, 46(17):158-165.
[26] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 1534—2017 中华人民共和国国家标准 花生油[S].北京:中国标准出版社, 2017.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, Standardization Administration of China.GB/T 1534—2017 National Standards of the People′s Republic of China Peanut oil[S].Beijing:China Standard Press, 2017.
[27] GRANATO D, SANTOS J S, ESCHER G B, et al.Use of principal component analysis (PCA) and hierarchical cluster analysis (HCA) for multivariate association between bioactive compounds and functional properties in foods:A critical perspective[J].Trends in Food Science and Technology, 2018, 72:83-90.