钙二醇钙二醇(25-hydroxy vitamin D3, 25-OH VD3)是VD3的羟基化衍生物[1],其制剂产品在临床上主要对慢性肾脏疾病、高血糖症、胆汁淤积性肝病有预防作用,并且可以治疗老年骨质疏松症,因此有较好的发展前景[2-4]。25-OH VD3的制备方法主要有化学合成法及微生物转化法,微生物转化法因其高选择性、作用温和等优点,引起了诸多学者的关注[5-6]。在微生物中,一般通过VD3羟化酶(VD3 hydroxylase,Vdh)对VD3进行羟基化,使无生物活性的脂溶性激素原VD3转化25-OH VD3,进而发挥其生物活性[7-9]。
Vdh基因最初发现于一种稀有的放线菌-自养无支梭菌(Pseudonocardia autotrophica)中,该菌株具备将VD3羟化为25-OH VD3的能力[10-11]。KANG等[12]利用Pseudonocardia sp.KCTC 1029BP的细胞作为全细胞催化剂转化VD3,成功制备出61.87 mg/L的25-OH VD3,但是由于野生菌转化时间长达9 d,且产物种类众多,不利于后续分离纯化。ABDULMUGHNI等[13]采用基因工程的方法异源表达Vdh,在巨大芽孢杆菌MS941中使用牛肾上腺毒素还原酶和肾上腺毒素体外系统建立了转化VD3的方法,虽然这种方法有效的降低了转化时间,但巨大芽孢杆菌作为宿主菌的安全问题有待进一步探讨。
本研究选择枯草芽孢杆菌(Bacillus subtilis)作为VD3羟化酶的宿主,其属于食品级安全微生物(generally recognized as safe,GRAS)[14],而且生长条件简单,易于培养,周期短,便于工业上大规模的高密度发酵应用生产,广泛应用于食品及医药等领域[15]。本工作首先构建了重组枯草芽孢杆菌Bacillus subtilis WB600/pMA5-vdh,采用CO差光谱法对表达后的酶进行酶活力检测。进一步利用枯草芽孢杆菌全细胞催化系统合成25-OH VD3,并对其进行鉴定。该方法创新性地将枯草芽孢杆菌全细胞催化系统应用于25-OH VD3的合成,同时优化全细胞转化的条件,提高了25-OH VD3的转化率,这为合成安全的25-OH VD3提供了新的思路。
1 材料与方法
1.1 材料与试剂
VD3、25-OH VD3,阿拉丁(上海)有限公司;连二亚硫酸钠(Na2S2O4)、2-羟丙基-β-环糊精、溶菌酶、乙酸乙酯、乙醇,国药集团化学试剂有限公司;限制性核酸内切酶(NdeⅠ,MluⅠ)、T4 DNA连接酶,美国Thermo Fisher公司;2×Taq PCR MasterMix、2×Pfu PCR MasterMix,杭州宝赛公司;质粒DNA提取试剂盒、DNA纯化试剂盒、DNA凝胶回收试剂盒,康宁生命科学有限公司(上海);卡那霉素、氨苄青霉素,美国Sigma公司;蛋白胨、酵母粉、琼脂粉,英国OXOID公司;其他试剂均为国产或进口分析纯。
VD3溶液配方:先用乙醇溶液溶解,再用灭过菌的0.22 μm的有机膜进行过滤,加入2-羟丙基-β-环糊精用作助溶剂,2-羟丙基-β-环糊精因其特有的空腔结构能够把VD3包裹在内,使其在发酵液中达到完全溶解。
1.2 仪器与设备
A-5082酶标仪,TECAN公司;525BR蛋白电泳仪,美国Bio Rad公司;UV 1800PC紫外可见分光光度计,上海美普达有限公司;JY92-IIDN超声细胞破碎仪,宁波新芝生物科技有限公司;Seven Multi pH计,梅特勒托利多仪器有限公司;Chromaster高效液相色谱仪,日立公司;ZORBAX SB C18色谱柱(250 mm×4.6 mm, 3.5-Micron),美国安捷伦公司;MALDI SYNAPT MS超高效液相色谱串联四极杆飞行时间质谱联用仪,美国沃符世公司。
1.3 实验方法
1.3.1 菌种、质粒、以及培养基
枯草芽孢杆菌Bacillus subtilis 168、枯草芽孢杆菌Bacillus subtilis WB600、大肠杆菌Escherichia.coli JM109与质粒pMA5为本实验室保藏;Vdh(GenBank:BAH58688.1)、启动子bacteriophage SPO1 promoter由上海生工合成。
LB培养基(g/L):蛋白胨10,酵母粉5,氯化钠10。
1.3.2 重组质粒CYP107的构建
通过NCBI数据库获得Vdh(GenBank:BAH58688.1)的基因序列,按照枯草芽孢杆菌密码子偏爱性进行优化合成基因,以其为模板,使用正向引物(CGCCATATGATGGCTTTAACAACTACTGGT)和反向引物(CGACGCGTTTAAGCAGAACGTGGACCCAT)扩增基因序列,引物的两端引入酶切位点NdeⅠ/MluⅠ。通过上述酶切位点连入pMA5中,并转化入E.coli JM109感受态细胞。挑取测序正确的质粒转化到枯草芽孢杆菌WB600细胞中,挑取阳性转化子进行保藏,获得重组枯草芽孢杆菌B.subtilis WB600/pMA5-vdh。
1.3.3 Vdh在枯草芽孢杆菌中进行表达
挑取卡那霉素的LB抗性平板上的重组枯草芽孢杆菌B.subtilis WB600/pMA5-vdh于15 mL、含有卡那霉素(30 μg/mL)的LB培养基中,37 ℃,200 r/min培养12 h。取上述菌液以2%(体积分数)转接至250 mL锥形瓶中的50 mL发酵培养基中,在OD600为0.6时通过添加0.1 mmol/L的异丙基-β-D-硫代吡喃半乳糖吡喃糖苷(isopropyl β-D-thiogalactoside,IPTG)诱导蛋白表达。37 ℃培养24 h后离心(10 000 r/min,10 min,4 ℃)收集细胞并洗涤。使用50 mg溶菌酶在37 ℃静置0.5 h,并使用超声细胞破碎仪在40%的功率下进行超声处理(破碎3 s暂停2 s,工作9 min)。最后通过离心取上清液并进行SDS-PAGE分析,评估目标蛋白的表达性能。
1.3.4 酶活力检测
Vdh属于典型的细胞色素P450酶,是一类含有B型血红素的蛋白超家族[16-18],其还原态可以和CO结合并在450 nm处产生特征吸收峰[19]。根据CO差光谱法检测酶活力[20],将待测样品用0.1 mol/L的磷酸缓冲液(pH 7.4)稀释至蛋白质量浓度约为0.3 g/L,取2 mL样品加入连二亚硫酸钠10 mg,立即混匀,反应5 min后,等量分装到2个离心管中,分别作为对照组和样本组。向样本组缓慢通入CO 2 min,盖紧盖子,稳定10 min,取200 μL加入96孔板中,用酶标仪进行400~500 nm全波长扫描。并根据公式(1)计算P450酶的含量:
(1)
式中:摩尔吸光系数ε=91 L/(mmol·cm),P为蛋白质量浓度,g/L。
1.3.5 全细胞转化
取1 mL种子液接种于50 mL初级转化培养基中,37 ℃、200 r/min培养至OD600为0.6,加入终浓度为0.1 mmol/L的IPTG继续培养,12 h后加入22.5 g/L的2-羟丙基-β-环糊精、18 g/L的葡萄糖溶液,再加入终质量浓度为0.1 g/L的底物VD3,30 ℃、200 r/min 继续转化24 h后4 ℃、10 000 r/min离心10 min得到菌体,菌体用PBS缓冲液洗涤过后,加入0.1 mmol/L的PBS以及溶菌酶37 ℃放置0.5 h,在超声破碎仪下进行破碎,破碎液4 ℃、10 000 r/min离心10 min取上清液与乙酸乙酯按1∶1的体积比混合均匀,4 ℃、10 000 r/min离心5 min后取上层有机相,用旋转蒸发仪进行减压浓缩,浓缩至得到白色粉末,用甲醇溶解后进行HPLC检测。相同条件以等菌体浓度的pMA5菌株单独转化为对照。
1.3.6 产物检测与鉴定
将溶解好的样品用0.22 μm的有机膜过滤后,在WATERS ACQUITY UPLC色谱仪上使用BEH C18(2.1 mm×150 mm, 1.7 μm)分析柱对样品进行分析,流动相由80%(体积分数)的乙腈水溶液组成。在265 nm处检测底物,以WATERS ACQUITY PDA为检测器,柱温为45 ℃,流速为0.3 mL/min,进样量为5 μL。
为进一步确定产物的分子质量,利用超高效液相色谱串联四极杆飞行时问质谱联用仪(美国沃符世公司)获取样品的质谱图。采用MassLynx V4.1(Waters, USA)对原始数据进行分析。
1.3.7 全细胞转化过程中发酵条件的优化
在初始转化条件为接种量2%,接种后 12 h 加底物质量浓度为0.1 g/L的VD3,以及18 g/L的葡萄糖和22.5 g/L的2-羟丙基-β-环糊精基础上,通过单因素试验分别考察转化温度(26~34 ℃)、初始pH(pH 5.0~9.0)、发酵时间、摇床转速(160~240 r/min)对转化率的影响。利用单因素实验优化后的转化温度、初始pH、发酵时间以及摇床转速筛选到的条件进行底物转化,确定最高转化率。
2 结果与分析
2.1 Vdh基因Vdh的克隆与表达
如图1所示,构建质粒pMA5-Vdh。首先,从NCBI数据库中检索到Vdh的序列,长度为1 212 bp,合成该序列并作为模板,进行PCR扩增,电泳结果如图2-a所示,可见特异性条带位置与目标基本一致。构建重组质粒pMA5-vdh重组质粒的大小为8 398 bp;将重组质粒分别用Nde Ⅰ、Mlu Ⅰ双酶切。pMA5-vdh酶切后理论条带大小是1 212和7 186 bp,结果如图2-b所示,电泳条带大小与理论值一致,说明Vdh基因成功插入了表达载体pMA5中,PCR也验证了pMA5-vdh构建的成功。按照方法1.3.3 表达该重组菌,细胞破碎后,SDS-PAGE分析结果见图3,重组菌裂解物上清液在约46 kDa位置表达有明显的蛋白质特征条带,与目标分子质量一致,表明基因Vdh在枯草芽孢杆菌中成功表达。

图1 质粒pMA5-vdh图谱
Fig.1 Construction map of plasmid pMA5-vdh
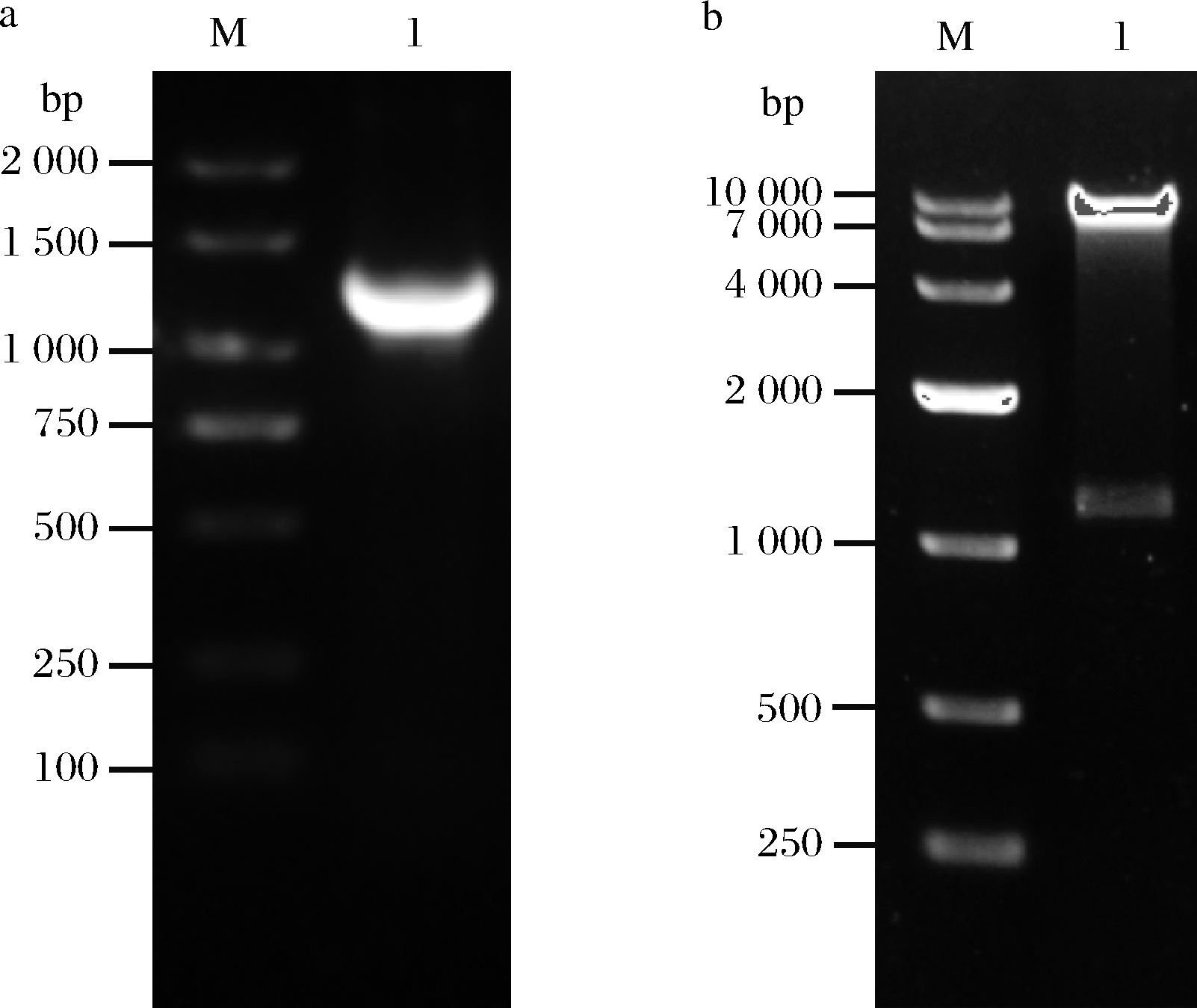
M-DNA marker a-Vdh基因扩增结果;b-重组质粒酶切鉴定
图2 目的基因及重组质粒酶切鉴定电泳结果
Fig.2 Results for agarose gel electrophoresis of target genes and recombination vectors
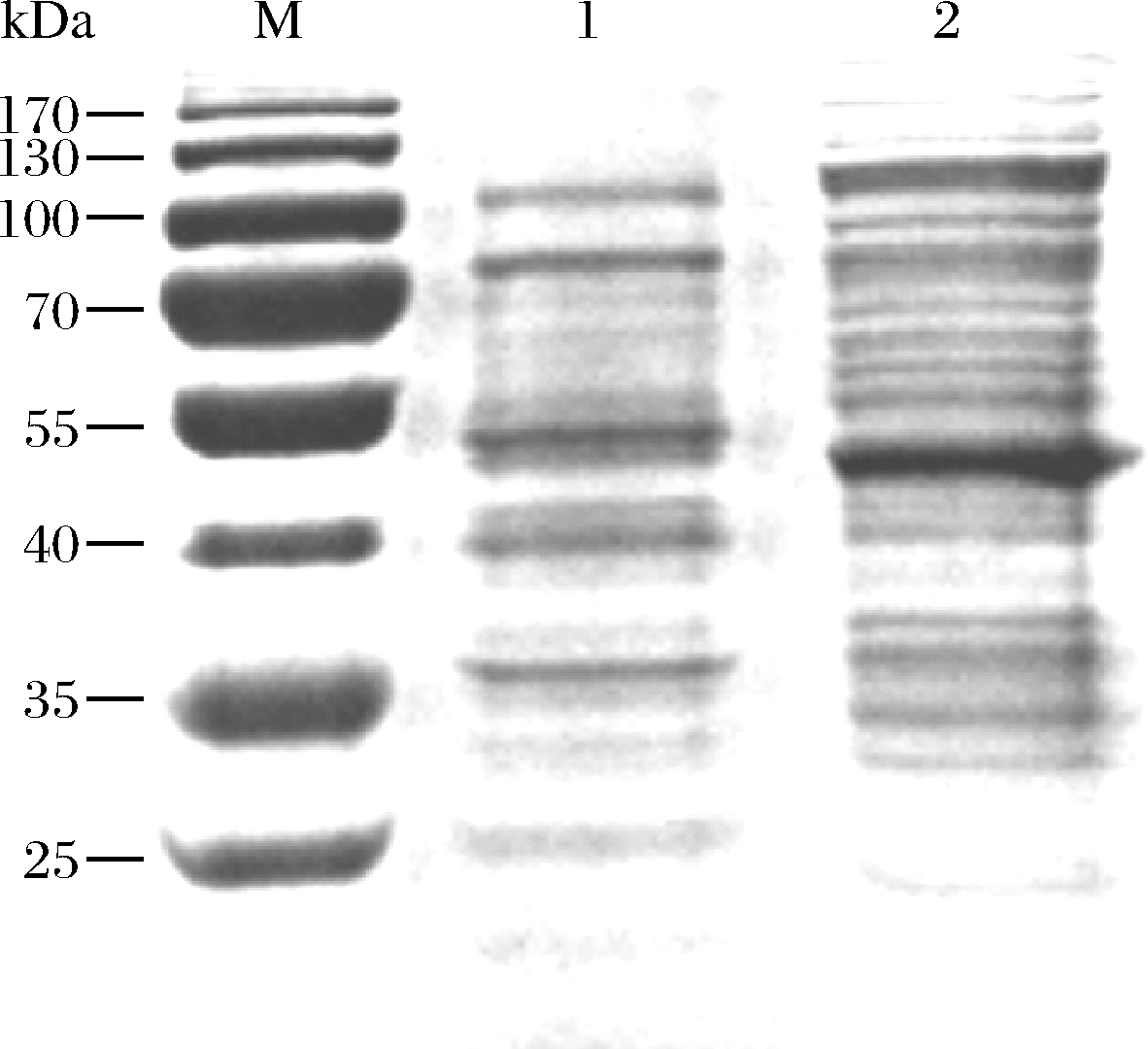
M-标准蛋白marker;1-B.subtilis WB600/pMA5粗酶液; 2-重组菌B.subtilis WB600/pMA5-vdh粗酶液
图3 重组酶的SDS-PAGE结果
Fig.3 SDS-PAGE result of recombination enzyme
2.2 酶的表达与酶活力检测
作为P450超家族成员,Vdh自身含有的亚铁红素辅基可以与CO结合而在450 nm处呈现特殊的光谱吸收峰。根据此原理,对样品进行光谱分析,如图4所示,在420 nm处样品峰值升高,此吸收峰为亚铁红素的低自旋状态所导致,加入强还原剂连二亚硫酸钠后,亚铁血红素基团被还原,从而降低其在420 nm处的吸收峰。样品通入CO后,还原型的Vdh与CO结合并在450 nm处呈现特征吸收峰,从而证实Vdh在本体系中实现活性表达。根据公式(1)计算得,羟基化酶含量为0.56 nmol/g。
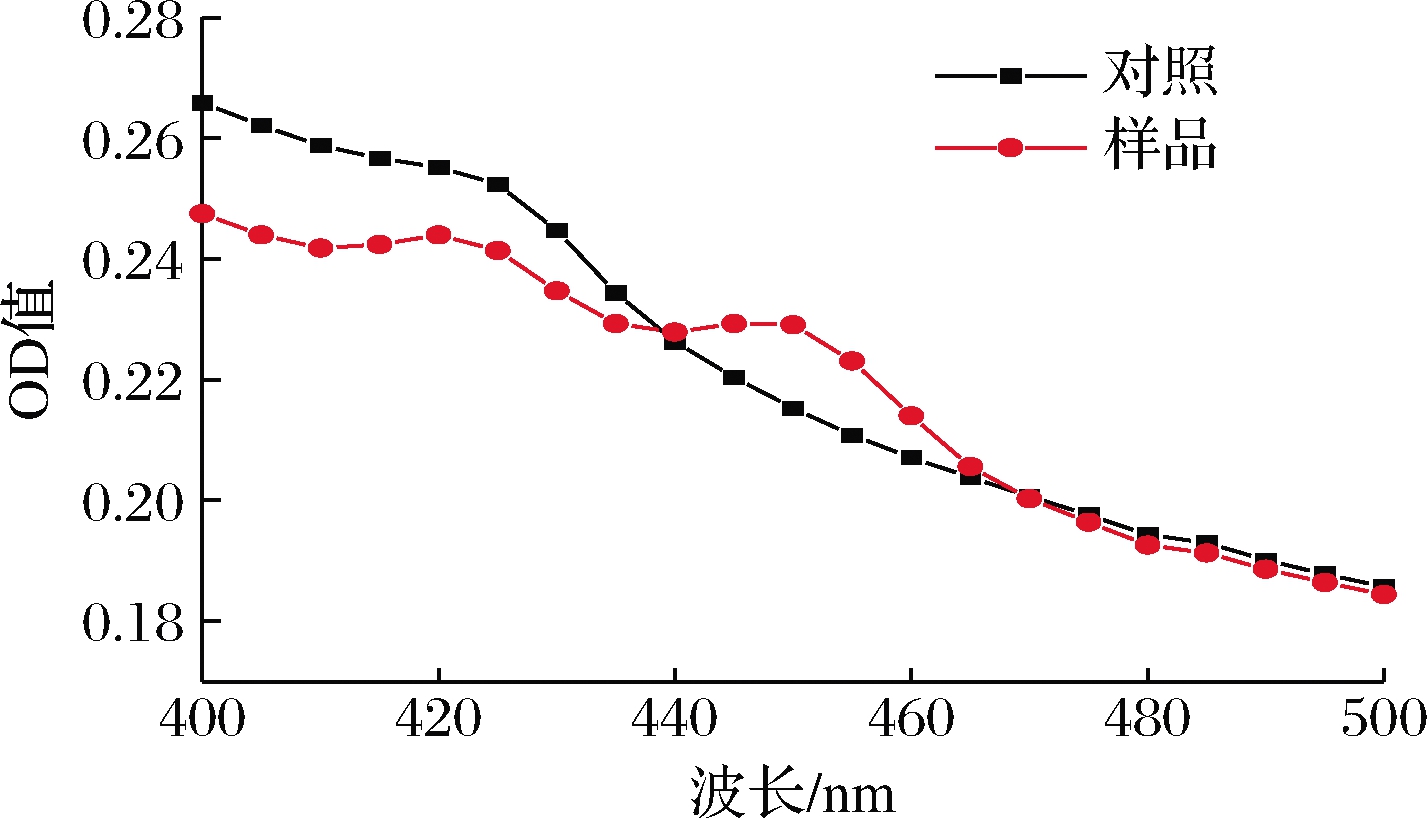
图4 Vdh的酶活力测定
Fig.4 Determination of Vdh enzyme activity
2.3 产物的检测与鉴定
通过Vdh对VD3进行羟基化,可以将底物VD3转化产物25-OH VD3。根据1.3.6所示方法检测底物及产物出峰,如图5所示,在5.29 min亲水性更强的产物洗脱下来,7.58 min底物VD3被洗脱下来,因产物与标样25-OH VD3的出峰时间一致,初步判断其为25-OH VD3。

图5 标样(VD3、25-OH VD3)和样品的液相色谱图
Fig.5 Liquid chromatogram of standard(VD3、25-OH VD3) and sample
进一步使用超高效液相色谱串联四极杆飞行时问质谱联用仪分析样品,目标分析物在ESI+条件下形成[M+H]+的准分子离子峰,产生m/z约401的特征离子碎片,同时产生脱去1个水分子的[M+H-H2O]+碎片离子和脱去2个水分子的[M+H-2H2O]+碎片离子。图6中的准分子离子峰[M+H]+为m/z 401,因此可以确定其相对分子质量为400,与25-OH VD3标样产生的准分子离子峰一致,因此进一步确认VD3可被转化为25-OH VD3。
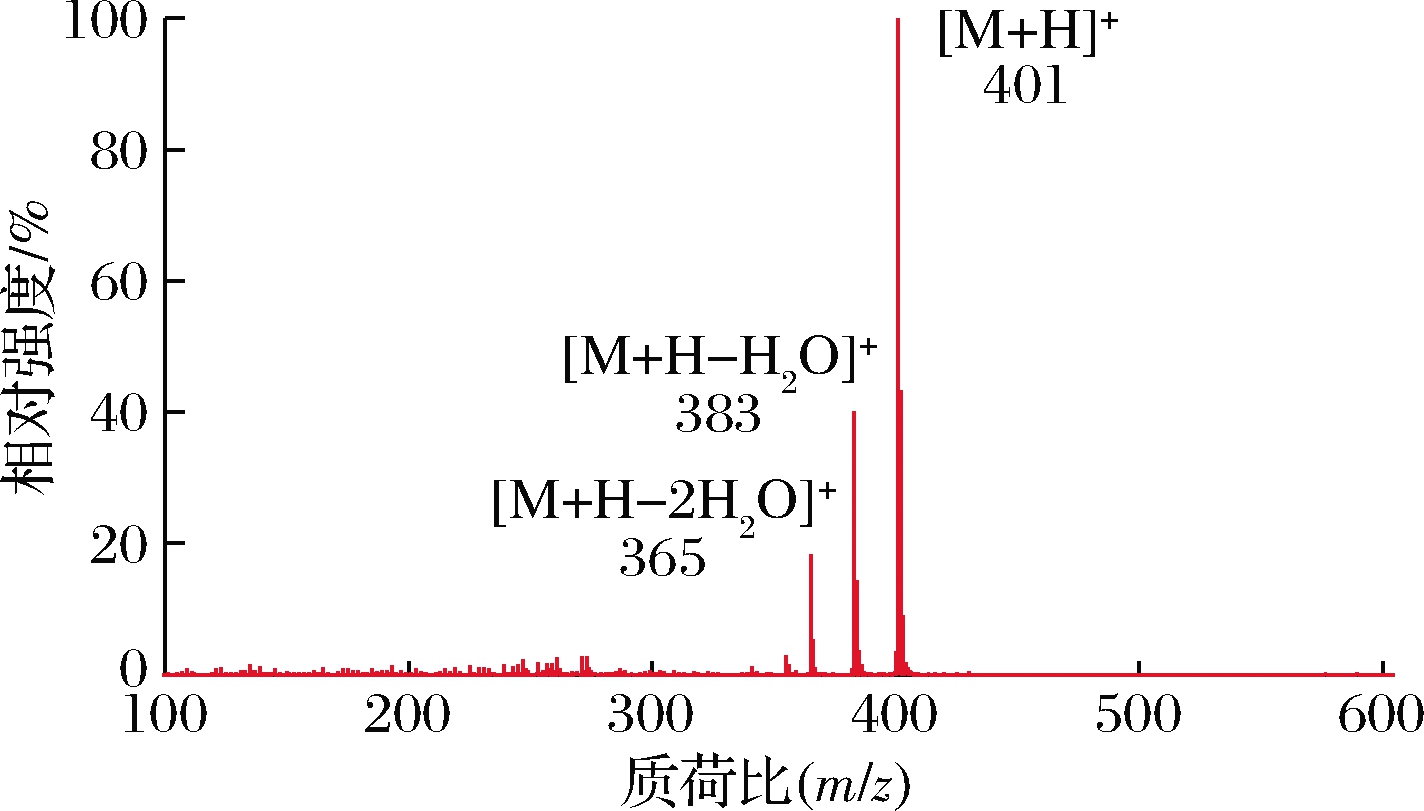
图6 25-OH VD3的ESI+质谱图
Fig.6 ESI+mass spectrum of 25-OH VD3
2.4 全细胞转化过程中发酵条件的优化
2.4.1 发酵温度对转化率的影响
温度是保证酶活性的重要条件,因此在发酵过程中必须保证稳定而合适的温度环境。不同发酵温度会影响产物的转化率,如图7-a所示,随着温度的升高,细胞的生长繁殖加快,细胞内产生的酶随之增多,因此转化率随之升高,在30 ℃达到最高,之后随着温度的升高,转化率逐渐降低,因此选择30 ℃为转化最适温度。
2.4.2 初始pH对转化率的影响
控制一定的pH是保证微生物生长的主要条件之一,pH可使细胞的代谢通路和细胞膜的通透性发生改变,从而影响菌体生长繁殖和发酵产物的合成。不同微生物对pH的要求各不相同,因此,选择合适的pH对微生物发酵具有重要意义。如图7-b所示,25-OH VD3的最佳初始pH为7.0,此时转化率达到最高。
2.4.3 发酵时间对转化率的影响
发酵时间对产物合成的影响也十分显著,因为随着发酵时间的延长,菌体的状态、培养基组分、pH等都会发生变化,因此,对发酵时间进行优化十分必要。如图7-c所示,25-OH VD3在转化48 h后产率达到最高值,培养时间过长反而导致菌体的自溶,所以确定25-OH VD3的转化时间为48 h。
2.4.4 摇床转速对转化率的影响
摇床转速主要通过溶氧量来影响发酵,转速较慢时,发酵液中的溶氧量少,不利于细菌发酵,如果过快则对细菌损伤大,也不利于发酵。如图7-d所示,从160 r/min开始,随着转速的升高,转化率逐渐升高,到220 r/min时转化率达到最高,之后过高的转速反而使转化率下降。
3 结论与讨论
VD类药物中的钙二醇(25-OH VD3)能够调控含钙离子的激素,在生物、食品及医药领域有很高的价值[21]。为建立安全高效的25-OH VD3生物转化合成新工艺,本文构建了Vdh的重组表达菌株Bacillus subtilis WB600/pMA5-vdh,并根据P450家族蛋白的光谱吸收特性,测定了Vdh的酶活力,确定了全细胞转化VD3的方法,在30 ℃、pH 7.0、摇床转速为220 r/min,外加0.1 g/L的VD3反应48 h后,底物转化率可达到10.36%。

a-温度对转化率的影响;b-pH对转化率的影响;c-发酵时间对转化率的影响;d-转速对转化率的影响
图7 不同条件对25-OH VD3转化率的影响
Fig.7 The influence of different conditions on the conversion rate of 25-OH VD3
Vdh在枯草芽孢杆菌中的成功表达将促进未来对VD3羟化酶结构的研究,以了解VD3羟化酶如何与底物接触并进行羟基化,也为25-OH VD3的生物转化工艺提供了借鉴。本研究首次以枯草芽孢杆菌作为底盘细胞构建了25-OH VD3生产途径,相较于ABDULMUGHNI等[21]利用B.megaterium转化VD3得到0.45 g/L的25-OH VD3,本研究得到的25-OH VD3的产量相对较低。这可能是由于枯草芽孢杆菌中所提供的辅因子不足,后续的研究可以对B.subtilis WB600做改造,进一步针对辅酶循环做深入探讨,通过引入NADH来增加辅因子,从而促进25-OH VD3的生成。
[1] WARNKE M, JUNG T, DERMER J, et al.25-Hydroxy vitamin D3 synthesis by enzymatic steroid side-chain hydroxylation with water[J].Angew Chem Int Ed Engl, 2016, 55(5):1 881-1 884.
[2] YASUDA K, ENDO M, IKUSHIRO S, et al.UV-dependent production of 25-hydroxyvitamin D2 in the recombinant yeast cells expressing human CYP2R1[J].Biochem Biophys Res Commun, 2013, 434(2):311-315.
[3] LISAKOVSKA O, SHYMANSKYI I, LABUDZYNSKYI D, et al.Vitamin D auto-/paracrine system is involved in modulation of glucocorticoid-induced changes in angiogenesis/bone remodeling coupling[J].International Journal of Endocrinology, 2020.DOI:10.1155/2020/8237610.
[4] WU P F, ZHANG R F, LUO M, et al.Impaired 25-hydroxylation of vitamin D in liver injury suppresses intestinal paneth cell defensins, leading to gut dysbiosis and liver fibrogenesis[J].American journal of physiology Gastrointestinal and liver physiology, 2020, 319(6):G685-G695
[5] 栗飞红, 陈向东, 汪辉, 等.利用Pseudonocardia sp.微生物转化制备骨化醇类化合物[J].微生物学通报, 2018, 45(10):2 164-2 173.
LI F H, CHEN X D, WANG H, et al.Preparation of calcified alcohols analogues by bioconversion using Pseudonocardia sp.[J].Microbiology China, 2018, 45(10):2 164-2 173.
[6] 苏海林. 甾体衍生物羟基化的生物转化研究进展[J].化工管理, 2020(32):41-42.
SU H L.Research progress in synthesis of hydroxylated steroid derivatives by biotransformation[J].Chemical Enterprise Management, 2020(32):41-42.
[7] FUJII T, FUJII Y, MACHIDA K, et al.Efficient biotransformations using Escherichia coli with tolC acrAB mutations expressing cytochrome P450 genes[J].Bioscience Biotechnology and Biochemistry, 2009, 73(4):805-810.
[8] SAKAKI T, SUGIMOTO H, HAYASHI K, et al.Bioconversion of vitamin D to its active form by bacterial or mammalian cytochrome P450[J].Biochimica et Biophysica Acta, 2011, 1 814(1):249-256.
[9] TANG D D, LIU W, HUANG L, et al.Efficient biotransformation of vitamin D3 to 25-hydroxy vitamin D3 by a newly isolated Bacillus cereus strain[J].Applied Microbiology and Biotechnology, 2020, 104(2):765-774.
[10] FUJII Y, KABUMOTO H, NISHIMURA K, et al.Purification, characterization, and directed evolution study of a vitamin D3 hydroxylase from Pseudonocardia autotrophica[J].Biochemical and Biophysical Research Communications, 2009, 385(2):170-175.
[11] KANG D J, IM J H, KANG J H, et al.Bioconversion of vitamin D3 to calcifediol by using resting cells of Pseudonocardia sp.[J].Biotechnology Letters, 2015, 37(9):1 895-1 904.
[12] KANG D J, IM J H, KANG J H, et al.Whole cell bioconversion of vitamin D3 to calcitriol using Pseudonocardia sp. KCTC 1029BP[J].Bioprocess Biosyst Eng, 2015, 38(7):1 281-1 290.
[13] ABDULMUGHNI A, JOZWIK I K, PUTKARADZE N, et al.Characterization of cytochrome P450 CYP109E1 from Bacillus megaterium as a novel vitamin D3 hydroxylase[J].Journal of Biotechnology, 2017, 243:38-47.
[14] PHAN T T P, TRAN L T, SCHUMANN W, et al.Development of Pgrac100-based expression vectors allowing high protein production levels in Bacillus subtilis and relatively low basal expression in Escherichia coli[J].Microbial Cell Factories, 2015, 14(1):72.
[15] 张大伟, 刘德华, 黄钦钦, 等.食品级高产亮氨酸氨肽酶重组Bacillus subtilis的构建和发酵优化[J].食品与发酵工业, 2020, 46(8):1-6.
ZHANG D W, LIU D H, HUANG Q Q, et al.Construction and fermentation optimization of food-grade recombinant Bacillus subtilis for the production of leucine aminopeptidase[J].Food and Fermentation Industries, 2020, 46(8):1-6.
[16] ROBERTS G A, CELIK A, HUNTER D J B, et al.A self-sufficient cytochrome P450 with a primary structural organization that includes a flavin domain and a[2Fe-2S] redox center[J].Journal of Biological Chemistry, 2003, 278(49):48 914-48 920.
[17] HANNEMANN F, BICHET A, EWEN K M, et al.Cytochrome P450 systems-biological variations of electron transport chains[J].Biochimica et Biophysica Acta-General Subjects, 2007, 1 770(3):330-344.
[18] MELLOR S B, VINDE M H, NIELSEN A Z, et al.Defining optimal electron transfer partners for light-driven cytochrome P450 reactions[J].Metabolic Engineering, 2019, 55:33-43.
[19] YASUTAKE Y, NISHIOKA T, IMOTO N, et al.A single mutation at the ferredoxin binding site of P450 Vdh enables efficient biocatalytic production of 25-hydroxyvitamin D3[J].Chembiochem, 2013, 14(17):2 284-2 291.
[20] OMURA T, SATO R.The carbon monoxide-binding pigment of liver microsomes.i.evidence for its hemoprotein nature[J].The Journal of Biological Chemistry, 1964, 239:2 370-2 378.
[21] ABDULMUGHNI A, ERICHSEN B, HENSEL J, et al.Improvement of the 25-hydroxyvitamin D3 production in a CYP109A2-expressing Bacillus megaterium system[J].Journal of Biotechnology, 2021, 325:355-359.