黑果腺肋花楸(Aronia melanocarpa),简称黑果花楸,果实较小,鲜食口感酸涩,但其含有丰富的多酚、黄酮等生物活性物质,如原花青素、花青素、白藜芦醇、绿原酸等,是抗氧化活性最高的水果之一[1],具有抗菌、抗炎症[2]等作用,可用于保肝、平衡血糖、养心、预防和治疗癌症、治疗消化系统和心血管系统疾病等[3-5]。
发酵果酒的质量取决于它的生物活性成分和风味,生物活性成分的含量不仅与果实本身含量有关,还与酵母菌的代谢相关,花青素与酵母细胞和酵母代谢物相互作用直接影响花青素的含量和组成[6];而风味特征也是果实品种、酵母菌株和酿酒技术条件3个因素之间复杂相互作用的结果[7]。酿酒酵母在酒精发酵过程中除将原料中的糖转化为酒精外,还会产生大量副产物,包括高级醇、乙酸酯、醛、有机酸等,是发酵果酒重要的香气成分,并能够显著影响发酵果酒的感官品质[8]。目前对于黑果花楸的研究有对黑果花楸酚类物质[1, 9]和花青素[10-11]的研究,对黑果花楸营养物质提取纯化[12-13]方法的研究,国内对于采用黑果花楸酿酒方面的研究也有诸多报道,王鹏[14]对浸提型黑果腺肋花楸露酒的浸提工艺进行了研究,于聪等[15]对黑果花楸酒的澄清工艺条件进行了优化,但在采用不同酿酒酵母进行发酵黑果花楸酒方面研究较少,因此通过不同酿酒酵母发酵黑果花楸酒,对其进行生物活性成分、抗氧化能力及香气成分分析,选择进行黑果花楸酒发酵最优酵母具有重要意义。
本研究采用5株酿造葡萄酒常用的酿酒酵母(Saccharomyces cerevisiae)F15、BO213、D254、AC、EC1118发酵生产黑果花楸酒,并对产生的5种黑果花楸酒的生物活性成分含量、抗氧化能力和香气成分及含量进行检测分析,以便选择最适合进行黑果花楸酒发酵的酿酒酵母,为黑果花楸酒的生产提供理论基础。
1 材料与方法
1.1 材料与试剂
原料:黑果腺肋花楸(产地吉林)。
酵母:F15、BO213、D254、AC、EC1118(均为活性干酵母,购于阿里巴巴)。
试剂:氯化钾、乙酸钠、碳酸钠、磷酸二氢钾、磷酸氢二钾、浓盐酸(均为分析纯),国药沪试;Trolox标准品、原花青素B1标准品、反式白藜芦醇标准品(均≧98%),大连美仑生物技术有限公司;荧光素钠(分析纯)、偶氮二异丁脒盐酸盐[2,2′-Azobis(2-methylpropionamidine)dihydrochloride,AAPH](97%)、Folin-Ciocalteu(分析纯)、没食子酸(≧98%),阿拉丁试剂(中国)有限公司。
1.2 仪器与设备
Synergy H4酶标仪,美国伯腾仪器有限公司;紫外可见光分光光度计,上海仪电分析仪器有限公司;安捷伦1260高效液相色谱仪、SB C18色谱柱,美国安捷伦科技公司;气相-高通量飞行时间质谱仪,美国力可公司。
1.3 实验方法
1.3.1 黑果腺肋花楸酒酿造工艺及操作要点
酿造工艺:
黑果腺肋花楸果→果粒分选→破碎打浆→添加浓缩3倍葡萄汁调整糖含量→调整硫含量→添加果胶酶→接入酿酒酵母→发酵(18 ℃)→发酵结束→皮渣分离→添加偏重亚硫酸钾,调整硫含量终止发酵→低温澄清→黑果腺肋花楸酒
操作要点:
(1)浓缩3倍的葡萄汁与黑果腺肋花楸果浆以质量比1∶1混合调整含糖量。
(2)酒精发酵前偏重亚硫酸钾添加量为50 mg/L,果胶酶添加量为0.6 g/L,总糖含量为234 g/L,酵母添加量为500 mg/L。
(3)酵母活化:按酵母与水为1∶10的比例将酵母接种于含有50 g/L的糖水中,35 ℃温和搅拌活化20 min,添加至调整后的黑果腺肋花楸果浆与浓缩葡萄汁混合液中进行发酵。
(4)使用500 mL锥形瓶进行发酵,发酵体积300 mL,每一菌种做3组平行。
(5)发酵过程中每天进行搅拌。
1.3.2 黑果花楸酒基本理化指标检测
总糖、总酸、挥发酸、pH、酒精度的测定参照GB 15038—2006《葡萄酒、果酒通用分析方法》进行。
1.3.3 黑果花楸酒生物活性成分检测
黑果花楸酒总酚含量检测采用福林酚法[16],总花青素检测采用pH示差法[17],反式白藜芦醇检测采用高效液相色谱法[18]。
1.3.4 黑果花楸酒抗氧化能力检测
采用总氧自由基清除能力(oxygen radical absorbance capacity,ORAC)方法进行检测,参照FENG等[19]和ZHANG等[20]的方法并稍作修改。将每份25 μL用浓度为75 mmol/L pH 7.4磷酸盐缓冲液(phosphate buffered saline,PBS)稀释的样品溶液与150 μL 荧光素钠(4×10-3mmol/L)溶液在96孔微量培养板中混合,37 ℃孵育10 min,然后迅速向每个孔中加入25 μL AAPH(153 mmol/L),每90 s测定1次荧光强度,约91次循环。激发波长485 nm,发射波长535 nm,公差均为±20 nm。以PBS(空白)或Trolox标准溶液(3.125、6.25、12.5、25、50、75 μmol/L)代替样品溶液,构建Trolox标准衰减曲线。通过减去对应于空白的荧光衰减曲线(AUCblank)来计算对应于样品的荧光衰减曲线(AUCsample)下的净面积(Net AUC),以Net AUC和标准品浓度绘制标准曲线,并计算标准曲线回归方程,最终结果以Trolox等价表示。净面积(Net AUC)计算如公式(1)、公式(2)所示:
(1)
Net AUC=AUCsample-AUCblank
(2)
1.3.5 GC-MS分析
送样至江南大学国家重点实验室气质联用实验室进行检测。
1.3.6 数据分析
使用Microsoft Excel 2019程序对黑果花楸酒生物活性成分及酒中挥发性化合物定量数据进行计算;使用Origin 2018进行图形绘制。
2 结果与分析
2.1 黑果花楸酒基本理化指标
如表1所示,5株酵母发酵的黑果花楸酒酒精度在10.9%vol~12.0%vol,总糖含量均>6 g/L,按GB/T 15037—2006《葡萄酒》划分,属于半干型酒;总酸含量均>11 g/L,超出GB/T 15037—2006《葡萄酒》要求(<8.0 g/L),且pH值均<3.30,因此在发酵过程中需要进行降酸处理;挥发酸含量在0.35~0.51 g/L,符合国家标准(<1.2 g/L)。
表1 不同酵母发酵的黑果花楸酒基本理化指标
Table 1 Basic physicochemical indexes of Aronia melanocarpa wine fermented by different yeasts
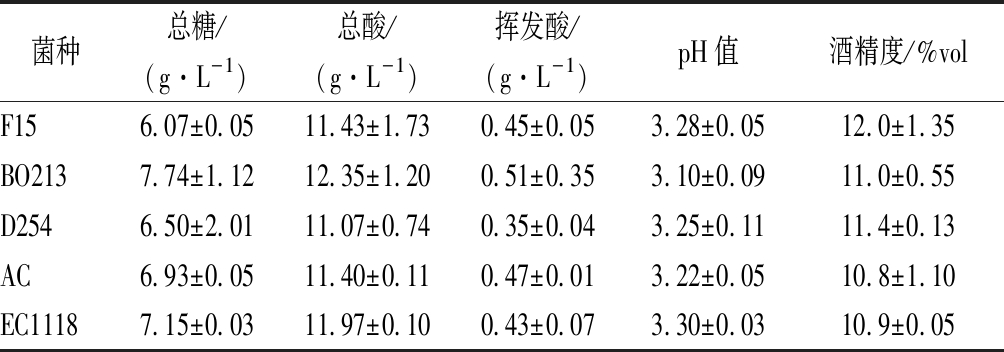
菌种总糖/(g·L-1)总酸/(g·L-1)挥发酸/(g·L-1)pH值酒精度/%volF156.07±0.0511.43±1.730.45±0.053.28±0.0512.0±1.35BO2137.74±1.1212.35±1.200.51±0.353.10±0.0911.0±0.55D2546.50±2.0111.07±0.740.35±0.043.25±0.1111.4±0.13AC6.93±0.0511.40±0.110.47±0.013.22±0.0510.8±1.10EC11187.15±0.0311.97±0.100.43±0.073.30±0.0310.9±0.05
2.2 不同酵母发酵对黑果花楸酒生物活性成分含量的影响
如表2所示,酵母菌F15及D254发酵生产的黑果花楸酒中总酚含量相对其他3种酵母发酵要高,分别为3 836.72、3 720.18 mg/L,其他酵母发酵的黑果花楸酒总酚含量在3 487.09~3 668.80 mg/L。同时,酵母菌F15及EC1118发酵生产的黑果花楸酒总花青素含量相对其他3种酵母要高,分别为691.89和688.55 mg/L。酵母菌D254发酵生产的黑果花楸酒反式白藜芦醇含量最高,为1.03 mg/L,酵母菌AC次之。总体来说,酵母菌F15发酵生产的黑果花楸酒生物活性成分较高,酵母菌BO213及EC1118发酵生产的黑果花楸酒生物活性成分含量最低。果酒中酚类物质含量受多种因素影响,除酒精度外,发酵过程中酵母细胞壁吸附酚类物质、单宁与蛋白质、多糖等大分子物质结合成不溶性的沉淀、酵母的次级代谢物丙酮酸、乙醛等与多酚类物质反应生成大分子聚合物、微生物产生的酶降解多酚类物质导致其水溶性下降产生沉淀等均会对酚类物质的含量产生影响[21]。
表2 不同酵母发酵的黑果花楸酒中生物活性物质含量 单位:mg/L
Table 2 Content of bioactive substances in Aronia melanocarpa wine fermented by different yeasts
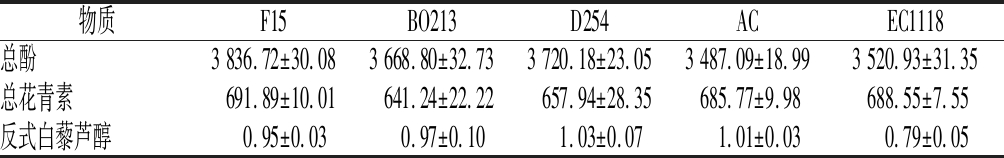
物质F15BO213D254ACEC1118总酚3 836.72±30.083 668.80±32.733 720.18±23.053 487.09±18.993 520.93±31.35总花青素691.89±10.01641.24±22.22657.94±28.35685.77±9.98688.55±7.55反式白藜芦醇0.95±0.030.97±0.101.03±0.071.01±0.030.79±0.05
2.3 不同酵母发酵对黑果花楸酒抗氧化能力的影响
如图1所示,5种酵母发酵生产的黑果花楸酒中,酵母菌F15发酵的黑果花楸酒ORAC值最高,酵母菌AC发酵的黑果花楸酒次之,酵母菌BO213发酵的黑果花楸酒ORAC值最低。近年来很多实验都证实葡萄酒具有抗氧化性,而其抗氧化性主要来源于其自身所含的酚类物质,总酚含量越高,抗氧化性则越强[22],花青素属于生物类黄酮物质,而黄酮物质最主要的生理活性功能是自由基清除能力。研究证明,花青素是当今人类发现最有效的抗氧化剂,也是最强效的自由基清除剂[23]。因此,酵母菌F15发酵的黑果花楸酒抗氧化能力较高主要因为其含有较高的总酚及花青素;结合表2发现酵母菌BO213发酵的黑果花楸酒多酚含量较酵母菌EC1118高,但其抗氧化能力却较酵母菌EC1118发酵的黑果花楸酒低,推测其原因是因为酵母菌EC1118发酵的黑果花楸酒花青素含量较高。

a-ORAC值;b-荧光值
图1 不同酵母发酵对黑果花楸酒抗氧化能力的影响
Fig.1 The effect of different yeast fermentation on the antioxidant capacity of Aronia melanocarpa wine
2.4 不同酵母发酵对黑果花楸酒香气成分的影响
GC-MS对5种酵母发酵产生的黑果花楸酒中香气化合物的检测结果显示(图2),酵母菌F15发酵的黑果花楸酒中香气物质数量最多,酵母菌EC1118发酵的黑果花楸酒次之。

图2 不同黑果花楸酒中香气成分的数量
Fig.2 Quantity of aroma components in different Aronia melanocarpa wine
由5株酵母发酵的黑果花楸酒中各香气成分的含量汇总表(表3)可以看出,5种酒样中香气成分的种类及含量存在一定的差异。
表3 不同酵母发酵的黑果花楸酒中香气化合物的含量 单位:μg/L
Table 3 Content of aroma compounds in Aronia melanocarpa wine fermented by different yeasts
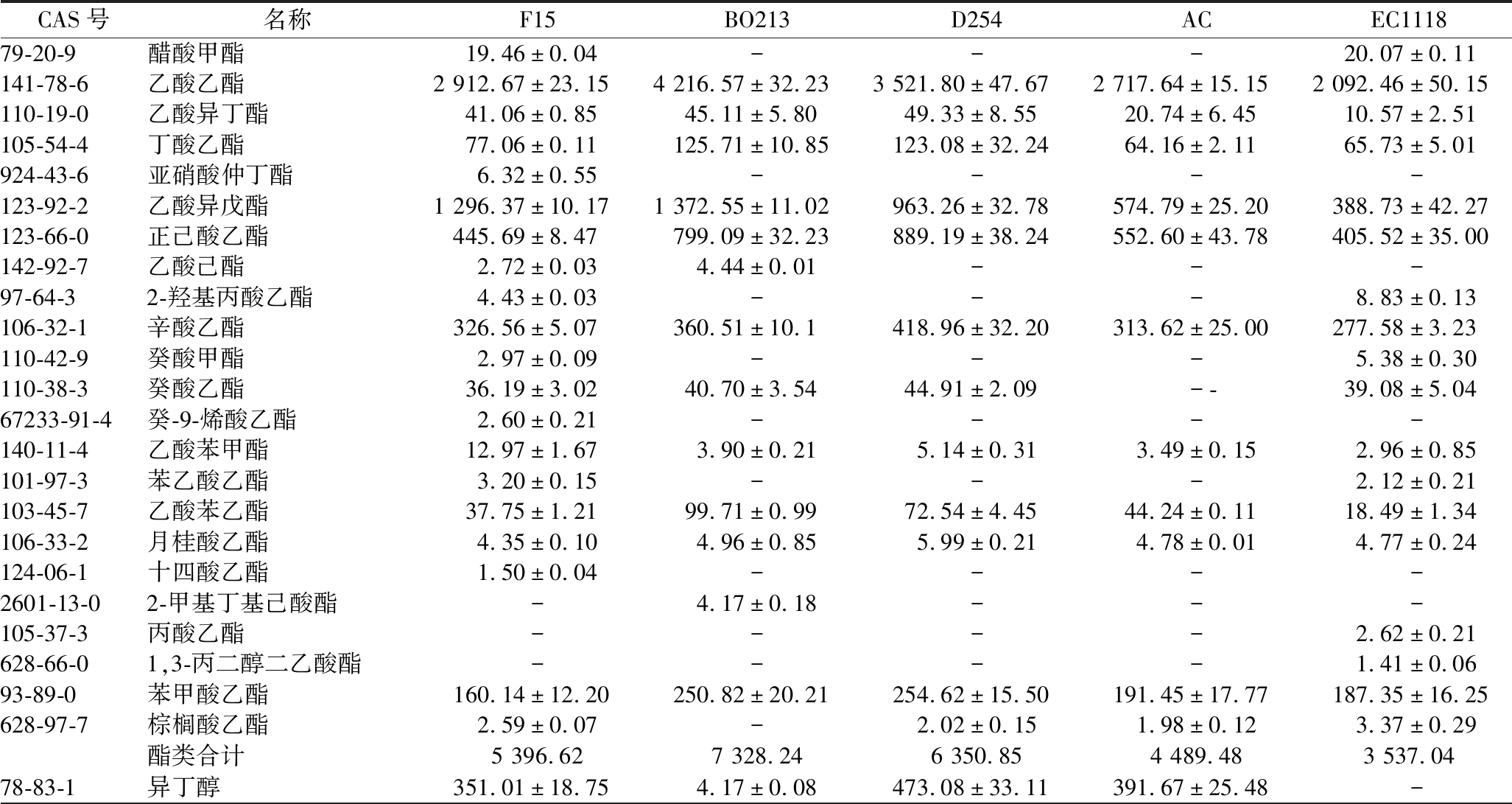
CAS号名称F15BO213D254ACEC111879-20-9醋酸甲酯19.46±0.04---20.07±0.11141-78-6乙酸乙酯2 912.67±23.154 216.57±32.233 521.80±47.672 717.64±15.152 092.46±50.15110-19-0乙酸异丁酯41.06±0.8545.11±5.8049.33±8.5520.74±6.4510.57±2.51105-54-4丁酸乙酯77.06±0.11125.71±10.85123.08±32.2464.16±2.1165.73±5.01924-43-6亚硝酸仲丁酯6.32±0.55----123-92-2乙酸异戊酯1 296.37±10.171 372.55±11.02963.26±32.78574.79±25.20388.73±42.27123-66-0正己酸乙酯445.69±8.47799.09±32.23889.19±38.24552.60±43.78405.52±35.00142-92-7乙酸己酯2.72±0.034.44±0.01---97-64-32-羟基丙酸乙酯4.43±0.03---8.83±0.13106-32-1辛酸乙酯326.56±5.07360.51±10.1418.96±32.20313.62±25.00277.58±3.23110-42-9癸酸甲酯2.97±0.09---5.38±0.30110-38-3癸酸乙酯36.19±3.0240.70±3.5444.91±2.09--39.08±5.0467233-91-4癸-9-烯酸乙酯2.60±0.21----140-11-4乙酸苯甲酯12.97±1.673.90±0.215.14±0.313.49±0.152.96±0.85101-97-3苯乙酸乙酯3.20±0.15---2.12±0.21103-45-7乙酸苯乙酯37.75±1.2199.71±0.9972.54±4.4544.24±0.1118.49±1.34106-33-2月桂酸乙酯4.35±0.104.96±0.855.99±0.214.78±0.014.77±0.24124-06-1十四酸乙酯1.50±0.04----2601-13-02-甲基丁基己酸酯-4.17±0.18---105-37-3丙酸乙酯----2.62±0.21628-66-01,3-丙二醇二乙酸酯----1.41±0.0693-89-0苯甲酸乙酯160.14±12.20250.82±20.21254.62±15.50191.45±17.77187.35±16.25628-97-7棕榈酸乙酯2.59±0.07-2.02±0.151.98±0.123.37±0.29酯类合计5 396.627 328.246 350.854 489.483 537.0478-83-1异丁醇351.01±18.754.17±0.08473.08±33.11391.67±25.48-
酯类:酵母菌BO213发酵的黑果花楸酒中酯类化合物含量最高,为7 328.24 μg/L,其次为酵母菌D254和F15,分别为6 350.85和5 396.62 μg/L,酵母菌EC1118发酵的黑果花楸酒中酯类化合物含量最少,为3 537.04 μg/L。
酵母菌F15发酵的黑果花楸酒中检测出的酯类化合物种类最多,为21种。5株酵母菌发酵的黑果花楸酒中共检测出7种乙酸酯,乙酸酯中乙酸乙酯含量最高,乙酸异戊酯含量次之。酵母菌BO213发酵的黑果花楸酒中乙酸乙酯含量最高,赋予黑果花楸酒更多愉悦的果香;5株酵母发酵的黑果花楸酒中能够提供香蕉香气的乙酸异戊酯含量均大于其阈值(200 μg/L)[8],酵母F15及酵母BO213发酵的黑果花楸酒中乙酸异戊酯含量均较高,分别为1 296.37和1 372.55 μg/L。
醇类:酵母菌D254发酵的黑果花楸酒中醇类化合物含量最高,为7 374.37 μg/L。异丁醇(酒精、生青味、苦的)、异戊醇(果香、指甲油味)、苯甲醇(甜香、花香)和苯乙醇(茉莉、玫瑰花香)是黑果花楸酒中重要的醇类物质。除酵母菌BO213发酵的黑果花楸酒外,其余4株酵母发酵的黑果花楸酒中异戊醇均为含量最高的醇类化合物,异戊醇含量为酵母菌D254>酵母菌AC>酵母菌F15>酵母菌EC1118;异丁醇也是黑果花楸酒中含量较高的醇类化合物,其含量为酵母菌D254>酵母菌AC>酵母菌F15>酵母菌BO213,酵母菌EC1118发酵的黑果花楸酒中未检测到异丁醇;苯甲醇和苯乙醇含量为酵母菌BO213>酵母菌D254>酵母菌AC>酵母菌F15>酵母菌EC1118。
酮、醛类:5株酵母菌发酵的黑果花楸中的酮类物质含量最高的为2-戊酮,其次为2,3-戊二酮,后者可以给黑果花楸酒带来奶油和黄油的味道,其中酵母菌F15发酵的黑果花楸酒2,3-戊二酮含量最高,为31.14 μg/L,酵母菌BO213、D254和EC1118发酵的黑果花楸酒中2,3-戊二酮含量接近,在10.4~11.2 μg/L,酵母菌AC发酵的黑果花楸酒中未检测到2,3-戊二酮。醛类物质中苯甲醛含量最高,可以为黑果花楸酒提供苦杏仁和焦糖的味道,并且在5株酵母发酵的黑果花楸酒中含量差异较大,其中酵母菌D254发酵的黑果花楸酒中苯甲醛含量最高,为1 644.40 μg/L,酵母菌EC1118发酵的黑果花楸酒中苯甲醛含量最低,为654.15 μg/L。
酸类:只有乙酸(醋酸味)在5株酵母发酵的黑果花楸酒中均被检出,其含量为酵母菌BO213>酵母菌AC>酵母菌EC1118>酵母菌F15>酵母菌D254,(E)-5-癸烯基乙酸、己酸和辛酸仅在酵母菌F15发酵的黑果花楸酒中有检测到。乙酸是发酵酒中主要的挥发酸,可与醇反应生成有水果香的醋酸酯,但是当乙酸含量过高时,说明发酵酒被醋酸菌、乳酸菌污染,超过阈值200 mg/L时,发酵酒会带有酸味。由于5株酵母发酵的黑果花楸酒中酸含量均较低,因此不会给发酵酒带来不愉悦的香气。
其他:除酯类、醇类、酮醛类和酸类化合物外,黑果花楸酒中还含有萜烯类和酚类等化合物,萜烯类化合物虽然在黑果花楸酒中含量较低,但因其阈值较低,其对黑果花楸酒的香气也会有很大贡献。酵母菌D254发酵的黑果花楸酒中萜烯类物质含量最高(128.12 μg/L),在检出的4种萜烯类物质中,苯乙烯的含量最高。2,4-二叔丁基苯酚在5株酵母发酵的黑果花楸酒中均被检出,且在酵母菌F15发酵的黑果花楸酒中的含量最高(5.39 μg/L)。
续表3

CAS号名称F15BO213D254ACEC111871-36-3正丁醇11.72±1.0822.18±1.5913.75±0.4511.89±0.7913.44±0.08123-51-3异戊醇5 065.83±53.78-6 096.27±10.135 102.39±43.044 359.14±43.67626-89-14-甲基-1-戊醇3.86±0.00----543-49-72-庚醇4.23±0.084.97±0.995.11±0.084.03±0.083.57±1.04111-27-3正己醇43.66±3.084.47±0.0948.69±0.1137.66±2.4835.67±3.54111-70-6庚醇11.12±0.0410.59±0.8423.50±2.4825.01±0.48-97-95-02-乙基-1-丁醇2.53±0.28----100431-87-6(S)-3-乙基-4-甲基戊醇-14.62±0.39---2.60±0.081120-06-5癸醇3.66±0.30----513-85-92,3-丁二醇33.92±1.1381.08±0.4260.97±2.3172.07±4.0564.41±2.20108-82-72,6-二甲基-4-庚醇4.24±0.09----111-87-5正辛醇12.58±1.0216.25±0.5716.52±1.3814.96±0.56-625-48-92-硝基-乙醇0.73±0.28----143-08-81-壬醇7.67±0.578.32±0.567.66±0.06-5.52±0.30505-10-23-甲硫基丙醇2.04±0.55----68832-18-81-脱氧-d-阿尔妥醇2.36±0.42----100-51-6苯甲醇151.81±22.28200.25±2.20186.64±22.28163.56±2.13124.44±4.4660-12-8苯乙醇267.08±2.91319.31±23.54288.51±26.05272.83±16.25256.83±32.20112-72-11-十四醇0.52±0.04----6032-29-72-戊醇--153.73±0.11-90.23±8.9342072-39-9(S)-(+)-3-甲基-1-戊醇---3.94±0.285.68±0.1571-23-8正丙醇----94.85±5.51111-35-33-乙氧基-1-丙醇----7.58±0.5457-55-61,2-丙二醇----2.05±0.991066-42-8二甲基硅丙二醇12.12±3.87---39.38±2.20醇类合计5 997.32671.587 374.376 100.025 105.40107-87-92-戊酮63.85±5.5374.41±4.9571.79±6.8554.57±1.2059.37±0.11600-14-62,3-戊二酮31.14±2.2010.40±0.9911.20±0.05-10.99±1.84111-13-7仲辛酮7.83±0.228.17±0.3217.78±1.0510.49±0.558.99±1.70110-93-06-甲基-5-庚烷-2-酮1.71±0.15---1.90±0.013102-33-83-戊烯-2-酮----6.90±0.0198-86-21-苯基乙酮2.12±0.16----79-77-6β-紫罗兰酮0.68±0.01----96-48-0二氢-2(3H)-呋喃酮2.65±0.03---3.14±0.35酮类合计109.9892.98100.7765.0691.29124-13-0正辛醛2.51±0.13--5.73±0.143.34±0.35124-19-6壬醛9.56±1.9210.68±0.0410.83±0.0414.21±0.6310.73±1.9298-01-12-呋喃甲醛2.65±0.14---4.83±0.05112-31-2癸醛9.49±0.49--4.38±0.042.44±0.04100-52-7苯甲醛707.21±8.811 535.13±22.031 644.40±16.251 174.30±2.20654.15±80.53764-40-92,4-戊二烯醛-3.05±0.13---醛类合计731.421 548.861 655.241 198.62675.4864-19-7乙酸4.44±0.7418.75±0.273.76±2.2013.95±0.048.74±0.3438421-90-8(E)-5-癸烯基乙酸8.94±1.11----142-62-1己酸10.77±0.39----124-07-2辛酸9.04±1.02----酸类合计33.1818.753.7613.958.74100-42-5苯乙烯30.12±3.54111.31±2.20118.27±13.0444.10±2.1525.01±2.11106-22-9β-香茅醇1.26±0.39---0.97±0.09928-96-1叶醇4.84±0.735.87±1.756.33±0.475.24±0.084.58±0.06562-74-34-萜烯醇3.71±0.563.81±0.153.52±1.02-3.01±0.33萜烯类合计39.94120.98128.1249.3333.5896-76-42,4-二叔丁基苯酚5.39±0.203.85±0.114.11±0.153.70±0.084.63±0.00酚类合计5.393.854.113.704.632471-84-31-亚甲基氢茚3.22±0.30----618-32-6苯甲酰溴--84.54±10.1--其他合计3.22-84.54--共计12 317.079 785.2415 701.8311 920.169 456.16
注:“-”表示未检测出或低于检测限
3 结论
分别采用5株酿酒酵母对黑果花楸进行发酵,得到5种黑果花楸酒,并对5种黑果花楸酒的理化指标、生物活性成分、总氧自由基清除能力和香气成分进行分析,结果表明酵母菌F15发酵的黑果花楸酒中生物活性成分含量最高,总氧自由基清除能力也最强。通过GC-MS法在5种黑果花楸酒中共检测到77种挥发性化合物,主要香气成分包括乙酸乙酯、乙酸异戊酯、异丁醇、异戊醇、苯甲醇和2,3-戊二酮。不同酵母菌发酵的黑果花楸酒中香气物质含量有所差异,酵母菌BO213发酵的黑果花楸酒酯类物质含量最高,但醇类物质含量最低;酵母菌D254发酵的黑果花楸酒醇类物质和醛类物质含量最高;酵母菌F15发酵的黑果花楸酒酮类物质和酸类物质含量最高。本研究为实践中进行黑果花楸酒发酵时挑选满足特定需求的酵母提供参考。
[1] WU T, GROOTAERT C, PITART J, et al.Aronia (Aronia melanocarpa) polyphenols modulate the microbial community in a Simulator of the Human Intestinal Microbial Ecosystem (SHIME) and decrease secretion of proinflammatory markers in a Caco-2/endothelial cell coculture model[J].Molecular Nutrition & Food Research, 2018, 62(22):e1 800 607.
[2] HANDELAND M, GRUDE N, TORP T, et al.Black chokeberry (Aronia melanocarpa) juice reduces incidences of urinary tract infection among nursing home residents in the long term—A pilot study[J].Nutrition Research, 2014, 34(6):518-525.
[3] SIDOR A, ![]() A, GRAMZA-MICHA
A, GRAMZA-MICHA OWSKA A.Black chokeberry (Aronia melanocarpa) and its products as potential health-promoting factors - An overview[J].Trends in Food Science & Technology, 2019, 89:45-60.
OWSKA A.Black chokeberry (Aronia melanocarpa) and its products as potential health-promoting factors - An overview[J].Trends in Food Science & Technology, 2019, 89:45-60.
[4] 魏登, 王柳, 许一鸣, 等.黑果花楸多糖抗衰老口服液提取工艺研究[J].中国食品添加剂, 2018(8):174-179.
WEI D, WANG L, XU Y M, et al.Study on extraction process of polysaccharide anti-aging oral liquid of Aronia melanocarpa[J].China Food Additives, 2018(8):174-179.
[5] 王柳, 许一鸣, 贺牟, 等.黑果腺肋花楸功效及药用食用研究进展[J].现代食品, 2018(7):53-56.
WANG L, XU Y M, HE M, et al.Research progress on efficacy and medicinal consumption of Aronia melanocarpa[J].Modern Food, 2018(7):53-56.
[6] 朱娟娟, 马海军, 李敏, 等.不同酿酒酵母共发酵对干红葡萄酒理化特性和香气组分的影响[J].食品与发酵工业, 2020, 46(2):194-202.
ZHU J J, MA H J, LI M, et al.Effects of co-fermentation of different Saccharomyces cerevisiae on physicochemical properties and aroma components of dry red wine[J].Food and Fermentation Industry, 2020, 46(2):194-202.
[7] TORRENS J, URP P, RIU-AUMATELL M, et al.Different commercial yeast strains affecting the volatile and sensory profile of cava base wine[J].International Journal of Food Microbiology, 2008, 124(1):48-57.
P, RIU-AUMATELL M, et al.Different commercial yeast strains affecting the volatile and sensory profile of cava base wine[J].International Journal of Food Microbiology, 2008, 124(1):48-57.
[8] 刘灿珍, 侯冬冬, 刘文, 等.5株酿酒酵母对海棠果酒品质的影响[J].中国酿造, 2019, 38(2):133-138.
LIU C Z, HOU D D, LIU W, et al.Effects of five Saccharomyces cerevisiae strains on the quality of Malus Crabapple wine[J].China Brewing, 2019, 38(2):133-138.
[9] RICCI A, TESLIC N, PETROPOLUS V-I, et al.Fast analysis of total polyphenol content and antioxidant activity in wines and oenological tannins using a flow injection system with tandem diode array and electrochemical detections[J].Food Analytical Methods, 2018, 12(2):347-354.
[10] YANG J, GAO J, YU W C, et al.The effects and mechanism of Aronia melanocarpa Elliot anthocyanins on hepatic fibrosis[J].Journal of Functional Foods, 2020, 68:103 897.
[11] 贾秀娟, 魏晓瑶, 赵艳敏, 等.黑果花楸果实中花青素含量分布及抗氧化活性[J].食品研究与开发, 2017, 38(8):33-37.
JIA X J, WEI X Y, ZHAO Y M, et al.Content distribution and antioxidant activity of anthocyanins in Aronia melanocarpa Elliot[J].Food Research and Development, 2017, 38(8):33-37.
[12] 郑悦, 王萍.黑果花楸花色苷提取纯化工艺研究[J].北京林业大学学报, 2016, 38(11):118-124.
ZHENG Y, WANG P.Study on extraction and purification process of anthocyanins from Aronia melanocarpa Elliot[J].Journal of Beijing Forestry University, 2016, 38(11):118-124.
[13] 杨苑艺, 李晶莹, 吴佳琳, 等.黑果花楸果实多酚提取工艺的研究[J].森林工程, 2015, 31(5):24-29;90.
YANG Y Y, LI J Y, WU J L, et al.Extraction of polyphenols from Aronia melanocarpa Elliot[J].Forest Engineering, 2015, 31(5):24-29;90.
[14] 王鹏. 浸提型黑果腺肋花楸露酒浸提工艺研究[J].辽宁林业科技, 2018(2):1-4;14.
WANG P.Study on extraction technology of Aronia melanocarpa wine[J].Journal of Liaoning Forestry Science &Technology, 2018(2):1-4;14.
[15] 于聪, 毛建利, 李艳.黑果腺肋花楸酒澄清工艺条件优化[J].食品研究与开发, 2020, 41(21):97-102.
YU C, MAO J L, LI Y.Optimization of clarification conditions of Aronia melanocarpa wine[J].Food Research and Development, 2020, 41(21):97-102.
[16] TIAN F, LI B, JI B P, et al.Antioxidant and antimicrobial activities of consecutive extracts from galla chinensis:The polarity affects the bioactivities[J].Food Chemistry, 2009, 113(1):173-179.
[17] YIN L Q, CHEN T, LI Y, et al.A comparative study on total anthocyanin content, composition of anthocyanidin, total phenolic content and antioxidant activity of pigmented potato peel and flesh[J].Food Science and Technology Research, 2016, 22(2):219-226.
[18] 黄瑞民, 张娟, 李凯, 等.宁夏干红葡萄酒中反式白藜芦醇的含量测定[J].华中师范大学学报(自然科学版), 2018, 52(5):673-677.
HUANG R M, ZHANG J, LI K, et al.Determination of trans-resveratrol in Ningxia dry red wine[J].Journal of Central China Normal University (natural science edition), 2018, 52(5):673-677.
[19] FENG L, PENG F, WANG X J, et al.Identification and characterization of antioxidative peptides derived from simulated in vitro gastrointestinal digestion of walnut meal proteins[J].Food Research International, 2019, 116:518-526.
[20] ZHANG N, HE Z J, HE S Y, et al.Insights into the importance of dietary chrysanthemum flower (Chrysanthemum morifolium cv.Hangju)-wolfberry (Lycium barbarum fruit) combination in antioxidant and anti-inflammatory properties[J].Food Research International, 2019, 116:810-818.
[21] MORATA A, GOMEZ-CORDOVES M C, SUBERVIOLA J, et al.Adsorption of anthocyanins by yeast cell walls during the fermentation of red wines[J].Journal of Agricultural and Food Chemistry, 2003, 51(14):4 084-4 088.
[22] 李硕. 不同品种蓝莓发酵酒的抗氧化性研究[J].酿酒科技, 2018(4):52-57.
LI S.Study on antioxidant activity of different blueberry fermented wine[J].Liquor-Making Science & Technology, 2018(4):52-57.
[23] REIG G, IGLESIAS I, GATIUS F, et al.Antioxidant capacity, quality, and anthocyanin and nutrient contents of several peach cultivars[Prunus persica (L.) Batsch] grown in spain[J].Journal of Agricultural and Food Chemistry, 2013, 61(26):6 344-6 357.