豆渣是大豆提取大豆蛋白或制取豆浆、豆腐等产生的副产物[1],随着大豆加工产业的不断发展,全世界范围内每年大约可产生2 000万t豆渣[2]。豆渣中含有20%以上的蛋白质,40%以上的膳食纤维以及种类和含量丰富的氨基酸[3],可作为优良的膳食纤维等补充剂应用于食品工业。然而,豆渣具有强烈的豆腥味,导致其难以在食品中大范围应用,常被作为饲料或直接丢弃,造成环境的污染与资源的浪费[4]。
豆渣中不良风味主要来源于加工过程中酶促氧化亚油酸、亚麻酸等不饱和脂肪酸所生成的小分子挥发性化合物[5],主要为5~8碳的短链醛、酮和酸,如戊醛、己醛、己烯醛等。另外,加工过程中的光氧化反应也会生成1-辛烯-3-醇和2-戊基呋喃等物质[6]。常用的豆渣风味改良方法有物理法、生物育种法、添加掩蔽剂和微生物发酵法等[5]。物理法主要利用高温高压处理抑制脂肪氧合酶活性或使其失去活性,以减少挥发性物质的生成[7-8]。生物育种法旨在选育脂肪氧合酶缺失的新品种[9]。添加掩蔽剂依靠引入其他风味来遮蔽豆腥味[10]。这些方法尽管都有一定的效果,但难以大范围应用且不能有效去除豆腥味。近年来,利用微生物发酵改良豆制品风味凭借其绿色、高效的特点广受青睐,常用的菌种有乳酸菌、酵母等[2,11-13],但现有菌种存在酸味、酒精味重的问题,仍有较大提升空间。
担子菌门食用型真菌如茯苓、灵芝、灰树花等具有良好的风味特征,在不同的生长阶段有不同的风味特点,如李田田等[14]分析了灰树花子实体中的挥发性化合物,检测出了异戊醇与甲酸乙酯等具有芳香风味的挥发性化合物;杨海芮等[15]检测了樟芝发酵液中的挥发性化合物,发现香气成分以醇类为主。虽然现有研究多集中在食用菌子实体的风味上,但这也指出了食用菌具有风味改良的潜力。茯苓菌属担子菌门,是常见的食药用真菌,常用于提取茯苓多糖[16],生长代谢过程中能够产生良好的风味物质,有望成为风味改良菌种的良好选择。
本文以豆渣为研究对象,利用茯苓菌进行液态发酵。采用顶空固相微萃取-气相色谱-质谱联用法(headspace-solid phase microextraction-GC-MS,HS-SPME-GC-MS)测定发酵后豆渣中挥发性化合物的种类及含量变化,考察茯苓菌发酵豆渣的风味改良效果和规律,为豆渣风味改良提供新的菌种选择,同时也为工业化发酵改良豆渣风味提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与原材料
茯苓菌(Wolfiporia cocos),菌种编号CGMCC 5.78,中国普通微生物菌种保藏管理中心;豆渣(豆粕提取大豆蛋白后的副产物),由河南平顶山金晶生物科技有限公司提供。
1.1.2 茯苓菌种子培养基配方
种子培养基(g/L):马铃薯200,葡萄糖20,KH2PO4 3.0,MgSO4·7H2O 1.5,VB1 0.1,pH 6.0。
1.1.3 试剂
2-甲基-3-庚酮(内标)、正构烷烃混合标准品(C8~C26,1 000 mg/L),美国Sigma-Aldrich公司。
1.2 仪器与设备
SCIONSQ-456-GC气质联用仪,美国布鲁克公司;50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(DVB/CAR/PDMS)萃取头,美国Supelco公司;ZQZY78AN恒温振荡培养箱,上海知楚仪器有限公司;BXM-30R立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;SW-CJ-1D超净工作台,苏州净化设备有限公司。
1.3 实验方法
1.3.1 茯苓菌液体发酵的工艺流程
茯苓菌液体发酵方法参考文献[17]并略有更改。挖取茯苓菌生长尖端菌丝块,接种到茯苓菌种子培养基(100 mL),26 ℃,120 r/min,培养3 d,活化菌株。随后按接种量10%将种子液接种到茯苓菌液体发酵培养基,26 ℃,120 r/min,培养3、5、7、9、11、13 d。
1.3.2 茯苓菌菌丝体干重的测定
将1.3.1中菌株发酵液收集,8 层纱布过滤冲洗菌丝,收集菌丝,置于60 ℃烘箱烘干至恒重,称量质量并记录。
1.3.3 茯苓菌液态发酵豆渣的工艺流程
称量豆渣4 g,置于250 mL三角瓶中,加入100 mL去离子水,搅拌均匀,120 ℃,20 min灭菌,作为液态发酵豆渣培养基备用。挖取茯苓菌菌丝生长尖端菌丝块,接种到茯苓菌种子培养基(100 mL),26 ℃,120 r/min,培养3 d,活化菌株。随后以10%接种量将种子液接种到液体发酵豆渣培养基,26 ℃,120 r/min,培养3、5、7、9 d,收集发酵产物,置于-80 ℃冰箱中保存。未经处理的豆渣命名为原始豆渣,未接种茯苓菌但在相同培养条件下放置的豆渣命名为空白豆渣,接种茯苓菌并发酵的豆渣称为发酵豆渣。
1.3.4 HS-SPME-GC-MS检测挥发性化合物
1.3.4.1 SPME条件
取8.5 mL发酵产物于顶空瓶中,选择50/30 μm DVB/CAR/PDMS萃取头,60 ℃平衡30 min后,将已老化的萃取头插入顶空瓶,在60 ℃条件下萃取30 min。萃取结束后,将萃取头插入色谱进样口。
1.3.4.2 GC条件
色谱柱:安捷伦DB-WAX极性毛细管柱(30 m×0.25 mm×0.25 μm),升温程序:进样口温度为250 ℃,初始柱温40 ℃保持3 min,以5 ℃/min的速率升温至90 ℃,再以10 ℃/min升温至230 ℃,保持7 min;载气(He)流速为0.8 mL/min,不分流进样。
1.3.4.3 MS条件
电子轰击(electron impact,EI)离子源;电子能量70 eV,扫描范围为(m/z)50.0~500.0。
定性结果参照质谱和WILEY138数据库比对结果,同时采用C8~C26的正构烷烃混合标准品计算挥发性物质的相对保留指数(retention index,RI),与NIST Chemistry Webbook,SRD 69数据库中化合物的相对保留指数进行比对分析,对化合物进行定性分析。
以2-甲基-3-庚酮为定量内标物,根据被检测的化合物与内标物的色谱峰面积之比,对被检测化合物进行定量,表示为μg/L。
1.3.5 风味活性值(odor activity value,OAV)的计算
风味活性值是挥发性风味化合物的浓度与其在水中的阈值的比值,计算如公式(1)所示:
(1)
式中:OAVi为风味化合物i的风味活性值;Ci为挥发性风味物质的质量浓度,μg/L;Ti为挥发性风味化合物在水中的阈值,μg/L。
1.3.6 感官评定
挑选食品专业的学生,按照感官评价标准GB/T 10220的要求对感官分析人员进行培训,挑选出10名(4男6女)学生进行茯苓菌发酵液与发酵豆渣感官评定分析。感官评定人员通过直接嗅闻的方式给出了茯苓菌发酵液与发酵豆渣的7个风味轮廓描述,分别为青草味、青涩味、土腥味、花香味、茶香味、甜香味和水果香,采用九分法对上述7个风味轮廓及整体接受度进行评分。
1.4 统计分析
所有样品的处理重复3次,数据以平均值±标准偏差表示,使用Origin 8.0和Excel 2019进行数据分析和作图。
2 结果与分析
2.1 不同发酵时间对茯苓菌菌丝体干重的影响
茯苓菌菌丝体干重随时间的变化如图1所示,培养时间在5~10 d时,菌丝体干重增加速度最快,为茯苓菌生长的对数期。10 d后菌丝体干重增长缓慢,而后趋于平稳,进入稳定期。茯苓菌株在种子培养基中的生长情况与金文松等[17]对茯苓菌株的研究类似,由此可知,利用茯苓菌发酵豆渣的时间应选择在5~10 d。
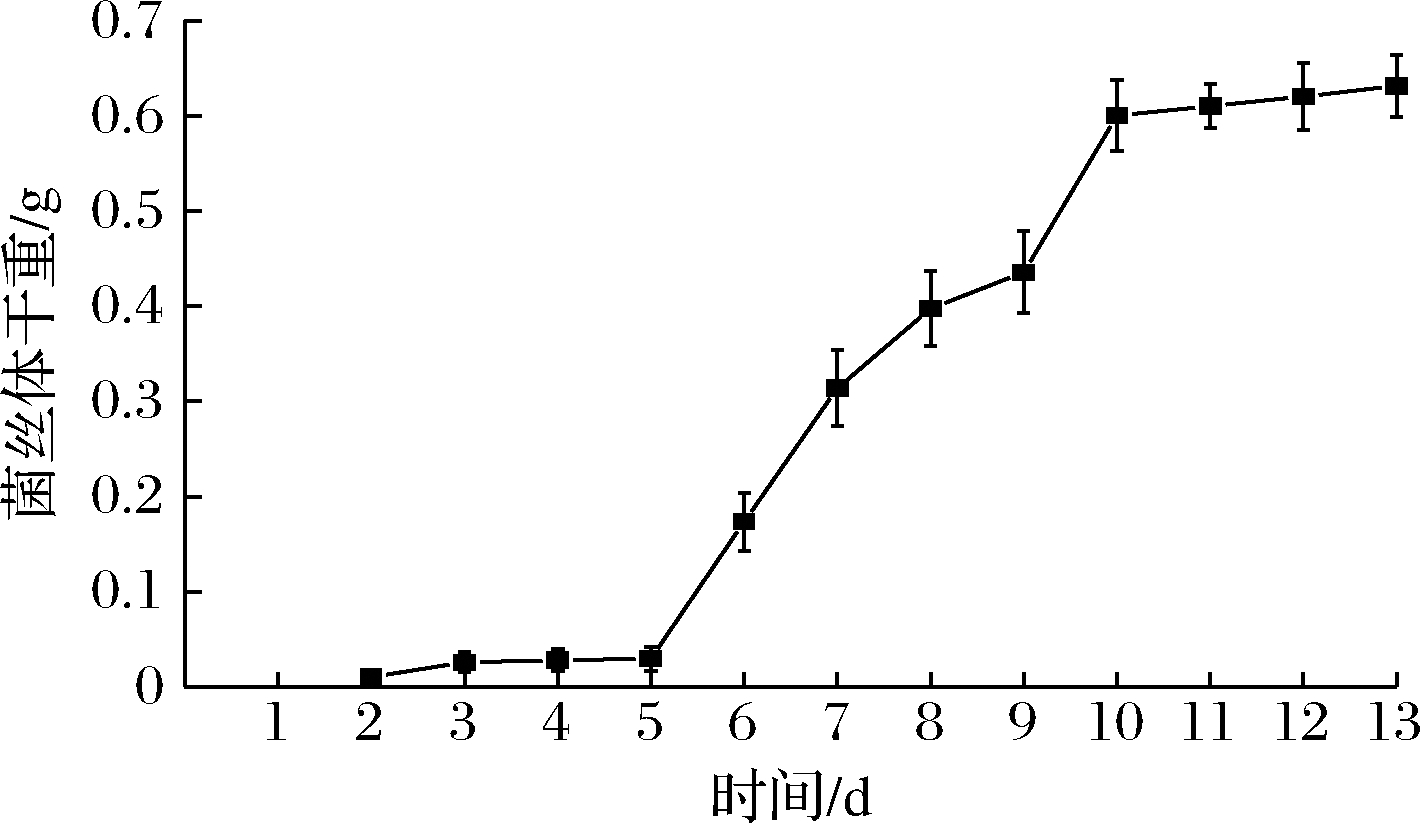
图1 不同发酵时间对茯苓菌丝体干重的影响
Fig.1 The effect of different fermentation duration on the dry weight of Wolfiporia cocos mycelium
2.2 不同发酵时间对发酵豆渣风味轮廓的影响
对原始豆渣与发酵3、5、7、9 d后的豆渣进行感官评定并绘制风味轮廓,如图2所示,发酵前后产品的风味轮廓有较大差异,在原始豆渣中突出的风味特征为“青草味”、“青涩味”和“土腥味”,发酵后这些风味特征大幅减少,且新产生了花香味、茶香味、甜香味和水果香味特征,说明茯苓菌发酵明显改良了豆渣的风味。
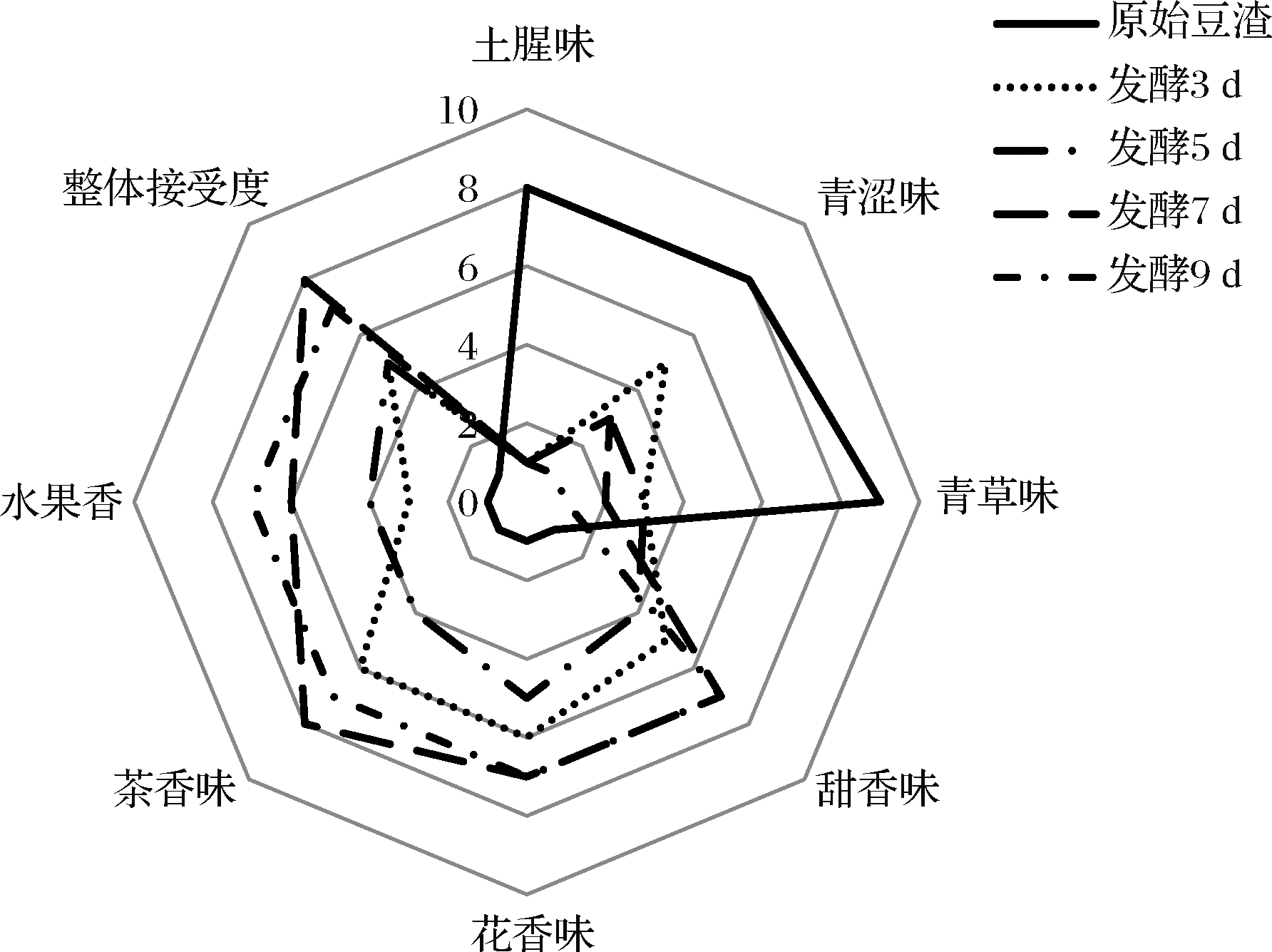
图2 发酵前后豆渣的风味轮廓
Fig.2 The flavor profiles of okara before and after fermentation
2.3 不同发酵时间对发酵豆渣挥发性化合物的影响
原始及发酵豆渣中挥发性化合物的种类和相对含量结果如表1所示,原始豆渣中含有39种挥发性化合物,空白豆渣与原始豆渣挥发性化合物种类相同且相对含量水平类似。发酵3、5、7、9 d的豆渣中分别含有22、27、27、18种挥发性化合物。在原始豆渣中检测出13种常见的不良风味化合物[5,18],含量较高的有己醛(54.31%)、正己醇(5.30%)、1-辛烯-3-醇(3.11%)、戊醛(3.03%)、反-2-已烯醛(1.99%)和顺-6-壬烯醛(1.64%),其他为庚醛、1-戊醇、癸醛、反-2-癸烯醛、反,反-2,4-壬二烯醛、反,反-2,4-癸二烯醛、5-戊基-2(5H)-呋喃酮,13种物质的总相对含量为77.33%。豆渣中不良风味化合物主要来源于原料加工过程中脂肪氧合酶导致的酶促氧化反应[12]。另外,在光照条件下,亚油酸以及单线态氧介导的特殊光氧化反应会产生1-辛烯-3-醇[6]。顺-6-壬烯醛在文献中鲜有报道,可能是由于原料来源或加工方式的不同所造成。发酵豆渣中不良风味化合物的相对含量显著减少,发酵3 d后13种不良风味化合物总相对含量由77.33%下降至66.48%,5、7、9 d后分别降至63.92%、31.49%、14.88%。由此可见,茯苓菌能够在发酵过程中消减豆渣中本身存在的不良风味化合物,且在9 d时的效果最好。
表1 不同发酵时间对发酵豆渣挥发性化合物的影响
Table 1 Effect of different fermentation duration on the volatile compounds of okara
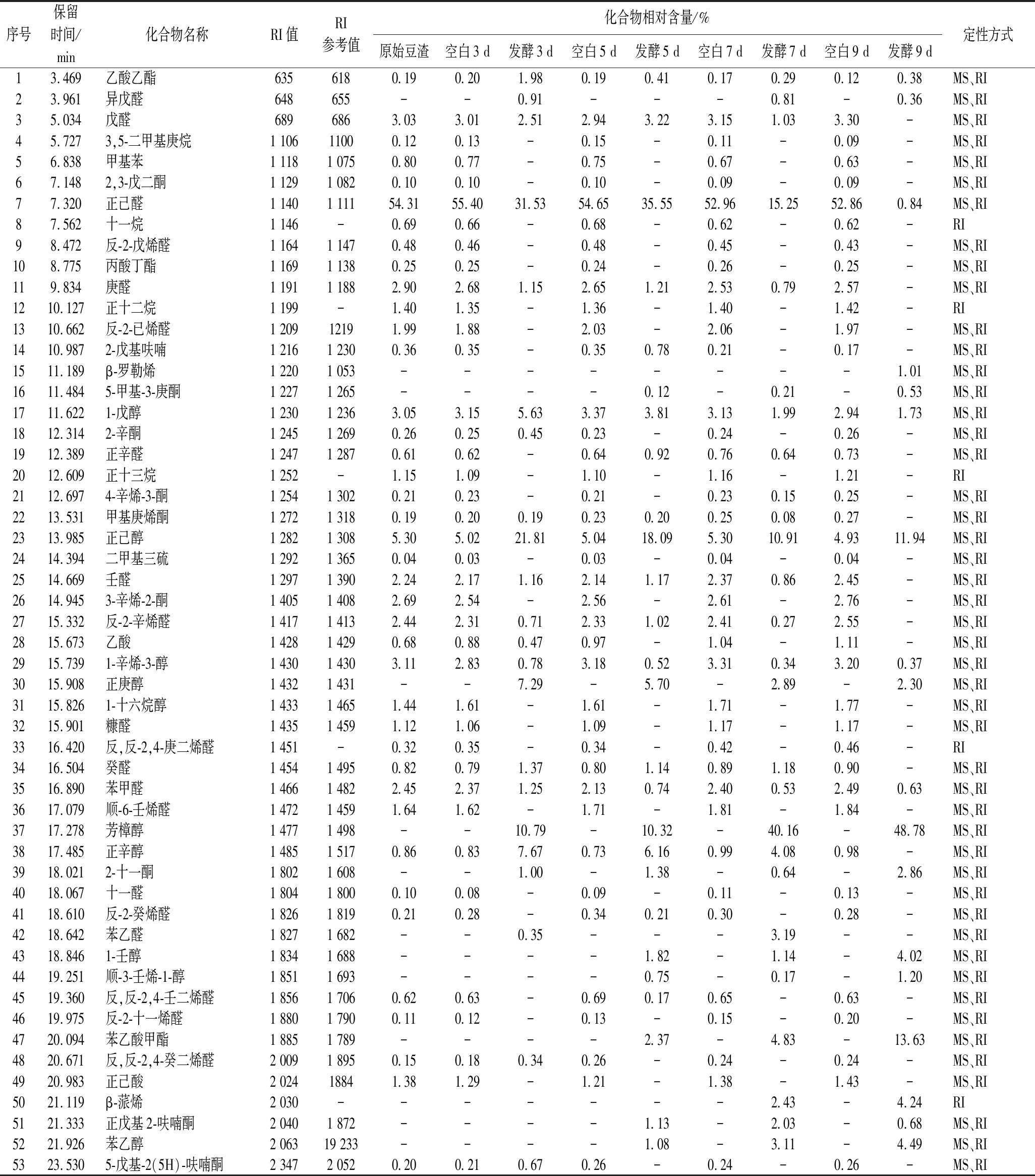
序号保留时间/min化合物名称RI值RI参考值化合物相对含量/%原始豆渣空白3 d发酵3 d空白5 d发酵5 d空白7 d发酵7 d空白9 d发酵9 d定性方式13.469乙酸乙酯6356180.190.201.980.190.410.170.290.120.38MS、RI23.961异戊醛648655--0.91---0.81-0.36MS、RI35.034戊醛6896863.033.012.512.943.223.151.033.30-MS、RI45.7273,5-二甲基庚烷1 10611000.120.13-0.15-0.11-0.09-MS、RI56.838甲基苯1 1181 0750.800.77-0.75-0.67-0.63-MS、RI67.1482,3-戊二酮1 1291 0820.100.10-0.10-0.09-0.09-MS、RI77.320正己醛1 1401 11154.3155.4031.5354.6535.5552.9615.2552.860.84MS、RI87.562十一烷1 146-0.690.66-0.68-0.62-0.62-RI98.472反-2-戊烯醛1 1641 1470.480.46-0.48-0.45-0.43-MS、RI108.775丙酸丁酯1 1691 1380.250.25-0.24-0.26-0.25-MS、RI119.834庚醛1 1911 1882.902.681.152.651.212.530.792.57-MS、RI1210.127正十二烷1 199-1.401.35-1.36-1.40-1.42-RI1310.662反-2-已烯醛1 20912191.991.88-2.03-2.06-1.97-MS、RI1410.9872-戊基呋喃1 2161 2300.360.35-0.350.780.21-0.17-MS、RI1511.189β-罗勒烯1 2201 053--------1.01MS、RI1611.4845-甲基-3-庚酮1 2271 265----0.12-0.21-0.53MS、RI1711.6221-戊醇1 2301 2363.053.155.633.373.813.131.992.941.73MS、RI1812.3142-辛酮1 2451 2690.260.250.450.23-0.24-0.26-MS、RI1912.389正辛醛1 2471 2870.610.62-0.640.920.760.640.73-MS、RI2012.609正十三烷1 252-1.151.09-1.10-1.16-1.21-RI2112.6974-辛烯-3-酮1 2541 3020.210.23-0.21-0.230.150.25-MS、RI2213.531甲基庚烯酮1 2721 3180.190.200.190.230.200.250.080.27-MS、RI2313.985正己醇1 2821 3085.305.0221.815.0418.095.3010.914.9311.94MS、RI2414.394二甲基三硫1 2921 3650.040.03-0.03-0.04-0.04-MS、RI2514.669壬醛1 2971 3902.242.171.162.141.172.370.862.45-MS、RI2614.9453-辛烯-2-酮1 4051 4082.692.54-2.56-2.61-2.76-MS、RI2715.332反-2-辛烯醛1 4171 4132.442.310.712.331.022.410.272.55-MS、RI2815.673乙酸1 4281 4290.680.880.470.97-1.04-1.11-MS、RI2915.7391-辛烯-3-醇1 4301 4303.112.830.783.180.523.310.343.200.37MS、RI3015.908正庚醇1 4321 431--7.29-5.70-2.89-2.30MS、RI3115.8261-十六烷醇1 4331 4651.441.61-1.61-1.71-1.77-MS、RI3215.901糠醛1 4351 4591.121.06-1.09-1.17-1.17-MS、RI3316.420反,反-2,4-庚二烯醛1 451-0.320.35-0.34-0.42-0.46-RI3416.504癸醛1 4541 4950.820.791.370.801.140.891.180.90-MS、RI3516.890苯甲醛1 4661 4822.452.371.252.130.742.400.532.490.63MS、RI3617.079顺-6-壬烯醛1 4721 4591.641.62-1.71-1.81-1.84-MS、RI3717.278芳樟醇1 4771 498--10.79-10.32-40.16-48.78MS、RI3817.485正辛醇1 4851 5170.860.837.670.736.160.994.080.98-MS、RI3918.0212-十一酮1 8021 608--1.00-1.38-0.64-2.86MS、RI4018.067十一醛1 8041 8000.100.08-0.09-0.11-0.13-MS、RI4118.610反-2-癸烯醛1 8261 8190.210.28-0.340.210.30-0.28-MS、RI4218.642苯乙醛1 8271 682--0.35---3.19--MS、RI4318.8461-壬醇1 8341 688----1.82-1.14-4.02MS、RI4419.251顺-3-壬烯-1-醇1 8511 693----0.75-0.17-1.20MS、RI4519.360反,反-2,4-壬二烯醛1 8561 7060.620.63-0.690.170.65-0.63-MS、RI4619.975反-2-十一烯醛1 8801 7900.110.12-0.13-0.15-0.20-MS、RI4720.094苯乙酸甲酯1 8851 789----2.37-4.83-13.63MS、RI4820.671反,反-2,4-癸二烯醛2 0091 8950.150.180.340.26-0.24-0.24-MS、RI4920.983正己酸2 02418841.381.29-1.21-1.38-1.43-MS、RI5021.119β-蒎烯2 030-------2.43-4.24RI5121.333正戊基2-呋喃酮2 0401 872----1.13-2.03-0.68MS、RI5221.926苯乙醇2 06319 233----1.08-3.11-4.49MS、RI5323.5305-戊基-2(5H)-呋喃酮2 3472 0520.200.210.670.26-0.24-0.26-MS、RI
注:“-”表示未检出;相似度为物质与质谱数据库Wiley中对比所得相似度;RI值参考NIST Chemistry Webbook, SRD 69 中的保留指数
发酵豆渣中检测出了11种优美风味挥发性化合物,分别为正辛醛、甲基庚烯酮、壬醛、正庚醇、苯甲醛、苯乙醛、芳樟醇、正辛醇、2-十一酮、苯乙酸甲酯、1-壬醇。在原始豆渣中仅检出了正辛醛、壬醛、苯甲醛与正辛醇,且总相对含量为6.16%。发酵3、5、7、9 d后分别增加至21.03%、24.32%、57.43%、69.83%。另外,芳樟醇、2-十一酮与苯乙醇等挥发性化合物只在发酵豆渣中检出,而未在原始豆渣与空白豆渣中检出,说明这些物质均来自于茯苓菌发酵。芳樟醇、2-十一酮、1-壬醇、苯乙酸甲酯与苯乙醇在发酵9 d的产物中相对含量最高,分别可达到48.78%、2.86%、4.02%、13.63%和4.49%。由此可见,茯苓菌发酵能够在减少不良风味化合物的同时生成优美风味化合物,且随着发酵时间的延长,优美风味化合物含量逐渐升高。
2.4 茯苓菌发酵豆渣不良风味挥发性化合物与优美风味挥发性化合物含量的变化
采用内标法计算发酵前后产品中13种典型的不良风味与12种优美风味化合物含量同时计算OAV,不良风味化合物的含量变化如表2所示,空白豆渣中不良风味化合物含量与原始豆渣类似,说明不良风味化合物的含量变化主要来自于茯苓菌发酵。如果化合物的含量高于阈值即OAV>1,则能够被感知到风味特征[19]。6种OAV>1的化合物发酵前后OAV变化见图3,原始豆渣中己醛OAV为20.24,对豆渣的不良风味起到主要作用;顺-6-壬烯醛具有较低的阈值,很容易被感知到,虽然豆渣中顺-6-壬烯醛的质量浓度仅为2.75 μg/L,但OAV可达137.45,使得体系具有强烈的青涩味。1-辛烯-3-醇具有蘑菇味和土腥味的特征,OAV达到5.22;反,反-2,4-壬二烯醛和反,反-2,4-癸二烯醛的阈值也较低,OAV分别达11.51 和3.51,加重了豆渣的不良风味特征。经过茯苓菌发酵后,这些物质的OAV均明显降低,其中发酵9 d的产物中,己醛OAV下降幅度达到98.20%,而顺-6-壬烯醛、反,反-2,4-癸二烯醛在发酵产物中均没有检出,说明茯苓菌发酵能够明显削减豆渣中的不良风味化合物。
表2 原始豆渣及发酵豆渣中主要不良风味物质含量
Table 2 The contents of off-flavor compounds in okara before and after fermentation
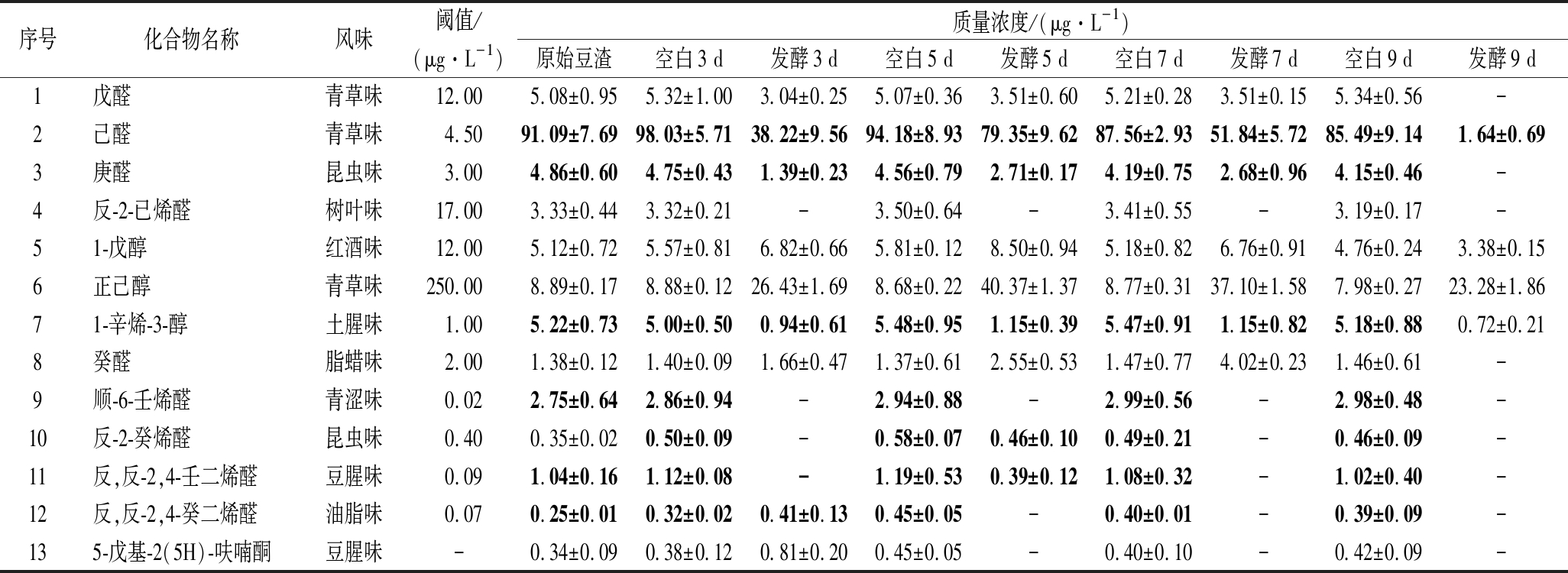
序号化合物名称风味阈值/(μg·L-1)质量浓度/(μg·L-1)原始豆渣空白3 d发酵3 d空白5 d发酵5 d空白7 d发酵7 d空白9 d发酵9 d1戊醛青草味12.005.08±0.955.32±1.003.04±0.255.07±0.363.51±0.605.21±0.283.51±0.155.34±0.56-2己醛青草味4.5091.09±7.6998.03±5.7138.22±9.5694.18±8.9379.35±9.6287.56±2.9351.84±5.7285.49±9.141.64±0.693庚醛昆虫味3.004.86±0.604.75±0.431.39±0.234.56±0.792.71±0.174.19±0.752.68±0.964.15±0.46-4反-2-已烯醛树叶味17.003.33±0.443.32±0.21-3.50±0.64-3.41±0.55-3.19±0.17-51-戊醇红酒味12.005.12±0.725.57±0.816.82±0.665.81±0.128.50±0.945.18±0.826.76±0.914.76±0.243.38±0.156正己醇青草味250.008.89±0.178.88±0.1226.43±1.698.68±0.2240.37±1.378.77±0.3137.10±1.587.98±0.2723.28±1.8671-辛烯-3-醇土腥味1.005.22±0.735.00±0.500.94±0.615.48±0.951.15±0.395.47±0.911.15±0.825.18±0.880.72±0.218癸醛脂蜡味2.001.38±0.121.40±0.091.66±0.471.37±0.612.55±0.531.47±0.774.02±0.231.46±0.61-9顺-6-壬烯醛青涩味0.022.75±0.642.86±0.94-2.94±0.88-2.99±0.56-2.98±0.48-10反-2-癸烯醛昆虫味0.400.35±0.020.50±0.09-0.58±0.070.46±0.100.49±0.21-0.46±0.09-11反,反-2,4-壬二烯醛豆腥味0.091.04±0.161.12±0.08-1.19±0.530.39±0.121.08±0.32-1.02±0.40-12反,反-2,4-癸二烯醛油脂味0.070.25±0.010.32±0.020.41±0.130.45±0.05-0.40±0.01-0.39±0.09-135-戊基-2(5H)-呋喃酮豆腥味-0.34±0.090.38±0.120.81±0.200.45±0.05-0.40±0.10-0.42±0.09-
注:“-”表示未检出或阈值未知,字体加粗表示化合物含量大于阈值
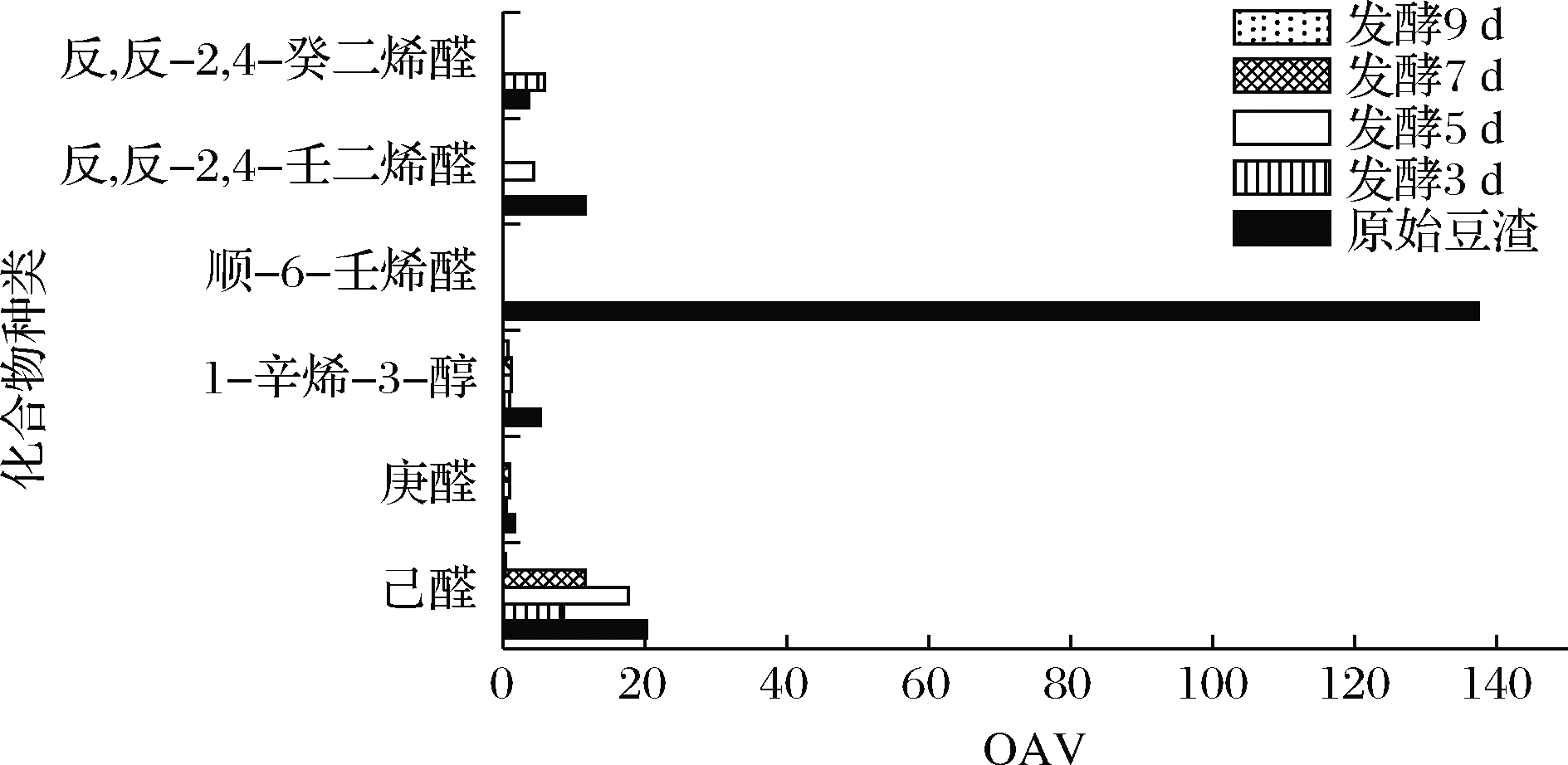
图3 豆渣发酵前后不良风味物质OAV的变化
Fig.3 The OAV of off-flavor compounds in okara before and after fermentation
己醛主要来源于脂肪氧合酶酶促氧化过程,经过茯苓菌发酵后,其含量减少的现象与利用其他微生物发酵豆类产品所产生的现象相符,如利用乳酸菌发酵豆奶后,己醛含量可大幅减少甚至无法检出[13]。这是因为微生物在生长代谢过程中能够通过自身产生的酸脱氢酶将己醛转化为己酸,从而降低己醛的含量[20]。此外,己醛还可能作为微生物生长发育的碳源之一,经过酶促分解后参与三羧酸循环。值得注意的是发酵5 d的产物中己醛含量相较发酵3 d的产物有所增加,一部分己醛在豆渣中可能与蛋白进行了共价结合而保存下来[21],经过茯苓菌的生长代谢,蛋白质被分解,这部分结合态的己醛被重新释放出来,造成己醛含量的短暂增加。
发酵豆渣中具有优美风味的挥发性化合物的含量变化如图4所示,原始豆渣中壬醛、正辛醛与正辛醇的含量较低,其风味特征由于被不良风味所掩蔽而无法被感知。接种茯苓菌后,芳樟醇和苯乙醇的含量随着发酵时间的延长而增加,且均在7 d时达到最大值。苯乙酸甲酯与1-壬醇的含量在发酵9 d时达到最高。优美风味化合物的OAV如表3所示,除发酵3 d时,其余发酵豆渣中芳樟醇的OAV均大于1,表明芳樟醇的存在为发酵豆渣提供了花香味的风味特征。发酵7 d时,芳樟醇、苯乙醇等物质含量达到最大,这与茯苓菌的生长特性一致,7 d时菌种生长速度较快,使得风味物质产生速度快,累积量多,而到9 d 时,由于菌种生长趋于稳定,增长幅度较小。
表3 原始豆渣及发酵豆渣中主要的优美风味挥发性化合物OAV
Table 3 The OAV of pleasant flavor compounds in okara before and after fermentation
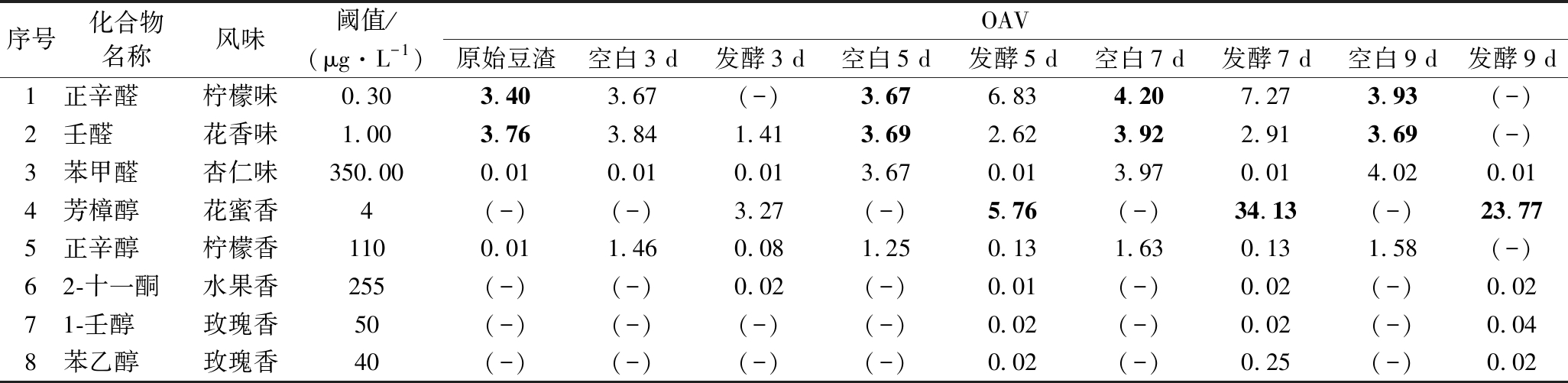
序号化合物名称风味阈值/(μg·L-1)OAV原始豆渣空白3 d发酵3 d空白5 d发酵5 d空白7 d发酵7 d空白9 d发酵9 d1正辛醛柠檬味0.303.403.67(-)3.676.834.207.273.93(-)2壬醛花香味1.003.763.841.413.692.623.922.913.69(-)3苯甲醛杏仁味350.000.010.010.013.670.013.970.014.020.014芳樟醇花蜜香4(-)(-)3.27(-)5.76(-)34.13(-)23.775正辛醇柠檬香1100.011.460.081.250.131.630.131.58(-)62-十一酮水果香255(-)(-)0.02(-)0.01(-)0.02(-)0.0271-壬醇玫瑰香50(-)(-)(-)(-)0.02(-)0.02(-)0.048苯乙醇玫瑰香40(-)(-)(-)(-)0.02(-)0.25(-)0.02
注:“(-)”表示因未检出而无法计算OAV,字体加粗表示OAV>1
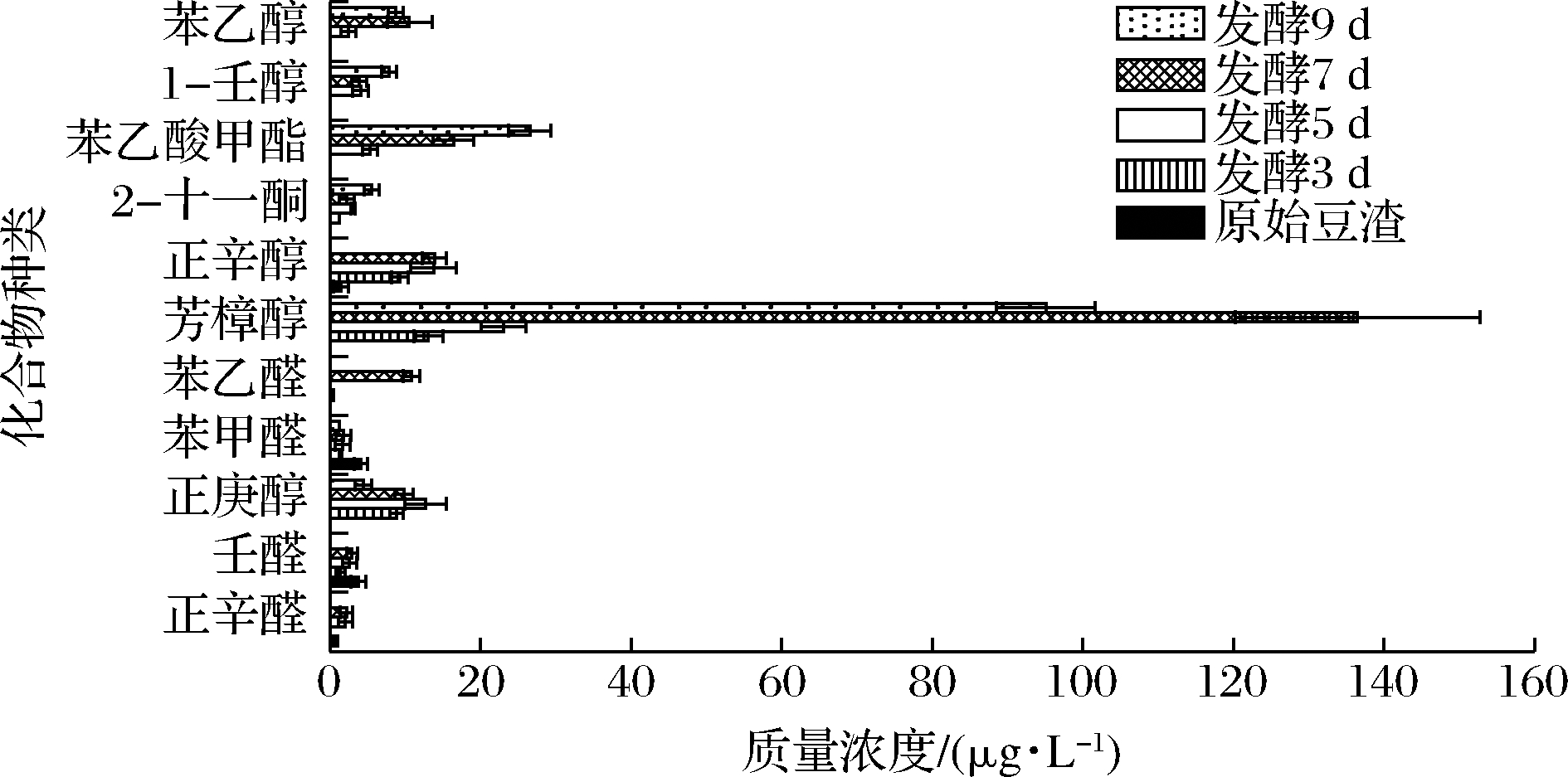
图4 豆渣及发酵豆渣中主要的优美风味挥发性化合物 含量的变化
Fig.4 The contents of pleasant flavor compounds in okara before and after fermentation
芳樟醇是一种典型的萜醇类化合物,具有花香味、茶香味的风味特征,是食品工业中常见的一种香料[22],在食用菌类产品中应用也很普遍,如廖川等[23]在茯苓普通粉中检出了芳樟醇;刘振东等[24]在检测了不同干燥方式的林芝松口蘑后,也检出了相对含量15%以上的芳樟醇。食品工业中,通常使用引入芳樟醇合酶的酿酒酵母和大肠杆菌,通过催化内源
性代谢产物香叶基二磷酸转化来实现合成[25]。在茯苓菌发酵豆渣产物中也检测出了芳樟醇,说明茯苓菌中可能存在芳樟醇合酶,使得茯苓菌能够利用豆渣中的基质合成芳樟醇。已有研究证实苯乙醇可以通过脱羧脱氢莽草酸途径合成,或者借助Ehrlich途径直接转化苯丙氨酸合成[26],这2种途径均广泛存在于微生物中,贾薇等[27]在食药用真菌樟芝发酵液中检出的主要香气成分之一为苯乙醇,宋昊等 [11]利用酵母发酵黄豆豆渣也检出了苯乙醇。鉴于豆渣中氨基酸的种类和含量丰富,茯苓菌能够获得充足的前体物质,转化生成苯乙醇。
3 结论
原始豆渣中检测出己醛、1-辛烯-3-醇、顺-6-壬烯醛等具有不良风味的挥发性化合物,它们的存在造成了豆渣青草味、土腥味的风味特征。接种茯苓菌后,发酵豆渣中的不良风味显著减少,且新具有了花香味、茶香味和甜香味的风味特征。通过发酵,己醛、顺-6-壬烯醛、1-辛烯-3-醇等化合物的含量明显减少,在发酵9 d时含量下降最大;同时也产生了芳樟醇、2-十一酮、苯乙酸甲酯、苯乙醇等具有优美风味的挥发性化合物,在7 d时含量最高。综合考虑风味轮廓与感官的接受度,发酵时间7 d时感官得分和接受度最高。综上所述,豆渣豆腥味改良的最佳条件为利用编号CGMCC 5.78茯苓菌液态发酵,培养条件为26 ℃,120 r/min,培养时间7 d。茯苓菌产香的具体代谢通路仍不清晰,后续研究可进一步探讨其代谢通路,为豆渣风味改良工业化生产提供理论依据。
[1] LEE D P S, GAN A X, KIM J E.Incorporation of biovalorised okara in biscuits:Improvements of nutritional, antioxidant, physical, and sensory properties[J].LWT-Food Science & Technology, 2020, 134:109 902.
[2] SHI H, ZHANG M, WANG W Q, et al.Solid-state fermentation with probiotics and mixed yeast on properties of okara[J].Food Bioscience, 2020, 36:100 610.
[3] GUIMARAES R M, SILVA T E, LEMES A C, et al.Okara:A soybean by-product as an alternative to enrich vegetable paste[J].LWT-Food Science & Technology, 2018, 92:593-599.
[4] 李放, 康玉凡.豆类膳食纤维研究进展[J].粮食与油脂, 2015, 28(3):14-18.
LI F, KANG Y F.Research progress on dietary fiber of legume[J].Cereals & Oils, 2015, 28(3):14-18.
[5] 代养勇, 曹健, 董海洲,等.大豆食品豆腥味研究进展[J].中国粮油学报, 2007, 22(4):50-53.
DAI Y Y, CAO J, DONG H Z,et al.Review of research on beany flavor of soy foods[J].Journal of the Chinese Cereals and Oils Association, 2007, 22(4):50-53.
[6] LEE J Y, MIN S, CHOE E O, et al.Formation of volatile compounds in soy flour by singlet oxygen oxidation during storage under light[J].Journal of Food Science, 2003, 68(6):1 933-1 937.
[7] 马磊, 孙君明, 韩粉霞, 等.大豆豆奶风味品质研究进展[J].大豆科学, 2012, 31(3):478-482.
MA L, SUN J M, HAN F X, et al.Advances on the study of soymilk flavor[J] Soybean Science, 2012, 31(3):478-482.
[8] LI Y Q, CHEN Q, LIU X H, et al.Inactivation of soybean lipoxygenase in soymilk by pulsed electric fields[J].Food Chemistry, 2008, 109(2):408-414.
[9] 赵毅. 脂肪氧合酶缺失型大豆加工特性及其豆奶加工工艺研究[D].北京:中国农业科学院, 2006.
ZHAO Y.Study on the characteristic of lipoxygenase-null soybean and soymilk process technics[D].Beijing:Chinese Academy of Agricultural Sciences, 2006.
[10] MILANI T M G, MENIS M E C, JORDANO A, et al.Pre-extrusion aromatization of a soy protein isolate using volatile compounds and flavor enhancers:Effects on physical characteristics, volatile retention and sensory characteristics of extrudates[J].Food Research International, 2014, 62:375-381.
[11] 宋昊, 郑玉芝.黄豆豆渣发酵产物中挥发性风味化合物成分分析[J].食品科学, 2016, 37(10):176-182.
SONG H, ZHENG Y Z.Analysis of volatile components in metabolites from okara fermentation[J] Food Science, 2016, 37(10):176-182.
[12] 施小迪. 豆乳及豆乳发酵液不良风味的形成及改善途径研究[D].北京:中国农业大学, 2017.
SHI X D. Study on the formation and improving methods for off-flavor of soymilk and soymilk fermented liquid[D].Beijing:China Agricultural University, 2017.
[13] BLAGDEN T D, GILLILAND S E.Reduction of levels of volatile compents associated with “Beany” flavor in soymilk by Lactobacilli and Streptococci[J].Journal of Food Science, 2005, 70(3):186-189.
[14] 李田田, 黄梓芮, 潘雨阳, 等.SPME-GC-MS分析灰树花 95%乙醇提取物挥发性成分[J].农产品加工, 2017(20):68-71.
LI T T, HUANG Z R, PAN Y, et al, Analysis of volatile components in 95% ethanol extraction of Grifola frondosa by headspace solid phase micro- extraction/GC-MS[J] Farm Product Processing, 2017(20):68-71.
[15] 杨海芮, 贾薇, 张劲松, 等.固相微萃取-气相色谱-质谱联用法分析樟芝发酵液、液体发酵菌丝体和固体培养菌丝体中香气成分[J].食用菌学报, 2016, 23(4):48-52.
YANG H R, JIA W, ZHANG J S, et al.Volatile aroma components in Taiwanofungus camphorates mycelium and spent culture fluid detected by solid-phase microextraction and GC-MS[J] Acta Edulis Fungi, 2016, 23(4):48-52.
[16] 李晓洁, 曾百慧, 陈慕兰, 等.酸性茯苓多糖的提取工艺优化[J].中国酿造, 2018, 37(10):158-161.
LI X J, ZENG B H, CHEN M L.et al.Extraction process optimization of acidic tuckahoe polysaccharides[J] China Brewing, 2018, 37(10):158-161.
[17] 金文松, 刘文君, 李立志, 等.16种茯苓菌株液体发酵产胞内多糖与三萜的比较研究[J].天然产物研究与开发, 2019, 31(5):878-886.
JIN W S, LIU W J, LI L Z, et al.Comparative study on the intracellular polysaccharides and triterpenoids produced by 16 Wolfiporia cocos strains with submerged fermentation strategies[J] Natural Product Research and Development, 2019, 31(5):878-886.
[18] YU H S, LIU R X, HU Y H, et al.Flavor profiles of soymilk processed with four different processing technologies and 26 soybean cultivars grown in China[J].International Journal of Food Properties, 2017, 20(3):2 887-2 898.
[19] MURTI T W, BOUILLANNE C, LANDON M, et al.Bacterial growth and volatile compounds in yoghurt-type products from soymilk containing Bifidobacterium ssp.[J].Journal of Food Science, 1993, 58(1):153-157.
[20] O′KEEFE S F, WILSON L A, MURPHY P A, et al.Determination of the binding of hexanal to soy glycinin and β-conglycinin in an aqueous model system using a headspace technique[J].Journal of Agricultural and Food Chemistry, 1991, 39(6):1 022-1 028.
[21] 黄战鏖, 侯峰.芳樟醇合成的研究进展及绿色评估[J].应用技术学报, 2017, 17(2):136-145;150.
HUANG Z A, HOU F.Research and green evaluation in the synthesis of linalool[J] Journal of Technology, 2017, 17(2):136-145;150.
[22] 陈笛, 陈雪津, 郭永春, 等.茉莉花芳樟醇生物合成关键基因的克隆与表达分析[J].西北植物学报, 2019, 39(8):1 344-1 352.
CHEN D, CHEN X J, GUO Y C, et al.Cloning and expression analysis of JsNEL/LINS from Jasminum sambac[J].Acta Botanica Boreali-occidentalia Sinica, 39(8):1 344-1 352.
[23] 廖川, 杨迺嘉, 刘建华, 等.茯苓超微粉与普通粉挥发性成分的研究[J].李时珍国医国药, 2008, 19(12):3 024-3 026.
LIAO C, YANG N J, LIU J H, et al.Determination of chemical constituents of the volatile oil from micro-milling of poria cocos and ordinary pulverization of Poria cocos[J] Lishizhen Medicine and Materia Medica Research, 2008, 19(12):3 024-3 026.
[24] 刘振东, 刘红丽, 姜静雨, 等.不同干燥方式对林芝松口蘑挥发性风味的影响[J].食品与发酵工业,2021,47(3):302-308.
LIU Z D, LIU H L, JIANG J Y, et al.Effect of different drying methods on volatile flavor components in Nyingchi tricholoma matsutake[J].Food and Fermentation Industries,2021,47(3):302-308.
[25] YANG Z Y, SAKAI M, SAYAMA H, et al.Elucidation of the biochemical pathway of 2-phenylethanol from shikimic acid using isolated protoplasts of rose flowers[J].Journal of Plant Physiology, 2009, 166(8):887-891.
[26] 史荣超,刘洒洒,侯阳阳, 等.梅奇酵母转化L-苯丙氨酸合成2-苯乙醇发酵条件优化[J/OL].食品与发酵工业,2021.DOI:10.13995/j.cnki.11-1802/ts.026271.
SHI R C, LIU S S, HOU Y Y, et al.Optimized bio-conversion of L-phenylalanine to 2-phenylethanol by Metschnikowia sp.[J/OL].Food and Fermentation Industries,2021.DOI:10.13995/j.cnki.11-1802/ts.026271.
[27] 贾薇, 白岩岩, 冯杰, 等.樟芝发酵产2-苯乙醇的条件优化[J].食用菌学报, 2016, 23(1):47-52.
JIA W, BAI Y Y, FENG J, et al.Optimization of selected growth parameters affecting 2-phenylethanol production in submerged cultures of Taiwanofungus camphoratus[J].Acta Edulis Fungi, 2016, 23(1):47-52.