花椒具有独特的香味和口感,在中国烹饪和食品加工业中被广泛用于辛辣调味。青花椒(Zanthoxylum schinifolium Sieb.et Zucc.)这一品种气味清香,且麻味浓厚,相比于红花椒更受消费者的喜爱[1]。青花椒中主要有挥发油、氨基酸、香豆素、酰胺类化合物等化学成分,具有较高的营养价值及功能价值[2]。花椒中化学成分的含量和组成很大程度上取决于花椒自身品种和产地环境[3-4]。青花椒主产于重庆江津和四川金阳两地,这2种青花椒在市场上广受欢迎。但由于两地的地理、气候条件有所不同,可能会导致青花椒中化学成分的组成及含量存在差异,进而影响其风味和功能价值。
目前,国内外大量的研究均关注于青花椒的挥发油成分及其香气特征,对于不同产地青花椒中的挥发油成分的研究已较为成熟[5-6]。除此之外,青花椒中的类黄酮、酰胺类、氨基酸等非挥发性物质在其滋味、药用价值上起着关键作用,同样极具研究和开发价值。但目前对青花椒中非挥发性成分的研究通常存在多指标检测操作繁杂、测定结果笼统而不能体现其具体成分、缺乏深度等缺点。近年来兴起的代谢组学技术为解决这一问题提供了新思路,其中非靶向代谢组学可对一定生理状态或特定条件下的样本中所有代谢物进行综合全面、无偏性的高覆盖检测,可寻找和鉴定出不同样品的差异代谢物,从而实现代谢特征的比较[7],为精确完整地分析不同产地的青花椒非挥发性成分提供了可行性。
因此,本研究采用基于超高效液相色谱-四级杆-静电场轨道阱高分辨质谱法(ultra performance liquid chromatography-quadrupole-electrostatic field orbital trap high resolution mass spectrometry,UPLC-QE-Orbitrap-MS)的非靶向代谢组学技术对金阳和江津两产地青花椒中非挥发性成分进行全面的鉴定,同时结合主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least square discriminant analysis,OPLS-DA)等多元统计分析方法对2种青花椒进行区分,并筛选得到化学标记物,以期为青花椒精深加工提供理论基础,为今后青花椒的优良种质资源筛选、栽培管理等方面提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
青花椒,分别采自重庆江津和四川金阳。甲醇、乙腈、醋酸铵、氨水(均为色谱级),上海安谱实验科技股份有限公司;L-2-氯苯丙氨酸(纯度≥98%),上海恒柏生物科技有限公司。
1.2 仪器与设备
Agilent 1290超高效液相色谱仪,美国安捷伦公司;Q Exactive Orbitrap高分辨质谱,美国赛默飞世尔科技;JXFSTPRP-24研磨仪,上海净信科技有限公司;VORTEX-5涡旋仪,其林贝尔仪器制造有限公司。
1.3 实验方法
1.3.1 样品前处理
2种青花椒各设置6个生物组重复。将青花椒用粉碎机粉碎后过40目筛,备用。
1.3.2 代谢物的提取
青花椒中代谢物的提取方法基于相关文献方法[8]略做修改。称取50 mg青花椒粉末加入至2 mL离心管中,加入1 000 μL提取液[V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1]后涡旋30 s将其混匀;随后于研磨仪中45 Hz处理4 min,在冰水浴中超声5 min,重复上述研磨和超声步骤3次;将得到的溶液静置在-20 ℃中1 h。静置后,4 ℃下13 000 r/min离心15 min,取上清液过0.22 μm滤膜,准备上机检测。
质控(quality control,QC)样本是通过将以上所有待测样本等量混合而制得,在液质检测的过程中,每6~10个检测分析样本中插入一个QC样本,与分析样本的采用相同的检测方法。QC样本用于分析样本在相同的处理方法下的重复性,以监测分析过程的重复性。通过对不同QC样本的基峰离子流图(basic peak ion current diagram,BPC)进行重叠展示分析,可以判断代谢物提取和检测的重复性以及仪器的稳定性。对所有样本和QC样本进行PCA分析,通过观察QC样本间的离散度,可以得知仪器分析的稳定性和可靠性。
1.3.3 UPLC-QE-Orbitrap-MS检测条件
UPLC-QE-Orbitrap-MS检测参考相关文献并做一定的修改[9]。使用Agilent 1290超高效液相色谱仪以及Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)液相色谱柱。正离子模式(positive ion mode,PIM)下流动相A相为0.1%(体积分数)甲酸水溶液,流动相B相为乙腈,采用梯度洗脱:0~1.0 min,1% B;1.0~8.0 min,1%~99% B;8.0~10.0 min,99% B;10.0~10.1 min,99%~1% B;10.1~12 min,1% B。;负离子模式(negative ion mode,NIM)下流动相A相为5 mmol/L醋酸铵水溶液(用氨水调节pH值至9.0),流动相B相为乙腈;梯度洗脱条件同正离子模式;进样体积为1 μL,流速为0.5 mL/min。
Thermo Q Exactive质谱仪在控制软件(Xcalibur,版本:4.0.27,Thermo)控制下进行一级、二级质谱数据采集。MS参数条件为:电喷雾(electrospray Ionization,ESI)离子源;喷雾电压为3 800 V(PIM)或-3 100 V(负离子模式);毛细管温度为320 ℃,鞘气流速为45 Arb;辅助气流速为15 Arb;质量扫描范围为70~1 000 m/z,一级分辨率为70 000,二级分辨率为17 500;分步碰撞能量的强度取值为3;分步碰撞能量依次为20、40和60 eV,扫描速率为7 Hz。
1.3.4 数据处理与统计分析
首先,使用ProteoWizard软件将经质谱分析后的原始数据转成mzML格式;然后使用ChromaTOF软件对质谱数据进行峰提取、基线矫正、解卷积、峰积分、峰对齐等分析[10]。采用Compound Discover(2.0版,Thermo)和OSI-SMMS(1.0版,大连化学数据解决方案信息技术公司),与MassBank、HMDB、MoTo DB、METLIN及Mzcloud数据库等进行物质鉴定,再将质控样本中检出率50%以下或RSD>30%的峰去除。使用SIMCA 14.1软件进行PCA、OPLS-DA等多元统计分析。
2 结果与分析
2.1 两种青花椒中非挥发性代谢物信息的多元统计分析
2.1.1 PCA分析
PIM和NIM下2种青花椒样本的BPC图如图1所示。所有样品的仪器分析信号强、各个色谱峰分离效果较好。此外,检测中插入的QC样本的BPC图可以很好地重叠,说明仪器具有较好的稳定性,样品处理以及检测的重复性高,为后续青花椒代谢物分析结果的准确性提供可行性。
2种青花椒非挥发性代谢物的PCA图如图2所示。2种模式下,PC1和PC2均已包含样品中大部分的代谢物信息,可用于后续分析。同时,2组青花椒样品以及QC样本组的平行样本均各自聚集在一起,因此组间具有较好的重复性,数据可信度较高。此外,2种青花椒在图中都有着明显的分离趋势,能够从总体上反应出2组样品之间的代谢物差异。
2.1.2 OPLS-DA分析
PCA分析对相关性较小的变量不敏感,而OPLS-DA是一种监督模型,能以最大程度地分离样品更有利于寻找差异代谢物。如图3所示,各组样本的重复点相距较近,且分别聚成一类,表明数据重复性好;同时,2个样品各居一侧,区分效果非常明显。此外,NIM模式下R2Y = 0.997,Q2Y = 0.912,PIM模式下R2Y = 0.994,Q2Y = 0.970,表示该模型的解释度和预测度良好。为避免出现过拟合的情况,采用了置换检验法对OPLS-DA在无差异情况下的建模效果进行了考察(图3)。2种模式下R2Y′和Q2′均小于原始模型的R2Y和Q2,则说明模型有意义,不存在过拟合现象,都符合样本数据的真实情况,具有良好的预测能力。后续可根据计算得出的变量重要性投影(variable importance inproject,VIP)值分析筛选其差异代谢物,VIP>1表示该代谢物对OPLS-DA模型中样品组的分离起了重要作用[11],VIP值越大表示该物质在区分两样本中的作用越关键。
a-PIM下的江津青花椒样本;b-PIM下的金阳青花椒样本;c-PIM下的QC样本; d-NIM下的江津青花椒样本;e-NIM下的金阳青花椒样本;f-NIM下的QC样本
图1 两种模式下江津青花椒、金阳青花椒和质控样本的基峰离子流图
Fig.1 BPC chromatogram of Jiangjin Zanthoxylum schinifolium Sieb.et Zucc., Jinyang Zanthoxylum schinifolium Sieb.et Zucc.and QC samples in two modes
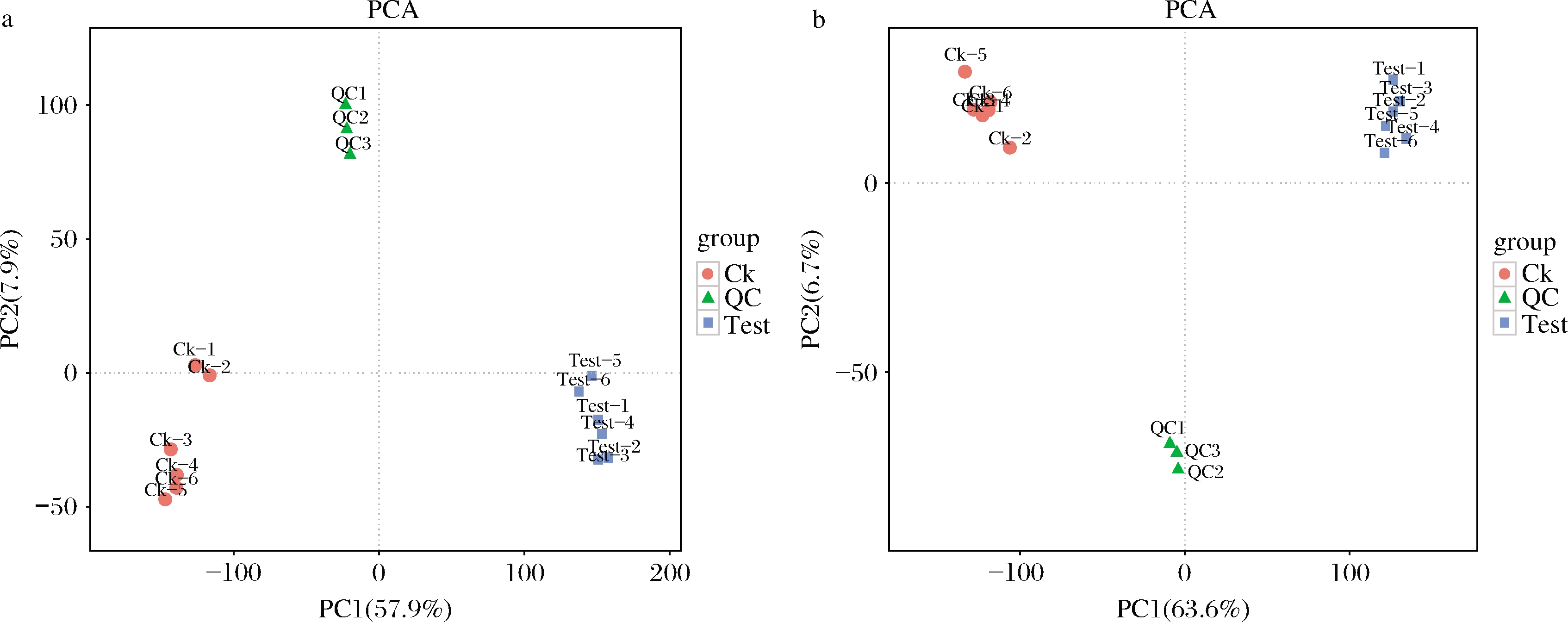
a-正离子模式;b-负离子模式
图2 两种离子模式下2组样品及质控的PCA结果
Fig.2 PCA results of two groups of samples and quality control in two modes 注:Ck-金阳青花椒;Test-江津青花椒(下同)

a-正离子模式模型得分图;b-正离子模式模型验证图; c-负离子模式模型得分图;d-负离子模式模型验证图
图3 两种离子模式下两组样品的OPLS-DA模型得分图与模型验证图
Fig.3 Scatter diagram of OPLS-DA model score and model verification of two groups in two modes
2.2 两种青花椒中非挥发性代谢物的差异分析
2.2.1 非挥发性差异代谢物的筛选与分析
设定2种青花椒中非挥发性差异代谢物的初步筛选条件为P<0.05,VIP>1,经筛选共得到74种主要的非挥发性差异代谢物(表1)。为简单、直观地表现出代谢物的变化情况,以及显示2种青花椒之间的总体模式特征,对这74种差异代谢物绘制了聚类热图(图4)。在所有非挥发性差异代谢物中,总体上氨基酸类物质在江津青花椒中呈上调表达,糖类、有机酸类以及类黄酮大多在金阳青花椒中呈上调表达。造成2种青花椒中化学成分差异的因素可能与生长环境息息相关,例如气候、土壤条件、海拔高度等。
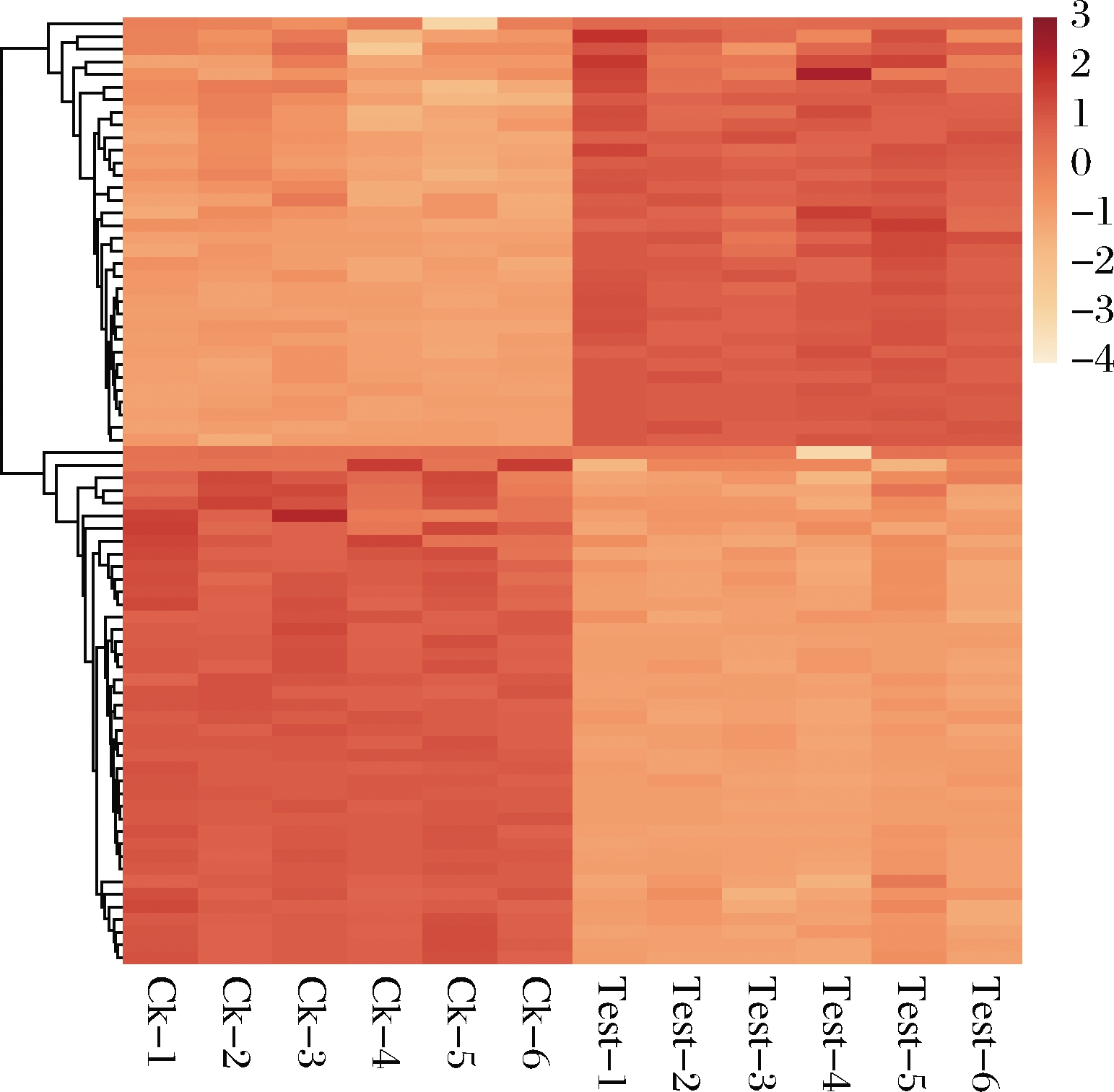
图4 两种青花椒中差异代谢物热图
Fig.4 The heat map of differential metabolite in two Zanthoxylum schinifolium Sieb.et Zucc.
花椒中氨基酸的组成和含量是营养质量的关键指标,同时在呈味上也起着重要作用。由表1可知,氨基酸类化合物在江津青花椒中总体呈上调表达。2个样本中的氨基酸呈现差异可能与土质有关,江津青花椒多栽植于山坡地,山地的土质条件较好,营养丰富,更有利于青花椒中氨基酸的合成[12]。此外,重金属元素同样也能诱导植物体内氨基酸的大量积累[13]。江津土壤中的硒含量非常丰富,但这种土壤中往往也会伴随着重金属元素的存在[14]。多项研究表明,相较于我国土壤中重金属含量的背景值,江津表层土壤中会含有更多的重金属元素,尤其是Cd元素[15-16],因此江津青花椒在生长过程中可能会面对更多的重金属胁迫。在此情况下,植物体内会增强脯氨酸合成酶的活性,或者抑制脯氨酸的氧化来应对重金属胁迫[17],因而在江津青花椒中脯氨酸会更多地积累。同样地,有研究表明在江津青花椒中呈上调表达的组氨酸也在植物抵御重金属胁迫上起着重要作用[18]。综上,2种青花椒中的氨基酸类成分呈现较大差异有可能与土质条件和重金属胁迫有关。
除氨基酸外,糖类、有机酸类及多酚黄酮类均在金阳青花椒中呈上调表达,这可能与两地的光照和湿度有着紧密联系。首先,花椒中的糖类成分主要存在于花椒果皮中,具有一定的营养价值,不可忽视[19]。有研究表明植物中糖类含量的变化可能是由于环境胁迫引起的,例如糖含量会因水分胁迫而增加[20],从而对渗透胁迫起到抵御作用。例如在干燥条件下,植物中的海藻糖会表现出极强的水合能力,可以取代生物分子表面的结合水,从而加强了蛋白质和生物膜的稳定性来抵御干旱胁迫[21]。同时,海藻糖中的羟基与蛋白质的极性基团和膜的磷酸基团之间还可形成氢键,以此来维持细胞膜在极端条件下的稳态[22]。此外,如蔗糖、葡萄糖这种常见的可溶性糖在应对水分胁迫时也起到了关键作用,其可以增大细胞的溶质浓度,改善细胞的吸水能力[23]。金阳干燥的气候可能会使青花椒更易受到水分胁迫,从而导致会糖类成分的大量积累。
同样地,有机酸是一种代谢活性溶质,在植物体内参与渗透压的调节和阳离子的平衡,因此水分胁迫也会促进有机酸的合成[24]。除了植物中常见的苹果酸、莽草酸外,脱落酸的积累也在抗旱性中起着关键作用,它可以通过减少植物的蒸腾作用、稳定生物膜以及改变植物体内代谢来达到抗旱的目的[25]。同时,有机酸作为一种光合作用的中间体[26],金阳长时间的日照便会导致有机酸在青花椒中的高度积累。
此外,由表1可得青花椒中的多酚黄酮类物质丰富,且大部分是在金阳青花椒中呈上调表达。多酚黄酮类化合物属于植物的次生代谢产物,大多数通常是由于植物应对生物和非生物胁迫而合成的。有研究表明水分胁迫会诱导植物体产生氧化胁迫,例如芦丁、槲皮苷、橙皮素等黄酮类化合物都具有较强的抗氧化活性,因而大量积累后可增强植物的氧化应激,从而增加其抗旱性能[27-28]。同时,由于金阳紫外线强度高,在高光照强度下编码多酚黄酮类化合物生物合成的结构基因的表达和某些重要酶的活性会增加,因此多酚黄酮类化合物的含量也会随之增加[29]。
表1 两种青花椒中的非挥发性差异代谢物
Table 1 Differential metabolites in two Zanthoxylum schinifolium Sieb.et Zucc.

类别总数差异物数量金阳青花椒中上调表达的物质江津青花椒中上调表达的物质有机酸类24119(奎尼酸、异缬草酸、莽草酸、脱落酸、2-丁酮酸、3,3′-二碘甲腺原氨酸、丙酮酸、苹果酸、2-异丙基苹果酸)2(甘油酸、4-乙酰氨基丁酸)糖类成分1799(蔗糖、海藻糖、水苏糖、甘油醛、棉籽糖、异肌醇、L-赤藓酮糖、2-O-α-D-吡喃葡萄糖-D-葡萄糖、D-木酮糖)0生物碱类及其衍生物2041(原阿片碱)3(蟾酥碱 O-葡萄糖苷、辣椒碱、细胞松弛素 Npho)类黄酮352114(槲皮苷、异槲皮苷、番石榴苷、橙皮素、原花青素B1、柠檬黄素、甲基柠檬黄素、异泽兰黄素、棕鳞矢车菊黄酮素、异环草苷、异鼠李素、8-羟基木犀草素4′-甲基醚8-葡萄糖-3′-硫酸酯、苜蓿素、芦丁)7(原花青素B2、6″-丙二酰黄芪甙、芹菜素、野蔷薇苷、3-甲基-表儿茶素、表儿茶素、山奈酚)酚类(除类黄酮外)733(咖啡酸、熊果苷、芥子醇)0氨基酸及其衍生物2216016(L-天冬酰胺、L-缬氨酸、氨基己二酸、N-甘氨酰甘氨酸、L-精氨酸、L-苯丙氨酸、L-赖氨酸、L-谷氨酸、L-组氨酸、L-苏氨酸、D-脯氨酸、D-焦谷氨酸、D-丝氨酸、精氨酸-组氨酸二肽、不对称二甲基精氨酸)香豆素类1211(羟基香豆素)0酰胺类7202(羟基-α-山椒素、白三烯B4二甲基酰胺)其他5675(肌醇、7-甲基肌苷、鸟苷、5′-三磷酸胞苷、肌苷)2(香紫苏醇、腺苷)
花椒果实中含量较高的肌苷、鸟苷在金阳青花椒中也呈现上调表达,这些物质具有增强免疫、延缓衰老等重要的生理活性[30]。鸟苷和肌苷的合成受激酶或核苷磷酸转移酶的催化,该途径的激活和调节同样也会受到水分胁迫的影响[31]。总的来说,江津雨量充沛,湿润多阴,而金阳日照时间长,紫外强度高,空气干燥,两地的气候原因可能导致了2种青花椒中糖类成分、有机酸、多酚类黄酮等成分呈现出较大的差异。
2.2.2 化学标记物的筛选
为寻找植物中的内源性化学标记物,经大量的研究目前已形成了系统的代谢组学策略,通过PCA和OPLS-DA来进行筛选和验证[32],已成功应用于对不同地理来源的苦艾草[33]、芹菜[34]、甘蓝[35]等的差异研究。为进一步确定引起2种青花椒差异的关键物质,参考基于代谢组学方法区分2种地理来源的生姜的研究[36],从2种青花椒的74种非挥发性差异代谢物中,根据VIP>2、2组间的倍数变化差异(fold change,FC)>3和P<0.001(独立样本T检验)的条件继续筛选出了9种具有极显著差异的化合物,作为区分江津青花椒和金阳青花椒的特征性化学标记物,分别是羟基-α-山椒素、蔗糖、海藻糖、棉籽糖、奎尼酸、莽草酸、2-异丙基苹果酸、L-精氨酸、L-赖氨酸。为了更直观地了解化学标记物,使用箱形图比较来自2个产地的青花椒样品中这9种物质的含量丰度差异(图5)。特征性标记物的鉴定为今后开发快速、针对性和低成本的诊断性生物标记物分析方法奠定了理论基础,可应用于青花椒的育种或质量评估分析。

图5 两种青花椒中9种化学标记物的相对含量丰度
Fig.5 Relative peak intensities of.nine chemical markers in two Zanthoxylum schinifolium Sieb.et Zucc.
3 结论
采用基于UPLC-QE-Orbitrap-MS的非靶向代谢组学技术对2种青花椒的非挥发性成分进行鉴定分析,无监督的PCA分析以及OPLS-DA模型分析实现了对2种产地青花椒的明显区分,说明代谢组技术可作为一种区分金阳青花椒和江津青花椒的有效手段。
2种青花椒中存在74种差异代谢物,包括有生物碱类、有机酸类、糖类、多酚黄酮类、酰胺类、香豆素类、氨基酸类等成分。从总体上看,氨基酸类成分在江津青花椒中呈上调表达,而有机酸类、糖类、多酚黄酮类等在金阳青花椒中呈上调表达,同时提出了2种青花椒中非挥发性成分差异的可能发生机制。此外,经进一步筛选确认了2个产地青花椒中具有极显著差异的物质,分别是羟基-α-山椒素、蔗糖、海藻糖、棉子糖、奎尼酸、莽草酸、2-异丙基苹果酸、L-精氨酸、L-赖氨酸,可作为区分这2种青花椒的特征性化学标记物。
综上,本研究通过代谢组学技术可以对青花椒中非挥发性成分进行全覆盖、无偏性的分析,从而能成功地对2种产地的青花椒进行区分,为今后青花椒的精深加工以及育种提供了参考方向。
[1] 李宏梁, 薛婷.花椒果皮的研究进展[J].中国调味品, 2014, 39(1):124-128.
LI H L, XUE T.Research progress of Pericarpium Zanthoxyli peel[J].China Condiment, 2014, 39(1):124-128.
[2] 刘锁兰, 魏璐雪, 王动, 等.青花椒化学成分的研究[J].药学学报, 1991(11):836-840.
LIU S L, WEI L X, WANG D, et al.Study on chemical composition in Zanthoxylum schinifolium Sieb.et Zucc.[J].Acta Pharmaceutica Sinica, 1991(11):836-840.
[3] 余晓琴, 张丽平, 阚建全.红花椒和青花椒HPLC指纹图谱的分析[J].食品与发酵工业, 2012, 38(4):171-174.
YU X Q, ZHANG L P, KAN J Q.Comparative analysis on HPLC fingerprints of Zanthoxylum bungeanum Maxim.and Zanthoxylum schinifoliu sieb.et Zucc[J].Food and Fermentation Industries, 2012, 38(4):171-174.
[4] 邓振义, 孙丙寅, 康克功, 等.不同产地花椒主要营养成分的比较研究[J].西北农业学报, 2005(3):112-114.
DENG Z Y, SUN B Y, KANG K G, et al.Comparative research of the main nutritional components of Chinese prickly ash in different producing areas[J].Acta Agriculturae Boreali-occidentalis Sinica, 2005(3):112-114.
[5] 张怀予, 王军节, 陈园凡, 等.水蒸气蒸馏法提取花椒精油及挥发性成分分析[J].食品与发酵工业, 2014, 40(7):166-172.
ZHANG H Y, WANG J J, CHEN Y F, et al.Optimization of steam distillation extraction of Zanthoxylum bungeanum essential oil by response surface methodology and essential volatile components analysis[J].Food and Fermentation Industries, 2014, 40(7):166-172.
[6] 田卫环, 张蓓.4种不同产地青、红花椒挥发油成分及香气特征研究[J].香料香精化妆品, 2017(2):7-11.
TIAN W H, ZHANG B.Study on components and aromatic characteristics of volatile oils of Zanthoxylum schinifolium Sieb.et Zucc.and Zanthoxylum bungeanum Maxim.from four different producing areas[J].Flavour Fragrance Cosmetics, 2017(2):7-11.
[7] DUNN W B, ERBAN A, WEBER R J M, et al.Mass appeal:Metabolite identification in mass spectrometry-focused untargeted metabolomics[J].Metabolomics, 2013, 9(1):S44-S66.
[8] 金文苑. 燕麦中苦味物质来源及脱苦方法研究[D].西安:陕西师范大学, 2018.
JIN W Y.Study on the source of bitter taste in oat and the method of removing bitter taste[D].Xi′an:Shaanxi Normal University, 2018.
[9] LI L, CHEN M, STOREY K B.Metabolic response of longitudinal muscles to acute hypoxia in sea cucumber Apostichopus japonicus (Selenka):A metabolome integrated analysis[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics, 2019, 29:235-244.
[10] KIND T, WOHLGEMUTH G, LEE D Y, et al.FiehnLib:Mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry[J].Analytical Chemistry, 2009, 81(24):10 038-10 048.
[11] 尹晓月, 王维东, 钱朝菊, 等.基于UPLC-MS的沙米代谢组学分析[J].中国实验方剂学杂志, 2018, 24(15):51-56.
YIN X Y, WANG W D, QIAN Z J, et al.Analysis of metabolomics in Agriophyllum squarrosum based on UPLC-MS[J].Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(15):51-56.
[12] 姜仲茂, 乌云塔娜, 王森, 等.不同产地野生长柄扁桃仁氨基酸组成及营养价值评价[J].食品科学, 2016, 37(4):77-82.
JIANG Z M, WUYUN T N, WANG S, et al.Amino acid composition and nutritional quality evaluation of wild Amygdalus pedunculatus Pall.kernels from different growing regions[J].Food Science, 2016, 37(4):77-82.
[13] 宋奇超, 曹凤秋, 巩元勇, 等.高等植物氨基酸吸收与转运及生物学功能的研究进展[J].植物营养与肥料学报, 2012, 18(6):1 507-1 517.
SONG Q C, CAO F Q, GONG Y Y, et al.Current research progresses of amino acids uptake,transport and their biological roles in higher plants[J].Journal of Plant Nutrition and Fertilizers, 2012, 18(6):1 507-1 517.
[14] 陶春军, 贾十军, 邢润华, 等.安徽独山富硒区土壤硒元素迁移转化规律及开发研究[J].地质学刊, 2014, 38(1):83-87.
TAO C J, JIA S J, XIN R H, et al.Selenium migration and transformation rules and development in selenium-rich soil in Dushan of Anhui[J].Journal of Geology, 2014, 38(1):83-87.
[15] 周皎, 何欣芮, 李瑜, 等.基于土壤重金属特征的绿色食品产地环境评价——以重庆(江津)现代农业园区为例[J].中国环境科学, 2020, 40(7):3 070-3 078.
ZHOU J, HE X R, LI Y, et, al.Evaluation of soil environmental quality in green food production based on spatial distribution of heavy metals—a case study of modern agricultural park in liangjin district,Chongqing[J].China Environmental Science, 2020, 40(7):3 070-3 078.
[16] 程永毅, 李忠意, 陈杰华, 等.重庆地区紫色土壤镉有效性水平及分异特性研究[J].西南大学学报(自然科学版), 2012, 34(1):85-91.
CHEN Y Y, LI Z Y, CHEN J H, et al.Study on the available Cd level of purple soil and its differentiation characteristics in Chongqing[J].Journal of Southwest University (Natural Science Edition), 2012, 34(1):85-91.
[17] MATYSIK J, ALIA, BHALU B, et al.Molecular mechanisms of quenching of reactive oxygen species by proline under stress in plants[J].Current Science, 2002, 82(5):525-532.
[18] KRAMER U, COTTERHOWELLS J D, CHARNOCK J M, et al.Free histidine as a metal chelator in plants that accumulate nickel[J].Nature, 1996, 379(6 566):635-638.
[19] 王锐清, 郭盛, 段金廒, 等.花椒果皮与种子营养类化学成分分析与资源价值评价[J].食品工业科技, 2017, 38(22):5-10.
WNAG R Q, GUO S, DUAN J A, et al.Nutritional component analysis and resourceful value evaluation of the pericarp and seed of Zanthoxylum bungeanum[J].Science and Technology of Food Industry, 2017, 38(22):5-10.
[20] SASAKI H, ICHIMURA K, OKADA K, et al.Freezing tolerance and soluble sugar contents affected by water stress during cold-acclimation and de-acclimation in cabbage seedlings[J].Scientia Horticulturae, 1998, 76(3-4):161-169.
[21] LUZARDO M D, AMALFA F, NUNEZ A M, et al.Effect of trehalose and sucrose on the hydration and dipole potential of lipid bilayers[J].Biophysical Journal, 2000, 78(5):2 452-2 458.
[22] 王文静, 张悦, 余明芳, 等.海藻糖调节植物响应非生物胁迫的研究进展[J].分子植物育种, 2020, 18(10):3 433-3 440.
WANG W J, ZHANG Y, YU M F, et al.Research progress of trehalose in regulating plant response to abiotic stress[J].Molecular Plant Breeding, 2020, 18(10):3 433-3 440.
[23] 张钊. 山梨醇和蔗糖在苹果抵抗干旱胁迫中的作用研究[D].杨凌:西北农林科技大学, 2016.
ZHANG Z.Study on the role of sorbitil/sucrose in resisting drought stress in apple leaves[D].Yangling:Northwest A & F University, 2016.
[24] LOPEZ-BUCIO J, NIETO-JACOBO M F, RAMIREZ-RODRIGUEZ V, et al.Organic acid metabolism in plants:From adaptive physiology to transgenic varieties for cultivation in extreme soils[J].Plant Science, 2000, 160(1):1-13.
[25] 王晓霞. 基于代谢组学野大豆(Glycine soja Sieb.et Zucc.)耐旱机制研究[D].长春:东北师范大学, 2020.
WANG X X.Metabolomics reveals the drought-tolerance mechanism in Glycine soja[D].Changchun:Northeast Normal University, 2020.
[26] 王兰兰, 宋晓卉, 杨笛, 等.环境条件对植物有机酸影响研究进展[J].沈阳师范大学学报(自然科学版), 2019, 37(3):236-239.
WANG L L, SONG X H, YANG D, et al.Progress of the effects of environmental conditions on organic acids in plants[J].Journal of Shenyang Normal University (Natural Science Edition), 2019, 37(3):236-239.
[27] 蔡娜, 淡荣, 陈鹏.水分胁迫对苦荞幼苗黄酮类物质含量的影响[J].西北农业学报, 2008(4):91-93.
CAI N, DAN R, CHEN P.Effects of water stress on flavonoids content of tartary buckwheat seedlings[J].Acta Agriculturae Boreali-occidentalis Sinica, 2008(4):91-93.
[28] NICHOLSONI R L, HAMMERSCHMIDT R.Phenolic compounds and their role in disease resistance[J].Annual Review of Phytopathology, 1992, 30:369-389.
[29] CHEYNIER V, COMTE G, DAVIES K M, et al.Plant phenolics:Recent advances on their biosynthesis, genetics, and ecophysiology[J].Plant Physiology and Biochemistry, 2013, 72(SI):1-20.
[30] ZHANG X M, YANG F Q, XIA Z N.Recent advances in research on pharmaceutical functions of nucleosides and nucleotides in dietary foods[J].Food Science, 2012, 9(33):277-282.
[31] STASOLLA C, KATAHIRA R, THORPE T A, et al.Purine and pyrimidine nucleotide metabolism in higher plants[J].Journal of Plant Physiology, 2003, 160(11):1 271-1 295.
[32] LI Y, ZHANG Z, HOU Z, et al.A rapid and integrated pyramid screening method to classify and identify complex endogenous substances with UPLC/Q-TOF MS-based metabolomics[J].Rsc Advances, 2015, 5(1):202-209.
[33] LI Y, WANG X, LI C, et al.Exploration of chemical markers using a metabolomics strategy and machine learning to study the different origins of Ixeris denticulata (Houtt.) Stebb[J].Food Chemistry, 2020, 330:127 232.
[34] LAU H, LASERNA A K C, LI S F Y.1H NMR-based metabolomics for the discrimination of celery (Apium graveolens L.var.dulce) from different geographical origins[J].Food Chemistry, 2020, 332:127 424.
[35] KIM J, JUNG Y, SONG B, et al.Discrimination of cabbage (Brassica rapa ssp pekinensis) cultivars grown in different geographical areas using H-1 NMR-based metabolomics[J].Food Chemistry, 2013, 137(1-4):68-75.
[36] MAIS E, ALOLGA R N, WANG S, et al.A comparative UPLC-Q/TOF-MS-based metabolomics approach for distinguishing Zingiber officinale Roscoe of two geographical origins[J].Food Chemistry, 2018, 240:239-244.