由真菌毒素引起的食品安全已成为人们高度关注的热点问题。其中以黄曲霉毒素B1(aflatoxin B1,AFB1)污染最为严重,其毒性、致癌性、致突变性、致畸性在所有真菌毒素中最强[1-4],并容易污染谷物,乳制品,水果和饲料[5]。许多国家都规定了AFB1的限量标准,例如,欧盟对AFB1的要求低至2 μg/kg[6]。我国对食品中AFB1也采取了严格的限量标准,例如,花生、玉米及其制品中的AFB1≤20 μg/kg;粮食、豆类、发酵食品及调味品中的AFB1≤5 μg/kg;乳制品及婴儿配方食品中AFB1≤10 μg/kg[7]。目前食品中AFB1的主要检测方法包括液相色谱-质谱法[8-9]、高效液相色谱法[10]、免疫色谱法[11-12]、时间分辨免疫荧光分析技术[13-14]。虽然这些分析法具有较好的准确度和良好的重复性,但仍存在着耗时、灵敏度低、需要复杂昂贵的检测仪器和专业操作人员的缺陷,在基层和现场无法被广泛应用。因此,建立一种简便、快速、灵敏的检测方法显得尤为重要。
酶联免疫吸附检测方法(enzyme linked immunosorbent assay,ELISA)作为应用最广的方法之一[15],在食品质量控制领域引起了广泛的关注[16-17]。但是,由于ELISA依赖抗体捕获目标物,成本较高,且只能达到中等灵敏度(μg/mL~ng/mL),无法满足痕量目标物的检测[18]。至今为止,研发人员已利用纳米材料具有较大的比表面积、易于化学修饰、高负载能力的优点[19-20],通过纳米材料作为载体来富集酶提高了ELISA的灵敏度[21-23]。尽管使用纳米材料改良ELISA已拥有可观的前景,但仍无法满足便携和现场检测的需求。
核酸适配体(aptamer,Apt)是由TUERK等[24]创建的指数富集的配体系统进化技术从DNA数据库里筛选出来可特异性识别靶标物质的核酸序列。相对于抗体而言,Apt的特异性更强、稳定性更高且更易于合成和修饰,特别适合作为小分子的生物识别元件[25-26]。研究表明,Apt技术可提高检测的敏感度和特异性[27],并且Apt和抗体的组合也显示出了良好的特异性[28-29]。
我们设计了一种双模态改良型ELISA,用于AFB1的高灵敏便携式检测。使用亲和素化的磁纳米颗粒(magnetic nanoparticles,MNPs)作为载体,富集辣根过氧化物酶(horseradish peroxidase,HRP),同时偶联生物素化的AFB1 Apt制备检测探针(MNPs@Apt@HRP)。通过Apt与抗体组合共同识别目标物,以HRP催化H2O2氧化无色底物TMB成为蓝色的ox-TMB,经过808 nm激光照射后ox-TMB还可发生很强的光热效应使溶液温度升高。
1 材料与方法
1.1 试剂与材料
AFB1标品(分析纯),美正生物科技有限公司。TMB(分析纯)、磷酸盐缓冲溶液(phosphate buffer saline,PBS),北京索莱宝科技有限公司。H2O2(30%)、柠檬酸(分析纯)、醋酸钠(分析纯)、乙二胺四乙酸二钠(分析纯),国药集团化学试剂有限公司。AFB1Apt序列(5′-3′)为:GTT GGG CAC GTG TTG TCT CTC TGT GTC TCG TGC CCT TCG CTA GGC CC[27],由上海生工生物工程有限公司合成。
Heraeus Pico 17离心机,赛默飞世尔科技公司产品;TCS-10金属恒温振荡器,杭州瑞诚仪器有限公司产品;Spark多功能酶标仪,瑞士帝肯公司产品;LSR808H-7 W-FC808激光器,吉藤电子科技有限公司产品;ELISA试剂盒,美正生物技术有限公司产品。
1.2 MNPs@Apt@HRP检测探针的制备
将MNPs(12 μL,0.1 mg beads/mL),AFB1Apt(12 μL,100 μmol/L)和HRP(12 μL,0.1 g/L)混合后,使用PBS稀释至1.2 mL,25 ℃ 孵育40 min,10 000 r/min离心8 min,并用超纯水洗涤3次除去多余HRP与AFB1适配体,洗涤后加入1.2 mL的PBS重悬,得到MNPs@Apt@HRP检测探针,4 ℃保存备用。
1.3 探针的制备优化及验证研究
取0.1 μL MNPs(10 mg beads/mL)与12 μL HRP(0.1 g/L),加入PBS缓冲液稀释至1 mL。25 ℃条件下分别孵育10、20、30、40、50 min后,10 000 r/min离心8 min,分别取上清液10 μL,加入等体积的TMB和H2O2,避光反应30 min,使用多功能酶标仪检测A652nm。
分别取10 μL HRP和50 μL H2O2;10 μL HRP和50 μL TMB;50 μL TMB和50 μL H2O2;10 μL HRP,50 μL TMB和50 μL H2O2作为对照组。然后分别取100 μL MNPs,50 μL TMB和50 μL H2O2;100 μL MNPs@Apt@HRP,50 μL TMB和50 μL H2O2作为实验组(使用的HRP质量浓度为0.1 g/L)。避光反应30 min。观察溶液的颜色变化,检测A652nm(每组3个平行)。然后使用808 nm激光照射4 min。立即将便携式温度计插入溶液中,检测溶液温度变化。插入温度计探头约5~8 s后获得的最高稳定值为光热测量信号。
1.4 探针调控比色信号研究
分别取100 μL质量浓度为5×10-3、2×10-3、1×10-3、6×10-4、3×10-4、1×10-4、6×10-5、3×10-5 g/L的MNPs@Apt@HRP加入到50 μL TMB和50 μL H2O2溶液中,避光反应30 min。观察溶液的颜色变化,并检测A652nm。
1.5 基于比色与热双模态改良型ELISA检测方法的建立
1.5.1 AFB1标准曲线的绘制
利用MNPs@Apt@HRP检测探针与抗体的组合识别96孔聚苯乙烯微板上的一系列浓度的AFB1。具体步骤如下:
(1)AFB1抗体包被:向微孔板中加入100 μL 10 g/L AFB1抗体,4 ℃过夜;
(2)封闭:弃去液体,甩干,并用0.01 mol/L PBS缓冲液洗涤3次,加入200 μL牛血清白蛋白(BSA,0.001 g/L)进行封闭,37 ℃下避光孵育1 h;
(3)加入AFB1标准溶:弃去液体,甩干,用0.01 mol/L PBS缓冲液洗涤3次,分别加入质量浓度为1×10-5、1×10-6、1×10-7、1×10-8、1×10-9、1×10-10、1×10-11、1×10-12 g/L的AFB1标准溶液,25 ℃ 下避光孵育30 min(每个浓度3组平行);
(4)加入MNPs@Apt@HRP探针:弃去液体,甩干,用0.01 mol/L PBS缓冲液洗涤3次,向孔中加入200 μL MNPs@Apt@HRP探针溶液,25 ℃下避光孵育30 min。
(5)加入底物:弃去液体,甩干,用0.01 mol/L PBS缓冲液洗涤3次,加入100 μL PBS缓冲液,50 μL TMB和50 μL H2O2,然后避光于25 ℃孵育30 min。
拍照记录每个孔中溶液颜色的变化,检测溶液的A652nm并进行光热免疫测定,记录得到的双模态信号分别绘制AFB1检测的标准曲线。
1.5.2 比色与热双模态改良型ELISA的特异性研究
分别选取7种结构类似于AFB1的化合物,包括棒曲霉素(patulin)、黄曲霉毒素B2(aflatoxin B2,AFB2)、T-2毒素(trichothecenes,TS)、伏马毒素B1(fumonisin B1,FB1)、玉米赤酶烯酮(zearalenone,ZEN)、赭曲霉毒素A(ochratoxin A,OTA)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)及混合样品,测试该方法的特异性。AFB1的质量浓度为10-7 g/L;干扰毒素的质量浓度为10-6 g/L。在相同条件下,检测溶液的双模态信号变化。
1.6 几种常见食品中AFB1的检测
1.6.1 比色与热双模态改良型ELISA
1.6.1.1 样品的前处理
(1)牛奶:取1 mL样品,加入3 mL超纯水,混合均匀;加热至沸腾10 min;立刻以10 000 r/min离心10 min,取上清液备用。
(2)花生:将样品粉碎,取5.0 g置入100 mL锥形瓶中,加入40%甲醇25 mL混合均匀;振荡10 min(200 r/min);以4 000 r/min离心5 min;取上清液1 mL,再加入4 mL去离子水;摇匀,备用。
(3)酱油:取5.0 g样品,加入10 mL乙腈溶液,振荡10 min(200 r/min)后,4 000 r/min离心5 min;取0.5 mL上清液,加入4.5 mL超纯水;摇匀,备用。
(4)醋:取1 mL样品,加入4 mL甲醇,振荡均匀后,4 000 r/min离心5 min;取1 mL上层液体,加入9 mL超纯水,将混合液的pH调节至7~8;摇匀,备用。
1.6.1.2 牛奶样品中加标回收率检测
取1 mL牛奶前处理的上清液,加入一定量的AFB1标准溶液,使上清液中AFB1的终质量浓度分别为1×10-7、1×10-8、1×10-9 g/L(做3组平行)。根据上文中所述实验过程,完成牛奶样品中AFB1的检测,并计算回收率。
1.6.1.3 样品中AFB1含量的检测
将本文建立的比色与热双模态改良型ELISA用于检测花生、牛奶、酱油和醋4种样品中AFB1的含量,并与商业化试剂盒检测结果进行对比分析,验证该检测方法的准确性及可靠性。
1.6.2 商业化ELISA试剂盒
为了验证新建方法的准确性,采用商业化ELISA试剂盒进行 AFB1检测,具体操作见试剂盒说明。
2 结果与分析
2.1 比色与热双模态改良型ELISA检测AFB1的原理
图1展示了比色与热双模态改良型ELISA检测AFB1的原理。在聚苯乙烯微孔板上包被AFB1抗体,MNPs@Apt@HRP为检测探针。当AFB1存在时,通过Apt和抗体的组合识别并捕获AFB1,形成“三明治”结构。以TMB和H2O2作为显色底物,待检物浓度的改变会导致探针浓度的不同,从而影响底物TMB颜色的改变,实现对AFB1的可视化检测。再通过808 nm激光照射之后,ox-TMB产生的光热效应导致溶液温度升高,以便携式温度计实现对AFB1的热信号便携检测。AFB1浓度越大,偶联的探针越多,ox-TMB显色越明显;温度升高越多。相反,如果没有目标分子或者很少,检测探针被冲洗掉后,无比色及温度信号产生。通过ox-TMB的A652nm与经过808 nm激光4 W/cm2功率密度照射2 min后的温度变化,实现了对AFB1的双模态信号检测。
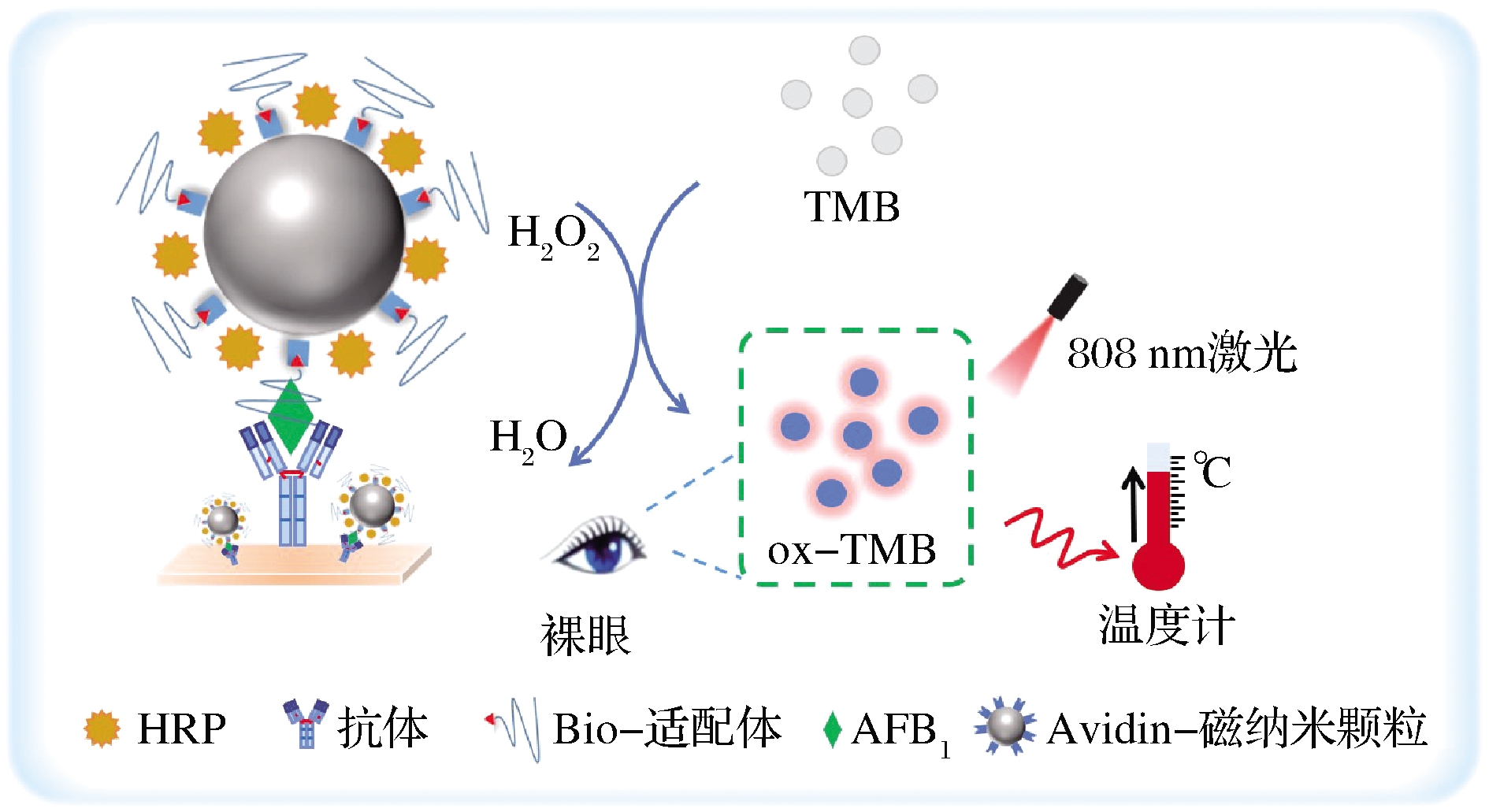
图1 基于比色与热双模态改良型ELISA用于AFB1 检测的原理示意图
Fig.1 Schematic diagram of high-sensitivity detection of AFB1 based on colorimetric and thermal bimodal improved ELISA
2.2 探针制备的优化
HRP催化TMB氧化生成ox-TMB是信号产生的关键因素,为了探索最佳的实验条件,我们研究了MNPs与HRP结合时间(10、20、30、40、50 min)对探针的影响。MNPs与HRP结合完毕后离心分离游离的HRP,取离心后的上清液进行显色反应。通过比较A652nm可以获得MNPs与HRP的最佳结合时间。如图2所示,结合时间达到40 min时,曲线趋势趋于稳定,ox-TMB的颜色不再产生明显变化,此时MNPs与HRP的结合效率较高。因此,选择40 min作为MNPs与HRP的结合时间。
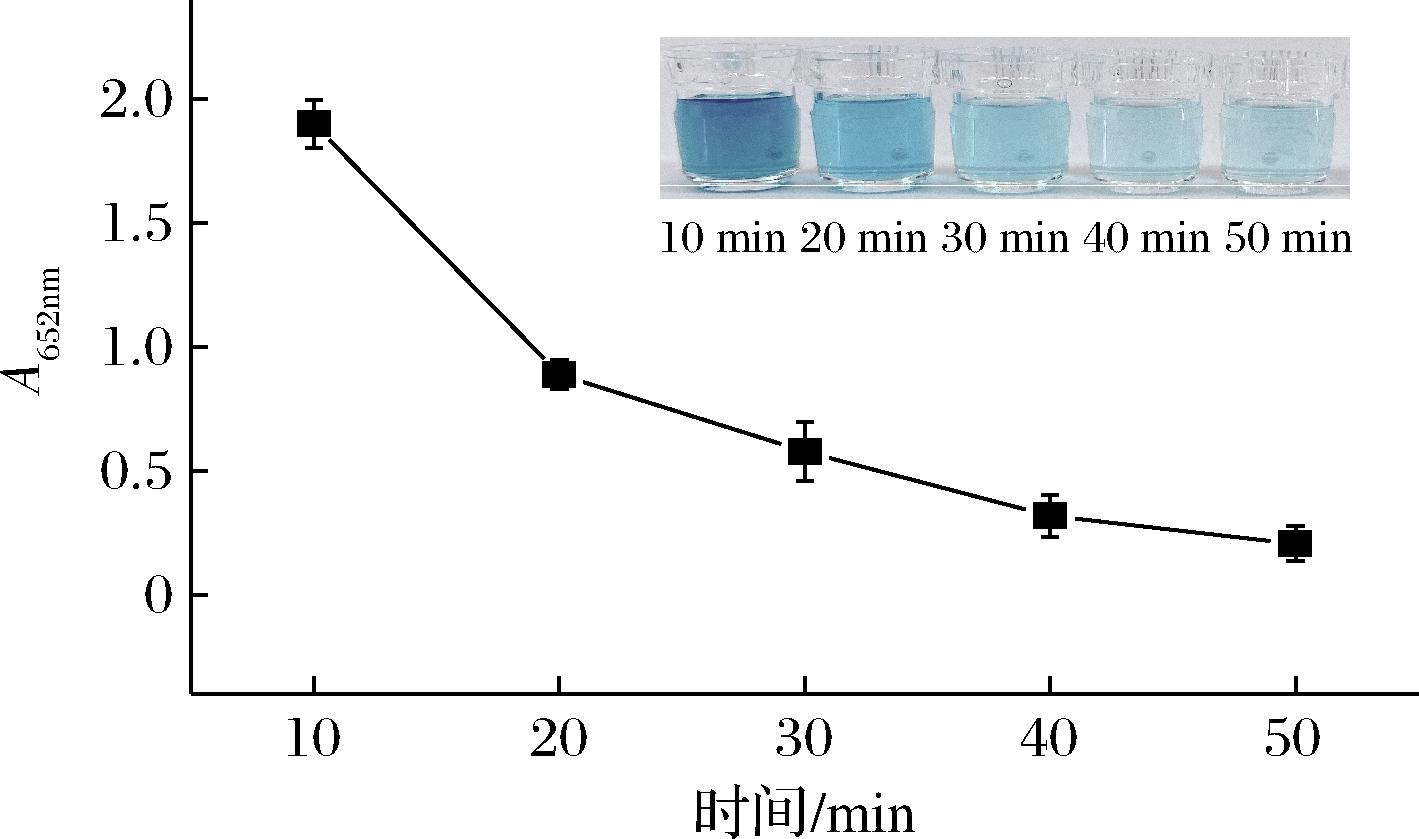
图2 不同时间MNPs与HRP结合离心后上清液中HRP 催化生成ox-TMB的吸光度值
Fig.2 The absorbance value of HRP catalyzed to produce ox-TMB in the supernatant after centrifugation of MNPs and HRP at different times 注:插图为不同时间对应的比色照片
2.3 HRP修饰情况与实验可行性的验证
HRP成功修饰在MNPs的表面,并且MNPs不影响显色反应是该方法建立的前提。本文探究了不同情况下TMB和H2O2显色反应,以此考察HRP在MNPs上的修饰情况与MNPs对显色反应的影响(图3)。
如图3-a所示,只有HRP,TMB和H2O2都存在的情况下,溶液会从无色变为蓝色,MNPs@Apt@HRP,TMB与H2O2都存在的情况下,也发生了颜色变化,表明MNPs@Apt@HRP成功催化TMB氧化生成ox-TMB,而单独的MNPs无法催化TMB产生明显的颜色变化。由此可证明,HRP已在MNPs的表面成功修饰。
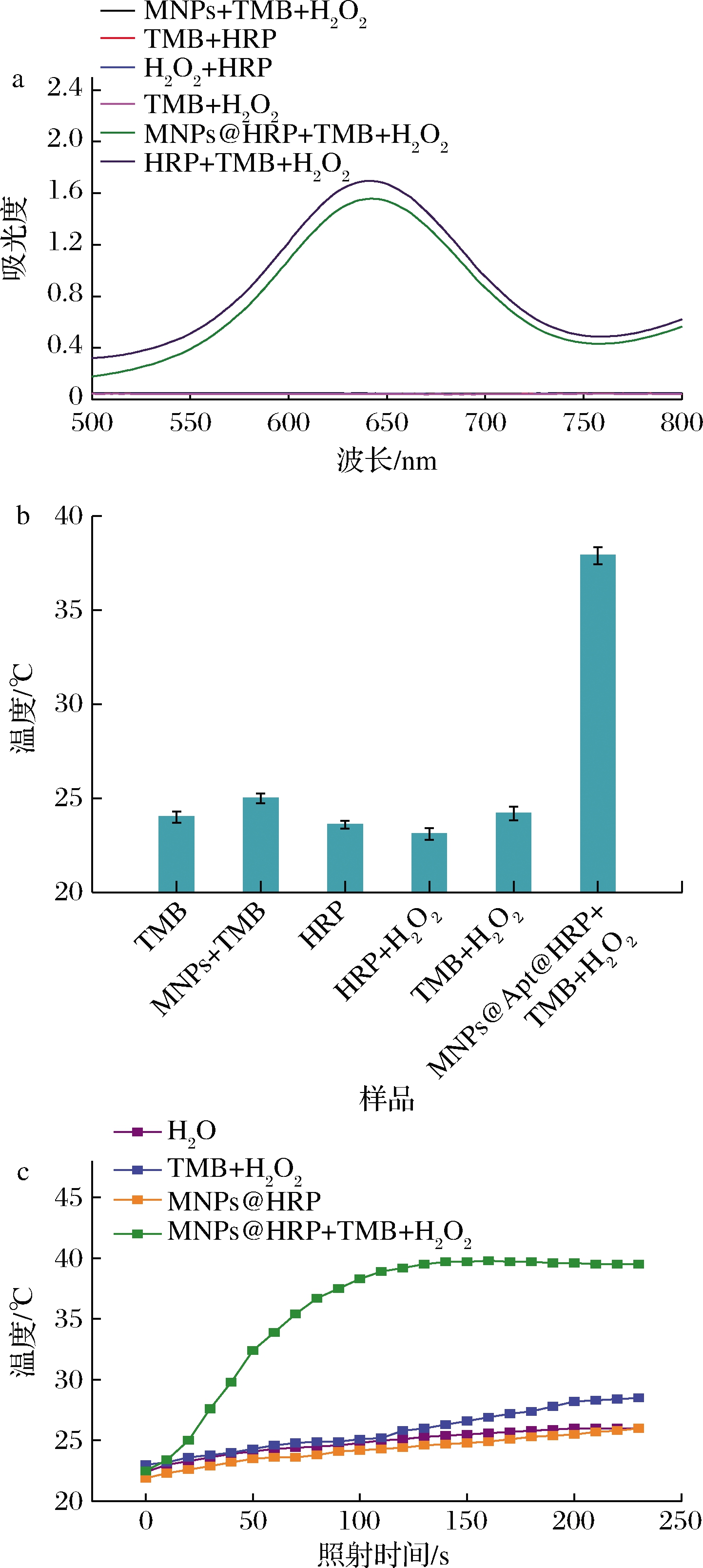
a-验证HRP修饰情况的可见光光谱;b-不同反应溶液的温度变化; c-时间对温度变化的影响
图3 实验可行性的验证
Fig.3 Verification of experimental feasibility
同样,使用4 W/cm2的808 nm激光辐照2 min,测试光热效应,辐照后立即使用便携式温度计测量溶液的温度。如图3-b所示,观察到MNPs@Apt@HRP,TMB与H2O2都存在的体系中温度升高了13.9 ℃,在TMB、MNPs+TMB、HRP、HRP+H2O2、TMB+H2O2的体系中辐照后未发现明显的温度升高。说明808 nm激光不会催化TMB氧化生成ox-TMB,而且热信号的产生是因为ox-TMB受到辐照后将光信号转变为热信号。这些结果证明了MNPs@Apt@HRP探针介导的比色与热双模态改良型ELISA具备可行性。
为了确认辐照时间,使用808 nm激光持续照射3 min。使用便携式温度计连续监控温度变化。如图3-c所示,照射时间在0~150 s时,温度随时间的增加而增大,当时间达到150 s时,温度趋于稳定,当时间>150 s时,温度不再发生明显改变。因此,在随后的免疫分析研究中,以150 s作为照射时间。
2.4 MNPs@Apt@HRP对ox-TMB生成量的影响
微孔板中捕获MNPs@Apt@HRP的量是否对生成的ox-TMB浓度有影响是比色与热双模态改良型ELISA完成对不同浓度AFB1检测的关键。本文研究了不同浓度的MNPs@Apt@HRP对ox-TMB生成量的影响,结果如图4所示。在3.91×10-6~5×10-3 g/L,随着探针浓度增加,观察到混合液从无色到蓝色的趋势,并且探针质量浓度为5×10-3 g/L时A652nm的增加最为明显。表明随着检测探针浓度的增加,可产生更高浓度的ox-TMB,微孔板中捕获的探针的量与ox-TMB比色信号的产生成正相关。
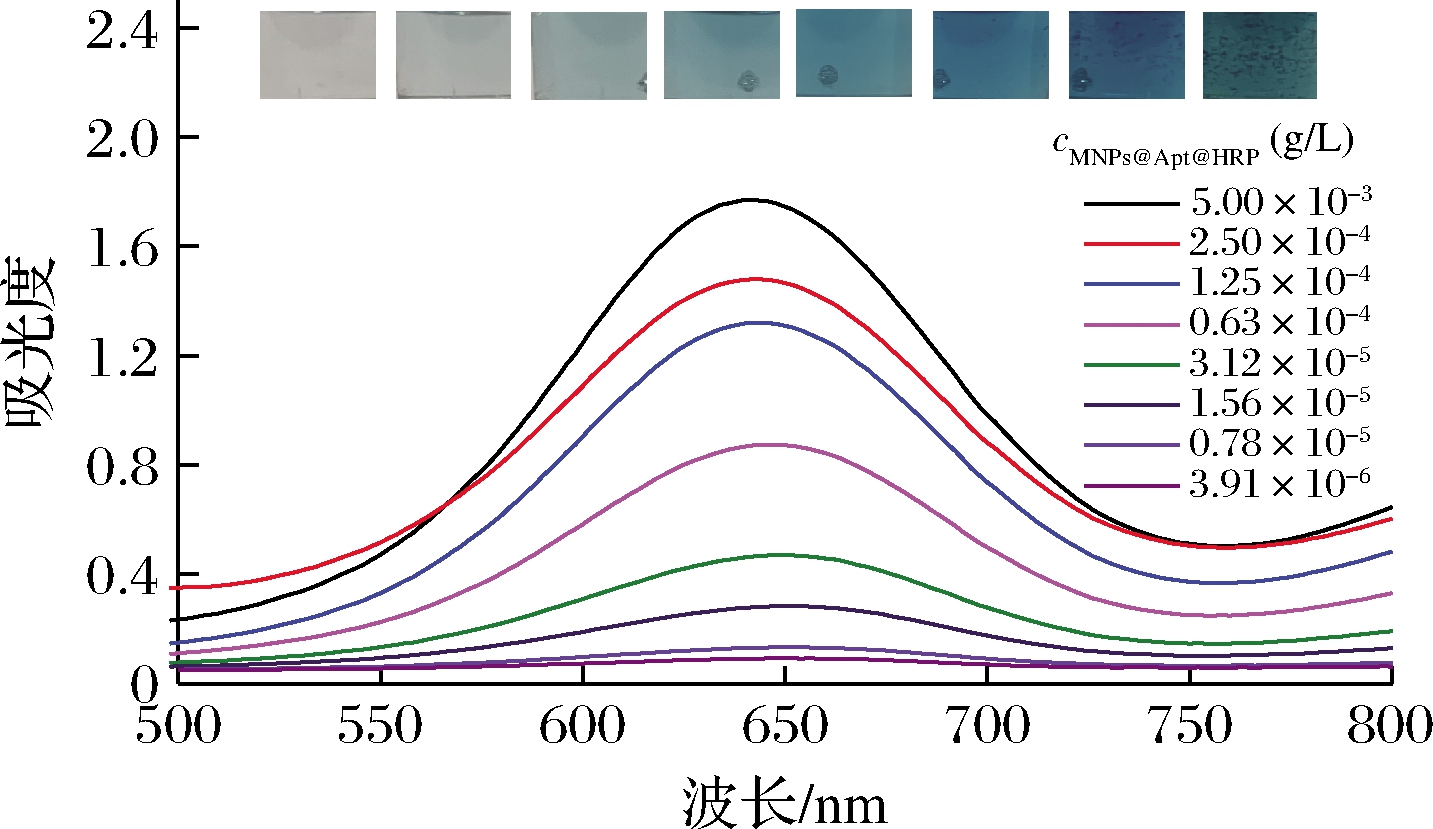
图4 不同浓度的MNPs@Apt@HRP与TMB和H2O2 相互作用的可见光光谱
Fig.4 Visible spectra of the interaction of different concentrations of MNPs@ATP@HRP with TMB and H2O2 注:插图为不同浓度MNPs@Apt@HRP对应的混合液照片
2.5 比色与热双模态改良型ELISA用于AFB1的检测
在最佳条件下,研究了比色与热双模态改良型ELISA用于AFB1检测的灵敏度。如图5-a所示,当AFB1的质量浓度为1×10-5~1×10-11 g/L时A652nm与AFB1浓度的对数呈现良好的线性关系,回归方程为A=0.047 1 lgc +0.757,线性相关系数R2=0.990 4(图5-b)。图5中插图可用于定性或半定量分析。当AFB1的质量浓度达到1×10-12 g/L时,A652nm几乎不再发生明显改变,检测灵敏度达到2.47×10-12 g/L。

a-可见光光谱;b-标准曲线
图5 不同浓度的AFB1可见光光谱和标准曲线
Fig.5 The visible spectra of AFB1 with different concentrations and standard curve 注:插图为不同浓度AFB1对混合液的颜色影响的照片
使用热信号对AFB1进行定量检测,结果如图6所示。当AFB1质量浓度为1×10-8~1×10-12g/L时,温度升高与AFB1浓度的对数呈线性相关,回归方程为ΔT=1.57 lgc+28.72,线性相关系数R2=0.991 6,检测灵敏度为3.79×10-13g/L。因此,通过使用便携式温度计可实现对AFB1的高灵敏定量检测。
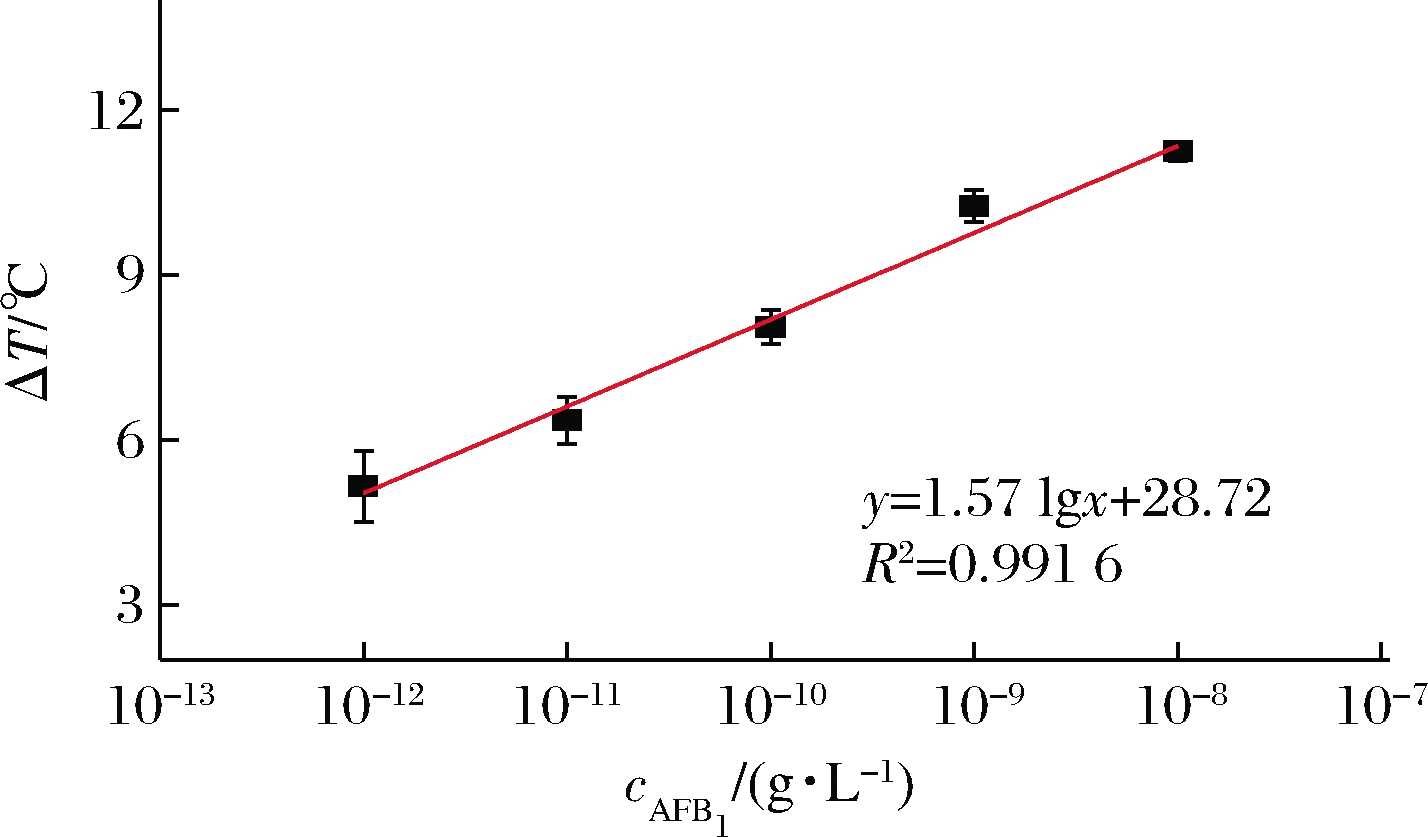
图6 热信号检测AFB1的标准曲线
Fig.6 Standard curve of thermal signal detection AFB1
2.6 比色与热双模态改良型ELISA用于AFB1检测的特异性
使用比色与热双模态改良型ELISA分别测定了质量浓度为1×10-6 g/L的干扰毒素(TS、OTA、AFB2、patulin、ZEN、FB1、DON)来进行免疫检测特异性研究。结果如图7所示,在检测7种干扰毒素时,既没有观察到干扰毒素产生明显的吸光度变化,并且无明显的温度信号产生。而在检测低质量浓度AFB1(1×10-7 g/L)时可观察到A652nm出现明显吸收峰,温度信号也有明显的升高。此外,测定混合液时,观察到比色与温度信号与单独检测AFB1时几乎没有变化。这些结果证明了即使存在高浓度干扰物质,比色与热双模态改良型ELISA仍具有较高的特异性。
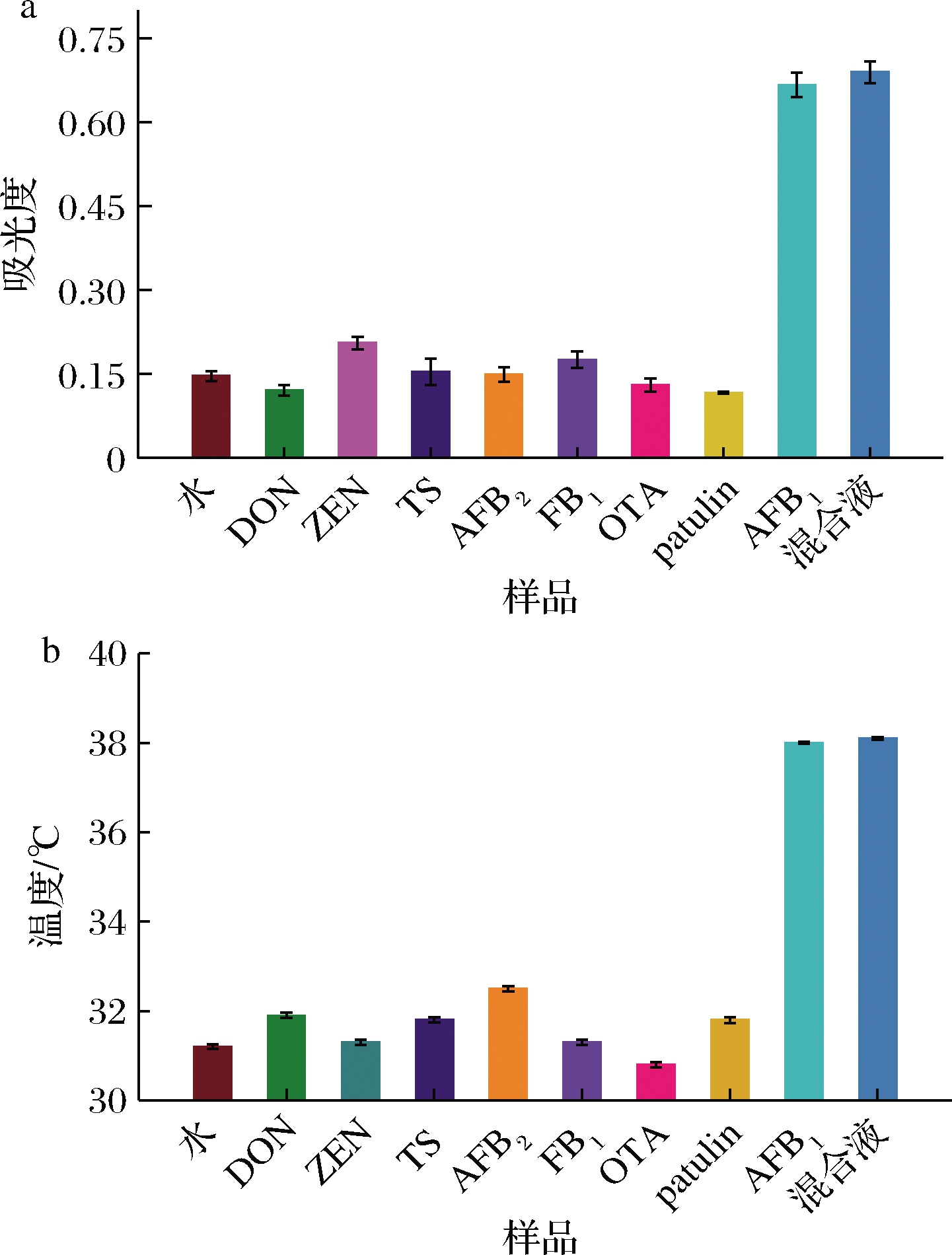
a-比色信号;b-热信号
图7 检测AFB1的特异性分析
Fig.7 Specificity analysis of AFB1
2.7 方法实用性结果研究
为了验证比色与热双模态改良型ELISA在实际样品中的适用性,我们采用标准加入法对牛奶样品中的AFB1含量进行了检测。我们在商业化ELISA试剂盒未检测到AFB1的牛奶样品中加入不同浓度的AFB1标准品,使样品中的AFB1终质量浓度分别为1×10-7、1×10-8、1×10-9 g/L。检测结果如表1所示,基于比色与热信号的测结果与加入的理论值相比,二者基本保持一致。基于双模态信号的检测回收率分别为99.07%~100.82%;100.74%~102.12%,相对标准偏差(relative standard deviation,RSD)分别为1.03%~2.55%;1.13%~2.84%。结果证明了该方法在实际样品检测中具有良好的实用性和准确性。
表1 比色与热双模态改良型ELISA测定牛奶中 AFB1的回收率![]()
Table 1 Colorimetric and thermal bimodal improved ELISA to determine the recovery rate of AFB1 in milk

方法AFB1含量/(g·L-1)加标值加标测定值加标回收率/%RSD/%比色 信号 1×10-79.91×10-8±1.06×10-899.071.031×10-81.01×10-8±2.16×10-9100.822.551×10-91.01×10-9±4.68×10-10100.652.13热信号1×10-71.02×10-7±3.38×10-8102.121.131×10-81.01×10-8±2.91×10-9100.742.841×10-91.01×10-9±3.27×10-10100.832.37
按照2.8中所述商业ELISA试剂盒中的使用方法检测不同质量浓度的AFB1标准溶液(0、0.03、0.12、0.48、2 μg/L)。检测结果如图8 所示,随着AFB1浓度的增大,A652nm逐渐降低。当AFB1质量浓度为0.03~2.00 μg/L,AFB1浓度与A652nm呈明显线性关系,线性方程为A=-0.108 6 lgc +0.144 4,其中R2=0.994 9,检测灵敏度为1.7×10-3 g/L。本文中的双模态改良型ELISA比色性检测AFB1的灵敏度为2.47×10-12 g/L,热信号对AFB1的检测灵敏度达到3.79×10-13g/L,分别比商业化试剂盒提高了3个和4个数量级。

a-可见光光谱;b-标准曲线
图8 ELISA试剂盒的可见光光谱和标准曲线
Fig.8 The visible spectra and standard curve of ELISA Kit
之后,我们用购买的ELISA试剂盒和设计的比色与热双模态改良型ELISA方法分别对花生、牛奶、酱油、醋4种样品中的AFB1进行了检测。如表2所示,试剂盒检测出牛奶中AFB1的浓度与2种信号检测出的结果基本保持一致,因此设计的改良型ELISA方法与ELISA试剂盒检测结果具有一致性。试剂盒在花生、酱油、醋中未检出AFB1。而比色信号与热信号检测到的花生,酱油和醋中AFB1的浓度基本一致,可见该方法实用性良好。尽管已检测到一定量的AFB1,但远远低于国家要求的≤5 μg/L,仍在安全范围内。
表2 比色与热双模态改良型ELISA检测样品中的 AFB1含量![]() 单位:g/L
单位:g/L
Table 2 The actual sample detection of colorimetric and thermal bimodal improved ELISA

样品比色信号热信号ELISA试剂盒牛奶1.24×10-2±1.31×10-31.31×10-2±2.24×10-31.54×10-2±1.14×10-4醋 6.95×10-9±3.56×10-106.79×10-9±5.16×10-10未检出花生3.95×10-9±2.75×10-104.02×10-9±1.86×10-10未检出酱油1.53×10-8±4.63×10-91.71×10-8±5.35×10-9未检出
3 结论
本文采用MNPs作为载体来富集HRP和AFB1 Apt制备检测探针,Apt与抗体组合作为识别元件,以TMB的显色反应与ox-TMB的光热效应为信号输出,构建了比色与热双模态的改良型ELISA,实现了AFB1的可视化比色及便携式温度信号的高灵敏及高特异性检测,检测灵敏度分别达到了2.47×10-12、3.79×10-13g/L。与商业化ELISA试剂盒相比, 灵敏度分别提高了3个和4个数量级。最后,将该方法成功应用于牛奶,花生,醋和酱油中AFB1的检测。适配体与抗体的组合捕获目标物相比试剂盒的竞争性结合更稳定、易修饰,且相较使用两个抗体形成三明治结构的ELISA成本更低。因此,该方法能够满足痕量检测AFB1的需求,在食品检测领域具有良好的应用前景。
[1] SHYU R H, SHYU H F, LIU H W, et al.Colloidal gold-based immunochromatographic assay for detection of ricin[J].Toxicon, 2002, 40(3):255-258.
[2] EGNER P A, WANG J B, ZHU Y R, et al.Chlorophyllin intervention reduces aflatoxin-DNA adducts in individuals at high risk for liver cancer[J].Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(25):14 601-14 606.
[3] REN Y P, ZHANG Y, SHAO S L, et al.Simultaneous determination of multi-component mycotoxin contaminants in foods and feeds by ultra-performance liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A, 2007, 1 143(1):48-64.
[4] OSTRY V, MALIR F, TOMAN J, et al.Mycotoxins as human carcinogens—the IARC Monographs classification[J].Mycotoxin Research, 2017, 33(1):65-73.
[5] REDDY K R N, REDDY C S, MURALIDHARAN K.Detection of Aspergillus spp.and aflatoxin B1 in rice in India[J].Food Microbiology.
[6] 常纪文. 从欧盟立法看动物福利法的独立性[J].环球法律评论, 2006(3):343-351.
CHANG J W.Looking at the independence of animal welfare law from EU legislation[J].Global Legal Review, 2006(3):343-351.
[7] 国家市场监督管理总局. GB 2761—2017 食品安全国家标准食品中真菌毒素限量[S].北京:中国标准出版社,2017.
State Administration for Market Regulation.GB 2761—2017 National food safety standard limits of mycotoxins in foods[S].Beijing:China Standards Press, 2017.
[8] HU X F, HU R, ZHANG Z W, et al.Development of a multiple immunoaffinity column for simultaneous determination of multiple mycotoxins in feeds using UPLC-MS/MS[J].Analytical and Bioanalytical Chemistry, 2016, 408(22):6 027-6 036.
[9] GARC A-MORALETA A,FONT G,MA
A-MORALETA A,FONT G,MA ES J, et al.Development of a new method for the simultaneous determination of 21 mycotoxins in coffee beverages by liquid chromatography tandem mass spectrometry[J].Food Research International, 2015, 72:247-255.
ES J, et al.Development of a new method for the simultaneous determination of 21 mycotoxins in coffee beverages by liquid chromatography tandem mass spectrometry[J].Food Research International, 2015, 72:247-255.
[10] CAMPOS W E O, ROSAS L B, NETO A P, et al.Extended validation of a sensitive and robust method for simultaneous quantification of aflatoxins B1, B2, G1 and G2 in Brazil nuts by HPLC-FLD[J].Journal of Food Composition & Analysis, 2017, 60:90-96.
[11] CHEN Y Q, CHEN Q, HAN M M, et al.Development and optimization of a multiplex lateral flow immunoassay for the simultaneous determination of three mycotoxins in corn, rice and peanut[J].Food Chemistry, 2016, 213:478-484.
[12] LI P W, ZHANG Z W, ZHANG Q, et al.Current development of microfluidic immunosensing approaches for mycotoxin detection via capillary electromigration and lateral flow technology[J].Electrophoresis, 2012, 33(15):2 253-2 265.
[13] HASIBEDER A, STEIN P, BRANDWIJK R, et al, Evaluation and validation of the detection of soluble triggering receptor expressed on myeloid cells 1 by enzyme-linked immunosorbent assay[J].Scientific Reports, 2015, 5(1):15 381.
[14] HU X F, YAO J J, WANG F Y, et al.Eu3+-labeled IgG-based time-resolved fluoroimmunoassay for highly sensitive detection of aflatoxin B1 in feed[J].Journal of the ence of Food and Agriculture, 2017, 98(2):647-680.
[15] WANG D, ZHANG Z W, LI P W, et al.Europium nanospheres-based time-resolved fluorescence for rapid and ultrasensitive determination of total aflatoxin in feed[J].Journal of Agricultural and Food Chemistry, 2015, 63(47):10 313-10 318.
[16] ENGVALL E, PERLMANN P.Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G[J].Immunochemistry, 1971, 8(9):871-874.
[17] WAN Y, ZHU G Y.Dopamine-mediated immunoassay for bacteria detection[J].Analytical and Bioanalytical Chemistry, 2017, 409(26):6 091-6 096.
[18] RENNARD S I, BERG R, MARTIN G R, et al, Enzyme-linked immunoassay (ELISA) for connective tissue components[J].Analytical Biochemistry, 1980, 104(1):205-214.
[19] YANG Y, WANG S M, ZHOU Z X, et al.Enhanced reusability and activity:DNA directed immobilization of enzyme on polydopamine modified magnetic nanoparticles[J].Biochemical Engineering Journal, 2018, 137:108-115.
[20] WATANABE S, HAGIHARA K, TSUKAGOSHI K, et al.Microbead-based ligase detection reaction assay using a molecular beacon probe for the detection of low-abundance point mutations[J].Analytical Chemistry, 2014, 86(1):900-906.
[21] WU Y D, GUO W S, PENG W P, et al.Enhanced fluorescence ELISA based on HAT triggering fluorescence "turn-on" with enzyme-antibody dual labeled AuNP probes for ultrasensitive detection of AFP and HBsAg[J].Acs Applied Materials & Interfaces, 2017, 9(11):9 369-9 377.
[22] LIAO T, YUAN F, YU H Y, et al.An ultrasensitive ELISA method for the detection of procalcitonin based on magnetic beads and enzyme-antibody labeled gold nanoparticles[J].Analytical Methods, 2016, 8(7):1 577-1 585.
[23] ZHANG L Y, FAN C, LIU M, et al.Biominerized gold-Hemin@MOF composites with peroxidase-like and gold catalysis activities:A high-throughput colorimetric immunoassay for alpha-fetoprotein in blood by ELISA and gold-catalytic silver staining[J].Sensors and Actuators, 2018, 266:543-552.
[24] TUERK C, GOLD L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science (New York), 1990, 249(4 968):505-510.
[25] FRANZISKA P, MAYER G.Selection and biosensor application of aptamers for small molecules[J].Frontiers in Chemistry, 2016, 4:25.
[26] WALTER J G, HEILKENBRINKER A, AUSTERJOST J, et al.Aptasensors for small molecule detection[J].Ztschrift fur Naturforschung B, 2012, 67(10):976-986.
[27] CHEN L, WEN F, LI M, et al.A simple aptamer-based fluorescent assay for the detection of aflatoxin B1 in infant rice cereal[J].Food Chemistry, 2017, 215:377-382.
[28] MENG H M, LIU H, KUAI H L, et al.Aptamer-integrated DNA nanostructures for biosensing, bioimaging and cancer therapy[J].Chemical Society Reviews, 2016, 45(9):2 583-2 602.
[29] SHIM W B, MUN H, CHUNG D H, et al.Chemiluminescence competitive aptamer assay for the detection of aflatoxin B1 in corn samples[J].Food Control, 2014, 36(1):30-35.