全麦食品中含有大量维生素、矿物质、纤维素等重要的营养物质,长期食用可以降低患冠心病、2型糖尿病和结肠直肠癌等慢性病的风险,近年来受到不少消费者的青睐[1-3]。但是全麦食品存在面团加工性能和感官品质较差、质地坚硬、结构粗糙等问题,这主要是因为麸皮的存在破坏了面团各组分间的相互作用和完整的网络结构[4-5]。阿拉伯木聚糖(arabinoxylan, AX)作为全麦膳食纤维组分的主要成分显著的影响了面团特性和产品质量,尤其是其中的水不溶性阿拉伯木聚糖(water-unextracted arabinoxylan, WUAX)(占总AX的90%)[6-7]。ARIF 等[8]研究发现WUAX可以通过增加面粉的吸水率、延缓面团发展、提高面团混合过程中的稳定性和耐受性来改善面团性质,但同时削弱了面包的所有物理和感官性质。同时WUAX的颗粒特性直接影响面筋的相互作用,通过与面团组分争夺水分间接影响面筋的形成[9]。ZHANG等[10]采用木聚糖酶对麦麸进行水解,发现酶解可以有效地减少麸皮对面筋结构的损伤,从而显著改善全麦面团的品质。BUKSA等[11]也发现了将阿拉伯木聚糖水解可以显著改善面团的质构,但分子质量较大的交联阿拉伯木聚糖效果较差。因此,为了改善全麦产品的品质,将WUAX进行酶解处理是一个可行的方法,但截至目前,其中的作用机制尚不清楚。
面筋蛋白通过赋予面团吸水率、凝聚力、黏度和弹性并形成均匀的网络结构而在小麦产品中发挥重要作用[12]。面筋蛋白在和面过程中,通过分子间二硫键和非共价键相互作用形成黏弹性三维网络。虽然非共价键的能量低于共价键,但非共价键被证明对面筋蛋白聚集和面团结构具有相当重要的作用[13]。在超过90 ℃的温度下,麦谷蛋白可以通过热诱导的SH—SS交换反应连接到醇溶蛋白上,而产生的游离巯基可以进一步与麦谷蛋白或醇溶蛋白反应[14]。
在团队前期研究中发现,戊聚糖酶可以显著改善全麦馒头的质构和比容,其主要是对面筋蛋白性质的改善[15]。为研究酶解处理WUAX对全麦产品中面筋蛋白性质改善的机理,本研究中比较了WUAX和水不溶性阿拉伯木聚糖酶解物(enzymatic hydrolyzed arabinoxylan, EAX)对面筋蛋白热聚集特性的影响,重点比较了两者对面筋蛋白在不同热处理条件下的平均粒径、游离巯基、游离氨基和表面疏水性的影响。
1 材料与方法
1.1 材料与试剂
面筋蛋白,日本TCI公司;麦麸,中国江苏省昆山市益海嘉里有限公司。其他化学试剂均为分析纯。
1.2 仪器与设备
Microtrac S3500激光粒度分析仪,美国Microtrac公司;TU-1901紫外分光光度计,深圳市亿鑫设备有限公司;F-7000荧光光谱仪,日本日立公司;SH117-LGJ-10C真空冷冻干燥机,北京中西远大工程有限公司;RH基本型磁力搅拌器,上海翼悾机电有限公司;H1650R高速冷冻离心机,上海皋朗机械设备有限公司。
1.3 实验方法
1.3.1 WUAX和酶解产物的制备
在脱脂除蛋白除淀粉的麦麸中加入饱和Ba(OH)2溶液,采用1∶10(g∶mL)的料液比在室温下提取16 h,离心取上清液,旋蒸浓缩并于蒸馏水中透析,然后醇沉过夜,沉淀冻干即为实验所用WUAX。将WUAX分散在pH 5.0的缓冲液中,于55 ℃加入木聚糖酶进行酶解,12 h后(前期实验证明此为最佳酶解时间)将酶解液冻干,得到EAX。
1.3.2 样品制备
将面筋蛋白(1.0 g)分别与不同量WUAX和EAX(3%、6%,质量分数,基于面筋蛋白的质量)混合,加入过量水并捏和成面团。所有样品在4 ℃静置1 h完成水化后,再恒温下加热30 min,然后在液氮中快速冷却。最后,所有样品都被冻干、磨粉后进行下一步分析。样品简写:G代表空白面筋蛋白样品,GW代表面筋-WUAX,GE代表面筋-EAX,含量以数字的形式写在缩写字母后面。
1.3.3 粒径测定
按照HAN等[16]的方法,通过Microtrac S3500激光粒度分析仪测量面筋蛋白样品在异丙醇中的粒度分布。仪器参数设置:折射率1.5,流速55%。
1.3.4 游离巯基测定
参考WANG等[17]的方法,20 mg面筋蛋白样品分散于4 mL缓冲液中(10.4 g/L Tris,6.9 g/L甘氨酸,1.2 g/L EDTA,2.5% SDS,pH 8.0),于室温下混合30 min后加入40 mL Ellman试剂,于暗处反应30 min,离心测上清液在412 nm处的吸光度。游离巯基浓度计算为SH(mmol/g)=73.53×A412×D/c,其中A412为412 nm处的吸光度,D为稀释因子,c为样品质量浓度,单位为mg/mL。
1.3.5 游离氨基测定
采用DU等[18]的方法并进行了一些修改。面筋(40 mg)用0.1 mol/L盐酸(pH 1.0,3 mL)搅拌30 min,离心(10 000×g,10 min,4 ℃),取上清液(20 μL)与150 μL邻苯二甲醛溶液(每100 mL含80 mg邻苯二甲醛,3.81 g十水合硼酸钠, 100 mg SDS和88 mg二硫苏糖醇)混合,加入酶标板。以纯水作为空白组,100 mg/L丝氨酸溶液作标准曲线,用酶标仪读取340 nm处的吸光度。
1.3.6 表面疏水性测定
参考RAHAMAN等[19]的方法,将面筋样品在0.01 mol/L磷酸盐缓冲液(pH 7.0)中分散1 h,离心取上清液并进行一系列稀释,取4.0 mL蛋白稀释液加入20 mL的8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid ,ANS)溶液(8.0 mmol/L),于黑暗条件下反应15 min。用F-7000荧光光谱仪在激发波长390 nm和发射波长470 nm处测定荧光。根据荧光强度与蛋白质浓度相关曲线的初始斜率计算样品的表面疏水性(H0)。
1.3.7 数据分析
采用Origin 8.5制作图表,并用SPSS 22.0对数据进行显著性差异分析(P<0.05)。
2 结果与分析
2.1 WUAX和EAX对面筋蛋白粒径分布的影响
面筋聚集性被认为是影响面制品品质的关键因素,面筋蛋白的粒径分布可以反映其聚集行为。3种温度下不同处理的面筋蛋白样品的D50值如图1所示。在25 ℃时,GW3的粒径大于对照样品的粒径,而GW6的粒径小于对照,说明少量的WUAX可以促进蛋白质在25 ℃下的交联聚合,而提高WUAX含量会抑制常温下面筋蛋白的交联,中断了面筋网络的形成。FREDERIX等[20]研究发现WUAX的分子质量较大,并以离散的细胞壁碎片形式存在,对较大面筋聚集体的形成具有负面影响。与添加WUAX不同,添加EAX样品的面筋蛋白粒径明显大于对照(P<0.05),并与浓度成正比。这一结果表明EAX导致面筋蛋白聚合度的增加,说明EAX能够促进常温下蛋白质的交联聚集,这有利于面筋网络的形成[21]。JIANG等[15]同样发现酶解处理全麦面团会释放较小分子质量的AX,这导致麦谷蛋白大聚合体数量的增加。
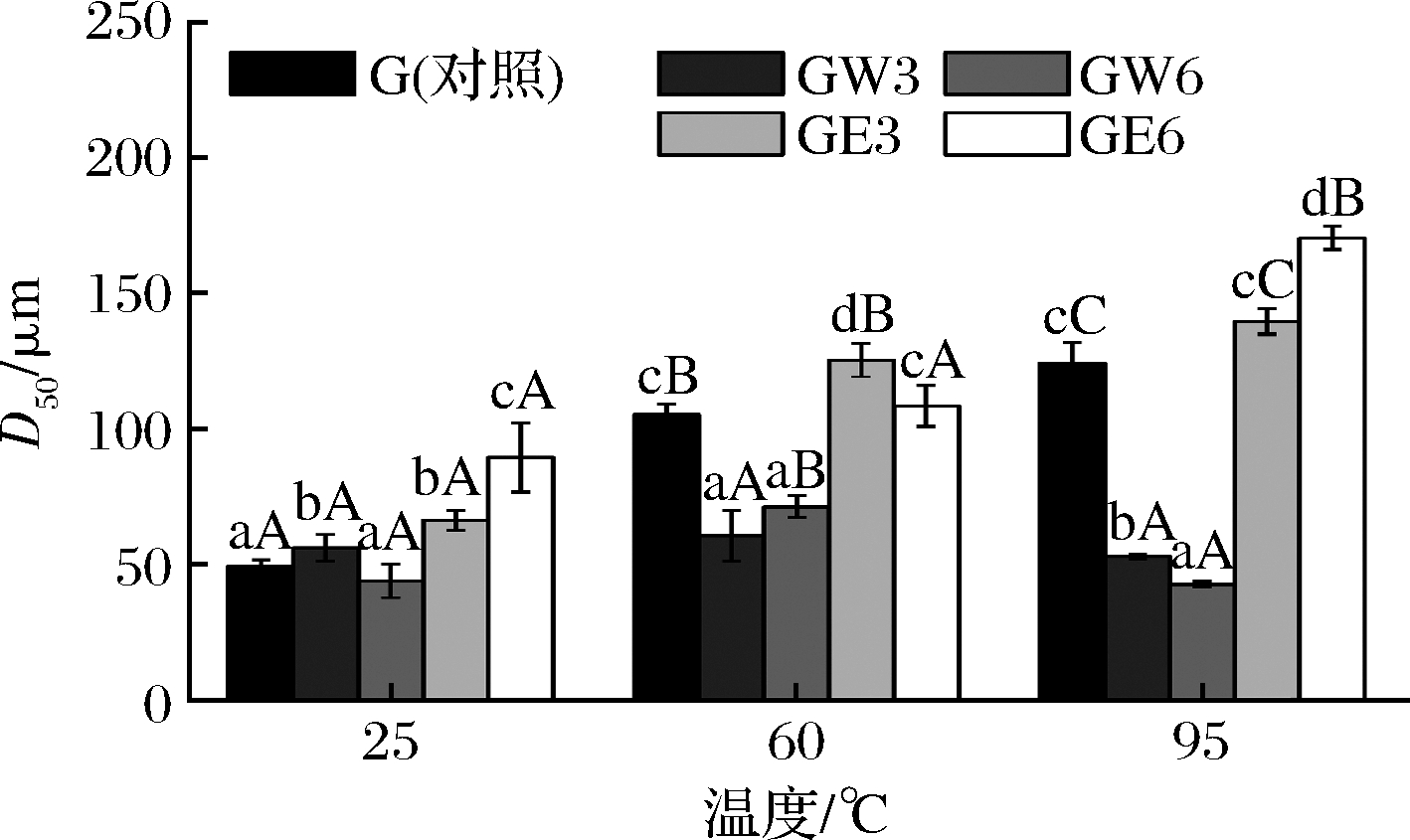
图1 WUAX和EAX对面筋蛋白粒径分布的影响
Fig.1 Effects of WUAX and EAX on the particle size distribution of gluten 注:不同小写字母表示相同温度下不同处理的样品间具有 显著性差异,不同大写字母代表相同处理下不同温度的样品间 具有显著性差异(P<0.05)(下同)
随着热处理温度的升高,麦谷蛋白-麦谷蛋白和麦谷蛋白-醇溶蛋白进一步聚集,增大了面筋颗粒的大小,表现为对照样品的粒径随温度的升高不断变大(P<0.05)。而在60、95 ℃热处理下,添加了WUAX的样品显著低于相同温度下对照样品的粒径(P<0.05)。这表明WUAX强烈阻碍面筋蛋白分子在加热过程中的交联聚合反应,限制了大聚体的形成。而添加了EAX的样品在热处理后的粒径显著增大(P<0.05),表明EAX诱导了面筋蛋白的热诱导聚集,促使其大聚体的形成。ZHAO等[22]同样研究发现,AX可以促进麦谷蛋白和麦谷蛋白的热诱导聚集,其中短链AX的作用更为明显。这说明小分子的AX可以对面筋蛋白的团聚起到正面的影响。
2.2 WUAX和EAX对面筋蛋白粒径分布的影响
通常,游离巯基含量的变化被认为是反映面筋蛋白聚合程度的重要指标,因为它与面筋蛋白二硫键含量的变化呈负相关[23]。添加WUAX在3种温度下均可增加面筋蛋白中游离巯基的含量(图2),这可能是由于WUAX较大的空间位阻和物理缠结作用减少了面筋蛋白分子链上的巯基相互之间的接触机会,导致二硫键无法形成,从而提高了游离巯基的含量[24]。
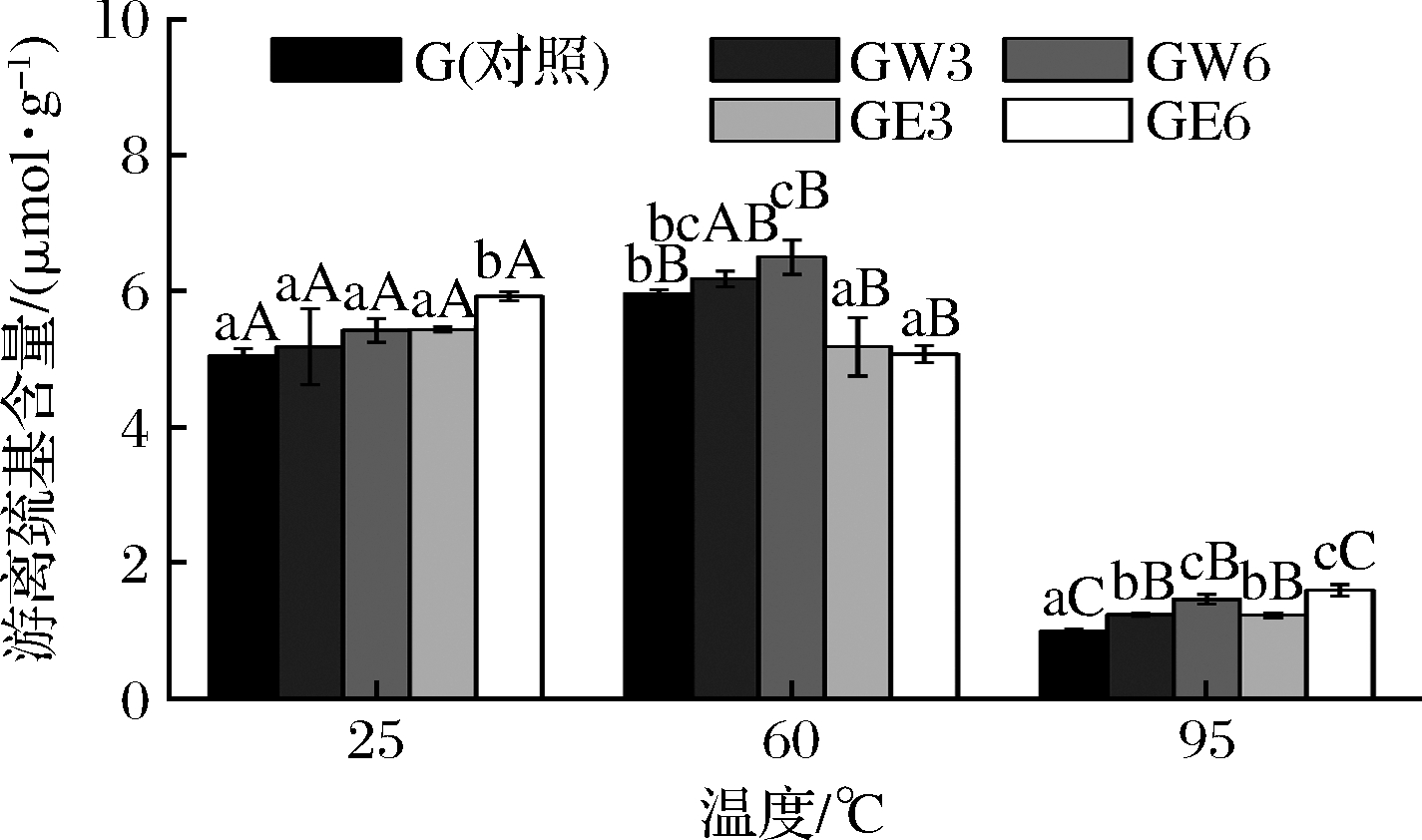
图2 WUAX和EAX对面筋蛋白游离巯基含量的影响
Fig.2 Effects of WUAX and EAX on free SH content of gluten
25、95 ℃下,添加EAX的样品中游离巯基的含量也高于对照,且增加作用强于相同浓度下的WUAX,这可能是由于在相同的质量浓度下,EAX的相对分子质量较小,造成其分子数量多于WUAX,从而形成较多的阻碍共价交联的作用位点[25]。也有报道称分子质量较小的EAX与蛋白质之间的非共价相互作用强于WUAX,使其更难与麦谷蛋白形成二硫键而产生更多的游离巯基[15]。但在60 ℃时,EAX降低了面筋蛋白中游离巯基的含量,促进了面筋蛋白的共价交联。这可能是在60 ℃时,麦谷蛋白分子链展开,分子间作用力断裂重排,小分子的EAX融渗在面筋分子空隙间,诱导了面筋分子间的热诱导共价连接。
与粒度分布的结果相比较,可以发现游离巯基的变化规律与粒度分布并不一致,这是因为在加热过程中,除了游离巯基氧化形成二硫键,面筋分子间还存在SH—SS交换作用,这种反应对面筋分子间的游离巯基含量的影响不大[26]。因此,WUAX和EAX对面筋蛋白粒径的相反效果既与巯基氧化作用有关,也与SH—SS交换作用有关。
2.3 游离氨基的分析
尽管WUAX和EAX可能阻碍了面筋蛋白中二硫键的形成,但是EAX能够提高面筋颗粒的平均粒径,所以WUAX和EAX可能通过其他键与面筋蛋白相互作用。面筋蛋白链上的氨基可能和多糖链上的羟基发生反应从而导致蛋白质聚集[27],因此本研究中也测定了不同处理条件下面筋蛋白中游离氨基的含量。从图3可以看出,与对照组相比,游离氨基含量在加入WUAX后显著增加(P<0.05),这可能是WUAX较大的空间位阻作用阻碍了面筋蛋白交联,破坏了面筋网络结构的形成,从而导致了蛋白链上氨基的暴露,游离氨基含量升高。而EAX显著减少了面筋蛋白样品中游离氨基含量(P<0.05),说明面筋蛋白的氨基与EAX的羟基之间发生了强烈的相互作用,掩蔽了部分游离氨基。这也可能是由于EAX诱导面筋蛋白聚集,从而降低了游离氨基的含量[17]。同时,WUAX和EAX的作用与浓度成正相关。
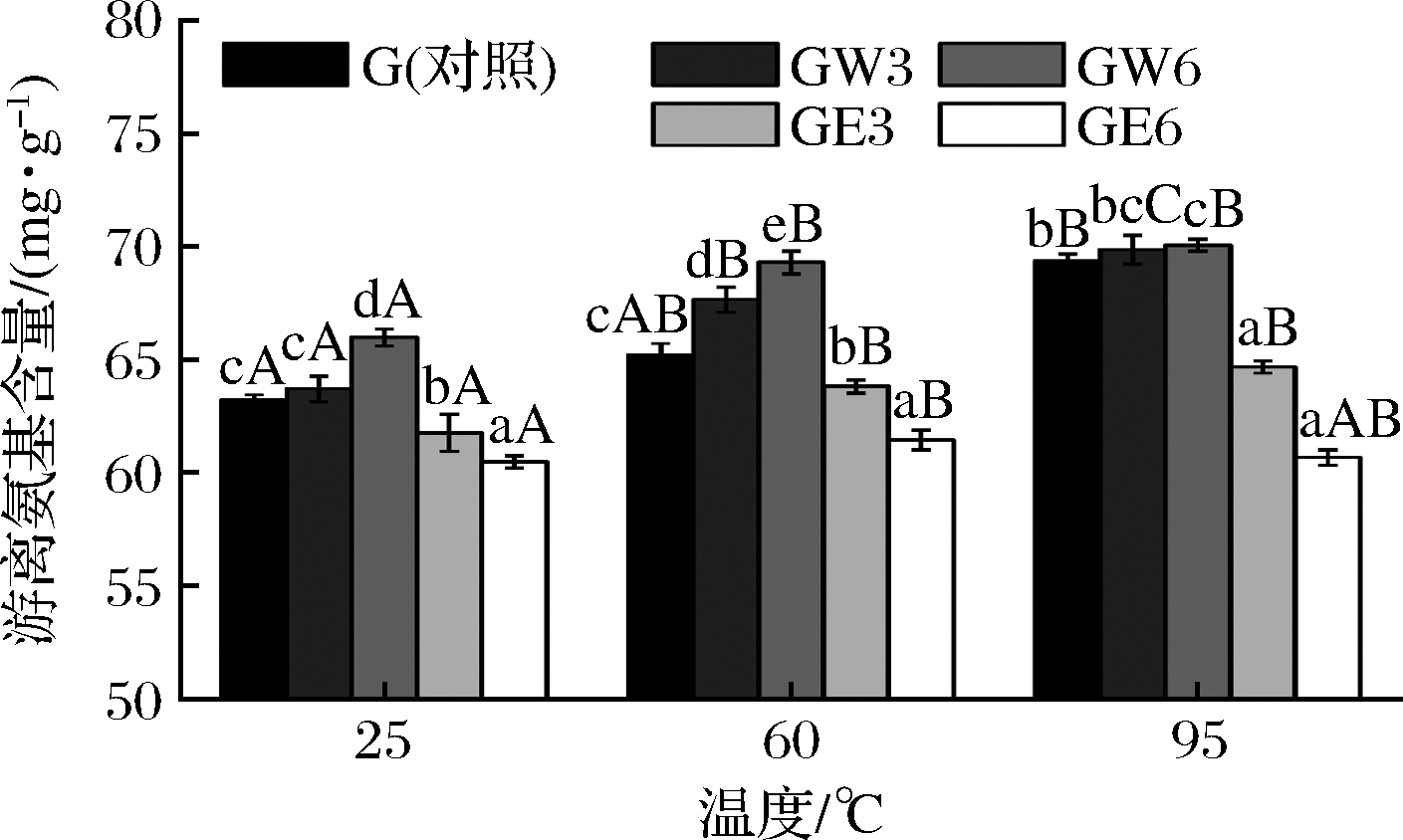
图3 WUAX和EAX对面筋蛋白游离氨基含量的影响
Fig.3 Effects of WUAX and EAX on free amino groups content of gluten
2.4 表面疏水性分析
面筋蛋白的表面疏水性反映了面筋蛋白三级结构的变化[28],WUAX及EAX对面筋蛋白表面疏水性的影响见表1。在25、60 ℃下WUAX均会导致面筋蛋白的表面疏水性增加,这表明面筋蛋白分子在WUAX的作用下展开,这可能是疏水性的大分子WUAX参与了面筋分子疏水核的相互作用,使其暴露了更多的疏水性区域[29]。而95 ℃下,WUAX导致面筋蛋白的表面疏水性略微下降,这可能是WUAX诱导蛋白展开从而暴露了过多的疏水性基团,导致其在95 ℃时发生疏水性的热诱导聚集[30]。这也可能是由于95 ℃时面筋蛋白分子发生聚集,而WUAX参与其中包覆面筋蛋白表面的部分疏水性区域,从而导致了面筋分子表面疏水性的降低。
表1 WUAX和EAX对面筋蛋白表面疏水性的影响
Table 1 Effects of WUAX and EAX on surface hydrophobicity of gluten
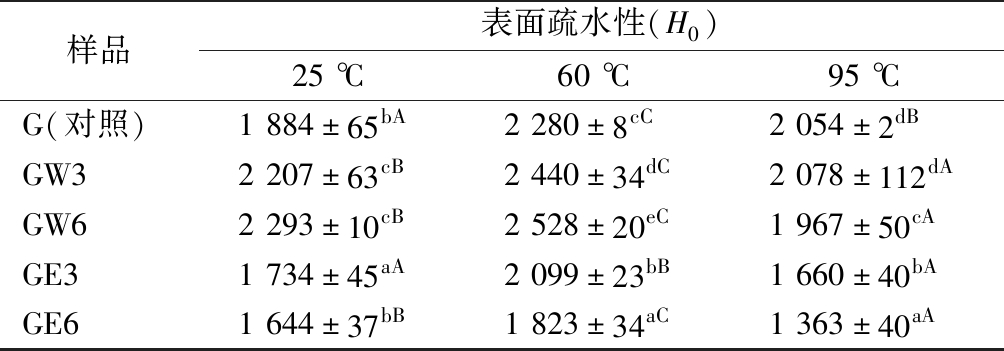
样品表面疏水性(H0)25 ℃60 ℃95 ℃G(对照)1 884±65bA2 280±8cC2 054±2dBGW32 207±63cB2 440±34dC2 078±112dAGW62 293±10cB2 528±20eC1 967±50cAGE31 734±45aA2 099±23bB1 660±40bAGE61 644±37bB1 823±34aC1 363±40aA
注:不同小写字母表示相同温度下不同处理的样品间具有显著性差异,不同大写字母代表相同处理下不同温度的样品间具有显著性差异(P<0.05)
在25、60和95 ℃时,EAX的添加均会导致面筋蛋白的表面疏水性下降,表明EAX能够诱导增强面筋蛋白间的疏水相互作用从而加强分子间聚集作用。这可能是由于EAX水溶性较好且分子质量较小,从而可以在面筋网络的空隙中起到填充物的作用,桥接蛋白分子链,支撑面筋蛋白的网络结构,从而增强面筋分子间的交联聚集,导致了表面疏水性的降低[31]。
3 结论
本研究通过比较不同热处理条件下添加WUAX和EAX后面筋蛋白粒度分布、游离巯基、游离氨基和三级结构的变化以研究WUAX和EAX与面筋蛋白的热诱导聚集的影响及相互作用机制。结果表明,WUAX显著抑制了面筋蛋白的交联聚集倾向,明显阻碍了热处理过程中面筋大聚体的形成,增加了面筋蛋白中游离巯基和游离氨基的含量,并导致面筋蛋白分子展开,暴露疏水性区域,破坏面筋网络结构。与WUAX不同,EAX可以诱导增强面筋蛋白的交联聚集,并促进面筋大聚集体的形成。同时,这种作用更多地体现在对面筋分子间疏水性相互作用的增强。因此,可以利用生物酶技术将WUAX降解为EAX,来解决WUAX对面筋蛋白品质劣化的问题,进而改善全麦产品的品质。
[1] JONES J M, ENGLESON J.Whole grains:Benefits and challenges[J/OL].Annual Review of Food Science and Technology, 2010.DOI: 10.1146/annurev.food.112408.132746.
[2] SCHAFFER-LEQUART C, LEHMANN U, ROSS A B, et al.Whole grain in manufactured foods:Current use, challenges and the way forward[J].Critical Reviews in Food Science and Nutrition, 2017, 57(8):1 562-1 568.
[3] WU W, QIU J, WANG A, et al.Impact of whole cereals and processing on type 2 diabetes mellitus:A review[J].Critical Reviews in Food Science and Nutrition, 2020,60(9):1 447-1 474.
[4] HEMDANE S, JACOBS P J, DORNEZ E, et al.Wheat (Triticum aestivum L.) bran in bread making:A critical review[J].Comprehensive Reviews in Food Science and Food Safety, 2016, 15(1):28-42.
[5] KHALID K H, OHM J-B, SIMSEK S.Whole wheat bread:Effect of bran fractions on dough and end-product quality[J].Journal of Cereal Science, 2017, 78:48-56.
[6] BASTOS R, COELHO E, COIMBRA M A.Arabinoxylans from Cereal by-Products[M].UK:Woodhead Publishing,2018:227-251.
[7] PITKANEN L, TUOMAINEN P, VIRKKI L, et al.Molecular characterization and solution properties of enzymatically tailored arabinoxylans[J].International Journal of Biological Macromolecules, 2011, 49(5):963-969.
[8] ARIF S, AHMED M, CHAUDHRY Q, et al.Effects of water extractable and unextractable pentosans on dough and bread properties of hard wheat cultivars[J].LWT, 2018, 97:736-742.
[9] WANG M, HAMER R J, VAN V T, et al.Effect of water unextractable solids on gluten formation and properties:Mechanistic considerations[J].Journal of Cereal Science, 2003, 37(1):55-64.
[10] ZHANG H, ZHANG X, CAO X R, et al.Semi-solid state fermentation and enzymatic hydrolysis impeded the destroy of wheat bran on gluten polymerization[J].LWT, 2018, 98:306-313.
[11] BUKSA K, ZIOBRO R, NOWOTNA A, et al.The influence of native and modified arabinoxylan preparations on baking properties of rye flour[J].Journal of Cereal Science, 2013, 58(1):23-30.
[12] SHEWRY P.What is gluten-why is it special?[J].Frontiers in Nutrition, 2019, 6:101.
[13] VERAVERBEKE W S, DELCOUR J A.Wheat protein composition and properties of wheat glutenin in relation to breadmaking functionality[J].Critical Reviews in Food Science and Nutrition, 2002, 42(3):179-208.
[14] LAGRAIN B, THEWISSEN B G, BRIJS K, et al.Mechanism of gliadin-glutenin cross-linking during hydrothermal treatment[J].Food Chemistry, 2008, 107(2):753-760.
[15] JIANG Z J, LIU L Y, YANG W, et al.Improving the physicochemical properties of whole wheat model dough by modifying the water-unextractable solids[J].Food Chemistry, 2018, 259:18-24.
[16] HAN C W, MA M, LI M, et al.Further interpretation of the underlying causes of the strengthening effect of alkali on gluten and noodle quality:Studies on gluten, gliadin, and glutenin[J].Food Hydrocolloids, 2020.DOI:10.1016/j.foodhyd.2020.105661.
[17] WANG P, TAO H, JIN Z Y, et al.Impact of water extractable arabinoxylan from rye bran on the frozen steamed bread dough quality[J].Food Chemistry, 2016, 200:117-124.
[18] DU J, DANG M, KHALIFA I, et al.Persimmon tannin changes the properties and the morphology of wheat gluten by altering the cross-linking, and the secondary structure in a dose-dependent manner[J].Food Research International, 2020, 137:109 536.
[19] RAHAMAN T, VASILJEVIC T, RAMCHANDRAN L.Shear, heat and pH induced conformational changes of wheat gluten-Impact on antigenicity[J].Food Chemistry, 2016, 196:180-188.
[20] FREDERIX S, HOEYMISSEN K, COURTIN C, et al.Water-extractable and water-unextractable arabinoxylans affect gluten agglomeration behavior during wheat flour gluten-starch separation[J].Journal of Agricultural and Food Chemistry, 2005, 52(26):7 950-7 956.
[21] 李翠翠, 陆啟玉.亚硫酸钠预处理对小麦面筋蛋白结构的影响[J].中国食品学报, 2018, 18(4):85-93.
LI C C,LU Q Y. Effects of Na2SO3 on the structure of wheat gluten protein[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(4):85-93.
[22] ZHAO X H, HOU C D, TIAN M Q, et al.Effect of water-extractable arabinoxylan with different molecular weight on the heat-induced aggregation behavior of gluten[J/OL].Food Hydrocolloids,2019. DOI: 10.1016/j.foodhyd.2019.105318.
[23] ZHOU Y, ZHAO D, FOSTER T J, et al.Konjac glucomannan-induced changes in thiol/disulphide exchange and gluten conformation upon dough mixing[J].Food Chemistry, 2014, 143:163-169.
[24] AMIRI A, SHAHEDI M, KADIVAR M.Evaluation of physicochemical properties of gluten modified by glucose oxidase and xylanase[J].Journal of Cereal Science, 2016, 71:37-42.
[25] WANG P, ZHAO X H, YANG R Q, et al.Water-extractable arabinoxylan-induced changes in the conformation and polymerization behavior of gluten upon thermal treatment[J].Journal of Agricultural and Food Chemistry, 2020, 68(13):4 005-4 016.
[26] BRUNEEL C, LAGRAIN B, BRIJS K, et al.Redox agents and N-ethylmaleimide affect the extractability of gluten proteins during fresh pasta processing[J].Food Chemistry, 2011, 127(3):905-911.
[27] KIM D Y, SHIN W S.Functional improvements in bovine serum albumin-fucoidan conjugate through the Maillard reaction[J].Food Chemistry, 2016, 190:974-981.
[28] WANG K Q, LUO S Z, CAI J, et al.Effects of partial hydrolysis and subsequent cross-linking on wheat gluten physicochemical properties and structure[J].Food Chemistry, 2016, 197(Pt A):168-174.
[29] MA S, HAN W, LI L, et al.The thermal stability, structural changeability, and aggregability of glutenin and gliadin proteins induced by wheat bran dietary fiber[J]. Food & Function, 2019, 10(1):172-179.
[30] BALDWIN R L.Dynamic hydration shell restores Kauzmann′s 1959 explanation of how the hydrophobic factor drives protein folding[J].Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(36):13 052-13 056.
[31] LI C F, CHEN G J, RAN C X, et al.Adlay starch-gluten composite gel:Effects of adlay starch on rheological and structural properties of gluten gel to molecular and physico-chemical characteristics[J].Food Chemistry, 2019, 289:121-129.