白酒在我国具有悠久的历史,在现代国民经济体系占比较大,特别是在区域经济发展中起着举足轻重的作用。白酒作为快速消费品,在满足人民群众生活需求、提高大众生活质量方面发挥了积极的作用[1]。为了保护消费者的合法权益,提高产品质量水平,国家相关部门根据产品质量法、食品安全法加强了酒类产品的抽检力度,酒精度是其中的重要指标。建立酒精度的准确、快速定量方法对于食品工业,如酒类酿造,低酒精饮料、无酒精饮料生产,以及非食品工业如化妆品、药品制造业都具有重要意义。
目前测量酒精度的主要方法是GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》,白酒中酒精度的测定方法是密度瓶法和酒精计法,啤酒和葡萄酒适用气相色谱法[2-4],其中部分测试方法操作过程繁琐,耗时耗力,容易造成较大的实验误差。随着现代仪器分析技术的发展,酒精度快速测定仪、比色法[5]、近红外光谱法[6-10]等酒精度的测定方法趋于成熟。相比于上述测定方法,核磁共振(nuclear magnetic resonance,NMR)波谱分析具有高重现性、无损伤性和无偏向性等优点[11],成为快速定性定量分析的一种重要方法。近年来,随着核磁分辨率的提高,核磁共振在药品食品行业中得到广泛应用。例如,可用于啤酒[12-15]和葡萄酒[16-17]的成分分析、真假鉴别及溯源性分析等。早在2004年,国家标准物质研究中心张伟等[18]利用核磁氢谱法对葡萄酒中的乙醇进行定量,测量结果准确可靠。2011年,杨星等[19]探讨了模拟白酒体系中温度对羟基质子峰位移的关系。对于国外蒸馏酒,在2016年ISAAC-LAM[20]采用45 MHz低场台式核磁共振波谱仪对几种酒精饮料中的乙醇含量进行测定,结果较好。2020年吉鑫等[21]利用核磁对白酒中有机酸和醛进行了定量分析,核磁共振氢谱结合偏最小二乘回归算法,得到的R2为0.93~0.99,取得了满意的结果。借鉴相关研究成果,本研究拟建立一种利用核磁对白酒的酒精度快速定量的方法,为企业和相关部门提供参考。
1 材料与方法
1.1 材料与试剂
实验所用白酒样品均为市售,采购于大型超市及专卖店,共15个样品。无水乙醇(分析纯,≥99.7%),Greagent公司;乙酸标准品(ACSreagent,≥99.7%),Sigma-Aldrich公司;氘代氯仿[D, 99.8%,含0.03%(体积分数) 四甲基硅烷(tetramethylsilane,TMS)],Cambridge Isotope Laboratories公司。
1.2 仪器与设备
Bruker Avance III HD 600 MHz核磁共振波谱仪,Bruker公司;S210-S pH计、ME204分析天平,Mettler-Toledo/梅特勒-托利多公司;移液枪,Eppendorf公司;WIGGENS Vortex3000涡旋振荡器,德国WIGGENS公司;酒精计,冀州耀华器械仪表厂。
1.3 实验方法
1.3.1 核磁共振波谱法
实验所采用的核磁共振波谱仪共振频率为600.13 MHz;配备5 mm BBO探头;采用脉冲序列为zg30;谱宽为20.027 6 ppm;采样点数为64 K;扫描次数为64;接受增益为2.25;弛豫时间为4 s;空扫次数为4;采用同轴核磁管测试,外管取500 μL样品,内管加入100 μL CDCl3(含0.03% TMS)锁场和定标;检测温度为298 K;样品检测前等待5 min用于稳定温度,每个样品重复测定3次,保证数据可靠性。
1.3.2 谱图数据处理
对核磁共振谱图采用MestReNova核磁共振数据分析软件处理,对核磁谱图进行相位矫正,基线矫正,以及化学位移零点矫正,对乙醇的甲基峰和亚甲基峰以及水峰进行积分,以基线平滑处开始积分,固定积分宽度,导出积分数据。建立工作曲线时,将标准成品酒积分数据、乙醇和水的化学位移值分别导入Origin 2019b软件,作图,得出拟合曲线及曲线方程;对于未知样品,将积分面积比、乙醇和水的化学位移值导入上述曲线方程,计算出酒精度(%vol)。
1.3.3 酒精计法及乙醇溶液配制
酒精计法使用GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》,按照要求最终数据换算成20 ℃时酒精度;文中不同乙醇溶液(%vol)均按照20 ℃时乙醇和水的密度配制。
2 结果与分析
2.1 不同测试温度条件对乙醇峰偏移影响
为探寻不同测试温度对核磁谱图峰位置偏移影响,在297.5~300.5 K的温度条件下对乙醇溶液(52%vol)进行核磁共振氢谱测试,结果如图1所示。在不同温度条件下,水羟基峰的位置随着温度而变化,当样品测试温度增加,水羟基峰的化学位移向核磁高场移动,较小的温度波动(0.5 K)也能引起水羟基峰位移明显变化,与文献一致[22]。在测试中,设定测试温度为298 K,测试前平衡5 min。
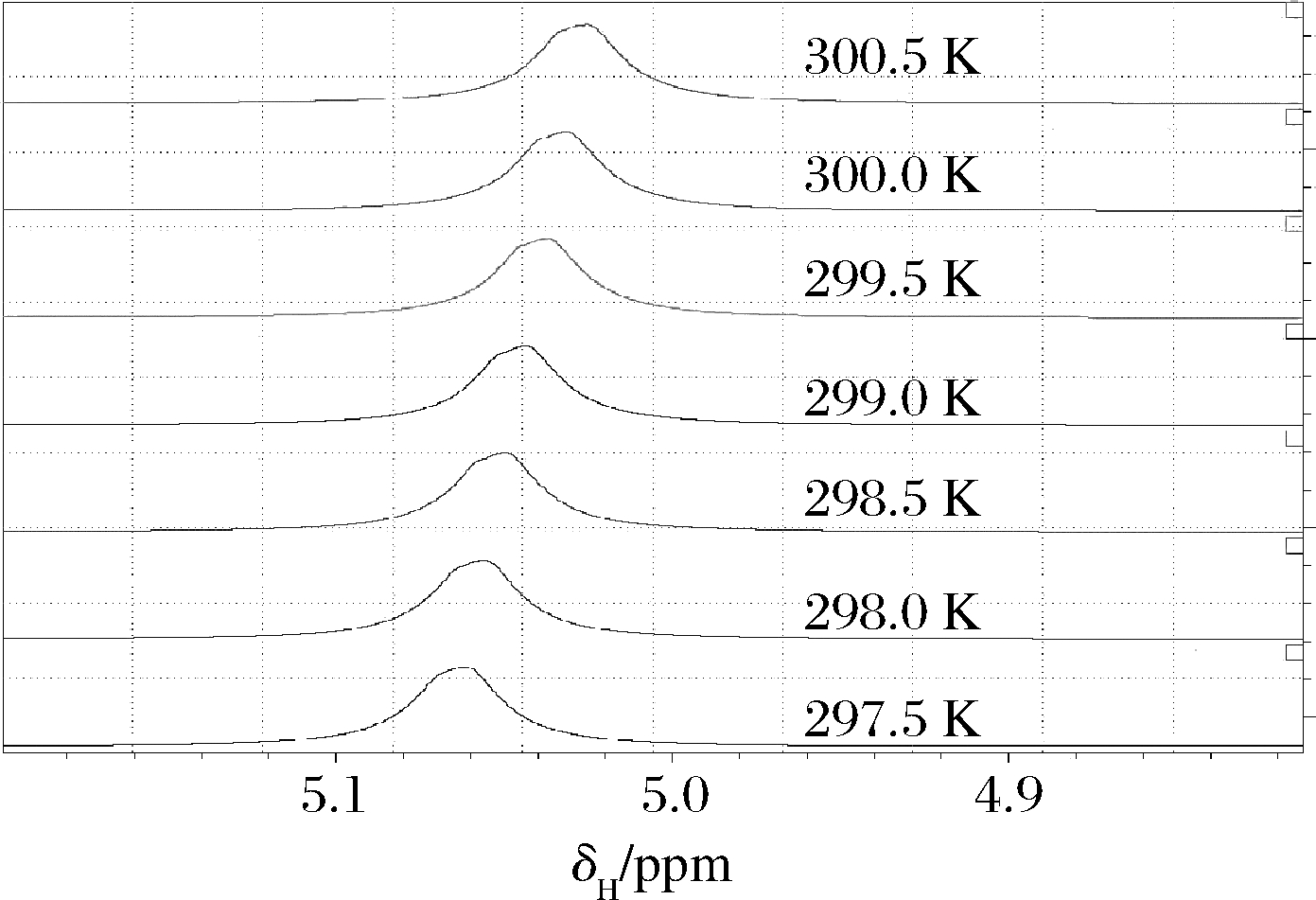
图1 不同温度的核磁氢谱(52%vol)
Fig.1 1H NMR spectra of ethanol at different temperature(52%vol)
2.2 不同乙醇浓度对核磁谱图的影响
不同厂家、品牌、香型白酒酒精度不尽相同,为探寻不同的酒精度对核磁谱图的影响,对10%~70%乙醇体积分数的乙醇水溶液共7个样品进行测试,结果如图2所示。乙醇的甲基与亚甲基峰面积随着乙醇含量增加而增大。乙醇体积分数的增加,分子间氢键增强,乙醇甲基峰,亚甲基峰和水羟基峰化学位移增大,向核磁低场移动,这为以峰位置的不同计算酒精度提供依据。
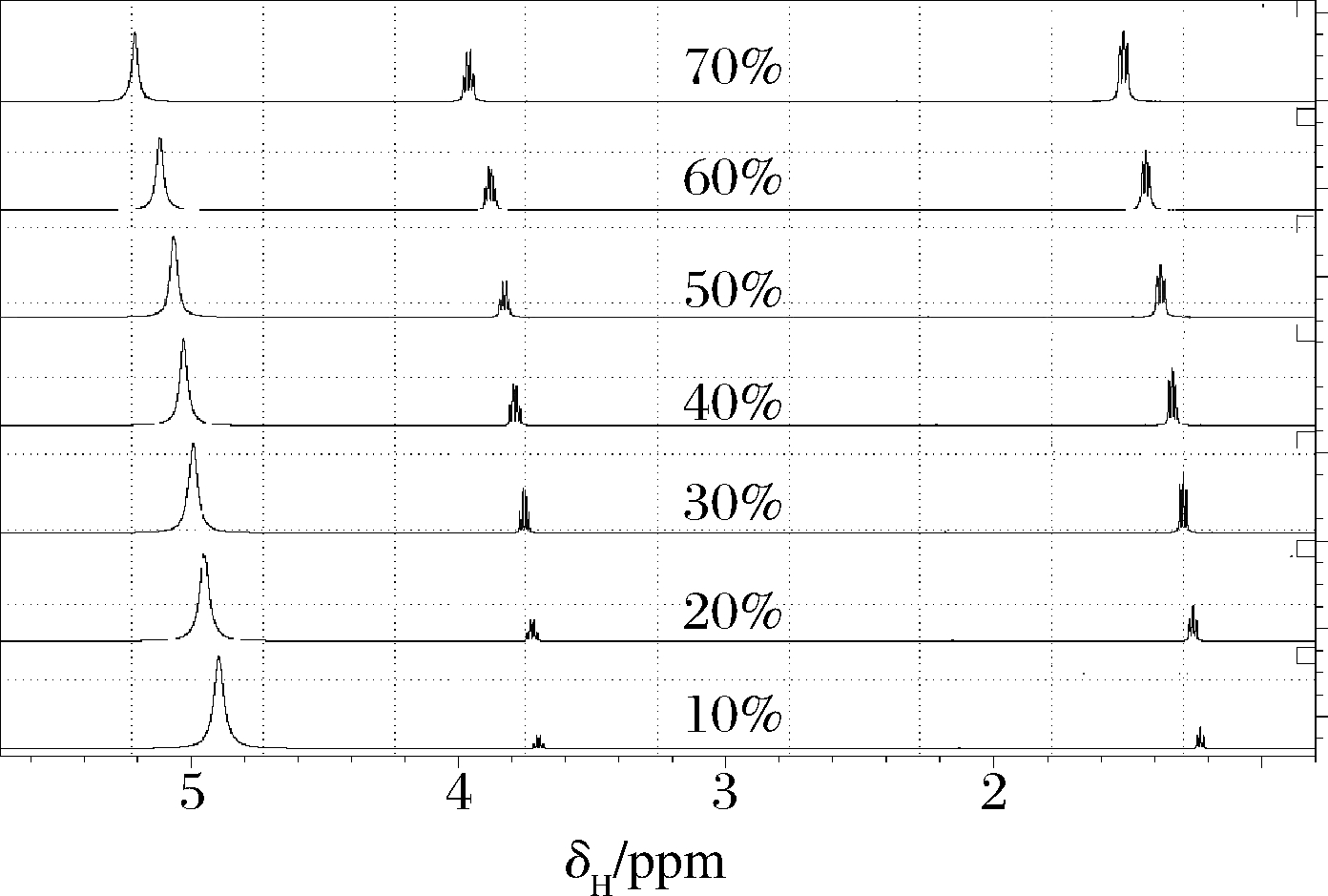
图2 不同乙醇体积分数的核磁共振氢谱
Fig.2 1H NMR spectra of different concentration of ethanol
2.3 不同浓度乙酸对乙醇峰偏移影响
白酒中含有约1%~2%的微量组分,包含醇、醛、酸、酯等,醇羟基和酸的游离氢都会与水峰形成氢键,对积分产生影响。一般白酒中的乙酸质量浓度为0.4~1.8 g/L,配制了0.1~2.0 g/L不同乙酸质量浓度的6种乙醇溶液(52%vol)进行核磁共振波谱仪测定,结果如图3所示,对6个样品进行pH值测定,并根据核磁共振谱对水羟基峰以及乙醇亚甲基峰积分,通过面积比得出的乙醇计算浓度,结果如表1所示。
由图3可知,1H NMR谱图中乙醇甲基峰,亚甲基峰以及水羟基峰在相同测试条件下化学位移基本未发生改变。在不同乙酸质量浓度条件下,不会影响酒样谱图中的峰化学位移值,即不同乙酸质量浓度不会导致酒样的化学位移偏移。

图3 不同乙酸浓度的核磁共振氢谱
Fig.3 1H NMR spectra of ethanol with different acetic acid
由表1可知,乙酸质量浓度不同,酒样pH值不同,乙醇峰化学位移值受酒样酸性影响较小。随着乙酸质量浓度的增加,酸的质子和水羟基峰重合在一起,对水羟基峰的积分产生影响,对其进行积分得到计算酒精度与真实值有负偏差,都在1%vol以内。
表1 不同乙酸浓度下的乙醇计算浓度
Table 1 Calculated ethanol concentration of different acetic acid concentration
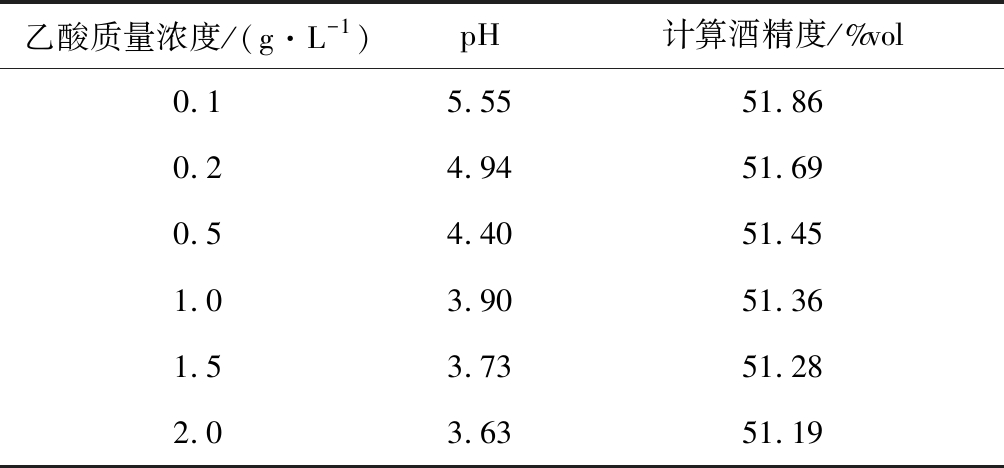
乙酸质量浓度/(g·L-1)pH计算酒精度/%vol0.15.5551.860.24.9451.690.54.4051.451.03.9051.361.53.7351.282.03.6351.19
2.4 测试曲线的建立
中国白酒历史文化悠久,由于地理环境不同,酿造条件及生产工艺等因素的差异,形成了风格迥异,各有特色的白酒种类。不同的成品酒中含有的风味成分不同,酒中酸和杂醇会影响水的积分,进而影响酒精度的计算。因此选择了市售不同酒精度的名优酒样建立标准测试曲线,共6种(表2)。对选择的成品酒样进行核磁共振测定,计算乙醇亚甲基峰和水羟基峰的比值,建立基于亚甲基峰与水羟基峰的积分比标准曲线,如图4所示。并且将成品酒样中水羟基峰和乙醇的甲基峰及亚甲基峰化学位移位置进行标定,并建立标准测试曲线,如图5所示。
表2 标准成品酒样数据
Table 2 The data of standard samples
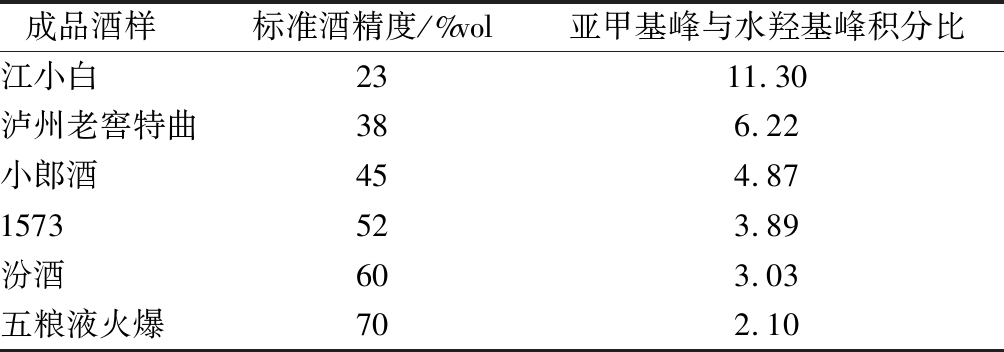
成品酒样 标准酒精度/%vol亚甲基峰与水羟基峰积分比江小白2311.30泸州老窖特曲386.22小郎酒454.871573523.89汾酒603.03五粮液火爆702.10
由图4可知,成品酒中亚甲基与水羟基峰面积的积分比拟合效果较好(R2=0.994 7),可以用来对未知酒样酒精度进行预测。由图5可知,不同酒精度的成品酒样中水羟基峰和乙醇甲基亚甲基峰位置呈一定线性变化,线性良好。其中对成品酒中乙醇甲基峰的峰位置拟合效果最佳(R2=0.991 8)。可以通过对酒样中甲基亚甲基及水羟基峰峰位置进行酒精度的预测。
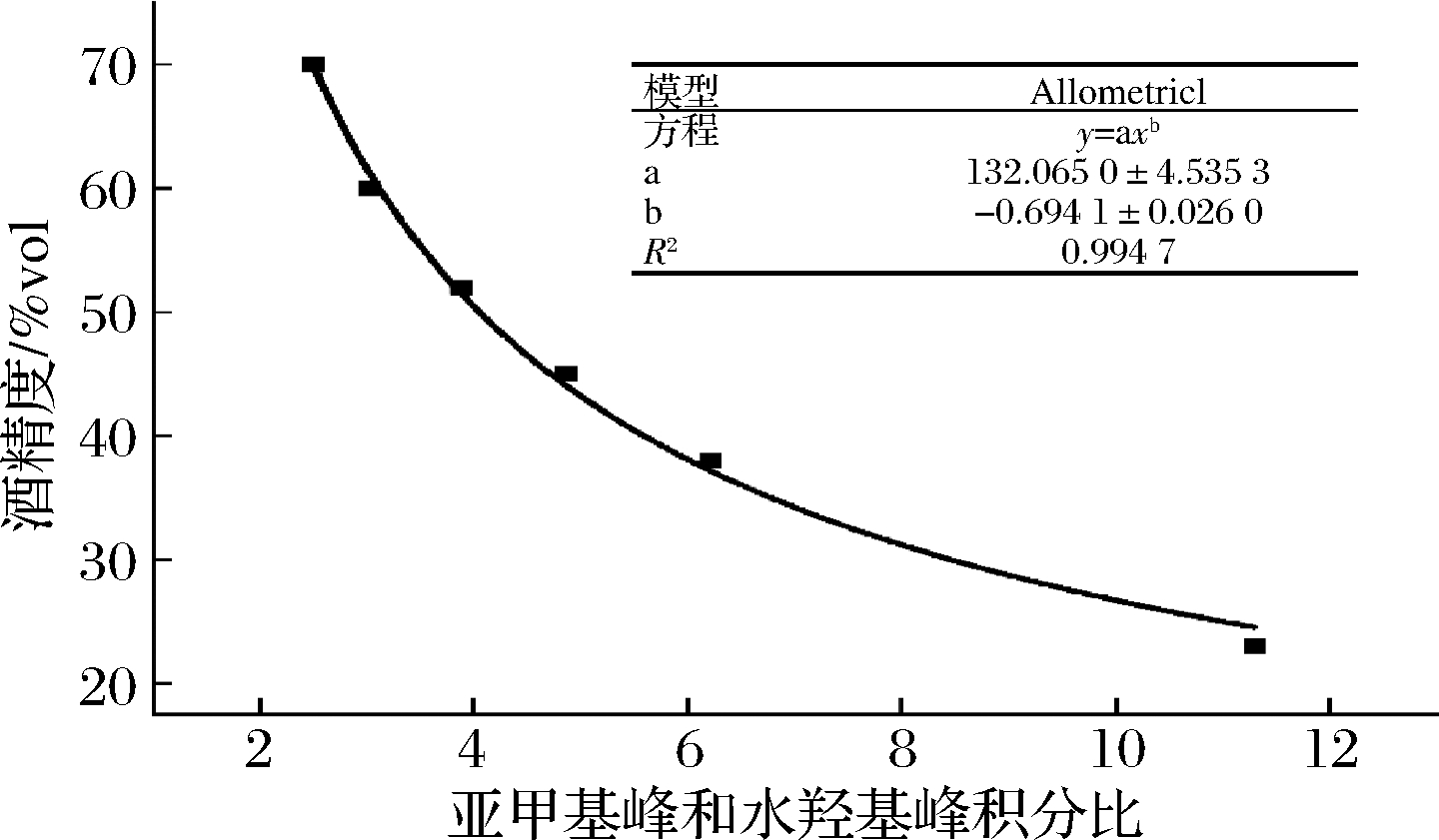
图4 标准成品酒积分比拟合图
Fig.4 Fitting result of the integral ratio with standard samples

图5 标准成品酒核磁峰位置拟合图
Fig.5 Fitting diagram based on NMR peaks in standard samples
2.5 方法验证
对9种市售的成品酒样进行核磁共振氢谱测定,将所测数据导入拟合方程,甲基峰位移拟合方程为Y=1.130 2+0.004 8X,亚甲基与水羟基峰积分比拟合方程为Y=132.065 0X-0.694 1,拟合得到的酒精度如表3所示,同时,使用国标酒精计法测试了酒精度作为对照。
由表3可知,实际拟合的酒精度与成品酒样标注的酒精度有着一定的差别,主要是由于测量方法的不同,将酒中的部分微量成分算入酒精度中,导致与标注酒精度有一定偏差。通过一系列成品酒样对2种不同的标准曲线进行验证,得到拟合酒精度。发现通过乙醇的亚甲基峰与水羟基峰面积积分比拟合效果更佳,相对偏差最大为1.48%,测得酒精度与标注酒精度偏差均在1%vol以内。核磁共振氢谱法测得白酒酒精度与国标酒精计法测得数据相差不大,均较为准确,但核磁检测取样量少,只需0.5 mL,检测前样品不需要重新蒸馏,耗时短,操作简便,适合批量分析。
表3 白酒样品拟合乙醇浓度
Table 3 Fitting ethanol concentration of Baijiu samples
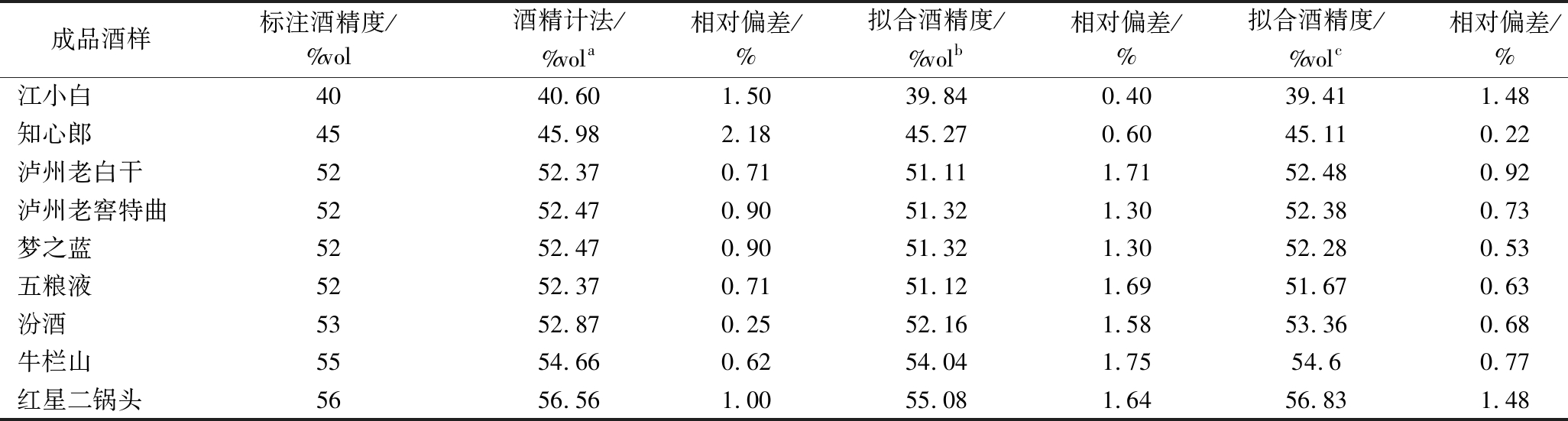
成品酒样标注酒精度/%vol酒精计法/%vola相对偏差/%拟合酒精度/%volb相对偏差/%拟合酒精度/%volc相对偏差/%江小白4040.601.5039.840.4039.411.48知心郎4545.982.1845.270.6045.110.22泸州老白干5252.370.7151.111.7152.480.92泸州老窖特曲5252.470.9051.321.3052.380.73梦之蓝5252.470.9051.321.3052.280.53五粮液5252.370.7151.121.6951.670.63汾酒5352.870.2552.161.5853.360.68牛栏山5554.660.6254.041.7554.60.77红星二锅头5656.561.0055.081.6456.831.48
注:a-GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》中酒精计法;b-甲基峰位移拟合;c-亚甲基与水羟基积分比拟合
3 结论
本研究采用1H NMR作为检测手段,对成品白酒中的酒精度进行检测,建立了白酒中酒精度的分析方法。其中,根据乙醇甲基峰位置拟合所得相关系数为R2=0.991 8;根据乙醇亚甲基峰与水羟基峰积分比拟合所得相关系数为R2=0.994 7。通过验证样品检测,酒精度与标注酒精度相对偏差均<0.02,酒精度偏差均小于1%vol,已达到食品国家安全标准要求。该检测方法简单快捷,可为白酒生产企业及相关检测部门提供参考,有一定的应用前景。
[1] ZHENG X W, HAN B Z.Baijiu, Chinese liquor:History, classification and manufacture[J].Journal of Ethnic Foods, 2016, 3(1):19-25.
[2] STUPAK M, KOCOUREK V, KOLOUCHOVA I, et al.Rapid approach for the determination of alcoholic strength and overall quality check of various spirit drinks and wines using GC-MS[J].Food Control, 2017, 80:307-313.
[3] SEO S H, KIM E J, PARK S E, et al.GC/MS-based metabolomics study to investigate differential metabolites between ale and lager beers[J].Food Bioscience, 2020, 36:100 671.
[4] COELHO E, LEMOS M, GENISHEVA Z, et al.Validation of a LLME/GC-MS methodology for quantification of volatile compounds in fermented beverages[J].Molecules, 2020, 25(3):621.
[5] LI J W, LI L, ZHANG J, et al.Metal ions regulated Ag NPRs etching colorimetric sensor array for discrimination of Chinese Baijiu[J].Sensors and Actuators B:Chemical, 2019, 297:126 715.
[6] HU L Q, YIN C L, MA S, et al.Rapid detection of three quality parameters and classification of wine based on Vis-NIR spectroscopy with wavelength selection by ACO and CARS algorithms[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2018, 205:574-581.
[7] PENG B Z, GE N, CUI L, et al.Monitoring of alcohol strength and titratable acidity of apple wine during fermentation using near-infrared spectroscopy[J].LWT-Food Science and Technology, 2016, 66:86-92.
[8] JIANG H, MEI C L, LI K J, et al.Monitoring alcohol concentration and residual glucose in solid state fermentation of ethanol using FT-NIR spectroscopy and L1-PLS regression[J].Spectrochim Acta A Mol Biomol Spectrosc, 2018, 204:73-80.
[9] WANG B Q, PENG B Z.A feasibility study on monitoring residual sugar and alcohol strength in kiwi wine fermentation using a fiber-optic FT-NIR spectrometry and PLS regression[J].J Food Sci, 2017, 82(2):358-363.
[10] ANJOS O, CALDEIRA I, ROQUE R, et al.Screening of different ageing technologies of wine spirit by application of near-infrared (NIR) spectroscopy and volatile quantification[J].Processes, 2020, 8(6):736.
[11] RAGONE R, TODISCO S, TRIGGIANI M, et al.Development of a food class-discrimination system by non-targeted NMR analyses using different magnetic field strengths[J].Food Chemistry, 2020, 332:127 339.
[12] DA SILVA L A, FLUMIGNAN D L, TININIS A G, et al.Discrimination of Brazilian lager beer by 1H NMR spectroscopy combined with chemometrics[J].Food Chemistry, 2019, 272:488-493.
[13] SILVA L A, FLUMIGNAN D L, PEZZA H R, et al.1H NMR spectroscopy combined with multivariate data analysis for differentiation of Brazilian lager beer according to brewery[J].European Food Research and Technology, 2019, 245(11):2 365-2 372.
[14] PALMIOLI A, ALBERICI D, CIARAMELLI C, et al.Metabolomic profiling of beers:Combining 1H-NMR spectroscopy and chemometric approaches to discriminate craft and industrial products[J].Food Chemistry, 2020, 327:127 025.
[15] RODRIGUES J E A, ERNY G L, BARROS A S, et al.Quantification of organic acids in beer by nuclear magnetic resonance (NMR)-based methods[J].Analytica Chimica Acta, 2010, 674(2):166-175.
[16] KUBALLA T, HAUSLER T, OKARU A O, et al.Detection of counterfeit brand spirits using 1H NMR fingerprints in comparison to sensory analysis[J].Food Chemistry, 2018, 245:112-118.
[17] CASSINO C,TSOLAKIS C, BONELLO F, et al.Wine evolution during bottle aging, studied by 1H NMR spectroscopy and multivariate statistical analysis[J].Food Research International, 2019, 116:566-577.
[18] 张伟, 徐蓓.核磁氢谱法测定葡萄酒中的乙醇[J].化学分析计量, 2004,13(6):39-41.
ZHANG W, XU P.Determination of ethanol in wine by 1H-NMR spectroscopy[J].Chemical Analysis and Meterage, 2004,13(6):39-41.
[19] 杨星, 曾新安.温度对模拟白酒体系氢键缔合影响分析[J].食品与发酵工业, 2011, 37(3):46-49.
YANG X, ZENG X A.1H NMR spectrum analysis on temperature dependence of spirit simulation[J].Food and Fermentation Industries, 2011, 37(3):46-49.
[20] ISAAC-LAM M F.Determination of alcohol content in alcoholic beverages using 45 MHz benchtop NMR spectrometer[J].International Journal of Spectroscopy, 2016, 2016:1-8.
[21] 吉鑫, 樊双喜, 李宜聪, 等.白酒中有机酸和醛类的偏最小二乘回归法定量分析模型[J].食品与发酵工业, 2020, 46(14):204-210;215.
JI X, FAN S X, LI Y C, et al.Quantitative analysis of organic acids and aldehydes in Baijiu via PLSR model[J].Food and Fermentation Industries, 2020, 46(14):204-210;215.
[22] GOTTLIEB H E, KOTLYAR V, NUDELMAN A.NMR chemical shifts of common laboratory solvents as trace impurities[J].The Journal of Organic Chemistry, 1997, 62(21):7 512-7 515.